Method Article
从斑马鱼胚胎中产生幼稚的胚泡外植体
摘要
斑马鱼胚泡外植体是通过从早期胚胎内的内源性信号中心分离胚胎细胞而产生的,产生相对幼稚的细胞簇,易于操纵和 离体培养。本文提供了制造这种外植体的说明,并通过询问原肠胚形成过程中节点信号的作用来证明它们的效用。
摘要
由于其光学清晰度和快速发育,斑马鱼胚胎是检查细胞行为和发育过程的绝佳系统。然而,由于胚胎信号的复杂性和冗余性,在早期胚胎发生过程中辨别任何单个信号的完整作用可能具有挑战性。通过外植斑马鱼胚层的动物区域,产生相对幼稚的胚胎细胞簇,这些细胞簇可以很容易地在 离体培养和操纵 。通过在外植前通过RNA注射引入目的基因,可以相对分离地评估该分子对基因表达,细胞行为和其他发育过程的影响。此外,来自不同基因型或条件的胚胎的细胞可以组合在单个嵌合外植体中,以检查细胞/组织相互作用和组织特异性基因功能。本文提供了产生斑马鱼胚层外植体的说明,并证明单个信号分子 - 节点配体 - 足以在其他幼稚的胚胎组织中诱导胚层形成和扩展形态发生。由于它们能够在简化的 离体 系统中概括胚胎细胞行为,形态原梯度和基因表达模式,因此这些外植体预计将对许多斑马鱼研究人员具有很大的实用性。
引言
发育生物学领域的一个长期目标是解开发育胚胎的复杂性,以了解动物形态和功能的起源。即使是早期的胚胎也包含信号分子,细胞和组织相互作用以及机械力的复杂混合体,所有这些都受到严格的空间和时间调节。因此,确定特定信号在感兴趣的发展过程中的确切作用通常具有挑战性。通过从内源性环境中去除胚胎组织,胚胎外植创造了一个简化的平台,可以在其中识别相对孤立的单个组织和分子的发育作用。外植技术可能在非洲爪蟾中最为人所知,在那里它们已被用于研究组织诱导,细胞信号传导,细胞粘附和形态发生,以及其他过程1,2,3,4。所谓动物帽外植体,其中胚泡期非洲爪蟾胚胎的动物区域在感应相互作用5、6、7之前被分离出来,是一种广泛而强大的外植体技术。未经驯养的动物帽注定成为外胚层7,8。尽管如此,它们仍然能够对几种归纳因子做出反应,使它们能够形成所有三个胚层的组织,并经历适合组织的形态发生运动9,10,11。然而,有限的遗传工具和对实时成像的次优适用性阻止了许多发育生物学家使用非洲爪蟾动物帽外植体。通过从斑马鱼胚胎中外植胚芽细胞,研究人员可以将动物帽测定的实用性与斑马鱼模型系统的光学清晰度,遗传工具的丰度和其他实验优势相结合。
迄今为止,研究人员已经使用了两种口味的斑马鱼外植体:所谓的pescoids和胚泡外植体。在卵黄模型中,整个胚泡,包括边缘区,从蛋黄中分离出来,并允许在没有胚胎外蛋黄合胞层(YSL)12,13的情况下外体发育。通过这种方式,pescoids与几十年前由Jane Oppenheimer和J.P. Trinkaus14,15产生的Fundulus外植体显着相似。这些外植体概括了胚胎图案化和形态发生的许多方面12,13。然而,由于这些分离物含有内源性信号中心(胚胎边缘),因此它们在分子环境方面并未简化。或者,研究人员可以通过排除边缘区域16,17,18,19,20,21来产生相对幼稚的斑马鱼胚泡外植体。未驯养的斑马鱼胚层外植体表达高水平的骨形态发生蛋白(BMP)形态原19,并在离体培养时产生非神经外胚层和包络层(EVL)。然而,它们概括了轴向图案化和形态发生的许多方面,以响应外源信号梯度19,20,21,类似于非洲爪蟾动物帽。因此,胚粒外显体是研究给定形态原(或形态原)在简化信号环境中生殖层规范,形态发生细胞运动和信号梯度中的作用的有利模型。此外,来自不同基因型或条件的胚胎的胚芽可以组合在单个嵌合外植体19,21中以研究细胞/组织自主性和感应相互作用。
斑马鱼胚芽孢子外植体可用于研究胚芽信号(例如,节点)在原肠胚形成过程中形态发生和组织规格中的作用。通过在单细胞阶段注射合成 的ndr2 RNA(编码节点配体),节点信号传导在整个胚胎的胚胚层中被激活。来自这些胚胎的外植体产生节点信号梯度,形成所有三个胚层,并经历收敛和延伸(C&E)原肠胚运动,如完整胚胎20所示。此外,嵌合外植体用于说明中胚层组织从未注射(幼稚)的胚芽细胞诱导神经外胚层的能力。该协议提供了创建斑马鱼胚层外植体的说明,并证明了它们在定义节点信号在组织诱导和形态发生中的作用方面的效用。
研究方案
1 准备试剂和耗材
- 试剂制备
- 准备500毫升3x Danieau的溶液(溶液1,表1)。
- 准备1L鸡蛋水(溶液2,表1)。
- 在鸡蛋水中准备1.2%的琼脂糖溶液。琼脂糖在微波炉中完全融化,然后在水浴中冷却至55°C。
- 根据实验条件准备4 mL外植体培养基(溶液3,表1,从19,21略微改良)。
注意:在计算所需体积时,请记住至少一个来自未注射(或对照注射)胚胎的外植体孔。- 用70%乙醇消毒工作空间。
- 从4°C中取出细胞培养基,并用70%乙醇喷雾/擦拭。
- 使外植体培养基并置于28.5°C培养箱中以在注射胚胎时加热。
注意:始终包括年龄匹配,完整的兄弟姐妹胚胎,以便分期。将这些胚胎去脉,并在琼脂糖包被的平板上培养0.3x Danieau溶液(溶液4,表1)。
- 从-20°C除去丙酶等分试样(1 mL,20 mg / mL),并在冰上解冻。解冻每三个实验条件一个1 mL等分试样。
- 准备琼脂糖板
- 制作注射板。
- 将100 mm x 15 mm的塑料培养皿中加入半滴熔融琼脂糖放入鸡蛋水中。
- 将注射模具以45°角轻轻地放在熔融琼脂糖的顶部,然后逐渐将其降低到琼脂糖中,确保下面没有气泡。让它完全冷却。
- 取出模具。立即使用盘子或通过加入2mL鸡蛋水,包裹盘子并将其储存在4°C以备后用。 注射前在28.5°C培养箱中加热板15-30分钟。
- 制作外植切割板。
- 将3 mL熔融的1.2%琼脂糖加入鸡蛋水中,放入60 mm x 15 mm培养皿中,确保整个井底都涂有涂层。让它完全冷却。
- 用琼脂糖覆盖培养板。
- 对于每个实验条件,将1 mL熔融的1.2%琼脂糖在鸡蛋水中分配到6孔板的一个孔中,确保整个孔的底部被涂覆。让它完全冷却。
- 为了制作嵌合外植体,通过在60 mm x 15 mm培养皿中的熔融琼脂糖中加入12个1mm玻璃珠,创建具有小孔的外植体切割皿。琼脂糖完全冷却后,用镊子取出珠子。
- 制作注射板。
2 用RNA注射胚胎
- 戴上手套,从-80°C的储存中取出一等分试样的合成 ndr2 mRNA,并立即将其放在冰上。
- 准备注射针。
- 用RNA填充拉动的玻璃毛细管针。将填充的针放入微型机械手中,并用镊子折断针尖。
- 使用带有一滴矿物油的载物台千分尺校准注射量,调整注射时间和气动注射器上的压力,以实现所需尺寸的推注。直径为120μm的推注量为1 nL。
注意:推注的所需体积将取决于RNA的浓度和每个胚胎的所需剂量。例如,如果RNA在10 ng / μL下等分,则注射1 nL以达到10pg的最终量。- 保持RNA针尖浸没在油中,直到准备注射。
- 加载胚胎并注射。
- 拉动繁殖池中的分隔物,让鱼产卵10-15分钟,然后使用茶过滤器收集胚胎。
- 使用巴斯德移液器和移液器泵将胚胎装入注射板,然后用戴手套的手指将卵子轻轻地压入槽中。
- 将10 pg ndr2 RNA注射到单细胞胚胎的蛋黄中,直到达到所需的胚胎数量或直到胚胎开始分裂。
注意:不要在单细胞阶段后注射,以确保RNA在整个胚胎中的均匀分布。 - 将胚胎从注射板中洗出到标记的100 mm x 15 mm培养皿中,从挤压瓶中加入温和的鸡蛋水流。
注意:始终保留一组年龄匹配、未被打扰的兄弟姐妹作为对照。 - 将胚胎放入28.5°C培养箱中,直到它们达到128细胞阶段。从培养皿中取出未受精的卵子和死胚胎。
3 对胚胎进行去鞘化
- 一旦胚胎达到128个细胞阶段,将它们放入标记的玻璃培养皿中,并从中倾出尽可能多的鸡蛋水。
- 用实验室胶带(对应于小碟子名称)标记玻璃结晶皿,并用鸡蛋水填充2/3的方式。将这些培养皿放在解剖显微镜旁边,以便快速接近。
- 在50 mL锥形管中加入1mL丙酶原液(20mg / mL,在冰上解冻)到15mL 3x Danieau溶液中。
注意:此量足以满足最多三种实验条件。增加前蛋白酶的体积和3倍Danieau的溶液,以获得额外的外植体条件。
注意:Pronase是一种刺激物;因此,在处理时戴上手套。 - 向每个含有胚胎的玻璃培养皿中加入至少5mL的丙酶溶液。
- 以圆周运动搅拌玻璃盘,在解剖显微镜下持续监测去角质的进度。
- 一旦绒毛膜开始起皱,1-2个胚胎从绒毛膜中出来,小心地将含有蛋白酶的玻璃培养皿和胚胎浸入含有鸡蛋水的相应玻璃结晶皿中。
- 洗涤去甲状胚胎。
- 用鸡蛋水清洗胚胎三次,轻轻加入,然后从盘子中倒出鸡蛋水。
- 第三次也是最后一次洗涤是用0.3倍的Danieau溶液。
注意:如果胚胎在洗涤后仍有绒毛膜,请轻轻移液胚胎,直到绒毛膜被移除,或者让它们静置在洗涤物(卵水或0.3x Danieau's溶液)中一两分钟,然后轻轻地以圆周运动搅拌。
- 用培养皿盖覆盖去瓶的胚胎,并将其返回培养箱(28.5°C),直到它们达到256个细胞阶段。
4 切口外植体
- 用3x Danieau的溶液填充琼脂糖包被的60 mm x 15 mm培养皿。
- 一旦胚胎处于256细胞阶段,将它们转移到含有3x Danieau溶液的琼脂糖包被的板中,沿着培养皿的中心排列。
- 使用镊子切割外植体(图1)。
- 使用一对闭合的镊子来稳定胚胎,并使用另一对镊子以大约一半的高度(从边缘到动物极)切穿胚层(图1A)。
- 要切割,用一对镊子轻轻挤压胚泡细胞。然后,取稳定镊子并沿着其他镊子运行它们,以在胚泡皮层上切开大约一半(图1B)。
- 旋转胚胎,将镊子放入现有的切口中,然后将剩余的胚芽正交切开到第一个切口(图1C)。
- 将外植体保持在3x Danieau的溶液中至少5分钟以愈合,然后将它们转移到涂有琼脂糖并充满4mL外植体培养基的6孔板的孔中。
注意:将未注射(或对照注射)兄弟姐妹的外植体切除为阴性对照。如果外植体的实施正确,这些外植体既不会延伸也不会表达内胚层、中胚层或神经外胚层的标志物。 - 将外植体培养板放入28.5°C培养箱中,直到达到所需的时间点/阶段(从完整的兄弟姐妹中确定)。
注意:如果用化合物(例如小分子抑制剂)处理外植体,则可以在所需的时间点将所需浓度直接添加到孔内的外植体培养基中。在计算浓度时,请记住包括琼脂糖的体积。(例如:1 mL 琼脂糖 + 4 mL 外植体培养基 = 每孔 5 mL 总体积)。
5 准备嵌合外植体
- 代替常规琼脂糖涂层板,在培养皿中切割嵌合体外植体,琼脂糖使用1mm玻璃珠模塑成十二个小的浅孔(第1.2.4节)。用3x Danieau的溶液填充此盘子。
注意:嵌合外植体是由两个不同基因型或条件的胚胎的胚芽细胞产生的。确保这些条件可以通过转基因或注射的荧光标记物的表达来区分。- 通过将一种基因型/条件的十二个胚胎添加到板的左侧,并将另一种基因型/条件的十二个胚胎添加到板的右侧来准备。
- 将每种条件的一个胚胎移动到板的中心,靠近12个孔中的一个。
- 使用镊子,按照单个胚胎外植体的描述从每个胚胎中切割一个外植体(步骤4.3)。
- 使用镊子将两个外植体的切边在浅孔内快速压在一起,以使两半愈合成单个外植体。
- 继续板内剩余的11个孔。一旦外植体愈合,将它们转移到涂有琼脂糖并充满4mL外植体培养基的6孔板的孔中。重复此步骤,直到达到所需的外植体数量。
6 培养和/或成像固定外植体
- 在28.5°C培养箱中培养外植体,直到完整的兄弟姐妹胚胎达到所需阶段。
- 活外植体可以安装用于连续延时成像,在整个培养期间定期成像,或在实验终点进行现场成像。
- 如果需要,固定外植体。一旦外植体达到所需的终点,记下完整胚胎兄弟姐妹的阶段,并将外植体放入装有1 mL 4%多聚甲醛的玻璃闪烁小瓶中PBS。在4°C的摇摇杯上固定过夜。
注意:多聚甲醛是有毒的。处理这种化学品时戴上手套,并通过每个机构批准的方法进行处理。- 固定后,用PBS + 0.1%吐温-20冲洗外植体六次,每次15分钟,然后逐渐脱水成甲醇。将外植体储存在-20°C,以便以后通过全口 原位 杂交,免疫荧光染色等进行分析。
结果
淋巴配体驱动斑马鱼胚层外植体的形成和C&E
从未注射的野生型(WT)胚胎或注射50pg编码绿色荧光蛋白(GFP)的mRNA的胚胎中切割的对照外接体在整个培养期间保持圆形(图2A-C),并且未能表达中胚层,内胚层或神经外胚层的标记物(图3C)20。总之,这些表明缺乏脊椎动物原肠胚形成的特征形态发生和胚层形成。然而,从注射10pg ndr2 mRNA的胚胎中切割的外植体在培养8-9小时后变得高度细长(图2D)。通过差分干涉造影剂(DIC)显微镜对这些外植体进行实时延时成像显示,延伸在受精后8小时或左右开始(图2F),同时C&E形态发生始于完整的斑马鱼胚胎22。从缺乏基本tdgf1结共受体23的MZoep-/-胚胎中切割的外植体未能响应ndr2注射而扩展(图2E),表明节点活性对于这种离体形态发生至关重要。此外,全坐位杂交进一步表明,表达ndr2的外植体表达神经外胚层(sox2)和几种中胚层亚型(tbxta、noto、tbx16)的标志物(图2G),以及内胚层和胚胎组织体20。
中胚层诱导神经外胚层不需要淋巴结信号
节点信号活动对于诱导内胚层和大多数中胚层是必不可少的,但对于斑马鱼胃肠23,24中的神经外胚层规格是可有可无的。虽然未注射的斑马鱼胚泡外植体没有分化成神经外胚层(图3C18),但来自注射10 pg ndr2的胚胎的外植体表现出沿着外胚体长轴的不同条纹的神经外胚层标记sox2的强劲表达(图2G),表明节点活性是离体神经外胚层形成所必需的。早就知道,中胚层组织可以诱导神经组织25、26、27、28、29,包括斑马鱼胚泡17个。然而,目前尚不清楚该外植体系统中的神经外胚层形成是否需要直接淋巴信号传导,或者外源性淋巴结配体是否诱导中胚层,然后二次诱导神经组织。
生成包含来自两个不同胚胎的前瞻性中胚层和神经外胚层部分的嵌合外植体,以测试是否需要淋巴信号传导组织 - 自主地用于神经外胚层规范离体。从表达中胚层特异性转基因GFP报告基因Tg[lhx1a:eGFP]30的WT胚胎中切割每个外植体的中胚层部分,注射高剂量(100pg)的ndr2(图3A)。从仅注射编码荧光核标志物H2B-RFP的mRNA的对照WT胚胎或节点信号缺陷MZoep-/-胚胎中切割每个外植体的推定神经外胚层部分(图3A)。通过结合来自这两种条件中的每一种的一种胚芽来生成每个嵌合外植体,通过在12 hpf下全安装原位杂交来测定组织特异性标记物的表达。
大多数注射有100 pg ndr2的胚胎的单胚胎外植体表达很少或没有sox2,并且在整个外植体中表达中胚层的标志物,包括tbxta和lhx1a:gfp报告(图3B,G)。未注射的WT胚芽(包括嵌合外植体的前瞻性神经外胚层部分的类型)在作为单个外植体培养时既不表达中胚层标记物也不表达sox2,表明缺乏神经外胚层和中胚层规格(图3C,H)。来自MZoep-/-胚胎的单胚胎外植体同样缺乏神经外胚层和中胚层标志物的表达,即使注射ndr2也是如此(图3D)。然而,当未注射的WT胚芽肿与由高剂量节点配体诱导的中胚层结合时,这些嵌合外植体强烈地表达中胚层标记物和sox2(图3E,I)。这些结果表明,如前所述,17、26、27、29,中胚层可以在细胞中诱导神经命运,否则这些细胞会成为非神经外胚层。为了测试这些外植体的前瞻性神经外胚层部分是否需要淋巴信号传导以进行神经诱导,嵌合外植体由注入100 pg ndr2的WT胚芽和来自MZoep-/-胚胎的胚芽产生(图3J)。尽管它们无法从邻近的中胚层部分接收节点信号,但这些外植体表达的sox2与WT对照嵌合体的程度相似(图3F)。该结果表明,与在没有节点活性的情况下指定神经组织的完整胚胎一致,节点信号传导不是神经外胚层诱导体自主的组织所必需的。
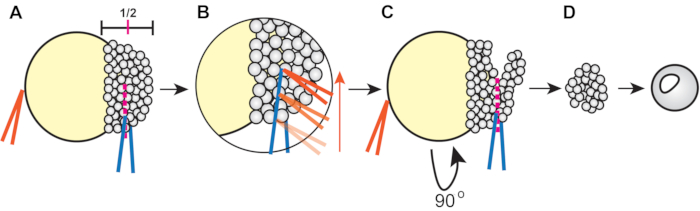
图1:斑马鱼胚芽外植程序(步骤4.3)。 (A)将非优势手(橙色)中的镊子闭合在蛋黄上以稳定胚胎,同时使用惯用手(蓝色)的镊子将胚芽捏成其高度的约1/2。(B)沿着蓝色镊子的边缘运行橙色镊子抓住胚胎以切开胚层,使第一个切口到达大约一半的胚泡。(C)将胚胎旋转90°,然后将蓝色镊子放在原始切口(但正交)内并捏合以切断剩余的胚泡。(D) 让外植的胚芽细胞在3x Danieau的溶液中愈合约5分钟,然后转移到外植培养基中。 请点击此处查看此图的放大版本。
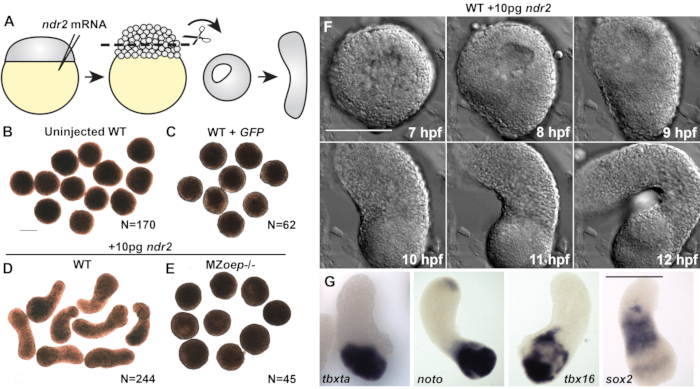
图2(从20修改而来):节点配体促进斑马鱼胚层外植体的C&E形态发生和胚层形成。 (B-E)在等效的2-4个体参体阶段,所述条件/基因型的活胚芽孢子外植体的代表性明场图像。N = 2至4项独立试验的外植体数量。(F) 来自WT胚胎的代表性外植体的延时DIC系列,注入10 pg ndr2 RNA。(G)全坐位原位杂交的代表性图像,用于注射10 pg ndr2 RNA的WT胚胎的外植体中指示的转录本。比例尺为200μm,请点击此处查看此图的放大版本。
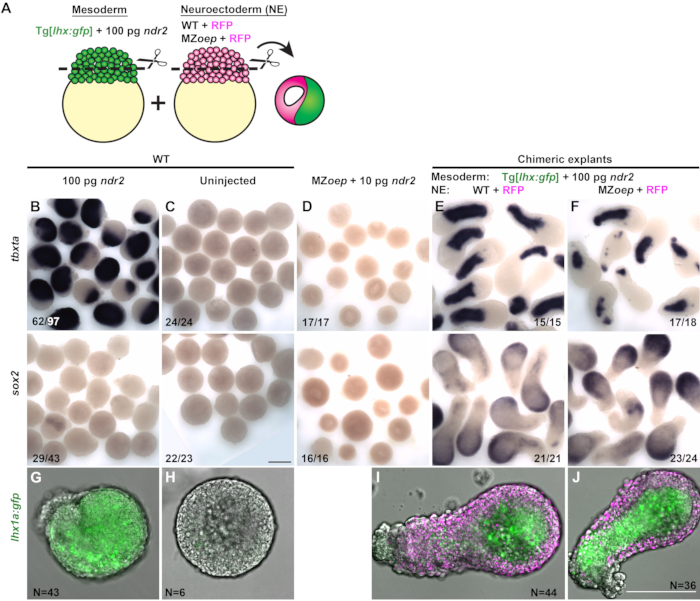
图3(从31修改而来):嵌合外植体显示,神经外胚层规范不需要组织自主的离体节点信号传导。 (B-F)中胚层标记tbxta(上图)和神经外胚层标记sox2(下图)的全位原位杂交,来自WT胚胎的外植体中注入100 pg ndr2 RNA(B),未注射的WT对照(C),注射10 pg ndr2(D)的MZoep-/-以及含有来自WT(E)或MZoep-/-(F)的神经外胚层部分的嵌合外植体)胚胎在相当于2-4个索米特阶段。分数表示外植体的数量,表型显示在所检查的外植体总数上。(G-J)活Tg[lhx1a:gfp]从单个胚胎(G-H)或与表达H2B的胚芽肿(I-J,洋红色)结合的具有代表性的图像,其条件指示在相当于2-4个体灰阶段。N = 来自三项独立试验的外植体数量。比例尺为200μm,请点击此处查看此图的放大版本。
| 解决方案 1 | 解决方案 2 | 解决方案 3 | 解决方案 4 | |
| 溶液 | 3x 丹尼奥 | 鸡蛋水 | 外植培养基 | 0.3倍达尼奥 |
| 成分 | 174 mM 氯化钠 | 60 微克/毫升海盐 | DMEM/F12 + 2.5 mM L-谷氨酰胺和 15 mM HEPES | 17.4 mM 氯化钠 |
| 2.1 mM 氯化钾 | 1升蒸馏水 | 3%新生儿犊牛血清或胎牛血清总体积 | 0.21 mM 千氯化钾 | |
| 1.2 mm MgSO4.7H2O | 1:200青霉素(50单位/毫升)-链霉素(50微克/毫升) | 0.12 mM 镁四氢硅4•7H2O | ||
| 1.8 mM 钙(NO3)2 •4H2O | 0.18 mM 钙(NO3)2 •4H2O | |||
| 15 mM 肝素 | 例: | 1.5 mM 肝素 | ||
| 蒸馏水 | 4 mL/条件 x 9 条件 = 36 mL | 蒸馏水 | ||
| 1.08 mL 新生犊牛血清(NCS,在 -20 °C (3%) | ||||
| 0.18 mL 200x 笔链球菌(PS,在 -20 °C 中等分) (1:200) | ||||
| 35 毫升 DMEM/F12 |
表 1.
讨论
本文描述了如何产生斑马鱼胚层外植体,并讨论了这些外植体在解决结形原信号传导在原肠胚增多中的作用中的两种实际应用。这种切割和培养外植体的方法提供了一块空白的幼稚细胞,可以使用RNA注射和小分子化合物处理来操纵这些细胞,以研究感兴趣的分子途径。
关键步骤
该协议中有四个步骤对其成功特别重要。首先是向胚胎注射适量的节点。该协议建议使用10 pg的 ndr2 RNA,尽管一系列剂量可促进扩展,但淋dal过多或过少都会阻止最佳外植体扩展20。第二步是对胚胎进行去鞘化。如果胚胎在蛋白酶中停留太长时间,卵黄就会破裂,胚胎将无法切割。如果它们在蛋白酶中的时间不够长,绒毛膜不会因洗涤而松动,而是需要耗时的手动去脉。第三个关键步骤是切割外植体。建议切入3x Danieau的溶液,因为0.3x Danieau溶液或鸡蛋水的较低盐含量不会促进外植体的愈合和存活。
此外,外植体必须在大约一半的高度切割,以确保细胞的幼稚。如果它们被切得太靠近蛋黄,它们将包含来自边缘(包括内源性节点)的信号,这些信号促进组织规格和形态发生。第四步也是最后一个关键步骤是嵌合外植体的愈合。两个外植体不会融合形成嵌合体,除非它们的切割边缘在切割后立即被轻轻地压在一起。
修改和故障排除
上述关键步骤提供了故障排除的机会。下面列出了一些常见问题和建议的解决方案。
如果外植体在存在节点信号传导的情况下没有延伸,则有一些可能的解决方案。(A)在单细胞阶段注射胚胎,以确保RNA均匀地分散在整个胚胎中。(B)通过使用千分尺测量注射推注量,确保注射体积正确,避免注射过多的 淋巴 RNA。(C)通过测量淋巴结RNA的浓度,避免注射太少 的淋巴结 RNA,以确保其没有降解。(D)保留一些年龄匹配的完整兄弟姐妹,以推断外植体的等效阶段。当完整的兄弟姐妹达到2-5个体参阶段时,外植体达到最大伸展。如果过早收集外植体,则无法达到最佳延伸。
如果蛋黄在去角膜后破裂,并且胚胎无法切割,则在绒毛膜开始皱褶并且1-2个胚胎脱落绒毛后,将胚胎从pronase溶液中取出。然后,立即用鸡蛋水冲洗。
如果外植体在边缘周围出现气泡,则有一些解决方案。(A)仅在特定的开发时间范围内切割外植体。虽然在128至1000个细胞阶段的任何阶段切割的外植体可以在培养物中存活和延伸,但在256至512个细胞阶段切割的外植体往往是最稳健的。(B)确保在3x Danieau的溶液中切割外植体,以确保适当的愈合。(C)干净但轻柔地切割外植体。避免在切割过程中拉伸或拉开细胞。
如果未注射的对照外植体延伸,则外植体可能切得太靠近蛋黄。对于幼稚的外植体,请确保切口在蛋黄和胚泡顶部之间。
如果嵌合外植体无法融合,那很可能是因为3x Danieau溶液中的外植体在切割后的趋势是四舍五入并在切缘上愈合。为了确保两个胚泡相互愈合而不是自己愈合,请在切割后立即将它们压在一起。使用镊子对琼脂糖内新加入的胚泡施加轻柔的压力,以鼓励它们一起愈合。
局限性
虽然这些外植体是研究给定形态原(或其他感兴趣的分子)在相对分离中的作用的宝贵工具,但在任何离体模型中进行的观察都必须谨慎解释。外植体表现出与体内20非常相似的C&E形态发生,但它们并没有概括原肠胚形成的所有方面,例如,表观运动。它们还缺乏存在于完整胚胎中的许多其他调节因子和信号分子。虽然这是外植体的一个显着的实验优势,但它也可能导致在体内不成立的结论 。例如,由于不接收外源性淋巴结配体的外植体无法表达神经外胚层标志物,因此仅从外植体中可以得出结论,神经外胚层规范需要节点信号传导。然而,神经外胚层是在缺乏所有节点信号传导23,24的完整胚胎内形成的,证明了其他信号分子在神经规范32中的重要作用。外植体可以告诉我们形态原在孤立环境中的能力。尽管如此,所有这些发现都应该在完整的胚胎中得到证实/比较,以便彻底解释结果。换句话说,外植体不能取代发育中的胚胎。相反,它们是识别形态原与周围环境的作用和关系的补充工具。考虑到这些局限性,斑马鱼胚层外植体是许多研究问题的宝贵工具。
对现有方法的意义
随着对合成胚胎学的新兴趣,定期采用几种离体和体外方法来模拟胚胎发育的各个方面。例如,由小鼠或人类胚胎/诱导多能干细胞组成的2维和3维类胃胚层可以通过外源信号分子的应用来诱导,以概括原肠胚,分割和神经修饰的一些图案化和/或形态发生事件33,34,35,36,37.虽然这些方法功能强大,但需要费力和长时间的培养方法来持续维持多能干细胞和生长胃胚泡,这需要很多天才能达到原肠胚形成阶段。相比之下,斑马鱼外植体不需要维持干细胞培养物,因为胚胎只是根据需要收集的。它们相对容易在数小时内生成并达到原肠胚阶段,与斑马鱼胚胎相同。这凸显了斑马鱼外植体的另一个优势,即它们完整的发育时钟。由于胚胎和诱导多能干细胞的发育年龄可能是可变的和高度争论的,胚胎外植体可能更适合研究发育的时间调节。最后,虽然斑马鱼的外植体(含有胚胎边缘)在培养物12、13中同样延伸,但它们响应于内源性信号传导中心。相反,这里描述的外植体使研究人员能够研究感兴趣的分子,而来自这种胚胎信号的干扰相对较小。
未来的潜在应用
在这里,外植体用于证明节点信号对于C&E形态发生是必要和足够的。尽管如此,预计它们可以并且将用于辨别许多不同分子在许多其他发育过程中的作用,例如,基因表达的调节,信号梯度和其他形态发生程序。此外,由于这些外植体在至少24 hpf19之前是可行的,可以预期它们的效用将超越原肠胚形成过程,扩展到诸如分割和器官发生等过程,任何研究人员都希望发育空白的过程。
披露声明
作者声明他们没有相互竞争的经济利益。
致谢
这项工作得到了NICHD R00HD091386到MLKW和NIEHS T32ES027801到AAE的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mm glass beads | Millipore-Sigma | Z250473 | |
| 4% Paraformaldehyde | VWR | J19943-K2 | |
| 6-well plates | Fisher | FB012927 | |
| Agarose | Thermo-Fisher | 16500500 | |
| Ca(NO3)2 .4H2O | Thermo-Fisher | 12364-36 | |
| DMEM/F12 media | Gibco | 11330032 | |
| Dumont #5 watchmakers forceps | World Precision Instruments | 500341 | |
| Embryo injection mold | Adaptive Science Tools | I-34 | |
| Glass crystalizing dishes | Fisher | 08-741A | |
| Glass Petri dishes | Fisher | 08-748A | |
| HEPES | VWR | JT4018-1 | |
| Instant Ocean sea salts | Instant Ocean | SS15-10 | |
| KCl | VWR | BDH9258-500G | |
| Low temperature incubator | Fisher | 15-015-2632 | |
| MgSO4.7H2O | VWR | 97062-134 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | M3301R | |
| Micrometer | SPI supplies | 02265-AB | |
| Mineral oil | VWR | MK635704 | |
| NaCl | VWR | BDH9286-500G | |
| Newborn Calf Serum | Invitrogen | 26010-066 | |
| Pasteur pipettes | Fisher | 13-678-30 | |
| Penicillin-Streptomycin Solution | Thermo-Fisher | 15140122 | |
| Pico-pump pneumatic injector | World Precision Instruments | SYS-PV820 | |
| Pipet pump | Fisher | 13 683C | |
| Plastic Petri dishes 100 mm | Fisher | FB0875712 | |
| Plastic Petri dishes 60 mm | Fisher | FB0875713A | |
| Plastic wash bottles | Fisher | 03-409-10E | |
| Pronase | Millipore-Sigma | 10165921001 | |
| Tween-20 | VWR | 200002-836 |
参考文献
- Green, J. B., New, H. V., Smith, J. C. Responses of embryonic Xenopus cells to activin and FGF are separated by multiple dose thresholds and correspond to distinct axes of the mesoderm. Cell. 71 (5), 731-739 (1992).
- Sudarwati, S., Nieuwkoop, P. D. Mesoderm formation in the anuranXenopus laevis (Daudin). Wilhelm Roux Archiv fur Entwicklungsmechanik der Organismen. 166 (3), 189-204 (1971).
- Gurdon, J. B., Fairman, S., Mohun, T. J., Brennan, S. Activation of muscle-specific actin genes in Xenopus development by an induction between animal and vegetal cells of a blastula. Cell. 41 (3), 913-922 (1985).
- Keller, R., Danilchik, M. Regional expression, pattern and timing of convergence and extension during gastrulation of Xenopus laevis. Development. 103 (1), 193-209 (1988).
- Ariizumi, T., et al. Isolation and differentiation of Xenopus animal cap cells. Current Protocols in Stem Cell Biology. , (2009).
- Asashima, M., Grunz, H. Effects of inducers on inner and outer gastrula ectoderm layers of Xenopus laevis. Differentiation. 23 (3), 206-212 (1983).
- Jones, E. A., Woodland, H. R. Development of the ectoderm in Xenopus: tissue specification and the role of cell association and division. Cell. 44 (2), 345-355 (1986).
- Keller, R. E. Vital dye mapping of the gastrula and neurula of Xenopus laevis. I. Prospective areas and morphogenetic movements of the superficial layer. Developmental Biology. 42 (2), 222-241 (1975).
- Sokol, S., Wong, G. G., Melton, D. A. A mouse macrophage factor induces head structures and organizes a body axis in Xenopus. Science. 249 (4968), 561-564 (1990).
- Thomsen, G., et al. Activins are expressed early in Xenopus embryogenesis and can induce axial mesoderm and anterior structures. Cell. 63 (3), 485-493 (1990).
- Howard, J. E., Smith, J. C. Analysis of gastrulation: different types of gastrulation movement are induced by different mesoderm-inducing factors in Xenopus laevis. Mechanisms of Development. 43 (1), 37-48 (1993).
- Fulton, T., et al. Axis specification in Zebrafish is robust to cell mixing and reveals a regulation of pattern formation by morphogenesis. Current Biology. 30 (15), 3063-3064 (2020).
- Schauer, A., Pinheiro, D., Hauschild, R., Heisenberg, C. -. P. Zebrafish embryonic explants undergo genetically encoded self-assembly. eLife. , 55190 (2020).
- Oppenheimer, J. M. The development of isolated blastoderms of Fundulus heteroclitus. The Journal of Experimental Zoology. 72 (2), 247-269 (1936).
- Trinkaus, J. P., Drake, J. W. Exogenous control of morphogenesis in isolated Fundulus blastoderms by nutrient chemical factors. The Journal of Experimental Zoology. 132 (2), 311-347 (1956).
- Grinblat, Y., Lane, M. E., Sagerström, C., Sive, H. Analysis of zebrafish development using explant culture assays. Methods in Cell Biology. 59, 127-156 (1999).
- Sagerström, C. G., Grinblat, Y., Sive, H. Anteroposterior patterning in the zebrafish, Danio rerio: an explant assay reveals inductive and suppressive cell interactions. Development. 122 (6), 1873-1883 (1996).
- Sagerström, C. G., Gammill, L. S., Veale, R., Sive, H. Specification of the enveloping layer and lack of autoneuralization in zebrafish embryonic explants. Devolopmental Dynamics. 232 (1), 85-97 (2005).
- Xu, P. F., Houssin, N., Ferri-Lagneau, K. F., Thisse, B., Thisse, C. Construction of a vertebrate embryo from two opposing morphogen gradients. Science. 344 (6179), 87-89 (2014).
- Williams, M. L. K., Solnica-Krezel, L. Nodal and planar cell polarity signaling cooperate to regulate zebrafish convergence and extension gastrulation movements. eLife. 9, (2020).
- de Olivera-Melo, M., Xu, P. F., Houssin, N., Thisse, B., Thisse, C. Generation of ectopic morphogen gradients in the Zebrafish blastula. Methods in Molecular Biology. 1863, 125-141 (2018).
- Sepich, D. S., Calmelet, C., Kiskowski, M., Solnica-Krezel, L. Initiation of convergence and extension movements of lateral mesoderm during zebrafish gastrulation. Devolopmental Dynamics. 234 (2), 279-292 (2005).
- Gritsman, K., et al. The EGF-CFC protein one-eyed pinhead is essential for nodal signaling. Cell. 97 (1), 121-132 (1999).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Spemann, H., Manngold, H. Uber inducktion von embryoalanlangen durch implantation artfremder organisatoren. Archiv für mikroskopische Anatomie und Entwicklungsmechanik. 100, 599-638 (1924).
- Mangold, O. Über die Induktionsfähigkeit der verschiedenen Bezirke der Neurula von Urodelen. Naturwissenschaften. 21 (43), 761-766 (1933).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Agathon, A., Thisse, C., Thisse, B. The molecular nature of the zebrafish tail organizer. Nature. 424 (6947), 448-452 (2003).
- Tacke, L., Grunz, H. Close juxtaposition between inducing chordamesoderm and reacting neuroectoderm is a prerequisite for neural induction in Xenopus laevis. Cell Death and Differentiation. 24 (1), 33-43 (1988).
- Swanhart, L. M., et al. Characterization of an lhx1a transgenic reporter in zebrafish. The International Journal of Developmental Biology. 54 (4), 731-736 (2010).
- Williams, M. L. K., Solnica-Krezel, L. A mesoderm-independent role for Nodal signaling in convergence & extension gastrulation movements. BioRxiv. , (2019).
- Londin, E. R., Niemiec, J., Sirotkin, H. I. Chordin, FGF signaling, and mesodermal factors cooperate in zebrafish neural induction. Developmental Biology. 279 (1), 1-19 (2005).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Veenvliet, J. V., et al. Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science. 370 (6522), (2020).
- Beccari, L., et al. Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids. Nature. 562 (7726), 272-276 (2018).
- Moris, N., et al. An in vitro model of early anteroposterior organization during human development. Nature. 582 (7812), 410-415 (2020).
- vanden Brink, S. C., et al. Single-cell and spatial transcriptomics reveal somitogenesis in gastruloids. Nature. 582 (7812), 405-409 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。