Method Article
Zebra Balığı Embriyolarından Naïve Blastoderm Explants Üretimi
Bu Makalede
Özet
Zebra balığı blastoderm eksplantları, embriyonik hücrelerin erken embriyo içindeki endojen sinyal merkezlerinden izole edilmesiyle, nispeten naif hücre kümelerinin kolayca manipüle edilmesi ve kültürlü ex vivoüretilmesiyle üretilir. Bu makalede, gastrülasyon sırasında Nodal sinyali için rolleri sorgulayarak bu tür eksplantlar yapmak için talimatlar sağlar ve yardımcı programlarını gösterir.
Özet
Optik netlikleri ve hızlı gelişimleri nedeniyle zebra balığı embriyoları hücre davranışlarını ve gelişim süreçlerini incelemek için mükemmel bir sistemdir. Bununla birlikte, embriyonik sinyallerin karmaşıklığı ve artıklığı nedeniyle, erken embriyogenez sırasında herhangi bir tek sinyalin tam rolünü ayırt etmek zor olabilir. Zebra balığı blastoderminin hayvan bölgesini alarak, kolayca kültürlenebilen ve manipüle edilebilen embriyonik hücrelerin nispeten naif kümeleri üretilir ex vivo. Eksplantasyondan önce RNA enjeksiyonu ile ilgi çekici bir gen tanıtarak, bu molekülün gen ekspresyasyonu, hücre davranışları ve diğer gelişimsel süreçler üzerindeki etkisini göreceli izolasyonda değerlendirebilirsiniz. Ayrıca, farklı genotip veya koşullardaki embriyolardan alınan hücreler, hücre/doku etkileşimlerini ve dokuya özgü gen fonksiyonlarını incelemek için tek bir kimerik eksplantta birleştirilebilir. Bu makale zebra balığı blastoderm eksplantları üretmek için talimatlar sağlar ve tek bir sinyal molekülü olan Nodal ligand'ın aksi takdirde naif embriyonik dokularda mikrop tabakası oluşumunu ve uzatma morfogenezine neden olmak için yeterli olduğunu göstermektedir. Basitleştirilmiş bir eks vivo sisteminde embriyonik hücre davranışlarını, morfojen gradyanlarını ve gen ekspresyon kalıplarını yeniden yakalama yetenekleri nedeniyle, bu eksplantların birçok zebra balığı araştırmacısı için büyük faydası olacağı beklenmektedir.
Giriş
Gelişimsel biyoloji alanının çok yıllık bir amacı, hayvan formunun ve işlevinin kökenini anlamak için embriyo geliştirmenin karmaşıklığını çözmektir. Erken embriyolar bile, hepsi katı mekansal ve zamansal düzenlemeye tabi olan sinyal molekülleri, hücre ve doku etkileşimleri ve mekanik kuvvetlerden oluşan karmaşık bir karışık içerir. Bu nedenle, belirli bir sinyalin gelişimsel bir ilgi sürecindeki kesin rolünü belirlemek genellikle zordur. Embriyonik dokuları endojen ortamlarından uzaklaştırarak, embriyo eksplantasyonu, bireysel dokuların ve moleküllerin göreceli izolasyondaki gelişimsel rollerini ayırt etmek için basitleştirilmiş bir platform oluşturur. Eksplantasyon teknikleri belki de en iyi bilinen Xenopus laevisDoku indüksiyonu, hücre sinyali, hücre yapışıklığı ve morfogenez, diğer işlemlerin yanı sıra 1 ,2,3,4. Blastula evresi Xenopus embriyolarının hayvan bölgesinin endüktif etkileşimlerden önce izole olduğu hayvan kapağı eksplantları5,6,7, yaygın ve güçlü bir eksplant tekniğidir. Yönetilmeyen hayvan kapakları ektoderm7,8olmak için yağlanır. Yine de, üç mikrop tabakasının da dokularını oluşturmalarına ve dokuya uygun morfogenetik hareketlerden geçmelerine izin veren birkaç endüktif faktöre yanıt vermeye yetkindirler9,10,11. Bununla birlikte, sınırlı genetik araçlar ve canlı görüntüleme için alt optimal uygunluk, birçok gelişim biyoloğu için Xenopus hayvan kapağı eksplantlarının kullanılmasını önler. Araştırmacılar, zebra balığı embriyolarından blastoderm hücrelerini çıkararak, hayvan kapağı testinin yararını optik netlik, genetik araçların bolluğu ve zebra balığı model sisteminin diğer deneysel avantajlarıyla birleştirebilirler.
Bugüne kadar, araştırmacılar iki zebra balığı eksplant lezzetini kullandılar: pescoids ve blastoderm eksplantları. Pescoid modelinde, marjinal bölge de dahil olmak üzere tüm blastoderm yumurta sarısından izole edilir ve ekstraembryonic yumurta sarısı senkron tabakası (YSL)12,13olmadan ex vivo geliştirmesine izin verilir. Bu şekilde, pescoidler Jane Oppenheimer ve J.P. Trinkaus14,15tarafından on yıllar önce üretilen Fundulus eksplantlarına önemli bir benzerlik taşır. Bu eksplantlar embriyonik desenleme ve morfogenezin birçok yönünü rekapitulateeder 12,13. Bununla birlikte, bu izolatlar endojen sinyal merkezleri (embriyonik marj) içerdiğinden, moleküler milieuları açısından basitleştirilmezler. Alternatif olarak, araştırmacılar marjinal bölge 16 , 17 , 18,19,20,21hariç nispeten naif zebra balığı blastoderm eksplantları üretebilirler. Yönetilmeyen zebra balığı blastoderm eksplantları yüksek düzeyde kemik morfogenetik protein (BMP) morfojenlerini19'a ifade eder ve kültürlü ex vivo18olduğunda sinirsel olmayan ektoderm ve saran tabakaya (EVL) yol açmaktadır. Bununla birlikte, Xenopus hayvan kapaklarına benzer eksojen sinyal gradyanları 19,20,21'e yanıt olarak eksenel desenleme ve morfogenezin birçok yönünü yeniden düzenlerler. Bu nedenle, blastoderm eksplantları, mikrop tabakası spesifikasyonunda, morfogenetik hücre hareketlerinde ve basitleştirilmiş bir sinyal ortamında sinyal gradyanlarında belirli bir morfonun (veya morfojenlerin) rolünü incelemek için avantajlı bir modeldir. Ayrıca, farklı genotip veya koşullardaki embriyolardan elde edilen blastodermler, hücre/doku özerkliğini ve endüktif etkileşimleri araştırmak için tek bir kimerik eksplant19,21'de birleştirilebilir.
Zebra balığı blastoderm eksplantları, embriyonik sinyallerin (örneğin Nodal) morfogenez ve gastrülasyon sırasında doku spesifikasyonundaki rolünü araştırmak için kullanılabilir. Tek hücreli aşamada sentetik ndr2 RNA (Nodal ligand kodlaması) enjekte ederek, Embriyonun blastoderm boyunca Nodal sinyali aktive edilir. Bu embriyolardan elde edilen eksplantlar Nodal sinyal gradyanları oluşturur, üç mikrop tabakasını da oluşturur ve bozulmamış embriyolarda görüldüğü gibi yakınsama ve uzatma (C&E) gastrülasyon hareketlerinden geçer20. Ek olarak, kimerik eksplantlar, mezoderm dokuların nöroektodermiyi davetsiz (naif) blastodermden indükleye etme yeteneğini göstermek için kullanılır. Bu protokol, zebra balığı blastoderm eksplantları oluşturmak için talimatlar sağlar ve Nodal sinyalinin doku indüksiyonu ve morfogenezdeki rolünü tanımlamadaki yararlarını gösterir.
Protokol
1 Reaktifleri ve malzemeleri hazırlayın
- Reaktif hazırlama
- 3x Danieau'nun çözeltisinin 500 mL'liğini hazırlayın (Çözüm 1, Tablo 1).
- 1 L yumurta suyu hazırlayın (Çözelti 2, Tablo 1).
- Yumurta suyunda% 1.2 agarose çözeltisi hazırlayın. Agarose'yi tamamen mikrodalga fırında eritin ve ardından bir su banyosunda 55 ° C'ye kadar soğutun.
- Deneysel durum başına 4 mL eksizyon ortamı (Çözüm 3, Tablo 1, 19,21'denbiraz değiştirilmiş) hazırlayın.
NOT: Gerekli hacmi hesaplarken, seçilmemiş (veya enjekte edilen kontrol) embriyolardan en az bir kuyu eksplantını hesaba katmayı unutmayın.- Çalışma alanını %70 etanol ile sterilize edin.
- Hücre kültürü ortamlarını 4 °C'den çıkarın ve % 70 etanol ile püskürtün/ silin.
- Embriyolar enjekte edilirken ısınmak için eksplant ortam yapın ve 28,5 °C inkübatöre yerleştirin.
NOT: Evreleme amacıyla her zaman yaşa uygun, sağlam kardeş embriyoları dahil edin. Bu embriyoları kaynatın ve 0,3x Danieau çözeltisinde agarose kaplı plakalarda kültürlendirin (Çözüm 4, Tablo 1).
- Pronaz aliquots (1 mL at 20 mg/mL) -20 °C çıkarın ve buz üzerinde çözülmeye bırakın. Her üç deneysel durum için bir adet 1 mL aliquot çözün.
- Agarose tabakları hazırlayın
- Enjeksiyon plakalarını yap.
- 100 mm x 15 mm plastik Petri kabının yarısını yumurta suyunda erimiş agarose ile doldurun.
- Enjeksiyon kalıbını erimiş agarozun üzerine 45 ° açıyla hafifçe yerleştirin ve yavaş yavaş agarose içine indirin, altında kabarcık sıkışmamasını sağlayın. Tamamen soğumaya bırakın.
- Kalıbı çıkarın. Plakayı hemen kullanın veya 2 mL yumurta suyu ekleyerek, plakayı sararak ve 4 °C'de depolayarak daha sonra saklayın. Enjeksiyondan önce plakayı 28,5 °C inkübatörde 15-30 dakika ısıtın.
- Explant kesme plakaları yapın.
- 60 mm x 15 mm Petri kabına yumurta suyuna 3 mL erimiş %1,2 agarose ekleyerek kuyunun tüm tabanının kaplanmasını sağlayın. Tamamen soğumaya bırakın.
- Agarose ile kültür plakalarını kaplayın.
- Her deneysel durum için, yumurta suyunda 1 mL erimiş% 1.2 agarose'u 6 kuyulu bir plakanın bir kuyusuna dağıtın ve kuyunun tüm tabanının kaplanmasını sağlayın. Tamamen soğumaya bırakın.
- Kimerik eksplantlar yapmak için, 60 mm x 15 mm Petri kabında erimiş agaroseya on iki adet 1 mm cam boncuk ekleyerek küçük kuyularla eksplant bir kesme kabı oluşturun. Agarose tamamen soğuduktan sonra boncukları kuşayıps ile çıkarın.
- Enjeksiyon plakalarını yap.
2 Embriyoları RNA ile enjekte edin
- Eldiven takarak, bir aliquot sentetik ndr2 mRNA'yı -80 ° C'de depodan çıkarın ve hemen buza yerleştirin.
- Enjeksiyon iğnesini hazırlayın.
- Çekilmiş bir cam kılcal iğneyi RNA ile doldurun. Doldurulmuş iğneyi bir mikro manipülatöre yerleştirin ve iğnenin ucunups ile kırın.
- Enjeksiyon hacmini bir damla mineral yağ ile bir sahne mikrometresi kullanarak kalibre edin, enjeksiyon süresini ve pnömatik enjektör üzerindeki basıncı ayarlayarak istenen boyutta bir bolus elde edin. 120 μm çapında bir bolus 1 nL hacme sahiptir.
NOT: Bolus'un istenen hacmi RNA'nın konsantrasyonuna ve embriyo başına istenen doza bağlı olacaktır. Örneğin, RNA 10 ng/μL'de aliquoted ise, son 10 pg miktarını elde etmek için 1 nL enjekte edin.- RNA iğne ucunu enjekte etmeye hazır olana kadar yağa batırın.
- Embriyoları yükleyin ve enjekte edin.
- Damızlık tanklardaki bölücüleri çekin, balıkların 10-15 dakika yumurtlamasına izin verin ve embriyoları bir çay süzgeci kullanarak toplayın.
- Embriyoları pasteur pipet ve pipet pompası kullanarak enjeksiyon plakasına yükleyin ve ardından yumurtaları oluklara hafifçe bastırmak için eldivenli bir parmak kullanın.
- İstenilen embriyo sayısına ulaşılana veya embriyolar bölünmeye başlayana kadar tek hücreli embriyoların sarısına 10 pg ndr2 RNA enjekte edin.
NOT: RNA'nın embriyo boyunca eşit dağılımını sağlamak için tek hücreli aşamadan sonra enjekte etmeyin. - Embriyoları enjeksiyon plakasından 100 mm x 15 mm Petri kabına, bir sıkma şişesinden hafif bir yumurta suyu akışı ile yıkayın.
NOT: Yaş uyumlu, seçilmemiş bir grup kardeşi her zaman kontrol olarak tutun. - Embriyoları 128 hücreli aşamaya ulaşana kadar 28,5 °C inkübatöre yerleştirin. Kısırlaştırılmamış yumurtaları ve ölü embriyoları tabaktan çıkarın.
3 Embriyoları kaynatın
- Embriyolar 128 hücreli aşamaya ulaştıktan sonra, etiketli cam Petri tabaklarına yerleştirin ve onlardan mümkün olduğunca fazla yumurta suyu demlendirin.
- Cam kristalize yemekleri laboratuvar bandıyla etiketleyin (küçük yemek isimlerine karşılık geliyor) ve yolu 2/3'ü yumurta suyu ile doldurun. Hızlı erişilebilirlik için bu yemekleri diseksiyon mikroskoplarının yanına yerleştirin.
- 50 mL konik bir tüpte 3x Danieau çözeltisinin 15 mL'sine 1 mL pronaz stoğu (20 mg / mL, buzda çözülmüş) ekleyin.
NOT: Bu miktar en fazla üç deneysel koşul için yeterlidir. Ek eksplant koşulları için pronaz hacmini ve 3x Danieau'nun çözümünü artırın.
DİkKAT: Pronaz tahriş edicidir; bu nedenle el kullanırken eldiven giyin. - Embriyo içeren her cam Petri kabına en az 5 mL pronaz çözeltisi ekleyin.
- Cam tabakları dairesel bir hareketle çalkalayarak, diseksiyon mikroskobu altında sürekli olarak dekonsiyonun ilerlemesini takip edin.
- Korozyonlar kırışmaya başladığında ve 1-2 embriyo korolarından çıktıktan sonra, pronaz içeren cam Petri kabını ve embriyoları yumurta suyu içeren ilgili cam kristalize kabın içine dikkatlice batırın.
- Kafeinsiz embriyoları yıkayın.
- Yumurta suyunu yavaşça ekleyip tabaktan dekante 100'e katarak embriyoları yumurta suyuyla üç kez yıkayın.
- Üçüncü ve son yıkama 0.3x Danieau'nun çözümü ile.
NOT: Embriyolarda yıkandıktan sonra hala korozyon varsa, koronerler çıkarılana kadar embriyoları hafifçe pipetlayın veya bir veya iki dakika boyunca yıkamada (yumurta suyu veya 0,3x Danieau'nun çözeltisi) oturmalarına izin verin ve dairesel hareketlerle hafifçe çalkalayın.
- Dekonsiyone embriyoları petri kabı kapağı ile örtün ve 256 hücreli aşamaya ulaşana kadar inkübatöre (28,5 °C) geri verin.
4 Kesilmiş eksplantlar
- Agarose kaplı 60 mm x 15 mm Petri kabını 3x Danieau çözeltisi ile doldurun.
- Embriyolar 256 hücreli aşamaya geçtikten sonra, onları 3x Danieau çözeltisi içeren agarose kaplı plakaya aktarın ve yemeğin merkezi boyunca sıralayın.
- Dış gezegenleri kümesleri kullanarak kesin (Şekil 1).
- Embriyoyu stabilize etmek için kapalı tutulan bir çift forseps kullanın ve diğerini blastodermi yüksekliğinin yaklaşık yarısında kesmek için kullanın (marjdan hayvan direğine) (Şekil 1A).
- Kesmek için, blastoderm hücrelerini bir çift önseziyle hafifçe sıkın. Daha sonra, stabilize edici torplapları alın ve blastoderm boyunca yaklaşık olarak yarıya kadar dilimlemek için diğer kümesler boyunca çalıştırın (Şekil 1B).
- Embriyoyu döndürün, tostu mevcut kesime yerleştirin ve kalan blastoderm ortogonalini ilk kesime kesin (Şekil 1C).
- Eksplantları iyileştirmek için 3x Danieau'nun çözeltisinde en az 5 dakika tutun, ardından agarose ile kaplanmış ve 4 mL explant ortamla doldurulmuş 6 kuyu plakasının kuyusuna aktarın.
NOT: Negatif kontroller olarak, eksplantları, eklenmemiş (veya denetim eklenmiş) eşdüzeylerden kesin. Eksplantlar doğru yapılırsa, bu eksplantlar endoderm, mezoderm veya nöroektoderm belirteçlerini ne genişletir ne de ifade eder. - Explant kültür plakalarını istenen zaman dilimine/aşamaya (sağlam kardeşlerden belirlenen) ulaşılana kadar 28,5 °C inkübatöre yerleştirin.
NOT: Eksplantların küçük bir molekül inhibitörü gibi bir bileşikle tedavi edilmesi durumunda, istenen konsantrasyon, istenen zaman noktalarında kuyuların içindeki eksplant ortama doğrudan eklenebilir. Konsantrasyonları hesaplarken agarose hacmini dahil etmeyi unutmayın. (Örnek: 1 mL agarose + 4 mL eksiz ortam = kuyu başına toplam hacim 5 mL).
5 Kimerik eksplantlar hazırlayın
- Normal bir agarose kaplı plaka yerine, 1 mm cam boncuk kullanarak on iki küçük, sığ kuyuya kalıplanmış agarose ile bir tabakta kimerik eksplantları kesin (bölüm 1.2.4). Bu tabağı 3x Danieau'nun çözeltisiyle doldurun.
NOT: Kimerik eksplantlar, farklı genotip veya koşullardaki iki embriyonun blastoderm hücrelerinden üretilir. Transgenik veya enjekte edilmiş floresan belirteçlerin ifadesiyle bu koşulların birbirinden ayırt edilebildiğinden emin olun.- Plakanın sol tarafına bir genotip/durumdaki on iki embriyoyu, diğer genotip/durumun on iki embriyosunu plakanın sağ tarafına ekleyerek hazırlayın.
- Her durumdan bir embriyoyu plakanın ortasına, 12 kuyudan birinin yakınına taşıyın.
- Forseps kullanarak, tek embriyo eksplantları için açıklandığı gibi her embriyodan bir eksplant kesin (adım 4.3).
- İki yarının tek bir eksplant halinde birlikte iyileşmesini sağlamak için iki dışlayıcının kesilmiş kenarlarını sığ kuyuda hızlı bir şekilde bastırın.
- Tabakta kalan on bir kuyu ile devam edin. Eksplantlar iyileştikten sonra, onları agarose ile kaplanmış ve 4 mL eksiz ortamla doldurulmuş 6 kuyulu bir plakanın kuyusuna aktarın. İstenilen sayıda eksplant elde edilene kadar tekrarlayın.
6 Sabit eksplantları kültür ve/veya görüntü
- Sağlam kardeş embriyoları istenen aşamaya gelene kadar kültür 28,5 °C inkübatörde eksplante eder.
- Canlı eksplantlar sürekli zaman atlamalı görüntüleme için monte edilebilir, kültür dönemi boyunca periyodik olarak görüntülenebilir veya deneysel uç noktada canlı olarak görüntülenebilir.
- İsterseniz eksplantları düzeltin. Eksplantlar istenen uç noktaya ulaştığında, sağlam embriyo kardeşlerin aşamasını not edin ve eksplantları PBS'de% 4 paraformaldehitin 1 mL'si olan bir cam scintillation şişesine yerleştirin. 4 °C'de bir çalkalayıcıya gece boyunca sabitlayın.
DİkKAT: Paraformaldehit toksiktir. Bu kimyasalı kullanırken eldiven giyin ve her kurum tarafından onaylanan yöntemlerle atın.- Fiksasyondan sonra, her biri PBS + % 0.1 Ara-20 ile altı kez, 15 dakika durulayın ve yavaş yavaş metanol içine susuz kalın. Eksplantları -20 °C'de saklayın ve daha sonra tüm montaj in situ hibridizasyonu, immünofluoresan boyama vb.
Sonuçlar
Nodal ligandlar mikrop tabakası oluşumunu ve zebra balığı blastoderm eksplantlarının C&E'lerini yönlendirir
50 pg mRNA kodlama yeşil floresan protein (GFP) ile enjekte edilenler veya bozulmamış vahşi tip (WT) embriyolardan kesilen kontrol eksplantları kültür dönemi boyunca yuvarlanmış olarak kalmıştır (Şekil 2A-C) ve mezoderm, endoderm veya nöroektoderm belirteçlerini ifade edememiştir ( Şekil3C)20. Bunlar birlikte, omurgalı gastrülasyonu karakterize eden morfogenez ve mikrop tabakası oluşumunun yokluğunu gösterir. Bununla birlikte, 10 pg ndr2 mRNA enjekte edilen embriyolardan kesilen eksplantlar kültürde 8-9 saat sonra oldukça uzadı(Şekil 2D). Bu eksplantların diferansiyel müdahale kontrastı (DIC) mikroskopisi ile canlı zaman atlamalı görüntülenmesi, C&E morfogenezinin bozulmamış zebra balığı embriyolarında başladığı zaman olan 8 saat sonrası döllenme (hpf)(Şekil 2F)veya civarında uzatma başlangıçları olduğunu ortaya koydu22. Temel tdgf1 Nodal ko-reseptör23'tenyoksun olan MZoep-/- embriyolarından kesilen eksplantlar, ndr2 enjeksiyonuna yanıt olarak uzatılamadı (Şekil 2E), Nodal aktivitesinin bu ex vivo morfogenez için kritik olduğunu gösterdi. Ek olarak, tam montajlı in situ hibridizasyon ayrıca ndr2-ekspresyonunun nöroektoderm(sox2)ve birkaç mezoderm alt tipinin(tbxta, noto, tbx16) (Şekil 2G) yanı sıra endoderm ve embriyonik organizatör20ekspres belirteçlerini gösterdiğini göstermiştir.
Mezoderm tarafından nöroektoderm indüksiyonu için nodal sinyal gereklidir
Nodal sinyal aktivitesi endoderm ve çoğu mezoderm indüksiyonu için gereklidir, ancak zebra balığı gastrulae23,24içinde nöroektoderm spesifikasyonu için dağıtılabilir. Uninjected zebrafish blastoderm explants nöroektoderm içine ayrımz iken (Şekil 3C18 ), 10pg ndr2 enjekte embriyolardan eksplant explant uzun eksen boyunca farklı çizgilerde nöroektoderm belirteç sox2 sağlam ifade sergiledi (Şekil 2G), nöroektoderm oluşumu için Nodal aktivite gerekli olduğunu gösteren explantex Mezodermal dokuların nöral doku25 , 26 , 27,28,29, zebra balığı blastoderm eksplantları dahil olmak üzere17. Bununla birlikte, bu eksplant sistemindeki nöroektoderm oluşumunun doğrudan Nodal sinyali gerektirip gerektirmediği veya ekzojen Nodal ligandların daha sonra ikinci olarak sinir dokularını indükleyen mezodermi indükleyip indüklemediği belirsizdir.
İki farklı embriyodan prospektif mezoderm ve nöroektoderm bölümleri içeren chimeric eksplantlar, Nodal sinyalinin nöroektoderm spesifikasyonu ex vivoiçin doku-otonom olarak gerekli olup olmadığını test etmek için oluşturulmuştır. Her eksplantın mezoderm kısmı, mezoderm spesifik transgenik GFP muhabiri, Tg[lhx1a:eGFP] 30 , yüksek dozda(100pg) ndr2 (Şekil 3A)enjekte edilen bir WT embriyosundan kesilmiştir. Her eksplantın putatif nöroektoderm kısmı, sadece floresan nükleer işaretleyici H2B-RFP kodlayan mRNA ile enjekte edilen bir kontrol WT embriyosundan veya Nodal sinyal eksikliği olan MZoep-/- embriyodan kesilmiştir (Şekil 3A). Her kimerik eksplant, 12 hpf'de tam montajlı in situ hibridizasyon ile dokuya özgü belirteçlerin ekspresyonu için test edilen bu iki koşulun her birinden bir blastoderm birleştirilerek oluşturulmuştu.
100 pg ndr2 enjekte edilen embriyolardan elde edilen tek embriyolu eksplantların çoğunluğu çok az veya hiç sox2ifade etti ve tbxta ve lhx1a:gfp reporter-through the explant (Şekil 3B, G)dahil olmak üzere mezoderm belirteçlerini ifade etti. Uninjected WT blastoderm (kimerik eksplantların prospektif nöroektoderm kısmını oluşturan tipte), tek bir eksplant olarak kültürlendiğinde ne mezoderm belirteçlerini ne de sox2'yi ifade etti, nöroektoderm ve mezoderm spesifikasyonunun eksikliğini gösterdi (Şekil 3C, H). MZoep-/- embriyolarından tek embriyolu eksplantlar benzer şekilde ndr2 (Şekil 3D)enjekte edildiğinde bile hem nöroektoderm hem de mezoderm belirteçlerinin ifadesinden yoksundu. Bununla birlikte, seçilmemiş WT blastodermleri yüksek dozda Nodal ligandları tarafından indüklenen mezoderm ile birleştirildiğinde, bu kimerik eksplantlar hem mezoderm belirteçlerini hem de sox2'yi sağlam bir şekilde ifade eder (Şekil 3E,I). Bu sonuçlar, daha önce gözlemlendiği gibi17,26,27,29, mezoderm'in hücrelerde sinirsel kaderi indükleyebileceğini göstermektedir. Nodal sinyalizasyonun nöral indüksiyonları için bu eksplantların prospektif nöroektoderm bölümünde doğrudan gerekli olup olmadığını test etmek için, 100 pg ndr2 enjekte edilen WT blastoderms ve MZoep-/- embriyolarından blastoderms ile chimeric eksplantlar oluşturulmuştur (Şekil 3J). Komşu mezodermal kısımdan Nodal sinyalleri alamamalarına rağmen, bu eksplantlar sox2'yi WT kontrol chimeras(Şekil 3F)ile benzer bir dereceye kadar ifade ettiler. Bu sonuç, Nodal aktivitesinin yokluğunda sinir dokularının belirtildiği bozulmamış embriyolarla tutarlı olduğunu göstermektedir, Nodal sinyali nöroektoderm indüksiyon ex vivoiçin doku-otonom olarak gerekli değildir.
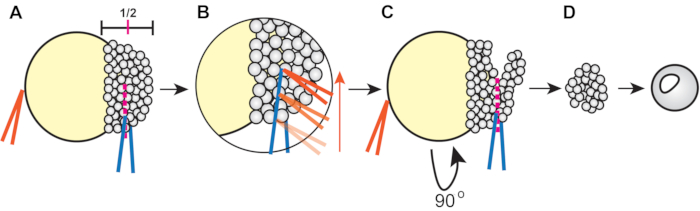
Şekil 1: Zebra balığı blastoderm eksplantasyonu prosedürü (adım 4.3). (A) Baskın olmayan eldeki forsepsleri tutun (turuncu) baskın eldeki forsepsleri (mavi) kullanarak blastoderm'i yüksekliğinin yaklaşık 1/2'sinde sıkıştırırken embriyoyu stabilize etmek için yumurta sarısına karşı kapatın. (B) İlk kesimin blastoderm boyunca yaklaşık olarak yarıya ulaşması için embriyoyu dilimleyen mavi torplasın kenarı boyunca turuncu torplatı çalıştırın. (C) Embriyoyu 90° döndürün, ardından mavi torptoları orijinal kesimin içine (ancak ortogonal) yerleştirin ve kalan blastoderm'i kesmek için kıstırın. (D) Eksiz ortama aktarmadan önce eksizyonlu blastoderm hücrelerinin 3x Danieau'nun çözeltisinde yaklaşık 5 dakika iyileşmesine izin verin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
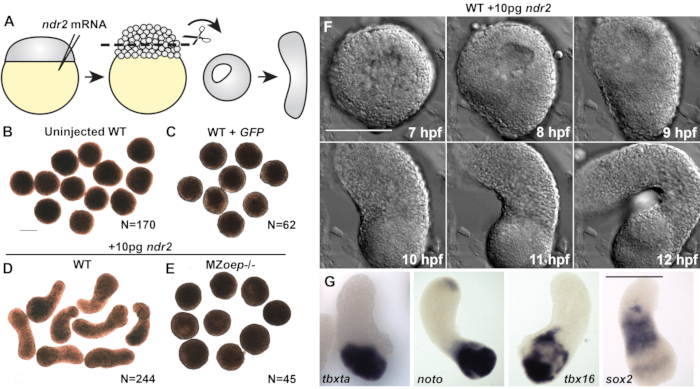
Şekil 2 (20'denmodifiye edilmiş): Nodal ligandlar zebra balığı blastoderm eksplantlarında C&E morfogenezini ve mikrop tabakası oluşumunu teşvik eder. (A) Zebra balığı embriyolarının enjeksiyon ve eksplantasyon şeması. (B-E) 2-4 somit aşamasında belirtilen koşulların/ genotiplerin canlı blastoderm eksplantlarının temsili parlak alan görüntüleri. N = iki ila dört bağımsız denemeden explant sayısı. (F) 10 pg ndr2 RNA enjekte edilen bir WT embriyosundan eklenen bir temsilcinin zaman atlamalı DIC serisi. (G) 10 pg ndr2 RNA ile enjekte edilen WT embriyolarından elde edilen eksplantlarda belirtilen transkriptler için tüm montajlı in situ hibridizasyonun temsili görüntüleri. Ölçek çubukları 200 μm'dir. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
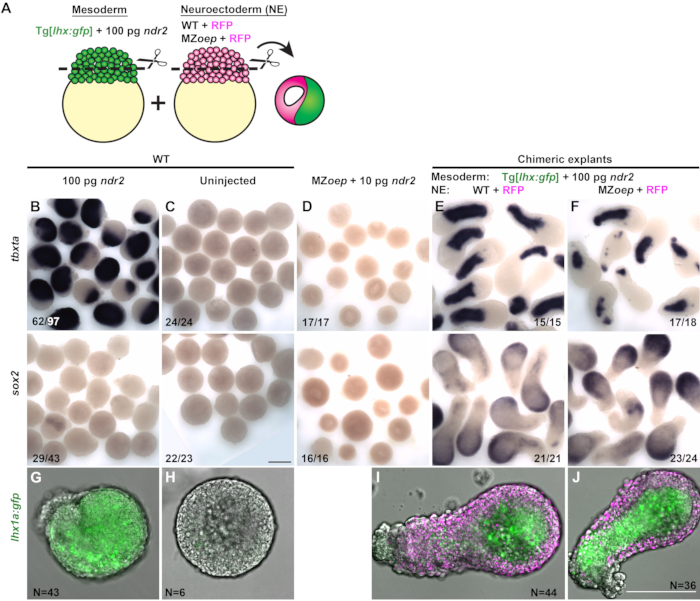
Şekil 3 (31'denmodifiye ): Kimerik eksplantlar, nöroektoderm spesifikasyonunun doku-otonom Nodal sinyal ex vivogerektirmediğini ortaya koymaktadır. (A) Kimerik zebra balığı eksplantları oluşturmak için prosedürün şeması. (B-F) 100 pg ndr2 RNA (B), uninj enjekte edilen WT embriyolarından eksplantlarda mezoderm belirteç tbxta (üst) ve nöroektoderm belirteç sox2 (alt) için tam montajlı in situ hibridizasyon 10 pg ndr2 (D) ile enjekte edilen WT kontrolleri (C), MZoep-/- ve WT (E) veya MZoep-/- (F ) nöroektoderm kısımlarını içeren kimerik eksplantlar ) embriyolar 2-4 somit evreye eşdeğerdir. Kesirler, incelenen toplam eksplant sayısı üzerinde gösterilen fenotipli eksplant sayısını gösterir. (G-J) Canlı Tg temsili görüntüler[lhx1a:gfp] tek bir embriyodan (G-H) veya 2-4 somit aşamasına eşdeğer olarak belirtilen koşulların H2B ifade eden blastodermleri (I-J, macenta) ile birleştirilir. N = üç bağımsız denemeden elde edilen eksplant sayısı. Ölçek çubukları 200 μm'dir. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Çözüm 1 | Çözüm 2 | Çözüm 3 | Çözüm 4 | |
| Çözüm | 3x Danieau'nun | Yumurta Suyu | Explant Medya | 0.3x Danieau's |
| Malzemeler | 174 mM NaCl | 60 μg/mL deniz tuzu | DMEM/F12 + 2,5 mM L-Glutamin ve 15 mM HEPES | 17,4 mM NaCl |
| 2,1 mM KCl | 1 L damıtılmış su | Yenidoğan Buzağı Serumu veya Fetal Sığır Serumunun toplam hacmi %3 | 0,21 mM KCl | |
| 1.2 mM MgSO4. 7H2O | 1:200 Penisilin (50 birim/mL)-Streptomisiin (50 μg/mL) | 0,12 mM MgSO4•7H2O | ||
| 1,8 mM Ca(NO3)2 •4H2O | 0,18 mM Ca(NO3)2 •4H2O | |||
| 15 mM HEPES | Örnek: | 1,5 mM HEPES | ||
| Damıtılmış su | 4 mL/koşul x 9 Koşullar = 36 mL | Damıtılmış su | ||
| 1.08 mL Yenidoğan Baldır Serumu (NCS, -20 °C'de aliquoted (%3) | ||||
| 0,18 mL 200x Pen-Strep (PS, -20 °C'de aliquoted) (1:200) | ||||
| 35 mL DMEM/F12 |
Tablo 1.
Tartışmalar
Bu makalede zebra balığı blastoderm eksplantlarının nasıl üretilacağı açıklanmıştır ve gaztrülasyonda Nodal morfojen sinyalinin rolünü ele almada bu eksplantların iki pratik uygulaması tartışılmıştır. Eksplantları kesme ve kültleme yöntemi, moleküler bir ilgi yolunu araştırmak için RNA enjeksiyonları ve küçük molekül bileşikleri ile tedavi kullanılarak manipüle edilebilen boş bir naif hücre kayrak sağlar.
Kritik adımlar
Bu protokolde başarısı için özellikle kritik olan dört adım vardır. Birincisi embriyolara uygun miktarda Nodal enjekte etmektir. Bu protokol 10 pg ndr2 RNA önerir ve bir dizi doz uzatmayı teşvik etse de, çok fazla veya çok az Nodal optimal eksplant uzantısını önleyecektir20. İkinci adım embriyoları arındırmadır. Embriyolar çok uzun süre pronazda kalırsa, yumurta sarısı patlar ve embriyoların kesilmesi uygun olmaz. Pronazda yeterince uzun süre değillerse, korozyonlar yıkanarak gevşetilmez ve bunun yerine zaman alıcı manuel kaynatma gerektirir. Üçüncü kritik adım eksplantları kesmektir. 0,3x Danieau çözeltisinin veya yumurta suyunun alt tuz içeriği eksplantların iyileşmesini ve hayatta kalmasını desteklemediği için 3x Danieau'nun çözeltisinin kesilmesi önerilir.
Ek olarak, hücrelerin naifliğini sağlamak için eksplantlar blastoderm yüksekliğinin yaklaşık yarısında kesilmelidir. Yumurta sarısına çok yakın kesilirse, kenar boşluğundan (endojen Nodal dahil) doku spesifikasyonunu ve morfogenezini destekleyen sinyaller içerirler. Dördüncü ve son kritik adım kimerik eksplantların iyileşmesindedir. İki eksplant, kesildikten hemen sonra kesilmiş kenarları hafifçe bastırılmadıkça chimeras oluşturmak için kaynaşmayacaktır.
Değişiklikler ve sorun giderme
Yukarıda açıklanan kritik adımlar sorun giderme için fırsatlar sağlar. Bazı yaygın sorunlar ve önerilen çözümler aşağıda sunulmuştur.
Nodal sinyalizasyon varlığında eksplantlar uzuyorsa, bazı olası çözümler vardır. (A) RNA'nın tüm embriyo boyunca eşit olarak dağılmasını sağlamak için embriyoları tek hücreli aşamada enjekte edin. (B) Enjeksiyon bolus ölçmek için bir mikrometre kullanarak enjekte edilen hacmin doğru olduğundan emin olarak çok fazla nodal RNA enjekte etmekten kaçının. (C) Bozulmamasını sağlamak için konsantrasyonunu ölçerek çok az nodal RNA enjekte etmekten kaçının. (D) Eksplantların eşdeğer aşamasını çıkarmak için bazı yaş uyumlu sağlam kardeşleri tutun. Explants, sağlam kardeşler 2-5 somit aşamasına ulaştığında maksimum uzatma elde eder. Eksplantlar çok erken toplanırsa, en uygun uzantıya ulaşılamaz.
Yumurta sarısı kaynatma sonrası patlıyorsa ve embriyolar kesilmeye uygun değilse, korozyonlar kırışmaya başladığında ve 1-2 embriyo koroyonlarını döktükten sonra embriyoları pronaz çözeltisinden çıkarın. Daha sonra hemen yumurta suyunda durulayın.
Eksplantlar kenarların etrafında kabarcıklı görünüyorsa, bazı çözümler vardır. (A) Sadece belirli bir geliştirme süresi içinde eksplantları kesin. 128 ila 1000 hücreli aşamaların herhangi bir aşamasında kesilen eksplantlar hayatta kalabilir ve kültürde uzayabilir, ancak 256 ila 512 hücreli aşamalarda kesilenler en sağlam olma eğilimindedir. (B) Uygun iyileşmeyi sağlamak için eksplantların 3x Danieau'nun çözeltisinde kesildiğini sağlayın. (C) Eksplantları temiz ama nazikçe kesin. Kesme işlemi sırasında hücreleri germekten veya ayırmaktan kaçının.
Genişletilmemiş kontrol eksplantları genişliyorsa, eksplantların yumurta sarısına çok yakın kesilmesi muhtemeldir. Eksplantların naif olması için, kesiklerin yumurta sarısı ile blastoderm'in tepesi arasında yarıya kadar yapıldığından emin olun.
Kimerik eksplantlar kaynaşmazsa, bunun nedeni, kesildikten sonra 3x Danieau'nun çözeltislerindeki eksplantların eğiliminin kesme kenarı üzerinde yuvarlanması ve iyileşmesidir. İki blastoderm'in kendilerinden çok birbirlerine iyileşmesini sağlamak için, kestikten hemen sonra birbirine bastırın. Birlikte iyileşmelerini teşvik etmek için agarose kuyusu içinde yeni katılan blastodermlere hafif basınç uygulamak için torper kullanın.
Sınırlama
Bu eksplantlar, belirli bir morfonun (veya başka bir ilgi molekülünün) göreceli izolasyondaki rolünü incelemek için değerli bir araç olsa da, herhangi bir ex vivo modelde yapılan gözlemler dikkatle yorumlanmalıdır. Eksplantlar, in vivo20'degözlemlenene çok benzeyen C&E morfogenezini sergiler, ancak gastrülasyonun tüm yönlerini, örneğin epiboly hareketlerini yeniden yakalamaz. Ayrıca, bozulmamış bir embriyoda bulunan diğer birçok düzenleyici faktörden ve sinyal moleküllerinden yoksundurlar. Bu eksplantların önemli bir deneysel avantajı olsa da, in vivotutmayan sonuçlara da yol açabilir. Örneğin, eksojen Nodal ligand almayan eksplantlar nöroektoderm belirteçlerini ifade edemediğinden, sadece eksplantlardan nöroektoderm spesifikasyonu için Nodal sinyalinin gerekli olduğu sonucuna varılamayabilir. Bununla birlikte, nöroektoderm, tüm Nodal sinyal23,24,diğer sinyal moleküllerinin nöral spesifikasyon32'dekihayati rolünü gösteren bozulmamış embriyolar içinde oluşur. Explants bize izole bir ortamda morfonun neler yapabileceğini söyleyebilir. Yine de, sonuçların iyice yorumlanması için tüm bu bulgular bozulmamış embriyolarda doğrulanmalıdır/karşılaştırılmalıdır. Başka bir deyişle, explants gelişmekte olan bir embriyonun yerini alamaz. Bunun yerine, bir morfonun çevreyle rolünü ve ilişkisini tanımlamak için tamamlayıcı bir araçtır. Bu sınırlamaları göz önünde bulundurarak, zebra balığı blastoderm eksplantları birçok araştırma sorusu için değerli bir araçtır.
Mevcut yöntemlere göre önemi
Sentetik embriyolojiye olan ilginin yenilenmesiyle, embriyonik gelişimin yönlerini modellemek için düzenli olarak çeşitli ex vivo ve in vitro yaklaşımlar sunulur. Örneğin, 2 ve 3 boyutlu gastruloidler, fare veya insan embriyonik / indüklenmiş pluripotent kök hücrelerden oluşan koaksiyel, eksojen sinyal moleküllerinin uygulanması yoluyla, gastrülasyon, segmentasyon ve nörolojinin bazı kalıplama ve/ veya morfogenetik olaylarının bir kısmını yeniden yakalamak için koaksiye edilebilir33,34,35,36,37 . Güçlü olmasına rağmen, bu yöntemler hem pluripotent kök hücreleri sürekli olarak korumak hem de gastrülasyon aşamalarına ulaşmak günler süren gastruloidleri yetiştirmek için zahmetli ve uzun süreli kültür yöntemleri gerektirir. Bunun aksine, zebra balığı eksplantları kök hücre kültürlerinin korunmasını gerektirmez, çünkü embriyolar gerektiğinde basitçe toplanır. Zebra balığı embriyoları ile aynı şekilde, birkaç saat içinde gaztrülasyon aşamalarını oluşturmak ve ulaşmak nispeten basittir. Bu, zebra balığı eksplantlarının bir başka avantajını, bozulmamış gelişim saatlerini vurgulamaktadır. Embriyonik ve indüklenmiş pluripotent kök hücrelerin gelişim yaşı değişken ve çok tartışılabilir olduğundan, embriyonik eksplantlar gelişimin zamansal düzenlemesini araştırmak için belki de daha uygundur. Son olarak, pescoid zebra balığı eksplantları (embriyonik marjı içeren) benzer şekilde kültür12,13, endojen sinyal merkezlerine yanıt olarak bunu yaparlar. Bunun yerine, burada açıklanan eksplantlar, araştırmacıların bu tür embriyonik sinyallerden nispeten az parazitle ilgi moleküllerini araştırmalarını sağlar.
Gelecekteki olası uygulamalar
Burada, Nodal sinyalinin C&E morfogenez için gerekli ve yeterli olduğunu göstermek için eksplantlar kullanıldı. Yine de, gen ekspresyonunun düzenlenmesi, sinyal gradyanları ve ek morfogenetik programlar gibi diğer birçok gelişimsel işlemde birçok farklı molekülün rolünü ayırt etmek için kullanılabileceği ve kullanılacağı öngörülmektedir. Ek olarak, bu eksplantlar en az 24 hpf19'a kadar uygulanabilir olduğundan, yardımcı programlarının gastrülasyonun ötesine, araştırmacıların gelişimsel boş bir sayfa istediği herhangi bir süreç olan segmentasyon ve organogenez gibi süreçlere uzanması beklenebilir.
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışma NICHD R00HD091386 tarafından MLKW'ye ve NIEHS T32ES027801 tarafından AAE'ye desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mm glass beads | Millipore-Sigma | Z250473 | |
| 4% Paraformaldehyde | VWR | J19943-K2 | |
| 6-well plates | Fisher | FB012927 | |
| Agarose | Thermo-Fisher | 16500500 | |
| Ca(NO3)2 .4H2O | Thermo-Fisher | 12364-36 | |
| DMEM/F12 media | Gibco | 11330032 | |
| Dumont #5 watchmakers forceps | World Precision Instruments | 500341 | |
| Embryo injection mold | Adaptive Science Tools | I-34 | |
| Glass crystalizing dishes | Fisher | 08-741A | |
| Glass Petri dishes | Fisher | 08-748A | |
| HEPES | VWR | JT4018-1 | |
| Instant Ocean sea salts | Instant Ocean | SS15-10 | |
| KCl | VWR | BDH9258-500G | |
| Low temperature incubator | Fisher | 15-015-2632 | |
| MgSO4.7H2O | VWR | 97062-134 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | M3301R | |
| Micrometer | SPI supplies | 02265-AB | |
| Mineral oil | VWR | MK635704 | |
| NaCl | VWR | BDH9286-500G | |
| Newborn Calf Serum | Invitrogen | 26010-066 | |
| Pasteur pipettes | Fisher | 13-678-30 | |
| Penicillin-Streptomycin Solution | Thermo-Fisher | 15140122 | |
| Pico-pump pneumatic injector | World Precision Instruments | SYS-PV820 | |
| Pipet pump | Fisher | 13 683C | |
| Plastic Petri dishes 100 mm | Fisher | FB0875712 | |
| Plastic Petri dishes 60 mm | Fisher | FB0875713A | |
| Plastic wash bottles | Fisher | 03-409-10E | |
| Pronase | Millipore-Sigma | 10165921001 | |
| Tween-20 | VWR | 200002-836 |
Referanslar
- Green, J. B., New, H. V., Smith, J. C. Responses of embryonic Xenopus cells to activin and FGF are separated by multiple dose thresholds and correspond to distinct axes of the mesoderm. Cell. 71 (5), 731-739 (1992).
- Sudarwati, S., Nieuwkoop, P. D. Mesoderm formation in the anuranXenopus laevis (Daudin). Wilhelm Roux Archiv fur Entwicklungsmechanik der Organismen. 166 (3), 189-204 (1971).
- Gurdon, J. B., Fairman, S., Mohun, T. J., Brennan, S. Activation of muscle-specific actin genes in Xenopus development by an induction between animal and vegetal cells of a blastula. Cell. 41 (3), 913-922 (1985).
- Keller, R., Danilchik, M. Regional expression, pattern and timing of convergence and extension during gastrulation of Xenopus laevis. Development. 103 (1), 193-209 (1988).
- Ariizumi, T., et al. Isolation and differentiation of Xenopus animal cap cells. Current Protocols in Stem Cell Biology. , (2009).
- Asashima, M., Grunz, H. Effects of inducers on inner and outer gastrula ectoderm layers of Xenopus laevis. Differentiation. 23 (3), 206-212 (1983).
- Jones, E. A., Woodland, H. R. Development of the ectoderm in Xenopus: tissue specification and the role of cell association and division. Cell. 44 (2), 345-355 (1986).
- Keller, R. E. Vital dye mapping of the gastrula and neurula of Xenopus laevis. I. Prospective areas and morphogenetic movements of the superficial layer. Developmental Biology. 42 (2), 222-241 (1975).
- Sokol, S., Wong, G. G., Melton, D. A. A mouse macrophage factor induces head structures and organizes a body axis in Xenopus. Science. 249 (4968), 561-564 (1990).
- Thomsen, G., et al. Activins are expressed early in Xenopus embryogenesis and can induce axial mesoderm and anterior structures. Cell. 63 (3), 485-493 (1990).
- Howard, J. E., Smith, J. C. Analysis of gastrulation: different types of gastrulation movement are induced by different mesoderm-inducing factors in Xenopus laevis. Mechanisms of Development. 43 (1), 37-48 (1993).
- Fulton, T., et al. Axis specification in Zebrafish is robust to cell mixing and reveals a regulation of pattern formation by morphogenesis. Current Biology. 30 (15), 3063-3064 (2020).
- Schauer, A., Pinheiro, D., Hauschild, R., Heisenberg, C. -. P. Zebrafish embryonic explants undergo genetically encoded self-assembly. eLife. , 55190 (2020).
- Oppenheimer, J. M. The development of isolated blastoderms of Fundulus heteroclitus. The Journal of Experimental Zoology. 72 (2), 247-269 (1936).
- Trinkaus, J. P., Drake, J. W. Exogenous control of morphogenesis in isolated Fundulus blastoderms by nutrient chemical factors. The Journal of Experimental Zoology. 132 (2), 311-347 (1956).
- Grinblat, Y., Lane, M. E., Sagerström, C., Sive, H. Analysis of zebrafish development using explant culture assays. Methods in Cell Biology. 59, 127-156 (1999).
- Sagerström, C. G., Grinblat, Y., Sive, H. Anteroposterior patterning in the zebrafish, Danio rerio: an explant assay reveals inductive and suppressive cell interactions. Development. 122 (6), 1873-1883 (1996).
- Sagerström, C. G., Gammill, L. S., Veale, R., Sive, H. Specification of the enveloping layer and lack of autoneuralization in zebrafish embryonic explants. Devolopmental Dynamics. 232 (1), 85-97 (2005).
- Xu, P. F., Houssin, N., Ferri-Lagneau, K. F., Thisse, B., Thisse, C. Construction of a vertebrate embryo from two opposing morphogen gradients. Science. 344 (6179), 87-89 (2014).
- Williams, M. L. K., Solnica-Krezel, L. Nodal and planar cell polarity signaling cooperate to regulate zebrafish convergence and extension gastrulation movements. eLife. 9, (2020).
- de Olivera-Melo, M., Xu, P. F., Houssin, N., Thisse, B., Thisse, C. Generation of ectopic morphogen gradients in the Zebrafish blastula. Methods in Molecular Biology. 1863, 125-141 (2018).
- Sepich, D. S., Calmelet, C., Kiskowski, M., Solnica-Krezel, L. Initiation of convergence and extension movements of lateral mesoderm during zebrafish gastrulation. Devolopmental Dynamics. 234 (2), 279-292 (2005).
- Gritsman, K., et al. The EGF-CFC protein one-eyed pinhead is essential for nodal signaling. Cell. 97 (1), 121-132 (1999).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Spemann, H., Manngold, H. Uber inducktion von embryoalanlangen durch implantation artfremder organisatoren. Archiv für mikroskopische Anatomie und Entwicklungsmechanik. 100, 599-638 (1924).
- Mangold, O. Über die Induktionsfähigkeit der verschiedenen Bezirke der Neurula von Urodelen. Naturwissenschaften. 21 (43), 761-766 (1933).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Agathon, A., Thisse, C., Thisse, B. The molecular nature of the zebrafish tail organizer. Nature. 424 (6947), 448-452 (2003).
- Tacke, L., Grunz, H. Close juxtaposition between inducing chordamesoderm and reacting neuroectoderm is a prerequisite for neural induction in Xenopus laevis. Cell Death and Differentiation. 24 (1), 33-43 (1988).
- Swanhart, L. M., et al. Characterization of an lhx1a transgenic reporter in zebrafish. The International Journal of Developmental Biology. 54 (4), 731-736 (2010).
- Williams, M. L. K., Solnica-Krezel, L. A mesoderm-independent role for Nodal signaling in convergence & extension gastrulation movements. BioRxiv. , (2019).
- Londin, E. R., Niemiec, J., Sirotkin, H. I. Chordin, FGF signaling, and mesodermal factors cooperate in zebrafish neural induction. Developmental Biology. 279 (1), 1-19 (2005).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Veenvliet, J. V., et al. Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science. 370 (6522), (2020).
- Beccari, L., et al. Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids. Nature. 562 (7726), 272-276 (2018).
- Moris, N., et al. An in vitro model of early anteroposterior organization during human development. Nature. 582 (7812), 410-415 (2020).
- vanden Brink, S. C., et al. Single-cell and spatial transcriptomics reveal somitogenesis in gastruloids. Nature. 582 (7812), 405-409 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır