Method Article
Génération d’explants de blastodermes naïfs à partir d’embryons de poisson zèbre
Dans cet article
Résumé
Les explantes de blastoderme de poisson-zèbre sont générées en isolant des cellules embryonnaires des centres de signalisation endogènes au sein de l’embryon précoce, produisant des amas cellulaires relativement naïfs facilement manipulables et cultivés ex vivo. Cet article fournit des instructions pour la fabrication de telles explants et démontre leur utilité en interrogeant les rôles de la signalisation nodale pendant la gastrulation.
Résumé
En raison de leur clarté optique et de leur développement rapide, les embryons de poisson-zèbre sont un excellent système pour examiner les comportements cellulaires et les processus de développement. Cependant, en raison de la complexité et de la redondance des signaux embryonnaires, il peut être difficile de discerner le rôle complet d’un signal unique au cours de l’embryogenèse précoce. En explantant la région animale du blastoderme du poisson-zèbre, des grappes relativement naïves de cellules embryonnaires sont générées qui peuvent être facilement cultivées et manipulées ex vivo. En introduisant un gène d’intérêt par injection d’ARN avant l’explantation, on peut évaluer l’effet de cette molécule sur l’expression des gènes, les comportements cellulaires et d’autres processus de développement dans un isolement relatif. En outre, les cellules d’embryons de différents génotypes ou conditions peuvent être combinées en une seule explante chimérique pour examiner les interactions cellule/tissu et les fonctions géniques spécifiques aux tissus. Cet article fournit des instructions pour générer des explantes de blastoderme de poisson-zèbre et démontre qu’une seule molécule de signalisation - un ligand nodal - est suffisante pour induire la formation de couche germinale et la morphogenèse d’extension dans des tissus embryonnaires autrement naïfs. En raison de leur capacité à récapituler les comportements des cellules embryonnaires, les gradients morphogènes et les modèles d’expression génique dans un système ex vivo simplifié, ces explants devraient être d’une grande utilité pour de nombreux chercheurs sur le poisson-zèbre.
Introduction
Un objectif permanent du domaine de la biologie du développement est de démêler la complexité du développement des embryons pour comprendre l’origine de la forme et de la fonction animales. Même les embryons précoces contiennent un mélange complexe de molécules de signalisation, d’interactions cellulaires et tissulaires et de forces mécaniques, tous soumis à une régulation spatiale et temporelle stricte. Pour cette raison, il est souvent difficile d’identifier le rôle précis d’un signal particulier dans un processus de développement d’intérêt. En retirant les tissus embryonnaires de leur environnement endogène, l’explantation d’embryons crée une plate-forme simplifiée permettant de discerner les rôles développementaux des tissus et des molécules individuels dans un isolement relatif. Les techniques d’explantation sont peut-être mieux connues dans Xenopus laevis, où elles ont été utilisées pour étudier l’induction tissulaire, la signalisation cellulaire, l’adhésion cellulaire et la morphogenèse, entre autres processus1,2,3,4. Les explants dits de capuchon animal, dans lesquels la région animale des embryons de Xenopus au stade de blastula est isolée avant les interactions inductives5,6,7, sont une technique d’explantation répandue et puissante. Les capuchons d’animaux non manipulés sont destinés à devenir ectodermes7,8. Pourtant, ils sont capables de répondre à plusieurs facteurs inductifs, ce qui leur permet de former des tissus des trois couches germinales et de subir des mouvements morphogénétiques appropriés aux tissus9,10,11. Cependant, des outils génétiques limités et une aptitude sous-optimale à l’imagerie vivante empêchent l’utilisation d’explants de capuchon animal Xenopus pour de nombreux biologistes du développement. En explantant des cellules de blastoderme à partir d’embryons de poisson zèbre, les chercheurs peuvent combiner l’utilité du test de la calotte animale avec la clarté optique, l’abondance d’outils génétiques et d’autres avantages expérimentaux du système modèle du poisson-zèbre.
À ce jour, les chercheurs ont utilisé deux saveurs d’explants de poisson zèbre: les soi-disant pescoïdes et les explants de blastoderme. Dans le modèle pescoïde, l’ensemble du blastoderme, y compris la zone marginale, est isolé du jaune et autorisé à se développer ex vivo sans la couche syncytiale extraembryonnaire du jaune (YSL)12,13. De cette façon, les pescoïdes ont une ressemblance notable avec les explants fundulus générés il y a des décennies par Jane Oppenheimer et J.P. Trinkaus14,15. Ces explantes récapitulent de nombreux aspects du modelage embryonnaire et de la morphogenèse12,13. Cependant, comme ces isolats contiennent des centres de signalisation endogènes (la marge embryonnaire), ils ne sont pas simplifiés en ce qui concerne leur milieu moléculaire. Alternativement, les chercheurs peuvent générer des explants de blastoderme de poisson zèbre relativement naïfs en excluant lazone marginale16,17, 18,19,20,21. Les explants blastodermiques de poisson zèbre non manipulés expriment des niveaux élevés de morphogènes de protéine morphogénétique osseuse (BMP)19 et donnent naissance à un ectoderme non neural et à une couche enveloppante (EVL) lorsqu’ils sont cultivés ex vivo18. Cependant, ils récapitulent de nombreux aspects du modelage axial et de la morphogenèse en réponse à des gradients de signalisation exogènes19,20,21, similaires aux capuchons animaux Xenopus. Pour cette raison, les explantes de blastodermes sont un modèle avantageux pour étudier le rôle d’un morphogène (ou de morphogènes) donné dans la spécification de la couche germinale, les mouvements des cellules morphogénétiques et les gradients de signalisation dans un environnement de signalisation simplifié. En outre, les blastodermes d’embryons de différents génotypes ou conditions peuvent être combinés en une seule explante chimérique19,21 pour étudier l’autonomie cellule/tissu et les interactions inductives.
Les explantes de blastoderme de poisson-zèbre peuvent être utilisées pour étudier le rôle des signaux embryonnaires (par exemple, Nodal) dans la morphogenèse et la spécification tissulaire pendant la gastrulation. En injectant de l’ARN synthétique ndr2 (codant pour un ligand nodal) au stade unicellulaire, la signalisation nodale est activée dans tout le blastoderme de l’embryon. Les explants de ces embryons génèrent des gradients de signalisation nodale, forment les trois couches germinales et subissent des mouvements de gastrulation de convergence et d’extension (C & E) comme on le voit chez les embryons intacts20. De plus, les explantes chimériques sont utilisées pour illustrer la capacité des tissus mésodermiques à induire le neuroectoderme à partir d’un blastoderme nonjecté (naïf). Ce protocole fournit des instructions pour la création d’explants de blastoderme de poisson zèbre et démontre leur utilité dans la définition du rôle de la signalisation nodale dans l’induction tissulaire et la morphogenèse.
Protocole
1 Préparer les réactifs et les fournitures
- Préparation du réactif
- Préparer 500 mL de solution de 3x Danieau (Solution 1, Tableau 1).
- Préparer 1 L d’eau d’œuf (Solution 2, Tableau 1).
- Préparez une solution à 1,2% d’agarose dans de l’eau d’œuf. Faire fondre l’agarose entièrement au micro-ondes, puis refroidir à 55 °C au bain-marie.
- Préparer 4 mL de milieux explants (Solution 3, Tableau 1, légèrement modifié par rapport à19,21) par condition expérimentale.
REMARQUE: N’oubliez pas de tenir compte d’au moins un puits d’explants d’embryons non injectés (ou injectés par contrôle) lors du calcul du volume requis.- Désinfectez l’espace de travail avec 70% d’éthanol.
- Retirer les milieux de culture cellulaire de 4 °C et vaporiser/essuyer avec de l’éthanol à 70 %.
- Faire des milieux d’explantation et placer dans l’incubateur à 28,5 °C pour réchauffer pendant l’injection des embryons.
REMARQUE: Incluez toujours des embryons de frères et sœurs intacts et appariés selon l’âge à des fins de stadification. Déchorionate ces embryons et les culture sur des plaques enduites d’agarose dans 0,3x la solution de Danieau (Solution 4, Tableau 1).
- Retirer les aliquotes de pronase (1 mL à 20 mg/mL) de -20 °C et laisser décongeler sur la glace. Décongeler une aliquote de 1 mL pour trois conditions expérimentales.
- Préparer des assiettes d’agarose
- Faites les plaques d’injection.
- Remplissez une boîte de Petri en plastique de 100 mm x 15 mm à mi-chemin avec de l’agarose fondue dans de l’eau d’œuf.
- Placez doucement le moule d’injection sur le dessus de l’agarose fondue à un angle de 45 ° et abaissez-le progressivement dans l’agarose, en veillant à ce qu’aucune bulle ne soit piégée en dessous. Laissez refroidir complètement.
- Retirez le moule. Utilisez la plaque immédiatement ou conservez-la pour plus tard en ajoutant 2 mL d’eau d’œuf, en enveloppant la plaque et en la stockant à 4 °C. Réchauffer la plaque pendant 15-30 min dans l’incubateur à 28,5 °C avant l’injection.
- Fabriquez des plaques de découpe d’explantation.
- Ajouter 3 mL d’agarose fondue à 1,2 % dans de l’eau d’œuf à une boîte de Petri de 60 mm x 15 mm, en veillant à ce que tout le fond du puits soit enduit. Laissez refroidir complètement.
- Enduire les plaques de culture d’agarose.
- Pour chaque condition expérimentale, distribuer 1 mL d’agarose fondue à 1,2 % dans de l’eau d’œuf dans un puits d’une plaque de 6 puits, en veillant à ce que tout le fond du puits soit revêtu. Laissez refroidir complètement.
- Pour faire des explants chimériques, créez un plat de coupe d’explants avec de petits puits en ajoutant douze perles de verre de 1 mm à l’agarose fondue dans une boîte de Petri de 60 mm x 15 mm. Retirez les perles avec une pince une fois que l’agarose refroidit complètement.
- Faites les plaques d’injection.
2 Injecter des embryons avec de l’ARN
- En portant des gants, retirez une aliquote d’ARNm synthétique ndr2 de l’entreposage à -80 °C et placez-la immédiatement sur la glace.
- Préparez l’aiguille d’injection.
- Remplissez une aiguille capillaire en verre tirée avec de l’ARN. Placez l’aiguille remplie dans un micro-manipulateur et cassez la pointe de l’aiguille avec une pince.
- Calibrer le volume d’injection à l’aide d’un micromètre d’étage avec une goutte d’huile minérale, en ajustant le temps d’injection et la pression sur l’injecteur pneumatique pour obtenir un bolus de la taille souhaitée. Un bolus d’un diamètre de 120 μm a un volume de 1 nL.
REMARQUE: Le volume souhaité du bolus dépendra de la concentration de l’ARN et de la dose souhaitée par embryon. Par exemple, si l’ARN est alicité à 10 ng/μL, injecter 1 nL pour obtenir une quantité finale de 10 pg.- Gardez l’extrémité de l’aiguille à ARN immergée dans l’huile jusqu’à ce qu’elle soit prête à être injectée.
- Chargez les embryons et injectez.
- Tirez les séparateurs dans des bassins de reproduction, laissez les poissons frayer pendant 10 à 15 minutes et collectez les embryons à l’aide d’une passoire à thé.
- Chargez les embryons dans la plaque d’injection à l’aide d’une pipette Pasteur et d’une pompe à pipette, puis utilisez un doigt ganté pour presser doucement les œufs dans les auges.
- Injecter 10 pg ndr2 d’ARN dans le jaune d’embryons unicellulaires jusqu’à ce que le nombre souhaité d’embryons soit atteint ou jusqu’à ce que les embryons commencent à se diviser.
REMARQUE: Ne pas injecter après l’étape unicellulaire pour assurer une distribution uniforme de l’ARN dans tout l’embryon. - Lavez les embryons de la plaque d’injection dans une boîte de Petri étiquetée de 100 mm x 15 mm avec un léger jet d’eau d’œuf provenant d’une bouteille à presser.
REMARQUE: Gardez toujours un groupe de frères et sœurs non affectés appariés à l’âge comme témoins. - Placez les embryons dans l’incubateur à 28,5 °C jusqu’à ce qu’ils atteignent le stade de 128 cellules. Retirez les œufs non fécondés et les embryons morts du plat.
3 Déchorionate les embryons
- Une fois que les embryons ont atteint le stade de 128 cellules, placez-les dans des boîtes de Petri en verre étiquetées et décantez autant d’eau d’œuf que possible.
- Étiquetez les plats cristallisants en verre avec du ruban adhésif de laboratoire (correspondant aux noms de petits plats) et remplissez les 2/3 du chemin avec de l’eau d’œuf. Placez ces plats à côté du microscope à dissection pour une accessibilité rapide.
- Ajouter 1 mL de pronase (20 mg/mL, décongelé sur glace) à 15 mL de solution de 3x Danieau dans un tube conique de 50 mL.
REMARQUE: Cette quantité est suffisante pour un maximum de trois conditions expérimentales. Augmentez le volume de pronase et 3x la solution de Danieau pour des conditions d’explantation supplémentaires.
ATTENTION: La pronase est un irritant; par conséquent, portez des gants lors de la manipulation. - Ajouter au moins 5 mL de solution de pronase à chaque boîte de Petri en verre contenant des embryons.
- Agitez les plats en verre dans un mouvement circulaire, en surveillant la progression de la décchorionation de manière cohérente sous un microscope à dissection.
- Une fois que les chorions commencent à se froisser et que 1-2 embryons sont sortis de leurs chorions, trempez soigneusement la boîte de Petri en verre contenant de la pronase et les embryons dans le plat cristallisant en verre correspondant contenant de l’eau d’œuf.
- Lavez les embryons décchorionés.
- Lavez les embryons trois fois avec de l’eau d’œuf en ajoutant doucement puis en décant l’eau d’œuf du plat.
- Le troisième et dernier lavage est avec 0,3x la solution de Danieau.
REMARQUE: Si les embryons ont encore des chorions après le lavage, pipettez doucement les embryons jusqu’à ce que les chorions soient retirés ou laissez-les reposer dans le lavage (eau d’œuf ou 0,3x la solution de Danieau) pendant une minute ou deux et agitez doucement avec des mouvements circulaires.
- Couvrir les embryons déséchorionés avec un couvercle de boîte de Petri et les renvoyer à l’incubateur (28,5 °C) jusqu’à ce qu’ils atteignent le stade de 256 cellules.
4 Explants coupés
- Remplissez la boîte de Petri de 60 mm x 15 mm revêtue d’agarose avec 3x la solution de Danieau.
- Une fois que les embryons sont au stade de 256 cellules, transférez-les dans la plaque enduite d’agarose contenant 3x la solution de Danieau, en les alignant le long du centre du plat.
- Couper les explants à l’aide de pinces (Figure 1).
- Utilisez une paire de pinces, maintenues fermées, pour stabiliser l’embryon et utilisez l’autre pour couper à travers le blastoderme à environ la moitié de sa hauteur (de la marge au pôle animal) (Figure 1A).
- Pour couper, pressez doucement les cellules du blastoderme avec une paire de pinces. Ensuite, prenez les pinces stabilisatrices et faites-les courir le long des autres pinces pour trancher approximativement à mi-chemin à travers le blastoderme(Figure 1B).
- Faites pivoter l’embryon, en plaçant la pince dans la coupe existante, puis coupez l’orthogonal blastodermique restant à la première coupe(Figure 1C).
- Conservez les explantes dans la solution de 3x Danieau pendant au moins 5 min pour guérir, puis transférez-les dans le puits d’une plaque de 6 puits recouverte d’agarose et remplie de 4 mL de milieu explant.
REMARQUE: Couper les explants de frères et sœurs non injectés (ou injectés par contrôle) comme témoins négatifs. Si les explantations sont effectuées correctement, ces explants n’étendront ni n’exprimeront les marqueurs de l’endoderme, du mésoderme ou du neuroectoderme. - Placez les plaques de culture d’explants dans l’incubateur à 28,5 °C jusqu’à ce que le point temporel/stade souhaité (déterminé à partir de frères et sœurs intacts) soit atteint.
REMARQUE: Si vous traitez des explants avec un composé, tel qu’un inhibiteur de petite molécule, la concentration souhaitée peut être ajoutée directement au milieu d’explantation dans les puits aux moments souhaités. N’oubliez pas d’inclure le volume d’agarose lors du calcul des concentrations. (Exemple : 1 mL d’agarose + 4 mL de milieu explant = 5 mL de volume total par puits).
5 Préparer des explants chimériques
- Au lieu d’une plaque enduite d’agarose ordinaire, couper des explantes chimériques dans un plat avec de l’agarose moulée en douze petits puits peu profonds à l’aide de perles de verre de 1 mm (section 1.2.4). Remplissez cette plaque avec 3x la solution de Danieau.
REMARQUE: Les explantes chimériques sont générées à partir de cellules blastodermiques de deux embryons de génotypes ou de conditions différents. S’assurer que ces conditions peuvent être distinguées les unes des autres par l’expression de marqueurs fluorescents transgéniques ou injectés.- Préparer en ajoutant douze embryons d’un génotype/condition sur le côté gauche de la plaque et douze embryons de l’autre génotype/condition sur le côté droit de la plaque.
- Déplacez un embryon de chaque condition au centre de la plaque, près de l’un des 12 puits.
- À l’aide d’une pince, coupez une explantation de chaque embryon comme décrit pour les explantations d’embryons uniques (étape 4.3).
- Appuyez rapidement sur les bords coupés des deux explants ensemble dans le puits peu profond à l’aide d’une pince pour permettre aux deux moitiés de guérir ensemble en une seule explantation.
- Continuez avec les onze puits restants à l’intérieur de la plaque. Une fois les explantes guéries, transférez-les dans le puits d’une plaque de 6 puits recouverte d’agarose et remplie de 4 mL de milieux d’explants. Répétez l’opération jusqu’à ce que le nombre souhaité d’explants soit atteint.
6 Culture et/ou image des explants fixes
- La culture explante dans l’incubateur à 28,5 °C jusqu’à ce que les embryons frères et sœurs intacts atteignent le stade souhaité.
- Les explants vivants peuvent être montés pour une imagerie time-lapse continue, imagés périodiquement tout au long de la période de culture ou imagés en direct à l’extrémité expérimentale.
- Fixez les explants si vous le souhaitez. Une fois que les explants atteignent le point d’extrémité souhaité, notez le stade des frères et sœurs embryonnaires intacts et placez les explants dans un flacon de scintillation en verre avec 1 mL de paraformaldéhyde à 4% dans le PBS. Fixer toute la nuit sur un agitateur à 4 °C.
ATTENTION : Le paraformaldéhyde est toxique. Portez des gants lorsque vous manipulez ce produit chimique et éliminez-le selon des méthodes approuvées par chaque établissement.- Après fixation, rincer les explantations six fois, 15 min chacune avec PBS + 0,1% Tween-20, et déshydrater progressivement en méthanol. Stocker les explants à -20 °C pour une analyse ultérieure par hybridation in situ en montage entier, coloration immunofluorescente, etc.
Résultats
Les ligands nodaux entraînent la formation de la couche germinale et le C & E des explants de blastoderme du poisson-zèbre
Les explantes témoins coupées à partir d’embryons de type sauvage (WT) non injectés ou celles injectées avec 50 pg d’ARNm codant pour la protéine fluorescente verte (GFP) sont restées arrondies tout au long de la période de culture(Figure 2A-C)et n’ont pas réussi à exprimer les marqueurs du mésoderme, de l’endoderme ou du neuroectoderme(Figure 3C)20. Ensemble, ceux-ci indiquent une absence de morphogenèse et de formation de couche germinale qui caractérisent la gastrulation des vertébrés. Cependant, les explantes coupées à partir d’embryons injectés avec 10 pg d’ARNm ndr2 sont devenues très allongées après 8-9 h en culture (Figure 2D). L’imagerie time-lapse en direct de ces explantes par microscopie à contraste interférent différentiel (DIC) a révélé que l’extension commence à ou autour de 8 h après la fécondation (HPF) (Figure 2F), en même temps que la morphogenèse C & E commence dans les embryons intacts de poisson zèbre22. Les explantes coupées dans des embryons MZoep-/- qui n’ont pas le co-récepteur nodal tdgf1 essentiel23,n’ont pas réussi à s’étendre en réponse à l’injection de ndr2 (Figure 2E),démontrant que l’activité nodale est essentielle pour cette morphogenèse ex vivo. En outre, l’hybridation in situ en montage entier a en outre montré que les explantes exprimant ndr2expriment des marqueurs du neuroectoderme(sox2)et de plusieurs sous-types de mésodermes (tbxta, noto, tbx16) (Figure 2G), ainsi que de l’endoderme et de l’organisateur embryonnaire20.
La signalisation nodale n’est pas nécessaire pour l’induction du neuroectoderme par le mésoderme
L’activité de signalisation nodale est essentielle pour l’induction de l’endoderme et de la plupart des mésodermes, mais est dispensable pour la spécification du neuroectoderme chez les gastrules23,24du poisson-zèbre . Alors que les explantes blastodermiques de poisson zèbre non injectées ne se différenciaient pas en neuroectoderme (Figure 3C18), les explantes d’embryons injectés avec 10 pg ndr2 présentaient une expression robuste du marqueur neuroectoderme sox2 en bandes distinctes le long de l’axe long de l’explante (Figure 2G), indiquant que l’activité nodale est nécessaire à la formation du neuroectoderme ex vivo. On sait depuis longtemps que les tissus mésodermiques peuvent induire des tissus neuronaux25,26,27,28,29, y compris dans les explants blastodermes de poisson zèbre17. Cependant, il n’est pas clair si la formation de neuroectodermes dans ce système d’explantation nécessite une signalisation nodale directe ou si les ligands nodaux exogènes induisent un mésoderme qui induit ensuite secondairement les tissus neuronaux.
Des explants chimériques contenant des portions potentielles de mésoderme et de neuroectoderme provenant de deux embryons différents ont été générées pour tester si la signalisation nodale est nécessaire de manière autonome pour la spécification du neuroectoderme ex vivo. La partie mésodermique de chaque explante a été découpée à partir d’un embryon autrement WT exprimant un rapporteur GFP transgénique spécifique au mésoderme, Tg[lhx1a:eGFP]30, injecté avec une dose élevée (100 pg) de ndr2 (Figure 3A). La partie putative du neuroectoderme de chaque explante a été découpée à partir d’un embryon WT témoin ou d’un embryon MZ déficient en signalisation nodaleoep-/- injecté uniquement avec de l’ARNm codant pour le marqueur nucléaire fluorescent H2B-RFP(Figure 3A). Chaque explante chimérique a été générée en combinant un blastoderme de chacune de ces deux conditions, qui ont été dosés pour l’expression de marqueurs spécifiques aux tissus par hybridation in situ à montage entier à 12 hpf.
La majorité des explantations mono-embryonnaires provenant d’embryons injectés avec 100 pg ndr2 exprimaient peu ou pas de sox2,et exprimaient des marqueurs du mésoderme, y compris tbxta et le rapporteur lhx1a:gfp - dans tout l’explante (Figure 3B, G). Le blastoderme WT non injecté (du type qui comprend la partie neuroectodermique potentielle des explantes chimériques) n’a exprimé ni marqueurs mésodermiques ni sox2 lorsqu’il est cultivé comme une seule explante, ce qui indique un manque de spécifications de neuroectoderme et de mésoderme(Figure 3C,H). Les explantations d’embryons uniques de MZoep-/- embryons manquaient également d’expression des marqueurs du neuroectoderme et du mésoderme, même lorsqu’ils s’injectaient du ndr2 (Figure 3D). Cependant, lorsque des blastodermes WT non injectés ont été combinés avec des mésodermes induits par de fortes doses de ligands nodaux, ces explantes chimériques ont exprimé à la fois les marqueurs mésodermiques et sox2 de manière robuste(Figure 3E,I). Ces résultats démontrent que, comme observé précédemment17,26,27,29, le mésoderme peut induire un destin neuronal dans des cellules qui deviendraient autrement un ectoderme non neural. Pour tester si la signalisation nodale est nécessaire directement dans la partie neuroectodermique potentielle de ces explants pour leur induction neurale, des explantes chimériques ont été créées à partir de blastodermes WT injectés avec 100 pg ndr2 et de blastodermes à partird’embryonsMZ oep -/- (Figure 3J). Malgré leur incapacité à recevoir les signaux nodaux de la partie mésodermique voisine, ces explantes ex-exprimant sox2 à un degré similaire à celui des chimères de contrôle WT(Figure 3F). Ce résultat démontre que, conformément aux embryons intacts dans lesquels des tissus neuronaux sont spécifiés en l’absence d’activité nodale, la signalisation nodale n’est pas nécessaire de manière autonome pour l’induction du neuroectoderme ex vivo.
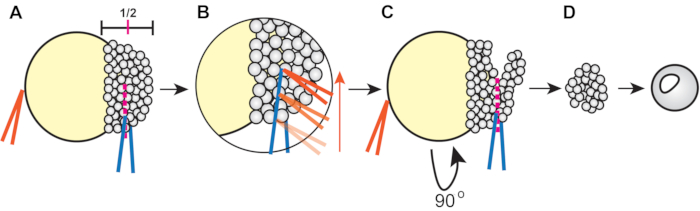
Figure 1: Procédure d’explantation du blastoderme du poisson-zèbre (étape 4.3). (A) Tenez la pince dans la main non dominante (orange) fermée contre le jaune pour stabiliser l’embryon tout en pinçant le blastoderme à environ 1/2 de sa hauteur à l’aide de la pince dans la main dominante (bleu). (B) Faites passer les pinces orange le long du bord des pinces bleues en saisissant l’embryon pour trancher à travers le blastoderme de sorte que la première coupure atteigne environ la moitié du blastoderme. (C) Faites pivoter l’embryon de 90°, puis placez la pince bleue à l’intérieur (mais orthogonale à) de la coupe d’origine et pincez pour couper le blastoderme restant. (D) Laisser les cellules blastodermiques explantées guérir dans 3x la solution de Danieau pendant environ 5 min avant de les transférer dans un milieu explantique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
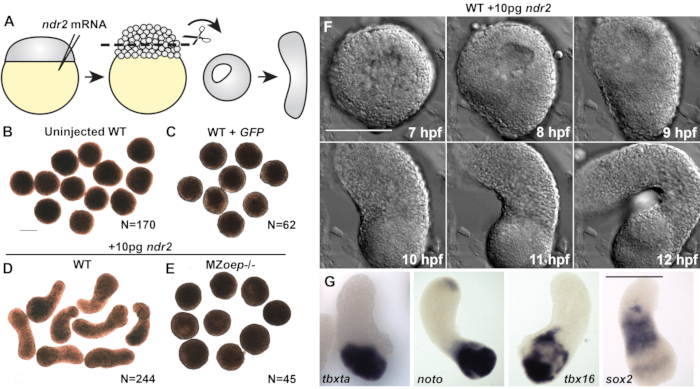
Figure 2 (modifiée à partir de20): Les ligands nodaux favorisent la morphogenèse C&E et la formation de couche germinale dans les explants de blastoderme de poisson-zèbre. (A) Diagramme d’injection et d’explantation d’embryons de poisson zèbre. (B-E) Images représentatives en champ lumineux d’explants de blastodermes vivants des conditions / génotypes indiqués au stade équivalent de 2-4 somite. N = nombre d’explants de deux à quatre essais indépendants. (F) Série DIC time-lapse d’une explante représentative d’un embryon WT injecté avec 10 pg ndr2 ARN. (G) Images représentatives de l’hybridation in situ en monture entière pour les transcriptions indiquées dans les explants d’embryons WT injectés avec 10 pg ndr2 ARN. Les barres d’échelle sont de 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
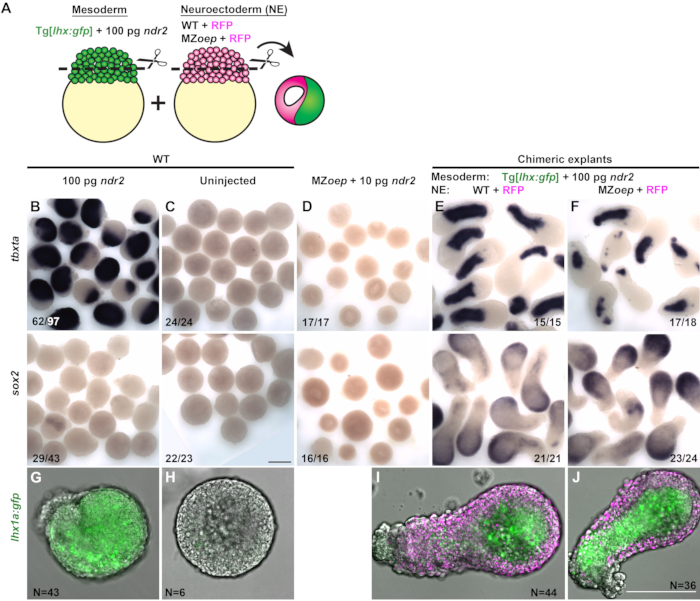
Figure 3 (Modifié à partir de31): Les explantes chimériques révèlent que la spécification du neuroectoderme ne nécessite pas de signalisation nodale autonome des tissus ex vivo. (A) Diagramme de la procédure de génération d’explants de poisson zèbre chimérique. (B-F) Hybridation in situ en montage entier pour le marqueur mésodermique tbxta (en haut) et le marqueur neuroectodermique sox2 (en bas) dans des explants d’embryons WT injectés avec 100 pg ndr2 ARN (B), des contrôles WT non injectés (C), MZoep-/- injecté avec 10 pg ndr2 (D), et des explants chimériques contenant des portions de neuroectoderme de WT (E) ou MZoep-/- (F ) embryons à l’équivalent du stade 2-4 somite. Les fractions indiquent le nombre d’explants avec le phénotype indiqué sur le nombre total d’explants examinés. (G-J) Images représentatives d’explantations vivantes de Tg[lhx1a:gfp] provenant d’un seul embryon (G-H) ou combinées avec des blastodermes exprimant H2B (I-J, magenta) des conditions indiquées à l’équivalent du stade 2-4 somite. N = nombre d’explants provenant de trois essais indépendants. Les barres d’échelle sont de 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Solution 1 | Solution 2 | Solution 3 | Solution 4 | |
| Solution | 3x Danieau’s | Eau d’œuf | Explant Média | 0,3x Danieau |
| Ingrédients | 174 mM de NaCl | 60 μg/mL de sels de mer | DMEM/F12 + 2,5 mM de L-Glutamine et 15 mM de HEPES | 17,4 mM de NaCl |
| 2,1 mM KCl | 1 L d’eau distillée | 3 % du volume total de sérum de veau nouveau-né ou de sérum bovin fœtal | 0,21 mM KCl | |
| 1,2 mM MgSO4. 7H2O | 1:200 Pénicilline (50 unités/mL)-Streptomycine (50 μg/mL) | 0,12 mM MgSO4•7H2O | ||
| 1,8 mM Ca(NO3)2 •4H2O | 0,18 mM Ca(NO3)2 •4H2O | |||
| 15 mM HEPES | Exemple: | 1,5 mM HEPES | ||
| Eau distillée | 4 mL/condition x 9 Conditions = 36 mL | Eau distillée | ||
| 1,08 mL de sérum de veau nouveau-né (NCS, aliquoteé à -20 °C (3 %) | ||||
| 0,18 mL 200x Pen-Strep (PS, aliquoted in -20 °C) (1:200) | ||||
| 35 mL DMEM/F12 |
Tableau 1.
Discussion
Cet article a décrit comment générer des explants de blastoderme de poisson zèbre et a discuté de deux applications pratiques de ces explants en abordant le rôle de la signalisation des morphogènes nodaux dans la gastrulation. Cette méthode de coupe et de culture des explants fournit une ardoise vierge de cellules naïves qui peuvent être manipulées à l’aide d’injections d’ARN et d’un traitement avec de petits composés moléculaires pour étudier une voie moléculaire d’intérêt.
Étapes critiques
Il y a quatre étapes dans ce protocole qui sont particulièrement critiques pour son succès. La première consiste à injecter aux embryons la quantité appropriée de Nodal. Ce protocole recommande 10 pg d’ARN ndr2, et bien qu’une gamme de doses favorise l’extension, trop ou trop peu de Nodal empêchera une extension optimale de l’explantation20. La deuxième étape consiste à déséchorioner les embryons. Si les embryons restent trop longtemps dans la pronase, les jaunes éclateront et les embryons ne seront pas viables à couper. S’ils ne sont pas dans la pronase assez longtemps, les chorions ne seront pas desserrés par le lavage et nécessiteront plutôt une décchorionation manuelle fastidieuse. La troisième étape critique consiste à couper les explants. Il est recommandé de couper dans 3x la solution de Danieau, car la teneur en sel plus faible de 0,3x la solution de Danieau ou l’eau d’œuf ne favorise pas la guérison et la survie des explants.
De plus, les explantes doivent être coupées à environ la moitié de la hauteur du blastoderme pour assurer la naïveté des cellules. S’ils sont coupés trop près du jaune, ils contiendront des signaux de la marge (y compris le nodal endogène) qui favorisent la spécification tissulaire et la morphogenèse. La quatrième et dernière étape critique est la guérison des explants chimériques. Deux explants ne fusionnent pas pour former des chimères à moins que leurs bords coupés ne soient doucement pressés ensemble immédiatement après leur coupe.
Modifications et dépannage
Les étapes critiques décrites ci-dessus offrent des possibilités de dépannage. Certains problèmes courants et solutions proposées sont présentés ci-dessous.
Si les explants ne s’étendent pas en présence de signalisation nodale, il existe des solutions possibles. (A) Injecter des embryons au stade unicellulaire pour s’assurer que l’ARN est uniformément dispersé dans l’ensemble de l’embryon. (B) Évitez d’injecter trop d’ARN nodal en vous assurant que le volume injecté est correct à l’aide d’un micromètre pour mesurer le bolus d’injection. (C) Évitez d’injecter trop peu d’ARN nodal en mesurant sa concentration pour s’assurer qu’il ne s’est pas dégradé. (D) Gardez des frères et sœurs intacts appariés selon l’âge pour déduire le stade équivalent des explants. Les explants atteignent une extension maximale lorsque les frères et sœurs intacts atteignent le stade de 2 à 5 somites. Si les explants sont collectés trop tôt, l’extension optimale ne sera pas atteinte.
Si les jaunes éclatent après la déschorionation et que les embryons ne sont pas viables à couper, retirez les embryons de la solution de pronase une fois que les chorions commencent à se froisser et que 1-2 embryons perdent leur chorion. Ensuite, rincez immédiatement à l’eau d’œuf.
Si les explants apparaissent pétillants sur les bords, il existe des solutions. (A) Couper les explants uniquement dans un délai de développement spécifique. Bien que les explants coupés à n’importe quel stade de 128 à 1000 cellules puissent survivre et s’étendre en culture, ceux coupés à des stades de 256 à 512 cellules ont tendance à être les plus robustes. (B) S’assurer que les explants sont coupés dans la solution de 3x Danieau pour assurer une bonne cicatrisation. (C) Couper les explantations proprement mais doucement. Évitez d’étirer ou de séparer les cellules pendant le processus de coupe.
Si les explants témoins non injectés s’étendent, les explants étaient susceptibles de couper trop près du jaune. Pour que les explantations soient naïves, assurez-vous que les coupes sont faites à mi-chemin entre le jaune et le haut du blastoderme.
Si les explants chimériques ne parviennent pas à fusionner, c’est probablement parce que la tendance des explants dans la solution de 3x Danieau une fois coupées est d’arrondir et de guérir sur le bord coupé. Pour vous assurer que les deux blastodermes guérissent l’un à l’autre plutôt qu’à eux-mêmes, pressez-les ensemble immédiatement après la coupe. Utilisez des pinces pour appliquer une légère pression sur les blastodermes nouvellement joints dans le puits d’agarose afin de les encourager à guérir ensemble.
Limitations
Bien que ces explants soient un outil précieux pour étudier le rôle d’un morphogène donné (ou d’une autre molécule d’intérêt) dans un isolement relatif, les observations faites dans tout modèle ex vivo doivent être interprétées avec soin. Les explantes présentent une morphogenèse C & E très similaire à celle observée in vivo20, mais elles ne récapitulent pas tous les aspects de la gastrulation, par exemple les mouvements épibulaires. Ils manquent également de nombreux autres facteurs régulateurs et molécules de signalisation présents dans un embryon intact. Bien qu’il s’agit d’un avantage expérimental significatif des explants, cela peut également conduire à des conclusions qui ne tiennent pas in vivo. Par exemple, étant donné que les explants qui ne reçoivent pas de ligands nodaux exogènes ne parviennent pas à exprimer les marqueurs neuroectodermiques, on pourrait conclure à partir des explants seuls que la signalisation nodale est nécessaire pour la spécification du neuroectoderme. Cependant, le neuroectoderme se forme au sein d’embryons intacts dépourvus de toute signalisation nodale23,24,démontrant le rôle vital d’autres molécules de signalisation dans la spécification neuronale32. Les explants peuvent nous dire de quoi un morphogène est capable dans un environnement isolé. Néanmoins, tous ces résultats doivent être confirmés dans / par rapport aux embryons intacts pour que les résultats soient interprétés à fond. En d’autres termes, les explants ne peuvent pas prendre la place d’un embryon en développement. Au lieu de cela, ils sont un outil supplémentaire pour identifier le rôle et la relation d’un morphogène avec l’environnement. Avec ces limitations à l’esprit, les explants de blastoderme de poisson zèbre sont un outil précieux pour de nombreuses questions de recherche.
Importance par rapport aux méthodes existantes
Avec un regain d’intérêt pour l’embryologie synthétique, plusieurs approches ex vivo et in vitro sont régulièrement utilisées pour modéliser des aspects du développement embryonnaire. Par exemple, des gastruloïdes à 2 et 3 dimensions composés de cellules souches pluripotentes embryonnaires / induites de souris ou d’humains peuvent être amadoués, par l’application de molécules de signalisation exogènes, pour récapituler certains des événements de motif et / ou de morphogénétique de la gastrulation, de la segmentation et de la neurulation33,34,35,36,37 . Bien que puissantes, ces méthodes nécessitent des méthodes de culture laborieuses et prolongées pour maintenir en permanence les cellules souches pluripotentes et pour développer des gastruloïdes, qui prennent plusieurs jours pour atteindre les stades de gastrulation. En revanche, les explants de poisson zèbre ne nécessitent aucun entretien des cultures de cellules souches, car les embryons sont simplement collectés au besoin. Ils sont relativement simples à générer et à atteindre les stades de gastrulation en quelques heures, tout comme les embryons de poisson zèbre. Cela met en évidence un autre avantage des explants de poisson zèbre, leur horloge de développement intacte. Parce que l’âge de développement des cellules souches pluripotentes embryonnaires et induites peut être variable et très débattu, les explantes embryonnaires sont peut-être mieux adaptées pour étudier la régulation temporelle du développement. Enfin, alors que les explantes de poisson zèbre pescoïde (qui contiennent la marge embryonnaire) s’étendent de la même manière dans la culture12,13, elles le font en réponse à des centres de signalisation endogènes. Au lieu de cela, les explants décrits ici permettent aux chercheurs d’étudier les molécules d’intérêt avec relativement peu d’interférences de tels signaux embryonnaires.
Applications futures potentielles
Ici, les explants ont été utilisés pour démontrer que la signalisation nodale est nécessaire et suffisante pour la morphogenèse C & E. Néanmoins, on s’attend à ce qu’ils puissent et seront utilisés pour discerner le rôle de nombreuses molécules différentes dans de nombreux autres processus de développement, par exemple, la régulation de l’expression des gènes, les gradients de signalisation et d’autres programmes morphogénétiques. De plus, parce que ces explants sont viables jusqu’à au moins 24 hpf19, on peut s’attendre à ce que leur utilité s’étende au-delà de la gastrulation dans des processus tels que la segmentation et l’organogenèse, tout processus dans lequel les chercheurs souhaitent une ardoise vierge de développement.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Ce travail a été soutenu par NICHD R00HD091386 à MLKW et par NIEHS T32ES027801 à AAE.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mm glass beads | Millipore-Sigma | Z250473 | |
| 4% Paraformaldehyde | VWR | J19943-K2 | |
| 6-well plates | Fisher | FB012927 | |
| Agarose | Thermo-Fisher | 16500500 | |
| Ca(NO3)2 .4H2O | Thermo-Fisher | 12364-36 | |
| DMEM/F12 media | Gibco | 11330032 | |
| Dumont #5 watchmakers forceps | World Precision Instruments | 500341 | |
| Embryo injection mold | Adaptive Science Tools | I-34 | |
| Glass crystalizing dishes | Fisher | 08-741A | |
| Glass Petri dishes | Fisher | 08-748A | |
| HEPES | VWR | JT4018-1 | |
| Instant Ocean sea salts | Instant Ocean | SS15-10 | |
| KCl | VWR | BDH9258-500G | |
| Low temperature incubator | Fisher | 15-015-2632 | |
| MgSO4.7H2O | VWR | 97062-134 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | M3301R | |
| Micrometer | SPI supplies | 02265-AB | |
| Mineral oil | VWR | MK635704 | |
| NaCl | VWR | BDH9286-500G | |
| Newborn Calf Serum | Invitrogen | 26010-066 | |
| Pasteur pipettes | Fisher | 13-678-30 | |
| Penicillin-Streptomycin Solution | Thermo-Fisher | 15140122 | |
| Pico-pump pneumatic injector | World Precision Instruments | SYS-PV820 | |
| Pipet pump | Fisher | 13 683C | |
| Plastic Petri dishes 100 mm | Fisher | FB0875712 | |
| Plastic Petri dishes 60 mm | Fisher | FB0875713A | |
| Plastic wash bottles | Fisher | 03-409-10E | |
| Pronase | Millipore-Sigma | 10165921001 | |
| Tween-20 | VWR | 200002-836 |
Références
- Green, J. B., New, H. V., Smith, J. C. Responses of embryonic Xenopus cells to activin and FGF are separated by multiple dose thresholds and correspond to distinct axes of the mesoderm. Cell. 71 (5), 731-739 (1992).
- Sudarwati, S., Nieuwkoop, P. D. Mesoderm formation in the anuranXenopus laevis (Daudin). Wilhelm Roux Archiv fur Entwicklungsmechanik der Organismen. 166 (3), 189-204 (1971).
- Gurdon, J. B., Fairman, S., Mohun, T. J., Brennan, S. Activation of muscle-specific actin genes in Xenopus development by an induction between animal and vegetal cells of a blastula. Cell. 41 (3), 913-922 (1985).
- Keller, R., Danilchik, M. Regional expression, pattern and timing of convergence and extension during gastrulation of Xenopus laevis. Development. 103 (1), 193-209 (1988).
- Ariizumi, T., et al. Isolation and differentiation of Xenopus animal cap cells. Current Protocols in Stem Cell Biology. , (2009).
- Asashima, M., Grunz, H. Effects of inducers on inner and outer gastrula ectoderm layers of Xenopus laevis. Differentiation. 23 (3), 206-212 (1983).
- Jones, E. A., Woodland, H. R. Development of the ectoderm in Xenopus: tissue specification and the role of cell association and division. Cell. 44 (2), 345-355 (1986).
- Keller, R. E. Vital dye mapping of the gastrula and neurula of Xenopus laevis. I. Prospective areas and morphogenetic movements of the superficial layer. Developmental Biology. 42 (2), 222-241 (1975).
- Sokol, S., Wong, G. G., Melton, D. A. A mouse macrophage factor induces head structures and organizes a body axis in Xenopus. Science. 249 (4968), 561-564 (1990).
- Thomsen, G., et al. Activins are expressed early in Xenopus embryogenesis and can induce axial mesoderm and anterior structures. Cell. 63 (3), 485-493 (1990).
- Howard, J. E., Smith, J. C. Analysis of gastrulation: different types of gastrulation movement are induced by different mesoderm-inducing factors in Xenopus laevis. Mechanisms of Development. 43 (1), 37-48 (1993).
- Fulton, T., et al. Axis specification in Zebrafish is robust to cell mixing and reveals a regulation of pattern formation by morphogenesis. Current Biology. 30 (15), 3063-3064 (2020).
- Schauer, A., Pinheiro, D., Hauschild, R., Heisenberg, C. -. P. Zebrafish embryonic explants undergo genetically encoded self-assembly. eLife. , 55190 (2020).
- Oppenheimer, J. M. The development of isolated blastoderms of Fundulus heteroclitus. The Journal of Experimental Zoology. 72 (2), 247-269 (1936).
- Trinkaus, J. P., Drake, J. W. Exogenous control of morphogenesis in isolated Fundulus blastoderms by nutrient chemical factors. The Journal of Experimental Zoology. 132 (2), 311-347 (1956).
- Grinblat, Y., Lane, M. E., Sagerström, C., Sive, H. Analysis of zebrafish development using explant culture assays. Methods in Cell Biology. 59, 127-156 (1999).
- Sagerström, C. G., Grinblat, Y., Sive, H. Anteroposterior patterning in the zebrafish, Danio rerio: an explant assay reveals inductive and suppressive cell interactions. Development. 122 (6), 1873-1883 (1996).
- Sagerström, C. G., Gammill, L. S., Veale, R., Sive, H. Specification of the enveloping layer and lack of autoneuralization in zebrafish embryonic explants. Devolopmental Dynamics. 232 (1), 85-97 (2005).
- Xu, P. F., Houssin, N., Ferri-Lagneau, K. F., Thisse, B., Thisse, C. Construction of a vertebrate embryo from two opposing morphogen gradients. Science. 344 (6179), 87-89 (2014).
- Williams, M. L. K., Solnica-Krezel, L. Nodal and planar cell polarity signaling cooperate to regulate zebrafish convergence and extension gastrulation movements. eLife. 9, (2020).
- de Olivera-Melo, M., Xu, P. F., Houssin, N., Thisse, B., Thisse, C. Generation of ectopic morphogen gradients in the Zebrafish blastula. Methods in Molecular Biology. 1863, 125-141 (2018).
- Sepich, D. S., Calmelet, C., Kiskowski, M., Solnica-Krezel, L. Initiation of convergence and extension movements of lateral mesoderm during zebrafish gastrulation. Devolopmental Dynamics. 234 (2), 279-292 (2005).
- Gritsman, K., et al. The EGF-CFC protein one-eyed pinhead is essential for nodal signaling. Cell. 97 (1), 121-132 (1999).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Spemann, H., Manngold, H. Uber inducktion von embryoalanlangen durch implantation artfremder organisatoren. Archiv für mikroskopische Anatomie und Entwicklungsmechanik. 100, 599-638 (1924).
- Mangold, O. Über die Induktionsfähigkeit der verschiedenen Bezirke der Neurula von Urodelen. Naturwissenschaften. 21 (43), 761-766 (1933).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Agathon, A., Thisse, C., Thisse, B. The molecular nature of the zebrafish tail organizer. Nature. 424 (6947), 448-452 (2003).
- Tacke, L., Grunz, H. Close juxtaposition between inducing chordamesoderm and reacting neuroectoderm is a prerequisite for neural induction in Xenopus laevis. Cell Death and Differentiation. 24 (1), 33-43 (1988).
- Swanhart, L. M., et al. Characterization of an lhx1a transgenic reporter in zebrafish. The International Journal of Developmental Biology. 54 (4), 731-736 (2010).
- Williams, M. L. K., Solnica-Krezel, L. A mesoderm-independent role for Nodal signaling in convergence & extension gastrulation movements. BioRxiv. , (2019).
- Londin, E. R., Niemiec, J., Sirotkin, H. I. Chordin, FGF signaling, and mesodermal factors cooperate in zebrafish neural induction. Developmental Biology. 279 (1), 1-19 (2005).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Veenvliet, J. V., et al. Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science. 370 (6522), (2020).
- Beccari, L., et al. Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids. Nature. 562 (7726), 272-276 (2018).
- Moris, N., et al. An in vitro model of early anteroposterior organization during human development. Nature. 582 (7812), 410-415 (2020).
- vanden Brink, S. C., et al. Single-cell and spatial transcriptomics reveal somitogenesis in gastruloids. Nature. 582 (7812), 405-409 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon