Method Article
Поколение наивных эксплантов Бластодерм из эмбрионов рыбок данио
В этой статье
Резюме
Экспланты бластодерм рыбок данио генерируются путем выделения эмбриональных клеток из эндогенных сигнальных центров в раннем эмбрионе, производя относительно наивные кластеры клеток, которыми легко манипулировать и культивировать ex vivo. В этой статье приведены инструкции по изготовлению таких эксплантов и демонстрируется их полезность путем опроса ролей узловой сигнализации во время гаструляции.
Аннотация
Благодаря своей оптической ясности и быстрому развитию, эмбрионы рыбок данио являются отличной системой для изучения поведения клеток и процессов развития. Однако из-за сложности и избыточности эмбриональных сигналов может быть сложно различить полную роль любого отдельного сигнала во время раннего эмбриогенеза. При эксплантировании животной области бластодермы рыбок данио образуются относительно наивные кластеры эмбриональных клеток, которые можно легко культивировать и манипулировать ex vivo. Вводя интересующий ген путем инъекции РНК перед эксплантацией, можно оценить влияние этой молекулы на экспрессию генов, поведение клеток и другие процессы развития в относительной изоляции. Кроме того, клетки эмбрионов различных генотипов или состояний могут быть объединены в один химерный эксплант для изучения взаимодействия клеток и тканей и тканеспецифических функций генов. В этой статье приведены инструкции по генерации эксплантов бластодермы рыбок данио и показано, что одной сигнальной молекулы - узлового лиганда - достаточно, чтобы индуцировать образование зародышевого слоя и морфогенез расширения в наивных эмбриональных тканях. Из-за их способности рекапитулировать поведение эмбриональных клеток, морфогенные градиенты и паттерны экспрессии генов в упрощенной системе ex vivo, эти экспланты, как ожидается, будут очень полезны для многих исследователей рыбок данио.
Введение
Извечная цель области биологии развития состоит в том, чтобы разгадать сложность развивающихся эмбрионов, чтобы понять происхождение формы и функции животных. Даже ранние эмбрионы содержат сложную попурри из сигнальных молекул, клеточных и тканевых взаимодействий и механических сил, подверженных строгой пространственной и временной регуляции. По этой причине часто бывает сложно точно определить точную роль конкретного сигнала в интересуемом процессе развития. Удаляя эмбриональные ткани из их эндогенной среды, эксплантация эмбрионов создает упрощенную платформу, в которой можно различить роли развития отдельных тканей и молекул в относительной изоляции. Методы эксплантации, пожалуй, наиболее известны в Xenopus laevis,где они использовались для изучения индукции тканей, клеточной сигнализации, клеточной адгезии и морфогенеза, среди других процессов1,2,3,4. Так называемые экспланты шляпок животных, в которых животная область эмбрионов Xenopus стадии бластулы выделяется перед индуктивными взаимодействиями5,6,7,являются широко распространенной и мощной эксплантной техникой. Неманипулированным шляпкам животных суждено стать эктодермой7,8. Тем не менее, они компетентны реагировать на несколько индуктивных факторов, что позволяет им формировать ткани всех трех зародышевых слоев и подвергаться соответствующим тканям морфогенетическим движениям9,10,11. Тем не менее, ограниченные генетические инструменты и неоптимальная пригодность для живой визуализации предотвращают использование эксплантов Xenopus для многих биологов развития. Эксплантируя клетки бластодермы из эмбрионов рыбок данио, исследователи могут объединить полезность анализа шляпки животных с оптической ясностью, обилием генетических инструментов и другими экспериментальными преимуществами модельной системы рыбок данио.
На сегодняшний день исследователи использовали два вкуса эксплантов рыбок данио: так называемые пескоиды и экспланты бластодермы. В пескоидной модели вся бластодерма, включая краевую зону, выделена из желтка и может развиваться ex vivo без внеэмбрионального синцитиального слоя желтка (YSL)12,13. Таким образом, пескоиды имеют заметное сходство с эксплантами Fundulus, созданными десятилетия назад Джейн Оппенгеймер и Дж.П. Тринкаусом14,15. Эти экспланты повторяют многие аспекты эмбрионального паттерна и морфогенеза12,13. Однако, поскольку эти изоляты содержат эндогенные сигнальные центры (эмбриональный край), они не упрощены в отношении их молекулярной среды. В качестве альтернативы, исследователи могут генерировать относительно наивные бластодермные экспланты рыбок данио, исключая маргинальную зону16,17,18,19,20,21. Неманипулированные экспланты бластодермы рыбок данио экспрессируют высокие уровни морфогенов костного морфогенетического белка (BMP)19 и дают начало ненейронной эктодерме и обволакивающим слою (EVL) при культивировании ex vivo18. Тем не менее, они повторяют многие аспекты осевого паттерна и морфогенеза в ответ на экзогенные сигнальные градиенты19,20,21,похожие на капсулы животных Xenopus. По этой причине экспланты бластодермы являются предпочтительной моделью для изучения роли данного морфогена (или морфогенов) в спецификации зародышевого слоя, морфогенетических движениях клеток и сигнальных градиентах в упрощенной сигнальной среде. Кроме того, бластодермы из эмбрионов различных генотипов или условий могут быть объединены в один химерный эксплант19,21 для исследования автономии клеток / тканей и индуктивных взаимодействий.
Экспланты бластодермы рыбок данио могут быть использованы для исследования роли эмбриональных сигналов (например, узловых) в морфогенезе и спецификации тканей при гаструляции. Путем инъекции синтетической РНК ndr2 (кодирующей узловой лиганд) на одноклеточной стадии, узловая сигнализация активируется по всей бластодерме эмбриона. Экспланты из этих эмбрионов генерируют узловые сигнальные градиенты, образуют все три зародышевых слоя и подвергаются конвергенции и расширению (C & E) гаструляционных движений, как видно у интактных эмбрионов20. Кроме того, химерные экспланты используются для иллюстрации способности тканей мезодермы индуцировать нейроэктодерму из неинжелированной (наивной) бластодермы. Этот протокол предоставляет инструкции по созданию эксплантов бластодермы рыбок данио и демонстрирует их полезность в определении роли узловой сигнализации в индукции тканей и морфогенезе.
протокол
1 Подготовьте реагенты и расходные материалы
- Подготовка реагентов
- Приготовьте 500 мл 3x раствора Данио (Раствор 1, Таблица 1).
- Приготовить 1 л яичной воды (раствор 2, табл. 1).
- Готовят 1,2% раствор агарозы в яичной воде. Расплавите агарозу полностью в микроволновой печи, а затем охладите до 55 °C на водяной бане.
- Готовят 4 мл эксплантной среды (раствор 3, таблица 1,модифицированную незначительно из19,21)для каждого экспериментального состояния.
ПРИМЕЧАНИЕ: Не забудьте учесть по крайней мере одну скважину эксплантов из неинъецированных (или контрольных инъекционных) эмбрионов при расчете необходимого объема.- Продезинфицируйте рабочее пространство 70% этанолом.
- Удалите питательную целлюлозу при 4 °C и распылите/протрите 70% этанолом.
- Сделайте эксплантные среды и поместите в инкубатор при 28,5 °C, чтобы согреться, пока эмбрионы вводятся.
ПРИМЕЧАНИЕ: Всегда включайте соответствующие возрасту, интактные эмбрионы братьев и сестер для целей постановки. Дехорионировать эти эмбрионы и культивировать их на пластинках, покрытых агарозой, в 0,3х растворе Данио (Раствор 4, Таблица 1).
- Удалить проназные аликвоты (1 мл при 20 мг/мл) от -20 °C и дать оттаять на льду. Размораживает одну аликвоту 1 мл на каждые три экспериментальных условия.
- Приготовьте агарозные пластины
- Сделайте инъекционные пластины.
- Наполните пластиковую чашку Петри 100 мм х 15 мм наполовину расплавленной агарозой в яичной воде.
- Осторожно поместите форму для инъекций поверх расплавленной агарозы под углом 45° и постепенно опустите ее в агарозу, следя за тем, чтобы под ней не задерживались пузырьки. Дайте ему полностью остыть.
- Удалите плесень. Используйте тарелку немедленно или сохраните на потом, добавив 2 мл яичной воды, обернув тарелку и сохранив ее при 4 °C. Прогреть пластину в течение 15-30 мин в инкубаторе при 28,5 °C перед инъекцией.
- Сделайте эксплантные режущие пластины.
- Добавьте 3 мл расплавленной 1,2% агарозы в яичной воде в чашку Петри 60 мм х 15 мм, гарантируя, что все дно колодца покрыто. Дайте ему полностью остыть.
- Покрыть культурную пластину агарозой.
- Для каждого экспериментального состояния дозируют 1 мл расплавленной 1,2% агарозы в яичной воде в одну скважину из 6-скважинной пластины, гарантируя, что все дно скважины покрыто. Дайте ему полностью остыть.
- Для приготовления химерных эксплантов создайте эксплантную режущую посуду с небольшими колодчиками, добавив двенадцать стеклянных шариков по 1 мм к расплавленной агарозе в чашке Петри 60 мм х 15 мм. Удалите бусины щипцами, как только агароза полностью остынет.
- Сделайте инъекционные пластины.
2 Инъекция эмбрионам РНК
- Надев перчатки, удалите аликвоту синтетической мРНК ndr2 из хранилища при -80 °C и немедленно поместите ее на лед.
- Подготовьте инъекционную иглу.
- Наполните вытянутую стеклянную капиллярную иглу РНК. Поместите заполненную иглу в микро-манипулятор и разбейте кончик иглы щипцами.
- Калибруйте объем впрыска с помощью ступенчатого микрометра с каплей минерального масла, регулируя время впрыска и давление на пневматический инжектор для достижения болюса нужного размера. Болюс диаметром 120 мкм имеет объем 1 нЛ.
ПРИМЕЧАНИЕ: Желаемый объем болюса будет зависеть от концентрации РНК и желаемой дозы на эмбрион. Например, если РНК аликвотирована при 10 нг/мкл, вводят 1 нл для достижения конечного количества 10 пг.- Держите наконечник иглы РНК погруженным в масло до готовности к инъекции.
- Загрузите эмбрионы и введйте инъекции.
- Вытащите разделители в резервуары для размножения, дайте рыбе нереститься в течение 10-15 минут и соберите эмбрионы с помощью чайного ситечка.
- Загрузите эмбрионы в инъекционную пластину с помощью пипетки Пастера и пипетки, а затем используйте палец в перчатке, чтобы аккуратно вдавить яйца в корыта.
- Вводите 10 pg NDR2 РНК в желток одноклеточных эмбрионов до тех пор, пока не будет достигнуто желаемое количество эмбрионов или пока эмбрионы не начнут делиться.
ПРИМЕЧАНИЕ: Не вводите после одноклеточной стадии, чтобы обеспечить равномерное распределение РНК по всему эмбриону. - Вымойте эмбрионы из инъекционной пластины в маркированную чашку Петри размером 100 мм x 15 мм с нежной струей яичной воды из бутылки для выжимки.
ПРИМЕЧАНИЕ: Всегда держите группу соответствующих возрасту, неинъектированных братьев и сестер в качестве контрольных. - Поместите эмбрионы в инкубатор с 28,5 °C, пока они не достигнут стадии 128 клеток. Удалите из блюда неодобрённые яйца и отмершую зародыш.
3 Дехорионировать эмбрионы
- Как только эмбрионы достигнут 128-клеточной стадии, поместите их в меченые стеклянные чашки Петри и отложите из них как можно больше яичной воды.
- Маркировать стеклянную кристаллизующую посуду лабораторной лентой (соответствующей названиям небольших блюд) и заполнять 2/3 пути яичной водой. Поместите эти блюда рядом с рассекающим микроскопом для быстрого доступа.
- Добавьте 1 мл проназы (20 мг/мл, размороженные на льду) к 15 мл 3-кратного раствора Данио в конической пробирке 50 мл.
ПРИМЕЧАНИЕ: Этого количества достаточно для трех экспериментальных условий. Увеличьте объем проназы и 3x раствора Данио для дополнительных условий эксплантата.
ВНИМАНИЕ: Проназа является раздражителем; следовательно, надевайте перчатки при обращении. - Добавьте не менее 5 мл раствора проназы в каждую стеклянную чашку Петри, содержащую эмбрионы.
- Перемешивают стеклянную посуду круговыми движениями, последовательно контролируя ход дехорионации под рассекающим микроскопом.
- Как только хорионы начнут сморщиваться и 1-2 эмбриона выходят из своих хорионов, осторожно окуньте стеклянную чашку Петри, содержащую проназу и эмбрионы, в соответствующую стеклянную кристаллизующуюся чашку, содержащую яичную воду.
- Промыть дехорионированные эмбрионы.
- Трижды вымойте эмбрионы яичной водой, осторожно добавив, а затем декантируя яичную воду из посуды.
- Третья и последняя промывка проводится с 0,3-кратным раствором Данио.
ПРИМЕЧАНИЕ: Если после промывания у эмбрионов все еще есть хорионы, аккуратно пипетируйте эмбрионы до тех пор, пока хорионы не будут удалены, или дайте им посидеть в стирке (яичная вода или 0,3-кратный раствор Данио) в течение минуты или двух и осторожно перемешивать круговыми движениями.
- Накройте дехорионированные эмбрионы крышкой чашки Петри и верните их в инкубатор (28,5 °C) до тех пор, пока они не достигнут стадии 256 клеток.
4 Разрезанные экспланты
- Наполните чашку Петри с агарозовым покрытием 60 мм x 15 мм раствором 3x Danieau.
- Как только эмбрионы находятся на 256-клеточной стадии, перенесите их в покрытую агарозой пластину, содержащую 3-кратный раствор Данио, выровняв их вдоль центра тарелки.
- Вырежьте экспланты с помощью щипцов(рисунок 1).
- Используйте одну пару щипцов, удерживаемых закрытыми, чтобы стабилизировать эмбрион, а другую для разрезания бластодермы примерно на половине ее высоты (от края до полюса животного)(рисунок 1А).
- Чтобы разрезать, аккуратно сожмите клетки бластодермы одной парой щипцов. Затем возьмите стабилизируя щипцы и проведите их вдоль других щипцов, чтобы разрезать примерно наполовину через бластодерму(рисунок 1B).
- Поверните зародыш, поместив щипцы в существующий разрез, а затем отрежьте оставшуюся бластодерму ортогонально к первомусрезу (рисунок 1С).
- Держите экспланты в 3-кратном растворе Данио не менее 5 минут для заживления, затем переложите их в колодец 6-скважинной пластины, покрытой агарозой и заполненной 4 мл эксплантной среды.
ПРИМЕЧАНИЕ: Вырезать экспланты из неинъекционных (или контрольных инъекционных) братьев и сестер в качестве отрицательных контрольных элементов. Если экспланты выполнены правильно, эти экспланты не будут ни расширять, ни экспрессировать маркеры эндодермы, мезодермы или нейроэктодермы. - Поместите эксплантированные культурные пластины в инкубатор с 28,5 °C до тех пор, пока не будет достигнута желаемая временная точка/стадия (определяемая по неповрежденным братьям и сестрам).
ПРИМЕЧАНИЕ: При обработке эксплантов соединением, таким как ингибитор малых молекул, желаемая концентрация может быть добавлена непосредственно к эксплантной среде в скважинах в желаемые моменты времени. Не забудьте включить объем агарозы при расчете концентраций. (Пример: 1 мл агарозы + 4 мл эксплантной среды = 5 мл общего объема на скважину).
5 Приготовьте химерные экспланты
- Вместо обычной пластины с покрытием агарозой нарежьте химерные экспланты в блюде с агарозой, отлитой в двенадцать небольших, неглубоких колодцев с использованием стеклянных бусин толщиной 1 мм (раздел 1.2.4). Заполните эту тарелку 3x раствором Данио.
ПРИМЕЧАНИЕ: Химерные экспланты генерируются из клеток бластодермы двух эмбрионов разных генотипов или условий. Убедитесь, что эти условия можно отличить друг от друга путем экспрессии трансгенных или вводимых флуоресцентных маркеров.- Подготовьте, добавив двенадцать эмбрионов одного генотипа/состояния в левую сторону пластины и двенадцать эмбрионов другого генотипа/состояния в правую сторону пластины.
- Переместите один эмбрион каждого состояния в центр плиты, рядом с одной из 12 скважин.
- Используя щипцы, вырежьте эксплант из каждого эмбриона, как описано для эксплантов одного эмбриона (этап 4.3).
- Быстро прижмите срезанные края двух эксплантов вместе в неглубоком колодце, используя щипцы, чтобы позволить двум половинкам зажить вместе в одном экспланте.
- Продолжайте с оставшимися одиннадцатью скважинами внутри плиты. После того, как экспланты заживут, перенесите их в колодец 6-скважинной пластины, покрытой агарозой и заполненной 4 мл эксплантной среды. Повторяйте до тех пор, пока не будет достигнуто желаемое количество эксплантов.
6 Культура и/или изображение неподвижных эксплантов
- Культивируется в инкубаторе с 28,5 °C до тех пор, пока неповрежденные эмбрионы братьев и сестер не достигнут желаемой стадии.
- Живые экспланты могут быть установлены для непрерывной покадровой визуализации, периодически визуализироваться в течение периода культивирования или вживую в экспериментальной конечной точке.
- При желании исправьте экспланты. Как только экспланты достигнут желаемой конечной точки, обратите внимание на стадию интактных братьев и сестер эмбриона и поместите экспланты в стеклянный сцинтилляционный флакон с 1 мл 4% параформальдегида в PBS. Зафиксируйте на ночь на шейкере при 4 °C.
ВНИМАНИЕ: Параформальдегид токсичен. Надевайте перчатки при обращении с этим химическим веществом и утилизируйте его методами, утвержденными каждым учреждением.- После фиксации промыть экспланты шесть раз, по 15 мин каждый с PBS + 0,1% Tween-20, и постепенно обезвоживать в метанол. Храните экспланты при -20 °C для последующего анализа путем гибридизации in situ, иммунофлуоресцентного окрашивания и т. Д.
Результаты
Узловые лиганды стимулируют образование зародышевого слоя и C &E эксплантов бластодерм рыбок данио
Контрольные экспланты, вырезанные из неинъецированных эмбрионов дикого типа (WT) или введенные с 50 пг мРНК, кодирующей зеленый флуоресцентный белок (GFP), оставались округлыми в течение всего периода культивирования(Рисунок 2A-C)и не смогли экспрессировать маркеры мезодермы, эндодермы или нейроэктодермы(Рисунок 3C)20. Вместе они указывают на отсутствие морфогенеза и образования зародышевого слоя, характеризующих гаструляцию позвоночных. Однако экспланты, вырезанные из эмбрионов, введенных с 10 пг мРНК ndr2, стали сильно вытянутыми через 8-9 ч в культуре(рисунок 2D). Живая покадровая визуализация этих эксплантов с помощью дифференциальной интерферионной контрастной (ДВС-микроскопии) показала, что расширение начинается примерно через 8 ч после оплодотворения (hpf)(рисунок 2F),в то же время, когда морфогенез C & E начинается у интактных эмбрионов рыбок данио22. Экспланты, вырезанные из эмбрионов MZoep-/-, у которых отсутствует существенный узловой корецептор tdgf1 23,не смогли распространиться в ответ на инъекцию ndr2 (рисунок 2E),демонстрируя, что узловая активность имеет решающее значение для этого морфогенеза ex vivo. Кроме того, гибридизация whole-mount in situ дополнительно показала, что ndr2-экспрессирующиеэкспланты экспрессируют маркеры нейроэктодермы (sox2) и нескольких поддоборезов мезодермы (tbxta, noto, tbx16) (рисунок 2G), а также эндодермы и эмбриональногоорганизатора 20.
Узловая сигнализация не требуется для индукции нейроэктодермы мезодермой
Узловая сигнальная активность необходима для индукции эндодермы и большинства мезодерм, но не является обязательной для спецификации нейроэктодермы в гаструлах рыбокданио23,24. В то время как неинъецированные экспланты бластодермы рыбок данио не дифференцировались в нейроэктодерму(рисунок 3C18),экспланты из эмбрионов, которым вводили 10 pg ndr2, демонстрировали надежную экспрессию маркера нейроэктодермы sox2 в отчетливых полосах вдоль длинной оси экспланта(рисунок 2G),что указывает на то, что узловая активность необходима для формирования нейроэктодермы ex vivo. Давно известно, что мезодермальные ткани могут индуцировать нервную ткань25,26,27,28,29,в том числе у рыбок данио бластодерм17. Однако неясно, требует ли образование нейроэктодермы в этой эксплантной системе непосредственно узловой сигнализации или экзогенные узловые лиганды индуцируют мезодерму, которая затем индуцирует нервные ткани во вторую секунду.
Химерные экспланты, содержащие проспективные участки мезодермы и нейроэктодермы из двух разных эмбрионов, были сгенерированы, чтобы проверить, требуется ли узловая сигнализация тканево-автономно для спецификации нейроэктодермы ex vivo. Мезодерменная часть каждого экспланта была вырезана из эмбриона WT, экспрессирующего специфическое для мезодермы трансгенный репортер GFP, Tg[lhx1a:eGFP]30,введенный с высокой дозой (100 пг) ndr2 (рисунок 3A). Предполагаемой нейроэктодермной части каждого экспланта вырезали либо из контрольного эмбриона WT, либо из узлового сигнального дефицита MZoep-/- эмбриона, вводимого только мРНК, кодирующей флуоресцентный ядерный маркер H2B-RFP(рисунок 3A). Каждый химерный эксплант был получен путем объединения одной бластодермы из каждого из этих двух состояний, которые были анализированы для экспрессии тканеспецифических маркеров путем гибридизации in situ всего крепления при 12 л.с.
Большинство эксплантов с одним эмбрионом из эмбрионов, вводимых со 100 pg ndr2, экспрессировали мало или вообще не выражали sox2и экспрессировали маркеры мезодермы, включая tbxta и репортер lhx1a:gfp - по всему экспланту(рисунок 3B,G). Неинжекционированная бластодерма WT (типа, который включает в себя перспективную нейроэктодермную часть химерных эксплантов) не экспрессирует ни маркеров мезодермы, ни sox2 при культивировании в виде одного эксплантата, что указывает на отсутствие спецификации нейроэктодермы и мезодермы(рисунок 3C,H). Эксплантатам с одним эмбрионом из MZoep-/- эмбрионам также не хватало экспрессии как нейроэктодермы, так и мезодермных маркеров, даже при введении ndr2 (рисунок 3D). Однако, когда неинжекционные бластодермы WT комбинировались с мезодермой, индуцированной высокими дозами узловых лигандов, эти химерные экспланты выражали как мезодермные маркеры, так и sox2 надежно(рисунок 3E,I). Эти результаты показывают, что, как наблюдалосьранее 17,26,27,29, мезодермаможет вызывать нервную судьбу в клетках, которые в противном случае стали бы ненейральной эктодермой. Чтобы проверить, требуется ли узловая сигнализация непосредственно в предполагаемой нейроэктодермной части этих эксплантов для их нейронной индукции, химерные экспланты были созданы из бластодерм WT, введенных с 100 pg ndr2 и бластодерм из эмбрионов MZoep-/-(рисунок 3J). Несмотря на свою неспособность принимать узловые сигналы от соседней мезодермальной части, эти экспланты экспрессировали sox2 в той же степени, что и контрольные химеры WT(рисунок 3F). Этот результат демонстрирует, что в соответствии с интактными эмбрионами, в которых нервные ткани указаны при отсутствии узловой активности, узловая сигнализация не требуется тканево-автономно для индукции нейроэктодермы ex vivo.
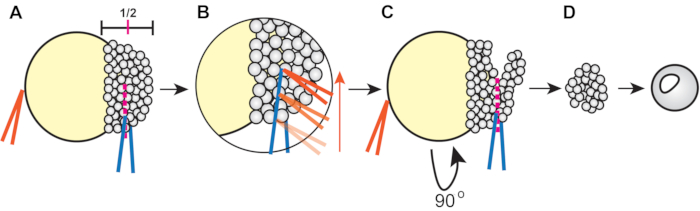
Рисунок 1:Процедура эксплантации бластодермы рыбок данио (этап 4.3). (А)Держите щипцы в недоминирующей руке (оранжевый) закрытыми против желтка, чтобы стабилизировать эмбрион при защемлении бластодермы примерно на 1/2 ее высоты, используя щипцы в доминирующей руке (синий). (B) Провести оранжевые щипцы вдоль края синих щипцов, сжимающих эмбрион, чтобы разрезать бластодерму так, чтобы первый разрез достиг примерно половины пути через бластодерму. (C)Поверните эмбрион на 90°, затем поместите синие щипцы внутрь (но ортогонально) исходного разреза и зажмите, чтобы разорвать оставшуюся бластодерму. (D) Дайте эксплантированным клеткам бластодермы заживать в 3-кратном растворе Данио в течение примерно 5 мин перед переносом в эксплантную жиму. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
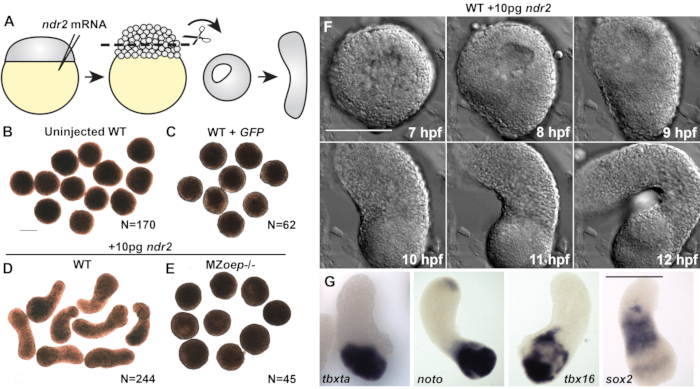
Рисунок 2 (модифицированный из20):Узловые лиганды способствуют морфогенезу C&E и образованию зародышевого слоя в эксплантатах бластодермы рыбок данио. (A) Диаграмма инъекции и эксплантации эмбрионов рыбок данио. (Б-Е) Репрезентативные ярко-полевые изображения живых бластодермных эксплантов указанных условий/генотипов на эквивалентной 2-4 стадии сомита. N = число эксплантов от двух до четырех независимых испытаний. (F) Покадровый цикл ОВС репрезентативного эксплантата из эмбриона WT, введенного с РНК 10 pg ndr2. (Г) Репрезентативные изображения гибридизации in situ с цельным креплением для транскриптов, указанных в эксплантатах эмбрионов WT, введенных с РНК 10 pg ndr2. Шкала 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
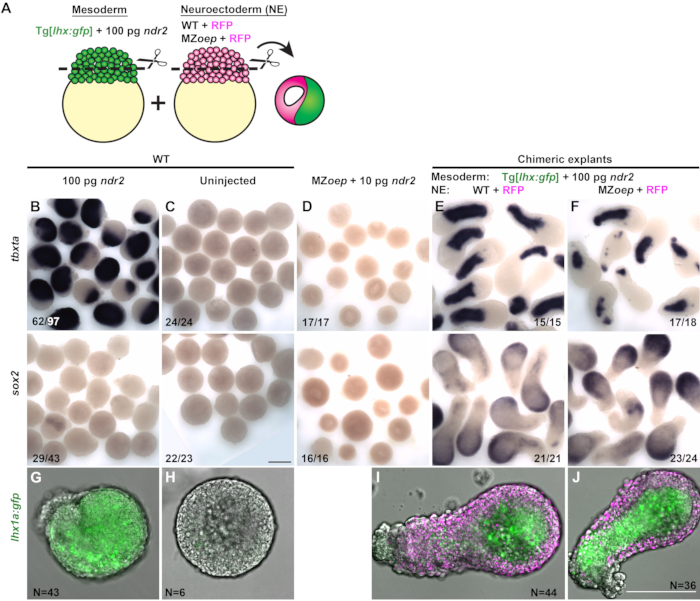
Рисунок 3 (Модифицированный из31):Химерные экспланты показывают, что спецификация нейроэктодермы не требует ткане-автономной узловой сигнализации ex vivo. (A)Диаграмма процедуры генерации химерных эксплантов рыбок данио. (Б-Ф) Гибридизация in situ в цельном креплении для мезодермного маркера tbxta (вверху) и нейроэктодермного маркера sox2 (снизу) в эксплантатах из эмбрионов WT, вводимых с РНК 100 pg ndr2 (B),неинъекционных контрольных элементов WT(C),MZoep-/- вводимых с 10 pg ndr2 (D),и химерных эксплантов, содержащих порции нейроэктодермы из WT(E)или MZoep-/-(F) ) эмбрионы на стадии эквивалента 2-4 сомита. Фракции указывают на количество эксплантов с фенотипом, показанным над общим количеством исследованных эксплантов. (G-J) Репрезентативные изображения живых Tg[lhx1a:gfp] эксплантов из одного эмбриона(G-H)или в сочетании с H2B-экспрессирующими бластодермами(I-J,пурпурный) условий, указанных на эквивалентной стадии 2-4 сомита. N = число эксплантов из трех независимых испытаний. Шкала 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Решение 1 | Решение 2 | Решение 3 | Решение 4 | |
| Решение | 3x Данио | Яичная вода | Эксплант Медиа | 0.3x Данио |
| Ингредиенты | 174 мМ NaCl | 60 мкг/мл морских солей | DMEM/F12 + 2,5 мМ L-глютамин и 15 мМ HEPES | 17,4 мМ NaCl |
| 2,1 мМ KCl | 1 л дистиллированной воды | 3% от общего объема сыворотки для новорожденных телят или бычьей сыворотки плода | 0,21 мМ KCl | |
| 1,2 мМ MgSO4. 7Ч2О | 1:200 Пенициллин (50 единиц/мл)-Стрептомицин (50 мкг/мл) | 0,12 мМ MgSO4•7H2O | ||
| 1,8 мМ Ca(NO3)2 •4H2O | 0,18 мМ Ca(NO3)2 •4H2O | |||
| 15 мМ HEPES | Пример: | 1,5 мМ HEPES | ||
| Дистиллированная вода | 4 мл/условие x 9 условий = 36 мл | Дистиллированная вода | ||
| 1,08 мл сыворотки для новорожденных телят (NCS, аликвотированная в -20 °C (3%) | ||||
| 0,18 мл 200x Pen-Strep (PS, аликвотирован в -20 °C) (1:200) | ||||
| 35 мл DMEM/F12 |
Таблица 1.
Обсуждение
В этой статье описано, как генерировать экспланты бластодермы рыбок данио и обсуждаются два практических применения этих эксплантов в решении роли узловой морфогенной сигнализации в гаструляции. Этот метод резки и культивирования эксплантов обеспечивает чистый лист наивных клеток, которыми можно манипулировать с помощью инъекций РНК и обработки соединениями малых молекул для исследования молекулярного пути, представляющим интерес.
Критические шаги
В этом протоколе есть четыре шага, которые особенно важны для его успеха. Первый заключается в введении эмбрионам соответствующего количества узлов. Этот протокол рекомендует 10 пг РНК ndr2, и хотя диапазон доз способствует расширению, слишком много или слишком мало Nodal будет препятствовать оптимальному расширению эксплантата20. Вторым шагом является дехорионирование эмбрионов. Если эмбрионы остаются в проназе слишком долго, желтки лопнут, и эмбрионы не удастся разрезать. Если они не находятся в проназе достаточно долго, хорионы не будут ослаблены мытьем и вместо этого потребуют трудоемкой ручной дехорионации. Третьим критическим шагом является резка эксплантов. Рекомендуется разрезать 3-кратный раствор Данио, так как более низкое содержание соли в 0,3х раствора Данио или яичной воды не способствует заживлению и выживанию эксплантов.
Кроме того, экспланты должны быть разрезаны примерно на половину высоты бластодермы, чтобы обеспечить наивность клеток. Если их разрезать слишком близко к желтку, они будут содержать сигналы от края (включая эндогенный узел), которые способствуют спецификации тканей и морфогенезу. Четвертый и последний критический шаг заключается в исцелении химерных эксплантов. Два эксплантата не будут сливаться, образуя химеры, если их срезанные края не будут аккуратно спрессованы вместе сразу после их разреза.
Изменения и устранение неполадок
Критические шаги, описанные выше, предоставляют возможности для устранения неполадок. Ниже представлены некоторые общие вопросы и предлагаемые решения.
Если экспланты не распространяются в присутствии узловой сигнализации, есть некоторые возможные решения. (A) Вводить эмбрионы на стадии одной клетки, чтобы гарантировать, что РНК равномерно рассеивается по всему эмбриону. (B) Избегайте инъекций слишком большого количества узловой РНК, убедив, что введенный объем является правильным, используя микрометр для измерения инъекционного болюса. (C) Избегайте инъекций слишком малого количества узловой РНК, измеряя ее концентрацию, чтобы убедиться, что она не деградировала. (D) Оставить некоторых совпадающих по возрасту неповрежденных братьев и сестер, чтобы сделать вывод об эквивалентной стадии эксплантов. Экспланты достигают максимального расширения, когда неповрежденные братья и сестры достигают стадии 2-5 сомит. Если экспланты собрать слишком рано, то оптимальное расширение не будет достигнуто.
Если желтки лопаются после дехорионации, и эмбрионы не жизнеспособно разрезают, удалите эмбрионы из раствора проназы, как только хорионы начнут сморщиваться и 1-2 эмбриона сбросят свой хорион. Затем сразу же смойте в яичной воде.
Если экспланты появляются пузырьков по краям, есть некоторые решения. (A) Сокращать экспланты только в течение определенных сроков разработки. Хотя экспланты, разрезанные на любой стадии от 128 до 1000 клеток, могут выживать и расширяться в культуре, те, которые разрезаются на стадиях от 256 до 512 клеток, как правило, являются наиболее надежными. (B) Убедитесь, что экспланты разрезаны в 3x растворе Данио, чтобы обеспечить надлежащее заживление. (C) Вырезать экспланты чисто, но осторожно. Избегайте растяжения или раздвигания ячеек во время процесса резки.
Если неинъекированные контрольные экспланты расширяются, экспланты, вероятно, будут разрезать слишком близко к желтку. Чтобы экспланты были наивными, убедитесь, что разрезы сделаны на полпути между желтком и верхней частью бластодермы.
Если химерные экспланты не сливаются, это, вероятно, потому, что тенденция эксплантов в 3-кратном растворе Данио после разреза заключается в том, чтобы округлиться и заживать над краем разреза. Чтобы убедиться, что две бластодермы заживают друг для друга, а не для себя, сжимайте их вместе сразу после разреза. Используйте щипцы, чтобы оказать мягкое давление на недавно соединенные бластодермы в агарозном колодце, чтобы побудить их к совместному исцелению.
Ограничения
Хотя эти экспланты являются ценным инструментом для изучения роли данного морфогена (или другой молекулы, представляющих интерес) в относительной изоляции, наблюдения, сделанные в любой модели ex vivo, должны интерпретироваться с осторожностью. Экспланты демонстрируют C&E морфогенез, который очень похож на наблюдаемый in vivo20,но они не повторяют все аспекты гаструляции, например, движения эпиболии. Им также не хватает многих других регуляторных факторов и сигнальных молекул, которые присутствуют в интактном эмбрионе. Хотя это является значительным экспериментальным преимуществом эксплантов, оно также может привести к выводам, которые не выдерживают in vivo. Например, поскольку экспланты, которые не получают экзогенные узловые лиганды, не экспрессированы маркерами нейроэктодермы, можно сделать вывод только из эксплантов, что для спецификации нейроэктодермы требуется узловая сигнализация. Однако нейроэктодерма образуется внутри интактных эмбрионов, лишенных всех узловых сигналов23,24,демонстрируя жизненно важную роль других сигнальных молекул в нейронной спецификации32. Экспланты могут сказать нам, на что способен морфоген в изолированной среде. Тем не менее, все такие результаты должны быть подтверждены / сопоставлены с интактными эмбрионами, чтобы результаты были тщательно интерпретированы. Другими словами, экспланты не могут занять место развивающегося эмбриона. Вместо этого они являются дополнительным инструментом для определения роли и отношений морфогена с окружающей средой. Имея в виду эти ограничения, бластодермы рыбок данио являются ценным инструментом для многих исследовательских вопросов.
Значение по отношению к существующим методам
С возобновлением интереса к синтетической эмбриологии для моделирования аспектов эмбрионального развития регулярно используется несколько подходов ex vivo и in vitro. Например, 2- и 3-мерные гаструлоиды, состоящие из мышиных или эмбриональных / индуцированных плюрипотентных стволовых клеток, могут быть соучены путем применения экзогенных сигнальных молекул для рекапитуляции некоторых паттернов и/ или морфогенетических событий гаструляции, сегментации и нейруляции33,34,35,36,37 . Несмотря на есть мощные, эти методы требуют трудоемких и длительных методов культивирования как для непрерывного поддержания плюрипотентных стволовых клеток, так и для выращивания гаструлоидов, которым требуется много дней, чтобы достичь стадий гаструляции. Напротив, экспланты рыбок данио не требуют поддержания культур стволовых клеток, так как эмбрионы просто собираются по мере необходимости. Они относительно просты в генерации и достигают стадий гаструляции в течение нескольких часов, так же, как эмбрионы рыбок данио. Это подчеркивает еще одно преимущество эксплантов рыбок данио, их неповрежденные часы развития. Поскольку возраст развития эмбриональных и индуцированных плюрипотентных стволовых клеток может быть переменным и весьма обсуждаемым, эмбриональные экспланты, возможно, лучше подходят для исследования временной регуляции развития. Наконец, в то время как экспланты пескоидных рыбок данио (которые содержат эмбриональный край) аналогичным образом распространяются в культуре12,13,они делают это в ответ на эндогенные сигнальные центры. Вместо этого экспланты, описанные здесь, позволяют исследователям исследовать молекулы, представляющие интерес, с относительно небольшим вмешательством от таких эмбриональных сигналов.
Потенциальные будущие применения
Здесь экспланты были использованы, чтобы продемонстрировать, что узловая сигнализация необходима и достаточна для морфогенеза C & E. Тем не менее, ожидается, что они могут и будут использоваться для определения роли многих различных молекул во многих других процессах развития, например, регуляции экспрессии генов, сигнальных градиентов и дополнительных морфогенетических программах. Кроме того, поскольку эти экспланты жизнеспособны по крайней мере до 24 л.с.19, можноожидать, что их полезность будет выходить за рамки гаструляции в такие процессы, как сегментация и органогенез, любой процесс, в котором исследователи хотят получить чистый лист развития.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана NICHD R00HD091386 для MLKW и NIEHS T32ES027801 для AAE.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mm glass beads | Millipore-Sigma | Z250473 | |
| 4% Paraformaldehyde | VWR | J19943-K2 | |
| 6-well plates | Fisher | FB012927 | |
| Agarose | Thermo-Fisher | 16500500 | |
| Ca(NO3)2 .4H2O | Thermo-Fisher | 12364-36 | |
| DMEM/F12 media | Gibco | 11330032 | |
| Dumont #5 watchmakers forceps | World Precision Instruments | 500341 | |
| Embryo injection mold | Adaptive Science Tools | I-34 | |
| Glass crystalizing dishes | Fisher | 08-741A | |
| Glass Petri dishes | Fisher | 08-748A | |
| HEPES | VWR | JT4018-1 | |
| Instant Ocean sea salts | Instant Ocean | SS15-10 | |
| KCl | VWR | BDH9258-500G | |
| Low temperature incubator | Fisher | 15-015-2632 | |
| MgSO4.7H2O | VWR | 97062-134 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | M3301R | |
| Micrometer | SPI supplies | 02265-AB | |
| Mineral oil | VWR | MK635704 | |
| NaCl | VWR | BDH9286-500G | |
| Newborn Calf Serum | Invitrogen | 26010-066 | |
| Pasteur pipettes | Fisher | 13-678-30 | |
| Penicillin-Streptomycin Solution | Thermo-Fisher | 15140122 | |
| Pico-pump pneumatic injector | World Precision Instruments | SYS-PV820 | |
| Pipet pump | Fisher | 13 683C | |
| Plastic Petri dishes 100 mm | Fisher | FB0875712 | |
| Plastic Petri dishes 60 mm | Fisher | FB0875713A | |
| Plastic wash bottles | Fisher | 03-409-10E | |
| Pronase | Millipore-Sigma | 10165921001 | |
| Tween-20 | VWR | 200002-836 |
Ссылки
- Green, J. B., New, H. V., Smith, J. C. Responses of embryonic Xenopus cells to activin and FGF are separated by multiple dose thresholds and correspond to distinct axes of the mesoderm. Cell. 71 (5), 731-739 (1992).
- Sudarwati, S., Nieuwkoop, P. D. Mesoderm formation in the anuranXenopus laevis (Daudin). Wilhelm Roux Archiv fur Entwicklungsmechanik der Organismen. 166 (3), 189-204 (1971).
- Gurdon, J. B., Fairman, S., Mohun, T. J., Brennan, S. Activation of muscle-specific actin genes in Xenopus development by an induction between animal and vegetal cells of a blastula. Cell. 41 (3), 913-922 (1985).
- Keller, R., Danilchik, M. Regional expression, pattern and timing of convergence and extension during gastrulation of Xenopus laevis. Development. 103 (1), 193-209 (1988).
- Ariizumi, T., et al. Isolation and differentiation of Xenopus animal cap cells. Current Protocols in Stem Cell Biology. , (2009).
- Asashima, M., Grunz, H. Effects of inducers on inner and outer gastrula ectoderm layers of Xenopus laevis. Differentiation. 23 (3), 206-212 (1983).
- Jones, E. A., Woodland, H. R. Development of the ectoderm in Xenopus: tissue specification and the role of cell association and division. Cell. 44 (2), 345-355 (1986).
- Keller, R. E. Vital dye mapping of the gastrula and neurula of Xenopus laevis. I. Prospective areas and morphogenetic movements of the superficial layer. Developmental Biology. 42 (2), 222-241 (1975).
- Sokol, S., Wong, G. G., Melton, D. A. A mouse macrophage factor induces head structures and organizes a body axis in Xenopus. Science. 249 (4968), 561-564 (1990).
- Thomsen, G., et al. Activins are expressed early in Xenopus embryogenesis and can induce axial mesoderm and anterior structures. Cell. 63 (3), 485-493 (1990).
- Howard, J. E., Smith, J. C. Analysis of gastrulation: different types of gastrulation movement are induced by different mesoderm-inducing factors in Xenopus laevis. Mechanisms of Development. 43 (1), 37-48 (1993).
- Fulton, T., et al. Axis specification in Zebrafish is robust to cell mixing and reveals a regulation of pattern formation by morphogenesis. Current Biology. 30 (15), 3063-3064 (2020).
- Schauer, A., Pinheiro, D., Hauschild, R., Heisenberg, C. -. P. Zebrafish embryonic explants undergo genetically encoded self-assembly. eLife. , 55190 (2020).
- Oppenheimer, J. M. The development of isolated blastoderms of Fundulus heteroclitus. The Journal of Experimental Zoology. 72 (2), 247-269 (1936).
- Trinkaus, J. P., Drake, J. W. Exogenous control of morphogenesis in isolated Fundulus blastoderms by nutrient chemical factors. The Journal of Experimental Zoology. 132 (2), 311-347 (1956).
- Grinblat, Y., Lane, M. E., Sagerström, C., Sive, H. Analysis of zebrafish development using explant culture assays. Methods in Cell Biology. 59, 127-156 (1999).
- Sagerström, C. G., Grinblat, Y., Sive, H. Anteroposterior patterning in the zebrafish, Danio rerio: an explant assay reveals inductive and suppressive cell interactions. Development. 122 (6), 1873-1883 (1996).
- Sagerström, C. G., Gammill, L. S., Veale, R., Sive, H. Specification of the enveloping layer and lack of autoneuralization in zebrafish embryonic explants. Devolopmental Dynamics. 232 (1), 85-97 (2005).
- Xu, P. F., Houssin, N., Ferri-Lagneau, K. F., Thisse, B., Thisse, C. Construction of a vertebrate embryo from two opposing morphogen gradients. Science. 344 (6179), 87-89 (2014).
- Williams, M. L. K., Solnica-Krezel, L. Nodal and planar cell polarity signaling cooperate to regulate zebrafish convergence and extension gastrulation movements. eLife. 9, (2020).
- de Olivera-Melo, M., Xu, P. F., Houssin, N., Thisse, B., Thisse, C. Generation of ectopic morphogen gradients in the Zebrafish blastula. Methods in Molecular Biology. 1863, 125-141 (2018).
- Sepich, D. S., Calmelet, C., Kiskowski, M., Solnica-Krezel, L. Initiation of convergence and extension movements of lateral mesoderm during zebrafish gastrulation. Devolopmental Dynamics. 234 (2), 279-292 (2005).
- Gritsman, K., et al. The EGF-CFC protein one-eyed pinhead is essential for nodal signaling. Cell. 97 (1), 121-132 (1999).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Spemann, H., Manngold, H. Uber inducktion von embryoalanlangen durch implantation artfremder organisatoren. Archiv für mikroskopische Anatomie und Entwicklungsmechanik. 100, 599-638 (1924).
- Mangold, O. Über die Induktionsfähigkeit der verschiedenen Bezirke der Neurula von Urodelen. Naturwissenschaften. 21 (43), 761-766 (1933).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Agathon, A., Thisse, C., Thisse, B. The molecular nature of the zebrafish tail organizer. Nature. 424 (6947), 448-452 (2003).
- Tacke, L., Grunz, H. Close juxtaposition between inducing chordamesoderm and reacting neuroectoderm is a prerequisite for neural induction in Xenopus laevis. Cell Death and Differentiation. 24 (1), 33-43 (1988).
- Swanhart, L. M., et al. Characterization of an lhx1a transgenic reporter in zebrafish. The International Journal of Developmental Biology. 54 (4), 731-736 (2010).
- Williams, M. L. K., Solnica-Krezel, L. A mesoderm-independent role for Nodal signaling in convergence & extension gastrulation movements. BioRxiv. , (2019).
- Londin, E. R., Niemiec, J., Sirotkin, H. I. Chordin, FGF signaling, and mesodermal factors cooperate in zebrafish neural induction. Developmental Biology. 279 (1), 1-19 (2005).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Veenvliet, J. V., et al. Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science. 370 (6522), (2020).
- Beccari, L., et al. Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids. Nature. 562 (7726), 272-276 (2018).
- Moris, N., et al. An in vitro model of early anteroposterior organization during human development. Nature. 582 (7812), 410-415 (2020).
- vanden Brink, S. C., et al. Single-cell and spatial transcriptomics reveal somitogenesis in gastruloids. Nature. 582 (7812), 405-409 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены