Method Article
ゼブラフィッシュ胚からのナイーブ・ブラストデム・エクスプラントの生成
要約
ゼブラフィッシュ・ブラソドルム外植は、初期胚内の内在性シグナル伝達センターから胚細胞を単離することによって生成され、比較的ナイーブな細胞クラスターを容易に操作し、 培養したex vivo。この記事では、このような外植を作るための手順を提供し、ガストルの間にNodalシグナリングの役割を尋問することによって、その有用性を示しています。
要約
その光学的明瞭さと急速な発達のために、ゼブラフィッシュ胚は細胞行動および発達過程を調べるための優れたシステムである。しかし、胚シグナルの複雑さと冗長性のために、初期胚発生時に単一のシグナルの完全な役割を見分けることは困難です。ゼブラフィッシュブラストドームの動物領域を出植することにより、胚細胞の比較的ナイーブなクラスターが生成され 、ex vivoを容易に培養および操作することができる。排泄前にRNA注入によって関心のある遺伝子を導入することで、この分子が遺伝子発現、細胞挙動、および他の発達過程に及ぼす影響を相対的に単離して評価することができます。さらに、異なる遺伝子型または条件の胚由来の細胞を単一のキメラ外植物で組み合わせて、細胞/組織相互作用および組織特異的遺伝子機能を調べることができます。この記事では、ゼブラフィッシュブラソドームエクスプラントを生成するための指示を提供し、単一のシグナル伝達分子であるNodalリガンドが、それ以外のナイーブ胚組織で生殖層形成および拡張形態形成を誘導するのに十分であることを実証する。単純な ex vivo システムにおける胚細胞の挙動、モルフォゲン勾配、遺伝子発現パターンを再現する能力により、これらの外植は多くのゼブラフィッシュ研究者にとって大きな有用性であると予想されています。
概要
発生生物学分野の多年生の目標は、動物の形態と機能の起源を理解するために胚を開発することの複雑さを解明することです。初期の胚でさえ、シグナル伝達分子、細胞および組織相互作用、および機械的力の複雑なメドレーを含み、すべて厳格な空間的および時間的調節の対象となる。このため、特定のシグナルの正確な役割を、目的の発達過程で正確に特定することはしばしば困難です。胚組織を内因性環境から取り除くことで、胚の排泄物は、相対的な孤立で個々の組織および分子の発達的役割を識別する簡素化されたプラットフォームを作成する。排泄技術は、おそらくゼノプス・ラエビスで最もよく知られており、組織誘導、細胞シグナル伝達、細胞接着、形態形成を研究するために使用されてきた。いわゆる動物のキャップの外植は、芽期ゼノプス胚の動物領域が誘導相互作用5、6、7の前に単離される、広範囲にわたる強力な外植技術である。操作されていない動物の帽子は、エクトダーム7、8になる運命にある。それでも、それらはいくつかの誘導因子に応答し、3つの胚芽層すべての組織を形成し、組織に適した形態学的運動9、10、11を受けることを可能にする。しかし、限られた遺伝的ツールと生画像のための最適でない適合性は、多くの発達生物学者のためのゼノプス動物キャップの外植の使用を防ぎます。ゼブラフィッシュ胚からブラストデラム細胞を植え出すことによって、研究者は動物キャップアッセイの有用性と光学的明瞭さ、遺伝的ツールの豊富さ、およびゼブラフィッシュモデルシステムの他の実験的利点を組み合わせることができます。
現在までに、研究者はゼブラフィッシュの外植の2つの味を利用してきました:いわゆるペスコイドとブラソデアルフ植物。ペスコイドモデルにおいて、限界帯を含む全ブラソダームは、卵黄から単離され、胚外卵黄間膜(YSL)12,13を伴わずにex vivoを発症させる。このように、ペスコイドは、ジェーン・オッペンハイマーとJ.P.トリンカウス14、15によって数十年前に生成されたFundulusの外植木に顕著に似ています。これらの外植は、胚パターン形成および形態形成12,13の多くの側面を再現する。しかし、これらの分離株には内因性シグナル伝達センター(胚性マージン)が含まれているため、その分子ミリューに関しては単純化されません。あるいは、研究者は、限界ゾーン16、17、18、19、20、21を除外することによって、比較的ナイーブなゼブラフィッシュブラストワルムの植物を生成することができます。未操作のゼブラフィッシュブラソドルム外植は、高レベルの骨形態形成タンパク質(BMP)モルフォゲン19を発現し、ex vivo18を培養した場合に非神経外胚葉およびエンベロープ層(EVL)を生じさせる。しかし、これらは、ゼノプス動物のキャップに似た外因性シグナル伝達勾配19、20、21に応答して、軸パターニングおよび形態形成の多くの側面を再現する。このため、blastoderm外植木は、胚葉層の仕様、形態遺伝学的細胞の動き、および単純化されたシグナル伝達環境におけるシグナル伝達勾配における特定のモルフォゲン(またはモルフォゲン)の役割を研究する有利なモデルである。さらに、異なる遺伝子型または条件の胚からの芽胚を単一のキメラ外植19、21に組み合わせて細胞/組織の自律性および誘導相互作用を調べることができる。
ゼブラフィッシュブラストドーム外植は、胃の間の形態形成および組織仕様における胚シグナル(例えば、Nodal)の役割を調べるのに使用することができる。単細胞段階で合成 ndr2 RNA(節線リガンドをコードする)を注入することにより、胚の胚を通して、節線シグナル伝達が活性化される。これらの胚からの外植は、結節シグナル伝達勾配を生成し、3つの胚層すべてを形成し、無傷の胚20に見られるように収束および拡張(C&E)胃運動を受ける。さらに、キメラ外植は、未注入(ナイーブ)ブラソドラムから神経切除を誘導する中胚葉組織の能力を説明するために使用される。このプロトコルは、ゼブラフィッシュブラストワルム外植体を作成するための指示を提供し、組織誘導および形態形成における節電シグナル伝達の役割を定義する際の有用性を示す。
プロトコル
1 試薬と消耗品の準備
- 試薬製剤
- 3x Danieauの溶液を500mL用意する(ソリューション1、表1)。
- 卵水1Lを準備する(溶液2、表1)。
- 卵水にアガロースの1.2%溶液を調製します。電子レンジでアガロースを完全に溶かし、水浴で55°Cに冷却します。
- 4 mL外植培地を用意(溶液3、表1、19,21)からわずかに変更した実験条件で調製する。
注:必要な体積を計算する際には、注入されていない(または注入されたコントロール)胚からの外植の少なくとも1つの井戸を考慮してください。- 70%エタノールでワークスペースを消毒します。
- 4°Cから細胞培養培地を取り除き、70%エタノールでスプレー/ワイプします。
- 胚を注入しながら、外植培地を作り、28.5°Cインキュベーターに温める。
注:ステージング目的のために、年齢に一致した無傷の兄弟胚を常に含めます。これらの胚をデコール化し、0.3xダノー溶液中のアガロースコーティングされたプレート上で培養する(溶液4、表1)。
- プロナーゼアリコート(20mg/mLで1 mL)を-20°Cから取り除き、氷の上で解凍します。3つの実験条件ごとに1つの1 mLアリコートを解凍する。
- アガロースプレートを準備する
- 射出プレートを作ります。
- 卵水に溶融アガロースを半方で100ミリメートル×15ミリメートルプラスチックペトリ皿を埋めます。
- 溶けたアガロースの上に緩やかに射出金型を45°の角度で置き、徐々にアガロースに下げ、泡が下に閉じ込められないようにします。完全に冷やしましょう。
- 金型を取り外します。すぐに使用するか、卵水2mLを加えて、プレートを包み、4°Cで保存して保存してください。 28.5°Cインキュベーターで15~30分間プレートを温めてから、注入します。
- 外植の切断プレートを作ります。
- 60mm x 15mmのペトリ皿に溶けた1.2%アガロースを3mL加え、井戸の底全体がコーティングされていることを確認します。完全に冷やしましょう。
- アガロースで培養プレートをコーティングします。
- 各実験条件について、卵水中の1mLの1mLを卵水中の1つのウェルウェルに分配し、ウェルの底全体がコーティングされていることを確認します。完全に冷やしましょう。
- キメラの外植を作るために、60 mm x 15 mm ペトリ皿で溶けたアガロースに 1 2 mm ガラスビーズを加えて、小さい井戸を使った外植加工皿を作ります。アガロースが完全に冷めたら、鉗子でビーズを取り除きます。
- 射出プレートを作ります。
2 RNAで胚を注入する
- 手袋を着用し、-80°Cで貯蔵から合成 ndr2 mRNAのアリコートを取り除き、すぐに氷の上に置きます。
- 注射針を準備します。
- 引っ張られたガラスの毛細血管の針にRNAを入れます。充填した針をマイクロマニピュレータに入れ、針の先端を鉗子で割ります。
- ミネラルオイルの滴でステージマイクロメーターを使用して注入量を校正し、空気圧インジェクターの注入時間と圧力を調整して、所望の大きさのボーラスを達成します。直径120μmのボーラスは1nLの体積を有する。
注:ボーラスの所望の体積は、RNAの濃度と胚あたりの所望の用量に依存します。例えば、RNAが10 ng/μLでアリクォートされている場合、1 nLを注入して10pgの最終量を達成します。- RNA針の先端を注入する準備ができるまで油に沈めておきます。
- 胚をロードし、注入します。
- 飼育タンクで仕切りを引き、魚が10〜15分間産卵し、ティーストレーナーを使用して胚を収集します。
- パスツールピペットとピペットポンプを使用して胚を注入プレートにロードし、手袋をした指を使って卵をトラフにそっと押し込みます。
- 所望の数の胚に達するか、胚が分裂し始めるまで、単細胞胚の黄身に10pg ndr2 RNAを注入する。
注:単細胞段階の後に注入して、胚全体のRNAの均一な分布を確保しないでください。 - 注射プレートから胚を、絞り瓶から卵水の穏やかな流れでラベル付きの100 mm x 15 mmペトリ皿に洗い出します。
注: 常に、年齢に一致する、注入されていない兄弟のグループをコントロールとして保持します。 - 128細胞の段階に到達するまで、胚を28.5°Cインキュベーターに入れる。未受精卵と死んだ胚を皿から取り除きます。
3 胚をデコールネイトする
- 胚が128細胞の段階に達したら、ラベル付きガラスペトリ皿に入れ、そこからできるだけ多くの卵水をデカントします。
- ラボテープ(小さな皿の名前に対応)でガラス結晶皿にラベルを付け、卵の水で道の2/3を埋めます。迅速なアクセシビリティのために解剖顕微鏡の隣にこれらの料理を置きます。
- 50 mL 円錐管に3x ダノー溶液の 15 mL にプロナーゼストック (20 mg/mL, 氷の上で解凍) を 1 mL 加えます。
注: この量は、最大 3 つの実験条件で十分です。追加の外植条件のためのプロナーゼと3xダニアウのソリューションの量を増やします。
注意:プロナーゼは刺激性です。したがって、取り扱い時に手袋を着用してください。 - 胚を含む各ガラスペトリ皿にプロナーゼ溶液の少なくとも5 mLを追加します。
- ガラス皿を円形の動きで攪拌し、解剖顕微鏡の下で一貫してデコール化の進行を監視する。
- コリオンがしわになり始め、1〜2個の胚がコリオンから出たら、プロナーゼと胚を含むガラスペトリ皿を卵水を含む対応するガラス結晶皿に慎重にダンクします。
- デコリオネート胚を洗う。
- 卵水で胚を3回洗い、卵水を軽く加えてから皿からデカンをします。
- 3回目と最後の洗浄は、0.3xダニアウのソリューションです。
注:胚が洗浄後もまだ経合部を持っている場合は、骨が取り除かれるまで胚を穏やかにピペット化するか、洗浄物(卵水または0.3xダニアウの溶液)に1〜2分間座らせ、円形の動きで穏やかに攪拌します。
- ペトリ皿の蓋でデコリオネート胚を覆い、256細胞の段階に達するまでインキュベーター(28.5°C)に戻します。
4 切り出し
- アガロースコーティングされた60mm x 15mmのペトリ皿に3xダニアウの溶液を充填します。
- 胚が256細胞の段階になったら、3xダニアウの溶液を含むアガロースコーティングされたプレートに移し、皿の中央に沿って並べます。
- 鉗子を使って外植を切る(図1)。
- 一対の鉗子を使用して、閉じた状態で、胚を安定化させ、もう一方を使用して(マージンから動物の極まで)、その高さの約半分でブラストドラムを切断する(図1A)。
- 切断するには、1組の鉗子でブラストデrm細胞を軽く絞ります。次に、安定化鉗子を取り、他の鉗子に沿ってそれらを実行して、blastodermを横切ってほぼ半分にスライスします(図1B)。
- 胚を回転させ、鉗子を既存の切り取りに入れ、残りのブラソドナルを最初の切り抜きに切断する(図1C)。
- 3xダニアウの溶液に外植物を少なくとも5分間保ち、アガロースでコーティングされ、4 mLの外植培地で満たされた6ウェルプレートの井戸に移します。
注: 負のコントロールとして、注入されていない (またはコントロールが挿入された) 兄弟から外植を切り取ります。外植が正しく行われれば、これらの外植は内胚葉、中胚葉、または神経外胚葉のマーカーを拡張も発現もしない。 - 必要なタイムポイント/ステージ(無傷の兄弟から決定される)に達するまで、外植培養プレートを28.5°Cインキュベーターに入れます。
注:低分子阻害剤などの化合物で外植物を処理する場合、所望の濃度は、所望の時点でウェル内の外植培地に直接添加することができます。濃度を計算する際には、アガロースの体積を含める必要があります。(例:1 mLアガロース+4 mL外植培地=井戸当たり総容積5mL)。
5 キメラエクスプランツの準備
- 通常のアガロースコーティングプレートの代わりに、アガロースを11mmガラスビーズを使用して12の小さな浅い井戸に成形した皿の中でキメラの外植木をカットします(セクション1.2.4)。このプレートに3xダニアウの溶液を入れなさい。
注:キメラ外植は、異なる遺伝子型または条件の2つの胚の芽細胞から生成されます。トランスジェニックまたは注入された蛍光マーカーの発現により、これらの条件を互いに区別できることを確認してください。- 1つの遺伝子型/条件の12個の胚をプレートの左側に、もう1つの遺伝子型/条件の12個の胚をプレートの右側に追加して準備します。
- 各条件の1つの胚をプレートの中央に、12の井戸の1つの近くに移動します。
- 鉗子を使用して、単一胚の外植体について説明したように、各胚から外植を切断する(ステップ4.3)。
- 2つの外植のカットエッジを、鉗子を使用して浅い井戸内で一緒に押し、2つの半分を単一の外植に一緒に癒すことができます。
- プレート内の残りの11個の井戸を続けます。外植が癒されたら、アガロースでコーティングされ、4 mLの外植培地で満たされた6ウェルプレートの井戸に移します。必要な数の外植が達成されるまで繰り返します。
6 固定外植の文化や画像
- 28.5°Cインキュベーター中の培養は、そのままの兄弟胚が所望の段階に達するまでである。
- ライブ外植は、連続的なタイムラプスイメージングのために取り付けたり、培養期間を通して定期的にイメージングしたり、実験エンドポイントでライブ画像化することができます。
- 必要に応じて、外植を修正します。外植が所望のエンドポイントに到達したら、無傷の胚兄弟の段階に注意し、PBSで4%パラホルムアルデヒドの1 mLを有するガラスシンチレーションバイアルに外植を置く。4°Cのシェーカーで一晩固定します。
注意:パラホルムアルデヒドは有毒です。この化学物質を取り扱う際には手袋を着用し、各機関が承認した方法で処分してください。- 固定後、6回、15分ずつPBS+0.1%Tween-20で外植をすすいで、徐々にメタノールに脱水する。外植体を-20°Cで保存し、後で全マウント をその場でのハイブリダイ ゼーション、免疫蛍光染色などで分析します。
結果
節成子は、ゼブラフィッシュブラストドームの胚芽の形成とC&Eを駆動します
未注入の野生型(WT)胚から切り取られた外植体または緑色蛍光タンパク質(GFP)をコードするmRNAの50pgを注入したものを切り取った対照は、培養期間を通して丸みを帯びたままであった(図2A-C)、メソダーム、内胚、または神経切除物のマーカーを発現できなかった(図3C)20。これらは一緒に、脊椎動物の胃の特徴を示す形態形成および生殖層形成の欠如を示す。しかしながら、10pgのndr2 mRNAを注入した胚から切り取られた外植は培養で8-9時間後に非常に細長くなった(図2D)。これらの外植体の生きたタイムラプスイメージングは、微分干渉対照(DIC)顕微鏡による、受精後8時間前後の延長発症(hpf)(図2F)を、C&E形態形成が無傷のゼブラフィッシュ胚22で始まるのと同じ時間であることを明らかにした。必須tdgf1 Nodal共受容体23を欠くMZoep-/-胚から切り取られた外植は、ndr2注射に応答して伸びることができなかった(図2E)、このエキソビボ形態形成に対してNodal活性が重要であることを示した。また、インジツハイブリゼーションにおける全実装は、ndr2-発現エキスプラントが神経切除膜(sox2)およびいくつかの中胚性サブタイプ(tbxta、noto、tbx16)(図2G)、ならびにエンドドームおよび胚性オーガナイザー20の発現マーカーであることをさらに示した。
節点シグナル伝達は、中皮による神経切除誘発には必要ない
節点シグナリング活性は、内胚葉および最中胚葉の誘導に不可欠であるが、ゼブラフィッシュガストルラー23、24内の神経切除剤仕様に対して欠かせない。未注入のゼブラフィッシュブラソドラム外植は神経切除に分化しなかったが(図3C18)、10pg ndr2を注入した胚からの外植は、外植の長い軸に沿った明確なストライプで神経切除マーカー sox2の強い発現を示した(図2G)、神経摘出胚形成exvivoに対して結節活性が必要であることを示している。長い間、中胚葉組織は、ゼブラフィッシュの芽球体17を含む神経組織25、26、27、28、29を誘導できることが知られている。しかし、この外植系における神経外発性の形成が、結節シグナル伝達を直接必要とするのか、あるいは外因性の結節リガンドが中皮を誘導し、神経組織を二次的に誘導するのかは不明である。
2つの異なる胚からの前向きのメソダームおよび神経切除胚部分を含むキメラ外植体を生成し、神経外胚形成仕様ex vivoに対して組織自律的に、能節シグナル伝達が必要かどうかを試験するために生成された。各外植体の中胚部分を、中胚特異的トランスジェニックGFPレポーターを発現する他のWT胚から切断した、Tg[lhx1a:eGFP]30、高用量(100pg)のndr2を注入した(図3A)。各外植の推定神経切除体部分は、コントロールWT胚またはノーダルシグナル欠損MZoep-/-胚から切り取られ、蛍光核マーカーH2B-RFPをコードするmRNAのみを注入した(図3A)。各キメラ外植物は、これら2つの条件のそれぞれから1つのブラソドアルを組み合わせることによって生成され、12hpfでのその場での全実装による組織特異的マーカーの発現についてアッセイした。
100pg ndr2を注射した胚からの単胚外植の大部分は、ほとんどまたは全くsox2を発現し、tbxtaおよびlhx1a:gfpレポーター-explantを含む中胚のマーカーを発現した(図3B,G)。未注入WTブラソデラム(キメラ外植の前向きの神経切除部を含むタイプ)は、単一の外植物として培養した場合に中胚葉マーカーもsox2も発現せず、神経切除および中胚葉の欠如を示す(図3C、H)。MZから単胚の外植体-/-胚は同様に、ndr2を注入しても神経切除および中胚マーカーの両方の発現を欠いていた(図3D)。しかし、未注入のWTブラソダームを、高用量のノダルリガンドによって誘導された中胚葉と組み合わせた場合、これらのキメラ外植は中胚葉マーカーとsox2の両方を強く発現させた(図3E、I)。これらの結果は、以前に観察された17、26、27、29のように、中皮が非神経外発性になる細胞の神経運命を誘導できることを示している。これらの外発植物の将来の神経外胚の部分内で結節シグナル伝達が直接必要かどうかをテストするために、キメラ外植は、MZoep-/-胚から100 pg ndr2とblastodermsを注入したWTブラストドームから作成された(図3J)。隣接する中胚葉部から節線信号を受信することができないにもかかわらず、これらの外植はWT対照キメラと同様の程度にsox2を発現した(図3F)。この結果は、神経組織が能節活性の無い場合に指定される無傷の胚と一致することを示すが、神経切除誘導ex vivoに対しては、節線シグナル伝達は組織自律的に必要とされない。
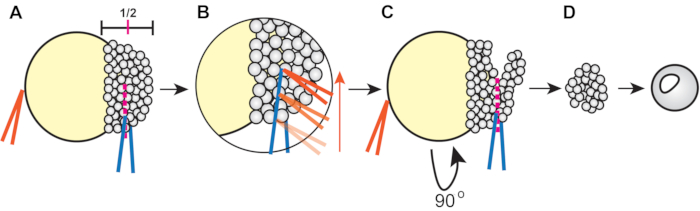
図1:ゼブラフィッシュのブラストデアルム排泄物の手順(ステップ4.3)(A)は、非支配的な手(オレンジ)に鉗子を保持し、胚を安定させるために、優勢な手の鉗子(青)の鉗子を使用して胚を安定させます。(B) 胚をつかんで胚を握る青い鉗子の端に沿ってオレンジ色の鉗子を走らせ、最初のカットがブラソドアルムのおよそ半分に達するように胚をスライスする。(C)胚を90°回転させ、青い鉗子を元の切り取り(ただし直交)に置き、残りのブラソドドルムを切断するピンチ。(D) 外植培地に移す前に、3xダニアウの溶液中で約5分間、溶出した芽細胞を治癒させる。この図の大きなバージョンを表示するには、ここをクリックしてください。
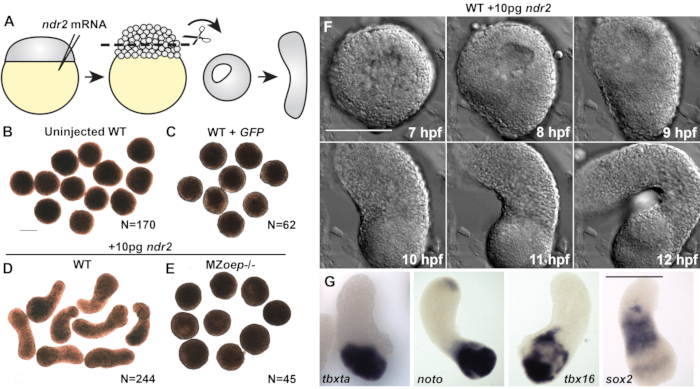
図2(20から改変):節状リガンドはゼブラフィッシュ胚葉のC&E形態形成および胚層形成を促進する。 (B-E)2-4スマイトステージに相当する示された条件/遺伝子型のライブブラストドアルム外植の代表的な明視野画像。N = 2 から 4 つの独立した試験の外植の数。(F)10 pg ndr2 RNAを注入したWT胚からの代表的な外発植物のタイムラプスDICシリーズ。(G)10 pg ndr2 RNAを注入したWT胚からの外植体に示された転写物に対するその場での全実装のハイブリダイゼーションの代表的な画像。スケールバーは200 μmです。
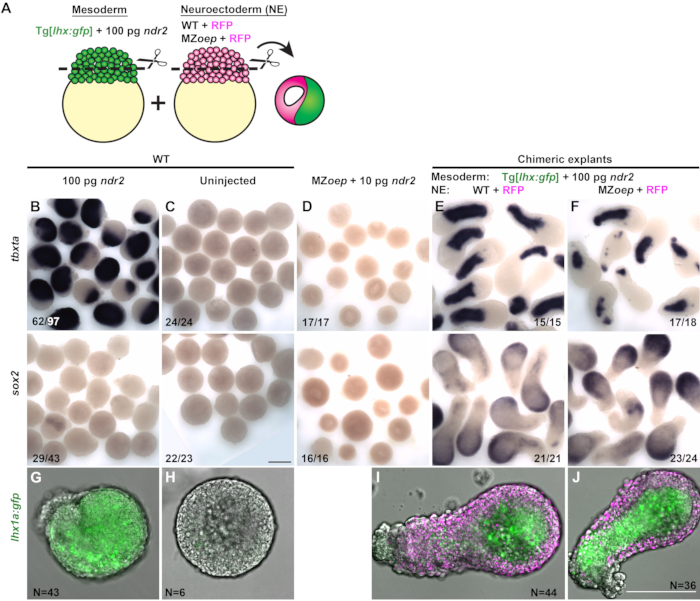
図3(31から改変):キメラ外植は、神経切除物の仕様は、組織自律的な節門シグナル伝達ex vivoを必要としないことを明らかにする。(B-F)100 pg ndr2 RNA(B)を注入したWT胚の外植植物における中胚マーカー tbxta(上)および神経切除マーカー sox2(下)のインザクチムハイブリダイゼーションにおける全型マウント(C)、MZoep-/--10 pg ndr2(D)、およびWT-MZから神経切除植物を含むキメラ外草を注入したWT胚からの外植子)2-4のスマイト段階に相当する胚。分数は、検査した外植の総数に対して表現型を示す外植体の数を示します。(G-J)単一胚(G-H)からの生きたTg[lhx1a:gfp]の外植物の代表的な画像は、2-4スマイトステージに相当する条件で示される条件のH2B発現ブラストルム(I-J、マゼンタ)と組み合わせたものである。N = 3つの独立試験からの外植の数。スケールバーは200 μmです。
| 解決策 1 | 解決策 2 | ソリューション 3 | ソリューション 4 | |
| 解決 | 3xダニアウの | 卵水 | エクスプラントメディア | 0.3x ダニアウの |
| ざいりょう | 174 mM ナクル | 海塩 60 μg/mL | DMEM/F12 + 2.5 mM L-グルタミンおよび15 mM HEPES | 17.4 mM ナクル |
| 2.1 mM KCl | 1 L 蒸留水 | 新生児子牛血清または胎児牛血清の総容積3% | 0.21 mM KCl | |
| 1.2 mM MgSO4.7H2O | 1:200 ペニシリン(50単位/mL)-ストレプトマイシン(50 μg/mL) | 0.12 mM MgSO4 •7H2O | ||
| 1.8 mM Ca(NO3)2 •4H2O | 0.18 mM Ca(NO3)2 •4H2O | |||
| 15 mM ヘペス | 例: | 1.5 mMヘペス | ||
| 蒸留水 | 4 mL/条件 x 9 条件 = 36 mL | 蒸留水 | ||
| 1.08 mL 新生児子牛血清(NCS、-20 °Cでアリクォート(3%) | ||||
| 0.18 mL 200xペンストレップ(PS、-20°Cで引用)(1:200) | ||||
| 35 mL DMEM/F12 |
表 1.
ディスカッション
この記事では、ゼブラフィッシュブラストドードルフ外植を生成する方法を説明し、これらの外植体の2つの実用的なアプリケーションを議論し、ガストルでのNodalモルフォゲンシグナル伝達の役割に対処する。この外植体の切断および培養の方法は、RNA注射を使用して操作し、対象となる分子経路を調査するために低分子化合物で処理することができるナイーブ細胞の空白のスレートを提供する。
重要なステップ
このプロトコルには、その成功のために特に重要な 4 つのステップがあります。1つ目は、胚に適切な量の節線を注入することです。このプロトコルは 、ndr2 RNAの10 pgを推奨し、用量の範囲は延長を促進するが、あまりにも多くまたは少なすぎるNodalは最適な外植延長20を防ぐだろう。第二のステップは、胚をデコリオネートすることです。胚があまりにも長くプロナーゼに残ると、黄身は破裂し、胚は切断できない。彼らは十分な長さプロナーゼにない場合は、コリオンは洗浄によって緩めず、代わりに時間のかかる手動デコール化を必要とします。第3の重要なステップは、外植を切断することです。0.3xダノーの溶液または卵水の低塩分は外植の治癒と生存を促進しないので、3x Danieauの溶液での切断が推奨されます。
さらに、細胞の素朴さを確保するために、外植はブラストドヴェルムの約半分の高さで切断する必要があります。卵黄に近づきすぎると、組織の仕様や形態形成を促進するマージン(内因性の節を含む)からの信号が含まれます。第4の重要なステップは、キメラ外植の治癒です。2つの外植は、カットエッジが切断された直後に穏やかに押し合わされない限り、キメラを形成するために融合しません。
変更とトラブルシューティング
上記の重要な手順は、トラブルシューティングの機会を提供します。いくつかの一般的な問題と提案された解決策を以下に示します。
伸び物が、節点シグナリングの存在下で伸びていない場合、いくつかの可能な解決策があります。(A) 単細胞段階で胚を注入し、RNAが胚全体に均等に分散されるようにする。(B)注入された量がマイクロメーターを使用して注入ボーラスを測定して正しいことを確認することによって、あまりにも多くの 節点 RNAを注入することを避ける。(C)分解していないことを確認するために、その濃度を測定することによってあまりにも少ない 節点 RNAを注入しないでください。(D)一部の年齢に一致した無傷の兄弟を維持し、外植の同等の段階を推測する。排泄物は、無傷の兄弟が2-5のスマイト段階に達すると最大の延長を達成する。外植が早く収集されると、最適な拡張に達しません。
黄身がデコール化後に破裂し、胚が切断できない場合は、コリオンがクリンクルし始め、1〜2個の胚が絨毛を流すと、胚をプロナーゼ溶液から取り除く。その後、すぐに卵水ですすいます。
外植木がエッジの周りに陽気に見える場合は、いくつかの解決策があります。(A) 開発の特定の期間内にのみ外植物をカットします。128〜1000細胞段階の任意の段階で切断された外植は生き残り、培養で伸びることができますが、256〜512細胞段階で切断されたものは最も堅牢である傾向があります。(B) 適切な治癒を確実にするために、外植物を3倍のダニオーの溶液で切断するようにしてください。(C)外植をきれいに、しかし穏やかに切る。切断プロセス中に細胞を伸ばしたり引き離したりしないでください。
未注入のコントロールの外植物が伸びている場合、外植は黄身に近づきすぎた可能性が高い。外植植物がナイーブになるようには、カットが黄身とブラストドゲルムの上部の中間に作られていることを確認してください。
キメラの外植体が融合できない場合、一度カットされた3xダニオーの溶液中の外植物の傾向は、切り上げてカットエッジを越えて治癒することである可能性が高い。2つのブラストダームが自分自身ではなく互いに治癒することを確実にするために、切断後すぐにそれらを一緒に押してください。鉗子を使用して、アガロース内の新しく結合したブラストアルムに穏やかな圧力をかけ、一緒に治癒するよう促します。
制限
これらの外植は、相対的な孤立における特定のモルフォゲン(または関心のある別の分子)の役割を研究するための貴重なツールですが、ex vivoモデルで行われた観察は注意して解釈する必要があります。外植は、生体内20で観察されたC&E形態形成と非常によく似ているが、例えばエピボリー運動など、胃の全ての側面を再現しない。彼らはまた、無傷の胚の中に存在する他の多くの調節因子およびシグナル伝達分子を欠いている。これは、外植の重要な実験的な利点であるが、それはまた、生体内で保持していない結論につながることができます.例えば、外因性の節状リガンドを受け取らない外植は神経外発性マーカーを発現しないため、神経外発性の仕様には、ノダルシグナル伝達が必要であると単独で結論付けることができます。しかし、神経切除は、全ての節線シグナル伝達23,24を欠いた無傷の胚内に形成され、神経仕様32における他のシグナル伝達分子の重要な役割を示す。外植は、孤立した環境でモルフォゲンが何ができるかを教えてくれます。それでも、結果を徹底的に解釈するためには、このようなすべての知見を無傷の胚と比較して確認する必要があります。言い換えれば、外植は発達中の胚の代わりをすることができない。代わりに、モルフォゲンと周囲との役割と関係を特定するための補助的なツールです。これらの制限を念頭に置いて、ゼブラフィッシュブラストワルムの外植は、多くの研究の質問のための貴重なツールです。
既存の方法に関する意義
合成発生学への関心が再び高まる中、胚発生の側面をモデル化するために、いくつかのex vivoおよびin vitroアプローチが定期的に採用されています。例えば、マウスまたはヒト胚性/誘導多能性幹細胞からなる2次元および3次元胃腸を同化することができ、外因性シグナル伝達分子の適用を通じて、ガストルレーション、セグメンテーション、およびうえ33、34、35、36、37のパターン形成および/または形態遺伝学的事象の一部を再現する.強力ではあるが、これらの方法は、多能性幹細胞を継続的に維持し、胃の成長に多くの日を要する胃腸を成長させるために、骨の折れる長期培養法を必要とします。対照的に、ゼブラフィッシュの外植は、胚が必要に応じて単に収集されるため、幹細胞培養の維持を必要としません。彼らはゼブラフィッシュ胚と同じ数時間以内に発芽し、胃の段階に到達することは比較的簡単です。これは、ゼブラフィッシュの外植、その無傷の発達時計のもう一つの利点を強調しています。胚性幹細胞および人工多能性幹細胞の発生年齢は可変的で議論が強いため、胚性外発植物は発達の時間的調節を調査するのにおそらく適している。最後に、ペスコイドゼブラフィッシュは、培養12、13において同様に伸びる(胚性マージンを含む)が、内因性シグナル伝達センターに応答して拡張する。代わりに、ここで説明する外植は、研究者がそのような胚シグナルからの比較的少ない干渉で関心のある分子を調査することを可能にする。
将来のアプリケーションの可能性
ここでは、C&E形態形成に対して節点シグナル伝達が必要かつ十分であることを実証するために外植を使用した。それでも、遺伝子発現の調節、シグナル伝達勾配、その他の形態遺伝学的プログラムなど、他の多くの発達過程における多くの異なる分子の役割を識別するために使用できることが期待されています。さらに、これらの外植体は少なくとも24 hpf19まで生存可能であるため、その有用性は、研究者が発達的なブランクスレートを望む任意のプロセスであるセグメント化および有機生成などのプロセスにガストルレーションを超えて広がることが期待できる。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
この作業は、NICHD R00HD091386からMLKW、NIEHS T32ES027801によってAAEにサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mm glass beads | Millipore-Sigma | Z250473 | |
| 4% Paraformaldehyde | VWR | J19943-K2 | |
| 6-well plates | Fisher | FB012927 | |
| Agarose | Thermo-Fisher | 16500500 | |
| Ca(NO3)2 .4H2O | Thermo-Fisher | 12364-36 | |
| DMEM/F12 media | Gibco | 11330032 | |
| Dumont #5 watchmakers forceps | World Precision Instruments | 500341 | |
| Embryo injection mold | Adaptive Science Tools | I-34 | |
| Glass crystalizing dishes | Fisher | 08-741A | |
| Glass Petri dishes | Fisher | 08-748A | |
| HEPES | VWR | JT4018-1 | |
| Instant Ocean sea salts | Instant Ocean | SS15-10 | |
| KCl | VWR | BDH9258-500G | |
| Low temperature incubator | Fisher | 15-015-2632 | |
| MgSO4.7H2O | VWR | 97062-134 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | M3301R | |
| Micrometer | SPI supplies | 02265-AB | |
| Mineral oil | VWR | MK635704 | |
| NaCl | VWR | BDH9286-500G | |
| Newborn Calf Serum | Invitrogen | 26010-066 | |
| Pasteur pipettes | Fisher | 13-678-30 | |
| Penicillin-Streptomycin Solution | Thermo-Fisher | 15140122 | |
| Pico-pump pneumatic injector | World Precision Instruments | SYS-PV820 | |
| Pipet pump | Fisher | 13 683C | |
| Plastic Petri dishes 100 mm | Fisher | FB0875712 | |
| Plastic Petri dishes 60 mm | Fisher | FB0875713A | |
| Plastic wash bottles | Fisher | 03-409-10E | |
| Pronase | Millipore-Sigma | 10165921001 | |
| Tween-20 | VWR | 200002-836 |
参考文献
- Green, J. B., New, H. V., Smith, J. C. Responses of embryonic Xenopus cells to activin and FGF are separated by multiple dose thresholds and correspond to distinct axes of the mesoderm. Cell. 71 (5), 731-739 (1992).
- Sudarwati, S., Nieuwkoop, P. D. Mesoderm formation in the anuranXenopus laevis (Daudin). Wilhelm Roux Archiv fur Entwicklungsmechanik der Organismen. 166 (3), 189-204 (1971).
- Gurdon, J. B., Fairman, S., Mohun, T. J., Brennan, S. Activation of muscle-specific actin genes in Xenopus development by an induction between animal and vegetal cells of a blastula. Cell. 41 (3), 913-922 (1985).
- Keller, R., Danilchik, M. Regional expression, pattern and timing of convergence and extension during gastrulation of Xenopus laevis. Development. 103 (1), 193-209 (1988).
- Ariizumi, T., et al. Isolation and differentiation of Xenopus animal cap cells. Current Protocols in Stem Cell Biology. , (2009).
- Asashima, M., Grunz, H. Effects of inducers on inner and outer gastrula ectoderm layers of Xenopus laevis. Differentiation. 23 (3), 206-212 (1983).
- Jones, E. A., Woodland, H. R. Development of the ectoderm in Xenopus: tissue specification and the role of cell association and division. Cell. 44 (2), 345-355 (1986).
- Keller, R. E. Vital dye mapping of the gastrula and neurula of Xenopus laevis. I. Prospective areas and morphogenetic movements of the superficial layer. Developmental Biology. 42 (2), 222-241 (1975).
- Sokol, S., Wong, G. G., Melton, D. A. A mouse macrophage factor induces head structures and organizes a body axis in Xenopus. Science. 249 (4968), 561-564 (1990).
- Thomsen, G., et al. Activins are expressed early in Xenopus embryogenesis and can induce axial mesoderm and anterior structures. Cell. 63 (3), 485-493 (1990).
- Howard, J. E., Smith, J. C. Analysis of gastrulation: different types of gastrulation movement are induced by different mesoderm-inducing factors in Xenopus laevis. Mechanisms of Development. 43 (1), 37-48 (1993).
- Fulton, T., et al. Axis specification in Zebrafish is robust to cell mixing and reveals a regulation of pattern formation by morphogenesis. Current Biology. 30 (15), 3063-3064 (2020).
- Schauer, A., Pinheiro, D., Hauschild, R., Heisenberg, C. -. P. Zebrafish embryonic explants undergo genetically encoded self-assembly. eLife. , 55190 (2020).
- Oppenheimer, J. M. The development of isolated blastoderms of Fundulus heteroclitus. The Journal of Experimental Zoology. 72 (2), 247-269 (1936).
- Trinkaus, J. P., Drake, J. W. Exogenous control of morphogenesis in isolated Fundulus blastoderms by nutrient chemical factors. The Journal of Experimental Zoology. 132 (2), 311-347 (1956).
- Grinblat, Y., Lane, M. E., Sagerström, C., Sive, H. Analysis of zebrafish development using explant culture assays. Methods in Cell Biology. 59, 127-156 (1999).
- Sagerström, C. G., Grinblat, Y., Sive, H. Anteroposterior patterning in the zebrafish, Danio rerio: an explant assay reveals inductive and suppressive cell interactions. Development. 122 (6), 1873-1883 (1996).
- Sagerström, C. G., Gammill, L. S., Veale, R., Sive, H. Specification of the enveloping layer and lack of autoneuralization in zebrafish embryonic explants. Devolopmental Dynamics. 232 (1), 85-97 (2005).
- Xu, P. F., Houssin, N., Ferri-Lagneau, K. F., Thisse, B., Thisse, C. Construction of a vertebrate embryo from two opposing morphogen gradients. Science. 344 (6179), 87-89 (2014).
- Williams, M. L. K., Solnica-Krezel, L. Nodal and planar cell polarity signaling cooperate to regulate zebrafish convergence and extension gastrulation movements. eLife. 9, (2020).
- de Olivera-Melo, M., Xu, P. F., Houssin, N., Thisse, B., Thisse, C. Generation of ectopic morphogen gradients in the Zebrafish blastula. Methods in Molecular Biology. 1863, 125-141 (2018).
- Sepich, D. S., Calmelet, C., Kiskowski, M., Solnica-Krezel, L. Initiation of convergence and extension movements of lateral mesoderm during zebrafish gastrulation. Devolopmental Dynamics. 234 (2), 279-292 (2005).
- Gritsman, K., et al. The EGF-CFC protein one-eyed pinhead is essential for nodal signaling. Cell. 97 (1), 121-132 (1999).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Spemann, H., Manngold, H. Uber inducktion von embryoalanlangen durch implantation artfremder organisatoren. Archiv für mikroskopische Anatomie und Entwicklungsmechanik. 100, 599-638 (1924).
- Mangold, O. Über die Induktionsfähigkeit der verschiedenen Bezirke der Neurula von Urodelen. Naturwissenschaften. 21 (43), 761-766 (1933).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Agathon, A., Thisse, C., Thisse, B. The molecular nature of the zebrafish tail organizer. Nature. 424 (6947), 448-452 (2003).
- Tacke, L., Grunz, H. Close juxtaposition between inducing chordamesoderm and reacting neuroectoderm is a prerequisite for neural induction in Xenopus laevis. Cell Death and Differentiation. 24 (1), 33-43 (1988).
- Swanhart, L. M., et al. Characterization of an lhx1a transgenic reporter in zebrafish. The International Journal of Developmental Biology. 54 (4), 731-736 (2010).
- Williams, M. L. K., Solnica-Krezel, L. A mesoderm-independent role for Nodal signaling in convergence & extension gastrulation movements. BioRxiv. , (2019).
- Londin, E. R., Niemiec, J., Sirotkin, H. I. Chordin, FGF signaling, and mesodermal factors cooperate in zebrafish neural induction. Developmental Biology. 279 (1), 1-19 (2005).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Veenvliet, J. V., et al. Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science. 370 (6522), (2020).
- Beccari, L., et al. Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids. Nature. 562 (7726), 272-276 (2018).
- Moris, N., et al. An in vitro model of early anteroposterior organization during human development. Nature. 582 (7812), 410-415 (2020).
- vanden Brink, S. C., et al. Single-cell and spatial transcriptomics reveal somitogenesis in gastruloids. Nature. 582 (7812), 405-409 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved