Method Article
分析测定切除实体瘤匀浆物的线粒体功能
摘要
我们开发了一种实用的方案和分析方法来评估新鲜肿瘤匀浆中的线粒体氧化磷酸化和电子转移能力。该协议可以很容易地用于调查有助于癌症发生,进展和治疗反应的各种线粒体功能。
摘要
线粒体通过能量产生、活性氧调节和大分子合成对癌症的发生和进展至关重要。线粒体对肿瘤环境的遗传和功能适应性驱动增殖和转移潜力。DNA和RNA测序的出现消除了评估肿瘤发生遗传介质的关键障碍。然而,迄今为止,评估肿瘤线粒体功能的方法学方法仍然难以捉摸,并且需要技术熟练程度,限制了可行性,最终降低了实验和临床环境中的诊断和预后价值。在这里,我们概述了一种简单快速的方法,使用高分辨率呼吸法量化新鲜切除的实体瘤均质物中的氧化磷酸化(OXPHOS)和电子转移(ET)容量。该协议可以可重复地应用于物种和肿瘤类型,并适用于评估线粒体ET途径的多样性。使用该协议,我们证明患有腔内B型乳腺癌的小鼠表现出有缺陷的烟酰胺腺嘌呤二核苷酸连锁呼吸和依赖琥珀酸盐通过OXPHOS产生三磷酸腺苷。
引言
所有细胞都通过生产和消耗三磷酸腺苷(ATP)(分子能量货币)的需求密切相关。由于细胞突变引起肿瘤的形成,线粒体通过能量产生的多样化来确保生存,这种能量产生通常与非癌性组织有表型上的区别1,2,3。因此,迫切需要对线粒体呼吸功能进行快速和深入的分析,以便于对肿瘤类型,癌症发生,进展和治疗反应进行分类。
切除组织标本的呼吸功能不能完整地进行评估,因为OXPHOS的主要底物不具有细胞渗透性。为了克服这一限制,线粒体可以通过分离,化学透化或机械均质化来制备。长期以来,线粒体分离被认为是评估呼吸功能的黄金标准。然而,它需要大量的组织,耗时,并且产量低,并且可能选择线粒体4的某些部分的偏倚。透化包括机械分离和将组织切片或纤维束暴露于选择性降解质膜的温和洗涤剂5。透化经常用于横纹组织,如骨骼和心肌,因为单个纤维束可以被梳理分开。与分离相比,透化在其天然细胞环境和物理形式5中产生更多的线粒体。透化已成功应用于其他组织,如肿瘤6,7和胎盘8;然而,透化纤维制剂的再现性可能难以克服,由于解剖的一致性和氧的要求,以克服扩散限制9。此外,透化纤维可能不适合某些细胞密集和高度纤维化的肿瘤类型。组织匀浆是通过质膜的机械破坏产生的,并且在线粒体产量和完整性方面与透化纤维相似10。组织均质也最大限度地减少了氧气扩散的局限性,并且可以通过优化机械力11,12来轻松用于组织类型。
在这里,我们概述了一种简单快速的方法,用于量化新鲜切除的实体瘤匀浆中氧化磷酸化(OXPHOS)和电子转移(ET)容量的速率。该协议经过优化设计,可使用Oxygraph-2k(O2k)高分辨率呼吸仪评估新鲜组织,这需要仪器设置和校准的先验知识,但可以使用任何Clark型电极,Seahorse分析仪或读板器进行类似的调整。该协议可以可重复地应用于物种和肿瘤类型,并适用于评估线粒体ET途径的多样性。
研究方案
所有涉及动物的实验和程序均由彭宁顿生物医学研究中心机构动物护理和使用委员会批准。
1. 试剂制备。
- 用10 mM HEPES,10%胎牛血清(FBS),1%青霉素 - 链霉素(100 U / mL)和0.2%两性霉素B制备EO771细胞生长培养基。
- 在1000 mL玻璃烧杯中准备1L活检保存(BIOPS)溶液。
- 加入3.180克Na2ATP(5.77mM终浓度)。
- 加入1.334克MgCL2·6H2O(终浓度6.56mM)。
- 加入2.502克牛磺酸(20mM终浓度)。
- 加入3.827克Na2磷酸肌酸(15mM终浓度)。
- 加入1.362克咪唑(20mM终浓度)。
- 加入0.077g二硫磷脂醇(0.5mM终浓度)。
- 加入9.76克MES水合物(50mM终浓度)。
- 加入800 mL H2O,并在30°C下使用磁力搅拌器混合成分。
- 加入72.3毫升100 mM K2EGTA(7.23 mM终浓度)。
- 将 7.608 g EGTA 和 2.3 g KOH 溶于 100 mL H2O 中。
- 使用 5 M KOH 将 pH 值调节至 7.0,使用 H 2 O 时将体积调至200mL。
- 加入27.7毫升100 mM CaK2EGTA(2.77mM终浓度)。
- 将7.608克EGTA溶解在200 mL的H2O中,并加热至80°C(100 mM终浓度)。
- 将2.002克CaCO3 溶解在200毫升热的100 mM EGTA溶液中。
- 在连续搅拌的同时,加入2.3g KOH并将pH值调节至7.0。
- 用5 M KOH将pH值调节至23°C时的pH值至6.75(0°C时pH值为7.1)。用 H2O 将体积调至 980 mL,然后混合溶液。再次检查pH值,必要时进行调整,用水将最终体积调高至1000 mL。
- 将BIOPS等分到锥形管(15 mL或50 mL)中,并在-20°C下储存直至使用。仅在使用前解冻一次。
- 在1000 mL玻璃烧杯中准备1L线粒体呼吸培养基(MiR05)。
- 加入0.190克EGTA(0.5mM终浓度)。
- 加入0.610克MgCL2·6H2O(3mM终浓度)。
- 加入2.502克牛磺酸(20mM终浓度)。
- 加入1.361克KH2PO 4(10mM终浓度)。
- 加入4.77克HEPES(20mM终浓度)。
- 加入37.65克D-蔗糖(110mM终浓度)。
- 加入800 mL H2O,并在30°C下使用磁力搅拌器混合成分。
- 加入120毫升0.5M乳糖酸(60mM终浓度)。
- 将35.83克乳糖酸溶解在100毫升H2O中。
- 使用 5 M KOH 将 pH 调节至 7.0,使用 H 2 O 时将体积调至200mL。
- 混合溶液,用5 M KOH将pH值调节至7.1。
- 在50 mL锥形管中称取1克BSA,基本上不含脂肪酸(1克/ L终浓度)。将步骤9中40 mL的pH 7.1溶液加入试管中,轻轻倒置以混合,避免起泡。将溶解的BSA转移到步骤9剩余的pH 7.1溶液中,并轻轻连续搅拌。再次检查pH值,必要时进行调整,并在H2O下将最终体积调高至1000 mL。
- 将MiR05培养基等分到50mL锥形管中,并储存在-20°C直至使用。仅在使用前解冻一次。
- 准备底物、解耦剂和抑制剂。
- 准备0.8M苹果酸盐:将536.4mgL L-苹果酸溶解在4mL H2O中,用5 M KOH中和至pH 7,用H2O使体积达到5mL。分成等分试样,然后储存在-20°C。
- 准备1M丙酮酸:将550mg丙酮酸钠盐溶解在4mL H2O中,用5M KOH中和至pH 7,用H2O将体积调高至5mL。分成等分试样,然后储存在-20°C。
- 准备0.5 M ADP(腺苷5′-二磷酸):将1.068gADP钠盐溶解在4mL的H2O中,用5M KOH中和至pH 7,用H2O使体积达到5mL。分成等分试样,然后储存在-20°C。
- 准备2M谷氨酸盐:将3.7426gL L-谷氨酸一水合物溶解在8mL H2O中,用5 M KOH中和至pH 7,用H2O将体积调高至10 mL。分成等分试样,然后储存在-20°C。
- 准备4mM细胞色素 c:将50mg细胞色素 c 溶解在1mL H2O中,分成等分试样,然后储存在-20°C。
- 准备1M琥珀酸盐:将2.701克琥珀酸二钠盐六水合物溶解在8 mL H2O中,用1 N HCl中和至pH 7,用H2O将体积调高至10 mL。
- 准备1 mM FCCP(羰基氰化物-4-(三氟甲氧基)苯腙):将2.54mgFCCP溶解在10mL纯乙醇中。分成等分试样,然后储存在-20°C。
- 准备150μM鱼藤酮:将3.94mg鱼藤酮溶解在10毫升纯乙醇中,以制备1mM储备液,涡旋直至完全溶解。用1.275毫升纯乙醇稀释225μL1mM鱼藤酮原液浓度,制成1.5毫升150μM鱼藤酮。避光,分成等分试样,然后储存在-20°C。
- 准备125μM抗霉素A:将11mg抗霉素A溶解在4mL纯乙醇中,以制备5mM抗霉素A的储备浓度.用975μL纯乙醇稀释25μL5mM抗霉素A储备浓度,制成1mL 0.125mM抗霉素A.分成等分试样,然后在-20°C下储存。
- 准备0.8M抗坏血酸:将1.584g抗坏血酸钠盐溶解在8mL H2O中.用抗坏血酸调节pH值至pH 6,用H2O将体积调高至10 mL.避光,分成等分试样,然后储存在-20°C。
- 制备0.2M TMPD(四甲基对苯二胺):将32.85mg TMPD溶解在987.5μLDMSO中。加入12.5μL0.8M抗坏血酸(10mM抗坏血酸终浓度)。避光,分成等分试样,然后储存在-20°C。
- 准备4M叠氮化钠:将2.6g叠氮化钠溶解在10mL H2O中,分成等分试样并储存在-20°C。
2. 肿瘤生长
- 在RPMI 1640生长培养基中培养EO771细胞,并将细胞保持在37°C加湿的培养箱中,其中CO2为5%。
- 单房四周龄雌性C57BL / 6J小鼠,在12小时的光照:黑暗循环中将它们保持在21-22°C。为小鼠 提供随意 获取食物和水的机会。
- 一旦小鼠达到10周龄,准备细胞和小鼠进行癌细胞植入。
- 胰蛋白酶消化细胞,用生长培养基使胰蛋白酶失活,并在室温下以500×g离心细胞5分钟。吸出上清液,在培养基中重悬并混合细胞沉淀(根据需要)。使用台盼蓝计数活细胞,并用1:1:1:1培养基/基底膜基质/ PBS溶液制备总体积为60μL的细胞稀释液1×10 6个细胞。一旦加入基底膜基质,充分混合并将细胞悬浮液保持在冰上。用60μL细胞悬浮液填充注射器,并将其放在冰上。高效工作并在制备后1.5小时内将细胞注射到小鼠体内。
- 通过异氟醚吸入麻醉小鼠(诱导为3%-5%,维持为1%-3%)。在右侧第 4和第5腹股沟乳腺之间剃须。原位注射EO771细胞悬浮液麻醉的小鼠。
- 使用电子卡尺监测和测量肿瘤生长,每周两次,持续4周。在尸检时,切除,称重,然后将肿瘤(或至少60mg肿瘤切片)立即放入10mL冰冷BIOPS中。将管子放在湿冰上。
3. 仪器设置和校准
- 在37°C水浴中加热MiR05培养基。
- 打开Oroboros O2k系统,打开DATLAB软件,输入或选择 用户。单击 连接到 O2k。检查O2k配置,确保为Power-O2k标记了正确的仪器,并且每个腔室对应于正确的氧传感器;单击 确定。O2k控制窗口打开后,在"系统"选项卡下,将"块温度"设置为 37 °C,将两个腔室的搅拌器速度设置为 750 rpm,将数据记录间隔设置为 2.0 s。检查箱子中的搅拌器功率和照明。在"氧气,O2"选项卡中,将传感器的增益设置为1 V/μA(对于较旧的仪器型号,可能需要调整增益),将"极化电压"设置为800 mV,然后单击" 连接到O2k"。打开新的实验文件后,为该文件命名,然后单击" 保存"。实验激活后,将打开一个协议选择窗口;单击 "取消" 以运行自定义 SUIT(底物开耦抑制剂滴定)。
- 选择实验方案后,将打开一个示例窗口,以填写实验代码、样本类型、队列、样本代码、样本编号和子样本编号(如适用)。将单位分配到mg并输入每mL的肿瘤匀浆浓度(每个腔室的量将自动填充)。确保指示的培养基为MiR05,腔室容积为2.00 mL。根据需要在底部框中添加注释,然后单击 OK。
- 取出塞子,从腔室中吸出70%的乙醇。切勿靠近暴露在腔室内部的膜附近吸出。用纯净水冲洗四次,然后用2.25 mL MiR05填充腔室。
- 传感器测试:单击 F9 关闭搅拌器 30 秒。搅拌棒重新打开后,确保每个腔室中的 O2 斜率以单指数方式迅速增加。如果腔室未通过传感器测试,请检查电气连接并清洁是否积聚了盐;重复测试。如果传感器仍然无法通过测试,请卸下极谱法氧传感器(POS)连接器以检查膜。如果观察到膜的可见损坏,严重氧化或显着的气泡积聚,请停止实验程序,并继续仪器维修。
- 氧气校准:执行氧气校准以获得准确的呼吸测量值。
- 通过扭转运动,将塞子缓慢插入其体积校准位置。虹吸通过吸入毛细管喷射的多余介质,该毛细管收集在塞子的孔中。通过扭曲运动,将塞子抬起,使其足够紧密地安装塞子垫片工具,在液相上方留下气体体积,以进行最终的空气平衡(30-45分钟)。
- 使用在此期间实现的稳态来校准氧传感器,以获得呼吸的准确测量值。O2 斜率负(氧的负斜率)为 0 ± 2 pmol/s·mL。如果该值高于2 pmol/s·mL,清洁腔室并用新鲜解冻的MiR05补充。如果斜率不稳定,请继续进行仪器维修。
- 达到稳定状态后,选择O2 浓度曲线,按住Shift键并左键鼠标按钮突出显示曲线的稳定区域。选择区域后,单击 F5,使用下拉箭头选择空气校准标记,然后单击 校准 并复制到剪贴板。
- 仪器背景校准(可选)
- 空气校准后,确保液相以上没有气体体积以进行助焊剂背景平衡(约15分钟),并完全关闭腔室。
注:在此期间实现的稳态速率代表仪器背景,可以从结果数据中减去,以提高分析精度。O2 斜率负值最初会略微增加,并在±2~4 pmol/s·mL之间趋于平稳。 - 如果该值很高(>6 pmol/s·mL),则存在潜在的生物污染。在这种情况下,清洁腔室并用新鲜解冻的MiR05补充。达到稳态后,选择 O2 斜率负曲线,并通过按住 Shift 键并左键单击鼠标按钮来突出显示曲线的稳定区域。
- 选择区域后,单击F5,选择"基线校正框"和带有下拉箭头的"基线"标记,然后单击"确定"。
- 空气校准后,确保液相以上没有气体体积以进行助焊剂背景平衡(约15分钟),并完全关闭腔室。
4. 肿瘤匀浆制备
- 将含有1 mL MiR05和紧密贴合的玻璃杵的玻璃均质机放在湿冰上。
- 在研究时,将组织置于冰冷的培养皿中的1 mL BIOPS中。
- 清洁并解剖组织以最大化可溶性物质,避免坏死区域,并去除边缘肿瘤组织。使用解剖显微镜、手术刀和手术镊子,去除任何头发、坏死组织、外周结缔组织和血管组织以及相邻脂肪(如适用)。在解剖过程中,注意将肿瘤保持在冰冷的BIOPS中。
- 将肿瘤切成小块(每个约5-10mg),并将剩余的肿瘤块放回10mLBIOPS中,保持在冰上。如果需要,稍后使用此组织进行其他准备。
注:快速执行以下步骤,以尽量减少样品未完全浸没在BIOPS中的时间。一旦样品被放入MiR05中,时间至关重要。尽快小心地将准备好的匀浆液移入校准室。 - 在滤纸上小心地擦拭组织切片,将它们放在一个小的塑料焦油称重船上,并记录初始湿重。将未使用的碎片放回10 mL锥形BIOPS管中以继续保存。
- 将组织切片浸入含有MiR05的冰冷均质机中,并在称重船上记录剩余重量(如果适用)。
- 使用玻璃研杵(清除范围0.09-0.16 mm),通过完成5-7次向下和向上的行程来轻轻破坏肿瘤组织。每次击打时,以顺时针逆时针旋转杵3次,同时向下推杵,再旋转3次,同时将杵拉回。确保在两次划水之间让组织沉降到均质机的底部,但避免将杵完全置于液体体积之上,以防止起泡。
注意:所得的匀浆应呈浑浊状,固体组织残留最少。 - 将匀浆倒入15 mL锥形管中,并将其放在冰上。
- 将1-3毫升新鲜MiR05移取在杵上,然后放入均质机中,以洗涤任何剩余的组织匀浆。将MiR05洗涤液倒入含有均质物的锥形管中。重复杵和均质器洗涤2-3次,以确保匀浆的完全转移。请记住目标浓度和所需体积,以免在洗涤步骤中过度稀释样品。
- 为了准确计算组织均质物浓度,请仔细检查均质器和均质液中剩余的非均质材料(即结缔组织)。
- 要从均质器中除去镊子无法到达的非均质材料,请将MiR05加入均质机中,用移液器吸出体积(包括组织),然后将内容物移动到培养皿中。
- 为了从均质物中除去非均质材料(沉降在锥形管底部的大块),请用移液管吸出大块并将其放在锥形管的组织盖上。
- 用镊子从培养皿或锥形管盖中取出组织,并将其擦拭在滤纸上。将剩余的匀浆从锥形管盖中重新加入锥形管中,盖上盖子,然后倒置混合。
- 重新检查均质机和均质器是否有任何额外的非均质材料,并重复步骤4.10.1-4.10.3以根据需要去除材料。
- 称重并记录从均质机回收的非均质材料的质量。检查匀浆制剂中是否有任何完全完整的组织转移。取出未均匀的碎片,并根据需要称重。
- 从初始湿重中减去从称重船、均质机和均质(如有必要)中回收的组织重量,以计算最终样品重量。
- 使用最终样品重量,添加额外的MiR05以使匀浆达到所需浓度(有关优化实验的详细信息,请参见步骤5)。
- 一旦称量并制备了匀浆,请尽快进行测定。将样品储存在湿冰上,直到转移到仪器上。
5. 底物、开耦剂、抑制剂滴定方案(SUIT)
- 校准仪器并制备样品后,以扭曲的运动取出塞子,并将MiR05从腔室中吸出(避免膜暴露在腔室内)。将匀浆混合均匀,并向腔室中加入2.25 mL匀浆。如果将一种匀浆液加入多个腔室,则一次将1 mL移液到每个腔室中,同时混合匀浆以确保均匀的组织分布。单击F4以命名事件并为其添加时间戳,然后单击"确定"。
- 使用 18 G 钝针将 50 mL 注射器与带有调节器和气体管的氧气罐中的氧气填充。将腔室过氧至~500μM氧气。为此,将氧气直接注入腔室。松散地插入塞子并等待关闭,直到氧气达到〜480μM。通过扭曲运动,慢慢关闭腔室,让呼吸平衡(约15-20分钟)。如有必要,用MiR05填充塞子中央毛细管。
- 分析测定N键和NS键合以及CIV(复合物IV)活性的OXPHOS和ET(电子转移状态)容量:使用专用微量注射器将底物,解偶合器和抑制剂注入完全封闭的腔室中。每次注射时单击 F4, 以实时命名每个腔室的事件并加盖时间戳。在整个研究过程中,选择 F6 以根据需要调整 O2 浓度和 O2 斜率负标度。每次注射后,将注射器用水(对于水溶性化合物)或70%乙醇(对于溶解在乙醇或DMSO中的化合物)洗涤3次。
注意:N-linked:O2 助焊剂由定义的NADH生成底物组合支持,NS连锁:O2 助焊剂由定义的NADH生成底物组合和琥珀酸盐的收敛支持。- 加入5μL0.8M苹果酸盐(2mM终浓度),并立即进行下一次注射。将注射器在水中洗涤3次。
- 立即加入5μL1M丙酮酸(2.5mM终浓度),等待呼吸稳定。将注射器在水中洗涤3次。
- 加入10μL0.5 M ADP(2.5mM终浓度),等待ADP响应稳定。将注射器在水中洗涤3次。
注意:可能需要额外的ADP(2.5-10 mM)以确保腺苷酸浓度不限于呼吸通量。 - 加入5μL2M谷氨酸盐(5mM终浓度),等待呼吸稳定。将注射器在水中洗涤3次。
- 加入5μL4mM细胞色素c(10μM终浓度),等待呼吸稳定。 将注射器在水中洗涤3次。
- 加入20μL1M琥珀酸盐(10mM终浓度),等待呼吸稳定。将注射器在水中洗涤3次。
- 滴定0.5-1μL增量为1mM FCCP(2-20μM终浓度),并等待每次注射后呼吸稳定,继续直到呼吸没有额外的增加。将注射器在70%乙醇中洗涤3次。
- 加入2μL150μM鱼藤酮(150nM-2μM终浓度),等待呼吸稳定。再加入1μL鱼藤酮,以确保没有进一步的抑制。如果呼吸减少,继续额外注射,直到呼吸没有减少。将注射器在70%乙醇中洗涤3次。
- 加入2μL125μM抗霉素A(125nM-5μM终浓度),等待呼吸稳定。再加入1μL抗霉素A,以确保没有进一步的抑制。如果呼吸减少,继续额外注射,直到呼吸没有减少。将注射器在70%乙醇中洗涤3次。
- 检查腔室的氧气浓度;如果浓度低于125μM,则向室内空气或轻度高氧酸盐进行复氧,以确保氧气不会限制呼吸通量。加入5μL0.8M抗坏血酸(2mM终浓度)。将注射器在70%乙醇中洗涤3次。
- 立即加入10μL0.2M TMPD(1mM终浓度)等待呼吸缓慢增加。将注射器在70%乙醇中洗涤3次。
- 当抗坏血酸/TMPD平台的呼吸通量时,立即加入25μL4M叠氮化钠(50mM终浓度)。将注射器在70%乙醇中洗涤3次。
- 结束研究 - 单击 "文件,保存并断开连接"。按照步骤9.2-9.3继续清洗腔室和注射器。
6. ADP灵敏度协议
- 校准仪器并制备样品后,以扭曲的运动取出塞子,并将MiR05从腔室中吸出(避免膜暴露在腔室内部)。将匀浆混合均匀,并向腔室中加入2.25 mL匀浆。假设将一个匀浆液添加到多个腔室中,一次将1 mL移液到每个腔室中,同时混合均质以确保均匀的组织分布。单击F4以命名事件并为其添加时间戳,然后单击"确定"。
- 插入塞子,并用扭曲的动作,慢慢关闭腔室,让呼吸平衡(约15-20分钟)。如有必要,用MiR05填充塞子中央毛细管。
- 琥珀酸盐连接线粒体ADP敏感性的分析测定:每次注射时单击 F4, 实时命名每个腔室的事件并加盖时间戳。在整个研究过程中,选择 F6 以根据需要调整 O2 浓度和 O2 斜率负标度。
- 加入2μL150μM鱼藤酮(150nM终浓度)。
- 立即加入20μL1M琥珀酸盐(10mM终浓度),等待呼吸稳定。
- 通过逐步添加低于饱和浓度来滴定ADP,直到达到最大响应速率(V MAX;2.5-10 mM终浓度)。
注意:由于ADP浓度的微小变化,注射后速率可能趋于平稳,因此在每个平台后增加注射浓度并继续滴定,直到即使ADP注射浓度增加一倍,呼吸也没有进一步增加。
7. 推荐的优化实验
- 确定方案的最佳均质和氧气浓度。
- 以多种组织浓度(例如,30 mg/mL、20 mg/mL、10 mg/mL、5 mg/mL、2.5 mg/mL、1 mg/mL 和/或 0.5 mg/mL)执行 SUIT 方案(步骤 5.1-5.3)。
- 选择一种浓度,使呼吸通量最大化,同时限制复氧的频率(不超过1-2)。如果需要更频繁的再氧合,请降低均质的浓度。
- 使用均质机确定最佳冲程数。
- 在多个均质化水平(例如,5 次冲程、10 次卒中、15 次卒中、20 次卒中)下执行 SUIT 方案(步骤 5.1-5.3)。
- 由于文献中没有足够的数据来确定肿瘤匀浆制剂中细胞色素 c 增加百分比的阈值,因此选择细胞色素 c反应有限但由感兴趣的底物激发的充分呼吸的制剂。
- 确定定量和可重复呼吸通量所需的最佳底物、ADP、开耦剂和抑制剂浓度。
- 在所选组织浓度(步骤7.1)下执行SUIT方案(步骤5.1-5.3.9)。滴定每个底物、开耦剂、抑制剂和ADP,直到没有观察到进一步的反应。在单独的实验中用叠氮化钠滴定抑制作用。
- 加入5μL0.8M苹果酸盐(2mM终浓度),并立即进行下一次注射。
- 滴定1μL增量1M丙酮酸,等待每次注射后呼吸稳定,继续直到呼吸没有额外的增加。
- 滴定2μL增量0.5M ADP,等待每次注射后呼吸稳定,继续直到呼吸没有额外增加。
- 滴定1μL增量2M谷氨酸盐,等待每次注射后呼吸稳定,继续直到呼吸没有额外的增加。
- 加入5μL4mM细胞色素c(10μM终浓度),等待呼吸稳定。
- 滴定5μL增量的1M琥珀酸盐,并等待每次注射后呼吸稳定,继续直到呼吸没有额外的增加。
- 滴定5μL增量0.5M ADP,等待每次注射后呼吸稳定,继续直到呼吸没有额外增加。
- 滴定0.5μL增量1mM FCCP,等待每次注射后呼吸稳定,继续直到呼吸没有额外增加。
- 滴定1μL增量150μM鱼藤酮,等待每次注射后呼吸稳定,继续直到呼吸没有减少。
- 滴定1μL增量125μM抗霉素A,并等待每次注射后呼吸稳定,继续直到呼吸没有进一步减少。
- 加入5μL0.8M抗坏血酸(2mM终浓度)。
- 立即加入5μL0.2M TMPD(0.5mM终浓度)等待呼吸缓慢增加。在另一个实验中,加入10μL0.2M TMPD(1mM终浓度)。
- 在单独的实验中,当抗坏血酸/TMPD平台的呼吸通量立即加入10μL,25μL,50μL和100μL的4M叠氮化钠(分别为20mM,50mM,100mM,200mM终浓度)。
- 选择在第一次注射中饱和的底物和抑制剂浓度,以改善实验的时间。在饱和或亚饱和浓度下使用 ADP,将 ADP 灵敏度评估与传统 SUIT 方案相结合。
- 使用次最大开耦剂浓度来证明剂量响应性,而不抑制呼吸通量。
- 在所选组织浓度(步骤7.1)下执行SUIT方案(步骤5.1-5.3.9)。滴定每个底物、开耦剂、抑制剂和ADP,直到没有观察到进一步的反应。在单独的实验中用叠氮化钠滴定抑制作用。
8. 数据分析
- 西装分析
- 从每次滴定中选择稳态或峰速率,然后导出以进行分析还原。
- 将数据表示为 pmol O2 每秒每毫克组织 (pmol/s/mg)。
- 通过从相应的速率中减去抗霉素A不敏感率(即,加入ADP后获得的稳态率),实现PM-L,PM-P,PMG-P,PMGS-P和PMGS-E的分析还原。
注意:下午:丙酮酸盐+苹果酸盐;PMG:丙酮酸盐+苹果酸盐+谷氨酸盐;PMGS:丙酮酸盐+苹果酸盐+谷氨酸盐+琥珀酸盐;-L:泄漏状态;-P:氧化磷酸化状态,-E:电子转移状态。 - 通过从抗坏血酸/TMPD峰速率中减去叠氮化钠不敏感率,实现CIV-E的分析还原。
- 通过从PMGS-E率中减去鱼藤酮不敏感率,实现PMG-E的分析还原。
- 通过从鱼藤酮不敏感率中减去抗霉素A不敏感率,实现S-E的分析还原。
- 通过以下等式实现细胞色素 c 控制效率的分析降低,这是外膜完整性的标志物:
jc = ((JCHNOc - JCHNO)/JCHNO) x 100
在等式中,jc 是添加细胞色素 c时增加的百分比,JCHNOc 是添加细胞色素 c后的氧通量,JCHNO 是添加细胞色素 c之前的氧通量。
- ADP 灵敏度分析
- 分析确定ADP灵敏度相对于琥珀酸盐+鱼藤酮泄漏率(而不是组织匀浆的速率)的动力学。
- 将 O2 通量(Y 轴)与相对 ADP 浓度(X 轴)绘制。确定最大呼吸速度(Vmax)作为ADP滴定所达到的峰值速率。
- 使用曲线拟合软件(PRISM,版本10.1)确定Michaelis-Menten动力学,以显示达到1/2 VMAX的ADP浓度(表观KM)。
9. 仪器质量控制
- 在所需的氧浓度范围(0-600μM)和零点校准上执行仪器O2 背景。
- 完成步骤 3.1 和 3.2
- 取出塞子并从腔室中吸出70%的乙醇(避免暴露在腔室内部的膜)。用双蒸馏 H 2 O 冲洗4次,然后用 2.25 mL MiR05 填充腔室
- 将腔室过氧至~600μM氧气。
- 将塞子缓慢插入其完全闭合的位置。虹吸通过注射毛细管喷射并收集在塞子孔中的多余介质,并使氧气信号稳定(30-45分钟)。
- 要执行氧气校准,请选择氧气浓度和斜率都稳定的区域,打开相应腔室的校准窗口,然后选择 R1 标记。
- 通过将20mg亚硫酸氢钠溶解在0.5mL水中来制备二亚硫酸盐溶液。限制暴露在空气中,因为二亚硫酸盐会随着时间推移而氧化,并暴露于氧气中。
- 一旦氧信号稳定,注入1μL并观察氧浓度的下降。根据需要调整二亚硫酸盐溶液的效力。
- 注入足够的二亚硫酸盐溶液,分别将氧浓度降低至450μM、300μM、225μM、150μM、75μM和0μM。在每次注射时,让氧气稳定下来,并为稳态斜率选择一个标记。一旦氧浓度为~0μM,标记氧浓度。
- 要执行仪器O2 背景校正,请选择相应腔室的通量/斜率窗口,选择 O2 背景校准,然后单击 校准 以获取感兴趣的标记。
- 要执行零点校准,请打开相应腔室的校准窗口,然后选择二亚硫酸盐滴定后获得的 R0 标记。
- 仪器清洁
- 用纯水快速冲洗每个腔室三次。对于第一次洗涤,吸出匀浆,用水充满腔室,然后吸出水。对于第二次洗涤,将腔室中装满水3/4,插入塞子以迫使水通过注射毛细管,通过注射毛细管吸入一些水,然后取出塞子以完全吸出洗涤。
- 用70%乙醇洗涤腔室5分钟。
- 在水槽或烧杯上,用纯水,70%乙醇和100%乙醇清洁塞子,迫使液体通过注射毛细管使用洗涤瓶。
- 用纯净水快速冲洗每个腔室两次。
- 用2mL含有约2mg冷冻线粒体,细胞裂解物或活成纤维细胞的PBS孵育室15分钟。
- 用纯净水冲洗腔室5分钟两次。
- 用70%乙醇洗涤室5次两次。
- 用100%乙醇洗涤室10分钟。
- 用70%乙醇填充腔室。
- 如果连续进行实验,请将腔室置于70%乙醇中5分钟,然后继续步骤3.3。
- 如果实验完成,请盖上塞子并关闭仪器。
- 每次使用后,请正确清洁注射器,并保持注射器专用于特定化合物的使用,以防止残留。
- 将注射器插入洗涤液中,并将注射针完全浸入水中。
- 将洗涤液吸入注射器中,使其达到最大体积。
- 从洗涤容器中取出注射器,将洗涤液喷射到烧杯中,然后在纸巾上吸走注射器。
- 每次使用后,请尽快重复步骤9.3.1-9.3.3三次。
结果
初步研究表明,EO771肿瘤的氧化性较低,因此需要高匀浆浓度才能进行充分的O2通量评估。进行优化实验以确定该研究的最佳组织匀浆浓度范围。最初以40mg / mL制备肿瘤匀浆,然后线性稀释。归一化为组织质量的O2通量在各个浓度上是一致的(图1A-D)。观察到40mg / mL导致快速氧消耗并且不适合实验(图1A)。30 mg / mL和20mg / mL的氧气消耗量显着减慢,但在没有底物或ADP的情况下仍然在短时间内迅速下降(图1B,C)。10 mg/mL的浓度产生了最佳的耗氧量(图1D),这将支持更长的90分钟SUIT方案。
SUIT方案用于评估NADH和琥珀酸盐连接的OXPHOS和ET,以及CIV活性(图2A)。在没有ADP的情况下,将丙酮酸和苹果酸盐添加到组织中,以通过NADH驱动泄漏(L)。然后加入饱和ADP以驱动最大NADH连接的OXPHOS(P),然后加入谷氨酸盐。然后加入细胞色素 c 以确保外膜完整性;所有样品中呼吸速率的增加均小于20%(图2B)。鉴于对NADH连接底物的反应非常低,在琥珀酸盐和鱼藤酮的存在下也评估了细胞色素 c 的释放,并观察到最小的细胞色素 c 刺激(图2B)。有趣的是,NADH连接的OXPHOS在EO771肿瘤中可以忽略不计(图2C)。然后在丙酮酸,苹果酸盐和谷氨酸盐的存在下加入琥珀酸盐以刺激电子流经琥珀酸脱氢酶。然后滴定FCCP以驱动最大电子流(E),这表明在EO771肿瘤中,磷酸化而不是氧化限制了呼吸(图2C)。随后对鱼藤酮和抗霉素A进行滴定以分别抑制复合物I和复合物III。然后加入抗坏血酸和TMPD以驱动通过CIV的最大电子流,然后被叠氮化钠抑制。 表1 说明了原始数据的解析还原方程(表2),以定量 图2C中绘制的呼吸参数。总体而言,肿瘤均质呼吸曲线(图2C)与未植入的洋地黄素透化的EO771细胞(图2D)相似,除了肿瘤中N和S连锁底物支持的最大电子转移减少。
由于NADH连接呼吸可以忽略不计,因此通过逐步滴定亚饱和ADP进一步评估琥珀酸盐的呼吸动力学,直到达到最大速率(VMAX)(图3A,3B)。在琥珀酸盐+鱼藤酮存在下ADP的半最大浓度(KM)为37.5μM,而VMAX约为10.5 pmol / s / mg(图3C)。因此,尽管氧化速率相对较差,但EO771肿瘤对ADP高度敏感,并且在相对较低的ADP浓度下持续ATP合成。
选择原始数据的适当区域进行提取对于实验的可重复性和准确定量至关重要。对于细胞色素c,需要在注射前立即在稳态下选择一个标记(图4A,标记1)。通常存在初始注射伪影,随后可能会有一段时间(约5-10分钟),其中O2通量不稳定。一旦O2通量稳定,通过进行额外选择来评估细胞色素c效率(图4A,标记2)。添加底物,ADP或大多数抑制剂后的选择也在注射伪影之后进行,一旦O2通量稳定下来(图4B)。用于确定最大非耦呼吸的选择是在FCCP滴定期间达到的峰值增加时进行的,这通常不是最后一次注射(图4C)。TMPD的选择是在添加抗坏血酸盐和TMPD并且在呼吸增加的峰值时进行的(图4D,标记1)。刚过这个峰值,加入抑制剂叠氮化钠,这会迅速降低呼吸,但也经常具有低于抑制呼吸速率的注射伪影(图4D)。抑制剂标记在注射伪影后立即形成(图4D,标记2)。O2通量通常不会稳定并继续减少。
表1:呼吸表示法和分析推导。 请点击此处下载此表格。
表2:腔B型乳腺肿瘤均质物的样本和呼吸特性。 请点击此处下载此表格。

图1:肿瘤匀浆浓度的优化。在(A)40毫克/毫升、(B)30毫克/毫升、(C)2毫克/毫升和(D)10毫克/毫升的乳腺肿瘤匀浆中制备的O2通量(红色)和O 2浓度(蓝色)。Thom:组织均质呼吸。请点击此处查看此图的放大版本。
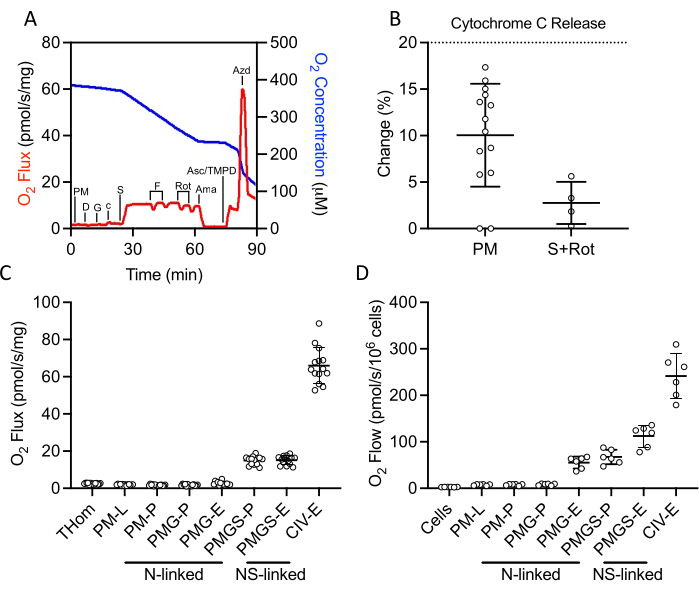
图2:通过高分辨率呼吸法评估新切除的肿瘤均质物中的OXPHOS和ET容量。 (A)底物,抑制剂,开耦剂方案过程中氧气消耗量(红色)和浓度(蓝色)的代表性图。PM:丙酮酸+苹果酸盐,D:ADP,G:谷氨酸盐,c:细胞色素c,S:琥珀酸酯,F:FCCP,腐烂:鱼藤酮,Ama:抗霉素A,Asc / TMPD:抗坏血酸/四甲基对苯二胺。(B) 加入细胞色素c后O2通量百分比增加。(C-D)在(C)EO771 衍生的肿瘤匀浆和(D)非植入的 EO771 洋地黄素透化细胞中存在 ADP、FCCP 和抗坏血酸/TMPD 的情况下,由苹果酸盐、丙酮酸盐、谷氨酸盐和琥珀酸盐支持的呼吸。Thom:组织均质呼吸;PM:丙酮酸盐+苹果酸盐;PMG:丙酮酸盐+苹果酸盐+谷氨酸盐;PMGS:丙酮酸盐+苹果酸盐+谷氨酸盐+琥珀酸盐;CIV:复合体IV;-L:泄漏状态;-P:氧化磷酸化状态,-E:电子转移状态;N-连锁:O2通量由定义的NADH生成底物组合支持;NS连锁:O2助焊剂由定义的NADH生成底物组合和琥珀酸盐的收敛性支持。请点击此处查看此图的放大版本。
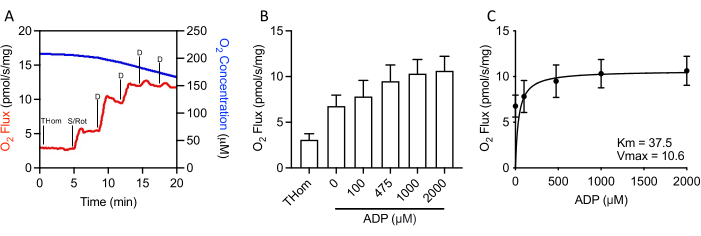
图3:EO771乳腺肿瘤显示出较高的ADP(腺苷5′-二磷酸)敏感性。(A) 整个 S 连锁 ADP 滴定方案中氧气消耗量(红色)和浓度(蓝色)的代表性图。Thom:组织均质呼吸;S/腐烂:琥珀酸盐/鱼藤酮;D: ADP。(B) 在鱼藤酮存在下由琥珀酸盐支持的呼吸和增加的ADP浓度(0μM ADP = S / Rot-L)。(C) 在琥珀酸盐 + 鱼藤酮存在下 ADP 的最大速率 (VMAX)和半最大浓度 (KM)。请点击此处查看此图的放大版本。
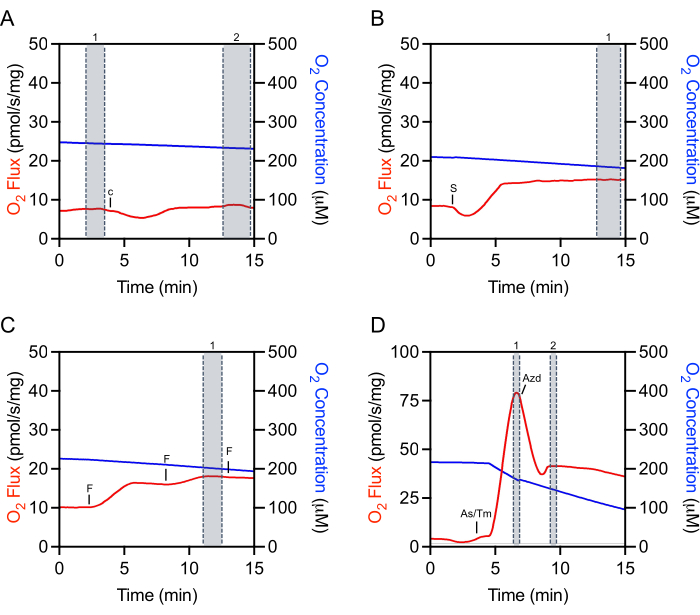
图4:代表性的示踪,说明选择原始O2助焊剂进行数据提取。 (A)细胞色素c选择:细胞色素c注射前的选择号1和注射后选择号2,当O2通量稳定时。c 细胞色素c.(B)底物、ADP和抑制剂选择:选择1后注射(本代表性图中的琥珀酸盐),其中O2通量已稳定。S:琥珀酸盐。(C)开央器选择:选择1号在解耦滴定过程中呼吸增加的峰值。在这个具有代表性的FCCP滴定图中,第三次注射略微降低呼吸,因此不用于选择。女:ACCP。(D)TMPD选择:选择1号在抗坏血酸盐和TMPD注射后呼吸增加的峰值。叠氮化钠选择:急性注射伪影后选择2,当呼吸最初减少时。As/Tm: 抗坏血酸/TMPD;Azd: Azide.请点击此处查看此图的放大版本。
讨论
评估癌症中线粒体呼吸的方法在很大程度上仅限于体外模型13,14,15,16。使用化学通透性6,7,17测量肿瘤中的线粒体呼吸已经取得了一些成功,但是没有统一的,金标准的方法可以普遍应用并跨肿瘤类型进行比较。此外,缺乏一致的数据分析和报告限制了数据的可推广性和可重复性。本文概述的方法提供了一种简单、相对快速的方法来测量来自新鲜切除的实体瘤标本的线粒体制剂中的线粒体呼吸18。肿瘤由原位植入的小鼠腔体B、ERα阴性EO771乳腺癌细胞19生长。
勤勉和小心地处理组织将大大提高耗氧率的准确性和标准化。如果样品不冷藏,未始终浸没在保存介质中或处理过度,则组织和线粒体很容易受损,从而导致常规和OXPHOS率欠佳。此外,均质组织的准确湿重至关重要,因为这是主要的归一化方法。可以考虑其它归一化方法,例如总蛋白或线粒体特异性标志物,例如柠檬酸合酶活性20。此外,需要解决组织异质性,先验地将肿瘤区域的决定纳入实验 。 坏死、纤维化和结缔组织可能无法均匀化和/或呼吸良好,除非有意测定这些肿瘤区域,否则应避免使用。值得注意的是,根据类型和切除区域的不同,肿瘤可能非常粘稠,这使得准确的称重和转移更具挑战性。应优化用于均质化的笔画次数,以确保线粒体的完全制备,同时减轻对外线粒体膜的损伤。
为了提高准确性和可重复性,我们建议对均质制备的行程次数,组织浓度以及底物,开耦剂,抑制剂浓度进行优化实验。研究可以比较不同的卒中次数以及它们如何与研究中增加细胞色素 c 的反应以及最大线粒体呼吸能力 21的对应关系。虽然人们普遍认为细胞色素 c 反应越少越好,因为添加细胞色素 c 后氧气消耗的增加可能表明对外线粒体膜的损害,但对于每个组织的这个阈值没有金标准,应该通过实验进行研究,以确保组织不会过度劳累或准备不足。在这种肿瘤组织中,发现~30%以下的细胞色素 c 反应不会损害呼吸功能。如果检测结果为阳性,细胞色素 c 的使用对于准确定量呼吸能力至关重要。在这种情况下,添加物补充内源性细胞色素 c, 如果耗尽,将导致呼吸频率的低估。
组织浓度滴定实验可以在一系列可行的浓度上进行,理想情况下,可以使用将在研究期间研究的SUIT进行。呼吸能力因肿瘤类型和组成而异。因此,线粒体密集的肿瘤或高呼吸能力将需要较低的浓度(0.5-5mg / mL)。线粒体少或呼吸能力低的肿瘤需要更高的浓度(7-12mg / mL)。此外,长或具有高消耗底物的SUITs可能需要较少的组织以防止腔室的再氧合或ADP限制。一些组织在氧气消耗方面具有线性关系,而其他组织在一定浓度范围内将显示出更高的灵敏度和最大氧化。应优化所选的组织浓度,以最大限度地提高氧通量,同时限制再氧合事件的次数。此外,通常最好高估需求或瞄准浓度范围的较高端。这些抑制剂对呼吸通量的定量至关重要,当用于较大的线粒体池时更精确。
另一个重要的考虑因素是方案期间使用的药物的浓度。匀浆浓度的变化可能会改变最大响应所需的底物、解偶联剂和抑制剂的浓度。因此,一旦选择了最佳浓度范围,就应该进行实验测试SUIT方案所需的剂量。可以添加额外的ADP,以确保腺苷酸浓度不限于呼吸通路。化学解偶联剂如FCCP或CCCP将抑制较高浓度的呼吸22。因此,必须少量滴定以显示最大达到速率。抑制剂,如鱼藤酮和抗霉素A,最好在第一次注射中饱和时使用。虽然在初步实验中确定了最佳浓度,但我们也观察到了对抑制剂的反应与治疗相关的差异,因此经常添加一次额外的抑制剂注射以证明最大抑制作用,因为结果速率是定量的基础。抗坏血酸/ TPMD的化学抑制对于准确的分析还原至关重要,因为TMPD经历自氧化23。我们通过加入叠氮化钠(一种已建立的CIV抑制剂)来控制抗坏血酸/TMPD/细胞色素 c 的自氧化。对于Km研究,单独在琥珀酸盐存在下添加鱼藤酮可防止草酰乙酸积累,其可以抑制低浓度下的琥珀酸脱氢酶活性24。ADP的体积和浓度高度依赖于线粒体对主要底物组合的敏感性。对ADP高度敏感的线粒体制剂将需要较低的起始浓度。此外,经过验证的化学品和适当的药物制备,注意pH值,对光的敏感性(如果适用)和储存温度对于成功的实验至关重要。
仪器设置和常规护理对于这些实验的成功至关重要。充分和适当地清洁腔室对于生物,蛋白质,抑制剂或开耦剂污染的可重复性和预防至关重要。Clark型电极和O2k系统利用玻璃反应室,这对于依赖耗材的基于板的系统来说是一个显着的成本优势。然而,玻璃室必须大力清洁,并可能在随后的研究中成为抑制剂污染的来源。在洗涤过程中用富含线粒体的标本(例如,孤立的心脏或肝脏线粒体)孵育可以降低实验污染的风险,除了稀释和基于酒精的洗涤程序外,还建议使用。如果进行连续研究,用乙醇和线粒体清洁可最大限度地减少抑制剂污染的可能性。建议在每次实验之前校准氧传感器,以获得相对于当前氧气分压的呼吸的准确测量值。如果多次校准不可行,如果洗涤程序后氧气浓度保持稳定和一致,则每天进行一次校准可能就足够了。
上面概述的程序利用Oroboros O2k仪器,使用先前设计和优化的保存溶液和呼吸培养基25,26,27测量肿瘤组织在肿瘤切除后4小时内的氧气消耗量。此协议中的多个参数可以修改以用于后续应用。仪器设置和校准、用于组织制备的均质器以及最佳均质和腔室氧浓度都可以适应于其他具有氧气监测潜力的仪器。例如,当添加均质时,腔室略微过量填充,因此当腔室完全关闭时,腔室毛细管保持满。这将消耗腔室中的一些氧气,但是通过优化样品浓度,我们可以在确定开始时的氧气水平时考虑这种消耗。或者,在室关闭之前,可以让样品在环境氧气下平衡,但这通常会增加实验开始前的时间并延迟底物的添加。虽然该协议中使用的均质器是广泛可及的,但可以采用其它商业均质技术,例如组织粉碎机或自动均质机28。
此外,组织制备和仪器程序可以与许多不同的SUIT一起使用,通过多种耦合和通路控制状态来研究呼吸控制29。这些SUIT协议已被开发用于测量功能容量,因此,潜在内源性底物的贡献对容量测量没有影响。我们通过减去抗霉素A-鱼藤酮或叠氮化钠不敏感率(如适用)来分析非线粒体耗氧量和/或匀浆的残留消耗量。线粒体可以在BIOPS或类似构建的保存溶液中长时间(>24小时)保持活力,具体取决于组织类型和完整性30,31。可以提前进行研究以确定时间储存限值,因为某些底物的OXPHOS可能具有不同的限制。如果实验不能在组织切除/活检后的几个小时内进行,这是必不可少的。37°C是大多数哺乳动物系统中评估呼吸功能的最佳生理温度。然而,如果测定温度似乎干扰了评估32,则可以在很宽的温度范围(25-40°C)内进行比较研究,以确保足够的响应性。工具性限制可能会限制进行此类研究的能力。
上述方法的主要局限性是1)通过机械均质化对线粒体造成损害的可能性,2)均质制剂中存在ATP酶或其他亚细胞生化物,这些制剂可能会干扰ATP或其他感兴趣变量的同时测定,并且可能需要额外的校正方法或使用抑制剂33,3)评估每个样品的许多样品和/或多个SUIT非常耗时,因为一台仪器一次可以容纳两个实验,并且需要在连续实验之间进行清洁和设置。优化实验和样品的一致制备可以最大限度地减少可能导致数据不一致的实质性线粒体损伤。
与起始材料的数量,分离线粒体的挑战或透化组织的技术挑战相比,该方法相对于现有/替代方法的重要性是可行性的提高。与透化组织相比,匀浆的制备速度更快,氧气没有那么有限,并且更不容易受到人员之间变异的影响。重要的是,几乎所有样品类型都适用于均质制备,从而可以跨组织进行比较分析。高分辨率呼吸测定法是线粒体OXPHOS和ET的金标准测量。该方法在临床前和临床癌症研究中的应用能够将当前的 体外 研究扩展到 离体 研究。此外,它还在临床和诊断环境中提供了潜在的应用。
披露声明
作者与这项工作没有利益冲突。
致谢
我们感谢彭宁顿生物医学研究中心比较生物学核心工作人员的动物护理。这项研究得到了美国国立卫生研究院拨款U54GM104940(JPK)和KL2TR003097(LAG)的部分支持。所有涉及动物的实验和程序均由彭宁顿生物医学研究中心机构动物护理和使用委员会批准。
材料
| Name | Company | Catalog Number | Comments |
| 2-(N-Morpholino)ethanesulfonic acid hydrate | Sigma-Aldrich | M8250 | |
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Adenosine 5'-triphosphate disodium salt hydrate | Sigma-Aldrich | A2383 | |
| Amphotericin B | Gibco | 15290018 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Ascorbate | Sigma-Aldrich | A4544 | |
| Bovine serum albumin, fraction V, heat shock, fatty acid free | Sigma-Aldrich | 3117057001 | Roche |
| BD 50 mL Luer-Lok Syringe | Fisher Scientific | 13-689-8 | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Calcium carbonate | Sigma-Aldrich | C4830 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | |
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| Datlab 7.4 software | Oroboros Instruments | ||
| Dimethylsulfoxide | Amresco | N182 | |
| Dithiothreitol | Sigma-Aldrich | D0632 | |
| D-Sucrose | Sigma-Aldrich | S7903 | |
| Dumont # 5 Forceps | Fine Science Tools | 11251-30 | Dumoxel, autoclavable |
| Dumont # 7 Forceps | Fine Science Tools | 11271-30 | Dumoxel, autoclavable |
| Digital Calipers 150 mm/6 in | World Precision Instruments | 501601 | |
| EO771 cells | CH3 BioSystems | SKU: 94APV1-vial-prem | Pathogen Tested |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Female C57BL/6J mice | Jackson Laboratory | Stock #000664 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Imidazole | Sigma-Aldrich | 56750 | |
| Kimwipes | Fisher Scientific | 34120 | |
| L-(−)-Malic acid | Sigma-Aldrich | G1626 | |
| Lactobionic acid | Sigma-Aldrich | L2398 | |
| Malate | Sigma-Aldrich | M6413 | |
| Matrigel Matrix | Corning | 354248 | |
| MgCl·6H2O | Sigma-Aldrich | M2670 | |
| Microsyringes | Hamilton | 87919, 80383, 80521, 80665, 80765, 80865, 87943 | |
| N,N,N′,N′-Tetramethyl-p-phenylenediamine | Sigma-Aldrich | T7394 | |
| Oxygraph-2k | Oroboros Instruments | 10023-03 | |
| Oxygraph-2k FluoRespirometer | Oroboros Instruments | 10003-01 | |
| PBS | Gibco | 10010023 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium hydroxide | Sigma-Aldrich | P1767 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| RPMI 1640 | Gibco | 21875034 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium pyruvate | Sigma-Aldrich | P5280 | |
| Succinate (disodium) | Sigma-Aldrich | W327700 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Whatman Filter Paper, grade 5 | Sigma-Aldrich | 1005-090 | |
| Wheaton Tenbroeck Tissue Grinder, 7 mL | Duran Wheaton Kimble | 357424 | |
| Straight Tip Micro Dissecting Scissors | Roboz | RS-5914SC | |
| Non-Safety Scalpel No. 11 | McKesson | 1029065 | |
| BD Precision Glide Needle 27 G x 1/2 | Becton, Dickinson and Company | 305109 | |
| BD Precision Glide Needle 18 G x 1 | Becton, Dickinson and Company | 305195 | |
| BD 1mL Slip Tip Syringe | Becton, Dickinson and Company | 309659 | |
| Pyrex Reusable Petri Dish, 60 mm | Thermo Fisher Scientific | 316060 | |
| Rodent Very High Fat Diet, 60% kcal from fat, 20% kcal from protein, and 20% kcal from carbohydrate | Research Diet | D12492 | |
| Pyrex Watch Glass, 100 mm | Thermo Fisher Scientific | S34819 |
参考文献
- DeBerardinis, R. J., Chandel, N. S. Fundamentals of cancer metabolism. Science Advances. 2 (5), 1600200(2016).
- Bajzikova, M., et al. Reactivation of dihydroorotate dehydrogenase-driven pyrimidine biosynthesis restores tumor growth of respiration-deficient cancer cells. Cell Metabolism. 29 (2), 399-416 (2019).
- Martínez-Reyes, I., et al. Mitochondrial ubiquinol oxidation is necessary for tumour growth. Nature. 585 (7824), 288-292 (2020).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6 (3), 18317(2011).
- Saks, V. A., et al. Bioenergetics of the Cell: Quantitative Aspects. Saks, V. A., et al. , Springer US. 81-100 (1998).
- Kaambre, T., et al. Metabolic control analysis of cellular respiration in situ in intraoperational samples of human breast cancer. Journal of Bioenergetics and Biomembranes. 44 (5), 539-558 (2012).
- Koit, A., et al. Mitochondrial respiration in human colorectal and breast cancer clinical material is regulated differently. Oxidative Medicine and Cellular Longevity. 2017, 1372640(2017).
- Holland, O. J., et al. Changes in mitochondrial respiration in the human placenta over gestation. Placenta. 57, 102-112 (2017).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Kondrashova, M. N., et al. Preservation of native properties of mitochondria in rat liver homogenate. Mitochondrion. 1 (3), 249-267 (2001).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. American Journal of Physiology-Cell Physiology. 292 (1), 125-136 (2007).
- Hlozková, K., Starková, J. Assessment of the metabolic profile of primary leukemia cells. Journal of Visualized Experiments: JoVE. (141), e58426(2018).
- Zhang, J., Zhang, Q. Cancer Metabolism: Methods and Protocols. Haznadar, M. , Springer. New York. 353-363 (2019).
- Wigner, P., Zielinski, K., Labieniec-Watala, M., Marczak, A., Szwed, M. Doxorubicin-transferrin conjugate alters mitochondrial homeostasis and energy metabolism in human breast cancer cells. Scientific Reports. 11 (1), 4544(2021).
- Schöpf, B., et al. Oxidative phosphorylation and mitochondrial function differ between human prostate tissue and cultured cells. The FEBS Journal. 283 (11), 2181-2196 (2016).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Le Naour, A., et al. EO771, the first luminal B mammary cancer cell line from C57BL/6 mice. Cancer Cell International. 20, 328(2020).
- Gnaiger, E., et al. Mitochondrial physiology. Bioenergetics Communications. 1, 44(2020).
- Hughey, C. C., Hittel, D. S., Johnsen, V. L., Shearer, J. Respirometric oxidative phosphorylation assessment in saponin-permeabilized cardiac fibers. Journal of Visualized Experiments: JoVE. (48), e2431(2011).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radical Biology and Medicine. 51 (9), 1621-1635 (2011).
- Munday, R. Generation of superoxide radical, hydrogen peroxide and hydroxyl radical during the autoxidation of N,N,N',N'-tetramethyl-p-phenylenediamine. Chemico-Biological Interactions. 65 (2), 133-143 (1988).
- Moser, M. D., Matsuzaki, S., Humphries, K. M. Inhibition of succinate-linked respiration and complex II activity by hydrogen peroxide. Archives of Biochemistry and Biophysics. 488 (1), 69-75 (2009).
- Veksler, V. I., Kuznetsov, A. V., Sharov, V. G., Kapelko, V. I., Saks, V. A. Mitochondrial respiratory parameters in cardiac tissue: a novel method of assessment by using saponin-skinned fibers. Biochimica et Biophysica Acta. 892 (2), 191-196 (1987).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. Heldmaier, G., Klingenspor, M. , Springer. Berlin, Heidelberg. 431-442 (2000).
- Doerrier, C., et al. High-resolution fluorespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Rohlenova, K., et al. Selective disruption of respiratory supercomplexes as a new strategy to suppress Her2(high) breast cancer. Antioxidants & Redox Signaling. 26 (2), 84-103 (2017).
- Gnaiger, E. Mitochondrial pathways and respiratory control. Bioenergetics Communications. 5th ed. , (2020).
- Barksdale, K. A., et al. Mitochondrial viability in mouse and human postmortem brain. FASEB Journal. 24 (9), 3590-3599 (2010).
- Underwood, E., Redell, J. B., Zhao, J., Moore, A. N., Dash, P. K. A method for assessing tissue respiration in anatomically defined brain regions. Scientific Reportys. 10 (1), 13179(2020).
- Jorgensen, L. B., Overgaard, J., Hunter-Manseau, F., Pichaud, N. Dramatic changes in mitochondrial substrate use at critically high temperatures: a comparative study using Drosophila. Journal of Experimental Biology. 224, Pt 6 (2021).
- Salin, K., et al. Simultaneous measurement of mitochondrial respiration and ATP production in tissue homogenates and calculation of effective P/O ratios. Physiological Reports. 4 (20), 13007(2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。