Method Article
Analytische Bestimmung der mitochondrialen Funktion von exzidierten soliden Tumorhomogenaten
In diesem Artikel
Zusammenfassung
Wir entwickelten ein praktisches Protokoll und einen analytischen Ansatz zur Bewertung der mitochondrialen oxidativen Phosphorylierung und Der Elektronentransferkapazität in frischen Tumorhomogenaten. Dieses Protokoll kann leicht angepasst werden, um verschiedene mitochondriale Funktionen zu überwachen, die zur Entstehung, Progression und Ansprechen auf die Behandlung von Krebs beitragen.
Zusammenfassung
Mitochondrien sind essentiell für den Ausbruch und das Fortschreiten von Krebs durch Energieproduktion, reaktive Sauerstoffspeziesregulation und Makromolekülsynthese. Genetische und funktionelle Anpassungen der Mitochondrien an die Tumorumgebung treiben das proliferative und metastatische Potenzial voran. Das Aufkommen der DNA- und RNA-Sequenzierung beseitigte kritische Barrieren für die Bewertung genetischer Mediatoren der Tumorgenese. Bis heute sind methodische Ansätze zur Bewertung der mitochondrialen Funktion von Tumoren jedoch schwer fassbar und erfordern technische Fähigkeiten, die die Machbarkeit einschränken und letztendlich den diagnostischen und prognostischen Wert sowohl im experimentellen als auch im klinischen Umfeld verringern. Hier skizzieren wir eine einfache und schnelle Methode zur Quantifizierung der Raten der oxidativen Phosphorylierung (OXPHOS) und Elektronentransferkapazität (ET) in frisch ausgeschnittenen soliden Tumorhomogenaten mittels hochauflösender Respirometrie. Das Protokoll kann reproduzierbar über Spezies und Tumorarten hinweg angewendet sowie angepasst werden, um eine Vielzahl von mitochondrialen ET-Signalwegen zu bewerten. Mit diesem Protokoll zeigen wir, dass Mäuse, die einen luminalen B-Brustkrebs tragen, eine defekte Nicotinamidadenindinukleotid-gebundene Atmung aufweisen und auf Succinat angewiesen sind, um Adenosintriphosphat über OXPHOS zu erzeugen.
Einleitung
Alle Zellen sind eng miteinander verbunden durch ihre Notwendigkeit, Adenosintriphosphat (ATP), die molekulare Energiewährung, zu produzieren und zu konsumieren. Da zelluläre Mutationen zur Bildung von Tumoren führen, sichern Mitochondrien das Überleben durch Diversifizierung der Energieproduktion, die oft phänotypisch von nicht-krebsartigem Gewebe unterscheidbar ist1,2,3. Daher besteht ein kritischer Bedarf an einer schnellen und tiefen Profilierung der mitochondrialen Atmungsfunktion, um die Klassifizierung von Tumortyp, Krebsbeginn, Progression und Behandlungsreaktion zu erleichtern.
Die Atmungsfunktionen von exzidierten Gewebeproben können nicht intakt bewertet werden, da die primären Substrate für OXPHOS nicht zelldurchlässig sind. Um diese Einschränkung zu überwinden, können Mitochondrien entweder durch Isolierung, chemische Permeabilisierung oder mechanische Homogenisierung hergestellt werden. Die mitochondriale Isolierung gilt seit langem als Goldstandard für die Beurteilung der Atmungsfunktion. Es erfordert jedoch große Mengen an Gewebe, ist zeitaufwendig und ist gering ertragreich mit möglicher Selektionsverzerrung für bestimmte Fraktionen der Mitochondrien4. Die Permeabilisierung besteht aus der mechanischen Trennung und Der Exposition von Gewebeschnitten oder Faserbündeln gegenüber einem milden Reinigungsmittel, das die Plasmamembran selektiv abbaut5. Die Permeabilisierung wird häufig in quergestreiften Geweben wie Skelett- und Herzmuskel eingesetzt, da einzelne Faserbündel auseinander gezogen werden können. Im Vergleich zur Isolation ergibt die Permeabilisierung mehr Mitochondrien in ihrer nativen zellulären Umgebung und physischen Form5. Die Permeabilisierung wurde erfolgreich in anderen Geweben wie Tumor6,7 und Plazenta8angewendet ; Die Reproduzierbarkeit von permeabilisierten Faserpräparaten kann jedoch aufgrund der Konsistenz der Dissektion und des Sauerstoffbedarfs zur Überwindung von Diffusionsbeschränkungen schwierig sein9. Darüber hinaus können permeabilisierte Fasern bei bestimmten Tumorarten, die dichtzellig und stark fibrotisch sind, ungeeignet sein. Gewebehomogenate entstehen durch mechanische Störung der Plasmamembran und ähneln permeabilisierten Fasern in Bezug auf mitochondriale Ausbeute und Integrität10. Gewebehomogenate minimieren auch die Einschränkungen der Sauerstoffdiffusion und können durch Optimierung der mechanischen Kraft11,12leicht gewebeübergreifend eingesetzt werden.
Hier skizzieren wir eine einfache und schnelle Methode zur Quantifizierung der Raten der oxidativen Phosphorylierung (OXPHOS) und Elektronentransferkapazität (ET) in frisch ausgeschnittenen soliden Tumorhomogenaten. Das Protokoll ist optimal für die Bewertung von frischem Gewebe mit dem hochauflösenden Oxygraph-2k (O2k)-Respirometer ausgelegt, das Vorkenntnisse in der instrumentellen Einrichtung und Kalibrierung erfordert, aber in ähnlicher Weise mit jeder Clark-Elektrode, jedem Seepferdchen-Analysator oder Plattenleser angepasst werden kann. Das Protokoll kann reproduzierbar über Spezies und Tumorarten hinweg angewendet sowie angepasst werden, um eine Vielzahl von mitochondrialen ET-Signalwegen zu bewerten.
Protokoll
Alle Experimente und Verfahren mit Tieren wurden vom Pennington Biomedical Research Center Institutional Animal Care and Use Committee genehmigt.
1. Vorbereitung des Reagenzes.
- EO771 Zellwachstumsmedien mit 10 mM HEPES, 10% fetalem Rinderserum (FBS), 1% Penicillin-Streptomycin (100 U/ml) und 0,2% Amphotericin B herstellen.
- Bereiten Sie 1 l Biopsiekonservierungslösung (BIOPS) in einem 1000 ml Glasbecher vor.
- 3,180 gNa2ATP (5,77 mM Endkonzentration) zugeben.
- 1,334 g MgCL2 ·6H2O(6,56 mM Endkonzentration) zugeben.
- 2,502 g Taurin (20 mM Endkonzentration) zugeben.
- 3,827 gNa2-Phosphokreatin(15 mM Endkonzentration) zugeben.
- 1,362 g Imidazol (20 mM Endkonzentration) zugeben.
- 0,077 g Dithiothreitol (0,5 mM Endkonzentration) zugeben.
- 9,76 g MES-Hydrat (50 mM Endkonzentration) zugeben.
- 800 mLH2O zugebenund die Bestandteile mit einem Magnetrührer bei 30 °C mischen.
- 72,3 ml 100 mMK2EGTA (7,23 mM Endkonzentration) zugeben.
- 7,608 g EGTA und 2,3 g KOH werden in 100 mLH2O gelöst.
- Stellen Sie den pH-Wert mit 5 M KOH auf 7,0 ein und bringen Sie das Volumen mit H 2 O auf200mL.
- 27,7 ml 100 mMCaK2EGTA (2,77 mM Endkonzentration) zugeben.
- 7,608 g EGTA in 200 mLH2Olösen und auf 80 °C (100 mM Endkonzentration) erhitzen.
- 2,002 gCaCO3 werden in 200 mL heißer 100 mM EGTA-Lösung gelöst.
- Unter ständigem Rühren 2,3 g KOH hinzufügen und den pH-Wert auf 7,0 einstellen.
- Stellen Sie den pH-Wert auf 6,75 bei 23 °C (pH 7,1 bei 0 °C) mit 5 M KOH ein. Bringen Sie das Volumen mitH2O auf bis zu 980 ml und mischen Sie die Lösung. Überprüfen Sie den pH-Wert noch einmal, stellen Sie ihn bei Bedarf ein und bringen Sie das Endvolumen mit Wasser auf bis zu 1000 ml.
- Aliquot BIOPS in konischen Röhrchen (15 ml oder 50 ml) und bei -20 °C bis zur Verwendung lagern. Nur einmal auftauen, kurz vor dem Gebrauch.
- Bereiten Sie 1 l mitochondriales Beatmungsmedium (MiR05) in einem 1000 ml Glasbecher vor.
- 0,190 g EGTA (0,5 mM Endkonzentration) zugeben.
- 0,610 gMgCL2 ·6H2O(3mM Endkonzentration) zugeben.
- 2,502 g Taurin (20 mM Endkonzentration) zugeben.
- 1,361 gKH2PO4 (10 mM Endkonzentration) zugeben.
- 4,77 g HEPES (20 mM Endkonzentration) zugeben.
- 37,65 g D-Saccharose (110 mM Endkonzentration) zugeben.
- 800 mLH2O zugebenund die Bestandteile mit einem Magnetrührer bei 30 °C mischen.
- 120 ml 0,5 M Lactobionsäure (60 mM Endkonzentration) zugeben.
- 35,83 g Lactobionsäure in 100 mLH2O lösen.
- Stellen Sie den pH-Wert mit 5 M KOH auf 7,0 ein und bringen Sie das Volumen mit H 2 O auf bis zu200ml.
- Mischen Sie die Lösung und stellen Sie den pH-Wert mit 5 M KOH auf 7,1 ein.
- 1 g BSA, im Wesentlichen fettsäurefrei (1 g/L Endkonzentration), werden in einem 50 mL konischen Röhrchen gewogen. 40 ml der pH 7,1-Lösung aus Schritt 9 in das Röhrchen geben, vorsichtig zum Mischen invertieren und Schäumen vermeiden. Das gelöste BSA aus Schritt 9 in die verbleibende pH 7,1-Lösung überführen und vorsichtig und kontinuierlich umrühren. Überprüfen Sie den pH-Wert noch einmal, stellen Sie ihn bei Bedarf ein und bringen Sie das Endvolumen mit H2O auf 1000 ml.
- Das MiR05-Medium in konische 50-ml-Röhrchen einfüllen und bis zum Gebrauch bei -20 °C lagern. Nur einmal auftauen, kurz vor dem Gebrauch.
- Bereiten Sie Substrate, Entkoppler und Inhibitoren vor.
- 0,8 M Malat zubereiten: 536,4 mg L-Apfelsäure in 4 mlH2O auflösen. Mit 5 M KOH auf pH 7 neutralisieren und das Volumen mit H2 O auf5mL bringen. In Aliquots teilen und dann bei -20 °C lagern.
- 1 M Pyruvat zubereiten: 550 mg Brenztraubensäure-Natriumsalz in 4 mLH2O auflösen. Mit 5 M KOH auf pH 7 neutralisieren und das Volumen mit H2 O auf bis zu5mL bringen. In Aliquots teilen und dann bei -20 °C lagern.
- 0,5 M ADP (Adenosin-5′-diphosphat) zubereiten: 1,068 g ADP-Natriumsalz in 4 mLH2O auflösen. Mit 5 M KOH auf pH 7 neutralisieren und das Volumen mit H2 O auf5mL bringen. In Aliquots teilen und dann bei -20 °C lagern.
- 2 M Glutamat zubereiten: 3,7426 g L-Glutaminsäure-Monohydrat in 8 mLH2O auflösen. Mit 5 M KOH auf pH 7 neutralisieren und das Volumen mitH2O auf 10 mL bringen. In Aliquots teilen und dann bei -20 °C lagern.
- 4 mM Cytochrom cherstellen : 50 mg Cytochrom c in 1 mlH2O auflösen. In Aliquots teilen und dann bei -20 °C lagern.
- 1 M Succinat zubereiten: 2,701 g Succinatdinaxisalzhexahydrat in 8 mLH2O auflösen. Mit 1 N HCl auf pH 7 neutralisieren und das Volumen mitH2O auf 10 mL bringen. In Aliquots teilen und dann bei -20 °C lagern.
- 1 mM FCCP (Carbonylcyanid-4-(trifluormethoxy)phenylhydrazon herstellen): 2,54 mg FCCP in 10 ml reinem Ethanol auflösen. In Aliquots teilen und dann bei -20 °C lagern.
- 150 μM Rotenon zubereiten: 3,94 mg Rotenon in 10 ml reinem Ethanol auflösen, um 1 mM Stamm herzustellen, wirbelt bis er vollständig gelöst ist. Verdünnen Sie 225 μL 1 mM Rotenone-Stammkonzentration mit 1,275 mL reinem Ethanol, um 1,5 mL 150 μM Rotenon herzustellen. Vor Licht schützen, in Aliquots aufteilen und dann bei -20 °C lagern.
- 125 μM Antimycin A herstellen: 11 mg Antimycin A in 4 ml reinem Ethanol auflösen, um 5 mM-Stammkonzentration von Antimycin A herzustellen. 25 μL 5 mM Antimycin A-Stammkonzentration mit 975 μL reinem Ethanol verdünnen, um 1 ml 0,125 mM Antimycin A herzustellen.
- 0,8 M Ascorbat zubereiten: 1.584 g Ascorbat-Natriumsalz in 8 mLH2O auflösen. Den pH-Wert mit Ascorbinsäure auf pH 6 einstellen und das Volumen mitH2O auf bis zu 10 mL bringen. Vor Licht schützen, in Aliquots aufteilen und dann bei -20 °C lagern.
- 0,2 M TMPD (Tetramethyl-p-phenylendiamin) herstellen: 32,85 mg TMPD in 987,5 μL DMSO auflösen. 12,5 μL 0,8 M Ascorbat (10 mM Endkonzentration von Ascorbat) zugeben. Vor Licht schützen, in Aliquots aufteilen und dann bei -20 °C lagern.
- 4 M Natriumazid zubereiten: 2,6 g Natriumazid in 10 mLH2O auflösen. In Aliquots teilen und bei -20 °C lagern.
2. Tumorwachstum
- Züchten Sie EO771-Zellen in RPMI 1640-Wachstumsmedien und halten Sie die Zellen in einem 37 °C befeuchteten Inkubator mit 5%CO2.
- Einhaus vier Wochen alte weibliche C57BL/6J-Mäuse, halten sie bei 21-22 °C auf einem 12 h Hell-Dunkel-Zyklus. Geben Sie den Mäusen ad libitum Zugang zu Nahrung und Wasser.
- Sobald die Mäuse 10 Wochen alt sind, bereiten Sie die Zellen und die Mäuse auf die Implantation von Krebszellen vor.
- Trypsinisieren Sie die Zellen, deaktivieren Sie Trypsin mit Wachstumsmedien und zentrifugieren Sie die Zellen bei 500 x g für 5 min bei Raumtemperatur. Den Überstand absaugen und resuspendieren und kombinieren Sie die Zellpellets (nach Bedarf) in Medien. Zählen Sie lebensfähige Zellen mit Trypanblau und bereiten Sie eine Zellverdünnung von 1 x 10 6 Zellen ineinem Gesamtvolumen von 60 μL mit einer 1:1:1 Media/ Basement Membrane Matrix/PBS Lösung vor. Sobald die Basalmembranmatrix hinzugefügt wurde, mischen Sie gut und halten Sie die Zellsuspension auf Eis. Füllen Sie die Spritzen mit 60 μL Zellsuspension und legen Sie sie auf Eis. Arbeiten Sie effizient und injizieren Sie Zellen innerhalb von 1,5 Stunden nach der Zubereitung in Mäuse.
- Anästhesieren Sie Mäuse durch Isofluran-Inhalation (3% -5% für induktion und 1% -3% für die Erhaltung). Rasieren Sie sich zwischen den rechten4. und5. Leistenmammeldrüsen. Orthotopisch injizieren die anästhesierten Mäuse die EO771 Zellsuspension.
- Verwenden Sie elektronische Messschieber, um das Tumorwachstum zweimal pro Woche für 4 Wochen zu überwachen und zu messen. Bei der Nekropsie den Tumor (oder mindestens 60 mg Tumorabschnitt) sofort in 10 ml eiskaltes BIOPS ausschneiden, wiegen und dann platzieren. Halten Sie die Röhre auf Nassemis.
3. Geräteeinrichtung und -kalibrierung
- Erwärmen Sie das MiR05 Medium in einem 37 °C warmen Wasserbad.
- Schalten Sie das Oroboros O2k-System ein, öffnen Sie die DATLAB-Software, geben Sie Benutzer ein oder wählen Sie Benutzer. Klicken Sie auf Mit O2k verbinden. Überprüfen Sie die O2k-Konfiguration und stellen Sie sicher, dass das richtige Gerät für Power-O2k gekennzeichnet ist und jede Kammer dem richtigen Sauerstoffsensor entspricht. Klicken Sie auf OK. Sobald sich das O2k-Steuerungsfenster öffnet, stellen Sie unter der Registerkarte Systeme die Blocktemperatur auf 37 °C, die Rührdrehzahl auf 750 U/ min für beide Kammern und das Datenaufzeichnungsintervall auf 2,0 s ein. Überprüfen Sie sowohl die Rührerleistung als auch die Beleuchtung in der Kammer. Stellen Sie auf der Registerkarte Sauerstoff, O2 die Verstärkung für Sensor auf 1 V/μA (die Verstärkung muss möglicherweise für ältere Gerätemodelle angepasst werden), die Polarisationsspannung auf 800 mV und klicken Sie dann auf Mit O2k verbinden. Sobald eine neue Experimentdatei geöffnet wird, benennen Sie die Datei und klicken Sie auf Speichern. Sobald das Experiment aktiv ist, öffnet sich ein Protokollauswahlfenster. Klicken Sie auf Abbrechen, um eine benutzerdefinierte SUIT (Substrate Uncoupler Inhibitor Titration) auszuführen.
- Nach der Protokollauswahl wird ein Beispielfenster geöffnet, in dem Sie den experimentellen Code, den Beispieltyp, die Kohorte, den Beispielcode, die Beispielnummer und die Unterstichprobennummer ausfüllen können. Weisen Sie die Einheit mg zu und geben Sie die Tumorhomogenatkonzentration pro ml ein (Menge pro Kammer wird automatisch aufgefüllt). Stellen Sie sicher, dass das angegebene Medium MiR05 ist und das Kammervolumen 2,00 ml beträgt. Fügen Sie nach Bedarf Kommentare im unteren Feld hinzu und klicken Sie auf OK.
- Entfernen Sie die Stopfen und saugen Sie das 70% ige Ethanol aus den Kammern ab. Saugen Sie niemals in der Nähe der Membran ab, die auf der Innenseite der Kammer freigelegt ist. Viermal mit reinem Wasser abspülen und die Kammer mit 2,25 ml MiR05 füllen.
- Sensortest: Klicken Sie auf F9, um die Rührer für 30 s auszuschalten. Sobald sich der Rührstab wieder einschaltet, ist darauf zu achten, dass dieO2-Neigung in jeder Kammer monoexponential schnell ansteigt. Wenn die Kammer den Sensortest nicht besteht, überprüfen Sie die elektrischen Anschlüsse und reinigen Sie, ob sich Salze angesammelt haben. Wiederholen Sie den Test. Wenn der Sensor den Test weiterhin nicht besteht, entfernen Sie den Anschluss des polarographischen Sauerstoffsensors (POS), um die Membran zu inspizieren. Wenn sichtbare Schäden an der Membran, starke Oxidation oder signifikante Blasenansammlung beobachtet werden, stoppen Sie die experimentellen Verfahren und fahren Sie mit der Gerätewartung fort.
- Sauerstoffkalibrierung: Führen Sie eine Sauerstoffkalibrierung durch, um genaue Atemmessungen zu erhalten.
- Führen Sie die Stopfen mit einer Drehbewegung langsam in ihre volumenkalibrierte Position ein. Saugen Sie das überschüssige Medium ab, das durch die Injektionskapillar ausgestoßen wird, die sich in der Vertiefung des Stopfens sammelt. Heben Sie die Stopfen mit einer Drehbewegung gerade so weit an, dass sie eng an das Stopfen-Abstandshalter-Werkzeug passen, so dass ein Gasvolumen über der flüssigen Phase für den endgültigen Luftausgleich (30-45 Min.) verbleibt.
- Verwenden Sie den in diesem Zeitraum erreichten stationären Zustand, um den Sauerstoffsensor zu kalibrieren, um genaue Messungen der Atmung zu erhalten. DieO2-Steigung neg. (negative Steigung des Sauerstoffs) beträgt 0 ± 2 pmol/s·mL. Wenn der Wert höher als 2 pmol/s·ml ist, reinigen Sie die Kammer und füllen Sie sie mit frisch aufgetautem MiR05 auf. Wenn die Steigung instabil ist, fahren Sie mit der Gerätewartung fort.
- Nachdem Sie einen stationären Zustand erreicht haben, wählen Sie dieO2-Konzentrationskurve aus und markieren Sie den stetigen Bereich der Kurve, indem Sie die Umschalttaste gedrückt halten und mit der linken Maustaste klicken. Sobald der Bereich ausgewählt ist, klicken Sie auf F5,wählen Sie die Markierung für die Luftkalibrierung mit dem Dropdown-Pfeil aus und klicken Sie auf Kalibrieren und in die Zwischenablage kopieren.
- Instrumentelle Hintergrundkalibrierung (optional)
- Stellen Sie nach der Luftkalibrierung sicher, dass sich kein Gasvolumen über der flüssigen Phase befindet, um das Hintergrundgleichgewicht des Flusses (~ 15 min) zu erreichen, und schließen Sie die Kammern vollständig.
HINWEIS: Die in diesem Zeitraum erreichte Steady-State-Rate stellt einen instrumentellen Hintergrund dar und kann von den resultierenden Daten für eine verbesserte analytische Präzision subtrahiert werden. Die O2 Steigung neg. wird zunächst leicht ansteigen und zwischen ± 2 bis 4 pmol/s·mL liegen. - Wenn der Wert hoch ist (>6 pmol/s·ml), besteht eine mögliche biologische Kontamination. Reinigen Sie in diesem Fall die Kammer und füllen Sie sie mit frisch aufgetautem MiR05 auf. Sobald ein stationärer Zustand erreicht ist, wählen Sie die O2 Steigung neg. Kurve und markieren Sie den stetigen Bereich der Kurve, indem Sie die Umschalttaste gedrückt halten und mit der linken Maustaste klicken.
- Nachdem Sie den Bereich ausgewählt haben, klicken Sie auf F5, wählen Sie das Feld Baseline-Korrektur und die Markierung für Baseline mit dem Dropdown-Pfeil aus und klicken Sie auf OK.
- Stellen Sie nach der Luftkalibrierung sicher, dass sich kein Gasvolumen über der flüssigen Phase befindet, um das Hintergrundgleichgewicht des Flusses (~ 15 min) zu erreichen, und schließen Sie die Kammern vollständig.
4. Tumorhomogenat-Präparat
- Legen Sie einen Glashomogenisator mit 1 ml MiR05 und einen eng anliegenden Glasstößel auf Nasseis.
- Zum Zeitpunkt der Studie legen Sie das Gewebe in 1 ml BIOPS in eine eiskalte Petrischale.
- Reinigen und sezieren Sie das Gewebe, um lösliches Material zu maximieren, nekrotische Regionen zu vermeiden und marginales Tumorgewebe zu entfernen. Entfernen Sie mit einem Dissektionsmikroskop, einem Skalpell und einer chirurgischen Pinzette haare, nekrotisches Gewebe, peripheres Binde- und Gefäßgewebe sowie angrenzendes Fett. Achten Sie darauf, den Tumor während der Dissektion in eiskalten BIOPS zu halten.
- Schneiden Sie den Tumor in kleine Stücke (~ 5-10 mg pro Stück) und legen Sie die verbleibenden Tumorstücke wieder in 10 ml BIOPS auf Eis. Verwenden Sie dieses Gewebe später für zusätzliche Präparate, falls erforderlich.
HINWEIS: Führen Sie die folgenden Schritte schnell aus, um die Zeit zu minimieren, in der die Probe nicht vollständig in BIOPS eingetaucht ist. Sobald die Probe in MiR05 platziert ist, ist die Zeit von entscheidender Bedeutung. Bewegen Sie das vorbereitete Homogenat so schnell wie möglich vorsichtig in die kalibrierte Kammer. - Tupfen Sie die Gewebeabschnitte vorsichtig auf ein Filterpapier, legen Sie sie auf ein kleines, mit Kunststoff geteertes Wiegeboot und notieren Sie das anfängliche Nassgewicht. Legen Sie die unbenutzten Stücke zur weiteren Konservierung wieder in das konische 10-ml-Röhrchen von BIOPS.
- Tauchen Sie die Gewebeabschnitte in einen eiskalten Homogenisator mit MiR05 ein und notieren Sie gegebenenfalls das Restgewicht auf dem Wiegeboot.
- Mit einem Glasstößel (Abstandsbereich 0,09-0,16 mm) das Tumorgewebe vorsichtig stören, indem Sie 5-7 Down-and-Up-Schläge durchführen. Drehen Sie den Stößel für jeden Schlag 3 Mal im Uhrzeigersinn gegen den Uhrzeigersinn, während Sie den Stößel nach unten drücken, und 3 weitere Male, während Sie den Stößel wieder nach oben ziehen. Achten Sie darauf, dass sich das Gewebe zwischen den Schlägen am Boden des Homogenisators absetzt, aber vermeiden Sie es, den Stößel vollständig über das Flüssigkeitsvolumen zu bringen, um ein Aufschäumen zu verhindern.
HINWEIS: Das resultierende Homogenat sollte trüb mit minimalen festen Geweberesten erscheinen. - Gießen Sie das Homogenat in ein 15 ml großes konisches Rohr und legen Sie es auf Eis.
- 1-3 ml frisches MiR05 über den Stößel und in den Homogenisator pipettieren, um das verbleibende Gewebehomogenat zu waschen. Gießen Sie die MiR05-Wäsche in das konische Röhrchen, das das Homogenat enthält. Wiederholen Sie den Stößel und die Homogenisatorwäsche 2-3 Mal, um eine vollständige Übertragung des Homogenats zu gewährleisten. Beachten Sie die Zielkonzentration und das erforderliche Volumen, um die Probe während der Waschschritte nicht zu verdünnen.
- Um die Gewebehomogenatkonzentration genau zu berechnen, untersuchen Sie den Homogenisator und das Homogenat sorgfältig auf verbleibendes nicht homogenisiertes Material (d. H. Bindegewebe).
- Um das nicht homogenisierte Material aus dem Homogenisator zu entfernen, das mit einer Pinzette nicht erreicht werden kann, fügen Sie MiR05 zum Homogenisator hinzu, saugen Sie das Volumen (einschließlich des Gewebes) mit einer Pipette ab und bewegen Sie den Inhalt in eine Petrischale.
- Um das nicht homogenisierte Material aus dem Homogenat zu entfernen (in großen Stücken am Boden des konischen Rohres abgesetzt), aspirieren Sie die großen Stücke mit einer Pipette und legen Sie sie auf die Gewebekappe des konischen Rohres.
- Entfernen Sie das Gewebe mit einer Pinzette aus der Petrischale oder konischen Röhrchenkappe und tupfen Sie es auf Filterpapier. Fügen Sie das verbleibende Homogenat von der konischen Rohrkappe zurück in das konische Rohr hinzu, verschließen Sie es und kehren Sie es dann um, um es zu mischen.
- Überprüfen Sie die Homogenisatoren erneut, und homogenisieren Sie sie auf zusätzliches nicht homogenisiertes Material, und wiederholen Sie die Schritte 4.10.1-4.10.3, um das Material nach Bedarf zu entfernen.
- Wiegen und notieren Sie die Masse des aus dem Homogenisator gewonnenen nicht homogenisierten Materials. Untersuchen Sie das Homogenatpräparat auf grob intaktes Gewebe, das übertragen wurde. Entfernen Sie die nicht homogenisierten Stücke und wiegen Sie sie nach Bedarf.
- Subtrahieren Sie das Gewebegewicht, das vom Wiegeboot, homogenisator und homogenisiert (falls erforderlich) vom anfänglichen Nassgewicht, um das endgültige Probengewicht zu berechnen.
- Fügen Sie unter Verwendung des endgültigen Probengewichts zusätzliches MiR05 hinzu, um homogenat auf die gewünschte Konzentration zu bringen (siehe Schritt 5 für Details zu Optimierungsexperimenten).
- Sobald das Homogenat gewogen und vorbereitet ist, fahren Sie so schnell wie möglich mit der Untersuchung fort. Bewahren Sie die Probe auf Nassemis auf, bis sie auf das Instrument übertragen wird.
5. Substrat, Entkoppler, Inhibitor-Titrationsprotokoll (SUIT)
- Sobald das Instrument kalibriert und die Probe vorbereitet ist, entfernen Sie die Stopfen mit einer Drehbewegung und saugen Sie den MiR05 aus den Kammern ab (vermeiden Sie die Membran, die in der Kammer freigelegt wurde). Mischen Sie das Homogenat gut und geben Sie 2,25 ml des Homogenats in die Kammer. Wenn Sie ein Homogenat zu mehreren Kammern hinzufügen, pipettieren Sie jeweils 1 ml in jede Kammer, während Sie das Homogenat mischen, um eine gleichmäßige Gewebeverteilung zu gewährleisten. Klicken Sie auf F4, um das Ereignis zu benennen und mit einem Zeitstempel zu versehen, und klicken Sie dann auf OK.
- Füllen Sie eine 50 ml Spritze mit Sauerstoff aus einem Sauerstofftank mit einem Regler und Gasschlauch mit einer stumpfen 18 G Nadel. Hyperoxygenieren Sie die Kammern auf ~ 500 μM Sauerstoff. Dazu injizieren Sie Sauerstoff direkt in die Kammern. Setzen Sie die Stopfen locker ein und warten Sie mit dem Schließen, bis der Sauerstoff ~ 480 μM erreicht. Mit einer Drehbewegung die Kammer langsam schließen und die Atmung ausgleichen lassen (~15-20 min). Füllen Sie die zentrale Kapillare des Stopfens bei Bedarf mit MiR05.
- Analytische Bestimmung der OXPHOS- und ET-Kapazität (Elektronentransferzustand) der N-verknüpften und NS-verknüpften und CIV-Aktivität (Complex IV): Verwenden Sie spezielle Mikrospritzen, um Substrate, Entkoppler und Inhibitoren in vollständig geschlossene Kammern zu injizieren. Klicken Sie bei jeder Injektion auf F4, um die Ereignisse für jede Kammer in Echtzeit zu benennen und mit einem Zeitstempel zu versehen. Wählen Sie während der gesamten Studie F6 aus, um die O2-Konzentrations- undO2-Steigungsskalen nach Bedarf anzupassen. Nach jeder Injektion waschen Sie die Spritzen 3 mal in Wasser (für wasserlösliche Verbindungen) oder 70% Ethanol (für in Ethanol oder DMSO gelöste Verbindungen).
ANMERKUNG: N-verknüpft:O2-Fluss unterstützt durch definierte NADH-erzeugende Substratkombinationen, NS-verknüpft:O2-Fluss unterstützt durch die Konvergenz definierter NADH-erzeugender Substratkombinationen und Succinat.- 5 μL 0,8 M Malat (2 mM Endkonzentration) zugeben und sofort mit der nächsten Injektion fortfahren. Waschen Sie die Injektionsspritze 3 mal in Wasser.
- Fügen Sie sofort 5 μL 1 M Pyruvat (2,5 mM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat. Waschen Sie die Injektionsspritze 3 mal in Wasser.
- Fügen Sie 10 μL 0,5 M ADP (2,5 mM Endkonzentration) hinzu und warten Sie, bis sich die ADP-Reaktion stabilisiert hat. Waschen Sie die Injektionsspritze 3 mal in Wasser.
HINWEIS: Zusätzliche aDP (2,5-10 mM) kann erforderlich sein, um sicherzustellen, dass die Adenylatkonzentrationen nicht auf Atemflüsse beschränkt sind. - Fügen Sie 5 μL 2 M Glutamat (5 mM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat. Waschen Sie die Injektionsspritze 3 mal in Wasser.
- Fügen Sie 5 μL 4 mM Cytochrom c (10 μM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat. Waschen Sie die Injektionsspritze 3 mal in Wasser.
- Fügen Sie 20 μL 1 M Succinat (10 mM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat. Waschen Sie die Injektionsspritze 3 mal in Wasser.
- Titrieren Sie 0,5-1 μL-Schritte von 1 mM FCCP (2-20 μM Endkonzentration) und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, bis sich die Atmung nicht mehr erhöht. Waschen Sie die Injektionsspritze 3 mal in 70% Ethanol.
- Fügen Sie 2 μL 150 μM Rotenon (150 nM-2 μM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat. Fügen Sie weitere 1 μL Rotenon hinzu, um sicherzustellen, dass keine weitere Hemmung vorliegt. Wenn die Atmung abnimmt, fahren Sie mit zusätzlichen Injektionen fort, bis die Atmung nicht abnimmt. Waschen Sie die Injektionsspritze 3 mal in 70% Ethanol.
- Fügen Sie 2 μL 125 μM Antimycin A (125 nM-5 μM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat. Fügen Sie weitere 1 μL Antimycin A hinzu, um sicherzustellen, dass keine weitere Hemmung vorliegt. Wenn die Atmung abnimmt, fahren Sie mit zusätzlichen Injektionen fort, bis die Atmung nicht abnimmt. Waschen Sie die Injektionsspritze 3 mal in 70% Ethanol.
- Überprüfen Sie die Sauerstoffkonzentration der Kammer; Wenn die Konzentration unter 125 μM liegt, Reoxygenat in raumluft oder leicht hyperoxygenat, um sicherzustellen, dass Sauerstoff den Atemfluss nicht einschränkt. 5 μL 0,8 M Ascorbat (2 mM Endkonzentration) zugeben. Waschen Sie die Injektionsspritze 3 mal in 70% Ethanol.
- Fügen Sie sofort 10 μL 0,2 M TMPD (1 mM Endkonzentration) hinzu und warten Sie auf eine langsame Zunahme der Atmung. Waschen Sie die Injektionsspritze 3 mal in 70% Ethanol.
- 25 μL 4 M Natriumazid (50 mM Endkonzentration) sofort zugeben, wenn der Atemfluss von Ascorbat/TMPD hoch ist. Waschen Sie die Injektionsspritze 3 mal in 70% Ethanol.
- Beenden Sie die Studie - klicken Sie auf Datei, Speichern und Trennen. Fahren Sie mit dem Waschen der Kammer und der Spritze gemäß den Schritten 9.2-9.3 fort.
6. ADP-Empfindlichkeitsprotokoll
- Sobald das Instrument kalibriert und die Probe vorbereitet ist, entfernen Sie die Stopfen mit einer Drehbewegung und saugen Sie das MiR05 aus den Kammern ab (vermeiden Sie die Membran, die auf der Innenseite der Kammer freigelegt ist). Mischen Sie das Homogenat gut und geben Sie 2,25 ml des Homogenats in die Kammer. Angenommen, sie fügen sie ein Homogenat zu mehreren Kammern hinzu, pipettieren Sie jeweils 1 ml in jede Kammer, während Sie das Homogenat mischen, um eine gleichmäßige Gewebeverteilung zu gewährleisten. Klicken Sie auf F4, um das Ereignis zu benennen und mit einem Zeitstempel zu versehen, und klicken Sie auf OK.
- Setzen Sie die Stopfen ein und schließen Sie mit einer Drehbewegung langsam die Kammer und lassen Sie die Atmung ausgleichen (~ 15-20 min). Füllen Sie die zentrale Kapillare des Stopfens bei Bedarf mit MiR05.
- Analytische Bestimmung der Succinat-verknüpften mitochondrialen ADP-Sensitivität: Klicken Sie bei jeder Injektion auf F4, um die Ereignisse für jede Kammer in Echtzeit zu benennen und mit einem Zeitstempel zu versehen. Wählen Sie während der gesamten Studie F6 aus, um die O2-Konzentrations- undO2-Steigungsskalen nach Bedarf anzupassen.
- Fügen Sie 2 μL 150 μM Rotenon (150 nM Endkonzentration) hinzu.
- Fügen Sie sofort 20 μL 1 M Succinat (10 mM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat.
- ADP durch schrittweise Addition von subsättigenden Konzentrationen titrieren, bis die maximale Ansprechrate erreicht ist (VMAX;2,5-10 mM Endkonzentration).
HINWEIS: Die Rate kann nach der Injektion aufgrund einer geringfügigen Änderung der ADP-Konzentration ein Plateau erreichen, so dass die Injektionskonzentration nach jedem Plateau erhöht und mit der Titration fortgefahren wird, bis es auch bei einem umfachen Anstieg der ADP-Injektionskonzentration keine weitere Zunahme der Atmung gibt.
7. Empfohlene Optimierungsexperimente
- Bestimmen Sie die optimale Homogenat- und Sauerstoffkonzentration für das Protokoll.
- Führen Sie das SUIT-Protokoll (Schritte 5.1-5.3) bei mehreren Gewebekonzentrationen durch (z. B. 30 mg/ml, 20 mg/ml, 10 mg/ml, 5 mg/ml, 2,5 mg/ml, 1 mg/ml und/oder 0,5 mg/ml).
- Wählen Sie eine Konzentration, die den Atemfluss maximiert und gleichzeitig die Häufigkeit von Sauerstoffmangel (nicht mehr als 1-2) begrenzt. Wenn häufigere Sauerstoffanfälle erforderlich sind, verringern Sie die Konzentration des Homogenats.
- Bestimmen Sie die optimale Anzahl von Hüften mit dem Homogenisator.
- Führen Sie das SUIT-Protokoll (Schritte 5.1-5.3) auf mehreren Homogenisierungsebenen durch (z. B. 5 Striche, 10 Hübe, 15 Hübe, 20 Hübe).
- Da es in der Literatur nicht genügend Daten gibt, um einen Schwellenwert für den prozentualen Anstieg von Cytochrom c mit Tumorhomogenat-Präparat zu bestimmen, wählen Sie das Präparat mit begrenzter Cytochrom-c-Reaktion, aber ausreichender Atmung, die durch die interessierenden Substrate angeregt wird.
- Bestimmen Sie die optimalen Substrat-, ADP-, Entkopplungs- und Inhibitorkonzentrationen, die für quantitative und reproduzierbare Atemflüsse erforderlich sind.
- Führen Sie das SUIT-Protokoll (Schritte 5.1-5.3.9) bei der gewählten Gewebekonzentration (Schritt 7.1) durch. Titrieren Sie jedes Substrat, Entkoppler, Inhibitor und ADP, bis keine weitere Reaktion mehr beobachtet wird. Titrieren Sie die Hemmung mit Natriumazid in separaten Experimenten.
- 5 μL 0,8 M Malat (2 mM Endkonzentration) zugeben und sofort mit der nächsten Injektion fortfahren.
- Titrieren Sie 1 μL-Schritte von 1 M Pyruvat und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, fahren Sie fort, bis es keine zusätzliche Zunahme der Atmung gibt.
- Titrieren Sie 2 μL-Schritte von 0,5 M ADP und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, fahren Sie fort, bis es keine zusätzliche Zunahme der Atmung gibt.
- Titrieren Sie 1 μL-Schritte von 2 M Glutamat und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, fahren Sie fort, bis es keine zusätzliche Zunahme der Atmung gibt.
- Fügen Sie 5 μL 4 mM Cytochrom c (10 μM Endkonzentration) hinzu und warten Sie, bis sich die Atmung stabilisiert hat.
- Titrieren Sie 5 μL-Schritte von 1 M Succinat und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, fahren Sie fort, bis es keine zusätzliche Zunahme der Atmung gibt.
- Titrieren Sie 5 μL-Schritte von 0,5 M ADP und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, bis es keine zusätzliche Zunahme der Atmung gibt.
- Titrieren Sie 0,5 μL-Schritte von 1 mM FCCP und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, fahren Sie fort, bis es keine zusätzliche Zunahme der Atmung gibt.
- Titrieren Sie 1 μL-Schritte von 150 μM Rotenon und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, fahren Sie fort, bis es keine Abnahme der Atmung gibt.
- Titrieren Sie 1 μL-Schritte von 125 μM Antimycin A und warten Sie, bis sich die Atmung nach jeder Injektion stabilisiert hat, bis es keine zusätzliche Abnahme der Atmung gibt.
- 5 μL 0,8 M Ascorbat (2 mM Endkonzentration) zugeben.
- Sofort 5 μL 0,2 M TMPD (0,5 mM Endkonzentration) hinzufügen, warten Sie, bis die Atmung langsam zunimmt. In einem separaten Experiment fügen Sie 10 μL 0,2 M TMPD (1 mM Endkonzentration) hinzu.
- In separaten Experimenten werden 10 μL, 25 μL, 50 μL und 100 μL 4 M Natriumazid (20 mM, 50 mM, 100 mM, 200 mM Endkonzentration) sofort zugegeben, wenn der atemwegliche Fluss von Ascorbat / TMPD Plateaus erreicht.
- Wählen Sie die Substrat- und Inhibitorkonzentrationen, die innerhalb der ersten Injektion gesättigt sind, um den Zeitpunkt des Experiments zu verbessern. Verwenden Sie ADP bei Sättigungs- oder Subsättigungskonzentrationen, um ADP-Sensitivitätsauswertungen mit herkömmlichen SUIT-Protokollen zu kombinieren.
- Verwenden Sie submaximale Entkopplerkonzentrationen, um die Dosisreaktionsfähigkeit ohne Hemmung des Atmungsflusses nachzuweisen.
- Führen Sie das SUIT-Protokoll (Schritte 5.1-5.3.9) bei der gewählten Gewebekonzentration (Schritt 7.1) durch. Titrieren Sie jedes Substrat, Entkoppler, Inhibitor und ADP, bis keine weitere Reaktion mehr beobachtet wird. Titrieren Sie die Hemmung mit Natriumazid in separaten Experimenten.
8. Datenanalyse
- SUIT-Analyse
- Wählen Sie die Steady-State- oder Peak-Raten aus jeder Titration und jedem Export für die analytische Reduktion aus.
- Drücken Sie die Daten als pmol O2 pro Sekunde pro mg Gewebe (pmol/s/mg) aus.
- Erreichen Sie die analytische Reduktion von PM-L, PM-P, PMG-P, PMGS-P und PMGS-E, indem Sie die unempfindliche Rate von Antimycin A von der jeweiligen Rate abziehen (d. h. die Steady-State-Rate, die nach Zugabe von ADP erhalten wird).
HINWEIS: PM: Pyruvat + Malat; PMG: Pyruvat + Malat + Glutamat; PMGS: Pyruvat + Malat + Glutamat + Succinat; -L:Leckzustand; -P: Oxidativer Phosphorylierungszustand, -E: Elektronentransferzustand. - Erreichen Sie die analytische Reduktion von CIV-E, indem Sie die Natriumazid-Unempfindlichkeitsrate von der maximalen Ascorbat/TMPD-Rate abziehen.
- Erreichen Sie die analytische Reduktion von PMG-E, indem Sie die Rotenon-Unempfindlichkeitsrate von der PMGS-E-Rate subtrahieren.
- Erreichen Sie die analytische Reduktion von S-E, indem Sie die Antimycin A-Insensitive-Rate von der Rotenon-Insensitive-Rate subtrahieren.
- Erreichen Sie die analytische Reduktion der Cytochrom c-Kontrolleffizienz, eines Markers für die Intaktheit der äußeren Membran, durch die folgende Gleichung:
jc = ((JCHNOc - JCHNO)/JCHNO) x 100
In der Gleichung ist jc der prozentuale Anstieg bei Zugabe von Cytochrom c, JCHNOc ist der Sauerstofffluss nach der Zugabe von Cytochrom cund JCHNO ist der Sauerstofffluss vor der Zugabe von Cytochrom c.
- ADP-Sensitivitätsanalyse
- Bestimmen Sie analytisch die Kinetik für die ADP-Sensitivität relativ zur Leckrate von Succinat + Rotenon (nicht die Rate des Gewebehomogenats).
- Zeichnen Sie denO2-Fluss (Y-Achse) gegen die relative ADP-Konzentration (X-Achse). Bestimmen Sie die maximale Atemgeschwindigkeit (Vmax) als Spitzenrate, die über die ADP-Titration erreicht wurde.
- Bestimmen Sie die Michaelis-Menten-Kinetik mit einer Kurvenanpassungssoftware (PRISM, Version 10.1), um die ADP-Konzentration aufzudecken, bei der 1/2 VMAX erreicht wird (Apparent KM).
9. Instrumentelle Qualitätskontrolle
- Führen Sie den instrumentellen O2-Hintergrund über den gewünschten Sauerstoffkonzentrationsbereich (0-600 μM) und die Nullkalibrierung durch.
- Ausführen der Schritte 3.1 und 3.2
- Entfernen Sie die Stopfen und saugen Sie das 70% ige Ethanol aus den Kammern ab (vermeiden Sie die Membran, die auf der Innenseite der Kammer freigelegt wird). 4-mal mit doppelt destilliertemH2O abspülenund die Kammer mit 2,25 ml MiR05 füllen
- Hyperoxygenieren Sie die Kammern auf ~ 600 μM Sauerstoff.
- Führen Sie die Stopfen langsam in ihre vollständig geschlossene Position ein. Saugen Sie das überschüssige Medium ab, das durch die Injektionskapillar ausgestoßen und im Brunnen des Stopfens gesammelt wird, und lassen Sie das Sauerstoffsignal stabilisieren (30-45 min).
- Um eine Sauerstoffkalibrierung durchzuführen, wählen Sie den Bereich aus, in dem sowohl die Sauerstoffkonzentration als auch die Steigung stabil sind, öffnen Sie das Kalibrierfenster für die jeweilige Kammer und wählen Sie die R1-Markierung aus.
- Bereiten Sie die Dithionitlösung vor, indem Sie 20 mg Natriumhydrosulfit in 0,5 ml Wasser auflösen. Begrenzen Sie die Exposition gegenüber Luft, da Dithionit im Laufe der Zeit mit Sauerstoffexposition oxidiert wird.
- Sobald das Sauerstoffsignal stabilisiert ist, injizieren Sie 1 μL und beobachten Sie den Rückgang der Sauerstoffkonzentration. Stellen Sie die Wirksamkeit der Dithionitlösung nach Bedarf ein.
- Injizieren Sie ausreichend Dithionitlösung, um die Sauerstoffkonzentration auf 450 μM, 300 μM, 225 μM, 150 μM, 75 μM bzw. 0 μM zu senken. Lassen Sie den Sauerstoff bei jeder Injektion stabilisieren und wählen Sie eine Markierung für die Steady-State-Steigung. Sobald die Sauerstoffkonzentration ~ 0 μM beträgt, markieren Sie die Sauerstoffkonzentration.
- Um eine instrumentelle O2-Hintergrundkorrektur durchzuführen, wählen Sie das Fluss-/Neigungsfenster für die jeweilige Kammer, wählen Sie O 2-Hintergrundkalibrierung und klicken Sie auf Kalibrieren für die gewünschten Markierungen.
- Um eine Nullkalibrierung durchzuführen, öffnen Sie das Kalibrierfenster für die jeweilige Kammer und wählen Sie die R0-Markierung, die nach der Dithionittittittierung erreicht wurde.
- Instrumentenreinigung
- Spülen Sie jede Kammer dreimal schnell mit reinem Wasser ab. Für die erste Wäsche das Homogenat absaugen, die Kammer vollständig mit Wasser füllen und dann das Wasser absaugen. Für die zweite Wäsche füllen Sie die Kammer 3/4 mit Wasser, führen Sie die Stopfen ein, um Wasser durch die Injektionskapillar zu drücken, saugen Sie etwas Wasser durch die Injektionskapillar ab und entfernen Sie dann die Stopfen, um die Wäsche vollständig abzusaugen.
- Waschen Sie die Kammern mit 70% Ethanol für 5 min.
- Reinigen Sie die Stopfen über einer Spüle oder einem Becher mit reinem Wasser, 70% Ethanol und 100% Ethanol und drücken Sie mit einer Waschflasche Flüssigkeit durch die Injektionskapillaren.
- Spülen Sie jede Kammer zweimal schnell mit reinem Wasser ab.
- Inkubieren Sie die Kammern mit 2 ml PBS, die ~ 2 mg gefrorene Mitochondrien, Zelllysat oder lebende Fibroblasten enthalten, für 15 Minuten.
- Waschen Sie die Kammern zweimal 5 Minuten lang mit reinem Wasser.
- Waschen Sie die Kammern mit 70% Ethanol für 5 min zweimal.
- Waschen Sie die Kammern mit 100% Ethanol für 10 min.
- Füllen Sie die Kammern mit 70% Ethanol.
- Wenn Sie ein aufeinanderfolgendes Experiment durchführen, lassen Sie die Kammern 5 Minuten lang in 70% Ethanol und fahren Sie dann mit Schritt 3.3 fort.
- Wenn die Experimente abgeschlossen sind, setzen Sie deckel auf die Stopfen und schalten Sie das Instrument aus.
- Reinigen Sie die Injektionsspritzen nach jedem Gebrauch ordnungsgemäß und bewahren Sie die Spritzen für eine bestimmte Verwendung von Verbindungen auf, um eine Verschleppung zu verhindern.
- Führen Sie die Spritze in die Waschflüssigkeit ein und tauchen Sie die Injektionsnadel vollständig ein.
- Ziehen Sie die Waschflüssigkeit bis zum maximalen Volumen in die Spritze.
- Nehmen Sie die Spritze aus dem Waschbehälter, werfen Sie die Waschflüssigkeit in ein Becherglas und tupfen Sie dann die Spritze auf ein Papiertuch.
- Wiederholen Sie die Schritte 9.3.1-9.3.3 dreimal so schnell wie möglich nach jedem Gebrauch.
Ergebnisse
Erste Studien zeigten, dass EO771-Tumoren niedrig oxidativ waren und daher hohe Homogenatkonzentrationen für eine adäquateO2-Flussbestimmung erforderten. Es wurden Optimierungsexperimente durchgeführt, um den optimalen Konzentrationsbereich des Gewebehomogenats für die Studie zu bestimmen. Tumorhomogenate wurden zunächst bei 40 mg/ml hergestellt und dann linear verdünnt. Der auf die Gewebemasse normierteO2-Fluss war über die Konzentrationen hinweg konsistent (Abbildungen 1A-D). Es wurde beobachtet, dass 40 mg/ml zu einem schnellen Sauerstoffmangel führten und nicht für Experimente geeignet waren (Abbildung 1A). Der Sauerstoffverbrauch verlangsamte sich mit 30 mg/ml und 20 mg/ml erheblich, nahm aber in Abwesenheit von Substraten oder ADP in kurzer Zeit rapide ab (Abbildung 1B,C). Die Konzentration von 10 mg/ml führte zu der optimalen Sauerstoffverbrauchsrate (Abbildung 1D), die ein längeres 90-minütiges SUIT-Protokoll unterstützen würde.
Ein SUIT-Protokoll wurde verwendet, um NADH- und Succinat-verknüpfte OXPHOS- und ET-Aktivitäten sowie die CIV-Aktivität zu bewerten (Abbildung 2A). Pyruvat und Malat wurden dem Gewebehomogenat in Abwesenheit von ADP zugesetzt, um Leckagen (L) durch NADH zu treiben. Sättigungs-ADP wurde dann hinzugefügt, um maximale NADH-verknüpfte OXPHOS (P) zu fahren, gefolgt von der Zugabe von Glutamat. Cytochrom c wurde dann hinzugefügt, um die Integrität der äußeren Membran zu gewährleisten; der Anstieg der Atmungsrate betrug in allen Proben weniger als 20 % (Abbildung 2B). Angesichts der sehr geringen Reaktion auf NADH-gebundene Substrate wurde die Cytochrom-c-Freisetzung auch in Gegenwart von Succinat und Rotenon bewertet und eine minimale Cytochrom-c-Stimulation beobachtet (Abbildung 2B). Interessanterweise war NADH-chromosomales OXPHOS bei EO771-Tumoren vernachlässigbar (Abbildung 2C). Succinat wurde dann in Gegenwart von Pyruvat, Malat und Glutamat hinzugefügt, um den Elektronenfluss durch Succinatdehydrogenase zu stimulieren. FCCP wurde dann titriert, um den maximalen Elektronenfluss (E) anzutreiben, was zeigte, dass bei EO771-Tumoren die Phosphorylierung und nicht die Oxidation auf die Atmung beschränkt war (Abbildung 2C). Rotenon und Antimycin A wurden anschließend titriert, um Komplex I bzw. Komplex III zu hemmen. Ascorbat und TMPD wurden dann hinzugefügt, um den maximalen Elektronenfluss durch CIV zu steuern, der dann durch Natriumazid gehemmt wird. Tabelle 1 veranschaulicht analytische Reduktionsgleichungen der Rohdaten (Tabelle 2), um die in Abbildung 2Cdargestellten Respiratorischen Parameter zu quantifizieren. Insgesamt ähneln die Tumorhomogenat-Atemprofile (Abbildung 2C) denen von nicht implantierten digitoninpermeabilisierten EO771-Zellen (Abbildung 2D) mit Ausnahme eines verminderten maximalen Elektronentransfers, der durch N- und S-verknüpfte Substrate im Tumor unterstützt wird.
Da die NADH-gebundene Atmung vernachlässigbar war, wurde die respiratorische Kinetik von Succinat durch schrittweise Titrationen von subsättigen ADP weiter bewertet, bis die maximale Rate (VMAX)erreicht war (Abbildung 3A, 3B). Die halbmaximale Konzentration (KM)von ADP in Gegenwart von Succinat + Rotenon betrug 37,5 μM, während die VMAX ~10,5 pmol/s/mg betrug (Abbildung 3C). So waren EO771-Tumoren trotz relativ schlechter Oxidationsraten hochempfindlich gegenüber ADP und hielten die ATP-Synthese bei relativ niedrigen ADP-Konzentrationen aufrecht.
Die Auswahl geeigneter Bereiche der Rohdaten für die Extraktion ist entscheidend für die Reproduzierbarkeit von Experimenten und die genaue Quantifizierung. Für Cytochrom cmuss unmittelbar vor der Injektion eine Markierung im Steady-State ausgewählt werden(Abbildung 4A,Markierung 1). Es gibt oft ein anfängliches Injektionsartefakt, dem eine Zeitspanne (ca. 5-10 min) folgen kann, in der derO2-Fluss nicht konstant ist. Die Bewertung der Cytochrom-c-Effizienz erfolgt durch eine zusätzliche Auswahl, sobald sich derO2-Fluss stabilisiert hat(Abbildung 4A,Markierung 2). Selektionen nach zugesetzten Substraten, ADP oder den meisten Inhibitoren erfolgen ebenfalls nach dem Injektionsartefakt und sobald sich derO2-Fluss stabilisiert hat (Abbildung 4B). Die Auswahl, die zur Bestimmung der maximalen entkoppelten Atmung verwendet wird, erfolgt bei der Spitzenerhöhung, die während der Titration von FCCP erreicht wird, was oft nicht die letzte Injektion ist (Abbildung 4C). Die Auswahl für TMPD erfolgt nach Zugabe von Ascorbat und TMPD und auf dem Höhepunkt der Atmungszunahme(Abbildung 4D,Markierung 1). Kurz nach diesem Peak wird der Inhibitor, Natriumazid, zugegeben, der die Atmung schnell verringert, aber auch oft ein Injektionsartefakt aufweist, das niedriger ist als die gehemmte Atmungsrate (Abbildung 4D). Die Inhibitormarkierung wird unmittelbar nach dem Injektionsartefakt gebildet(Abbildung 4D,Markierung 2). DerO2-Fluss stabilisiert sich typischerweise nicht und nimmt weiter ab.
Tabelle 1: Respiratorische Notation und analytische Ableitung. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Proben- und Atmungseigenschaften von luminalen B-Brusttumorhomogenaten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.

Abbildung 1: Optimierung der Tumorhomogenatkonzentration. O2 Flussmittel (rot) undO2 Konzentration (blau) in Mammatumorhomogenaten, hergestellt bei (A) 40 mg/ml, (B) 30 mg/ml, (C) 20 mg/ml und (D) 10 mg/ml. Thom: Gewebehomogenat-Atmung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
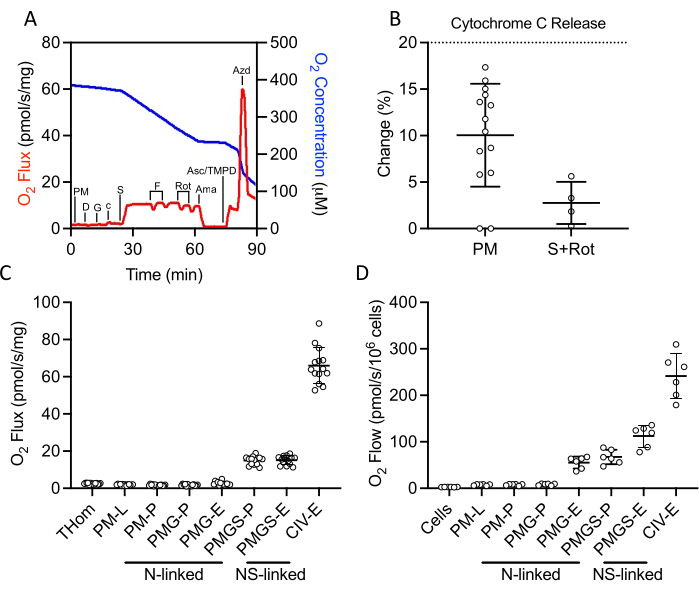
Abbildung 2: Bewertung der OXPHOS- und ET-Kapazität durch hochauflösende Respirometrie in frisch ausgeschnittenen Tumorhomogenaten. (A) Repräsentative Darstellung des Sauerstoffverbrauchs (rot) und der Konzentrationen (blau) im Verlauf eines Substrat-, Inhibitor- und Entkopplerprotokolls. PM: Pyruvat + Malat, D: ADP, G: Glutamat, c: Cytochrom c, S: Succinat, F: FCCP, Rot: Rotenon, Ama: Antimycin A, Asc/TMPD: Ascorbat/Tetramethyl-p-phenylendiamin. (B) Prozentualer Anstieg desO2-Flusses bei Zugabe von Cytochrom c. (C-D) Die Atmung unterstützt durch Malat, Pyruvat, Glutamat und Succinat in Gegenwart von ADP, FCCP und Ascorbat/TMPD in (C) EO771-abgeleiteten Tumorhomogenaten und (D) nicht implantierten EO771-Digitonin-permeabilisierten Zellen. Thom: Gewebehomogenat-Atmung; PM: Pyruvat + Malat; PMG: Pyruvat + Malat + Glutamat; PMGS: Pyruvat + Malat + Glutamat + Succinat; CIV: Komplex IV; -L: Leckzustand; -P: Oxidativer Phosphorylierungszustand, -E: Elektronentransferzustand; N-verknüpft:O2-Fluss, unterstützt durch definierte NADH-erzeugende Substratkombinationen; NS-gebunden:O2-Fluss unterstützt durch die Konvergenz von definierten NADH-erzeugten Substratkombinationen und Succinat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
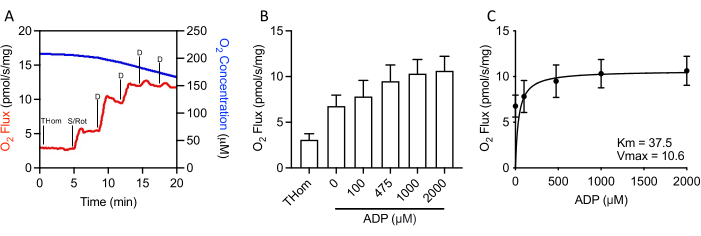
Abbildung 3: EO771-Brusttumoren zeigten eine hohe ADP-Sensitivität (Adenosin-5′-Diphosphat). (A) Repräsentative Darstellung des Sauerstoffverbrauchs (rot) und der Konzentrationen (blau) in einem S-gebundenen ADP-Titrationsprotokoll. Thom: Gewebehomogenat-Atmung; S/Rot: Succinat/Rotenone; D: ADP. (B) Atmung unterstützt durch Succinat in Gegenwart von Rotenon und steigende Konzentrationen von ADP (0 μM ADP = S/Rot-L). (C) Maximale Rate (VMAX) und halbe maximale Konzentration (KM) von ADP in Gegenwart von Succinat + Rotenon. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
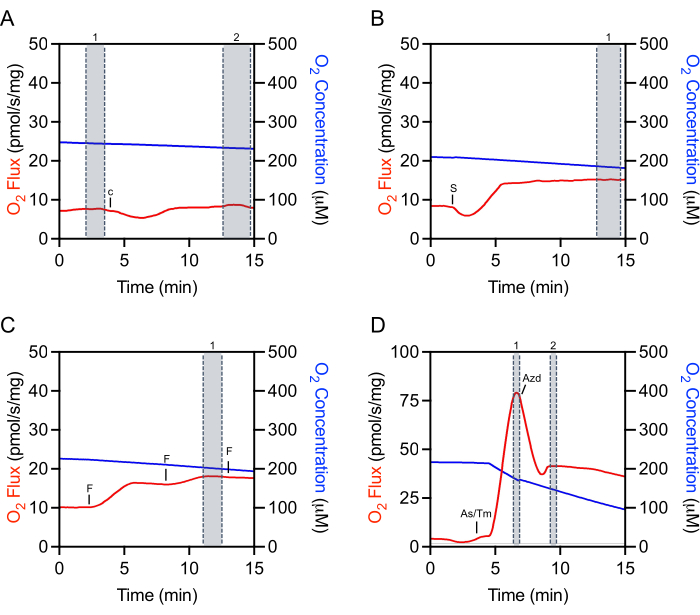
Abbildung 4: Repräsentative Rückverfolgung zur Veranschaulichung der Markierungsauswahl vonO2-Rohflüssen für die Datenextraktion. (A) Cytochrom-c-Auswahl: Auswahl Nummer 1 vor der Cytochrom-c-Injektion und Auswahlnummer 2 nach der Injektion, wenn sich derO2-Fluss stabilisiert hat. c Cytochrom c. (B) Substrat-, ADP- und Inhibitorauswahl: Auswahl Nummer 1 nach der Injektion (Succinat in diesem repräsentativen Diagramm), bei der sich derO2-Fluss stabilisiert hat. S: Succinat. (C) Entkoppeltelektion: Auswahl Nummer 1 bei der maximalen Zunahme der Atmung während der Entkoppeltitration. In diesem repräsentativen FCCP-Titrationsdiagramm verringert die dritte Injektion die Atmung leicht und wird daher nicht zur Selektion verwendet. F: ACCP. (D) TMPD-Auswahl: Auswahl Nummer 1 bei der maximalen Zunahme der Atmung nach den Ascorbat- und TMPD-Injektionen. Natriumazidauswahl: Auswahl Nummer 2 nach dem akuten Injektionsartefakt, wenn die Atmung anfänglich abnimmt. As/Tm: Ascorbat/TMPD; Azd: Azid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Ansätze zur Bewertung der mitochondrialen Atmung bei Krebs waren weitgehend auf die In-vitro-Modelle 13,14,15,16beschränkt. Einige Erfolge wurden bei der Messung der mitochondrialen Atmung in Tumoren mittels chemischer Permeabilisierung6,7,17erzielt, aber es gibt keinen einheitlichen Goldstandardansatz, der universell angewendet und über Tumorarten hinweg verglichen werden kann. Darüber hinaus hat das Fehlen einer konsistenten Datenanalyse und Berichterstattung die Generalisierbarkeit und Reproduzierbarkeit der Daten eingeschränkt. Die hier beschriebene Methode bietet einen einfachen, relativ schnellen Ansatz zur Messung der mitochondrialen Atmung18 in mitochondrialen Präparaten aus frisch ausgeschnittenen soliden Tumorproben. Tumore wurden aus orthotopisch implantierten murinen Luminal B, ERα-negativen EO771 Brustkrebszellengezüchtet 19.
Sorgfalt und Sorgfalt bei der Gewebehandhabung werden die Genauigkeit und Normalisierung der Sauerstoffverbrauchsraten erheblich verbessern. Das Gewebe und die Mitochondrien können leicht beschädigt werden, wenn die Probe nicht kalt gehalten wird, nicht konsequent in Konservierungsmedien eingetaucht wird oder übermäßig gehandhabt wird, was zu suboptimalen Routine- und OXPHOS-Raten führt. Darüber hinaus ist das genaue Nassgewicht des homogenisierten Gewebes von entscheidender Bedeutung, da dies die primäre Normalisierungsmethode ist. Andere Normalisierungsmethoden können in Betracht gezogen werden, wie z.B. Gesamtprotein oder mitochondriale spezifische Marker, wie die Citratsynthase-Aktivität20. Darüber hinaus muss die Heterogenität des Gewebes angegangen werden, wobei Entscheidungen über Tumorregionen in Experimente einbezogen werden sollen, die a priori getroffen werden. Nekrotisches, fibrotisches und Bindegewebe homogenisiert und / oder atmet nicht gut und sollte vermieden werden, es sei denn, diese Tumorregionen werden absichtlich untersucht. Insbesondere kann der Tumor je nach Art und Exzisionsregion sehr klebrig sein, was das genaue Wiegen und Übertragen schwieriger macht. Die Anzahl der Schläge, die für Homogenisierungen verwendet werden, sollte optimiert werden, um eine vollständige Vorbereitung der Mitochondrien zu gewährleisten und gleichzeitig die Schädigung der äußeren mitochondrialen Membranen zu mildern.
Für eine verbesserte Genauigkeit und Reproduzierbarkeit empfehlen wir die Durchführung von Optimierungsexperimenten für die Anzahl der Schläge für die Homogenatpräparation, die Gewebekonzentration und die Konzentrationen von Substrat, Entkoppler und Inhibitoren. Studien können die unterschiedliche Anzahl von Schlaganfällen vergleichen und wie sie mit der Reaktion auf die Zugabe von Cytochrom c innerhalb der Studie sowie der maximalen mitochondrialen Atmungskapazität korrespondieren 21. Obwohl allgemein anerkannt ist, dass eine geringere Cytochrom-c-Reaktion besser ist, da eine Erhöhung des Sauerstoffverbrauchs nach Zugabe von Cytochrom c auf eine Schädigung der äußeren mitochondrialen Membran hinweisen kann, gibt es keinen Goldstandard, was dieser Schwellenwert für jedes Gewebe ist, und sollte experimentell untersucht werden, um sicherzustellen, dass das Gewebe nicht überarbeitet oder untervorbereitet wird. In diesem Tumorgewebe wurde festgestellt, dass eine Cytochrom-c-Reaktion unter ~ 30% die Atmungsfunktion nicht beeinträchtigte. Die Verwendung von Cytochrom c wird entscheidend für die genaue Quantifizierung der Atmungskapazität, wenn der Test positiv ist. In diesem Fall füllt die Zugabe das endogene Cytochrom c auf, das, wenn es erschöpft ist, eine Unterschätzung der Atemfrequenzen verursacht.
Gewebekonzentrationstitrationsexperimente können über eine Reihe von machbaren Konzentrationen durchgeführt werden und würden idealerweise mit SUITs durchgeführt, die während der Studie untersucht werden. Die Atmungskapazität variiert je nach Tumortyp und -zusammensetzung. Daher erfordern Tumore, die mit Mitochondrien oder hoher Atmungskapazität dicht sind, niedrigere Konzentrationen (0,5-5 mg / ml). Tumore mit wenigen Mitochondrien oder geringer Atmungskapazität erfordern höhere Konzentrationen (7-12 mg / ml). Darüber hinaus benötigen SUITs, die lang sind oder stark verbrauchte Substrate aufweisen, möglicherweise weniger Gewebe, um eine Reoxygenierung der Kammer oder eine ADP-Begrenzung zu verhindern. Einige Gewebe haben eine lineare Beziehung im Sauerstoffverbrauch, während andere in bestimmten Konzentrationsbereichen eine verbesserte Empfindlichkeit und maximale Oxidation aufweisen. Die gewählte Gewebekonzentration sollte optimiert werden, um den Sauerstofffluss zu maximieren und gleichzeitig die Anzahl der Reoxygenierungsereignisse zu begrenzen. Darüber hinaus ist es oft besser, den Bedarf zu überschätzen oder das obere Ende des Konzentrationsbereichs anzustreben. Die Inhibitoren, die für die Quantifizierung von Atemwegen unerlässlich sind, sind präziser, wenn sie in größeren Mitochondrienpools eingesetzt werden.
Eine weitere wesentliche Überlegung ist die Konzentration der Medikamente, die während der Protokolle verwendet werden. Änderungen der Homogenatkonzentration können die Konzentrationen von Substraten, Entkopplern und Inhibitoren verändern, die für ein maximales Ansprechen erforderlich sind. Sobald also der optimale Konzentrationsbereich ausgewählt ist, sollte ein Experiment durchgeführt werden, in dem die für das SUIT-Protokoll erforderlichen Dosen getestet werden. Zusätzliches ADP kann hinzugefügt werden, um sicherzustellen, dass die Adenylatkonzentrationen nicht auf Atemflüsse beschränkt sind. Chemische Entkoppler wie FCCP oder CCCP hemmen die Atmung bei höheren Konzentrationen22. Daher ist es wichtig, in kleinen Mengen zu titrieren, um die maximal erreichte Rate aufzudecken. Inhibitoren wie Rotenon und Antimycin A werden am besten verwendet, wenn sie innerhalb der ersten Injektion gesättigt werden. Während in Vorversuchen optimale Konzentrationen bestimmt wurden, haben wir auch behandlungsbedingte Unterschiede in der Reaktion auf Inhibitoren beobachtet und fügen daher oft eine zusätzliche Injektion von Inhibitoren hinzu, um eine maximale Hemmung nachzuweisen, da die resultierenden Raten als Grundlage für die Quantifizierung dienen. Die chemische Hemmung von Ascorbat/TPMD ist für eine genaue analytische Reduktion unerlässlich, da TMPD einer Autooxidation unterzogen wird23. Wir kontrollierten die Autooxidation von Ascorbat / TMPD / Cytochrom c durch die Zugabe von Natriumazid, einem etablierten CIV-Inhibitor. Für die Km-Studien verhindert die Zugabe von Rotenon in Gegenwart von Succinat allein die Oxalacetatakkumulation, die die Succinatdehydrogenase-Aktivität bei niedrigen Konzentrationen hemmen kann24. Das Volumen und die Konzentration von ADP hängen stark von der Empfindlichkeit der Mitochondrien gegenüber der vorherrschenden Substratkombination ab. Mitochondriale Präparate, die sehr empfindlich auf ADP reagieren, erfordern niedrigere Ausgangskonzentrationen. Darüber hinaus sind validierte Chemikalien und die richtige Arzneimittelaufbereitung unter Berücksichtigung des pH-Wertes, der Lichtempfindlichkeit (falls zutreffend) und der Lagertemperatur für erfolgreiche Experimente unerlässlich.
Instrumentenaufbau und Routinepflege sind für den Erfolg dieser Experimente von entscheidender Bedeutung. Eine angemessene und ordnungsgemäße Reinigung der Kammern ist für die Reproduzierbarkeit und Vorbeugung von biologischen, Protein-, Inhibitor- oder Unkopplikatorenkontaminationen unerlässlich. Clark-Elektroden und O2k-Systeme verwenden Glasreaktionskammern, was einen erheblichen Kostenvorteil gegenüber plattenbasierten Systemen darstellt, die auf Verbrauchsmaterialien angewiesen sind. Die Glaskammern müssen jedoch kräftig gereinigt werden und können in späteren Studien eine Quelle der Inhibitorkontamination sein. Die Inkubation mit mitochondrienreichen Proben während des Waschprozesses (z. B. isolierte Herz- oder Lebermitochondrien) kann das Risiko einer experimentellen Kontamination verringern und wird zusätzlich zu Verdünnungs- und alkoholbasierten Waschverfahren empfohlen. Wenn konsekutive Studien durchgeführt werden, minimiert die Reinigung mit Ethanol und Mitochondrien die Möglichkeit einer Inhibitorkontamination. Die Kalibrierung des Sauerstoffsensors wird vor jedem Experiment empfohlen, um genaue Messungen der Atmung relativ zum vorherrschenden Sauerstoffpartialdruck zu erhalten. Wenn mehrere Kalibrierungen nicht durchführbar sind, kann eine Kalibrierung pro Tag ausreichen, wenn die Sauerstoffkonzentration nach dem Waschvorgang stabil und konstant bleibt.
Die oben beschriebenen Verfahren nutzen das Oroboros O2k-Instrument zur Messung des Sauerstoffverbrauchs im Tumorgewebe innerhalb von 4 Stunden nach der Tumorexzision unter Verwendung einer zuvor entwickelten und optimierten Konservierungslösung und der Beatmungsmedien25,26,27. Mehrere Parameter in diesem Protokoll können für nachfolgende Anwendungen geändert werden. Der Geräteaufbau und die Kalibrierung, die homogenisatoren, die für die Gewebevorbereitung verwendet werden, und die optimale Homogenat- und Kammersauerstoffkonzentration können alle für den Einsatz auf anderen Instrumenten mit Sauerstoffüberwachungspotenzial angepasst werden. Zum Beispiel wurden die Kammern beim Hinzufügen von Homogenat leicht überfüllt, und wenn die Kammer vollständig geschlossen ist, bleibt die Kammerkapillar voll. Dies verbraucht etwas Sauerstoff in der Kammer, aber mit der Optimierung der Probenkonzentration können wir diesen Verbrauch bei der Bestimmung des Sauerstoffgehalts berücksichtigen, mit dem wir beginnen sollen. Alternativ kann die Probe bei Umgebungssauerstoff ausgeglichen werden, bevor die Kammer geschlossen wird, aber dies erhöht oft die Zeitspanne vor Beginn des Experiments und verzögert die Zugabe von Substraten. Während die in diesem Protokoll verwendeten Homogenisatoren allgemein zugänglich sind, könnten andere kommerzielle Homogenisierungstechniken eingesetzt werden, wie z.B. ein Gewebezerkleinerer oder ein automatisierter Homogenisator28.
Darüber hinaus können die Gewebevorbereitungs- und Instrumentenverfahren mit einer Reihe verschiedener SUITs verwendet werden, um die Atemkontrolle durch eine Vielzahl von Kopplungs- und Signalwegkontrollzuständen zu untersuchen29. Diese SUIT-Protokolle wurden entwickelt, um die Funktionsfähigkeit zu messen, und somit hat der Beitrag potenzieller endogener Substrate keinen Einfluss auf die Kapazitätsmessung. Wir berücksichtigen analytisch den nicht-mitochondrialen Sauerstoffverbrauch und/oder den Restverbrauch des Homogenats durch Subtraktion des Antimycin-A-Rotenons bzw. natriumazidunempfindlicher Raten. Mitochondrien können in BIOPS oder ähnlich aufgebauten Konservierungslösungen für längere Zeit (>24 h) lebensfähig bleiben, abhängig von Gewebetyp und Unversehrtheit30,31. Studien können im Voraus durchgeführt werden, um die zeitlichen Lagergrenzen zu bestimmen, da OXPHOS bestimmter Substrate unterschiedliche Einschränkungen haben kann. Dies ist unerlässlich, wenn das Experiment nicht innerhalb weniger Stunden nach der Gewebeexzision / Biopsie durchgeführt werden kann. 37°C ist eine optimale und physiologische Temperatur zur Beurteilung der Atmungsfunktion in den meisten Säugetiersystemen. Wenn jedoch die Assay-Temperatur die Bewertung32zu stören scheint, können Vergleichsstudien über einen weiten Temperaturbereich (25-40 °C) durchgeführt werden, um eine angemessene Reaktionsfähigkeit zu gewährleisten. Instrumentelle Einschränkungen können die Fähigkeit zur Durchführung solcher Studien einschränken.
Haupteinschränkungen der oben beschriebenen Methode sind 1) das Potenzial für eine Schädigung der Mitochondrien durch mechanische Homogenisierung, 2) das Vorhandensein von ATPasen oder anderen subzellulären Biochemikalien in Homogenatpräparaten, die die gleichzeitige Bestimmung von ATP oder anderen Variablen von Interesse stören können und zusätzliche Korrekturmethoden erfordern oder Inhibitoren verwenden33 , und 3) die Auswertung vieler Proben und/oder mehrerer SUITs pro Probe ist zeitaufwendig, da ein Instrument zwei Experimente gleichzeitig aufnehmen kann und zwischen aufeinanderfolgenden Experimenten gereinigt und eingerichtet werden muss. Optimierungsexperimente und die konsistente Aufbereitung von Proben können erhebliche mitochondriale Schäden minimieren, die zu inkonsistenten Daten beitragen würden.
Die Bedeutung der Methode in Bezug auf bestehende/alternative Methoden ist eine verbesserte Machbarkeit im Vergleich zur Menge an Ausgangsmaterial, die Herausforderung der Isolierung von Mitochondrien oder die technische Herausforderung bei der Permeabilisierung von Gewebe. Die Herstellung von Homogenaten ist schneller, Sauerstoff ist nicht annähernd so limitierend und ist im Vergleich zu permeabilisiertem Gewebe weniger anfällig für Variabilität zwischen dem Personal. Wichtig ist, dass fast alle Probentypen für die Homogenatvorbereitung geeignet sind, was eine vergleichende Analyse über Gewebe hinweg ermöglicht. Die hochauflösende Respirometrie ist die Goldstandardmessung von mitochondrialen OXPHOS und ET. Die Anwendung dieser Methode in der präklinischen und klinischen Krebsforschung hat die Fähigkeit, aktuelle In-vitro-Untersuchungen auf Ex-vivo-Studien auszuweiten. Darüber hinaus bietet es potenzielle Anwendungen im klinischen und diagnostischen Umfeld.
Offenlegungen
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit dieser Arbeit.
Danksagungen
Wir danken den Mitarbeitern des Pennington Biomedical Research Center Comparative Biology Core für die Tierpflege. Diese Forschung wurde zum Teil durch die Zuschüsse des National Institute of Health U54GM104940 (JPK) und KL2TR003097 (LAG) unterstützt. Alle Experimente und Verfahren mit Tieren wurden vom Pennington Biomedical Research Center Institutional Animal Care and Use Committee genehmigt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-(N-Morpholino)ethanesulfonic acid hydrate | Sigma-Aldrich | M8250 | |
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Adenosine 5'-triphosphate disodium salt hydrate | Sigma-Aldrich | A2383 | |
| Amphotericin B | Gibco | 15290018 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Ascorbate | Sigma-Aldrich | A4544 | |
| Bovine serum albumin, fraction V, heat shock, fatty acid free | Sigma-Aldrich | 3117057001 | Roche |
| BD 50 mL Luer-Lok Syringe | Fisher Scientific | 13-689-8 | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Calcium carbonate | Sigma-Aldrich | C4830 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | |
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| Datlab 7.4 software | Oroboros Instruments | ||
| Dimethylsulfoxide | Amresco | N182 | |
| Dithiothreitol | Sigma-Aldrich | D0632 | |
| D-Sucrose | Sigma-Aldrich | S7903 | |
| Dumont # 5 Forceps | Fine Science Tools | 11251-30 | Dumoxel, autoclavable |
| Dumont # 7 Forceps | Fine Science Tools | 11271-30 | Dumoxel, autoclavable |
| Digital Calipers 150 mm/6 in | World Precision Instruments | 501601 | |
| EO771 cells | CH3 BioSystems | SKU: 94APV1-vial-prem | Pathogen Tested |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Female C57BL/6J mice | Jackson Laboratory | Stock #000664 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Imidazole | Sigma-Aldrich | 56750 | |
| Kimwipes | Fisher Scientific | 34120 | |
| L-(−)-Malic acid | Sigma-Aldrich | G1626 | |
| Lactobionic acid | Sigma-Aldrich | L2398 | |
| Malate | Sigma-Aldrich | M6413 | |
| Matrigel Matrix | Corning | 354248 | |
| MgCl·6H2O | Sigma-Aldrich | M2670 | |
| Microsyringes | Hamilton | 87919, 80383, 80521, 80665, 80765, 80865, 87943 | |
| N,N,N′,N′-Tetramethyl-p-phenylenediamine | Sigma-Aldrich | T7394 | |
| Oxygraph-2k | Oroboros Instruments | 10023-03 | |
| Oxygraph-2k FluoRespirometer | Oroboros Instruments | 10003-01 | |
| PBS | Gibco | 10010023 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium hydroxide | Sigma-Aldrich | P1767 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| RPMI 1640 | Gibco | 21875034 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium pyruvate | Sigma-Aldrich | P5280 | |
| Succinate (disodium) | Sigma-Aldrich | W327700 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Whatman Filter Paper, grade 5 | Sigma-Aldrich | 1005-090 | |
| Wheaton Tenbroeck Tissue Grinder, 7 mL | Duran Wheaton Kimble | 357424 | |
| Straight Tip Micro Dissecting Scissors | Roboz | RS-5914SC | |
| Non-Safety Scalpel No. 11 | McKesson | 1029065 | |
| BD Precision Glide Needle 27 G x 1/2 | Becton, Dickinson and Company | 305109 | |
| BD Precision Glide Needle 18 G x 1 | Becton, Dickinson and Company | 305195 | |
| BD 1mL Slip Tip Syringe | Becton, Dickinson and Company | 309659 | |
| Pyrex Reusable Petri Dish, 60 mm | Thermo Fisher Scientific | 316060 | |
| Rodent Very High Fat Diet, 60% kcal from fat, 20% kcal from protein, and 20% kcal from carbohydrate | Research Diet | D12492 | |
| Pyrex Watch Glass, 100 mm | Thermo Fisher Scientific | S34819 |
Referenzen
- DeBerardinis, R. J., Chandel, N. S. Fundamentals of cancer metabolism. Science Advances. 2 (5), 1600200 (2016).
- Bajzikova, M., et al. Reactivation of dihydroorotate dehydrogenase-driven pyrimidine biosynthesis restores tumor growth of respiration-deficient cancer cells. Cell Metabolism. 29 (2), 399-416 (2019).
- Martínez-Reyes, I., et al. Mitochondrial ubiquinol oxidation is necessary for tumour growth. Nature. 585 (7824), 288-292 (2020).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6 (3), 18317 (2011).
- Saks, V. A., et al., Saks, V. A., et al. . Bioenergetics of the Cell: Quantitative Aspects. , 81-100 (1998).
- Kaambre, T., et al. Metabolic control analysis of cellular respiration in situ in intraoperational samples of human breast cancer. Journal of Bioenergetics and Biomembranes. 44 (5), 539-558 (2012).
- Koit, A., et al. Mitochondrial respiration in human colorectal and breast cancer clinical material is regulated differently. Oxidative Medicine and Cellular Longevity. 2017, 1372640 (2017).
- Holland, O. J., et al. Changes in mitochondrial respiration in the human placenta over gestation. Placenta. 57, 102-112 (2017).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Kondrashova, M. N., et al. Preservation of native properties of mitochondria in rat liver homogenate. Mitochondrion. 1 (3), 249-267 (2001).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. American Journal of Physiology-Cell Physiology. 292 (1), 125-136 (2007).
- Hlozková, K., Starková, J. Assessment of the metabolic profile of primary leukemia cells. Journal of Visualized Experiments: JoVE. (141), e58426 (2018).
- Zhang, J., Zhang, Q., Haznadar, M. . Cancer Metabolism: Methods and Protocols. , 353-363 (2019).
- Wigner, P., Zielinski, K., Labieniec-Watala, M., Marczak, A., Szwed, M. Doxorubicin-transferrin conjugate alters mitochondrial homeostasis and energy metabolism in human breast cancer cells. Scientific Reports. 11 (1), 4544 (2021).
- Schöpf, B., et al. Oxidative phosphorylation and mitochondrial function differ between human prostate tissue and cultured cells. The FEBS Journal. 283 (11), 2181-2196 (2016).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Le Naour, A., et al. EO771, the first luminal B mammary cancer cell line from C57BL/6 mice. Cancer Cell International. 20, 328 (2020).
- Gnaiger, E., et al. Mitochondrial physiology. Bioenergetics Communications. 1, 44 (2020).
- Hughey, C. C., Hittel, D. S., Johnsen, V. L., Shearer, J. Respirometric oxidative phosphorylation assessment in saponin-permeabilized cardiac fibers. Journal of Visualized Experiments: JoVE. (48), e2431 (2011).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radical Biology and Medicine. 51 (9), 1621-1635 (2011).
- Munday, R. Generation of superoxide radical, hydrogen peroxide and hydroxyl radical during the autoxidation of N,N,N',N'-tetramethyl-p-phenylenediamine. Chemico-Biological Interactions. 65 (2), 133-143 (1988).
- Moser, M. D., Matsuzaki, S., Humphries, K. M. Inhibition of succinate-linked respiration and complex II activity by hydrogen peroxide. Archives of Biochemistry and Biophysics. 488 (1), 69-75 (2009).
- Veksler, V. I., Kuznetsov, A. V., Sharov, V. G., Kapelko, V. I., Saks, V. A. Mitochondrial respiratory parameters in cardiac tissue: a novel method of assessment by using saponin-skinned fibers. Biochimica et Biophysica Acta. 892 (2), 191-196 (1987).
- Gnaiger, E., Heldmaier, G., Klingenspor, M., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Doerrier, C., et al. High-resolution fluorespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Rohlenova, K., et al. Selective disruption of respiratory supercomplexes as a new strategy to suppress Her2(high) breast cancer. Antioxidants & Redox Signaling. 26 (2), 84-103 (2017).
- Gnaiger, E. Mitochondrial pathways and respiratory control. Bioenergetics Communications. 5th ed. , (2020).
- Barksdale, K. A., et al. Mitochondrial viability in mouse and human postmortem brain. FASEB Journal. 24 (9), 3590-3599 (2010).
- Underwood, E., Redell, J. B., Zhao, J., Moore, A. N., Dash, P. K. A method for assessing tissue respiration in anatomically defined brain regions. Scientific Reportys. 10 (1), 13179 (2020).
- Jorgensen, L. B., Overgaard, J., Hunter-Manseau, F., Pichaud, N. Dramatic changes in mitochondrial substrate use at critically high temperatures: a comparative study using Drosophila. Journal of Experimental Biology. 224, (2021).
- Salin, K., et al. Simultaneous measurement of mitochondrial respiration and ATP production in tissue homogenates and calculation of effective P/O ratios. Physiological Reports. 4 (20), 13007 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten