Method Article
Détermination analytique de la fonction mitochondriale des homogénats tumoraux solides excisés
Dans cet article
Résumé
Nous avons développé un protocole pratique et une approche analytique pour évaluer la phosphorylation oxydative mitochondriale et la capacité de transfert d’électrons dans les homogénats tumoraux frais. Ce protocole peut être facilement adapté pour étudier diverses fonctions mitochondriales qui contribuent à l’initiation, à la progression et à la réponse au traitement du cancer.
Résumé
Les mitochondries sont essentielles à l’apparition et à la progression du cancer par la production d’énergie, la régulation réactive des espèces de l’oxygène et la synthèse des macromolécules. Les adaptations génétiques et fonctionnelles des mitochondries à l’environnement tumoral entraînent un potentiel prolifératif et métastatique. L’avènement du séquençage de l’ADN et de l’ARN a éliminé les obstacles critiques à l’évaluation des médiateurs génétiques de la tumorigenèse. Cependant, à ce jour, les approches méthodologiques pour évaluer la fonction mitochondriale tumorale restent insaisissables et nécessitent des compétences techniques limitant la faisabilité, diminuant finalement la valeur diagnostique et pronostique dans les contextes expérimentaux et cliniques. Ici, nous décrivons une méthode simple et rapide pour quantifier les taux de phosphorylation oxydative (OXPHOS) et la capacité de transfert d’électrons (ET) dans les homogénats tumoraux solides fraîchement excisés en utilisant la respirométrie à haute résolution. Le protocole peut être appliqué de manière reproductible à travers les espèces et les types de tumeurs, ainsi que adapté pour évaluer une diversité de voies ET mitochondriales. En utilisant ce protocole, nous démontrons que les souris porteuses d’un cancer mammaire luminal B présentent une respiration défectueuse liée au nicotinamide adénine dinucléotide et une dépendance au succinate pour générer de l’adénosine triphosphate via OXPHOS.
Introduction
Toutes les cellules sont intimement liées par leur besoin de produire et de consommer de l’adénosine triphosphate (ATP), la monnaie d’énergie moléculaire. Comme les mutations cellulaires donnent lieu à la formation de tumeurs, les mitochondries assurent la survie grâce à la diversification de la production d’énergie qui se distingue souvent phénotypiquement des tissus non cancéreux1,2,3. En tant que tel, il existe un besoin critique de profilage rapide et profond de la fonction respiratoire mitochondriale afin de faciliter la classification du type de tumeur, de l’initiation du cancer, de la progression et de la réponse au traitement.
Les fonctions respiratoires des échantillons de tissus excisés ne peuvent pas être évaluées intactes car les substrats primaires d’OXPHOS ne sont pas perméables aux cellules. Pour surmonter cette limitation, les mitochondries peuvent être préparées soit par isolement, perméabilisation chimique, soit par homogénéisation mécanique. L’isolement mitochondrial est longtemps considéré comme une référence pour l’évaluation de la fonction respiratoire. Cependant, il nécessite de grandes quantités de tissu, prend du temps et est à faible rendement avec un biais de sélection possible pour certaines fractions de mitochondries4. La perméabilisation consiste en une séparation mécanique et l’exposition de coupes de tissus ou de faisceaux de fibres à un détergent doux qui dégrade sélectivement la membraneplasmique 5. La perméabilisation est fréquemment utilisée dans les tissus striés tels que le muscle squelettique et cardiaque, car les faisceaux de fibres individuels peuvent être séparés. Par rapport à l’isolement, la perméabilisation donne plus de mitochondries dans leur environnement cellulaire natif et leur forme physique5. La perméabilisation a été appliquée avec succès dans d’autres tissus tels que la tumeur6,7 et le placenta8; cependant, la reproductibilité des préparations de fibres perméabilisées peut être difficile en raison de la consistance de la dissection et des besoins en oxygène pour surmonter les limitations de diffusion9. De plus, les fibres perméabilisées peuvent ne pas convenir à certains types de tumeurs densément cellulaires et hautement fibrotiques. Les homogénats tissulaires sont générés par perturbation mécanique de la membrane plasmique et sont similaires aux fibres perméabilisées en termes de rendement mitochondrial et d’intégrité10. Les homogénats tissulaires minimisent également les limites de la diffusion de l’oxygène et peuvent être facilement utilisés dans tous les types de tissus grâce à l’optimisation de la force mécanique11,12.
Ici, nous décrivons une méthode simple et rapide pour quantifier les taux de phosphorylation oxydative (OXPHOS) et la capacité de transfert d’électrons (ET) dans les homogénats de tumeurs solides fraîchement excisés. Le protocole est conçu de manière optimale pour évaluer les tissus frais à l’aide du respiromètre haute résolution Oxygraph-2k (O2k), qui nécessite une connaissance préalable de la configuration instrumentale et de l’étalonnage, mais peut être adapté de la même manière à l’aide de n’importe quelle électrode de type Clark, analyseur Seahorse ou lecteur de plaques. Le protocole peut être appliqué de manière reproductible à travers les espèces et les types de tumeurs, ainsi que adapté pour évaluer une diversité de voies ET mitochondriales.
Protocole
Toutes les expériences et procédures impliquant des animaux ont été approuvées par le Pennington Biomedical Research Center Institutional Animal Care and Use Committee.
1. Préparation du réactif.
- Préparer les milieux de croissance cellulaire EO771 avec 10 mM d’HEPES, 10 % de sérum fœtal bovin (FBS), 1 % de pénicilline-streptomycine (100 U/mL) et 0,2 % d’amphotéricine B.
- Préparer 1 L de solution de préservation de biopsie (BIOPS) dans un bécher en verre de 1000 ml.
- Ajouter 3,180 g de Na2ATP (concentration finale de 5,77 mM).
- Ajouter 1,334 g de MgCL2·6H2 O (concentration finale de 6,56 mM).
- Ajouter 2,502 g de taurine (concentration finale de 20 mM).
- Ajouter 3,827 g de Na2phosphocréatine (concentration finale de 15 mM).
- Ajouter 1,362 g d’imidazole (concentration finale de 20 mM).
- Ajouter 0,077 g de dithiothréitol (concentration finale de 0,5 mM).
- Ajouter 9,76 g d’hydrate MES (concentration finale de 50 mM).
- Ajouter 800 mL deH2O et mélanger les constituants à l’aide d’un agitateur magnétique à 30 °C.
- Ajouter 72,3 mL de 100 mM K2EGTA (concentration finale de 7,23 mM).
- Dissoudre 7,608 g d’EGTA et 2,3 g de KOH dans 100 mL deH2O.
- Réglez le pH à 7,0 avec 5 M KOH et portez le volume à 200 mL avec H2O.
- Ajouter 27,7 mL de 100 mMcaK2EGTA (concentration finale de 2,77 mM).
- Dissoudre 7,608 g d’EGTA dans 200 mL deH2O et chauffer à 80 °C (concentration finale de 100 mM).
- Dissoudre 2,002 g de CaCO3 dans 200 mL de solution chaude d’EGTA de 100 mM.
- En remuant continuellement, ajouter 2,3 g de KOH et ajuster le pH à 7,0.
- Ajuster le pH à 6,75 à 23 °C (pH 7,1 à 0 °C) avec 5 M KOH. Porter le volume à 980 mL avec H2O et mélanger la solution. Vérifiez à nouveau le pH, ajustez-le si nécessaire et portez le volume final à 1000 mL avec de l’eau.
- Aliquote BIOPS dans des tubes coniques (15 mL ou 50 mL) et conserver à -20 °C jusqu’à utilisation. Ne décongeler qu’une seule fois, juste avant utilisation.
- Préparer 1 L de milieu respiratoire mitochondrial (MiR05) dans un bécher en verre de 1000 ml.
- Ajouter 0,190 g d’EGTA (concentration finale de 0,5 mM).
- Ajouter 0,610 g de MgCL2·6H2O (concentration finale de 3 mM).
- Ajouter 2,502 g de taurine (concentration finale de 20 mM).
- Ajouter 1,361 g de KH2PO4 (concentration finale de 10 mM).
- Ajouter 4,77 g de HEPES (concentration finale de 20 mM).
- Ajouter 37,65 g de D-saccharose (concentration finale de 110 mM).
- Ajouter 800 mL deH2O et mélanger les constituants à l’aide d’un agitateur magnétique à 30 °C.
- Ajouter 120 mL d’acide lactobionique 0,5 M (concentration finale de 60 mM).
- Dissoudre 35,83 g d’acide lactobionique dans 100 mL deH2O.
- Réglez le pH à 7,0 avec 5 M KOH et portez le volume jusqu’à 200 mL avec H2O.
- Mélanger la solution et ajuster le pH à 7,1 avec 5 M KOH.
- Peser 1 g de BSA, essentiellement sans acides gras (concentration finale de 1 g/L), dans un tube conique de 50 mL. Ajouter 40 mL de la solution pH 7.1 de l’étape 9 au tube, inverser doucement pour mélanger et éviter la formation de mousse. Transférer le BSA dissous dans la solution de pH 7.1 restante à partir de l’étape 9 et remuer doucement et continuellement. Vérifiez à nouveau le pH, ajustez-le si nécessaire et portez le volume final à 1000 mL avec H2O.
- Aliquoter le milieu MiR05 dans des tubes coniques de 50 mL et conserver à -20 °C jusqu’à utilisation. Ne décongeler qu’une seule fois, juste avant utilisation.
- Préparez des substrats, des découpleurs et des inhibiteurs.
- Préparer 0,8 M de malate : Dissoudre 536,4 mg d’acide L-malique dans 4 mL deH2O. Neutraliser avec 5 M KOH à pH 7 et porter le volume à 5 mL avec H2O. Diviser en aliquotes puis conserver à -20 °C.
- Préparer 1 M de pyruvate : Dissoudre 550 mg de sel de sodium de l’acide pyruvique dans 4 mL deH2O. Neutraliser avec 5 M KOH à pH 7 et porter le volume à 5 mL avec H2O. Diviser en aliquotes puis conserver à -20 °C.
- Préparer 0,5 M ADP (adénosine 5′-diphosphate) : Dissoudre 1,068 g de sel de sodium ADP dans 4 mL deH2O. Neutraliser avec 5 M KOH à pH 7 et porter le volume à 5 mL avec H2O. Diviser en aliquotes puis conserver à -20 °C.
- Préparer 2 M de glutamate : Dissoudre 3,7426 g d’acide L-glutamique monohydraté dans 8 mL deH2O. Neutraliser avec 5 M KOH à pH 7 et porter le volume à 10 mL avec H2O. Diviser en aliquotes puis conserver à -20 °C.
- Préparer 4 mM Cytochrome c: Dissoudre 50 mg de Cytochrome c dans 1 mL deH2O. Diviser en aliquotes puis conserver à -20 °C.
- Préparer 1 M de succinate : Dissoudre 2,701 g de sel disodique de succinate hexahydraté dans 8 mL deH2O.Neutraliser avec 1 N HCl à pH 7 et porter le volume à 10 mL avec H2O. Répartir en aliquotes puis conserver à -20 °C.
- Préparer 1 mM fccP (cyanure de carbonyle-4-(trifluorométhoxy)phénylhydrazone) : Dissoudre 2,54 mg de FCCP dans 10 mL d’éthanol pur. Diviser en aliquotes puis conserver à -20 °C.
- Préparer 150 μM de roténone : Dissoudre 3,94 mg de roténone dans 10 mL d’éthanol pur pour préparer 1 mM de bouillon, vortex jusqu’à dissolution complète. Diluer 225 μL de concentration de 1 mM de roténone avec 1,275 mL d’éthanol pur pour obtenir 1,5 mL de 150 μM de roténone. Protéger de la lumière, diviser en aliquotes, puis conserver à -20 °C.
- Préparer 125 μM d’antimycine A : Dissoudre 11 mg d’antimycine A dans 4 mL d’éthanol pur pour préparer 5 mM de concentration en stock d’antimycine A. Diluer 25 μL de 5 mM d’antimycine A avec 975 μL d’éthanol pur pour obtenir 1 mL de 0,125 mM d’antimycine A. Diviser en aliquotes puis conserver à -20 °C.
- Préparer 0,8 M d’ascorbate : Dissoudre 1,584 g de sel de sodium d’ascorbate dans 8 mL deH2O. Ajuster le pH avec de l’acide ascorbique à pH 6 et porter le volume à 10 mL avec H2O. Protéger de la lumière, diviser en aliquotes, puis conserver à -20 °C.
- Préparer 0,2 M TMPD (tétraméthyl-p-phénylènediamine) : Dissoudre 32,85 mg de TMPD dans 987,5 μL de DMSO. Ajouter 12,5 μL d’ascorbate de 0,8 M (concentration finale d’ascorbate de 10 mM). Protéger de la lumière, diviser en aliquotes, puis conserver à -20 °C.
- Préparer 4 M d’azoture de sodium : Dissoudre 2,6 g d’azoture de sodium dans 10 mL deH2O. Diviser en aliquotes et conserver à -20 °C.
2. Croissance tumorale
- Cultivez des cellules EO771 dans un milieu de croissance RPMI 1640 et maintenez les cellules dans un incubateur humidifié à 37 °C avec 5% de CO2.
- Souris femelles C57BL/6J âgées de quatre semaines et d’une seule maison, maintenez-les à 21-22 °C sur un cycle clair:sombre de 12 h. Fournir aux souris un accès ad libitum à la nourriture et à l’eau.
- Une fois que les souris atteignent l’âge de 10 semaines, préparez les cellules et les souris à l’implantation de cellules cancéreuses.
- Trypsiniser les cellules, désactiver la trypsine avec un milieu de croissance et centrifuger les cellules à 500 x g pendant 5 min à température ambiante. Aspirer le surnageant et le remettre en suspension et combiner les pastilles cellulaires (au besoin) dans un milieu. Compter les cellules viables à l’aide du bleu de trypan et préparer une dilution cellulaire de 1 x10 6 cellules dans un volume total de 60 μL avec une solution 1:1:1 Media/Basement Membrane Matrix/PBS. Une fois la matrice de la membrane basale ajoutée, mélangez bien et maintenez la suspension cellulaire sur la glace. Remplissez les seringues avec 60 μL de suspension cellulaire et placez-les sur de la glace. Travaillez efficacement et injectez des cellules dans des souris dans les 1,5 h suivant la préparation.
- Anesthésier les souris par inhalation d’isoflurane (3%-5% pour l’induction et 1%-3% pour l’entretien). Raser entre les glandes mammaires inguinales droites4 ème et5ème. Injecter orthotopiquement les souris anesthésiées avec la suspension cellulaire EO771.
- Utilisez des étriers électroniques pour surveiller et mesurer la croissance tumorale deux fois par semaine pendant 4 semaines. Lors de la nécropsie, excisez, pesez, puis placez la tumeur (ou un minimum de 60 mg de section tumorale) immédiatement dans 10 mL de BIOPS glacé. Gardez le tube sur de la glace humide.
3. Configuration et étalonnage de l’instrument
- Réchauffez le miR05 au bain-marie à 37 °C.
- Allumez le système Oroboros O2k, ouvrez le logiciel DATLAB, entrez ou sélectionnez Utilisateur. Cliquez sur Se connecter à O2k. Vérifiez la configuration O2k et assurez-vous que le bon instrument est étiqueté pour Power-O2k et que chaque chambre correspond au bon capteur d’oxygène; cliquez sur OK. Une fois que la fenêtre de contrôle O2k s’ouvre, sous l’onglet Systèmes, réglez la température du bloc à 37 °C, la vitesse de l’agitateur à 750 tr/min pour les deux chambres, et l’intervalle d’enregistrement des données à 2,0 s. Vérifiez à la fois l’alimentation de l’agitateur et l’éclairage dans les cases de la chambre. Dans l’onglet Oxygène, O2, réglez le gain pour le capteur sur 1 V / μA (le gain peut devoir être ajusté pour les modèles d’instruments plus anciens), la tension de polarisation à 800 mV, puis cliquez sur Connecter à O2k. Une fois qu’un nouveau fichier d’expérience s’ouvre, nommez le fichier et cliquez sur Enregistrer. Une fois l’expérience active, une fenêtre de sélection de protocole s’ouvre ; cliquez sur Annuler pour exécuter un SUIT personnalisé (Titrage inhibiteur du découpleur de substrat).
- Après la sélection du protocole, une fenêtre d’exemple s’ouvrira pour remplir le code expérimental, le type d’échantillon, la cohorte, le code d’échantillon, le numéro d’échantillon et le numéro de sous-échantillon, le cas échéant. Assignez l’unité à mg et entrez la concentration d’homogénat tumoral par mL (la quantité par chambre se remplira automatiquement). Assurez-vous que le milieu indiqué est MiR05 et que le volume de la chambre est de 2,00 mL. Ajoutez des commentaires au besoin dans la zone inférieure et cliquez sur OK.
- Retirez les bouchons et aspirez l’éthanol à 70% des chambres. Ne jamais aspirer près de la membrane exposée à l’intérieur de la chambre. Rincez quatre fois à l’eau pure et remplissez la chambre de 2,25 mL de MiR05.
- Test du capteur: Cliquez sur F9 pour éteindre les agitateurs pendant 30 s. Une fois la barre d’agitateur rallumée, assurez-vous que la pente O2 augmente rapidement de manière monoexponentielle dans chaque chambre. Si la chambre échoue au test du capteur, vérifiez les connexions électriques et nettoyez si des sels se sont accumulés; répétez le test. Si le capteur continue d’échouer au test, retirez le connecteur du capteur d’oxygène polarographique (POS) pour inspecter la membrane. Si des dommages visibles à la membrane, une forte oxydation ou une accumulation importante de bulles sont observés, arrêtez les procédures expérimentales et passez à l’entretien de l’instrument.
- Étalonnage de l’oxygène: Effectuez l’étalonnage de l’oxygène pour obtenir des mesures précises de la respiration.
- Avec un mouvement de torsion, Insérez lentement les bouchons dans leur position calibrée en volume. Siphonnez l’excès de milieu éjecté à travers le capillaire d’injection qui s’accumule dans le puits du bouchon. Avec un mouvement de torsion, soulevez les bouchons juste assez pour s’adapter étroitement à l’outil d’espacement de bouchon en laissant un volume de gaz au-dessus de la phase liquide pour l’équilibrage final de l’air (30-45 min.).
- Utilisez l’état d’équilibre obtenu au cours de cette période pour calibrer le capteur d’oxygène afin d’obtenir des mesures précises de la respiration. La penteO2 neg. (pente négative de l’oxygène) est de 0 ± 2 pmol/s·mL. Si la valeur est supérieure à 2 pmol/s·mL, nettoyez la chambre et reconstituez-la avec du MiR05 fraîchement décongelé. Si la pente est instable, passez à l’entretien des instruments.
- Après avoir atteint un état stable, sélectionnez la courbe de concentration O 2 etmettez en surbrillance la région stable de la courbe en maintenant la touche Maj enfoncée et en cliquant avec le bouton gauche de la souris. Une fois la région sélectionnée, cliquez sur F5, sélectionnez la marque pour l’étalonnage de l’air avec la flèche déroulante et cliquez sur Calibrer et copiez dans le presse-papiers.
- Étalonnage instrumental en arrière-plan (facultatif)
- Après l’étalonnage de l’air, assurez-vous qu’il n’y a pas de volume de gaz au-dessus de la phase liquide pour l’équilibrage du fond de flux (~ 15 min) et fermez complètement les chambres.
REMARQUE : Le taux d’équilibre atteint au cours de cette période représente un arrière-plan instrumental et peut être soustrait des données résultantes pour une précision analytique accrue. La pente O2 neg. augmentera d’abord légèrement et plafonnera entre ± 2 à 4 pmol/s·mL. - Si la valeur est élevée (>6 pmol/s·mL), il y a contamination biologique potentielle. Dans ce cas, nettoyez la chambre et reconstituez-la avec du MiR05 fraîchement décongelé. Une fois l’état d’équilibre atteint, sélectionnez la courbe de pente O 2 etmettez en surbrillance la région stable de la courbe en maintenant la touche Maj enfoncée et en cliquant avec le bouton gauche de la souris.
- Après avoir sélectionné la région, cliquez sur F5, sélectionnez la zone de correction de ligne de base et la marque de ligne de base avec la flèche déroulante, puis cliquez sur OK.
- Après l’étalonnage de l’air, assurez-vous qu’il n’y a pas de volume de gaz au-dessus de la phase liquide pour l’équilibrage du fond de flux (~ 15 min) et fermez complètement les chambres.
4. Préparation de l’homogénat tumoral
- Placez un homogénéisateur en verre contenant 1 mL de MiR05 et un pilon en verre bien ajusté sur de la glace humide.
- Au moment de l’étude, placez le tissu dans 1 mL de BIOPS dans une boîte de Petri glacée.
- Nettoyez et disséquez le tissu pour maximiser le matériau soluble, éviter les régions nécrotiques et enlever le tissu tumoral marginal. À l’aide d’un microscope à dissection, d’un scalpel et d’une pince à épiler chirurgicale, enlevez les poils, le tissu nécrotique, le tissu conjonctif et vasculaire périphérique et la graisse adjacente, le cas échéant. Prenez soin de garder la tumeur dans un BIOPS glacé pendant la dissection.
- Coupez la tumeur en petits morceaux (~ 5-10 mg chacun) et replacez les morceaux tumoraux restants dans 10 mL de BIOPS conservés sur la glace. Utilisez ce tissu plus tard pour des préparations supplémentaires si nécessaire.
Remarque : Effectuez rapidement les étapes suivantes pour réduire la durée pendant laquelle l’échantillon n’est pas complètement immergé dans BIOPS. Une fois l’échantillon placé dans MiR05, le temps presse. Déplacez soigneusement l’homogénat préparé dans la chambre étalonnée dès que possible. - Épongez soigneusement les sections de tissu sur un papier filtre, placez-les sur un petit bateau de pesage goudronné en plastique et enregistrez le poids humide initial. Replacez les pièces inutilisées dans le tube conique de 10 mL de BIOPS pour une conservation continue.
- Immergez les sections de tissus dans un homogénéisateur glacé contenant du MiR05 et enregistrez le poids restant sur le bateau de pesée, le cas échéant.
- À l’aide d’un pilon en verre (plage de clairance 0,09-0,16 mm), perturbez doucement le tissu tumoral en effectuant 5 à 7 coups ascendants. Pour chaque coup, faites pivoter le pilon dans le sens inverse des aiguilles d’une montre 3 fois tout en poussant le pilon vers le bas et 3 fois supplémentaires tout en tirant le pilon vers le haut. Assurez-vous de laisser le tissu se déposer au fond de l’homogénéisateur entre les coups, mais évitez d’amener le pilon complètement au-dessus du volume de liquide pour éviter la formation de mousse.
REMARQUE: L’homogénat résultant doit apparaître trouble avec un minimum de restes de tissus solides. - Versez l’homogénat dans un tube conique de 15 mL et placez-le sur de la glace.
- Pipette 1-3 mL de MiR05 frais sur le pilon et dans l’homogénéisateur pour laver tout homogénat de tissu restant. Versez le lavage MiR05 dans le tube conique contenant l’homogénat. Répétez le lavage du pilon et de l’homogénéisateur 2 à 3 fois pour assurer le transfert complet de l’homogénat. Gardez à l’esprit la concentration cible et le volume requis pour ne pas trop diluer l’échantillon pendant les étapes de lavage.
- Pour calculer avec précision la concentration d’homogénat tissulaire, inspectez soigneusement l’homogénéisateur et l’homogénat pour détecter s’il reste du matériel non homogénéisé (c.-à-d. le tissu conjonctif).
- Pour retirer le matériau non homogénéisé de l’homogénéisateur qui ne peut pas être atteint avec une pince à épiler, ajoutez MiR05 à l’homogénéisateur, aspirez le volume (y compris le tissu) avec une pipette et déplacez le contenu dans une boîte de Pétri.
- Pour retirer le matériau non homogénéisé de l’homogénat (déposé en gros morceaux au fond du tube conique), aspirez les gros morceaux avec une pipette et placez-les sur le capuchon tissulaire du tube conique.
- Retirez le tissu de la boîte de Pétri ou du bouchon du tube conique avec une pince à épiler et épongez-le sur du papier filtre. Ajouter l’homogénat restant du capuchon du tube conique dans le tube conique, le coiffer, puis inverser pour mélanger.
- Réinspectez les homogénéisateurs et l’homogénéat pour détecter tout matériau non homogénéisé supplémentaire et répétez les étapes 4.10.1 à 4.10.3 pour retirer le matériau au besoin.
- Peser et enregistrer la masse du matériau non homogénéisé récupéré de l’homogénéisateur. Inspecter la préparation de l’homogénat pour tout tissu grossièrement intact transféré. Retirez les pièces non homogénéisées et pesez si nécessaire.
- Soustrayez le poids tissulaire récupéré du bateau de pesée, de l’homogénéisateur et de l’homogénat (si nécessaire) du poids humide initial pour calculer le poids final de l’échantillon.
- En utilisant le poids final de l’échantillon, ajoutez du MiR05 supplémentaire pour amener l’homogénat à la concentration souhaitée (voir l’étape 5 pour plus de détails concernant les expériences d’optimisation).
- Une fois l’homogénat pesé et préparé, procédez au dosage dès que possible. Conservez l’échantillon sur de la glace humide jusqu’à ce qu’il soit transféré à l’instrument.
5. Substrat, découpleur, protocole de titrage inhibiteur (SUIT)
- Une fois l’instrument étalonné et l’échantillon préparé, retirez les bouchons avec un mouvement de torsion et aspirez le MiR05 des chambres (en évitant la membrane exposée à l’intérieur de la chambre). Bien mélanger l’homogénat et ajouter 2,25 mL de l’homogénat à la chambre. Si vous ajoutez un homogénat à plusieurs chambres, pipettez 1 mL à la fois dans chaque chambre tout en mélangeant l’homogénat pour assurer une distribution égale des tissus. Cliquez sur F4 pour nommer et horodater l’événement, puis cliquez sur OK.
- Remplissez une seringue de 50 mL avec de l’oxygène provenant d’un réservoir d’oxygène avec un régulateur et un tube de gaz à l’aide d’une aiguille émoussée de 18 G. Hyperoxygéner les chambres à ~500 μM d’oxygène. Pour cela, injectez de l’oxygène directement dans les chambres. Insérez lâchement les bouchons et attendez de fermer jusqu’à ce que l’oxygène atteigne ~ 480 μM. Avec un mouvement de torsion, fermez lentement la chambre et laissez la respiration s’équilibrer (~15-20 min). Remplissez le capillaire central du bouchon avec MiR05 si nécessaire.
- Détermination analytique de la capacité OXPHOS et ET (état de transfert d’électrons) de l’activité N-liée et NS et CIV (complexe IV) : Utilisez des microsyringes dédiées pour injecter des substrats, des découpleurs et des inhibiteurs dans des chambres entièrement fermées. Cliquez sur F4 à chaque injection pour nommer et horodater les événements de chaque chambre en temps réel. Tout au long de l’étude, sélectionnez F6 pour ajuster les échellesde concentration d’O2 et de penteO2 au besoin. Après chaque injection, laver les seringues 3 fois dans de l’eau (pour les composés solubles dans l’eau) ou à 70% d’éthanol (pour les composés dissous dans l’éthanol ou le DMSO).
REMARQUE: lié à l’azote: flux O2 soutenu par des combinaisons de substrats génératrices de NADH définies, lié au NS: flux O2 soutenu par la convergence de combinaisons de substrats générées par le NADH et de succinate définis.- Ajouter 5 μL de malate de 0,8 M (concentration finale de 2 mM) et passer immédiatement à l’injection suivante. Lavez la seringue d’injection 3 fois dans de l’eau.
- Ajouter immédiatement 5 μL de 1 M de pyruvate (concentration finale de 2,5 mM) et attendre que la respiration se stabilise. Lavez la seringue d’injection 3 fois dans de l’eau.
- Ajouter 10 μL de 0,5 M ADP (concentration finale de 2,5 mM) et attendre que la réponse ADP se stabilise. Lavez la seringue d’injection 3 fois dans de l’eau.
REMARQUE : Un ADP supplémentaire (2,5-10 mM) peut être nécessaire pour s’assurer que les concentrations d’adénylate ne se limitent pas aux flux respiratoires. - Ajouter 5 μL de glutamate 2 M (concentration finale de 5 mM) et attendre que la respiration se stabilise. Lavez la seringue d’injection 3 fois dans de l’eau.
- Ajouter 5 μL de cytochrome c de 4 mM (concentration finale de 10 μM) et attendre que la respiration se stabilise. Lavez la seringue d’injection 3 fois dans de l’eau.
- Ajouter 20 μL de 1 M de succinate (concentration finale de 10 mM) et attendre que la respiration se stabilise. Lavez la seringue d’injection 3 fois dans de l’eau.
- Titrer des incréments de 0,5-1 μL de 1 mM FCCP (concentration finale de 2-20 μM) et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas d’augmentation supplémentaire de la respiration. Lavez la seringue d’injection 3 fois dans de l’éthanol à 70%.
- Ajouter 2 μL de roténone de 150 μM (concentration finale de 150 nM-2 μM) et attendre que la respiration se stabilise. Ajouter 1 μL de roténone pour s’assurer qu’il n’y a plus d’inhibition. S’il y a une diminution de la respiration, continuez avec des injections supplémentaires jusqu’à ce qu’il n’y ait pas de diminution de la respiration. Lavez la seringue d’injection 3 fois dans de l’éthanol à 70%.
- Ajouter 2 μL de 125 μM d’antimycine A (concentration finale de 125 nM-5 μM) et attendre que la respiration se stabilise. Ajouter 1 μL d’antimycine A pour s’assurer qu’il n’y a plus d’inhibition. S’il y a une diminution de la respiration, continuez avec des injections supplémentaires jusqu’à ce qu’il n’y ait pas de diminution de la respiration. Lavez la seringue d’injection 3 fois dans de l’éthanol à 70%.
- Vérifiez la concentration en oxygène de la chambre; si la concentration est inférieure à 125 μM, réoxygéner dans l’air ambiant ou hyperoxygéner légèrement pour s’assurer que l’oxygène ne limite pas le flux respiratoire. Ajouter 5 μL d’ascorbate de 0,8 M (concentration finale de 2 mM). Lavez la seringue d’injection 3 fois dans de l’éthanol à 70%.
- Ajouter immédiatement 10 μL de 0,2 M TMPD (concentration finale de 1 mM) attendre une augmentation de la respiration lente. Lavez la seringue d’injection 3 fois dans de l’éthanol à 70%.
- Ajouter 25 μL d’azoture de sodium 4 M (concentration finale de 50 mM) immédiatement lorsque le flux respiratoire d’Ascorbate/TMPD plafonne. Lavez la seringue d’injection 3 fois dans de l’éthanol à 70%.
- Terminez l’étude - cliquez sur Fichier, Enregistrer et Déconnecter. Continuez à laver la chambre et la seringue en suivant les étapes 9.2 à 9.3.
6. Protocole de sensibilité ADP
- Une fois l’instrument étalonné et l’échantillon préparé, retirez les bouchons avec un mouvement de torsion et aspirez le MiR05 des chambres (en évitant la membrane exposée à l’intérieur de la chambre). Bien mélanger l’homogénat et ajouter 2,25 mL de l’homogénat à la chambre. Supposons l’ajout d’un homogénat à plusieurs chambres, pipeter 1 mL à la fois dans chaque chambre tout en mélangeant l’homogénat pour assurer une distribution tissulaire égale. Cliquez sur F4 pour nommer et horodater l’événement et cliquez sur OK.
- Insérez les bouchons et, avec un mouvement de torsion, fermez lentement la chambre et laissez la respiration s’équilibrer (~15-20 min). Remplissez le capillaire central du bouchon avec MiR05 si nécessaire.
- Détermination analytique de la sensibilité mitochondriale À l’ADP liée au succinate : Cliquez sur F4 à chaque injection pour nommer et horodater les événements de chaque chambre en temps réel. Tout au long de l’étude, sélectionnez F6 pour ajuster les échellesde concentration d’O2 et de penteO2 au besoin.
- Ajouter 2 μL de 150 μM de roténone (concentration finale de 150 nM).
- Ajouter immédiatement 20 μL de 1 M de succinate (concentration finale de 10 mM) et attendre que la respiration se stabilise.
- Titrer l’ADP par addition progressive de concentrations sous-saturées jusqu’à atteindre le taux de réponse maximal (VMAX; concentration finale de 2,5 à 10 mM).
REMARQUE: Le taux peut plafonner après l’injection en raison d’un petit changement dans la concentration d’ADP, augmentant ainsi la concentration d’injection après chaque plateau et continuant avec le titrage jusqu’à ce qu’il n’y ait plus d’augmentation de la respiration, même avec une augmentation de la concentration d’injection d’ADP.
7. Expériences d’optimisation recommandées
- Déterminer l’homogénat optimal et la concentration en oxygène pour le protocole.
- Exécuter le protocole SUIT (étapes 5.1 à 5.3) à plusieurs concentrations tissulaires (p. ex., 30 mg/mL, 20 mg/mL, 10 mg/mL, 5 mg/mL, 2,5 mg/mL, 1 mg/mL et/ou 0,5 mg/mL).
- Sélectionnez une concentration qui maximise le flux respiratoire tout en limitant la fréquence des réoxygénations (pas plus de 1-2). Si des réoxygénations plus fréquentes sont nécessaires, diminuez la concentration de l’homogénat.
- Déterminez le nombre optimal de coups avec l’homogénéisateur.
- Effectuer le protocole SUIT (étapes 5.1 à 5.3) à plusieurs niveaux d’homogénéisation (p. ex., 5 coups, 10 coups, 15 coups, 20 coups).
- Comme il n’y a pas suffisamment de données dans la littérature pour déterminer un seuil de pourcentage d’augmentation du cytochrome c avec la préparation d’homogénat tumoral, choisissez la préparation avec une réponse limitée au cytochrome c mais une respiration adéquate énergisée par le(s) substrat(s) d’intérêt.
- Déterminer les concentrations optimales de substrat, d’ADP, de découpleur et d’inhibiteurs nécessaires pour les flux respiratoires quantitatifs et reproductibles.
- Exécuter le protocole SUIT (étapes 5.1 à 5.3.9) à la concentration tissulaire choisie (étape 7.1). Titrer chaque substrat, découpleur, inhibiteur et ADP jusqu’à ce qu’aucune autre réponse ne soit observée. Titrer l’inhibition avec de l’azoture de sodium dans des expériences séparées.
- Ajouter 5 μL de malate de 0,8 M (concentration finale de 2 mM) et passer immédiatement à l’injection suivante.
- Titrer des incréments de 1 μL de 1 M de pyruvate et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas d’augmentation supplémentaire de la respiration.
- Titrer des incréments de 2 μL de 0,5 M ADP et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas d’augmentation supplémentaire de la respiration.
- Titrer des incréments de 1 μL de 2 M de glutamate et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas d’augmentation supplémentaire de la respiration.
- Ajouter 5 μL de cytochrome c de 4 mM (concentration finale de 10 μM) et attendre que la respiration se stabilise.
- Titrer des incréments de 5 μL de 1 M de succinate et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas d’augmentation supplémentaire de la respiration.
- Titrer des incréments de 5 μL de 0,5 M ADP et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas d’augmentation supplémentaire de la respiration.
- Titrer des incréments de 0,5 μL de 1 mM FCCP et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas d’augmentation supplémentaire de la respiration.
- Titrer des incréments de 1 μL de 150 μM de roténone et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas de diminution de l’augmentation de la respiration.
- Titrer des incréments de 1 μL de 125 μM d’antimycine A et attendre que la respiration se stabilise après chaque injection, continuer jusqu’à ce qu’il n’y ait pas de diminution supplémentaire de la respiration.
- Ajouter 5 μL d’ascorbate de 0,8 M (concentration finale de 2 mM).
- Ajouter immédiatement 5 μL de 0,2 M TMPD (concentration finale de 0,5 mM) attendre l’augmentation de la respiration lente. Dans une expérience distincte, ajouter 10 μL de TMPD de 0,2 M (concentration finale de 1 mM).
- Dans des expériences séparées, ajouter 10 μL, 25 μL, 50 μL et 100 μL d’azoture de sodium 4 M (concentration finale de 20 mM, 50 mM, 100 mM, 200 mM, respectivement) immédiatement lorsque le flux respiratoire d’Ascorbate / TMPD plafonne.
- Choisissez le substrat et les concentrations d’inhibiteurs qui saturent lors de la première injection pour améliorer le calendrier de l’expérience. Utilisez l’ADP à des concentrations saturantes ou sous-saturées pour combiner les évaluations de sensibilité à l’ADP avec les protocoles SUIT traditionnels.
- Utilisez des concentrations de découpleur inférieures au maximum pour démontrer la réactivité à la dose sans inhibition du flux respiratoire.
- Exécuter le protocole SUIT (étapes 5.1 à 5.3.9) à la concentration tissulaire choisie (étape 7.1). Titrer chaque substrat, découpleur, inhibiteur et ADP jusqu’à ce qu’aucune autre réponse ne soit observée. Titrer l’inhibition avec de l’azoture de sodium dans des expériences séparées.
8. Analyse des données
- Analyse SUIT
- Sélectionnez les taux d’équilibre ou de pointe de chaque titrage et exportez pour la réduction analytique.
- Exprimez les données en pmol O2 par seconde et par mg de tissu (pmol/s/mg).
- Obtenir la réduction analytique des PM-L, PM-P, PMG-P, PMGS-P et PMGS-E en soustrayant le taux d’insensibilité à l’antimycine A du taux respectif (c.-à-d. le taux à l’état d’équilibre obtenu après addition d’ADP).
NOTE: PM: Pyruvate + Malate; PMG: Pyruvate + Malate + Glutamate; PMGS: Pyruvate + Malate + Glutamate + Succinate; -L: État de fuite; -P : État de phosphorylation oxydative, -E : État de transfert d’électrons. - Obtenir la réduction analytique du CIV-E en soustrayant le taux insensible à l’azoture de sodium du taux maximal d’ascorbate/TMPD.
- Obtenir la réduction analytique du PMG-E en soustrayant le taux insensible à la roténone du taux PMGS-E.
- Obtenir la réduction analytique de S-E en soustrayant le taux insensible à l’antimycine A du taux insensible à la roténone.
- Atteindre la réduction analytique de l’efficacité de contrôle du cytochrome c, un marqueur de l’intégrité de la membrane externe, par l’équation suivante:
jc = ((JCHNOc - JCHNO)/JCHNO) x 100
Dans l’équation, jc est l’augmentation en % lors de l’addition du cytochrome c,JCHNOc est le flux d’oxygène après l’ajout du cytochrome c,et JCHNO est le flux d’oxygène avant l’ajout du cytochrome c.
- Analyse de sensibilité ADP
- Déterminer analytiquement la cinétique de la sensibilité ADP par rapport au taux de fuite de succinate + roténone (et non le taux d’homogénat tissulaire).
- Tracer le flux O2 (axe Y) par rapport à la concentration relative d’ADP (axe X). Déterminer la vitesse respiratoire maximale (Vmax)comme le taux de pointe atteint sur le titrage ADP.
- Déterminer la cinétique de Michaelis-Menten à l’aide d’un logiciel d’ajustement de courbe (PRISM, version 10.1) pour révéler la concentration d’ADP à laquelle 1/2 VMAX est atteint (Apparent KM).
9. Contrôle instrumental de la qualité
- Effectuer un fond D’O2 instrumental sur la plage de concentration d’oxygène souhaitée (0-600 μM) et un étalonnage nul.
- Effectuer les étapes 3.1 et 3.2
- Retirez les bouchons et aspirez l’éthanol à 70% des chambres (en évitant la membrane exposée à l’intérieur de la chambre). Rincer 4 fois avec du H2Odouble distillé et remplir la chambre avec 2,25 mL de MiR05
- Hyperoxygéner les chambres à ~600 μM d’oxygène.
- Insérez lentement les bouchons dans leur position complètement fermée. Siphonner l’excès de milieu éjecté à travers le capillaire d’injection et recueilli dans le puits du bouchon et permettre au signal d’oxygène de se stabiliser (30-45 min).
- Pour effectuer l’étalonnage de l’oxygène, sélectionnez la région où la concentration et la pente d’oxygène sont stables, ouvrez la fenêtre d’étalonnage de la chambre respective et sélectionnez la marque R1.
- Préparer la solution de dithionite en dissolvant 20 mg d’hydrosulfite de sodium dans 0,5 mL d’eau. Limitez l’exposition à l’air car la dithionite est oxydée au fil du temps avec l’exposition à l’oxygène.
- Une fois le signal d’oxygène stabilisé, injectez 1 μL et observez la baisse de la concentration en oxygène. Ajuster la puissance de la solution de dithionite au besoin.
- Injecter une solution suffisante de dithionite pour abaisser la concentration d’oxygène à 450 μM, 300 μM, 225 μM, 150 μM, 75 μM et 0 μM, respectivement. À chaque injection, laissez l’oxygène se stabiliser et sélectionnez une marque pour la pente à l’état d’équilibre. Une fois que la concentration en oxygène est d’environ 0 μM, marquez la concentration en oxygène.
- Pour effectuer une correction instrumentale de l’arrière-plan O2, sélectionnez la fenêtre de flux/pente de la chambre respective, sélectionnez Étalonnage de l’arrière-plan O2 et cliquez sur Calibrer pour les marques d’intérêt.
- Pour effectuer un étalonnage nul, ouvrez la fenêtre d’étalonnage de la chambre respective et sélectionnez la marque R0 obtenue après titrage de la dithionite.
- Nettoyage des instruments
- Rincez rapidement chaque chambre à l’eau pure trois fois. Pour le premier lavage, aspirez l’homogénat, remplissez complètement la chambre d’eau, puis aspirez l’eau. Pour le deuxième lavage, remplissez la chambre 3/4 pleine d’eau, insérez les bouchons pour forcer l’eau à travers le capillaire d’injection, aspirez une partie de l’eau à travers le capillaire d’injection, puis retirez les bouchons pour aspirer complètement le lavage.
- Lavez les chambres avec de l’éthanol à 70% pendant 5 min.
- Au-dessus d’un évier ou d’un bécher, nettoyez les bouchons avec de l’eau pure, 70% d’éthanol et 100% d’éthanol, en forçant le liquide à travers les capillaires d’injection à l’aide d’une bouteille de lavage.
- Rincez rapidement chaque chambre à l’eau pure deux fois.
- Incuber les chambres avec 2 mL de PBS contenant environ 2 mg de mitochondries congelées, de lysat cellulaire ou de fibroblastes vivants pendant 15 minutes.
- Lavez les chambres à l’eau pure pendant 5 min deux fois.
- Lavez les chambres avec de l’éthanol à 70% pendant 5 min deux fois.
- Lavez les chambres avec 100% d’éthanol pendant 10 min.
- Remplissez les chambres avec de l’éthanol à 70%.
- Si vous effectuez une expérience consécutive, laissez les chambres dans de l’éthanol à 70% pendant 5 min, puis passez à l’étape 3.3.
- Si les expériences sont terminées, mettez des couvercles sur les bouchons et éteignez l’instrument.
- Après chaque utilisation, nettoyez correctement les seringues d’injection et gardez les seringues dédiées à une utilisation de composé spécifique pour éviter tout transfert.
- Insérez la seringue dans le liquide de lavage et immergez complètement l’aiguille d’injection.
- Aspirez le liquide de lavage dans la seringue au volume maximal.
- Retirez la seringue du récipient de lavage, éjectez le liquide de lavage dans un bécher, puis épongez la seringue sur une serviette en papier.
- Répétez les étapes 9.3.1 à 9.3.3 trois fois dès que possible après chaque utilisation.
Résultats
Les études initiales ont révélé que les tumeurs à EO771 étaient faiblement oxydatives et nécessitaient donc des concentrations élevées d’homogénat pour une évaluation adéquate du flux d’O2. Des expériences d’optimisation ont été menées pour déterminer la plage de concentration optimale d’homogénat tissulaire pour l’étude. Les homogénats tumoraux ont d’abord été préparés à 40 mg/mL, puis dilués linéairement. Le flux d’O2 normalisé à la masse tissulaire était cohérent entre les concentrations(figures 1A-D). Il a été observé que 40 mg/mL entraînaient un épuisement rapide de l’oxygène et ne convenaient pas à l’expérimentation(figure 1A). La consommation d’oxygène a considérablement ralenti avec 30 mg/mL et 20 mg/mL mais a tout de même diminué rapidement en peu de temps en l’absence de substrats ou d’ADP(Figure 1B,C). La concentration de 10 mg/mL a donné lieu au taux optimal de consommation d’oxygène(figure 1D)qui permettrait de prendre en charge un protocole SUIT plus long de 90 minutes.
Un protocole SUIT a été utilisé pour évaluer l’OXPHOS et l’ET liés au NADH et au succinate, ainsi que l’activité CIV (Figure 2A). Le pyruvate et le malate ont été ajoutés à l’homogénat tissulaire en l’absence d’ADP pour entraîner une fuite (L) à travers le NADH. L’ADP saturé a ensuite été ajouté pour entraîner un maximum d’OXPHOS (P) lié au NADH, suivi de l’ajout de glutamate. Le cytochrome c a ensuite été ajouté pour assurer l’intégrité de la membrane externe; l’augmentation de la fréquence respiratoire était inférieure à 20 % dans tous les échantillons(figure 2B). Compte tenu de la très faible réponse aux substrats liés au NADH, la libération de cytochrome c a également été évaluée en présence de succinate et de roténone et a observé une stimulation minimale du cytochrome c (Figure 2B). Fait intéressant, OXPHOS lié au NADH était négligeable dans les tumeurs à EO771(Figure 2C). Le succinate a ensuite été ajouté en présence de pyruvate, de malate et de glutamate pour stimuler le flux d’électrons à travers la succinate déshydrogénase. Le FCCP a ensuite été titré pour entraîner le flux maximal d’électrons (E), ce qui a révélé que dans les tumeurs EO771, la phosphorylation plutôt que l’oxydation limitait la respiration(Figure 2C). La roténone et l’antimycine A ont ensuite été titrées pour inhiber les complexes I et III, respectivement. L’ascorbate et le TMPD ont ensuite été ajoutés pour entraîner un flux maximal d’électrons à travers le CIV, qui est ensuite inhibé par l’azoture de sodium. Le tableau 1 illustre les équations analytiques de réduction des données brutes (tableau 2) pour quantifier les paramètres respiratoires tracés à la figure 2C. Dans l’ensemble, les profils respiratoires homogénéisés de la tumeur(Figure 2C)sont similaires à ceux des cellules EO771 perméabilisées par la digitonine non implantées (Figure 2D), à l’exception du transfert maximal d’électrons diminué soutenu par des substrats liés à la N et au S dans la tumeur.
Étant donné que la respiration liée au NADH était négligeable, la cinétique respiratoire du succinate a été évaluée par des titrages progressifs de l’ADP sous-saturé jusqu’à ce que le taux maximal (VMAX)soit atteint(Figure 3A,3B). La concentration demi-maximale (KM)d’ADP en présence de succinate + roténone était de 37,5 μM, tandis que le VMAX était d’environ 10,5 pmol/s/mg(Figure 3C). Ainsi, malgré des taux d’oxydation relativement faibles, les tumeurs EO771 étaient très sensibles à l’ADP et maintenaient la synthèse de l’ATP à des concentrations d’ADP relativement faibles.
La sélection des régions appropriées des données brutes pour l’extraction est essentielle à la reproductibilité des expériences et à la quantification précise. Pour le cytochrome c, une marque doit être sélectionnée à l’état d’équilibre immédiatement avant l’injection(Figure 4A, marque 1). Il y a souvent un artefact d’injection initiale qui peut être suivi d’une période de temps (environ 5-10 min) où le flux O2 n’est pas stable. L’évaluation de l’efficacité du cytochrome c se fait en faisant une sélection supplémentaire une fois que le fluxO2 s’est stabilisé(Figure 4A,marque 2). Les sélections après l’ajout de substrats, d’ADP ou de la plupart des inhibiteurs sont également effectuées après l’artefact d’injection et une fois que le flux d’O2 s’est stabilisé(Figure 4B). La sélection utilisée pour déterminer la respiration maximale non couplée se fait au pic d’augmentation obtenu lors du titrage du FCCP, qui n’est souvent pas la dernière injection faite (Figure 4C). La sélection pour le TMPD est faite après l’ajout de l’ascorbate et du TMPD et au pic de l’augmentation de la respiration (Figure 4D, marque 1). Juste après ce pic, l’inhibiteur, l’azoture de sodium, est ajouté, ce qui diminue rapidement la respiration mais a aussi souvent un artefact d’injection inférieur à la fréquence respiratoire inhibée(Figure 4D). La marque de l’inhibiteur est faite immédiatement après l’artefact d’injection (Figure 4D, marque 2). Le flux o2 ne se stabilisera généralement pas et continuera à diminuer.
Tableau 1 : Notation respiratoire et dérivation analytique. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Caractéristiques de l’échantillon et des voies respiratoires des homogénats de tumeurs mammaires luminales B. Veuillez cliquer ici pour télécharger ce tableau.

Figure 1: Optimisation de la concentration en homogénat tumoral. FluxO2 (rouge) etO2 Concentration (bleu) dans les homogénats tumoraux mammaires préparés à (A) 40 mg/mL, (B) 30 mg/mL, (C) 20 mg/mL, et (D) 10 mg/mL. Thom : Respiration de l’homogénat tissulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
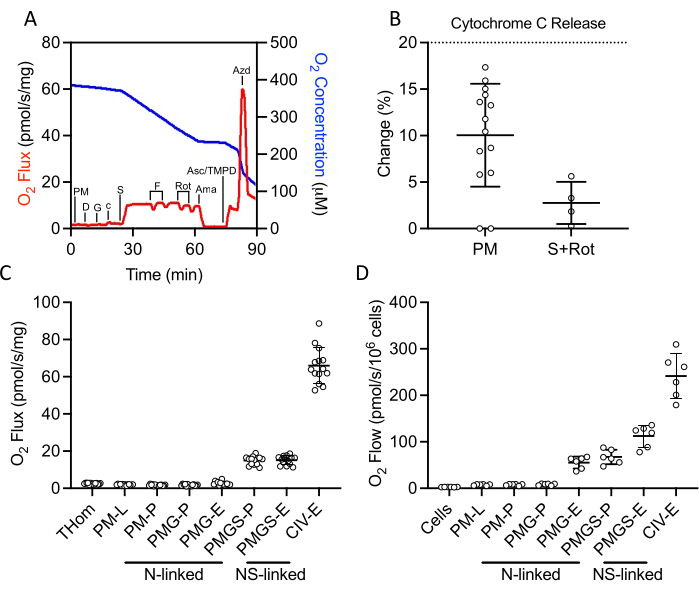
Figure 2: Évaluation de la capacité OXPHOS et ET par respirométrie à haute résolution dans des homogénats tumoraux fraîchement excisés. (A) Graphique représentatif de la consommation d’oxygène (rouge) et des concentrations (bleu) au cours d’un substrat, inhibiteur, protocole de découpleur. PM: Pyruvate + Malate, D: ADP, G: Glutamate, c: Cytochrome c, S: Succinate, F: FCCP, Rot: Roténone, Ama: Antimycine A, Asc / TMPD: Ascorbate / Tétraméthyl-p-phénylènediamine. (B) Pourcentage d’augmentation du fluxo2 lors de l’ajout du cytochrome c. (C-D) Respiration soutenue par le malate, le pyruvate, le glutamate et le succinate en présence d’ADP, de FCCP et d’ascorbate/TMPD dans les homogénats tumoraux dérivés de l’EO771(C)et(D)les cellules perméabilisées à la digitonine EO771 non implantées. Thom: Respiration homogénéisée tissulaire; PM: Pyruvate + Malate; PMG: Pyruvate + Malate + Glutamate; PMGS: Pyruvate + Malate + Glutamate + Succinate; CIV: Complexe IV; -L : État de fuite ; -P : État de phosphorylation oxydative, -E : État de transfert d’électrons ; Lié à l’azote : fluxo2 soutenu par des combinaisons de substrats génératrices de NADH définies; Lié au NS : flux d’O2 soutenu par la convergence de combinaisons de substrats générés par le NADH et le succinate définis. Veuillez cliquer ici pour voir une version agrandie de cette figure.
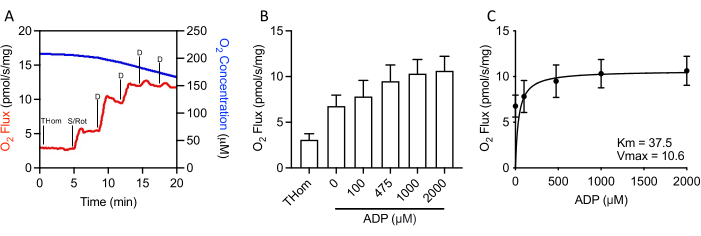
Figure 3: Tumeurs mammaires EO771 présentant une sensibilité élevée à l’ADP (adénosine 5′-diphosphate). (A) Graphique représentatif de la consommation d’oxygène (rouge) et des concentrations (bleu) tout au long d’un protocole de titrage ADP lié à S. Thom: Respiration homogénéisée tissulaire; S/Pourriture : Succinate/Roténone ; D : ADP. (B) Respiration soutenue par le succinate en présence de roténone et des concentrations croissantes d’ADP (0 μM ADP = S/Rot-L). (C) Taux maximal (VMAX)et demi-concentration maximale (KM)d’ADP en présence de succinate + roténone. Veuillez cliquer ici pour voir une version agrandie de cette figure.
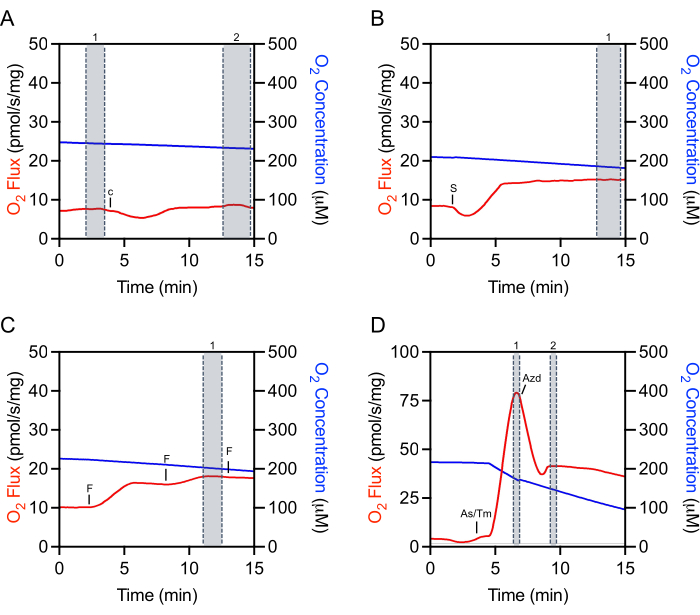
Figure 4: Traçage représentatif illustrant la sélection de marques des flux d’O2 bruts pour l’extraction des données. (A) Cytochrome c sélection : sélection numéro 1 avant l’injection de Cytochrome c et sélection numéro 2 après l’injection lorsque le flux d’O2 s’est stabilisé. c Cytochrome c. (B) Sélection du substrat, de l’ADP et de l’inhibiteur : sélection numéro 1 après l’injection (succinate dans ce diagramme représentatif) où le fluxO2 s’est stabilisé. S : Succinate. (C) Sélection du découpleur: sélection numéro 1 au pic d’augmentation de la respiration pendant le titrage du découpleur. Dans ce diagramme de titrage FCCP représentatif, la troisième injection diminue légèrement la respiration et n’est donc pas utilisée pour la sélection. F : ACCP. (D) Sélection TMPD: sélection numéro 1 au pic d’augmentation de la respiration après les injections d’ascorbate et de TMPD. Sélection de l’azoture de sodium: sélection numéro 2 après l’artefact d’injection aiguë lorsque la respiration diminue initialement. As/Tm : Ascorbate/TMPD; Azd : Azide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les approches d’évaluation de la respiration mitochondriale dans le cancer ont été largement limitées aux modèles in vitro 13,14,15,16. Un certain succès a été obtenu dans la mesure de la respiration mitochondriale dans les tumeurs en utilisant la perméabilisation chimique6,7,17, mais il n’existe pas d’approche uniforme et de référence qui puisse être universellement appliquée et comparée à tous les types de tumeurs. De plus, le manque d’analyse et de rapports cohérents des données limite la généralisabilité et la reproductibilité des données. La méthode décrite ici fournit une approche simple et relativement rapide pour mesurer la respiration mitochondriale18 dans les préparations mitochondriales à partir d’échantillons de tumeurs solides fraîchement excisées. Les tumeurs ont été cultivées à partir de cellules cancéreuses mammaires murines Luminal B, ERα-négatives EO771 implantées orthotopiquement19.
La diligence et le soin apportés à la manipulation des tissus amélioreront considérablement la précision et la normalisation des taux de consommation d’oxygène. Les tissus et les mitochondries peuvent être facilement endommagés si l’échantillon n’est pas conservé au froid, n’est pas systématiquement immergé dans un milieu de conservation ou est trop manipulé, ce qui entraîne une routine sous-optimale et des taux OXPHOS. De plus, le poids humide précis du tissu homogénéisé est d’une importance cruciale car il s’agit de la principale méthode de normalisation. D’autres méthodes de normalisation peuvent être envisagées, telles que les protéines totales ou les marqueurs spécifiques mitochondriaux, tels que l’activité de la citrate synthase20. De plus, l’hétérogénéité tissulaire devra être abordée, avec des décisions sur les régions tumorales à inclure dans les expériences faites a priori. Le tissu nécrotique, fibrotique et conjonctif peut ne pas s’homogénéiser et / ou bien respirer et doit être évité à moins de tester intentionnellement ces régions tumorales. Notamment, la tumeur peut être très collante en fonction du type et de la région d’excision, ce qui rend le pesage et le transfert précis plus difficiles. Le nombre d’AVC utilisés pour les homogénéisations doit être optimisé pour assurer une préparation complète des mitochondries tout en atténuant les dommages aux membranes mitochondriales externes.
Pour améliorer la précision et la reproductibilité, nous recommandons d’effectuer des expériences d’optimisation pour le nombre de coups pour la préparation de l’homogénat, la concentration tissulaire et les concentrations de substrat, de découpleur et d’inhibiteur. Les études peuvent comparer le nombre différent d’accidents vasculaires cérébraux et comment ils correspondent à la réponse à l’ajout de cytochrome c dans l’étude ainsi que la capacité respiratoire mitochondriale maximale 21. Bien qu’il y ait une acceptation générale que moins de réponse au cytochrome c est meilleure, car une augmentation de la consommation d’oxygène après l’ajout du cytochrome c peut indiquer des dommages à la membrane mitochondriale externe, il n’y a pas de norme d’or quant à ce que ce seuil est pour chaque tissu et devrait être étudié expérimentalement pour s’assurer que le tissu n’est pas surchargé ou sous-préparé. Dans ce tissu tumoral, il a été constaté qu’une réponse au cytochrome c inférieure à ~ 30% n’altérait pas la fonction respiratoire. L’utilisation du cytochrome c devient essentielle pour une quantification précise de la capacité respiratoire si le test est positif. Dans ce cas, l’addition reconstitue le cytochrome endogène c, qui, s’il est épuisé, provoquera une sous-estimation de la fréquence respiratoire.
Les expériences de titrage de concentration tissulaire peuvent être effectuées sur une gamme de concentrations réalisables et, idéalement, seraient effectuées avec des SUIT qui seront étudiées au cours de l’étude. La capacité respiratoire varie selon le type de tumeur et la composition. Ainsi, les tumeurs denses avec des mitochondries ou une capacité respiratoire élevée nécessiteront des concentrations plus faibles (0,5-5 mg / mL). Les tumeurs avec peu de mitochondries ou une faible capacité respiratoire nécessiteront des concentrations plus élevées (7-12 mg / mL). De plus, les SUIC qui sont longs ou qui ont des substrats très consommés peuvent nécessiter moins de tissu pour empêcher la réoxygénation de la chambre ou la limitation de l’ADP. Certains tissus auront une relation linéaire dans la consommation d’oxygène, tandis que d’autres montreront une sensibilité améliorée et une oxydation maximale à certaines plages de concentration. La concentration tissulaire choisie doit être optimisée pour maximiser le flux d’oxygène tout en limitant le nombre d’événements de réoxygénation. De plus, il est souvent préférable de surestimer le besoin ou de viser l’extrémité supérieure de la plage de concentration. Les inhibiteurs, qui sont essentiels à la quantification des flux respiratoires, sont plus précis lorsqu’ils sont utilisés dans de plus grands bassins de mitochondries.
Une autre considération essentielle est la concentration des médicaments utilisés pendant les protocoles. Les changements dans la concentration d’homogénat peuvent modifier les concentrations de substrats, de découpleurs et d’inhibiteurs nécessaires à la réponse maximale. Ainsi, une fois la plage de concentration optimale choisie, une expérience testant les doses requises pour le protocole SUIT doit être effectuée. D’autres ADP peuvent être ajoutés pour s’assurer que les concentrations d’adénylate ne se limitent pas aux flux respiratoires. Les découpleurs chimiques tels que le FCCP ou le CCCP inhiberont la respiration à des concentrations plus élevées22. En tant que tel, il est essentiel de titrer en petites quantités pour révéler le taux maximal atteint. Les inhibiteurs, tels que la roténone et l’antimycine A, sont mieux utilisés lorsqu’ils sont saturés lors de la première injection. Bien que les concentrations optimales aient été déterminées dans des expériences préliminaires, nous avons également observé des différences liées au traitement dans la réponse aux inhibiteurs et ajoutons donc souvent une injection supplémentaire d’inhibiteurs pour démontrer une inhibition maximale, car les taux résultants servent de base à la quantification. L’inhibition chimique de l’ascorbate/TPMD est essentielle pour une réduction analytique précise car le TMPD subit une autooxydation23. Nous avons contrôlé l’auto-oxydation de l’ascorbate/TMPD/cytochrome c par l’ajout d’azoture de sodium, un inhibiteur établi du CIV. Pour les études Km, l’ajout de roténone en présence de succinate seul empêche l’accumulation d’oxaloacétate qui peut inhiber l’activité de la succinate déshydrogénase à de faibles concentrations24. Le volume et la concentration d’ADP dépendent fortement de la sensibilité des mitochondries à la combinaison de substrats dominante. Les préparations mitochondriales qui sont très sensibles à l’ADP nécessiteront des concentrations de départ plus faibles. De plus, des produits chimiques validés et une préparation appropriée des médicaments avec une attention particulière au pH, à la sensibilité à la lumière, le cas échéant, et à la température de stockage sont essentiels pour des expériences réussies.
La mise en place des instruments et les soins de routine sont d’une importance cruciale pour le succès de ces expériences. Un nettoyage adéquat et approprié des chambres est essentiel pour la reproductibilité et la prévention de la contamination biologique, protéique, inhibitrice ou découpleuse. Les électrodes de type Clark et les systèmes O2k utilisent des chambres de réaction en verre, ce qui représente un avantage de coût significatif par rapport aux systèmes à base de plaques qui reposent sur des consommables. Cependant, les chambres de verre doivent être vigoureusement nettoyées et peuvent être une source de contamination par les inhibiteurs dans les études ultérieures. L’incubation avec des échantillons riches en mitochondries pendant le processus de lavage (mitochondries isolées du cœur ou du foie, par exemple) peut réduire le risque de contamination expérimentale et est recommandée en plus des procédures de dilution et de lavage à base d’alcool. Si des études consécutives sont menées, le nettoyage à l’éthanol et aux mitochondries minimise la possibilité de contamination par les inhibiteurs. L’étalonnage du capteur d’oxygène est recommandé avant chaque expérience afin d’obtenir des mesures précises de la respiration par rapport à la pression partielle d’oxygène dominante. Si plusieurs étalonnages ne sont pas possibles, un étalonnage par jour peut suffire si la concentration d’oxygène reste stable et constante après la procédure de lavage.
Les procédures décrites ci-dessus utilisent l’instrument Oroboros O2k pour mesurer la consommation d’oxygène dans le tissu tumoral dans les 4 heures suivant l’excision tumorale en utilisant une solution de préservation et un milieu respiratoire préalablement conçus et optimisés25,26,27. Plusieurs paramètres de ce protocole peuvent être modifiés pour des applications ultérieures. La configuration et l’étalonnage de l’instrument, les homogénéisateurs utilisés pour la préparation des tissus et la concentration optimale d’oxygène de l’homogénat et de la chambre peuvent tous être adaptés pour une utilisation sur d’autres instruments présentant un potentiel de surveillance de l’oxygène. Par exemple, les chambres étaient légèrement surchargées lors de l’ajout d’homogénat, et donc lorsque la chambre est complètement fermée, le capillaire de la chambre reste plein. Cela consommera un peu d’oxygène dans la chambre, mais avec l’optimisation de la concentration de l’échantillon, nous pouvons tenir compte de cette consommation pour déterminer le niveau d’oxygène par le départ. Alternativement, l’échantillon peut être autorisé à s’équilibrer à l’oxygène ambiant avant la fermeture de la chambre, mais cela augmentera souvent le temps avant le début de l’expérience et retardera l’ajout de substrats. Alors que les homogénéisateurs utilisés dans ce protocole sont largement accessibles, d’autres techniques d’homogénéisation commerciales pourraient être utilisées, comme un broyeur de tissus ou un homogénéisateur automatisé28.
En outre, la préparation des tissus et les procédures d’instruments peuvent être utilisées avec un certain nombre de SUIT différents pour étudier le contrôle respiratoire par une diversité d’états de couplage et de contrôle des voies29. Ces protocoles SUIT ont été développés pour mesurer la capacité fonctionnelle, et par conséquent, la contribution des substrats endogènes potentiels n’a aucun impact sur la mesure de la capacité. Nous rendons compte analytiquement de la consommation d’oxygène non mitochondrial et/ou de la consommation résiduelle de l’homogénat par soustraction de l’antimycine A-roténone, ou des taux insensibles à l’azoture de sodium, selon le cas. Les mitochondries peuvent rester viables dans BIOPS ou des solutions de préservation construites de manière similaire pendant de longues périodes de temps (>24 h) en fonction du type de tissu et de l’intégrité30,31. Des études peuvent être effectuées à l’avance pour déterminer les limites de stockage temporelles, car OXPHOS de certains substrats peut avoir des limitations différentes. Ceci est essentiel si l’expérience ne peut pas être effectuée dans les heures suivant l’excision / biopsie tissulaire. 37°C est une température optimale et physiologique pour l’évaluation de la fonction respiratoire dans la plupart des systèmes mammifères. Toutefois, si la température d’essai semble interférer avec l’évaluation32,des études comparatives peuvent être menées sur une large plage de températures (25-40 °C) pour assurer une réactivité adéquate. Des contraintes instrumentales peuvent limiter la capacité de mener de telles études.
Les principales limites de la méthode décrite ci-dessus sont 1) le potentiel de dommages aux mitochondries par homogénéisation mécanique, 2) la présence d’ATPases ou d’autres produits biochimiques subcellulaires dans les préparations d’homogénéate qui peuvent interférer avec la détermination simultanée de l’ATP ou d’autres variables d’intérêt et peuvent nécessiter des méthodes de correction supplémentaires ou l’utilisation d’inhibiteurs33 , et 3) l’évaluation de nombreux échantillons et/ou de plusieurs SUIT par échantillon prend beaucoup de temps, car un instrument peut accueillir deux expériences à la fois et nécessite un nettoyage et une mise en place entre les expériences successives. Des expériences d’optimisation et une préparation cohérente des échantillons peuvent minimiser les dommages mitochondriaux importants qui contribueraient à des données incohérentes.
L’importance de la méthode par rapport aux méthodes existantes / alternatives est l’amélioration de la faisabilité par rapport à la quantité de matière première, le défi d’isoler les mitochondries ou le défi technique de la perméabilisation des tissus. La préparation des homogénats est plus rapide, l’oxygène n’est pas aussi limitant et est moins sensible à la variabilité entre le personnel que les tissus perméabilisés. Il est important de noter que presque tous les types d’échantillons conviennent à la préparation d’homogénats, ce qui permet une analyse comparative des tissus. La respirométrie à haute résolution est la mesure de référence des OXPHOS et et ET mitochondriaux mitochondriaux. L’application de cette méthode dans la recherche préclinique et clinique sur le cancer a la capacité d’étendre les investigations in vitro actuelles aux études ex vivo. En outre, il offre des applications potentielles dans les milieux cliniques et diagnostiques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts lié à ce travail.
Remerciements
Nous remercions le personnel de base du Pennington Biomedical Research Center Comparative Biology pour les soins aux animaux. Cette recherche a été soutenue en partie par les subventions U54GM104940 (JPK) et KL2TR003097 (LAG) de l’Institut national de la santé. Toutes les expériences et procédures impliquant des animaux ont été approuvées par le Pennington Biomedical Research Center Institutional Animal Care and Use Committee.
matériels
| Name | Company | Catalog Number | Comments |
| 2-(N-Morpholino)ethanesulfonic acid hydrate | Sigma-Aldrich | M8250 | |
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Adenosine 5'-triphosphate disodium salt hydrate | Sigma-Aldrich | A2383 | |
| Amphotericin B | Gibco | 15290018 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Ascorbate | Sigma-Aldrich | A4544 | |
| Bovine serum albumin, fraction V, heat shock, fatty acid free | Sigma-Aldrich | 3117057001 | Roche |
| BD 50 mL Luer-Lok Syringe | Fisher Scientific | 13-689-8 | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Calcium carbonate | Sigma-Aldrich | C4830 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | |
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| Datlab 7.4 software | Oroboros Instruments | ||
| Dimethylsulfoxide | Amresco | N182 | |
| Dithiothreitol | Sigma-Aldrich | D0632 | |
| D-Sucrose | Sigma-Aldrich | S7903 | |
| Dumont # 5 Forceps | Fine Science Tools | 11251-30 | Dumoxel, autoclavable |
| Dumont # 7 Forceps | Fine Science Tools | 11271-30 | Dumoxel, autoclavable |
| Digital Calipers 150 mm/6 in | World Precision Instruments | 501601 | |
| EO771 cells | CH3 BioSystems | SKU: 94APV1-vial-prem | Pathogen Tested |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Female C57BL/6J mice | Jackson Laboratory | Stock #000664 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Imidazole | Sigma-Aldrich | 56750 | |
| Kimwipes | Fisher Scientific | 34120 | |
| L-(−)-Malic acid | Sigma-Aldrich | G1626 | |
| Lactobionic acid | Sigma-Aldrich | L2398 | |
| Malate | Sigma-Aldrich | M6413 | |
| Matrigel Matrix | Corning | 354248 | |
| MgCl·6H2O | Sigma-Aldrich | M2670 | |
| Microsyringes | Hamilton | 87919, 80383, 80521, 80665, 80765, 80865, 87943 | |
| N,N,N′,N′-Tetramethyl-p-phenylenediamine | Sigma-Aldrich | T7394 | |
| Oxygraph-2k | Oroboros Instruments | 10023-03 | |
| Oxygraph-2k FluoRespirometer | Oroboros Instruments | 10003-01 | |
| PBS | Gibco | 10010023 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium hydroxide | Sigma-Aldrich | P1767 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| RPMI 1640 | Gibco | 21875034 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium pyruvate | Sigma-Aldrich | P5280 | |
| Succinate (disodium) | Sigma-Aldrich | W327700 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Whatman Filter Paper, grade 5 | Sigma-Aldrich | 1005-090 | |
| Wheaton Tenbroeck Tissue Grinder, 7 mL | Duran Wheaton Kimble | 357424 | |
| Straight Tip Micro Dissecting Scissors | Roboz | RS-5914SC | |
| Non-Safety Scalpel No. 11 | McKesson | 1029065 | |
| BD Precision Glide Needle 27 G x 1/2 | Becton, Dickinson and Company | 305109 | |
| BD Precision Glide Needle 18 G x 1 | Becton, Dickinson and Company | 305195 | |
| BD 1mL Slip Tip Syringe | Becton, Dickinson and Company | 309659 | |
| Pyrex Reusable Petri Dish, 60 mm | Thermo Fisher Scientific | 316060 | |
| Rodent Very High Fat Diet, 60% kcal from fat, 20% kcal from protein, and 20% kcal from carbohydrate | Research Diet | D12492 | |
| Pyrex Watch Glass, 100 mm | Thermo Fisher Scientific | S34819 |
Références
- DeBerardinis, R. J., Chandel, N. S. Fundamentals of cancer metabolism. Science Advances. 2 (5), 1600200 (2016).
- Bajzikova, M., et al. Reactivation of dihydroorotate dehydrogenase-driven pyrimidine biosynthesis restores tumor growth of respiration-deficient cancer cells. Cell Metabolism. 29 (2), 399-416 (2019).
- Martínez-Reyes, I., et al. Mitochondrial ubiquinol oxidation is necessary for tumour growth. Nature. 585 (7824), 288-292 (2020).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6 (3), 18317 (2011).
- Saks, V. A., et al., Saks, V. A., et al. . Bioenergetics of the Cell: Quantitative Aspects. , 81-100 (1998).
- Kaambre, T., et al. Metabolic control analysis of cellular respiration in situ in intraoperational samples of human breast cancer. Journal of Bioenergetics and Biomembranes. 44 (5), 539-558 (2012).
- Koit, A., et al. Mitochondrial respiration in human colorectal and breast cancer clinical material is regulated differently. Oxidative Medicine and Cellular Longevity. 2017, 1372640 (2017).
- Holland, O. J., et al. Changes in mitochondrial respiration in the human placenta over gestation. Placenta. 57, 102-112 (2017).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Kondrashova, M. N., et al. Preservation of native properties of mitochondria in rat liver homogenate. Mitochondrion. 1 (3), 249-267 (2001).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. American Journal of Physiology-Cell Physiology. 292 (1), 125-136 (2007).
- Hlozková, K., Starková, J. Assessment of the metabolic profile of primary leukemia cells. Journal of Visualized Experiments: JoVE. (141), e58426 (2018).
- Zhang, J., Zhang, Q., Haznadar, M. . Cancer Metabolism: Methods and Protocols. , 353-363 (2019).
- Wigner, P., Zielinski, K., Labieniec-Watala, M., Marczak, A., Szwed, M. Doxorubicin-transferrin conjugate alters mitochondrial homeostasis and energy metabolism in human breast cancer cells. Scientific Reports. 11 (1), 4544 (2021).
- Schöpf, B., et al. Oxidative phosphorylation and mitochondrial function differ between human prostate tissue and cultured cells. The FEBS Journal. 283 (11), 2181-2196 (2016).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Le Naour, A., et al. EO771, the first luminal B mammary cancer cell line from C57BL/6 mice. Cancer Cell International. 20, 328 (2020).
- Gnaiger, E., et al. Mitochondrial physiology. Bioenergetics Communications. 1, 44 (2020).
- Hughey, C. C., Hittel, D. S., Johnsen, V. L., Shearer, J. Respirometric oxidative phosphorylation assessment in saponin-permeabilized cardiac fibers. Journal of Visualized Experiments: JoVE. (48), e2431 (2011).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radical Biology and Medicine. 51 (9), 1621-1635 (2011).
- Munday, R. Generation of superoxide radical, hydrogen peroxide and hydroxyl radical during the autoxidation of N,N,N',N'-tetramethyl-p-phenylenediamine. Chemico-Biological Interactions. 65 (2), 133-143 (1988).
- Moser, M. D., Matsuzaki, S., Humphries, K. M. Inhibition of succinate-linked respiration and complex II activity by hydrogen peroxide. Archives of Biochemistry and Biophysics. 488 (1), 69-75 (2009).
- Veksler, V. I., Kuznetsov, A. V., Sharov, V. G., Kapelko, V. I., Saks, V. A. Mitochondrial respiratory parameters in cardiac tissue: a novel method of assessment by using saponin-skinned fibers. Biochimica et Biophysica Acta. 892 (2), 191-196 (1987).
- Gnaiger, E., Heldmaier, G., Klingenspor, M., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Doerrier, C., et al. High-resolution fluorespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Rohlenova, K., et al. Selective disruption of respiratory supercomplexes as a new strategy to suppress Her2(high) breast cancer. Antioxidants & Redox Signaling. 26 (2), 84-103 (2017).
- Gnaiger, E. Mitochondrial pathways and respiratory control. Bioenergetics Communications. 5th ed. , (2020).
- Barksdale, K. A., et al. Mitochondrial viability in mouse and human postmortem brain. FASEB Journal. 24 (9), 3590-3599 (2010).
- Underwood, E., Redell, J. B., Zhao, J., Moore, A. N., Dash, P. K. A method for assessing tissue respiration in anatomically defined brain regions. Scientific Reportys. 10 (1), 13179 (2020).
- Jorgensen, L. B., Overgaard, J., Hunter-Manseau, F., Pichaud, N. Dramatic changes in mitochondrial substrate use at critically high temperatures: a comparative study using Drosophila. Journal of Experimental Biology. 224, (2021).
- Salin, K., et al. Simultaneous measurement of mitochondrial respiration and ATP production in tissue homogenates and calculation of effective P/O ratios. Physiological Reports. 4 (20), 13007 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon