Method Article
Eksiz katı tümör homojenatlarının Mitokondriyal fonksiyonunun analitik tayini
Bu Makalede
Özet
Taze tümör homojenatlarında mitokondriyal oksidatif fosforilasyon ve elektron transfer kapasitesini değerlendirmek için pratik bir protokol ve analitik yaklaşım geliştirdik. Bu protokol, kanser başlangıç, ilerleme ve tedavi yanıtına katkıda bulunan çeşitli mitokondriyal işlevleri incelemek için kolayca uyarlanabilir.
Özet
Mitokondri, enerji üretimi, reaktif oksijen türleri düzenlemesi ve makromolekül sentezi yoluyla kanserin başlaması ve ilerlemesi için gereklidir. Mitokondrilerin tümör ortamına genetik ve fonksiyonel adaptasyonları proliferatif ve metastatik potansiyeli yönlendirmektedir. DNA ve RNA diziliminin ortaya çıkması, tümöregenez genetik arabulucularının değerlendirilmesine yönelik kritik engelleri ortadan kaldırdı. Bununla birlikte, bugüne kadar, tümör mitokondriyal fonksiyonunu değerlendirmek için metodolojik yaklaşımlar zor olmaya devam etmektedir ve fizibiliteyi sınırlayan teknik yeterlilik gerektirmektedir, sonuçta hem deneysel hem de klinik ortamlarda tanısal ve prognostik değeri azaltmaktadır. Burada, yüksek çözünürlüklü respirometri kullanarak yeni eksilen katı tümör homojenatlarında oksidatif fosforilasyon (OKSFOS) ve elektron transferi (ET) kapasitesini ölçmek için basit ve hızlı bir yöntem özetliyoruz. Protokol, türler ve tümör tipleri arasında tekrarlanabilir ve mitokondriyal ET yollarının çeşitliliğini değerlendirmek için uyarlanabilir. Bu protokolü kullanarak, armatürel B meme kanseri taşıyan farelerin kusurlu nikotinamid adenin dinükleotid bağlantılı solunum ve OXPHOS aracılığıyla adenozin trifosfat üretmek için süksinite güvendiğini gösteriyoruz.
Giriş
Tüm hücreler, moleküler enerji para birimi olan adenozin trifosfat (ATP) üretme ve tüketme ihtiyaçları ile yakından bağlantılıdır. Hücresel mutasyonlar tümör oluşumuna yol açtıkça, mitokondriler genellikle kanserli olmayan dokudan fenotipik olarak ayırt edilebilen enerji üretiminin çeşitlendirilmesi yoluyla sağkalım sağlar1,2,3. Bu nedenle, tümör tipinin sınıflandırılmasını, kanser başlangıç, ilerleme ve tedavi yanıtını kolaylaştırmak için mitokondriyal solunum fonksiyonunun hızlı ve derin profillemesine kritik bir ihtiyaç vardır.
OXPHOS için birincil substratlar hücre geçirgen olmadığı için ekscislenmiş doku örneklerinin solunum fonksiyonları bozulmadan değerlendirilemez. Bu sınırlamanın üstesinden gelmek için mitokondri izolasyon, kimyasal permeabilizasyon veya mekanik homojenizasyon ile hazırlanabilir. Mitokondriyal izolasyon uzun zamandır solunum fonksiyonlarının değerlendirilmesi için altın bir standart olarak kabul edilir. Bununla birlikte, büyük miktarda doku gerektirir, zaman alıcıdır ve mitokondri4'ünbelirli fraksiyonları için olası seçim önyargısı ile düşük verimlidir. Permeabilizasyon, doku bölümlerinin veya lif demetlerinin plazma zarını seçici olarak bozan hafif bir deterjana mekanik olarak ayrılması ve maruz kalmasından oluşur5. Permeabilizasyon, iskelet ve kalp kası gibi çizgili dokularda sıklıkla kullanılır, çünkü bireysel lif demetleri birbirinden alay edilebilir. İzolasyon ile karşılaştırıldığında, permeabilizasyon kendi yerel hücresel ortamlarında ve fiziksel formlarında daha fazla mitokondri verir5. Permeabilizasyon tümör6,7 ve plasnta8gibi diğer dokularda başarıyla uygulanmıştır; bununla birlikte, difüzyon sınırlamalarının üstesinden gelmek için diseksiyon ve oksijen gereksinimlerinin tutarlılığı nedeniyle permeabilize lif preparatlarının tekrarlanabilirliği zor olabilir9. Ayrıca, permeabilize lifler yoğun hücresel ve yüksek fibrotik olan bazı tümör tiplerinde uygun olmayabilir. Doku homojenatları plazma zarının mekanik bozulması yoluyla üretilir ve mitokondriyal verim ve bütünlük açısından permeabilize liflere benzer10. Doku homojenatları ayrıca oksijen difüzyonunun sınırlamalarını en aza indirir ve mekanik kuvvet11 , 12optimizasyonu yoluyla doku tipleri arasında kolayca kullanılabilir.
Burada, taze eksize katı tümör homojenatlarında oksidatif fosforilasyon (OKSPHOS) ve elektron transferi (ET) kapasitesini ölçmek için basit ve hızlı bir yöntem özetliyoruz. Protokol, enstrümantal kurulum ve kalibrasyon hakkında önceden bilgi gerektiren ancak herhangi bir Clark tipi elektrot, Denizatı analizörü veya plaka okuyucu kullanılarak benzer şekilde uyarlanabilebilen Oxygraph-2k (O2k) yüksek çözünürlüklü respirometre kullanılarak taze dokuyu değerlendirmek için en uygun şekilde tasarlanmıştır. Protokol, türler ve tümör tipleri arasında tekrarlanabilir ve mitokondriyal ET yollarının çeşitliliğini değerlendirmek için uyarlanabilir.
Protokol
Hayvanları içeren tüm deneyler ve prosedürler Pennington Biyomedikal Araştırma Merkezi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylandı.
1. Reaktif hazırlama.
- 10 mM HEPES, %10 fetal sığır serumu (FBS), %1 penisilin-streptomisiin (100 U/mL) ve %0,2 amfoterisikin B ile EO771 hücre büyüme ortamı hazırlayın.
- 1000 mL cam kabında 1 L biyopsi koruma (BIOPS) çözeltisi hazırlayın.
- 3.180 g Na2ATP (5.77 mM son konsantrasyon) ekleyin.
- 1.334 g MgCL2·6H2O (6,56 mM son konsantrasyon) ekleyin.
- 2.502 g Taurin ekleyin (20 mM son konsantrasyon).
- 3.827 g Na2Fosforeatin (15 mM son konsantrasyon) ekleyin.
- 1.362 g Imidazol ekleyin (20 mM son konsantrasyon).
- 0.077 g Dithiothreitol (.5 mM son konsantrasyon) ekleyin.
- 9,76 g MES hidrat (50 mM son konsantrasyon) ekleyin.
- 800 mL H2O ekleyin ve 30 °C'de manyetik bir karıştırıcı kullanarak bileşenleri karıştırın.
- 72,3 mL 100 mM K2EGTA (7,23 mM son konsantrasyon) ekleyin.
- 7.608 g EGTA ve 2.3 g KOH'yi 100 mL H2O'da çözün.
- 5 M KOH ile pH'ı 7,0'a ayarlayın veH2 O ile sesi 200 mL'ye kadar getirin.
- 27,7 mL 100 mM CaK2EGTA (2,77 mM son konsantrasyon) ekleyin.
- 7.608 g EGTA'yı 200 mL H2O'da çözün ve 80 °C'ye (100 mM son konsantrasyon) ısıtın.
- 2.002 g CaCO3'ün 200 mL sıcak 100 mM EGTA çözeltisinde çözün.
- Sürekli karıştırırken, 2,3 g KOH ekleyin ve pH'ı 7,0'a ayarlayın.
- pH'ı 5 M KOH ile 23 °C'de (0 °C'de pH 7.1) 6.75'e ayarlayın. H2O ile ses seviyesini 980 mL'ye kadar getirin ve çözeltiyi karıştırın. pH'ı bir kez daha kontrol edin, gerekirse ayarlayın ve son ses seviyesini suyla 1000 mL'ye kadar getirin.
- Aliquot BIOPS konik borulara (15 mL veya 50 mL) girer ve kullanıma kadar -20 °C'de saklayın. Kullanmadan hemen önce sadece bir kez çözün.
- 1000 mL cam bir kabın içine 1 L mitokondriyal solunum ortamı (MiR05) hazırlayın.
- 0.190 g EGTA (0.5 mM son konsantrasyon) ekleyin.
- 0.610 g MgCL2·6H2O (3 mM son konsantrasyon) ekleyin.
- 2.502 g Taurin ekleyin (20 mM son konsantrasyon).
- 1.361 g KH2PO4 (10 mM son konsantrasyon) ekleyin.
- 4,77 g HEPES (20 mM son konsantrasyon) ekleyin.
- 37,65 g D-Sakkaroz (110 mM son konsantrasyon) ekleyin.
- 800 mL H2O ekleyin ve 30 °C'de manyetik bir karıştırıcı kullanarak bileşenleri karıştırın.
- 120 mL 0,5 M Laktobiyonik asit (60 mM son konsantrasyon) ekleyin.
- 35,83 g Laktobiyonik asidi 100 mL H2O'da çözün.
- 5 M KOH ile pH'ı 7,0'a ayarlayın veH2 O ile 200 mL'ye kadar ses seviyesi getirin.
- Çözeltiyi karıştırın ve pH'ı 5 M KOH ile 7,1'e ayarlayın.
- 50 mL konik bir tüpte 1 g BSA, esasen yağ asidi içermeyen (1 g/L son konsantrasyon) tartın. 9. adımdan tüpe 40 mL pH 7.1 çözeltisi ekleyin, karıştırmak için hafifçe ters çevirin ve köpürmeyi önleyin. Çözünmüş BSA'yı 9. pH'ı bir kez daha kontrol edin, gerekirse ayarlayın ve son ses seviyesini H2O ile 1000 mL'ye kadar getirin.
- MiR05 ortamını 50 mL konik borulara aliquotlayın ve kullanıma kadar -20 °C'de saklayın. Kullanmadan hemen önce sadece bir kez çözün.
- Substratları, ayırmaları ve inhibitörleri hazırlayın.
- 0,8 M Malat hazırlayın: 536,4 mg L-Malic asidi 4 mL H2O'da çözün 5 M KOH ile pH 7'ye nötralize edin ve H 2 O ile hacmi5mL'ye kadar getirin aliquotlara bölün ve ardından -20 °C'de saklayın.
- 1 M Pyruvate hazırlayın: 550 mg Pyruvic asit sodyum tuzunun 4 mL'de çözün H2O. 5 M KOH ile pH 7'ye nötralize edin ve H 2 O ile hacmi5mL'ye kadar getirin.
- 0,5 M ADP (adenozin 5′-difosfat) hazırlayın: 1.068 g ADP sodyum tuzunun4 mL'sindeçözün H 2 O. 5 M KOH ile pH 7'ye nötralize edin ve H 2 O ile hacmi5mL'ye kadar getirin.
- 2 M Glutamat Hazırlayın: 3.7426 g L-Glutamik asit monohidratını 8 mL H 2 O'da çözün5M KOH ile pH 7'ye nötralize edin ve H2O ile hacmi 10 mL'ye kadar getirin.
- 4 mM Sitokrom chazırlayın: 50 mg Sitokrom c'yi 1 mL H2O'da çözün.
- 1 M Süksinit hazırlayın: 2.701 g Succinate disodium tuz heksahydratını 8 mL H2O'da çözün 1 N HCl ile pH 7'ye nötralize edin ve H2O ile hacmi 10 mL'ye kadar getirin Aliquots'a bölün ve ardından -20 °C'de saklayın.
- 1 mM FCCP (karbonil siyanür-4-(trifluoromethoxy)fenilhidrazon hazırlayın): 10 mL saf etanolde 2,54 mg FCCP çözün. Aliquots'a bölün ve sonra -20 °C'de saklayın.
- 150 μM Rotenone hazırlayın: 1 mM stok, girdap tamamen çözünene kadar hazırlamak için 10 mL saf etanolde 3,94 mg Rotenone çözün. 150 μM Rotenone'nin 1,5 mL'si yapmak için 1.275 mL saf etanol ile 225 μL 1 mM Rotenone stok konsantrasyonunu seyreltin. Işıktan koruyun, aliquotlara bölün ve ardından -20 ° C'de saklayın.
- 125 μM Antimisin A hazırlayın: 5 mM stok konsantrasyonu Antimisin A hazırlamak için 4 mL saf etanolde 11 mg Antimisin A çözün. Seyreltin 25 μL of 5 mM Antimiycin 975 μL saf etanol ile bir stok konsantrasyonu 0.125 mM Antimycin A.'nın 1 mL'si yapmak için aliquotlara bölün ve ardından -20 °C'de saklayın.
- 0,8 M Askorbat hazırlayın: 1,584 g Askorbat sodyum tuzunun 8 mL'de çözünH 2O. pH'ı askorbik asitle pH 6'ya ayarlayın ve H2O ile hacmi 10 mL'ye kadar getirin.
- 0,2 M TMPD (tetrametril-p-fenilenediamin) hazırlayın: 987,5 μL DMSO'da 32,85 mg TMPD çözün. 12,5 μL 0,8 M askorbat ekleyin (10 mM son askorbat konsantrasyonu). Işıktan koruyun, aliquotlara bölün ve ardından -20 ° C'de saklayın.
- 4 M Sodyum azit hazırlayın: 2,6 g Sodyum Azide'yi 10 mL H2O'da çözün.
2. Tümör büyümesi
- EO771 hücrelerini RPMI 1640 büyüme medyasında büyütün ve hücreleri% 5 CO2ile 37 ° C nemlendirilmiş inkübatörde koruyun.
- Tek evli dört haftalık dişi C57BL / 6J fareler, 12 saat açıkta 21-22 ° C'de koruyun: karanlık döngü. Farelere reklam sıvısının yiyecek ve suya erişimini sağlayın.
- Fareler 10 haftalık olduktan sonra, hücreleri ve fareleri kanser hücresi implantasyonu için hazırlayın.
- Hücreleri trypsinize edin, trypsin'i büyüme ortamıyla devre dışı bırakın ve oda sıcaklığında 5 dakika boyunca 500 x g'da hücreleri santrifüjlayın. Üst ve resuspend aspirat ve hücre peletleri (gerektiği gibi) medyada birleştirin. Trypan mavisi kullanarak uygulanabilir hücreleri sayın ve 1:1:1 Ortam / Bodrum Membran Matrisi / PBS çözeltisi ile toplam 60 μL hacimde 1 x 106 hücrelik bir hücre seyreltme hazırlayın. Bodrum membran matrisi eklendikten sonra, iyice karıştırın ve hücre süspansiyonunu buzda tutun. Şırınnaları 60 μL hücre süspansiyonu ile doldurun ve buza yerleştirin. Verimli bir şekilde çalışın ve hazırlamadan sonraki 1,5 saat içinde farelere hücre enjekte edin.
- Fareleri izofluran inhalasyonu ile uyuşturun (indüksiyon için% 3-5 ve bakım için% 1-3). Sağ4 ve 5. kasık meme bezleri arasında tıraş edin. Ortopedik olarak uyuşturuldu farelere EO771 hücre süspansiyonu enjekte edin.
- 4 hafta boyunca haftada iki kez tümör büyümesini izlemek ve ölçmek için elektronik kaliperler kullanın. Nekropsi sırasında, tümörü (veya en az 60 mg tümör bölümünü) hemen 10 mL buz gibi BIOPS'a yerleştirin. Tüpü ıslak buzda tut.
3. Cihaz kurulumu ve kalibrasyonu
- MiR05 ortamını 37 °C'lik su banyosunda ısıtın.
- Oroboros O2k sistemini açın, DATLAB yazılımını açın, Kullanıcıgirin veya seçin. O2k'ye Bağlan 'ıtıklatın. O2k konfigürasyonını kontrol edin ve doğru cihazın Power-O2k için etiketli olduğundan ve her odanın doğru Oksijen Sensörüne karşılık geldiğine emin olun; Tamam 'ıtıklatın. O2k kontrol penceresi açıldıktan sonra, Sistemler sekmesinin altında Blok Sıcaklığını 37 °C olarak ayarlayın, Karıştırıcı hızı her iki oda için 750 rpm'ye, Veri Kayıt aralığını ND 2,0 s'ye ayarlayın. Oda kutularında hem Karıştırıcı Gücü hem de Aydınlatma'yı kontrol edin. Oksijen, O2 sekmesinde Sensör Kazancı'nı 1 V/μA olarak ayarlayın (kazancın eski enstrüman modelleri için ayarlanması gerekebilir), Polarizasyon Voltajı 800 mV'ye ayarlayın ve ardından O2k'ye Bağlan 'atıklayın. Yeni bir deneme dosyası açıldıktan sonra, dosyayı adlandırın ve Kaydet 'itıklatın. Deneme etkin olduğunda, bir protokol seçim penceresi açılır; özel bir SUIT (Substrat uncoupler inhibitör titrasyon) çalıştırmak için İptal'e tıklayın.
- Protokol seçiminin ardından, deneysel kodu, örnek türünü, kohort, örnek kodu, örnek numarasını ve alt örnek numarasını uygun şekilde doldurmak için bir örnek pencere açılır. Üniteyi mg'a atayın ve tümör homojen konsantrasyonuna mL başına girin (oda başına miktar otomatik olarak doldurulur). Belirtilen Ortamın MiR05 ve Oda Hacminin 2,00 mL olduğundan emin olun. Alt kutuya gerektiği gibi yorum ekleyin ve Tamam'ı tıklatın.
- Durdurucuları çıkarın ve% 70 etanolleri odalardan emiş edin. Odanın içinde açığa çıkan zara asla yakın aspire etmeyin. Dört kez saf suyla durulayın ve odayı 2,25 mL MiR05 ile doldurun.
- Sensör testi: Karıştırıcıları 30 sn kapatmak için F9'a tıklayın. Karıştırıcı çubuğu tekrar açıldığında, O2 eğiminin her odada monoexponentially hızla arttığından emin olun. Oda sensör testinden başarısız olursa, elektrik bağlantılarını kontrol edin ve tuzlar birikmişse temizleyin; testi tekrarlayın. Sensör testte başarısız olmaya devam ederse, membranı incelemek için polarografik oksijen sensörü (POS) konektörünü çıkarın. Membranda gözle görülür hasar, ağır oksidasyon veya önemli kabarcık birikimi görülürse, deneysel prosedürleri durdurun ve cihaz servisine devam edin.
- Oksijen kalibrasyonu: Doğru solunum ölçümleri elde etmek için oksijen kalibrasyonu gerçekleştirin.
- Büküm hareketiyle, durdurucuları yavaşça hacim ayarlı konumlarına yerleştirin. Stoperin kuyusunda toplayan enjeksiyon kılcal damardan atılan fazla ortamı sifonlayın. Büküm hareketiyle, son hava dengesi (30-45 dk.) için sıvı fazın üzerinde bir gaz hacmi bırakarak durdurucu-aralayıcı aletine sıkıca sığacak kadar durdurucuları kaldırın.
- Doğru solunum ölçümleri elde etmek için oksijen sensörünü kalibre etmek için bu süre zarfında elde edilen sabit durumu kullanın. O2 eğim neg. (oksijenin negatif eğimi) 0 ± 2 pmol/s·mL'dir. Değer 2 pmol/s·mL'den yüksekse, hazneyi temizleyin ve yeni çözülmüş MiR05 ile yenilenin. Eğim dengesizse, cihaz servisine geçin.
- Sabit bir duruma ulaştıktan sonra, O2 konsantrasyon eğrisini seçin ve kaydırma tuşunu basılı tutarak eğrinin sabit bölgesini vurgulayın ve fare düğmesini sol tıklatın. Bölge seçildikten sonra, F5'e tıklayın, açılan okla hava kalibrasyonu için işareti seçin ve Kalibre Et'e tıklayın ve panoya kopyalayın.
- Enstrümantal arka plan kalibrasyonu (isteğe bağlı)
- Hava kalibrasyonunu takiben, akı arka plan dengelenmesi (~15 dk) için sıvı fazın üzerinde gaz hacmi olmadığından emin olun ve odaları tamamen kapatın.
NOT: Bu dönemde elde edilen sabit durum oranı araçsal arka planı temsil eder ve gelişmiş analitik hassasiyet için elde edilen verilerden çıkarılabilir. O2 eğimli neg. başlangıçta biraz artacak ve ± 2 ila 4 pmol /s·mL arasında plato olacaktır. - Değer yüksekse (>6 pmol/s·mL), potansiyel biyolojik kontaminasyon vardır. Bu durumda, odayı temizleyin ve taze çözülmüş MiR05 ile yenilenin. Sabit bir durum elde edildikten sonra, O2 eğimli neg. eğrisini seçin ve Shift tuşunu basılı tutarak eğrinin sabit bölgesini vurgulayın ve fare düğmesini sol tıklatın.
- Bölgeyi seçtikten sonra, F5'i tıklatın, Taban Çizgisi Düzeltme Kutusu'nu ve taban çizgisi işaretini açılan okla seçin ve Tamam 'ıtıklatın.
- Hava kalibrasyonunu takiben, akı arka plan dengelenmesi (~15 dk) için sıvı fazın üzerinde gaz hacmi olmadığından emin olun ve odaları tamamen kapatın.
4. Tümör homojen hazırlığı
- Islak buz üzerine 1 mL MiR05 ve sıkıca oturan bir cam pestle içeren bir cam homojenizatör yerleştirin.
- Çalışma sırasında, dokuyu buz gibi bir Petri kabına 1 mL BIOPS'a yerleştirin.
- Çözünür malzemeyi en üst düzeye çıkarmak, nekrotik bölgelerden kaçınmak ve marjinal tümör dokusunu çıkarmak için dokuyu temizleyin ve parçalara ayırın. Diseksiyon mikroskobu, neşter ve cerrahi cımbız kullanarak, herhangi bir saçı, nekrotik dokuyu, periferik bağ ve vasküler dokuyu ve varsa bitişik yağı çıkarın. Diseksiyon sırasında tümörü buz gibi BIOPS'ta tutmaya özen edin.
- Tümörü küçük parçalara ayırın (her biri ~ 5-10 mg) ve kalan tümör parçalarını buzda tutulan 10 mL BIOPS'a geri yerleştirin. Gerekirse ek preparatlar için bu dokuyu daha sonra kullanın.
NOT: Numunenin BIOPS'a tam olarak batırılmama süresini en aza indirmek için aşağıdaki adımları hızlı bir şekilde gerçekleştirin. Örnek MiR05'e yerleştirildikten sonra, zaman çok önemlidir. Hazırlanan homojenatı en kısa sürede kalibre edilmiş odaya dikkatlice hareket ettirin. - Doku bölümlerini bir filtre kağıdına dikkatlice lekeleyin, küçük bir plastik katranlı tartı teknesine yerleştirin ve ilk ıslak ağırlığı kaydedin. Kullanılmayan parçaları, sürekli koruma için 10 mL konik BIOPS tüpüne geri yerleştirin.
- Doku bölümlerini MiR05 içeren buz gibi bir homojenizatöre batırın ve varsa ağırlık teknesinde kalan ağırlığı kaydedin.
- Cam pestle (boşluk aralığı 0.09-0.16 mm) kullanarak, 5-7 aşağı ve yukarı vuruşu tamamlayarak tümör dokusunu hafifçe bozun. Her vuruş için, pestle'ı aşağı iterken saat yönünde saat yönünde 3 kez ve pestleyi geri çekerken 3 kez daha döndürün. Dokunun in-strokes arasında homojenizatörnün dibine yerleşmesine izin vermeyi unutmayın, ancak köpürmeyi önlemek için pestleyi sıvı hacminin tam üstüne getirmekten kaçının.
NOT: Elde eden homojenat, minimum katı doku kalıntıları ile bulutlu görünmelidir. - Homojenatı 15 mL konik bir tüpe dökün ve buza yerleştirin.
- Pipet 1-3 mL taze MiR05 pestle üzerinde ve homojenizatör içine kalan doku homojenizat yıkamak için. MiR05 yıkamayı homojenatı içeren konik tüpe dökün. Homojenatın tamamen aktarılmasını sağlamak için pestle ve homojenizatör yıkamayı 2-3 kez tekrarlayın. Yıkama adımları sırasında numuneyi aşırı seyreltmemek için hedef konsantrasyonu ve gerekli hacmi aklınızda bulundurun.
- Doku homojen konsantrasyonu doğru bir şekilde hesaplamak için homojenizatörü ve homojenatı homojenize olmayan kalan malzeme (yani bağ dokusu) için dikkatlice inceleyin.
- Homojenize olmayan malzemeyi cımbızla ulaşılamayan homojenizatörden çıkarmak için, homojenizatöre MiR05 ekleyin, hacmi (doku dahil) bir pipetle emiş ve içeriği bir Petri kabına taşıyın.
- Homojenize olmayan malzemeyi homojenden çıkarmak için (konik tüpün dibindeki büyük parçalara yerleşmiş), büyük parçaları bir pipetle aspire edin ve konik tüpün doku kapağına yerleştirin.
- Dokuyu petri kabından veya konik tüp kapağından cımbızla çıkarın ve filtre kağıdına damlatın. Konik tüp kapağından kalan homojenatı konik tüpe geri ekleyin, kaplayın ve karıştırmak için ters çevirin.
- Homojenizatörleri yeniden inceleyin ve homojenize olmayan herhangi bir ek malzeme için homojenize edin ve malzemeyi gerektiği gibi çıkarmak için 4.10.1-4.10.3 adımlarını tekrarlayın.
- Homojenizatörden elde edilen homojenize olmayan malzemenin kütlesini tartın ve kaydedin. Homojen preparatın, aktarılan herhangi bir bozulmamış doku için incelenmesi. Homojenize edilmemiş parçaları çıkarın ve gerektiği gibi tartın.
- Son numune ağırlığını hesaplamak için tartım teknesinden, homojenizatörden ve homojenattan (gerekirse) alınan doku ağırlığını ilk ıslak ağırlıktan çıkarın.
- Son örnek ağırlığı kullanarak, homojenatı istenen konsantrasyona getirmek için ek MiR05 ekleyin (optimizasyon denemeleriyle ilgili ayrıntılar için 5. adıma bakın).
- Homojenat tartıldıktan ve hazırlandıktan sonra, mümkün olan en kısa sürede teste geçin. Numuneyi cihaza aktarılana kadar ıslak buzda saklayın.
5. Substrat, uncoupler, inhibitör titrasyon protokolü (SUIT)
- Cihaz kalibre edildikten ve numune hazırlandıktan sonra, durdurucuları büküm hareketiyle çıkarın ve MiR05'i odalardan epire edin (odanın içinde maruz kalan zardan kaçının). Homojenatı iyice karıştırın ve odaya 2,25 mL homojenatı ekleyin. Birden fazla odaya bir homojenat ekleniyorsa, eşit doku dağılımını sağlamak için homojenatı karıştırırken her odaya bir seferde 1 mL pipet. Olayı adlandırmak ve zaman damgalamak için F4'e tıklayın ve ardından Tamam'a tıklayın.
- 50 mL'lik bir şırıngayı, künt bir 18 G iğne kullanarak bir regülatör ve gaz tüpü ile bir oksijen tankından oksijenle doldurun. Odaları ~500 μM oksijene hiperoksijene edin. Bunun için doğrudan odalara oksijen enjekte edin. Durdurucuları gevşek bir şekilde yerleştirin ve oksijen ~ 480 μM'ye ulaşana kadar kapanmayı bekleyin. Büküm hareketiyle, odayı yavaşça kapatın ve solunumun dengeye (~15-20 dk) izin verin. Gerekirse stoper merkezi kılcal damarı MiR05 ile doldurun.
- N bağlantılı ve NS bağlantılı ve CIV (Complex IV) aktivitesinin OKSB ve ET (elektron transfer durumu) kapasitesinin analitik belirlenmesi: Substratları, ayırmaları ve inhibitörleri tamamen kapalı odalara enjekte etmek için özel mikrosyringes kullanın. Her oda için olayları gerçek zamanlı olarak adlandırmak ve zaman damgalamak için her enjeksiyonda F4'e tıklayın. Çalışma boyunca, gerektiğinde O2 konsantrasyonu ve O2 eğim neg. ölçeklerini ayarlamak için F6'yı seçin. Her enjeksiyondan sonra şırıngları suda 3 kez (suda çözünür bileşikler için) veya% 70 etanol (etanol veya DMSO'da çözünmüş bileşikler için) yıkayın.
NOT: N bağlantılı: Tanımlanmış NADH üreten substrat kombinasyonları tarafından desteklenen O2 akı, NS bağlantılı: O2 akı, tanımlanmış NADH-generate substrat kombinasyonlarının ve süksinitlerin yakınsaması ile desteklenir.- 5 μL 0,8 M Malat (2 mM son konsantrasyon) ekleyin ve hemen bir sonraki enjeksiyona geçin. Enjeksiyon şırındını suda 3 kez yıkayın.
- Hemen 5 μL 1 M Pyruvate (2,5 mM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin. Enjeksiyon şırındını suda 3 kez yıkayın.
- 10 μL 0,5 M ADP (2,5 mM son konsantrasyon) ekleyin ve ADP yanıtının sabitlemesini bekleyin. Enjeksiyon şırındını suda 3 kez yıkayın.
NOT: Adenilit konsantrasyonlarının solunum akıları ile sınırlı olmadığından emin olmak için ek ADP (2,5-10 mM) gerekebilir. - 5 μL 2 M Glutamat (5 mM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin. Enjeksiyon şırındını suda 3 kez yıkayın.
- 5 μL 4 mM Sitokrom c (10 μM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin. Enjeksiyon şırındını suda 3 kez yıkayın.
- 20 μL 1 M Succinate (10 mM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin. Enjeksiyon şırındını suda 3 kez yıkayın.
- Titrat 0.5-1 μL artışları 1 mM FCCP (2-20 μM son konsantrasyon) ve her enjeksiyondan sonra solunumun stabilize olmasını bekleyin, solunumda ek bir artış olmayana kadar devam edin. Enjeksiyon şırındını% 70 etanolde 3 kez yıkayın.
- 2 μL 150 μM Rotenon (150 nM-2 μM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin. Daha fazla inhibisyon olmamasını sağlamak için 1 μL daha Rotenone ekleyin. Solunumda azalma varsa, solunumda bir azalma olmayana kadar ek enjeksiyonlarla devam edin. Enjeksiyon şırındını% 70 etanolde 3 kez yıkayın.
- 2 μL 125 μM Antimisin A (125 nM-5 μM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin. Başka bir inhibisyon olmamasını sağlamak için 1 μL daha Antimiycin A ekleyin. Solunumda azalma varsa, solunumda bir azalma olmayana kadar ek enjeksiyonlarla devam edin. Enjeksiyon şırındını% 70 etanolde 3 kez yıkayın.
- Odanın oksijen konsantrasyonlarını kontrol edin; konsantrasyon 125 μM'nin altındaysa, oksijenin solunum akısını sınırlamamasını sağlamak için oda havasına reoksijene veya hafif hiperoksijenetin. 5 μL 0,8 M Askorbat (2 mM son konsantrasyon) ekleyin. Enjeksiyon şırındını% 70 etanolde 3 kez yıkayın.
- Hemen 10 μL 0,2 M TMPD (1 mM son konsantrasyon) ekleyin, solunumun yavaş artmasını bekleyin. Enjeksiyon şırındını% 70 etanolde 3 kez yıkayın.
- Askorbat/TMPD platolarının solunum akısı olduğunda hemen 25 μL 4 M Sodyum Azide (50 mM son konsantrasyon) ekleyin. Enjeksiyon şırındını% 70 etanolde 3 kez yıkayın.
- Çalışmayı sonlandırın- Dosya, Kaydet ve Bağlantıyı Kes 'etıklayın. 9.2-9.3 adımlarını izleyerek hazneyi ve şırınna yıkamaya devam edin.
6. ADP duyarlılık protokolü
- Cihaz kalibre edildikten ve numune hazırlandıktan sonra, durdurucuları büküm hareketiyle çıkarın ve MiR05'i odalardan epire edin (odanın iç kısmına maruz kalan zardan kaçının). Homojenatı iyice karıştırın ve odaya 2,25 mL homojenatı ekleyin. Eşit doku dağılımını sağlamak için homojenatı karıştırırken her odaya bir seferde bir homojenat, pipet 1 mL eklediğinizi varsayalım. Olayı adlandırmak ve zaman damgalamak için F4'e tıklayın ve Tamam'a tıklayın.
- Durdurucuları takın ve büküm hareketiyle hazneyi yavaşça kapatın ve solunumun dengeye (~15-20 dk) izin verin. Gerekirse stoper merkezi kılcal damarı MiR05 ile doldurun.
- Succinate bağlantılı mitokondriyal ADP duyarlılığının analitik tespiti: Her odanın olaylarını gerçek zamanlı olarak adlandırmak ve zaman damgalamak için her enjeksiyonda F4'e tıklayın. Çalışma boyunca, gerektiğinde O2 konsantrasyonu ve O2 eğim neg. ölçeklerini ayarlamak için F6'yı seçin.
- 2 μL 150 μM Rotenon (150 nM son konsantrasyon) ekleyin.
- Hemen 20 μL 1 M Süksinit (10 mM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin.
- Maksimum yanıt oranına ulaşana kadar alt doygunluk konsantrasyonlarının adım adım eklenmesiyle ADP'yi titratın (VMAX; 2,5-10 mM son konsantrasyon).
NOT: ADP konsantrasyonundaki küçük bir değişiklik nedeniyle enjeksiyondan sonra oran platolaşabilir, böylece her platodan sonra enjeksiyon konsantrasyonunu artırabilir ve ADP enjeksiyon konsantrasyonunda kat artışı olsa bile solunumda daha fazla artış olmayana kadar titrasyonla devam edebilir.
7. Önerilen optimizasyon deneyleri
- Protokol için en uygun homojenatı ve oksijen konsantrasyonu belirleyin.
- Suit protokolünü (adım 5.1-5.3) birden fazla doku konsantrasyonlarında (örneğin, 30 mg/mL, 20 mg/mL, 10 mg/mL, 5 mg/mL, 2.5 mg/mL, 1 mg/mL ve/veya 0.5 mg/mL) gerçekleştirin.
- Reoksijenasyon sıklığını sınırlarken solunum akısını en üst düzeye çıkaran bir konsantrasyon seçin (en fazla 1-2). Daha sık reoksijenasyon gerekiyorsa, homojenatın konsantrasyonu azaltın.
- Homojenizatör ile en uygun vuruş sayısını belirleyin.
- SUIT protokolünü (adım 5.1-5.3) birden fazla homojenizasyon seviyesinde (örneğin, 5 vuruş, 10 vuruş, 15 vuruş, 20 vuruş) gerçekleştirin.
- Literatürde tümör homojen preparasyonu ile sitokrom c'nin yüzdelik artışının eşiğini belirlemek için yeterli veri olmadığından, sınırlı sitokrom c yanıtı ile hazırlığı seçin, ancak ilgi alanı alt tabakaları tarafından enerjilendirilmiş yeterli solunum.
- Nicel ve tekrarlanabilir solunum akıları için gereken en uygun substrat, ADP, uncoupler ve inhibitör konsantrasyonlarını belirleyin.
- Seçilen doku konsantrasyonunda (adım 7.1) SUIT protokolünü (adım 5.1-5.3.9) gerçekleştirin. Başka bir yanıt gözlenene kadar her alt tabakayı, ayırıcıyı, inhibitörü ve ADP'yi titrat. Ayrı deneylerde sodyum azit ile inhibisyonu titrat.
- 5 μL 0,8 M Malat (2 mM son konsantrasyon) ekleyin ve hemen bir sonraki enjeksiyona geçin.
- Titrate 1 μL artışları 1 M Pyruvate ve her enjeksiyondan sonra solunumun stabilize olmasını bekleyin, solunumda ek bir artış olmayana kadar devam edin.
- Titrat 2 μL artışları 0.5 M ADP ve her enjeksiyondan sonra solunumun stabilize olmasını bekleyin, solunumda ek bir artış olmayana kadar devam edin.
- Titrate 1 μL artışları 2 M Glutamat ve her enjeksiyondan sonra solunum stabilize bekleyin, solunumda ek bir artış olmayana kadar devam edin.
- 5 μL 4 mM Sitokrom c (10 μM son konsantrasyon) ekleyin ve solunumun stabilize olmasını bekleyin.
- Titrate 5 μL artışlar 1 M Succinate ve her enjeksiyondan sonra solunum stabilize bekleyin, solunumda ek bir artış olmayana kadar devam edin.
- Titrat 5 μL artışlar 0.5 M ADP ve her enjeksiyondan sonra solunum stabilize bekleyin, solunumda ek bir artış olmayana kadar devam edin.
- Titrat 0.5 μL artışlar 1 mM FCCP ve her enjeksiyondan sonra solunum stabilize bekleyin, solunumda ek bir artış olmayana kadar devam edin.
- Titrat 1 μL artışlar 150 μM Rotenon ve her enjeksiyondan sonra solunum stabilize bekleyin, solunumda bir azalma olmayana kadar devam edin.
- Titrat 1 μL artışlar 125 μM Antimisin A ve her enjeksiyondan sonra solunum stabilize bekleyin, solunumda ek bir azalma olmayana kadar devam edin.
- 5 μL 0,8 M Askorbat (2 mM son konsantrasyon) ekleyin.
- Hemen 5 μL 0,2 M TMPD (.5 mM son konsantrasyon) ekleyin, solunumun yavaş artmasını bekleyin. Ayrı bir deneyde, 10 μL 0,2 M TMPD (1 mM son konsantrasyon) ekleyin.
- Ayrı deneylerde, Ascorbate/TMPD platolarının solunum akısı olduğunda hemen 10 μL, 25 μL, 50 μL ve 100 μL 4 M Sodyum Azide (sırasıyla 20 mM, 50 mM, 100 mM, 200 mM son konsantrasyon) eklenir.
- Deneyin zamanlamasını iyileştirmek için ilk enjeksiyonda doygunluk gösteren substrat ve inhibitör konsantrasyonlarını seçin. ADP duyarlılık değerlendirmelerini geleneksel SUIT protokolleriyle birleştirmek için doygunluk veya alt doygunluk konsantrasyonlarında ADP kullanın.
- Solunum akısının inhibisyonu olmadan doz yanıt verme hızını göstermek için alt maksimal uncoupler konsantrasyonlarını kullanın.
- Seçilen doku konsantrasyonunda (adım 7.1) SUIT protokolünü (adım 5.1-5.3.9) gerçekleştirin. Başka bir yanıt gözlenene kadar her alt tabakayı, ayırıcıyı, inhibitörü ve ADP'yi titrat. Ayrı deneylerde sodyum azit ile inhibisyonu titrat.
8. Veri analizi
- SUIT analizi
- Analitik azaltma için her titrasyon ve dışa aktarmadan sabit durum veya tepe oranlarını seçin.
- Verileri doku mg'ı başına saniyede2 pmol O (pmol/s/mg) olarak ifade edin.
- Antimisiyan A'yı ilgili orandan (yani ADP eklendikten sonra elde edilen sabit durum oranı) çıkararak PM-L, PM-P, PMG-P, PMGS-P ve PMGS-E'nin analitik azalmasını elde edin.
NOT: PM: Pyruvate + Malat; PMG: Pyruvate + Malat + Glutamat; PMGS: Pyruvate + Malat + Glutamat + Succinate; -L:Sızıntı durumu; -P: Oksidatif fosforilasyon durumu, -E: Elektron transfer durumu. - Sodyum azit duyarsız oranını en yüksek askorbat/TMPD oranından çıkararak CIV-E'nin analitik azalmasını elde edin.
- Rotenon duyarsız oranını PMGS-E oranından çıkararak PMG-E'nin analitik azalmasını elde edin.
- Antimycin A duyarsız oranını rotenon duyarsız oranından çıkararak S-E'nin analitik azalmasını elde edin.
- Aşağıdaki denklemle dış zar sağlamlığının bir göstergesi olan sitokrom c kontrol verimliliğinin analitik olarak azaltılmasını elde edin:
jc = ((JCHNOc - JCHNO)/JCHNO) x 100
Denklemde, jc sitokrom cilavesi üzerine % artıştır, JCHNOc sitokrom cilavesi sonrası oksijen akısıdır ve JCHNO sitokrom cilavesi öncesinde oksijen akısıdır.
- ADP duyarlılık analizi
- Succinate + rotenon sızıntı oranına göre ADP duyarlılığı için kinetiği analitik olarak belirleyin (doku homojenat oranı değil).
- O2 akısını (Y ekseni) göreli ADP konsantrasyonuna (X ekseni) karşı çizin. ADP titrasyon üzerinden elde edilen en yüksek hız olarak maksimum solunum hızını (Vmaks.
- 1/2 VMAX'in elde edildiği ADP konsantrasyonunu ortaya çıkarmak için bir eğri uydurma yazılımı (PRISM, sürüm 10.1) kullanarak Michaelis-Menten kinetiğini belirleyin (Görünür KM).
9. Enstrümantal kalite kontrolü
- İstenilen oksijen konsantrasyon aralığı(0-600 μM) ve sıfır kalibrasyon üzerinde enstrümantal O 2 arka plan gerçekleştirin.
- 3.1 ve 3.2 adımlarını tamamlayın
- Durdurucuları çıkarın ve% 70 etanolleri odalardan etanat edin (odanın iç kısmına maruz kalan zardan kaçının). Çift damıtılmış H 2 O ile 4 kez durulayın veodayı2,25 mL MiR05 ile doldurun
- Odaları ~600 μM oksijene hiperoksijene edin.
- Stoperleri yavaşça tamamen kapalı konumlarına yerleştirin. Enjeksiyon kılcal damardan atılan ve stoper kuyusunda toplanan fazla ortamı sifonla ve oksijen sinyalinin dengelenmesini (30-45 dk) bekleyin.
- Oksijen kalibrasyonunu gerçekleştirmek için hem oksijen konsantrasyonunun hem de eğimin sabit olduğu bölgeyi seçin, ilgili odanın kalibrasyon penceresini açın ve R1 işaretini seçin.
- 0,5 mL suda 20 mg sodyum hidrosülfit eriterek disiyonit çözeltisini hazırlayın. Dithionite zamanla oksijene maruz kalarak oksitlendikçe havaya maruz kalmayı sınırlayın.
- Oksijen sinyali stabilize edildikten sonra, 1 μL enjekte edin ve oksijen konsantrasyonundaki düşüşü gözlemleyin. Dithionite çözeltisinin gücünü gerektiği gibi ayarlayın.
- Oksijen konsantrasyonunu sırasıyla 450 μM, 300 μM, 225 μM, 150 μM, 75 μM ve 0 μM'ye düşürmek için yeterli disiyonit çözeltisi enjekte edin. Her enjeksiyonda, oksijenin stabilize olmasını ve sabit durum eğimi için bir işaret seçmesini sağlar. Oksijen konsantrasyonu ~0 μM olduğunda, oksijen konsantrasyonu işaretleyin.
- Enstrümantal O2 arka plan düzeltmesi yapmak için, ilgili odanın akı/eğim penceresini seçin, O2 Arka Plan Kalibrasyonu'nu seçin ve ilgi çekici işaretler için Kalibre'yi tıklatın.
- Sıfır kalibrasyon gerçekleştirmek için, ilgili odanın kalibrasyon penceresini açın ve disiyonit titrasyondan sonra elde edilen R0 işaretini seçin.
- Cihaz temizliği
- Her odayı üç kez saf suyla hızlı bir şekilde durulayın. İlk yıkama için, homojenliği epire edin, odayı tamamen suyla doldurun ve ardından suyu aspire edin. İkinci yıkama için, odayı 3/4 su dolu doldurun, durdurucuları enjeksiyon kılcal damarı boyunca suyu zorlamak için yerleştirin, suyun bir kısmını enjeksiyon kılcal damarı boyunca epire edin ve ardından tamamen yıkamayı aspire etmek için durdurucuları çıkarın.
- Odaları% 70 etanol ile 5 dakika yıkayın.
- Bir lavabo veya beher üzerinde, durdurucuları saf su,% 70 etanol ve% 100 etanol ile temizleyin, bir yıkama şişesi kullanarak enjeksiyon kılcal damarlarından sıvıyı zorlayın.
- Her odayı iki kez saf suyla hızlı bir şekilde durulayın.
- Odaları 15 dakika boyunca ~2 mg dondurulmuş mitokondri, hücre lisatı veya canlı fibroblast içeren 2 mL PBS ile kuluçkaya yatırın.
- Odaları iki kez 5 dakika saf suyla yıkayın.
- Odaları% 70 etanol ile 5 dakika iki kez yıkayın.
- Odaları 10 dakika boyunca% 100 etanol ile yıkayın.
- Odaları% 70 etanol ile doldurun.
- Ardışık bir deney yaparsa, odaları 5 dakika boyunca% 70 etanolde bırakın ve ardından 3.3 adıma devam edin.
- Deneyler tamamlandıysa, durduruculara kapaklar takın ve cihazı kapatın.
- Her kullanımdan sonra, enjeksiyon şırınnalarını düzgün bir şekilde temizleyin ve şırınnaları taşımayı önlemek için belirli bileşik kullanım için özel tutun.
- Şırıngayı yıkama sıvısına yerleştirin ve enjeksiyon iğnesini tamamen batırın.
- Yıkama sıvısını şırındağa maksimum ses seviyesine kadar çekin.
- Şırınnayı yıkama kabından çıkarın, yıkama sıvısını bir kabın içine atın ve ardından şırınnayı bir kağıt havluya damlatın.
- Her kullanımdan sonra 9.3.1-9.3.3 adımlarını mümkün olan en kısa sürede üç kez yineleyin.
Sonuçlar
İlk çalışmalar, EO771 tümörlerinin düşük oksidatif olduğunu ve bu nedenle yeterli O2 akı değerlendirmesi için yüksek homojen konsantrasyonlara ihtiyaç olduğunu ortaya koydu. Çalışma için optimal doku homojenatı konsantrasyon aralığını belirlemek için optimizasyon deneyleri yapıldı. Tümör homojenatları başlangıçta 40 mg/mL'de hazırlandı ve daha sonra doğrusal olarak seyreltildi. Doku kütlesine normalleştirilen O2 akı konsantrasyonları arasında tutarlıydı (Şekil 1A-D). 40 mg/mL'nin hızlı oksijen tükenmesi ile sonuçlendiği ve deney için uygun olmadığı gözlenmiştir(Şekil 1A). Oksijen tüketimi 30 mg/mL ve 20 mg/mL ile önemli ölçüde yavaşladı, ancak substratların veya ADP'nin yokluğunda kısa sürede hızla azaldı (Şekil 1B,C). 10 mg/mL konsantrasyonu, daha uzun, 90 dakikalık SUIT protokolünü destekleyecek optimum oksijen tüketim oranı (Şekil 1D) ile sonuçlandı.
NADH ve succinate bağlantılı OXPHOS ve ET'nin yanı sıra CIV aktivitesini değerlendirmek için bir SUIT protokolü kullanılmıştır (Şekil 2A). NADH yoluyla sızıntıyı (L) yönlendirmek için ADP yokluğunda doku homojenatına piruvat ve malat eklendi. Doygunluk ADP daha sonra maksimum NADH bağlantılı OKSFO (P) tahrikine ve ardından glutamat eklenmesine eklendi. Sitokrom c daha sonra dış zar bütünlüğünü sağlamak için eklendi; solunum oranındaki artış tüm örneklerde %20'nin altındaydı (Şekil 2B). NADH bağlantılı substratlara verilen çok düşük yanıt göz önüne alındığında, sitokrom c salınımı da süksinit ve rotenon varlığında değerlendirildi ve minimal sitokrom c stimülasyonu gözlendi (Şekil 2B). İlginçtir ki, NADH bağlantılı OKSFOS EO771 tümörlerinde ihmal edilebilirdi (Şekil 2C). Daha sonra süksinit dehidrogenaz yoluyla elektron akışını teşvik etmek için piruvat, malat ve glutamat varlığında süksit eklendi. FCCP daha sonra maksimal elektron akışını (E) sağlamak için titratlandı, bu da EO771 tümörlerinde oksidasyon yerine fosforilasyonun solunumla sınırlandığını ortaya koydu (Şekil 2C). Rotenon ve antimisidan A daha sonra sırasıyla karmaşık I ve kompleks III'ü inhibe etmek için titratlandı. Askorbat ve TMPD daha sonra sodyum azit tarafından inhibe edilen CIV aracılığıyla maksimum elektron akışını sağlamak için eklendi. Tablo 1, Şekil2C'deçizilen solunum parametrelerini nicel olarak kalibre etmek için ham verilerin analitik azaltma denklemlerini göstermektedir ( Tablo 2). Genel olarak, tümör homojen solunum profilleri (Şekil 2C) implante edilmemiş digitonin permeabilize EO771 hücrelerininkine benzer (Şekil 2D) tümördeki N ve S bağlantılı substratlar tarafından desteklenen azalmış maksimal elektron transferi hariç.
NADH bağlantılı solunum ihmal edilebilir olduğundan, süksinit solunum kinetiği, maksimum hıza (VMAX)ulaşılana kadar alt doygunluk ADP'nin adım adım titrasyonları ile daha da değerlendirildi (Şekil 3A,3B). Succinate + rotenon varlığında ADP'nin yarı maksimal konsantrasyonu (KM)37,5 μM, VMAX ise ~10,5 pmol/s/mg idi (Şekil 3C). Bu nedenle, nispeten zayıf oksidasyon oranlarına rağmen, EO771 tümörleri ADP'ye karşı oldukça hassastı ve nispeten düşük ADP konsantrasyonlarında SÜREKLI ATP senteziydi.
Çıkarma için ham verilerin uygun bölgelerini seçmek, deneylerin tekrarlanabilirliği ve doğru niceleme için kritik öneme sahiptir. Sitokrom ciçin, enjeksiyondan hemen önce sabit durumda bir işaretin seçilmesi gerekir(Şekil 4A, işaret 1). Genellikle O2 akısının sabit olmadığı bir süre (yaklaşık 5-10 dk) takip edilebilen bir ilk enjeksiyon yapıtı vardır. Sitokrom c verimliliğinin değerlendirilmesi, O2 akı stabilize edildikten sonra ek bir seçim yapılarak yapılır(Şekil 4A, işaret 2). Substratların, ADP'nin veya çoğu inhibitörün eklenmesinden sonraki seçimler de enjeksiyon yapıtından sonra ve O2 akı stabilize edildikten sonra yapılır (Şekil 4B). Maksimum ayrılmamış solunumu belirlemek için kullanılan seçim, fccp titrasyon sırasında elde edilen en yüksek artışta yapılır, bu genellikle yapılan son enjeksiyon değildir (Şekil 4C). TMPD seçimi hem askorbat hem de TMPD eklendikten sonra ve solunumda en yüksek artışta yapılır(Şekil 4D, işaret 1). Bu zirveden hemen sonra, respirasyonunu hızla azaltan ancak aynı zamanda inhibe edilen solunum oranından daha düşük bir enjeksiyon yapıtına sahip olan inhibe edici sodyum azit eklenir (Şekil 4D). inhibitör işareti enjeksiyon yapıtından hemen sonra yapılır(Şekil 4D, işaret 2). O2 akı genellikle stabilize olmaz ve azalmaya devam etmez.
Tablo 1: Solunum çezasyonu ve analitik türetme. Bu Tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Luminal B meme tümörü homojenatlarının örnek ve solunum özellikleri. Bu Tabloyu indirmek için lütfen tıklayınız.

Şekil 1: Tümör homojenaz konsantrasyonunun optimizasyonu. (A)40 mg/mL, (B) 30 mg/mL, (C)20 mg/mL ve (D) 10 mg/mL'de hazırlanan meme tümörü homojenatlarında O 2 Akı (kırmızı) ve O 2 Konsantrasyonu (mavi). Doku homojen solunumu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
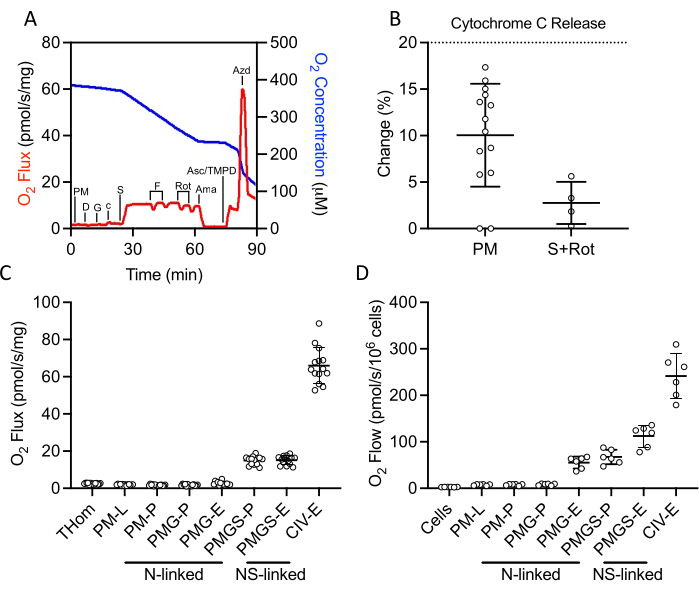
Şekil 2: Yeni eksilen tümör homojenatlarında OKSFOS ve ET kapasitesinin yüksek çözünürlüklü respirometri ile değerlendirilmesi. (A)Bir substrat, inhibitör, uncoupler protokolü boyunca oksijen tüketiminin (kırmızı) ve konsantrasyonların (mavi) temsili arsası. PM: Pyruvate + Malat, D: ADP, G: Glutamat, c: Sitokrom c, S: S: Succinate, F: FCCP, Rot: Rotenone, Ama: Antimycin A, Asc/TMPD: Askorbat/Tetrametil-p-fenilenediamin. (B) Sitokrom cilavesi üzerine O2 akısında yüzde artış . (C-D) ADP, FCCP ve askorbat/TMPD'nin(C)EO771 türevli tümör homojenatları ve(D)implante edilmemiş EO771 digitonin permeabilize hücrelerde malat, piruvat, glutamat ve süksinit ile desteklenen solunum. Thom: Doku homojen solunumu; PM: Pyruvate + Malat; PMG: Pyruvate + Malat + Glutamat; PMGS: Pyruvate + Malat + Glutamat + Succinate; CIV: Kompleks IV; -L: Sızıntı durumu; -P: Oksidatif fosforilasyon durumu, -E: Elektron transfer durumu; N bağlantılı: Tanımlanmış NADH üreten substrat kombinasyonları tarafından desteklenen O2 akı; NS bağlantılı: Tanımlanan NADH-generate substrat kombinasyonlarının ve süksinitlerinin yakınsaması ile desteklenen O2 akı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
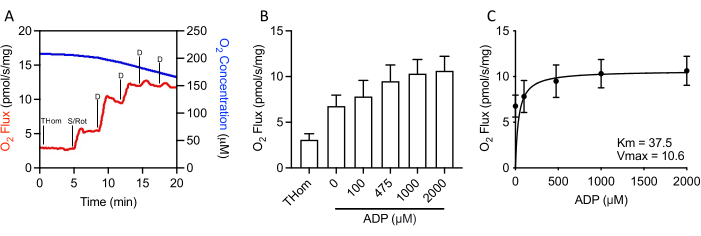
Şekil 3: EO771 meme tümörlerinde yüksek ADP (adenozin 5′-difosfat) hassasiyeti saptıldı. (A) S bağlantılı bir ADP titrasyon protokolü boyunca oksijen tüketiminin (kırmızı) ve konsantrasyonların (mavi) temsili grafiği. Thom: Doku homojen solunumu; S/Rot: Succinate/Rotenone; D: ADP. (B) Rotenon varlığında süksinit ile desteklenen solunum ve artan ADP konsantrasyonları (0 μM ADP = S/ Rot-L). (C) Süksinit + rotenon varlığında ADP'nin maksimum oranı (VMAX)ve yarı maksimal konsantrasyonu (KM). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
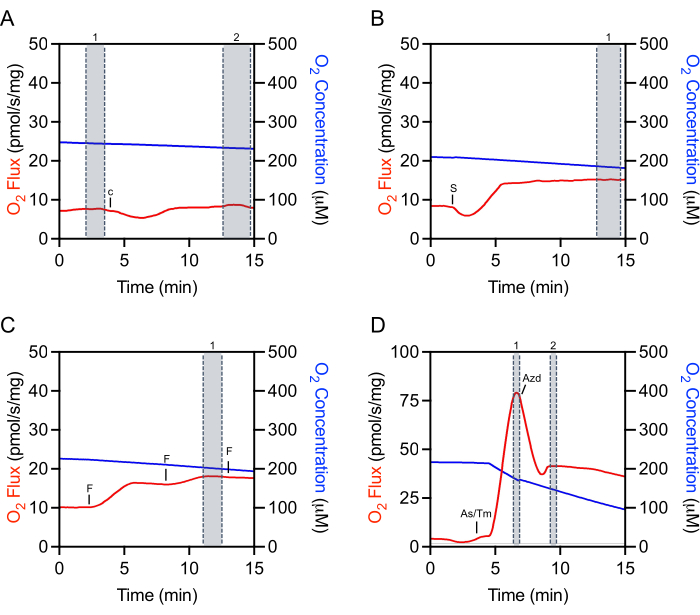
Şekil 4: Veri ayıklama için ham O2 akılarının işaret seçimini gösteren temsili izleme. (A) Sitokrom c seçimi: Sitokrom c enjeksiyonundan önce seçim numarası 1 ve O 2 akı stabilize olduğunda enjeksiyondan sonra seçim numarası2. c Sitokrom c. (B) Substrat, ADP ve inhibitör seçimi: O 2 akısının stabilize olduğu enjeksiyondan sonra1 numaralı seçim (bu temsili arsada süksinit). S: Succinate. (C) Uncoupler seçimi: uncoupler titrasyon sırasında solunumda en yüksek artışta 1 numaralı seçim. Bu temsili FCCP titrasyon grafiğinde, üçüncü enjeksiyon solunumu biraz azaltır ve bu nedenle seçim için kullanılmaz. F: ACCP. (D) TMPD seçimi: askorbat ve TMPD enjeksiyonlarından sonra solunumun en yüksek artışında seçim numarası 1. Sodyum azit seçimi: solunum başlangıçta azaldığında akut enjeksiyon yapıtından sonra seçim numarası 2. As/Tm: Ascorbate/TMPD; Azd: Azide. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Kanserde mitokondriyal solunumu değerlendirme yaklaşımları büyük ölçüde in vitro modeller13 , 14,15,16ile sınırlıdır. Kimyasal permeabilizasyon6, 7,17kullanılarak tümörlerde mitokondriyal solunumun ölçülmesinde bazı başarılar elde edilmiştir, ancak tümör tipleri arasında evrensel olarak uygulanabilecek ve karşılaştırılabilecek tekdüze, altın standartlı bir yaklaşım yoktur. Ayrıca, tutarlı veri analizi ve raporlama eksikliği, sınırlı veri genelleştirilebilirliğine ve tekrarlanabilirliğine sahiptir. Burada özetlenen yöntem, mitokondriyal solunum18'i mitokondriyal preparatlarda taze eklenmiş katı tümör örneklerinden ölçmek için basit, nispeten hızlı bir yaklaşım sağlar. Tümörler ortopedik olarak implante edilmiş murine Luminal B, ERα-negatif EO771 meme kanseri hücrelerinden yetiştirildi19.
Doku kullanımı ile ilgili titizlik ve özen, oksijen tüketim oranlarının doğruluğunu ve normalleşmesini büyük ölçüde artıracaktır. Örnek soğuk tutulmazsa, sürekli olarak koruma ortamına batırılmazsa veya aşırı ele alınırsa doku ve mitokondri kolayca zarar verebilir, bu da yetersiz rutin ve OKSFOS oranlarına neden olur. Ayrıca homojenize dokunun doğru ıslak ağırlığı birincil normalleştirme yöntemi olduğu için kritik öneme sahiptir. Sitrat synthase aktivitesi20gibi toplam protein veya mitokondriyal spesifik belirteçler gibi diğer normalleştirme yöntemleri düşünülebilir. Ek olarak, doku heterojenliğinin ele alınması gerekecektir, tümör bölgeleri hakkındaki kararlar bir priori yapılan deneylere dahil edilecektir. Nekrotik, fibrotik ve bağ dokusu homojenleşmeyebilir ve/veya iyi bir şekilde solunum yapamayabilir ve bu tümör bölgeleri kasıtlı olarak test edilmediği sürece kaçınılmalıdır. Özellikle, tümör tipine ve eksizyon bölgesine bağlı olarak çok yapışkan olabilir, bu da doğru tartım ve transferi daha zor hale getirir. Homojenizasyonlar için kullanılan inme sayısı, dış mitokondriyal zarlardaki hasarı azaltırken mitokondrilerin tam olarak hazırlanmasını sağlamak için optimize edilmelidir.
Daha iyi doğruluk ve tekrarlanabilirlik için homojen hazırlık, doku konsantrasyonu ve substrat, uncoupler, inhibitör konsantrasyonları için inme sayısı için optimizasyon deneyleri yapılmasınızı öneririz. Çalışmalar, farklı inme sayısını ve çalışma içindeki sitokrom c'nin eklenmesine ve maksimum mitokondriyal solunum kapasitesine yanıtla nasıl karşılık geldiklerini karşılaştırabilir 21. Daha az sitokrom c yanıtının daha iyi olduğuna dair genel bir kabul olmasına rağmen, sitokrom c ilavesi sonrası oksijen tüketimindeki artış dış mitokondriyal zarın zarar gördüğünü gösterebileceğinden, bu eşiğin her doku için ne olduğu konusunda altın standart yoktur ve dokunun fazla çalışmaması veya hazırlıksız olmaması için deneysel olarak araştırılmalıdır. Bu tümör dokusunda ~ % 30'un altındaki sitokrom c yanıtının solunum fonksiyonlarını bozmadığı bulunmuştur. Sitokrom c kullanımı, test pozitifse solunum kapasitesinin doğru ölçülmesi için kritik hale gelir. Bu durumda, ilave, tükenirse solunum oranlarının hafife almasına neden olacak endojen sitokrom c'yi yeniler.
Doku konsantrasyonu titrasyon deneyleri bir dizi uygulanabilir konsantrasyonda yapılabilir ve ideal olarak çalışma sırasında araştırılacak SUIT'lerle yapılır. Solunum kapasitesi tümör tipine ve bileşimine göre değişecektir. Bu nedenle, mitokondri veya yüksek solunum kapasitesine sahip yoğun tümörler daha düşük konsantrasyonlar gerektirecektir (0.5-5 mg/mL). Az sayıda mitokondri veya düşük solunum kapasitesine sahip tümörler daha yüksek konsantrasyonlar gerektirecektir (7-12 mg/mL). Ek olarak, uzun veya yüksek oranda tüketilen substratlara sahip SUIT'ler, odanın reoksijenasyonunu veya ADP sınırlamasını önlemek için daha az dokuya ihtiyaç duyabilir. Bazı dokular oksijen tüketiminde doğrusal bir ilişkiye sahip olurken, diğerleri belirli konsantrasyon aralıklarında gelişmiş hassasiyet ve maksimum oksidasyon gösterecektir. Seçilen doku konsantrasyonu, reoksijenasyon olaylarının sayısını sınırlarken oksijen akısını en üst düzeye çıkarmak için optimize edilmelidir. Ek olarak, konsantrasyon aralığının daha yüksek ucunun ihtiyacını abartmak veya hedeflemek genellikle daha iyidir. Solunum akılarının niceliği için gerekli olan inhibitörler, daha büyük mitokondri havuzlarında kullanıldığında daha hassastır.
Bir diğer önemli husus, protokoller sırasında kullanılan ilaçların konsantrasyonudur. Homojen konsantrasyondaki değişiklikler, maksimum yanıt için gerekli olan substratların, uncoupler'ların ve inhibitörlerin konsantrasyonlarını değiştirebilir. Bu nedenle, en uygun konsantrasyon aralığı seçildikten sonra, SUIT protokolü için gerekli dozları test eden bir deney yapılmalıdır. Adenilit konsantrasyonlarının solunum akılarıyla sınırlı olmadığından emin olmak için ek ADP eklenebilir. FCCP veya CCCP gibi kimyasal uncouplers daha yüksek konsantrasyonlarda solunumu inhibe edecektir22. Bu nedenle, elde edilen maksimum oranı ortaya çıkarmak için küçük miktarlarda titrat yapmak önemlidir. Rotenon ve antimycin A gibi inhibitörler, ilk enjeksiyonda doyurulduğu zaman en iyi şekilde kullanılır. Ön deneylerde optimal konsantrasyonlar belirlenirken, inhibitörlere yanıt olarak tedaviye bağlı farklılıklar gözlemledik ve sonuç oranları nicelemenin temeli olarak maksimum inhibisyon göstermek için genellikle bir ek inhibitör enjeksiyonu ekledik. TMPD otooksidasyon23'etabi olduğu için Doğru analitik azaltma için Askorbat/TPMD'nin kimyasal inhibisyonu gereklidir. Yerleşik bir CIV inhibitörü olan sodyum azit ilavesi ile askorbat/TMPD/sitokrom c'nin otomatik oksidasyonunu kontrol ettik. Km çalışmaları için, tek başına süksinit varlığında rotenon eklenmesi, düşük konsantrasyonlarda süksinit dehidrogenaz aktivitesini inhibe edebilecek oksaloasetat birikimini önler24. ADP'nin hacmi ve konsantrasyonu, mitokondrilerin hakim substrat kombinasyonuna duyarlılığına oldukça bağlıdır. ADP'ye karşı oldukça hassas olan mitokondriyal preparatlar daha düşük başlangıç konsantrasyonları gerektirecektir. Ayrıca, onaylanmış kimyasallar ve pH'a dikkat ederek uygun ilaç hazırlama, varsa ışığa duyarlılık ve depolama sıcaklığı başarılı deneyler için gereklidir.
Cihaz kurulumu ve rutin bakım, bu deneylerin başarısı için kritik öneme sahiptir. Odaların yeterli ve uygun şekilde temizlenmesi, biyolojik, protein, inhibitör veya uncoupler kontaminasyonunun tekrarlanabilirliği ve önlenmesi için gereklidir. Clark tipi elektrotlar ve O2k sistemleri, sarf malzemelerine dayanan plaka bazlı sistemler için önemli bir maliyet avantajı olan cam reaksiyon odalarını kullanır. Bununla birlikte, cam odalar güçlü bir şekilde temizlenmelidir ve sonraki çalışmalarda inhibitör kontaminasyon kaynağı olabilir. Yıkama işlemi sırasında mitokondri bakımından zengin örneklerle inkübasyon (örneğin izole kalp veya karaciğer mitokondrileri) deneysel kontaminasyon riskini azaltabilir ve seyreltme ve alkol bazlı yıkama prosedürlerine ek olarak önerilir. Ardışık çalışmalar yürütülürse, etanol ve mitokondri ile temizlik inhibitör kontaminasyon olasılığını en aza indirir. Oksijen sensörünün kalibrasyonu, her deneyden önce oksijenin hakim kısmi basıncına göre doğru solunum ölçümleri elde etmek için önerilir. Birden fazla kalibrasyon mümkün değilse, yıkama işleminden sonra oksijen konsantrasyonu sabit ve tutarlı kalırsa günde bir kalibrasyon yeterli olabilir.
Yukarıda özetlenen prosedürler, daha önce tasarlanmış ve optimize edilmiş koruma çözeltisi ve solunum ortamı 25,26,27kullanarak tümör eksizyonundan sonraki 4 saat içinde tümör dokusundaki oksijen tüketimini ölçmek için OroborosO2kcihazından yararlanır. Bu iletişim kuralındaki birden çok parametre sonraki uygulamalar için değiştirilebilir. Cihaz kurulumu ve kalibrasyonu, doku hazırlama için kullanılan homojenizatörler ve optimal homojenat ve oda oksijen konsantrasyonu, oksijen izleme potansiyeline sahip diğer aletlerde kullanılmak üzere uyarlanabilir. Örneğin, odalar homojenlik eklerken biraz fazla dolduruldu ve böylece oda tamamen kapatıldığında, oda kılcal damarları dolu kalır. Bu, odada biraz oksijen tüketecektir, ancak numune konsantrasyonunun optimizasyonu ile, hangi oksijen seviyesinin başlayacağını belirlemede bu tüketimi hesaba katabiliriz. Alternatif olarak, numunenin oda kapanmadan önce ortam oksijeninde aşındırmasına izin verilebilir, ancak bu genellikle deney başlamadan önceki süreyi artıracak ve substratların eklenmesini geciktirecektir. Bu protokolde kullanılan homojenizatörlere yaygın olarak erişilebilir olsa da, doku öğütücü veya otomatik homojenizatör28gibi diğer ticari homojenizasyon teknikleri kullanılabilir.
Ek olarak, doku hazırlama ve enstrüman prosedürleri, çeşitli kavrama ve yol kontrol durumları ile solunum kontrolünü incelemek için bir dizi farklı SUV ile kullanılabilir29. Bu SUIT protokolleri fonksiyonel kapasiteyi ölçmek için geliştirilmiştir ve bu nedenle potansiyel endojen substratların katkısının kapasite ölçümü üzerinde hiçbir etkisi yoktur. Antimisin A-rotenon veya sodyum azide duyarsız oranlarının çıkarılması yoluyla mitokondriyal olmayan oksijen tüketimini ve/veya homojenatın artık tüketimini analitik olarak hesaba katıyoruz. Mitokondri, doku tipine ve sağlamlığına bağlı olarak biops veya benzer şekilde inşa edilmiş koruma çözümlerinde uzun süre (>24 saat) canlı kalabilir30,31. Belirli substratların OXPHOS'unun farklı sınırlamaları olabileceğinden, zamansal depolama sınırlarını belirlemek için çalışmalar önceden yapılabilir. Deney doku eksizyon/biyopsiden sonraki birkaç saat içinde yapılamıyorsa bu esastır. 37°C, çoğu memeli sisteminde solunum fonksiyonlarının değerlendirilmesi için en uygun ve fizyolojik bir sıcaklıktır. Bununla birlikte, test sıcaklığı değerlendirme32'yemüdahale ediyor gibi görünüyorsa, yeterli yanıt hızını sağlamak için geniş bir sıcaklık aralığında (25-40 °C) karşılaştırmalı çalışmalar yapılabilir. Enstrümantal kısıtlamalar bu tür çalışmaların yürütülmesi yeteneğini sınırlayabilir.
Yukarıda açıklanan yöntemin başlıca sınırlamaları şunlardır: 1) Mekanik homojenizasyon yoluyla mitokondrilere zarar verme potansiyeli, 2) ATP'nin veya diğer ilgi değişkenlerinin eşzamanlı olarak belirlenmesini engelleyebilecek homojen preparatlarda ATPases veya diğer hücresel altı biyokimyasalların varlığı ve ek düzeltme yöntemleri veya inhibitör kullanımı gerektirebilir33 ve 3) örnek başına birçok numunenin ve/veya birden fazla SUIT'nin değerlendirilmesi zaman alıcıdır, çünkü bir cihaz aynı anda iki deneye ev sahipliği yapabilir ve ardışık deneyler arasında temizlik ve kurulum gerektirir. Optimizasyon deneyleri ve numunelerin tutarlı bir şekilde hazırlanması, tutarsız verilere katkıda bulunacak önemli mitokondriyal hasarı en aza indirebilir.
Yöntemin mevcut/alternatif yöntemlere göre önemi, başlangıç malzemesi miktarı, mitokondri izole etme zorluğu veya permeabilizasyon dokusunda teknik zorluk ile karşılaştırıldığında gelişmiş fizibilitedir. Homojenatların hazırlanması daha hızlıdır, oksijen neredeyse sınırlayıcı değildir ve permeabilize dokuya kıyasla personel arasındaki değişkenliğe daha az duyarlıdır. Daha da önemlisi, neredeyse tüm numune tipleri dokular arasında karşılaştırmalı analize izin veren homojen preparat için uygundur. Yüksek çözünürlüklü respirometri, mitokondriyal OKSFOS ve ET'nin altın standart ölçümüdür. Bu yöntemin klinik öncesi ve klinik kanser araştırmalarında uygulanması, mevcut in vitro araştırmaları ex vivo çalışmalara genişletme kapasitesine sahiptir. Ayrıca, klinik ve tanısal ortamlarda potansiyel uygulamalar sunar.
Açıklamalar
Yazarların bu eserle ilgili herhangi bir çıkar çatışması yoktur.
Teşekkürler
Pennington Biyomedikal Araştırma Merkezi Karşılaştırmalı Biyoloji Çekirdeği personeline hayvan bakımı için teşekkür ederiz. Bu araştırma kısmen Ulusal Sağlık Enstitüsü tarafından U54GM104940 (JPK) ve KL2TR003097 (LAG) hibeleri tarafından desteklendi. Hayvanları içeren tüm deneyler ve prosedürler Pennington Biyomedikal Araştırma Merkezi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-(N-Morpholino)ethanesulfonic acid hydrate | Sigma-Aldrich | M8250 | |
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Adenosine 5'-triphosphate disodium salt hydrate | Sigma-Aldrich | A2383 | |
| Amphotericin B | Gibco | 15290018 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Ascorbate | Sigma-Aldrich | A4544 | |
| Bovine serum albumin, fraction V, heat shock, fatty acid free | Sigma-Aldrich | 3117057001 | Roche |
| BD 50 mL Luer-Lok Syringe | Fisher Scientific | 13-689-8 | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Calcium carbonate | Sigma-Aldrich | C4830 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | |
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| Datlab 7.4 software | Oroboros Instruments | ||
| Dimethylsulfoxide | Amresco | N182 | |
| Dithiothreitol | Sigma-Aldrich | D0632 | |
| D-Sucrose | Sigma-Aldrich | S7903 | |
| Dumont # 5 Forceps | Fine Science Tools | 11251-30 | Dumoxel, autoclavable |
| Dumont # 7 Forceps | Fine Science Tools | 11271-30 | Dumoxel, autoclavable |
| Digital Calipers 150 mm/6 in | World Precision Instruments | 501601 | |
| EO771 cells | CH3 BioSystems | SKU: 94APV1-vial-prem | Pathogen Tested |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Female C57BL/6J mice | Jackson Laboratory | Stock #000664 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Imidazole | Sigma-Aldrich | 56750 | |
| Kimwipes | Fisher Scientific | 34120 | |
| L-(−)-Malic acid | Sigma-Aldrich | G1626 | |
| Lactobionic acid | Sigma-Aldrich | L2398 | |
| Malate | Sigma-Aldrich | M6413 | |
| Matrigel Matrix | Corning | 354248 | |
| MgCl·6H2O | Sigma-Aldrich | M2670 | |
| Microsyringes | Hamilton | 87919, 80383, 80521, 80665, 80765, 80865, 87943 | |
| N,N,N′,N′-Tetramethyl-p-phenylenediamine | Sigma-Aldrich | T7394 | |
| Oxygraph-2k | Oroboros Instruments | 10023-03 | |
| Oxygraph-2k FluoRespirometer | Oroboros Instruments | 10003-01 | |
| PBS | Gibco | 10010023 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium hydroxide | Sigma-Aldrich | P1767 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| RPMI 1640 | Gibco | 21875034 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium pyruvate | Sigma-Aldrich | P5280 | |
| Succinate (disodium) | Sigma-Aldrich | W327700 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Whatman Filter Paper, grade 5 | Sigma-Aldrich | 1005-090 | |
| Wheaton Tenbroeck Tissue Grinder, 7 mL | Duran Wheaton Kimble | 357424 | |
| Straight Tip Micro Dissecting Scissors | Roboz | RS-5914SC | |
| Non-Safety Scalpel No. 11 | McKesson | 1029065 | |
| BD Precision Glide Needle 27 G x 1/2 | Becton, Dickinson and Company | 305109 | |
| BD Precision Glide Needle 18 G x 1 | Becton, Dickinson and Company | 305195 | |
| BD 1mL Slip Tip Syringe | Becton, Dickinson and Company | 309659 | |
| Pyrex Reusable Petri Dish, 60 mm | Thermo Fisher Scientific | 316060 | |
| Rodent Very High Fat Diet, 60% kcal from fat, 20% kcal from protein, and 20% kcal from carbohydrate | Research Diet | D12492 | |
| Pyrex Watch Glass, 100 mm | Thermo Fisher Scientific | S34819 |
Referanslar
- DeBerardinis, R. J., Chandel, N. S. Fundamentals of cancer metabolism. Science Advances. 2 (5), 1600200 (2016).
- Bajzikova, M., et al. Reactivation of dihydroorotate dehydrogenase-driven pyrimidine biosynthesis restores tumor growth of respiration-deficient cancer cells. Cell Metabolism. 29 (2), 399-416 (2019).
- Martínez-Reyes, I., et al. Mitochondrial ubiquinol oxidation is necessary for tumour growth. Nature. 585 (7824), 288-292 (2020).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6 (3), 18317 (2011).
- Saks, V. A., et al., Saks, V. A., et al. . Bioenergetics of the Cell: Quantitative Aspects. , 81-100 (1998).
- Kaambre, T., et al. Metabolic control analysis of cellular respiration in situ in intraoperational samples of human breast cancer. Journal of Bioenergetics and Biomembranes. 44 (5), 539-558 (2012).
- Koit, A., et al. Mitochondrial respiration in human colorectal and breast cancer clinical material is regulated differently. Oxidative Medicine and Cellular Longevity. 2017, 1372640 (2017).
- Holland, O. J., et al. Changes in mitochondrial respiration in the human placenta over gestation. Placenta. 57, 102-112 (2017).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Kondrashova, M. N., et al. Preservation of native properties of mitochondria in rat liver homogenate. Mitochondrion. 1 (3), 249-267 (2001).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. American Journal of Physiology-Cell Physiology. 292 (1), 125-136 (2007).
- Hlozková, K., Starková, J. Assessment of the metabolic profile of primary leukemia cells. Journal of Visualized Experiments: JoVE. (141), e58426 (2018).
- Zhang, J., Zhang, Q., Haznadar, M. . Cancer Metabolism: Methods and Protocols. , 353-363 (2019).
- Wigner, P., Zielinski, K., Labieniec-Watala, M., Marczak, A., Szwed, M. Doxorubicin-transferrin conjugate alters mitochondrial homeostasis and energy metabolism in human breast cancer cells. Scientific Reports. 11 (1), 4544 (2021).
- Schöpf, B., et al. Oxidative phosphorylation and mitochondrial function differ between human prostate tissue and cultured cells. The FEBS Journal. 283 (11), 2181-2196 (2016).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Le Naour, A., et al. EO771, the first luminal B mammary cancer cell line from C57BL/6 mice. Cancer Cell International. 20, 328 (2020).
- Gnaiger, E., et al. Mitochondrial physiology. Bioenergetics Communications. 1, 44 (2020).
- Hughey, C. C., Hittel, D. S., Johnsen, V. L., Shearer, J. Respirometric oxidative phosphorylation assessment in saponin-permeabilized cardiac fibers. Journal of Visualized Experiments: JoVE. (48), e2431 (2011).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radical Biology and Medicine. 51 (9), 1621-1635 (2011).
- Munday, R. Generation of superoxide radical, hydrogen peroxide and hydroxyl radical during the autoxidation of N,N,N',N'-tetramethyl-p-phenylenediamine. Chemico-Biological Interactions. 65 (2), 133-143 (1988).
- Moser, M. D., Matsuzaki, S., Humphries, K. M. Inhibition of succinate-linked respiration and complex II activity by hydrogen peroxide. Archives of Biochemistry and Biophysics. 488 (1), 69-75 (2009).
- Veksler, V. I., Kuznetsov, A. V., Sharov, V. G., Kapelko, V. I., Saks, V. A. Mitochondrial respiratory parameters in cardiac tissue: a novel method of assessment by using saponin-skinned fibers. Biochimica et Biophysica Acta. 892 (2), 191-196 (1987).
- Gnaiger, E., Heldmaier, G., Klingenspor, M., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Doerrier, C., et al. High-resolution fluorespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Rohlenova, K., et al. Selective disruption of respiratory supercomplexes as a new strategy to suppress Her2(high) breast cancer. Antioxidants & Redox Signaling. 26 (2), 84-103 (2017).
- Gnaiger, E. Mitochondrial pathways and respiratory control. Bioenergetics Communications. 5th ed. , (2020).
- Barksdale, K. A., et al. Mitochondrial viability in mouse and human postmortem brain. FASEB Journal. 24 (9), 3590-3599 (2010).
- Underwood, E., Redell, J. B., Zhao, J., Moore, A. N., Dash, P. K. A method for assessing tissue respiration in anatomically defined brain regions. Scientific Reportys. 10 (1), 13179 (2020).
- Jorgensen, L. B., Overgaard, J., Hunter-Manseau, F., Pichaud, N. Dramatic changes in mitochondrial substrate use at critically high temperatures: a comparative study using Drosophila. Journal of Experimental Biology. 224, (2021).
- Salin, K., et al. Simultaneous measurement of mitochondrial respiration and ATP production in tissue homogenates and calculation of effective P/O ratios. Physiological Reports. 4 (20), 13007 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır