需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种微创、快速脊髓侧向半切技术,用于模拟大鼠开放性脊髓损伤
摘要
在这里,我们描述了一种新的、快速的技术,模拟大鼠的开放性脊髓损伤,消除了椎板切除术。侧向半切片是在通过显微镜观察时进行的。该技术用途广泛,也可用于其他动物脊髓的颈椎、胸椎和腰椎区域。
摘要
开放性脊髓损伤技术模拟撕裂样损伤是耗时且侵入性的,因为它们涉及椎板切除术。这项新技术通过去除两个棘突并抬起,然后倾斜尾椎弓来消除椎板切除术。手术区域无需椎板切除术即可打开。然后在显微镜下直接可见光控制下进行横向半切片。创伤被最小化,只需要一个小的骨头伤口。
这种技术有几个优点:它更快,因此对动物的负担更小,骨伤更小。由于椎板切除术被消除,因此对脊髓造成意外伤害的可能性较小,并且没有可能导致问题的骨碎片(嵌入脊髓中的骨碎片会导致肿胀和继发性损伤)。椎管保持完整。主要限制是半切片只能在椎间隙进行。
结果表明,这种技术可以比使用椎板切除术的传统手术方法快得多(11 分钟对 35 分钟)。该技术对于使用开放性脊髓损伤动物模型的研究人员很有用,因为它具有广泛的适应性,不需要任何额外的专用仪器。
引言
不幸的是,脊髓损伤 (SCI) 是人类普遍存在的损伤。脊髓损伤可能以不同的方式复杂化,例如感染,研究这些损伤在临床上很重要1.由于 SCI 没有单一的、明确的治疗方法,因此仍然需要动物模型来进一步了解研究人员并推进可能的治疗方法 2,3。虽然闭合性损伤最常建模(压迫和挫伤),但了解撕裂伤在临床上很重要,这只能在开放性损伤中建模4.由于损伤的性质(挫伤与手术切口),与闭合损伤模型相比,使用横断面或半切面的开放性伤口模型可用于证明伤口的更精确定位。开放性伤口实验可以以可控、可靠和可复制的方式揭示更具体的神经元损伤5。脊髓的完全或部分横断是一种广泛使用的开放性伤口技术,可以在 Brown 和 Martinez6 的文章中详细查看。
在研究大鼠开放性脊髓损伤时,几种动物提出了手术引起的问题:椎板切除术的骨碎片嵌入脊髓并引起肿胀;较大的骨伤口需要很长时间才能愈合;手术时间太长了。开发了一种替代手术技术来消除这些问题。目标是开发一种对动物更温和的更快技术。这种新开发的技术比传统的SCI技术快得多。手术方法是微创的,可减少骨伤口,同时消除椎板切除术引起的问题。
所有开放性伤口技术都涉及打开硬脑膜7。最近的几项研究检查了不同的、新开发的技术,旨在改进以前的方法 8,9。尽管使用这种新技术不能排除硬脑膜的开口,但它会在硬脑膜上造成更小的伤口,同时提供可靠、可控的脊髓损伤。在查阅有关脊髓损伤技术的文献时,许多作者试图通过对原始技术进行微小的更改来最大限度地减少手术时间10.椎板切除术始终是这些外科手术的一部分,尽管它很耗时并且需要更大的骨伤口才能制作6.这种手术技术适用于使用开放性伤口脊髓损伤模型的研究人员,特别是在椎间隙进行的完全横断或侧向半切(图1)。
研究方案
所有动物程序均根据欧盟指令(2010/63/EU)进行,并得到匈牙利国家食品链安全办公室动物伦理委员会(PEI/001/2894-11/2014)的批准。在这项研究中,遵守了所有适用的有关动物道德使用的机构和政府法规。
1.手术前的准备
- 对手术过程中使用的所有器械进行消毒(参见 材料表),并在手术前对要进行工作的表面进行消毒。
- 预防性注射单剂皮下注射抗生素。
注:抗生素剂量详见材料表。 - 将动物留在手术室1小时以适应它们并在手术前减轻其压力。
- 通过肌肉注射氯胺酮和甲苯噻嗪(氯胺酮80mg / kg体重(bw)和甲苯噻嗪8mg / kg bw)的组合麻醉大鼠。
注意:除麻醉外,k 乙胺-甲苯噻嗪组合为该手术提供了足够的镇痛作用。镇痛方案可以根据机构动物使用指南进行修改。 - 在手术过程中使用加热的桌子或红外线灯保持大鼠温暖,并使用眼科软膏在整个麻醉过程中保持眼睛湿润(必要时重新涂抹)。
- 用手术胶带将动物固定在手术台上,在动物的前后爪子和尾巴上,根据受伤部位,也固定在颈部。如有必要,将大鼠置于立体定位框架中以在手术过程中稳定它。
- 使用无菌手术缝合线,在大鼠的上前牙周围放置一个环,并将其固定在手术台的边缘。
- 将舌头向侧面拉出以进行气道管理。
- 剃掉背部的毛发,在切口的每个方向至少 2 厘米。
- 使用聚维酮碘溶液和无菌纱布对手术区域的皮肤进行至少三次消毒。特别注意浸泡该区域周围的毛皮。用无菌窗帘固定手术部位。
- 在放置第一个切口之前,通过捏住动物的脚趾和尾巴来评估麻醉的充分性。在整个手术过程中继续监测麻醉的充分性。
2. 手术
- 使用手术刀刀片20放置皮肤切口。要打开手术区域,请沿着脊柱放置一个 2-2.5 厘米长的切口,切开所有皮肤层。使用 L1 椎骨作为中点,将该切口平行于脊柱放置,使其沿脊柱在颅骨和尾部方向延伸 ~1 cm。
- 通过切开肌肉周围的结缔组织来活动伤口的两侧。
- 沿着脊柱放置两个平行的切口,穿透骨膜。将切口放在两侧脊柱突旁边,跨越 Th13 和 L1 椎骨之间的距离。
- 在raspatorium的帮助下解剖附着在椎骨上的肌肉,直到所有脊柱韧带都可见。放置一个牵开器。
- 使用牙科骨钳切除第 13 胸椎和第 1 腰椎的脊柱突,以可视化整个手术区域。在此,通过观察放大(4x-16x放大倍率)显微图像来控制程序。
- 必要时,在整个手术过程中使用无菌纱布控制出血。
- 小心地抬起 L1 脊柱突的其余部分,抬高 L1 椎弓。切断黄韧带以进入脊髓。进一步抬高尾部脊柱突,允许进入脊髓硬脑膜,脊髓硬脑膜也被切断。将尾椎突向颅骨方向倾斜,以观察软脑膜。
- 透过软脑膜寻找后正中静脉,显示脊柱的中线。
- 使用静脉作为定向平分线,使用显微外科手术刀放置一个切口,同时保留静脉。将切口放在静脉下方,在穿过脊髓前后径的横向平面上。通过将刀片横向移离中心线来切断一半的脊髓。
注意:切口是单侧的,在右侧,在第 4个 腰节。 - 尽量放置切口以避免割伤脊髓前动脉。切割脊髓时,确保不要对椎体施加过大的压力,以保留脊髓腹侧的脊髓前动脉。
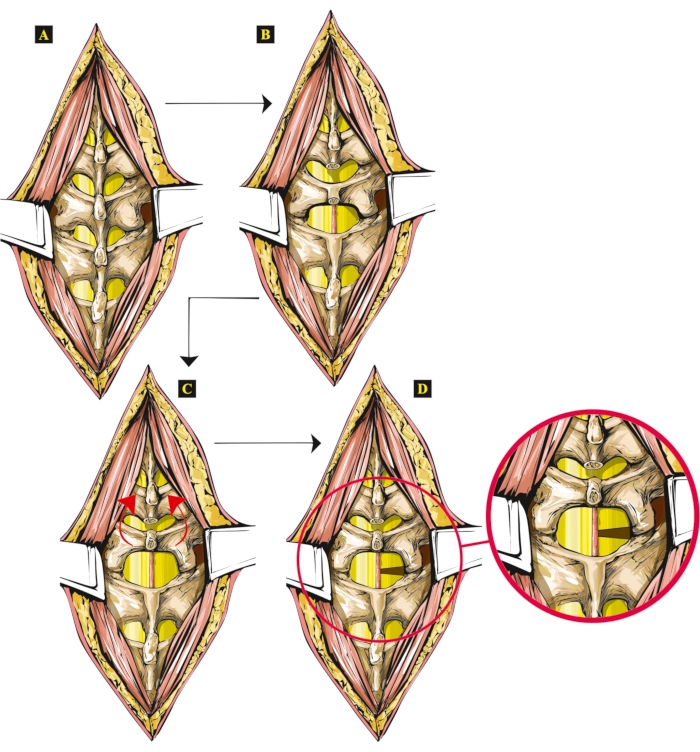
图 1:显示新的开放 SCI 技术在大鼠中的步骤的图稿。 (A) 裸露的椎骨。(B) 切除脊髓突(Th13 和 L1)。(C) L1椎骨的抬起和倾斜的椎弓。(D) 在右侧进行半切除术,将半切除的脊髓单独显示,放大。请点击这里查看此图的较大版本.
- 在伤口闭合期间不要直接闭合硬脑膜。沿着脊柱突紧密缝合(缝合线大小 4-0)肌肉,间接闭合硬脑膜上的小伤口。
- 用缝合线缝合背侧结缔组织层。
- 最后,将切口周围的皮肤缝合在一起。
3. 术后护理和随访
- 让动物在笼子里醒来。除了温控室外,还使用加热灯保持动物温暖。手术后醒来后不要让大鼠独自一人,也不要将它们与其他大鼠放在同一个笼子里。
- 至少每 10 分钟监测一次呼吸频率,直到他们完全清醒。如有必要,应用轻柔的刺激(例如,揉头)以帮助他们从麻醉中醒来。
- 当动物警觉并适当活动时,将它们安全运回动物屋。
- 在手术后的前24小时内密切监视大鼠。在手术后的第一个24小时后,每天至少检查动物两次,直到实验结束,监测痛苦的迹象。
- 使用相关的机构动物福利协议每天彻底评估它们是否有痛苦迹象,并特别注意检查它们的伤口是否有感染和炎症迹象。
注意:压力和感染会影响动物的福利和实验结果。 - 每天皮下注射抗生素,直到实验结束。将动物放在无菌笼子里,每个笼子一只动物,并像以前一样 随意给予食物和水。在实验结束时(或如果在实验时间范围内观察到任何严重的不良反应),根据相关的机构动物福利协议,人道地对动物实施安乐死。
注:在这里,动物被安乐死(在氯胺酮 - 甲苯噻嗪组合诱导的深度睡眠中),首先施用生理盐水灌注(1/3 mL / g bw),然后施用4%多聚甲醛灌注(1 mL / g bw)。
结果
半切开后,大鼠表现出同侧后肢麻痹(成功半切除的体内 证据)。只有在切除脊髓后才能进行彻底的标本评估(见 图 2,其中从腹侧和背侧都可以看到切除的脊髓)。
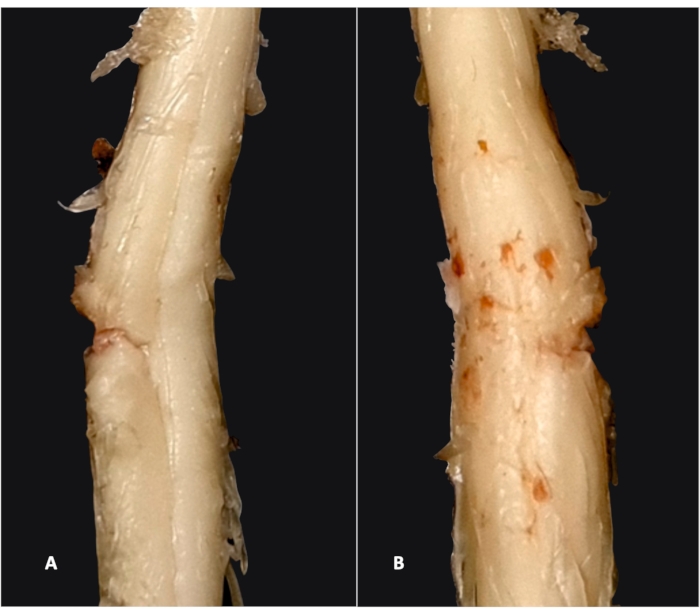
图 2:半切除术后切除脊髓的腹侧和背侧视图。 从腹侧 ?...
讨论
这种微创脊髓损伤技术是在研究脊髓损伤大鼠时开发的,该团队面临着手术本身引起的问题(椎板切除术的骨碎片导致压迫和损伤脊髓,手术时间过长,大骨伤口愈合缓慢)。通过消除椎板切除术,手术变得更快(11 分钟对 35 分钟),椎管结构保持完整,骨伤口小得多,并且没有可能损坏脊髓的骨碎片。
棘突的切除不能消除,因为上(颅)棘突的切除对于向下(尾部)棘?...
披露声明
作者声明,他们没有已知的相互竞争的经济利益或个人关系,这些利益或关系可能会影响本文所报告的工作。
致谢
作者要感谢 Gergely Ángyán 的原创艺术作品。这项研究工作由匈牙利布达佩斯的塞梅尔维斯大学资助。这项研究还得到了匈牙利人力资源开发运营计划(EFOP-3.6.2-16-2017-00006)的支持。在塞梅尔维斯大学治疗主题计划的框架内,匈牙利创新和技术部的主题卓越计划(2020-4.1.1.-TKP2020)提供了额外的支持。
材料
| Name | Company | Catalog Number | Comments |
| Augmentin (1,000 mg/200 mg powder) | GlaxoSmithKline, UK | One-time dose of s.c. antibiotics prophylactically (10 mg of amoxicillin and 2 mg clavulanic acid; Augmentin 1,000 mg/200 mg powder). Every day following surgery, 10 mg of amoxicillin and 2 mg of clavulanic acid (Augmentin 1,000 mg/200 mg powder) per day per animal | |
| Betadine | EGIS, Hungary | Disinfect the skin of the surgical area using a povidone-iodine solution | |
| Calypsol (50 mg/mL) | Richter Gedeon, Hungary | Anesthesia: combination of ketamine 80 mg/kg and xylazine 8 mg/kg intramuscularly | |
| CP XYLAZIN 2% (20 mg/mL) | Produlab Pharma B.V., the Netherlands | Anesthesia: combination of ketamine 80 mg/kg and xylazine 8 mg/kg intramuscularly | |
| Dental bone forceps | Dentech, Hungary | BS 0127 | Remove the spinous processes of the 13th thoracic vertebra and the 1st lumbar vertebra using dental bone forceps |
| dental surgical micromotor | W&H, Austria | MF-TECTORQUE | Using a dental surgical micromotor, a laminectomy is performed at the L1 vertebra |
| optical microscope | Zeiss, Germany | OPMI19-FC | Control the procedure by viewing an enlarged (16x magnification) microscopic image |
| physiological saline solution (0.9% NaCl) | Fresenius Kabi, Germany | Keep the rat's eyes moist throughout the entire anesthesia using physiological saline solution drops (reapply as necessary) | |
| raspatorium | Dentech, Hungary | FK 1164 | Dissect the muscles attached to the vertebrae with the aid of a raspatorium, until all the spinal ligaments are visible. |
| retractor | Dentech, Hungary | RT 1253 | |
| scalpel | Dentech, Hungary | BB 173 | |
| scalpel | Dentech, Hungary | BB 184 | |
| scalpel blade 12 | B. Braun, Germany | 12 | |
| scalpel blade 20 | B. Braun, Germany | 20 | |
| sterile cut gauze 10 x 10 cm | Sterilux, Hartmann, Germany | ||
| sutures (monofilament, synthetic; absorbable and nonabsorbable), size: 4-0 | B. Braun, Germany | ||
| tweezer (13 cm) | Dentech, Hungary | BD 1555 | |
| tweezer (delicate tissue forceps) | Dentech, Hungary | BD 1670 |
参考文献
- Failli, V., et al. Functional neurological recovery after spinal cord injury is impaired in patients with infections. Brain. 135, 3238-3250 (2012).
- Guan, B., Chen, R., Zhong, M., Liu, N., Chen, Q. Protective effect of Oxymatrine against acute spinal cord injury in rats via modulating oxidative stress, inflammation and apoptosis. Metabolic Brain Disease. 35 (1), 149-157 (2020).
- Kjell, J., Olson, L. Rat models of spinal cord injury: from pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Minakov, A. N., Chernov, A. S., Asutin, D. S., Konovalov, N. A., Telegin, G. B. Experimental models of spinal cord injury in laboratory rats. Acta Naturae. 10 (3), 4-10 (2018).
- Borbély, Z., et al. Effect of rat spinal cord injury (hemisection) on the ex vivo uptake and release of [3H]noradrenaline from a slice preparation. Brain Research Bulletin. 131, 150-155 (2017).
- Brown, A. R., Martinez, M. Thoracic spinal cord hemisection surgery and open-field locomotor assessment in the rat. Journal of Visualized Experiments: JoVE. (148), e59738 (2019).
- Taoka, Y., Okajima, K. Spinal cord injury in the rat. Progress in Neurobiology. 56 (3), 341-358 (1998).
- Hou, S., Saltos, T. M., Iredia, I. W., Tom, V. J. Surgical techniques influence local environment of injured spinal cord and cause various grafted cell survival and integration. Journal of Neuroscience Methods. 293, 144-150 (2018).
- Mattucci, S., et al. Development of a traumatic cervical dislocation spinal cord injury model with residual compression in the rat. Journal of Neuroscience Methods. 322, 58-70 (2019).
- Ahmed, R. U., Alam, M., Zheng, Y. P. Experimental spinal cord injury and behavioral tests in laboratory rats. Heliyon. 5 (3), 01324 (2019).
- Ashammakhi, N., et al. Regenerative therapies for spinal cord injury. Tissue Engineering. Part B, Reviews. 25 (6), 471-491 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。