È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una tecnica di emisezione laterale del midollo spinale minimamente invasiva e veloce per modellare le lesioni aperte del midollo spinale nei ratti
In questo articolo
Riepilogo
Qui, descriviamo una nuova tecnica veloce che modella la lesione del midollo spinale aperto nei ratti che elimina la laminectomia. L'emisezione laterale viene eseguita durante la visualizzazione attraverso un microscopio. La tecnica è versatile e può essere utilizzata anche nelle regioni cervicale, toracica e lombare del midollo spinale di altri animali.
Abstract
Le tecniche di lesione del midollo spinale a cielo aperto che modellano lesioni simili alla lacerazione sono dispendiose in termini di tempo e invasive perché comportano la laminectomia. Questa nuova tecnica elimina la laminectomia rimuovendo due processi spinosi e sollevando, quindi inclinando, l'arco vertebrale caudale. L'area chirurgica si apre senza la necessità di laminectomia. L'emisezione laterale viene quindi eseguita con controllo visibile diretto al microscopio. Il trauma è ridotto al minimo, richiedendo solo una piccola ferita ossea.
Questa tecnica ha diversi vantaggi: è più veloce e, quindi, meno onerosa per l'animale, e la ferita ossea è più piccola. Poiché la laminectomia viene eliminata, ci sono meno possibilità di lesioni indesiderate al midollo spinale e non ci sono schegge ossee che possono causare problemi (le schegge ossee incorporate nel midollo spinale possono causare gonfiore e danni secondari). Il canale vertebrale rimane intatto. Il limite principale è che l'emisezione può essere eseguita solo negli spazi intervertebrali.
I risultati mostrano che questa tecnica può essere eseguita molto più velocemente rispetto all'approccio chirurgico tradizionale, utilizzando la laminectomia (11 min vs. 35 min). Questa tecnica può essere utile per i ricercatori che lavorano con modelli animali di lesione del midollo spinale aperto in quanto è ampiamente adattabile e non richiede alcuna strumentazione specializzata aggiuntiva.
Introduzione
Le lesioni del midollo spinale (SCI) sono purtroppo lesioni prevalenti nell'uomo. Le lesioni midollari possono essere complicate in diversi modi, ad esempio dalle infezioni, ed è clinicamente importante studiare queste lesioni1. Poiché non esiste un'unica cura definitiva per la lesione midollare, sono ancora necessari modelli animali per approfondire la comprensione dei ricercatori e far progredire i possibili trattamenti 2,3. Sebbene le lesioni chiuse siano più comunemente modellate (compressione e contusione), è clinicamente importante comprendere le lacerazioni, che possono essere modellate solo nelle lesioni aperte4. I modelli a ferita aperta che utilizzano la transezione o l'emisezione possono essere utilizzati per dimostrare una localizzazione più precisa di una ferita rispetto ai modelli di lesione chiusa, a causa della natura della lesione (contusione vs. taglio chirurgico). Gli esperimenti a ferita aperta possono far luce su lesioni neuronali più specifiche in modo controllato, affidabile e replicabile5. La transezione completa o parziale del midollo spinale è una tecnica a ferita aperta ampiamente utilizzata e può essere visualizzata in dettaglio nell'articolo di Brown e Martinez6.
Durante lo studio della lesione aperta del midollo spinale nei ratti, diversi animali hanno presentato problemi sorti dall'intervento chirurgico: schegge ossee della laminectomia si sono incorporate nel midollo spinale e hanno causato gonfiore; la ferita ossea più grande ha avuto bisogno di molto tempo per guarire; L'intervento è durato troppo a lungo. È stata sviluppata una tecnica chirurgica alternativa per eliminare questi problemi. L'obiettivo era quello di sviluppare una tecnica più veloce e più delicata per l'animale. Questa tecnica di nuova concezione è molto più veloce delle tradizionali tecniche di lesione midollare. L'approccio chirurgico è minimamente invasivo, con conseguente riduzione della ferita ossea ed eliminazione dei problemi derivanti dalla laminectomia.
Tutte le tecniche a ferita aperta prevedono l'apertura della dura7. Diversi studi recenti hanno esaminato diverse tecniche di nuova concezione, con l'obiettivo di migliorare i metodi precedenti 8,9. Anche se l'apertura della dura non può essere esclusa con questa nuova tecnica, provoca una ferita più piccola sulla dura offrendo al contempo una lesione affidabile e controllata del midollo spinale. Consultando la letteratura sulle tecniche di lesione del midollo spinale, molti autori hanno cercato di ridurre al minimo i tempi dell'intervento chirurgico implementando piccole modifiche alla tecnica originale10. La laminectomia fa sempre parte di queste procedure chirurgiche, anche se richiede molto tempo e richiede una ferita ossea più grandeda realizzare 6. Questa tecnica chirurgica può essere appropriata per i ricercatori che utilizzano modelli di lesione del midollo spinale a ferita aperta, in particolare la transezione completa o l'emisezione laterale eseguita negli spazi intervertebrali (Figura 1).
Protocollo
Tutte le procedure sugli animali sono state eseguite secondo la direttiva UE (2010/63/UE) e sono state approvate dal comitato etico per gli animali dell'Ufficio nazionale ungherese per la sicurezza della catena alimentare (PEI/001/2894-11/2014). Durante questo studio sono state seguite tutte le normative istituzionali e governative applicabili in materia di uso etico degli animali.
1. Preparazione prima dell'intervento chirurgico
- Sterilizzare tutti gli strumenti utilizzati durante la procedura (vedere la Tabella dei materiali) e disinfettare le superfici in cui deve essere eseguito il lavoro prima della procedura.
- Iniettare una singola dose di antibiotici sottocutanei a scopo profilattico.
NOTA: Vedere la tabella dei materiali per i dettagli sul dosaggio degli antibiotici. - Lasciare gli animali in sala operatoria per 1 ora per acclimatarli e ridurre lo stress prima dell'intervento.
- Anestetizzare il ratto tramite un'iniezione intramuscolare di una combinazione di ketamina e xilazina (ketamina 80 mg/kg di peso corporeo e xilazina 8 mg/kg di peso corporeo).
NOTA: Oltre all'anestesia, la combinazione ketamina-xilazina fornisce un'analgesia sufficiente per questa procedura. Il regime di analgesia può essere modificato in base alle linee guida istituzionali per l'uso degli animali. - Tenere il ratto al caldo durante la procedura utilizzando un tavolo riscaldato o una luce a infrarossi e mantenere gli occhi umidi durante l'anestesia utilizzando un unguento oftalmico (riapplicare se necessario).
- Fissare l'animale sul tavolo operatorio utilizzando del nastro chirurgico sulle zampe anteriori e posteriori e sulla coda e, a seconda del sito della lesione, anche sul collo. Se necessario, posizionare il ratto in una cornice stereotassica per stabilizzarlo durante l'intervento chirurgico.
- Utilizzando una sutura chirurgica sterile, posizionare un anello attorno ai denti anteriori superiori del ratto e fissarlo sul bordo del tavolo operatorio.
- Estrarre la lingua lateralmente per la gestione delle vie aeree.
- Radere il pelo sul dorso, almeno 2 cm in ogni direzione del punto in cui verrà praticata l'incisione.
- Disinfettare la pelle dell'area chirurgica almeno tre volte, utilizzando una soluzione di iodio povidone e una garza sterile. Prestare particolare attenzione a mettere in ammollo la pelliccia che circonda l'area. Fissare il sito chirurgico con un telo sterile.
- Valutare l'adeguatezza dell'anestesia prima di effettuare la prima incisione pizzicando le dita e la coda dell'animale. Continuare a monitorare l'adeguatezza dell'anestesia durante l'intera procedura.
2. Chirurgia
- Posizionare l'incisione cutanea utilizzando una lama di bisturi 20. Per aprire l'area chirurgica, praticare un'incisione lunga 2-2,5 cm lungo la colonna vertebrale, tagliando tutti gli strati della pelle. Posizionare questa incisione parallelamente alla colonna vertebrale utilizzando la vertebra L1 come punto medio, facendola estendere di ~1 cm sia in direzione cranica che caudale lungo la colonna vertebrale.
- Mobilizzare i lati della ferita tagliando il tessuto connettivo che circonda i muscoli.
- Posiziona due incisioni parallele lungo la colonna vertebrale, penetrando nel periostio. Posiziona le incisioni proprio accanto ai processi spinali su entrambi i lati, coprendo la distanza tra le vertebre Th13 e L1.
- Sezionare i muscoli attaccati alle vertebre con l'aiuto di un raspatorium fino a quando tutti i legamenti spinali sono visibili. Metti in posizione un divaricatore.
- Rimuovere i processi spinali della 13avertebra toracica e della1a vertebra lombare utilizzando una pinza ossea dentale per visualizzare l'intera area chirurgica. A questo punto, controlla la procedura visualizzando un'immagine microscopica ingrandita (ingrandimento 4x-16x).
- Utilizzare una garza sterile per controllare il sanguinamento durante la procedura, quando necessario.
- Sollevare con cautela il resto dei processi spinali L1, sollevando l'arco vertebrale L1. Recidere il legamento flavum per accedere al midollo spinale. Sollevare ulteriormente i processi spinali caudali, consentendo l'accesso alla dura madre spinale, anch'essa recisa. Inclinare i processi spinali caudali in direzione cranica per visualizzare la pia madre.
- Guarda attraverso la pia madre per la vena mediana posteriore, mostrando la linea mediana della colonna vertebrale.
- Usando la vena come bisettrice direzionale, posiziona un'incisione usando un bisturi microchirurgico risparmiando la vena. Posizionare l'incisione sotto la vena, nel piano trasversale attraverso il diametro anteroposteriore del midollo spinale. Recidere metà del midollo spinale spostando lateralmente la lama lontano dalla linea centrale.
NOTA: L'incisione è unilaterale, sul lato destro, in corrispondenza del 4° segmento lombare. - Prova a posizionare l'incisione per evitare di tagliare l'arteria spinale anteriore. Assicurarsi che non venga applicata una pressione eccessiva sul corpo vertebrale quando si taglia il midollo spinale per risparmiare l'arteria spinale anteriore sul lato ventrale del midollo spinale.
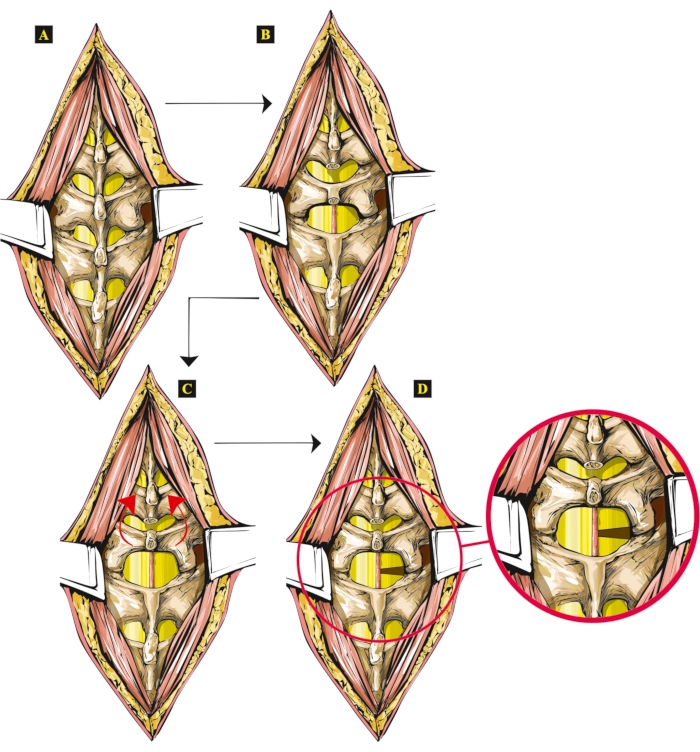
Figura 1: Illustrazione che mostra le fasi della nuova tecnica di lesione midollare aperta nei ratti. (A) Le vertebre esposte. (B) Processi spinali rimossi (Th13 e L1). (C) L'arco vertebrale sollevato e inclinato della vertebra L1. (D) Emisezione eseguita sul lato destro, con il midollo spinale emisettato mostrato separatamente, ingrandito. Fare clic qui per visualizzare una versione più grande di questa figura.
- Non chiudere la dura madre direttamente durante la chiusura della ferita. Suturare strettamente (misura di sutura 4-0) i muscoli lungo i processi spinali, chiudendo indirettamente la piccola ferita sulla dura madre.
- Chiudere lo strato di tessuto connettivo dorsale con punti di sutura.
- Infine, suturare la pelle intorno al sito di incisione.
3. Cure post-chirurgiche e follow-up
- Lascia che gli animali si risveglino nelle loro gabbie. Tenere al caldo l'animale (o gli animali) utilizzando una lampada riscaldante oltre alla stanza a temperatura controllata. Non lasciare i ratti da soli dopo che si sono svegliati dopo l'intervento chirurgico e non metterli insieme ad altri ratti nella stessa gabbia.
- Monitora la frequenza respiratoria almeno ogni 10 minuti fino a quando non è completamente sveglio. Se necessario, applicare una leggera stimolazione (ad esempio, strofinare la testa) per favorire il risveglio dall'anestesia.
- Quando gli animali sono vigili e adeguatamente attivi, trasportali in sicurezza nella cuccia degli animali.
- Tenere i ratti sotto stretta sorveglianza per le prime 24 ore dopo l'intervento. Dopo le prime 24 ore dopo l'intervento, controllare gli animali almeno due volte al giorno fino alla fine dell'esperimento, monitorando i segni di sofferenza.
- Valutateli accuratamente una volta al giorno per rilevare eventuali segni di sofferenza utilizzando il protocollo istituzionale per il benessere degli animali e prestate particolare attenzione a controllare le loro ferite per segni di infezione e infiammazione.
NOTA: Lo stress e l'infezione influiscono sul benessere degli animali e sull'esito degli esperimenti. - Somministrare antibiotici per via sottocutanea ogni giorno fino alla fine degli esperimenti. Tenere gli animali in gabbie sterili, un animale per gabbia, e dare cibo e acqua ad libitum, come prima. Al termine degli esperimenti (o se si osservano reazioni avverse gravi durante il periodo di tempo dell'esperimento), sopprimere gli animali in modo umano, in conformità con il protocollo istituzionale di riferimento per il benessere degli animali.
NOTA: In questo caso, gli animali sono stati sottoposti a eutanasia (in un sonno profondo indotto dalla combinazione di ketamina-xilazina) somministrando prima una perfusione fisiologica salina (1/3 mL/g di peso corporeo) seguita da una perfusione di paraformaldeide al 4% (1 mL/g di peso corporeo).
Risultati
Dopo l'emisezione, i ratti mostrano paralisi nell'arto posteriore omolaterale (prova in vivo del successo dell'emisezione). Una valutazione approfondita del campione può essere effettuata solo dopo la rimozione del midollo spinale (vedere la Figura 2, dove il midollo spinale rimosso può essere visto sia dal lato ventrale che da quello dorsale).
Discussione
Questa tecnica di lesione del midollo spinale minimamente invasiva è stata sviluppata studiando ratti con lesioni al midollo spinale e il team ha dovuto affrontare problemi derivanti dall'intervento chirurgico stesso (schegge ossee dalla laminectomia che causano compressione e danneggiano il midollo spinale, intervento chirurgico che richiede troppo tempo, guarigione lenta di una grande ferita ossea). Eliminando la laminectomia, la procedura è diventata molto più veloce (11 minuti contro 35 minuti), la struttura del c...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari o relazioni personali che potrebbero aver influenzato il lavoro riportato in questo articolo.
Riconoscimenti
Gli autori ringraziano Gergely Ángyán per l'artwork originale. Questo lavoro di ricerca è stato finanziato dall'Università Semmelweis di Budapest, Ungheria. Questo studio è stato sostenuto anche dal programma operativo ungherese per lo sviluppo delle risorse umane (EFOP-3.6.2-16-2017-00006). Un ulteriore sostegno è stato ricevuto dal programma di eccellenza tematica (2020-4.1.1.-TKP2020) del Ministero per l'innovazione e la tecnologia in Ungheria, nell'ambito del programma tematico Therapy dell'Università Semmelweis.
Materiali
| Name | Company | Catalog Number | Comments |
| Augmentin (1,000 mg/200 mg powder) | GlaxoSmithKline, UK | One-time dose of s.c. antibiotics prophylactically (10 mg of amoxicillin and 2 mg clavulanic acid; Augmentin 1,000 mg/200 mg powder). Every day following surgery, 10 mg of amoxicillin and 2 mg of clavulanic acid (Augmentin 1,000 mg/200 mg powder) per day per animal | |
| Betadine | EGIS, Hungary | Disinfect the skin of the surgical area using a povidone-iodine solution | |
| Calypsol (50 mg/mL) | Richter Gedeon, Hungary | Anesthesia: combination of ketamine 80 mg/kg and xylazine 8 mg/kg intramuscularly | |
| CP XYLAZIN 2% (20 mg/mL) | Produlab Pharma B.V., the Netherlands | Anesthesia: combination of ketamine 80 mg/kg and xylazine 8 mg/kg intramuscularly | |
| Dental bone forceps | Dentech, Hungary | BS 0127 | Remove the spinous processes of the 13th thoracic vertebra and the 1st lumbar vertebra using dental bone forceps |
| dental surgical micromotor | W&H, Austria | MF-TECTORQUE | Using a dental surgical micromotor, a laminectomy is performed at the L1 vertebra |
| optical microscope | Zeiss, Germany | OPMI19-FC | Control the procedure by viewing an enlarged (16x magnification) microscopic image |
| physiological saline solution (0.9% NaCl) | Fresenius Kabi, Germany | Keep the rat's eyes moist throughout the entire anesthesia using physiological saline solution drops (reapply as necessary) | |
| raspatorium | Dentech, Hungary | FK 1164 | Dissect the muscles attached to the vertebrae with the aid of a raspatorium, until all the spinal ligaments are visible. |
| retractor | Dentech, Hungary | RT 1253 | |
| scalpel | Dentech, Hungary | BB 173 | |
| scalpel | Dentech, Hungary | BB 184 | |
| scalpel blade 12 | B. Braun, Germany | 12 | |
| scalpel blade 20 | B. Braun, Germany | 20 | |
| sterile cut gauze 10 x 10 cm | Sterilux, Hartmann, Germany | ||
| sutures (monofilament, synthetic; absorbable and nonabsorbable), size: 4-0 | B. Braun, Germany | ||
| tweezer (13 cm) | Dentech, Hungary | BD 1555 | |
| tweezer (delicate tissue forceps) | Dentech, Hungary | BD 1670 |
Riferimenti
- Failli, V., et al. Functional neurological recovery after spinal cord injury is impaired in patients with infections. Brain. 135, 3238-3250 (2012).
- Guan, B., Chen, R., Zhong, M., Liu, N., Chen, Q. Protective effect of Oxymatrine against acute spinal cord injury in rats via modulating oxidative stress, inflammation and apoptosis. Metabolic Brain Disease. 35 (1), 149-157 (2020).
- Kjell, J., Olson, L. Rat models of spinal cord injury: from pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Minakov, A. N., Chernov, A. S., Asutin, D. S., Konovalov, N. A., Telegin, G. B. Experimental models of spinal cord injury in laboratory rats. Acta Naturae. 10 (3), 4-10 (2018).
- Borbély, Z., et al. Effect of rat spinal cord injury (hemisection) on the ex vivo uptake and release of [3H]noradrenaline from a slice preparation. Brain Research Bulletin. 131, 150-155 (2017).
- Brown, A. R., Martinez, M. Thoracic spinal cord hemisection surgery and open-field locomotor assessment in the rat. Journal of Visualized Experiments: JoVE. (148), e59738 (2019).
- Taoka, Y., Okajima, K. Spinal cord injury in the rat. Progress in Neurobiology. 56 (3), 341-358 (1998).
- Hou, S., Saltos, T. M., Iredia, I. W., Tom, V. J. Surgical techniques influence local environment of injured spinal cord and cause various grafted cell survival and integration. Journal of Neuroscience Methods. 293, 144-150 (2018).
- Mattucci, S., et al. Development of a traumatic cervical dislocation spinal cord injury model with residual compression in the rat. Journal of Neuroscience Methods. 322, 58-70 (2019).
- Ahmed, R. U., Alam, M., Zheng, Y. P. Experimental spinal cord injury and behavioral tests in laboratory rats. Heliyon. 5 (3), 01324 (2019).
- Ashammakhi, N., et al. Regenerative therapies for spinal cord injury. Tissue Engineering. Part B, Reviews. 25 (6), 471-491 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon