Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıçanlarda Açık Omurilik Yaralanmalarını Modellemek için Minimal İnvaziv, Hızlı Omurilik Lateral Hemikesim Tekniği
Bu Makalede
Özet
Burada, sıçanlarda laminektomiyi ortadan kaldıran açık omurilik yaralanmasını modelleyen yeni ve hızlı bir teknik tanımlanmıştır. Lateral hemiseksiyon mikroskopla görüntülenirken yapılır. Teknik çok yönlüdür ve diğer hayvanların omuriliğinin servikal, torasik ve bel bölgelerinde de kullanılabilir.
Özet
Açık omurilik yaralanması teknikleri, laserasyon benzeri yaralanmaları modellemek, laminektomi içerdikleri için zaman alıcı ve invazivdir. Bu yeni teknik, iki dikenli işlemi kaldırarak ve kaldırarak, ardından kaudal vertebral arkı eğerek laminektomiyi ortadan kaldırır. Laminektomiye gerek kalmadan ameliyat bölgesi açılır. Lateral hemiseksiyon daha sonra mikroskop altında doğrudan görünür kontrol ile gerçekleştirilir. Travma en aza indirilir ve sadece küçük bir kemik yarası gerektirir.
Bu tekniğin birçok avantajı vardır: daha hızlıdır ve bu nedenle hayvan için daha az yük oluşturur ve kemik yarası daha küçüktür. Laminektomi ortadan kaldırıldığı için, omurilikte istenmeyen yaralanma olasılığı daha azdır ve sorunlara neden olabilecek kemik kıymıkları yoktur (omuriliğe gömülü kemik kıymıkları şişmeye ve ikincil hasara neden olabilir). Vertebral kanal sağlam kalır. Ana sınırlama, hemiseksiyonun sadece intervertebral boşluklarda yapılabilmesidir.
Sonuçlar, bu tekniğin laminektomi kullanılarak geleneksel cerrahi yaklaşımdan çok daha hızlı uygulanabileceğini göstermektedir (11 dk'ya karşı 35 dk). Bu teknik, geniş çapta uyarlanabilir olduğu ve herhangi bir ek özel enstrümantasyon gerektirmediği için açık omurilik yaralanmasının hayvan modelleriyle çalışan araştırmacılar için yararlı olabilir.
Giriş
Omurilik yaralanmaları (SCI'ler) ne yazık ki insanlarda yaygın yaralanmalardır. SCI'ler, örneğin enfeksiyonlar nedeniyle farklı şekillerde komplike olabilir ve bu yaralanmaları incelemek klinik olarak önemlidir1. SCI'ler için tek ve kesin bir tedavi olmadığından, araştırmacıların anlayışını ilerletmek ve olası tedavileri ilerletmek için hayvan modellerine hala ihtiyaç vardır 2,3. Kapalı yaralanmalar en sık modellense de (kompresyon ve kontüzyon), sadece açık yaralanmalarda modellenebilen laserasyonları anlamak klinik olarak önemlidir4. Transeksiyon veya hemiseksiyon kullanan açık yara modelleri, yaralanmanın doğası gereği (kontüzyon ve cerrahi kesi) kapalı yaralanma modellerine kıyasla bir yaranın daha kesin bir lokalizasyonunu göstermek için kullanılabilir. Açık yara deneyleri, kontrollü, güvenilir ve tekrarlanabilir bir şekilde daha spesifik nöronal yaralanmalara ışık tutabilir5. Omuriliğin tam veya kısmi transeksiyonu yaygın olarak kullanılan bir açık yara tekniğidir ve Brown ve Martinez 6'nın makalesinde ayrıntılı olarak görülebilir.
Sıçanlarda açık omurilik yaralanmasını incelerken, birkaç hayvan ameliyattan kaynaklanan problemler ortaya çıktı: laminektomiden kaynaklanan kemik kıymıkları omuriliğe gömüldü ve şişmeye neden oldu; daha büyük kemik yarasının iyileşmesi için uzun bir zamana ihtiyacı vardı; Ameliyat çok uzun sürdü. Bu sorunları ortadan kaldırmak için alternatif bir cerrahi teknik geliştirilmiştir. Amaç, hayvan için daha nazik olan daha hızlı bir teknik geliştirmekti. Yeni geliştirilen bu teknik, geleneksel SCI tekniklerinden çok daha hızlıdır. Cerrahi yaklaşım minimal invazivdir, laminektomiden kaynaklanan sorunları ortadan kaldırırken daha küçük bir kemik yarası ile sonuçlanır.
Tüm açık yara teknikleri dura7'nin açılmasını içerir. Son zamanlarda yapılan birkaç çalışma, önceki yöntemleri iyileştirmeyi amaçlayan farklı, yeni geliştirilen teknikleri incelemiştir 8,9. Bu yeni teknikle duranın açılması göz ardı edilemese de, omurilikte güvenilir, kontrollü bir yaralanma sunarken dura üzerinde daha küçük bir yaraya neden olur. Omurilik yaralanması teknikleri ile ilgili literatüre başvuran birçok yazar, orijinal teknikte küçük değişiklikler yaparak ameliyat süresini en aza indirmeye çalışmıştır10. Laminektomi her zaman bu cerrahi prosedürlerin bir parçasıdır, ancak zaman alıcıdır ve daha büyük bir kemik yarası yapılmasını gerektirir6. Bu cerrahi teknik, açık yara omurilik yaralanması modellerini, özellikle intervertebral boşluklarda gerçekleştirilen tam transeksiyon veya lateral hemiseksiyonu kullanan araştırmacılar için uygun olabilir (Şekil 1).
Protokol
Tüm hayvan prosedürleri AB Direktifine (2010/63/EU) göre gerçekleştirilmiş ve Macaristan Ulusal Gıda Zinciri Güvenliği Ofisi (PEI/001/2894-11/2014) hayvan etik komitesi tarafından onaylanmıştır. Bu çalışma sırasında hayvanların etik kullanımı ile ilgili tüm geçerli kurumsal ve resmi düzenlemelere uyulmuştur.
1. Ameliyat öncesi hazırlık
- İşlem sırasında kullanılan tüm aletleri sterilize edin ( Malzeme Tablosuna bakın) ve işlemden önce işin yapılacağı yüzeyleri dezenfekte edin.
- Profilaktik olarak tek bir doz deri altı antibiyotik enjekte edin.
NOT: Antibiyotik dozaj ayrıntıları için Malzeme Tablosuna bakın. - Ameliyat öncesi hayvanları alıştırmak ve streslerini azaltmak için 1 saat ameliyathanede bırakın.
- Sıçanı, ketamin ve ksilazin (ketamin 80 mg / kg vücut ağırlığı (vücut ağırlığı) ve ksilazin 8 mg / kg vücut ağırlığı) kombinasyonunun kas içi enjeksiyonu ile uyuşturun.
NOT: Anesteziye ek olarak, ketamin-ksilazin kombinasyonu bu prosedür için yeterli analjezi sağlar. Analjezi rejimi, kurumsal hayvan kullanım kılavuzlarına göre değiştirilebilir. - Isıtılmış bir masa veya kızılötesi ışık kullanarak işlem sırasında fareyi sıcak tutun ve oftalmik merhem kullanarak anestezi boyunca gözleri nemli tutun (gerekirse tekrar uygulayın).
- Hayvanı ameliyat masasına ön ve arka pençelerinde ve kuyruğunda cerrahi bant kullanarak ve yaralanma bölgesine bağlı olarak boynuna da sabitleyin. Gerekirse, ameliyat sırasında stabilize etmek için fareyi stereotaksik bir çerçeveye yerleştirin.
- Steril cerrahi dikiş kullanarak, sıçanın üst ön dişlerinin etrafına bir halka yerleştirin ve bunu ameliyat masasının kenarına sabitleyin.
- Hava yolu yönetimi için dili yana doğru çekin.
- Sırttaki kürkü, kesiğin yapılacağı her yönde en az 2 cm olacak şekilde tıraş edin.
- Povidon-iyot çözeltisi ve steril gazlı bez kullanarak cerrahi alanın cildini en az üç kez dezenfekte edin. Alanı çevreleyen kürkü ıslatmaya özellikle dikkat edin. Ameliyat bölgesini steril bir örtü ile sabitleyin.
- Hayvanın ayak parmaklarını ve kuyruğunu sıkıştırarak ilk kesiyi yerleştirmeden önce anestezinin yeterliliğini değerlendirin. Tüm prosedür boyunca anestezinin yeterliliğini izlemeye devam edin.
2. Ameliyat
- Bir neşter bıçağı kullanarak cilt kesisini yerleştirin 20. Ameliyat alanını açmak için, omurga boyunca 2-2,5 cm uzunluğunda bir kesi yerleştirin ve cildin tüm katmanlarını kesin. L1 omurunu orta nokta olarak kullanarak bu kesiyi omurgaya paralel olarak konumlandırın ve omurga boyunca hem kraniyal hem de kaudal yönde ~1 cm uzamasını sağlayın.
- Kasları çevreleyen bağ dokusunu keserek yaranın kenarlarını harekete geçirin.
- Omurga boyunca periosteuma nüfuz edecek şekilde iki paralel kesi yerleştirin. Kesizyonları, Th13 ve L1 omurları arasındaki mesafeyi kapsayacak şekilde her iki taraftaki omurga işlemlerinin hemen yanına yerleştirin.
- Tüm omurilik bağları görünene kadar omurlara bağlı kasları bir raspatorium yardımıyla inceleyin. Bir ekartör yerleştirin.
- Tüm cerrahi alanı görselleştirmek için diş kemiği forseps kullanarak 13. torasik omurun ve 1. bel omurun omurga süreçlerini çıkarın. Burada, büyütülmüş (4x-16x büyütme) mikroskobik bir görüntüyü görüntüleyerek prosedürü kontrol edin.
- Gerektiğinde işlem boyunca kanamayı kontrol etmek için steril gazlı bez kullanın.
- L1 omurga işlemlerinin geri kalanını dikkatlice kaldırın ve L1 vertebral kemerini yükseltin. Omuriliğe erişmek için ligamentum flavum'u kesin. Kaudal omurga süreçlerini daha da yükseltin ve aynı zamanda kopmuş olan spinal dura mater'e erişim sağlayın. Pia mater'i görselleştirmek için kaudal spinal süreçleri kraniyal yönde eğin.
- Omurganın orta hattını sergileyen posterior medyan ven için pia mater'den bakın.
- Damarı yönlü bir açıortay olarak kullanarak, damarı korurken mikrocerrahi bir neşter kullanarak bir kesi yerleştirin. İnsizyonu damarın altına, omuriliğin anteroposterior çapı boyunca enine düzlemde yerleştirin. Bıçağı yanal olarak merkez çizgisinden uzaklaştırarak omuriliğin yarısını kesin.
NOT: Kesi tek taraflı, sağ tarafta, 4. bel segmentindedir. - Ön omurilik arterini kesmemek için kesiyi yerleştirmeye çalışın. Omuriliğin ventral tarafındaki anterior spinal arteri yedeklemek için omuriliği keserken omur gövdesine aşırı basınç uygulanmadığından emin olun.
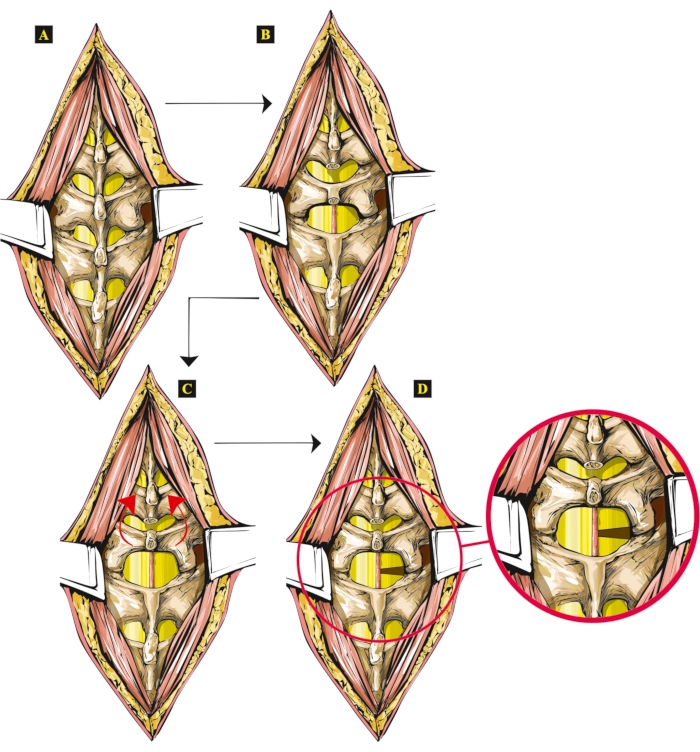
Şekil 1: Sıçanlarda yeni açık SCI tekniğinin adımlarını gösteren resim. (A) Açıkta kalan omurlar. (B) Spinal süreçler çıkarıldı (Th13 ve L1). (C) L1 omurun kaldırılmış ve eğik omur kemeri. (D) Hemiseke sağ tarafta, hemiseke edilmiş omurilik ayrı olarak gösterilmiş, yakınlaştırılmış. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Yara kapatma sırasında dura mater'i doğrudan kapatmayın. Sıkıca dikiş atın (sütür boyutu 4-0) omurga süreçleri boyunca kasları, dura mater üzerindeki küçük yarayı dolaylı olarak kapatır.
- Dorsal bağ dokusu tabakasını dikişlerle kapatın.
- Son olarak, kesi bölgesinin etrafındaki cildi dikin.
3. Ameliyat sonrası bakım ve takip
- Hayvanların kafeslerinde uyanmalarına izin verin. Sıcaklık kontrollü odaya ek olarak bir ısı lambası kullanarak hayvan(lar)ı sıcak tutun. Ameliyattan sonra uyandıktan sonra fareleri yalnız bırakmayın ve diğer farelerle aynı kafese koymayın.
- Tamamen uyanana kadar solunum hızlarını en az 10 dakikada bir izleyin. Gerekirse, anesteziden uyanmalarına yardımcı olmak için hafif stimülasyon uygulayın (örneğin, başını ovalayın).
- Hayvanlar uyanık ve uygun şekilde aktif olduklarında, onları güvenli bir şekilde hayvan barınağına geri taşıyın.
- Ameliyattan sonraki ilk 24 saat boyunca fareleri yakın gözetim altında tutun. Ameliyattan sonraki ilk 24 saatin ardından, deney sonuna kadar hayvanları günde en az iki kez kontrol edin ve sıkıntı belirtilerini izleyin.
- İlgili kurumsal hayvan refahı protokolünü kullanarak sıkıntı belirtileri açısından günde bir kez iyice değerlendirin ve yaralarını enfeksiyon ve iltihap belirtileri açısından kontrol etmek için özel dikkat gösterin.
NOT: Stres ve enfeksiyon, hayvanların refahını ve deneylerin sonucunu etkiler. - Deneylerin sonuna kadar her gün deri altından antibiyotik uygulayın. Hayvanları, kafes başına bir hayvan olacak şekilde steril kafeslerde tutun ve daha önce olduğu gibi yiyecek ve su ad libitum verin. Deneylerin sonunda (veya deneyin zaman dilimi boyunca herhangi bir ciddi advers reaksiyon gözlemlenirse), ilgili kurumsal hayvan refahı protokolüne uygun olarak hayvanlara insancıl bir şekilde ötenazi yapın.
NOT: Burada, hayvanlara önce fizyolojik bir salin perfüzyonu (1/3 mL / g vücut ağırlığı) ve ardından% 4 paraformaldehit perfüzyonu (1 mL / g canlı ağırlık) uygulanarak ötenazi yapıldı (ketamin-ksilazin kombinasyonunun neden olduğu derin bir uykuda).
Sonuçlar
Hemiseksiyonu takiben, sıçanlar ipsilateral arka bacakta felç gösterir (in vivo başarılı hemiseksiyonun kanıtı). Kapsamlı numune değerlendirmesi ancak omuriliğin çıkarılmasını takiben yapılabilir (çıkarılan omuriliğin hem ventral hem de dorsal taraftan görülebildiği Şekil 2'ye bakınız).
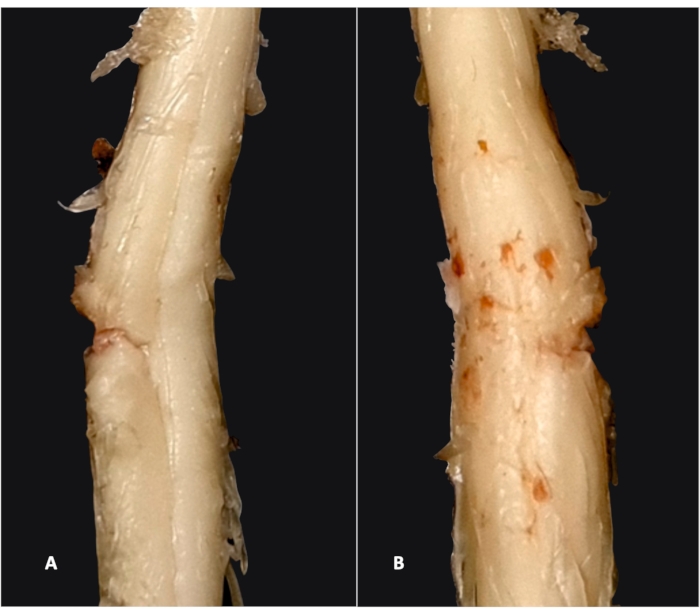
Şek...
Tartışmalar
Bu minimal invaziv omurilik yaralanması tekniği, omurilik yaralanmalı sıçanlar üzerinde çalışılırken geliştirildi ve ekip, ameliyatın kendisinden kaynaklanan problemlerle karşı karşıya kaldı (laminektomiden kaynaklanan kemik kıymıkları, sıkışmaya neden olan ve omuriliğe zarar veren kemik kıymıkları, ameliyatın çok uzun sürmesi, büyük bir kemik yarasının yavaş iyileşmesi). Laminektomiyi ortadan kaldırarak prosedür çok daha hızlı hale geldi (11 dakikaya karşı 35 dakika), vertebra...
Açıklamalar
Yazarlar, bu yazıda bildirilen çalışmayı etkilemiş gibi görünebilecek bilinen hiçbir rakip mali çıkarları veya kişisel ilişkileri olmadığını beyan ederler.
Teşekkürler
Yazarlar, orijinal sanat eseri için Gergely Ángyán'a teşekkür etmek istiyor. Bu araştırma çalışması, Budapeşte, Macaristan'daki Semmelweis Üniversitesi tarafından finanse edilmiştir. Bu çalışma Macaristan İnsan Kaynaklarının Geliştirilmesi Operasyonel Programı (EFOP-3.6.2-16-2017-00006) tarafından da desteklenmiştir. Macaristan'da İnovasyon ve Teknoloji Bakanlığı'nın Tematik Mükemmellik Programından (2020-4.1.1.-TKP2020) Semmelweis Üniversitesi'nin Terapi tematik programı çerçevesinde ek destek alınmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Augmentin (1,000 mg/200 mg powder) | GlaxoSmithKline, UK | One-time dose of s.c. antibiotics prophylactically (10 mg of amoxicillin and 2 mg clavulanic acid; Augmentin 1,000 mg/200 mg powder). Every day following surgery, 10 mg of amoxicillin and 2 mg of clavulanic acid (Augmentin 1,000 mg/200 mg powder) per day per animal | |
| Betadine | EGIS, Hungary | Disinfect the skin of the surgical area using a povidone-iodine solution | |
| Calypsol (50 mg/mL) | Richter Gedeon, Hungary | Anesthesia: combination of ketamine 80 mg/kg and xylazine 8 mg/kg intramuscularly | |
| CP XYLAZIN 2% (20 mg/mL) | Produlab Pharma B.V., the Netherlands | Anesthesia: combination of ketamine 80 mg/kg and xylazine 8 mg/kg intramuscularly | |
| Dental bone forceps | Dentech, Hungary | BS 0127 | Remove the spinous processes of the 13th thoracic vertebra and the 1st lumbar vertebra using dental bone forceps |
| dental surgical micromotor | W&H, Austria | MF-TECTORQUE | Using a dental surgical micromotor, a laminectomy is performed at the L1 vertebra |
| optical microscope | Zeiss, Germany | OPMI19-FC | Control the procedure by viewing an enlarged (16x magnification) microscopic image |
| physiological saline solution (0.9% NaCl) | Fresenius Kabi, Germany | Keep the rat's eyes moist throughout the entire anesthesia using physiological saline solution drops (reapply as necessary) | |
| raspatorium | Dentech, Hungary | FK 1164 | Dissect the muscles attached to the vertebrae with the aid of a raspatorium, until all the spinal ligaments are visible. |
| retractor | Dentech, Hungary | RT 1253 | |
| scalpel | Dentech, Hungary | BB 173 | |
| scalpel | Dentech, Hungary | BB 184 | |
| scalpel blade 12 | B. Braun, Germany | 12 | |
| scalpel blade 20 | B. Braun, Germany | 20 | |
| sterile cut gauze 10 x 10 cm | Sterilux, Hartmann, Germany | ||
| sutures (monofilament, synthetic; absorbable and nonabsorbable), size: 4-0 | B. Braun, Germany | ||
| tweezer (13 cm) | Dentech, Hungary | BD 1555 | |
| tweezer (delicate tissue forceps) | Dentech, Hungary | BD 1670 |
Referanslar
- Failli, V., et al. Functional neurological recovery after spinal cord injury is impaired in patients with infections. Brain. 135, 3238-3250 (2012).
- Guan, B., Chen, R., Zhong, M., Liu, N., Chen, Q. Protective effect of Oxymatrine against acute spinal cord injury in rats via modulating oxidative stress, inflammation and apoptosis. Metabolic Brain Disease. 35 (1), 149-157 (2020).
- Kjell, J., Olson, L. Rat models of spinal cord injury: from pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Minakov, A. N., Chernov, A. S., Asutin, D. S., Konovalov, N. A., Telegin, G. B. Experimental models of spinal cord injury in laboratory rats. Acta Naturae. 10 (3), 4-10 (2018).
- Borbély, Z., et al. Effect of rat spinal cord injury (hemisection) on the ex vivo uptake and release of [3H]noradrenaline from a slice preparation. Brain Research Bulletin. 131, 150-155 (2017).
- Brown, A. R., Martinez, M. Thoracic spinal cord hemisection surgery and open-field locomotor assessment in the rat. Journal of Visualized Experiments: JoVE. (148), e59738 (2019).
- Taoka, Y., Okajima, K. Spinal cord injury in the rat. Progress in Neurobiology. 56 (3), 341-358 (1998).
- Hou, S., Saltos, T. M., Iredia, I. W., Tom, V. J. Surgical techniques influence local environment of injured spinal cord and cause various grafted cell survival and integration. Journal of Neuroscience Methods. 293, 144-150 (2018).
- Mattucci, S., et al. Development of a traumatic cervical dislocation spinal cord injury model with residual compression in the rat. Journal of Neuroscience Methods. 322, 58-70 (2019).
- Ahmed, R. U., Alam, M., Zheng, Y. P. Experimental spinal cord injury and behavioral tests in laboratory rats. Heliyon. 5 (3), 01324 (2019).
- Ashammakhi, N., et al. Regenerative therapies for spinal cord injury. Tissue Engineering. Part B, Reviews. 25 (6), 471-491 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır