Method Article
基于泰勒鼠脑脊髓炎病毒的感染性病因癫痫模型
摘要
C57BL / 6小鼠中Theiler小鼠脑脊髓炎病毒(TMEV)的脑内感染复制了人类患者病毒性脑炎和随后癫痫的许多早期和慢性临床症状。本文描述了TMEV模型的病毒感染、症状和组织病理学。
摘要
癫痫的主要原因之一是中枢神经系统(CNS)感染;因此,在这种感染中幸存下来的患者中约有8%会发展为癫痫,在经济欠发达国家,这一比例要高得多。这项工作概述了感染性病因的癫痫建模,并将其用作新型抗癫痫化合物检测的平台。提出了在C57BL / 6小鼠中通过非立体定向脑内注射Theiler小鼠脑脊髓炎病毒(TMEV)诱导癫痫的方案,该方案复制了病毒性脑炎和随后癫痫的许多早期和慢性临床症状在人类患者中。描述了脑炎期间小鼠的临床评估,以监测癫痫发作活动并检测新型化合物的潜在抗癫痫作用。此外,还显示了病毒性脑炎和癫痫发作(如海马损伤和神经炎症)的组织病理学后果,以及自发性癫痫发作等长期后果。TMEV模型是首批转化的,感染驱动的实验平台之一,允许研究中枢神经系统感染引起的癫痫发展机制。因此,它还有助于为中枢神经系统感染后有患癫痫风险的患者确定潜在的治疗靶点和化合物。
引言
病毒性脑炎的常见后果之一是癫痫发作。许多病毒感染在感染的急性期引发症状性癫痫发作;在公众中,此类癫痫发作的风险增加了20%以上1,2,3。感染后存活的患者在感染后的数月至数年内发生慢性癫痫的风险也增加 4%-20%1,4。泰勒鼠脑脊髓炎病毒(TMEV)已被确定为研究病毒性脑炎小鼠模型中急性和慢性癫痫发作的合适病毒5,6,7。TMEV是小核糖核酸病毒科的一种无包膜,阳性,单链RNA病毒,传统上用于研究SJL小鼠脊髓中的脱髓鞘,C57BL / 6(B6)小鼠受到保护,因为它们具有感染后快速清除病毒的能力。然而,TMEV在感染后第一周(pi)内诱导50%-75%的雄性和雌性B6小鼠急性癫痫发作,而约25%-40%的小鼠在数周至数月pi2,5,6,8,9中发生慢性癫痫。除了癫痫发作外,小鼠还表现出癫痫海马体的常见组织病理学,伴有神经变性和神经胶质增生5,6,8,10,11,12。此外,TMEV感染的B6小鼠在学习和记忆行为测试中表现明显较差,并且具有认知合并症,这也见于癫痫13,14,15的临床患者。
传统上,癫痫和癫痫发作模型利用化学惊厥物质或电刺激来诱导癫痫发作;然而,这些模型缺乏构建有效性,并且通常显示比临床患者更严重的癫痫发作和脑损伤16。没有适合每个研究问题的模型17.如果研究中枢神经系统感染后癫痫发作发展的诱发因素,或者如果筛选化合物的抗惊厥效率,则使用TMEV模型特别有趣。
由于TMEV模型已经在国际上几个不同的实验室中建立和使用,作者已经确定了允许成功实施该模型的许多细节,例如,不同病毒和小鼠株的特异性。最可靠的癫痫发作诱导是用丹尼尔的TMEV和B6J小鼠2,5,6,8,9株产生的。该模型目前被国家神经疾病和中风研究所(NINDS)用作识别针对癫痫和癫痫发作的新药的平台18,19。本文包括病毒诱导和临床监测的详细方案,以允许其他研究人员利用这种病毒性脑炎模型来进一步了解疾病机制以及药物测试。
以下协议反映了为该模型中的化合物测试而设计的研究,尽管可以进行许多其他类型的研究。在右半球颞区(右眼后部和内侧)注射丹尼尔TMEV菌株之前,对小鼠进行短暂麻醉。根据研究问题,如果需要未感染的对照动物,小鼠接受无菌磷酸盐缓冲盐水(PBS,pH 7.4,包括KH 2 PO4 [1.06 mM],NaCl [155.17 mM]和Na 2 HPO4·7H 2 O[2.97mM])而不是TMEV。先前在TMEV感染小鼠中的经验表明,处理诱导的癫痫发作发生在感染后第3天和第7天之间。实验化合物的进样频率、途径和测试时间根据其性质而变化。建议在周五进行病毒接种,这样可以在下周(周一至周五)进行第3-7天的癫痫发作监测。在癫痫监测周期间,实验化合物可以每天两次(至少间隔4小时)给药(ip),除非化合物的动力学或作用机制另有建议。治疗期间的癫痫发作监测可以在先前确定的时间点进行。进样和观察时间因个别化合物而异。向动物注射测试化合物或代替药物化合物的载体。这两组可以像实验组类似地处理和观察。在实验过程中,处理小鼠并对癫痫发作进行评分的一个人应该对治疗不知情。
研究方案
所有上述程序均已获得有关当局的授权。动物按照"实验动物护理和使用指南"(国家研究委员会)中的建议进行维护,并符合公共卫生服务政策和犹他大学机构动物护理和使用委员会,动物协议(编号:21-11009,药理学和毒理学系)和柏林自由大学(协议:G0015/21, LAGeso Berlin,药理学和毒理学研究所),分别。图 3 和 图5 所示的结果在33.9-42502-04-11/0516和33.9-42502-04-15/1892下获得批准(LAVES Oldenburg,汉诺威兽医大学药理学,毒理学和药学系)。
1. 设计研究的考虑和准备
- 病毒
- 丹尼尔的TMEV菌株由犹他大学的Robert Fujinami慷慨提供。最初,它是从哈佛殖民地20的一只老鼠中分离出来的。在处理TMEV之前,请查阅各自国家生物制剂的具体分类和法规,并与机构生物安全人员讨论以确保符合法规。通常,TMEV被归类为BSL 2,具体取决于菌株和基因修饰。在大多数动物中诱导癫痫发作所需的标准剂量为3 x 105 斑块形成单位(PFU)。
注意:例如,如果使用转基因小鼠,则可能必须调整剂量。总体而言,滴度在 2 x 104 PFU 和 2.44 x 107 PFU 之间已被用于成功诱导癫痫发作。对照动物接受无菌PBS,不会出现癫痫发作。该病毒不会感染人类;但是,实验人员应始终佩戴PPE(实验室外套,手套,安全眼镜),并且在处置前应将小鼠尸体和床上用品高压灭菌。
- 丹尼尔的TMEV菌株由犹他大学的Robert Fujinami慷慨提供。最初,它是从哈佛殖民地20的一只老鼠中分离出来的。在处理TMEV之前,请查阅各自国家生物制剂的具体分类和法规,并与机构生物安全人员讨论以确保符合法规。通常,TMEV被归类为BSL 2,具体取决于菌株和基因修饰。在大多数动物中诱导癫痫发作所需的标准剂量为3 x 105 斑块形成单位(PFU)。
- 动物
- 为了诱导和研究癫痫发作,请使用B6J小鼠,因为其他小鼠品系不一定显示癫痫发作,例如SJL / J,FVB / N或Balb / c小鼠5。雌性和雄性小鼠在急性癫痫发作频率5上没有差异。对青少年到成年小鼠(从5-6周龄开始)进行实验。
- 节食
- 饮食已被确定为疾病严重程度实验室间变异性的一个来源;因此,将饮食视为变化22的潜在因素。
- 团体规模
- 由于在该模型中并非所有动物都会发生急性或慢性癫痫发作,因此使用约20只小鼠/组进行化合物测试。
- 动物福利
- 如果任何小鼠在当地IACUC指南确定的观察时间(例如48小时)后因感染或施用研究化合物而表现出显着的不良反应(例如嗜睡,梳理不良,过度发红和伤口脓性分泌物),则人道地对小鼠实施安乐死。
- 对任何在感染期间表现出极端体重减轻(>20%)的小鼠实施安乐死。
- 如果动物饮食不当,请让它们获得用儿科电解质溶液或类似溶液润湿的补充颗粒。
2. 病毒接种
- 注射器的灭菌
- 取下胰岛素注射器的盖子。在针头周围添加聚乙烯管作为套圈,以确保足够的注射深度为 2.5 mm。将注射器浸入乙醇中30分钟。将注射器置于紫外线下30分钟。
- 将盖子放回针头上。将注射器包裹在消毒袋中并用胶带将其封闭。标有准备日期。
- 病毒注射
- 从-80°C冰箱中获取丹尼尔TMEV菌株的等分试样。解冻病毒并将其保存在冰上。避免解冻和重新冷冻病毒。用病毒悬浮液加载注射器(3 x 105 PFU在20μLPBS或DMEM培养基中稀释)。
注意:该病毒对小鼠具有传染性,但对人类没有传染性。 - 用消毒剂清洁工作台,并在烟雾吸收器下工作。病毒接种不是无菌的,但尽可能干净。
- 将小鼠转移到麻醉诱导室中,并在氧气中使用2%异氟醚诱导麻醉。达到手术耐受性需要几分钟;根据动物的呼吸和麻醉深度调整浓度。
- 将麻醉小鼠从引擎盖下的麻醉盒中转移。检查手术耐受性,例如捏住脚趾。整个过程在不到30秒的时间内完成,因此动物在注射过程中不需要吸入异氟醚。添加眼膏以防止角膜干燥。
- 用酒精垫清洁动物的头部。将鼠标的头部稍微向左倾斜,使注射部位指向上方。
- 将皮肤向后拉一点,将针头插入头部,并在右半球颞区(右眼后部和内侧)皮质内注射20μL至2.5mm深度。
- 在所有动物的同一半球单方面进行注射。使用眼睛和耳朵作为顶叶皮层位置的标志。该位置先前已在组织学上得到验证;参见 图1。根据立体定向注射相对于前膛的注射坐标为 −2.0 (AP);+3.0 (毫升);−1.5 (DV)。
- 将注射器留在原位5-15秒。写下注射是否有任何泄漏或是否看到气泡 - 在这种情况下,准备一个新的注射器。小心地将注射器拉出时,稍微旋转。在麻醉下涂抹眼膏以防止干燥。
- 可选:根据当地程序在尾巴或耳朵上对动物进行编码(可选但容易,因为动物是无意识的)。
- 将动物转移到一个新的笼子中,在从麻醉中恢复期间,半开/半关放在加热垫(35-40°C)上。在动物恢复足够的意识以维持胸骨卧位之前,不要让它们无人看管。
注意:动物在康复后可以再次集体饲养(受感染的动物不与模拟感染的动物混合)。受感染的小鼠不应与未感染的小鼠关在同一个房间里。 - 跟踪前7天pi小鼠的体重,因为它们在感染后体重减轻,可能需要额外的喂养。
- 从-80°C冰箱中获取丹尼尔TMEV菌株的等分试样。解冻病毒并将其保存在冰上。避免解冻和重新冷冻病毒。用病毒悬浮液加载注射器(3 x 105 PFU在20μLPBS或DMEM培养基中稀释)。
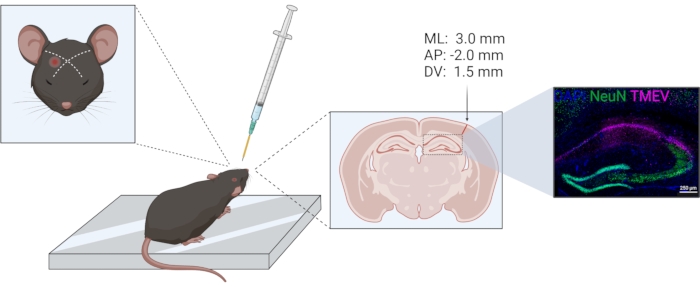
图1:TMEV注射过程示意图。 从左到右:对于右顶叶皮层注射,针头在眼睛和对侧耳朵之间的假想线的略微侧侧注射。用于深度控制的环以黄色表示。注射道可以在冠状脑部分看到,由箭头标记。注射部位对应于箭头上方给出的坐标。右图显示了泰勒病毒(紫色)在海马形成的CA1内的分布。该图是用 biorender.com 编制的。 请点击此处查看此图的大图。
3. 化合物测试
- 复配制剂
- 查看配方说明。根据建议或提供的说明准备车辆解决方案。例如,提出了抗癫痫药物左乙拉西坦(LEV)的程序。LEV在350mg / kg的剂量下将癫痫发作负担降低到车辆水平的30%-40%。本研究中使用的载体是0.5%甲基纤维素。
- 根据化合物计算剂量。根据计算称出药物。为了治疗1公斤小鼠,称出350毫克LEV。
- 按照配方说明(例如超声处理、载体赋形剂等)的指示,用适当体积的载体溶液制备储备溶液。考虑到小鼠的进样体积为0.01 mL/g,1 kg的进样体积为10 mL,含350 mg列夫,得到35 mg/mL19的溶液。报告计算和剂量(以毫克/千克为单位)以及体积(以毫升为单位)。
注意:可以在 补充材料 1 的第 2 页找到示例协议。
- 复方给药
- 将笼子随机分配到载体或复合组。使用模拟感染的小鼠研究癫痫发展的机制或用于验证目的,但不用于常规药物筛选。
- 报告环境条件,如温度、湿度、一天中的时间等。
- 用化合物和载体溶液涡旋溶液。在注射器中吸出载体或化合物,并对注射器进行颜色编码以防止混淆。
- 称量动物的体重。确保B6J小鼠在第3天pi(不四舍五入)为>18克。报告重量。
- 给药化合物(例如,通过腹膜内注射或其他适当的途径)。写下给药的时间和途径。
- 监测动物在化合物给药后的任何行为变化,特别是在第一次注射后。如果发生癫痫发作,根据拉辛量表23报告癫痫发作强度;请参阅步骤 3.2。
注意:化合物给药的示例方案可以在补充材料1第3页中找到,而给药期间观察到的癫痫发作将记录在补充材料1第4-5页。
- 处理性癫痫发作的癫痫发作监测
- 由对治疗不知情的实验者执行此过程。把所有的笼子都放在长凳上。在光照阶段每天观察动物癫痫发作2次。
- 通过修改的拉辛量表23对癫痫发作活动进行评分:0 =行为没有变化,1=嘴巴和面部运动,2=点头,3=单侧前肢阵挛,4 =双侧前肢阵挛与抚养,5 =全身强直阵挛活动伴姿势张力丧失,有时跳跃,6=长时间和过度跳跃和多动。报告癫痫发作的次数和强度。
- 将笔滑过笼子以发出一些声音。
- 将每只动物转移到另一个盒子中并返回。
- 用来回的动作轻轻摇晃笼子,注意不要用力摇晃笼子,以免动物撞到笼子的侧面或顶部,有遭受人身伤害的危险。
- 监测笼子里所有动物的癫痫发作情况。在任何时候,如果小鼠癫痫发作,将其转移回家庭笼子并记下癫痫发作的程度,而不会通过噪音或处理进一步刺激癫痫发作。
- 对于没有自发抓住或在笼子里轻轻摇晃后抓住的动物,通过更激烈的处理来触发癫痫发作:小心地翻转鼠标的尾巴从左到右。
注意:癫痫发作的动物是过度兴奋的,并且可能是跳跃的。 - 再次观察每只动物的癫痫发作行为。对后续笼子重复该过程。
注:癫痫监测的示例性方案可在 补充材料1第6-7页中找到。
- 复方效应数据报告
- 使用重复测量(RM)方差分析每日体重。
- 使用每日累积癫痫发作负担值作为数据的图形表示。将疗效数据(没有拉辛3-5期癫痫发作的动物数量)作为每组的保护数量/测试数量(通常N = 20)。因此,使用费舍尔精确检验比较载体和药物治疗组之间的反应(缉获或非缉获)的数据。
注意:如果癫痫发作期为2期或以下,则动物被视为"受保护"免受癫痫发作,而非受保护动物的癫痫发作时间为3-5期。 - 类似地分析耐受性数据,如具有行为障碍或毒性作用的动物数量/每组中测试的数量。注意任何不良反应,包括死亡。
- 如果注射载体的小鼠少于50%急性发作,则不考虑数据。
结果
对急性癫痫发作的复合效应
如果行为癫痫发作发生在药物注射 (DI) 期间或随后的 AM/PM 癫痫发作处理/监测会话期间,则记录行为癫痫发作。在处理癫痫发作期间观察到的癫痫发作可以表示为热图,如图 2 所示,用于LEV(350mg / kg)。为了分析癫痫发作负荷,取载体治疗组的最终(第7天)累积癫痫发作负荷值的平均值,并通过Mann-Whitney U检验与复合治疗组进行比较(癫痫发作负荷值包括在注射后观察时收集的值)。对于复合疗效,费舍尔精确检验确定载体和药物治疗组之间的疗效是否存在统计学差异。同样,耐受性数据用费舍尔精确测试进行分析。通过重复测量方差分析进行体重分析,以确定实验过程中的变化,以及复合和载体处理的小鼠之间的差异。
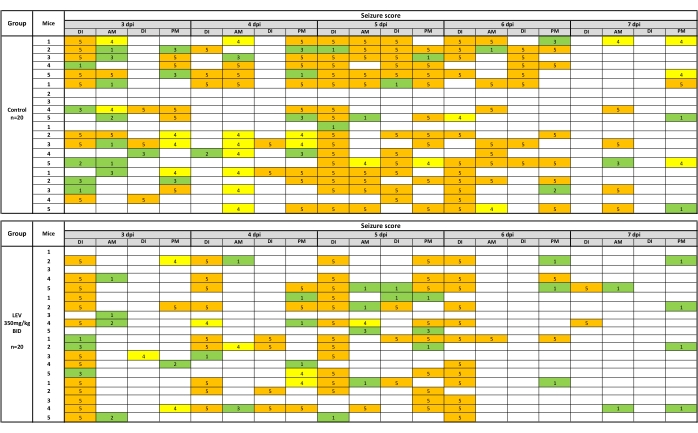
图2:用载体(0.5%甲基纤维素)或LEV(350mg / kg)测试后行为癫痫发作的热图。 在处理和癫痫观察前1小时每天注射两次。如果行为癫痫发作发生在药物注射(DI)期间或随后的AM/PM癫痫发作处理/监测期间,则记录行为癫痫发作。LEV(350 mg / kg)在5天的观察期内显着减少了处理过程中观察到的癫痫发作(占车辆癫痫负担的35.9%)。热图是通过用绿色描绘癫痫发作阶段 1-3、4 期黄色和 5 期橙色来创建的。这个新图是根据已发布的数据集19 创建的。 请点击此处查看此图的大图。
慢性癫痫
除了第一周 pi 报告的癫痫发作负担外,根据研究和假设,有几个读数可能有用。如果长期饲养动物,一部分受感染的动物会在数周时发生自发性癫痫发作,其发生频率低于急性癫痫发作,因此需要脑电图记录。为了记录小鼠的脑电图,需要在立体定位手术中植入电极24。图3显示了感染TMEV8的小鼠在慢性期通过脑电图记录的各种癫痫事件。
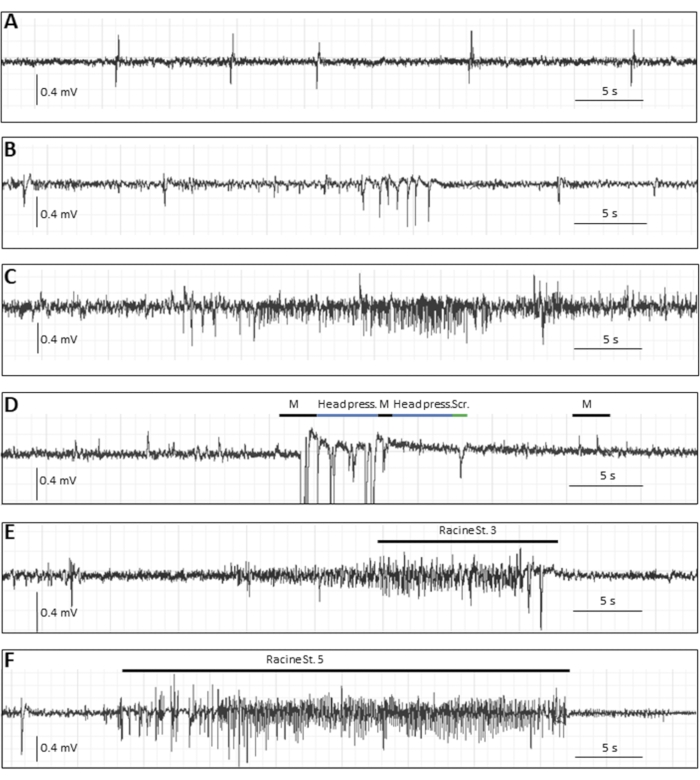
图 3:小鼠 DA 病毒感染后慢性期(14 周 pi)的典型 EEG 痕迹。 (A-C) 未见行为运动相关性的代表性脑电图事件,即 (A) 单尖峰,(B) 尖峰簇,(C) 以及电图,可能是局灶性癫痫发作。(D-F)具有行为相关性的代表性脑电图事件。D所示的小鼠有癫痫样事件,伴有肌阵挛性抽搐(用"M"表示,伴有运动伪影)、刻板运动(用"按头"表示,当鼠标将头部平压在地面上时)或行为停滞;"Scr"描述了抓挠的运动伪影,(E)和(F)显示了全身性惊厥性癫痫发作期间的典型脑电图改变:(E)持续时间为22秒和1 Hz的拉辛3期癫痫发作,以及(F)持续时间为34秒和5.4 Hz的5期癫痫发作。此图已在8之前发布,并经爱思唯尔许可转载。请点击此处查看此图的大图。
组织学
由于癫痫和癫痫发作通常伴有患者的海马病理学,这在实验模型中得到了概括,大多数实验室还分析了海马体的变化或潜在的抗癫痫治疗对病理学的影响。通常分析的参数包括海马神经变性和萎缩,以及通过标记特定免疫细胞群的炎症。对于此类分析,在实验结束时,对小鼠进行深度麻醉,直到发生呼吸停止并且心率显着减慢或显示心律失常。通过心内灌注PBS去除血液,然后用4%多聚甲醛(PFA)25 固定组织。然后通过冷冻切片和(免疫)染色26处理组织,然后进行显微镜分析。
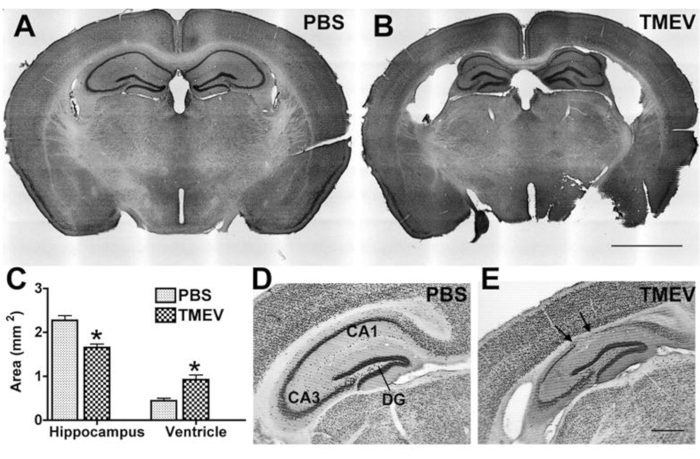
图4:癫痫TMEV感染小鼠的海马变性。 (A,B)Cresyl紫染色的冠状切片在(A)对照(PBS)小鼠中显示正常的细胞结构,在2个月pi时在(B)TMEV小鼠中显示海马变性。注意:侧脑室扩大,肺泡塌陷,锥体细胞层变薄。(C)这种损伤的量化显示,与PBS小鼠(N = 6;数据是SEM平均值±;p < 0.001;学生的t检验)。(D,E)NeuN标记进一步说明了在6个月pi时切片中神经元细胞损失的大小。箭头表示锥体细胞完全缺失的区域。(E)即使在癫痫小鼠中,齿状回似乎也相对完整。比例尺 = (A,B) 2 毫米;(深,东) 0.5 毫米。此图已在6 之前发布,经牛津大学出版社许可转载。 请点击此处查看此图的大图。
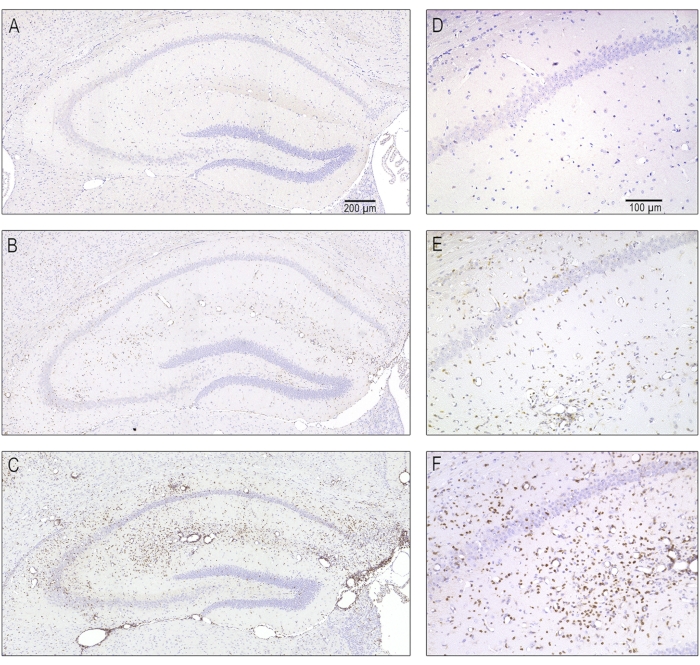
图5:感染后7天急性脑炎引起的T细胞浸润不同严重程度的代表性显微照片。 含有同侧背侧海马体的连续切片用CD3抗体染色以标记T淋巴细胞。(公元,卒)没有T细胞浸润的正常海马体,因为它出现在模拟感染的动物中。(乙、 东)中度T细胞浸润,见于大多数TMEV感染小鼠。(中、 女)T淋巴细胞的严重浸润,仅在一些受感染的小鼠中可见。此图已在8 之前发布,并经爱思唯尔许可转载。 请点击此处查看此图的大图。
补充文件1:补充文件由TMEV模型中用于化合物测试的表格组成。 第 1 页概述了实验设置。有关化合物、载体和化合物溶液制备的信息记录在第1-2页。复合应用记录在第3页。第4-5页上的评分表用于记录由进行化合物注射的实验者观察到和量化的癫痫发作。在第4页上,可以收集每个笼子5只小鼠的笼子1-4的数据,在第5页上,可以记录笼子5-8,这是我们手中进行化合物测试的标准动物数量。第6-7页上的评分表由致盲观察者使用,该观察者在每次化合物注射后1小时进行观察,处理和轻轻摇晃笼子。同样,在这些示例评分表上总共可以注意到八个笼子的癫痫发作评分。最后一页8可用于记录任何其他观察或注释。请点击此处查看此图的大图。
讨论
这是第一个基于感染的癫痫啮齿动物模型,可以调查急性和慢性癫痫发作的发展。它将有助于确定药物靶点和新化合物,用于预防或改变癫痫最常见病因之一的疾病。
如上所述,可能需要仔细考虑批次和病毒滴度,以确保足够比例的TMEV处理小鼠表现出处理诱导的癫痫发作。如果动物的癫痫发作次数比平时少,请使用一批N = 20只动物来验证病毒效率。如果其活性降低(小于50%),则是时候制作新的等分试样并用N = 20只动物进行测试。如果新的等分试样没有更有效,则应纯化一批新的病毒。对于某些转基因小鼠系,可能需要使用较低的病毒滴度;因此,初步实验后应根据需要稀释病毒滴度。B6小鼠的大多数可用数据来自杰克逊实验室(美国缅因州巴尔港或德国苏尔茨菲尔德查尔斯河);然而,从Harlan(德国埃斯特鲁普)获得的B6小鼠的癫痫发作率相似,已得到证实8。具有B6背景的转基因动物的癫痫发作率与野生型B6小鼠相当,但如果遗传变化对病毒入侵,炎症反应或神经变性有影响,则可能会有所不同21。急性癫痫发作是自发观察到的,但由处理和噪音触发,因此在比较癫痫发作率时,以类似的方式处理所有动物至关重要。以前,每天两次的处理提供了高癫痫发作负担,并且在感染后第3-7天表现出癫痫发作的小鼠比例更高6,8,19。也可以使用额外的处理时间(第 1 天和第 2 天)来增加癫痫发作负担。此外,可以在每次处理之前观察动物,以确保不会发生自发性癫痫发作。例如,嘈杂的实验室环境可能会产生癫痫发作,这反过来又可能使动物在测试期间对处理引起的癫痫发作无效。
虽然TMEV感染在大多数小鼠中产生处理引起的癫痫发作,但尚不清楚为什么一些动物对这种治疗有抵抗力。如上所述,可能是电图癫痫发作(伴有轻微或没有相关行为)发生,并且通常无法在没有伴随脑电图记录的情况下进行量化。也可能是注射位置的微小差异有助于降低大脑中的病毒效应;然而,据报道,由于病毒对海马体的嗜性,皮质和纹状体感染5,6,8,9 后癫痫发作。对于该模型中的药物筛选研究,为了确定癫痫发作的减少(例如,癫痫发作负担减少50%),每组需要更多的动物(例如,N = 20)。此外,该模型中癫痫发作行为的可变性需要药物与载体效应的更大差异来确定癫痫发作的显着减少。因此,此模型的一个限制是对较大组规模的要求。然而,足够的组大小也允许识别该模型中的抗癫痫和抗炎作用19。
该模型中绝大多数可观察到的癫痫发作发生在急性感染期间。尽管在用TMEV治疗的小鼠中观察到海马变性,免疫细胞活化和认知缺陷,但只有一小部分接受治疗的动物最终会出现慢性自发性癫痫发作。这种低的总体癫痫发作负担将需要大量受感染的小鼠才能正确研究该模型中的自发癫痫发作,这超出了许多项目的范围和能力。深度电极植入和脑电图监测也会增加实验动物的负担。虽然深度电极可能有助于识别自发性癫痫发作活动,但感染后海马解剖结构的变化可能使电极放置的一致性成为一项挑战。
确定癫痫新疗法的迫切需要开发可用作抗癫痫疗效快速筛查方法的模型。此模型提供了解决此紧急请求的功能。此外,它不需要任何立体战术手术的事实使其成为研究抗癫痫化合物的合适且易于执行的模型。
披露声明
提交人声明,他们没有相互竞争的经济利益。
致谢
SB得到了柏林FU的启动资助。KSW由R37 NS065434和ALSAM基金会支持。LAB由D-SPAN奖项1F99NS125773-01支持。我们感谢Robert Fujinami博士为我们提供泰勒病毒和犹他大学细胞成像核心设施的显微镜支持。
材料
| Name | Company | Catalog Number | Comments |
| Absorbent paper | - | - | any |
| Analytical balance | Mettler Toledo (Columbus, OH, U.S.A.) | 30216542 | 0. 1 mg–220 g |
| Animal balance | Ohaus (Parsippany, NJ, U.S.A.) | STX2202 | 0.01 g–2200 g |
| BD Lo-Dose U-100 Insulin Syringes | BD (Mississauga, ON, Canada) | BD329461 | Lo-Dose sterile syringes with permanent BD Micro-Fine IV needle - 1 mL |
| Daniel's strain of TMEV | kindly provided by Robert Fujinami (University of Utah) | - | 3 x 105 plaque-forming units aliquot(s) |
| Disinfectant, e.g. VennoVet 1 super | Menno Chemie Vertriebsgesellschaft GmbH, Germany | - | Recommended by campus veterinarians with less than or equal to 5% alcohol |
| Fisherbrand medium sterile Alcohol prep pad C7 | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 22-363-750 | |
| Fluriso | VETone (Boise, ID, U.S.A) | 502017 | Isoflurane 250 mL, 2%–5% |
| Fume absorber | Labconco (Kansas City, MO, U.S.A.) | - | - |
| General Protection Disposable SMS White Lab Coats | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 17-100-810A | |
| GraphPad Prism version 9 | (La Jolla, CA, U.S.A.) | ||
| Ice bucket | - | - | any |
| Microsoft Excel Microsoft | (Redmond, WA, U.S.A.) | ||
| Microsoft Word Microsoft | (Redmond, WA, U.S.A.) | ||
| Mouse cage | - | - | any mouse cage holding at least 5 mice |
| PrecisionGlide needles | BD (Mississauga, ON, Canada) | 329652 | BD Slip Tip with PrecisionGlide Needle Insulin Syringes - 26 G x 3/8 - 0.45 mm x 10 mm |
| Self-Sealing Sterilizing Pouch | Fisher Scientific (Hampton, NY, U.S.A.) | NC9241087 | 12.6 x 25.5 cm |
| Small glass flask | - | - | any, volume 25 mL |
| sterile PBS | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 10010056 | |
| Stir bar | Carl Roth GmbH & CO. KG | X171.1 | size according to volume of solution |
| Stir plate | Carl Roth GmbH & CO. KG | AAN2.1 | |
| Syringe Luer-Lok | BD (Mississauga, ON, Canada) | 309628 | 1 mL syringe only |
| Ultrasonic Cleaner, Heater/Mechanical Timer | Cole-Parmer (Vernon Hills, IL, U.S.A.) | EW-08895-23 | Bath sonicator - 0.5 gal, 115 V |
| Vehicle solution | - | - | depending on compound vehicle |
| Vortex REAX | Heidolph Instruments GmbH & Co. KG, Germany | 541-10000-00 |
参考文献
- Getts, D. R., Balcar, V. J., Matsumoto, I., Müller, M., King, N. J. Viruses and the immune system: their roles in seizure cascade development. Journal of Neurochemistry. 104 (5), 1167-1176 (2008).
- Libbey, J. E., Fujinami, R. S. Neurotropic viral infections leading to epilepsy: Focus on Theiler's murine encephalomyelitis virus. Future Virology. 6 (11), 1339-1350 (2011).
- Vezzani, A., et al. Infections, inflammation and epilepsy. Acta Neuropathologica. 131 (2), 211-234 (2016).
- Misra, U. K., Tan, C. T., Kalita, J. Viral encephalitis and epilepsy. Epilepsia. 49, 13-18 (2008).
- Libbey, J. E., et al. Seizures following picornavirus infection). Epilepsia. 49 (6), 1066-1074 (2008).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Development of postinfection epilepsy after Theiler's virus infection of C57BL/6 mice. Journal of Neuropathology and Experimental Neurology. 69 (12), 1210-1219 (2010).
- Stewart, A. M., et al. Perspectives of zebrafish models of epilepsy: What, how and where next. Brain Research Bulletin. 87 (2-3), 135-143 (2012).
- Bröer, S., et al. Brain inflammation, neurodegeneration and seizure development following picornavirus infection markedly differ among virus and mouse strains and substrains. Experimental Neurology. 279, 57-74 (2016).
- Bröer, S., et al. Viral mouse models of multiple sclerosis and epilepsy: Marked differences in neuropathogenesis following infection with two naturally occurring variants of Theiler's virus BeAn strain. Neurobiology of Disease. 99, 121-132 (2017).
- Loewen, J. L., Barker-Haliski, M. L., Dahle, E. J., White, H. S., Wilcox, K. S. Neuronal Injury, gliosis, and glial proliferation in two models of temporal lobe epilepsy. Journal of Neuropathology and Experimental Neurology. 75 (4), 366-378 (2016).
- Bell, L. A., Wallis, G. J., Wilcox, K. S. Reactivity and increased proliferation of NG2 cells following central nervous system infection with Theiler's murine encephalomyelitis virus. Journal of Neuroinflammation. 17 (1), 369 (2020).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Theiler's virus infection chronically alters seizure susceptibility. Epilepsia. 51 (8), 1418-1428 (2010).
- Buenz, E. J., Rodriguez, M., Howe, C. L. Disrupted spatial memory is a consequence of picornavirus infection. Neurobiology of Disease. 24 (2), 266-273 (2006).
- Tramoni-Negre, E., Lambert, I., Bartolomei, F., Felician, O. Long-term memory deficits in temporal lobe epilepsy. Revue Neurologique. 173 (7-8), 490-497 (2017).
- Ponds, R. W., Hendriks, M. Cognitive rehabilitation of memory problems in patients with epilepsy. Seizure. 15 (4), 267-273 (2006).
- Sloviter, R. S. Experimental status epilepticus in animals: What are we modeling. Epilepsia. 12, 11-13 (2009).
- Löscher, W. Animal models of seizures and epilepsy: Past, present, and future role for the discovery of antiseizure drugs. Neurochemical Research. 42 (7), 1873-1888 (2017).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Metcalf, C. S., et al. Screening of prototype antiseizure and anti-inflammatory compounds in the Theiler's murine encephalomyelitis virus model of epilepsy. Epilepsia Open. 7 (1), 46-58 (2021).
- Daniels, J. B., Pappenheimer, A. M., Richardson, S. Observations on encephalomyelitis of mice (DA strain). Journal of Experimental Medicine. 96 (6), 517-530 (1952).
- Käufer, C., et al. Chemokine receptors CCR2 and CX3CR1 regulate viral encephalitis-induced hippocampal damage but not seizures. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8929-8938 (2018).
- Libbey, J. E., et al. The effects of diet on the severity of central nervous system disease: One part of lab-to-lab variability. Nutrition. 32 (7-8), 877-883 (2016).
- Racine, R. J. Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Kim, J. E., Cho, K. O. The pilocarpine model of temporal lobe epilepsy and EEG monitoring using radiotelemetry system in mice. Journal of Visualized Experiments. (132), e56831 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Tu, L., et al. Free-floating immunostaining of mouse brains. Journal of Visualized Experiments. (176), e62876 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。