Method Article
Модель эпилепсии инфекционной этиологии с использованием вируса мышиного энцефаломиелита Тейлера
В этой статье
Резюме
Внутримозговая инфекция вирусом мышиного энцефаломиелита Тейлера (TMEV) у мышей C57BL/6 реплицирует многие ранние и хронические клинические симптомы вирусного энцефалита и последующей эпилепсии у пациентов-людей. В этой статье описывается вирусная инфекция, симптомы и гистопатология модели TMEV.
Аннотация
Одной из основных причин эпилепсии является инфекция центральной нервной системы (ЦНС); Примерно у 8% пациентов, переживших такую инфекцию, развивается эпилепсия, причем показатели значительно выше в менее экономически развитых странах. В данной работе представлен обзор моделирования эпилепсии инфекционной этиологии и использования ее в качестве платформы для тестирования новых противосудорожных соединений. Представлен протокол индукции эпилепсии путем нестереотаксической внутримозговой инъекции вируса мышиного энцефаломиелита Тейлера (TMEV) у мышей C57BL/6, который воспроизводит многие ранние и хронические клинические симптомы вирусного энцефалита и последующей эпилепсии у пациентов-людей. Описана клиническая оценка мышей во время энцефалита для мониторинга судорожной активности и выявления потенциальных противосудорожных эффектов новых соединений. Кроме того, показаны гистопатологические последствия вирусного энцефалита и судорог, таких как повреждение гиппокампа и нейровоспаление, а также долгосрочные последствия, такие как спонтанные эпилептические припадки. Модель TMEV является одной из первых трансляционных, ориентированных на инфекцию, экспериментальных платформ, позволяющих исследовать механизмы развития эпилепсии как следствия инфекции ЦНС. Таким образом, он также служит для выявления потенциальных терапевтических мишеней и соединений для пациентов с риском развития эпилепсии после инфекции ЦНС.
Введение
Одним из частых последствий вирусного энцефалита являются эпилептические припадки. Многие вирусные инфекции вызывают симптоматические судороги во время острой фазы инфекции; Риск таких припадков увеличивается более чем на 20% среди населения в целом 1,2,3. Пациенты, пережившие инфекцию, также имеют повышенный риск развития хронической эпилепсии в 4-20% в течение нескольких месяцев или лет после заражения 1,4. Вирус мышиного энцефаломиелита Тейлера (TMEV) был идентифицирован как подходящий вирус для изучения острых и хронических судорог на мышиной модели вирусного энцефалита 5,6,7. TMEV представляет собой безоболочечный одноцепочечный РНК-вирус семейства Picornaviridae с положительным смыслом и традиционно используется для изучения демиелинизации в спинном мозге мышей SJL, от которого защищены мыши C57BL / 6 (B6), поскольку они обладают способностью быстро очищать вирус после заражения. Тем не менее, TMEV вызывает острые судороги у 50-75% мышей-самцов и самок B6 в течение первой недели после заражения (pi), в то время как примерно у 25-40% развивается хроническая эпилепсия от нескольких недель домесяцев pi 2,5,6,8,9. Помимо судорог, у мышей также наблюдается общая гистопатология эпилептического гиппокампа с нейродегенерацией и глиозом 5,6,8,10,11,12. Кроме того, мыши B6, инфицированные TMEV, показывают значительно худшие результаты в поведенческих тестах на обучение и память и имеют когнитивную коморбидность, что также наблюдается у клинических пациентов с эпилепсией13,14,15.
Традиционно модели эпилепсии и судорог используют либо применение химиосудорожных веществ, либо электрическую стимуляцию, чтобы вызвать судороги; Однако эти модели не имеют конструктной валидности и часто демонстрируют более тяжелые судороги и повреждения головного мозга, чем у клинических пациентов16. Не существует модели, подходящей для каждого исследовательского вопроса17. Использование модели TMEV особенно интересно, если исследуются предрасполагающие факторы развития судорог после инфекции ЦНС или если проводится скрининг соединений на предмет их противосудорожной эффективности.
Поскольку модель TMEV была создана и используется в нескольких различных лабораториях по всему миру, авторы определили множество деталей, которые позволяют успешно реализовать модель, например, специфичность различных штаммов вирусов и мышей. Наиболее достоверная индукция судорог была получена с помощью штамма Даниэля мышей TMEV и B6J 2,5,6,8,9. В настоящее время модель используется Национальным институтом неврологических расстройств и инсульта (NINDS) в качестве платформы для выявления новых лекарств против эпилепсии и судорог18,19. Эта статья включает в себя подробный протокол индукции вируса и клинического мониторинга, чтобы позволить другим исследователям использовать эту модель вирусного энцефалита для дальнейшего понимания механизмов заболевания, а также для тестирования лекарств.
Следующий протокол отражает исследование, предназначенное для тестирования соединений в этой модели, хотя может быть выполнено множество других типов исследований. Мышей ненадолго анестезируют перед инъекцией штаммом TMEV Даниэля в височную область правого полушария (заднюю и медиальную по отношению к правому глазу). В зависимости от вопроса исследования, если требуются неинфицированные контрольные животные, мыши получают стерильный фосфатно-буферный физиологический раствор (PBS, pH 7,4, включая KH 2 PO 4 [1,06 мМ], NaCl [155,17 мМ] и Na 2 HPO4·7H 2 O [2,97мМ]) вместо TMEV. Предыдущий опыт работы с мышами, инфицированными TMEV, показал, что судороги, вызванные обработкой, возникают между 3-м и 7-м днем после заражения. Частота инъекций, путь и время испытаний экспериментальных соединений варьируются в зависимости от их свойств. Рекомендуется проводить прививку вируса в пятницу, что позволяет проводить мониторинг приступов на 3-7 день на следующей неделе, с понедельника по пятницу. В течение недели мониторинга приступов экспериментальные соединения можно вводить (в/) два раза в день (с интервалом не менее 4 часов), если иное не вытекает из кинетики или механизма действия соединения. Мониторинг судорог во время лечения может проводиться в заранее определенный момент времени. Время инъекции и наблюдения варьируется в зависимости от отдельных соединений. Животным вводят исследуемое соединение или транспортное средство вместо лекарственного соединения. Эти две группы можно обрабатывать и наблюдать аналогично экспериментальной группе. Во время эксперимента один человек, работающий с мышами и оценивающий судороги, должен быть слеп к лечению.
протокол
Все описанные процедуры были санкционированы соответствующими органами. Животные содержатся в соответствии с рекомендациями «Руководства по уходу и использованию лабораторных животных» (Национальный исследовательский совет) и в соответствии с политикой Службы общественного здравоохранения и Институциональным комитетом по уходу за животными и их использованию в Университете штата Юта, протокол для животных (номер: 21-11009, Департамент фармакологии и токсикологии) и в Freie Universität Berlin (протокол: G0015/21, LAGeSo Berlin, Институт фармакологии и токсикологии) соответственно. Результаты, показанные на рисунках 3 и 5 , были утверждены в соответствии с 33.9-42502-04-11/0516 и 33.9-42502-04-15/1892 (LAVES Oldenburg, кафедра фармакологии, токсикологии и фармации, Университет ветеринарной медицины Ганновера).
1. Соображения и подготовка к разработке исследования
- Вирус
- Штамм TMEV Даниэля был любезно предоставлен Робертом Фудзинами из Университета штата Юта. Первоначально он был выделен из мыши в Гарвардской колонии20. Ознакомьтесь с конкретной классификацией и правилами для биологических агентов в соответствующих странах, прежде чем обращаться с TMEV, и обсудите с персоналом учреждения по биобезопасности, чтобы обеспечить соблюдение правил. Как правило, TMEV классифицируется как BSL 2, в зависимости от штамма и генетических модификаций. Стандартная доза, необходимая для индукции судорог у большинства животных, составляет 3 х 10,5 бляшкообразующих единиц (БОЕ).
ПРИМЕЧАНИЕ: Дозу, возможно, придется адаптировать, например, если используются трансгенные мыши. В целом, титры от 2 x 104 БОЕ до 2,44 x 107 БОЕ использовались для успешной индукции судорог. Контрольные животные получают стерильный PBS и не испытывают судорог. Вирус не заражает людей; однако экспериментаторы должны постоянно носить СИЗ (лабораторный халат, перчатки, защитные очки), а туши мышей и постельные принадлежности должны быть автоклавированы перед утилизацией.
- Штамм TMEV Даниэля был любезно предоставлен Робертом Фудзинами из Университета штата Юта. Первоначально он был выделен из мыши в Гарвардской колонии20. Ознакомьтесь с конкретной классификацией и правилами для биологических агентов в соответствующих странах, прежде чем обращаться с TMEV, и обсудите с персоналом учреждения по биобезопасности, чтобы обеспечить соблюдение правил. Как правило, TMEV классифицируется как BSL 2, в зависимости от штамма и генетических модификаций. Стандартная доза, необходимая для индукции судорог у большинства животных, составляет 3 х 10,5 бляшкообразующих единиц (БОЕ).
- Животные
- Для индукции и исследования судорог используйте мышей B6J, так как другие штаммы мышей не обязательно проявляют судороги, например, мыши SJL/J, FVB/N или Balb/c5. Нет никакой разницы между самками и самцами мышей в частоте острых приступов5. Проводите эксперименты на мышах от подросткового до взрослого возраста (начиная с 5-6-недельного возраста).
- Диета
- Диета была определена как один из источников вариабельности тяжести заболевания от лаборатории к лаборатории; Следовательно, рассматривайте диету как потенциальный фактор для вариации22.
- Размер группы
- Поскольку не у всех животных развиваются острые или хронические судороги в этой модели, используйте около 20 мышей / группу для тестирования соединений.
- Благополучие животных
- Если какая-либо мышь демонстрирует значительные побочные эффекты от инфекции или введения исследуемого соединения (например, вялость, плохой уход, чрезмерное покраснение и гнойные выделения из раны) после времени наблюдения, определенного местными рекомендациями IACUC (например, 48 часов), усыпьте мышь гуманно.
- Гуманно усыпляйте любую мышь, демонстрирующую экстремальную потерю массы тела (>20%) в период заражения.
- Если животные не едят должным образом, дайте им доступ к дополнительным гранулам, смоченным педиатрическим раствором электролита или аналогичным.
2. Прививка вируса
- Стерилизация инъекционного шприца
- Снимите колпачок инсулинового шприца. Добавьте полиэтиленовую трубку в качестве воротника вокруг иглы, чтобы обеспечить достаточную глубину впрыска 2,5 мм. Погрузите шприц в этанол на 30 мин. Поместите шприц под ультрафиолетовый свет на 30 минут.
- Наденьте колпачок обратно на иглу. Заверните шприц в стерилизующий мешочек и заклейте его скотчем. Этикетка с датой приготовления.
- Инъекция вируса
- Получите аликвоты штамма TMEV Даниэля из морозильной камеры при температуре -80 °C. Разморозьте вирус и держите его на льду. Избегайте размораживания и повторного замораживания вируса. Загрузите в шприц вирусную суспензию (3 х 105 БОЕ, разведенные в 20 мкл питательной среды PBS или DMEM).
ВНИМАНИЕ: Вирус заразен для мышей, но не для людей. - Очистите скамейку дезинфицирующим средством и работайте под поглотителем дыма. Инокуляция вируса не стерильна, а максимально чиста.
- Перенесите мышь в индукционную камеру для анестезии и используйте 2% изофлуран в кислороде, чтобы вызвать анестезию. Достижение хирургической толерантности занимает несколько минут; Регулируйте концентрацию в зависимости от дыхания животного и глубины анестезии.
- Перенесите анестезированную мышь из анестезиологического бокса под капюшоном. Проверьте переносимость хирургического вмешательства, например, по защемлению пальца ноги. Вся процедура выполняется менее чем за 30 с, поэтому животному не нужно вдыхать изофлуран во время инъекции. Добавьте глазную мазь, чтобы предотвратить пересыхание роговицы.
- Очистите голову животного спиртовой салфеткой. Наклоните голову мыши немного влево, чтобы место инъекции было направлено вверх.
- Оттяните кожу немного назад, введите иглу в головку и введите 20 мкл интракортикально на глубину 2,5 мм в височную область правого полушария (заднюю и медиальную по отношению к правому глазу).
- Выполняют инъекцию в одностороннем порядке в одно и то же полушарие у всех животных. Используйте глаз и ухо в качестве ориентиров для расположения теменной коры. Размещение было предварительно проверено гистологически; см. рисунок 1. Координаты инъекции по стереотаксической инъекции по отношению к брегме составляют −2,0 (AP); +3,0 (МЛ); −1,5 (ДВ).
- Оставьте шприц на месте на 5-15 с. Запишите, есть ли утечка от инъекции или видны пузырьки воздуха - в этом случае подготовьте новый шприц. Осторожно вытаскивая шприц, слегка поверните его. Наносите глазную мазь, чтобы предотвратить сухость под наркозом.
- НЕОБЯЗАТЕЛЬНО: Закодируйте животное на хвосте или ухе в зависимости от местных процедур (необязательно, но легко, так как животное находится без сознания).
- Переведите животное в новую клетку, которую помещают наполовину на грелку (35-40 °C) во время восстановления после анестезии. Не оставляйте животных без присмотра до тех пор, пока они не придут в сознание, достаточное для поддержания лежачего положения на грудине.
ПРИМЕЧАНИЕ: После выздоровления животные могут быть снова помещены в группу (инфицированные животные не смешиваются с имитационно инфицированными животными). Инфицированных мышей не следует размещать в одной комнате с неинфицированными мышами. - Следите за весом мышей в течение первых 7 дней, так как они теряют вес после заражения и могут нуждаться в дополнительном кормлении.
- Получите аликвоты штамма TMEV Даниэля из морозильной камеры при температуре -80 °C. Разморозьте вирус и держите его на льду. Избегайте размораживания и повторного замораживания вируса. Загрузите в шприц вирусную суспензию (3 х 105 БОЕ, разведенные в 20 мкл питательной среды PBS или DMEM).
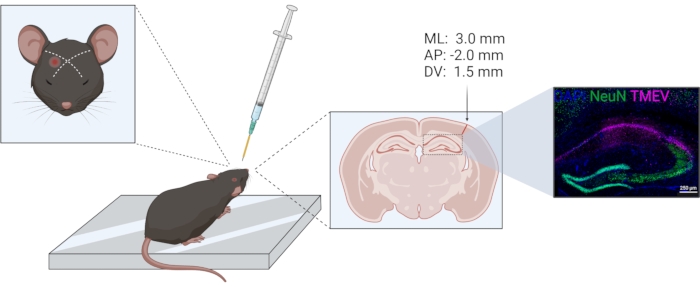
Рисунок 1: Схема процедуры инъекции TMEV. Слева направо: Для инъекции в правую теменную кору игла вводится немного сбоку от воображаемой линии между глазом и противоположным ухом. Ошейник для контроля глубины обозначен желтым цветом. Инъекционный тракт можно увидеть в венечном отделе мозга, отмеченном стрелкой. Место инъекции соответствует координатам, приведенным над стрелкой. На правом изображении показано распределение вируса Тейлера (фиолетового) в CA1 формации гиппокампа. Рисунок был подготовлен с использованием biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Тестирование соединений
- Приготовление компаунда
- Ознакомьтесь с инструкциями по составлению рецептуры. Подготовьте раствор для автомобиля в соответствии с рекомендациями или инструкциями. В качестве примера представлена процедура применения противоэпилептического препарата леветирацетам (ЛЕВ). LEV снижает судорожную нагрузку до 30-40% от уровня носителя при дозе 350 мг / кг. Транспортное средство, используемое в этом исследовании, составляет 0,5% метилцеллюлозы.
- Рассчитайте дозы в зависимости от соединения. Взвесьте препарат согласно расчету. Для лечения 1 кг мышей взвесьте 350 мг LEV.
- Приготовьте исходный раствор с соответствующим объемом раствора носителя, как указано в инструкциях по составлению (например,.обработка ультразвуком, вспомогательные вещества носителя и т.д.). Учитывая объем инъекции 0,01 мл / г мыши, объем инъекции для 1 кг будет составлять 10 мл с 350 мг LEV, в результате чего получается раствор 35 мг / мл19. Сообщите расчет и дозу в мг/кг и объем в мл.
ПРИМЕЧАНИЕ: Примерный протокол можно найти на странице 2 Дополнительного материала 1.
- Введение соединения
- Рандомизируйте клетки для транспортного средства или составной группы. Используйте имитационно-инфицированных мышей для изучения механизмов развития эпилепсии или в целях валидации, но не для рутинного скрининга лекарств.
- Сообщайте об условиях окружающей среды, таких как температура, влажность, время суток и т. д.
- Встряхните раствор с компаундом, а также раствор транспортного средства. Аспирируйте транспортное средство или соединение в шприц и раскрасьте шприцы, чтобы предотвратить путаницу.
- Взвесьте животных. Убедитесь, что мыши B6J имеют вес >18 г на 3-й день (без округления). Сообщите вес.
- Вводят соединение (например, путем внутрибрюшинной инъекции или другими подходящими путями). Напишите время и маршрут введения.
- Следите за животными на предмет любых поведенческих изменений после введения состава, особенно после первых инъекций. Если судороги возникают, сообщите об интенсивности судорог по шкале Расина23; Смотрите шаг 3.2.
ПРИМЕЧАНИЕ: Примерный протокол введения соединения можно найти в Дополнительном материале 1, стр. 3, в то время как судороги, наблюдаемые во время введения, будут записаны в Дополнительном материале 1, стр. 4-5.
- Мониторинг судорог при судорогах, вызванных обработкой
- Выполните эту процедуру экспериментатором, слепым к лечению. Перенесите все клетки на скамейку. Наблюдайте за животными на предмет судорог 2 раза в день во время световой фазы.
- Оцените судорожную активность по модифицированной шкале Расина23: 0 = отсутствие изменений в поведении, 1 = движения рта и лица, 2 = кивание головой, 3 = односторонний клонус передних конечностей, 4 = двусторонний клонус передних конечностей с вставанием на дыбы, 5 = генерализованная тонико-клоническая активность с потерей постурального тонуса, иногда прыжки, 6 = длительные и чрезмерные прыжки и гиперактивность. Сообщите о количестве и интенсивности приступов.
- Проведите загоном по клетке, чтобы пошуметь.
- Переложите каждое животное в другой ящик и обратно.
- Осторожно встряхивайте клетку, двигаясь вперед-назад, стараясь не трясти клетку так сильно, чтобы животные не ударились о бока или верхнюю часть клетки и не могли получить физическую травму.
- Следите за всеми животными в клетке на предмет судорог. В любое время, если у мыши случился припадок, перенесите его обратно в домашнюю клетку и запишите уровень припадка без дальнейшей стимуляции припадка шумом или обработкой.
- Для животных, которые не схватились спонтанно или после легкого встряхивания клетки, вызовите судороги более интенсивным обращением: осторожно переверните мышь, перевернув ее хвостом слева направо.
ПРИМЕЧАНИЕ: Животные с судорогами гипервозбудимы и могут быть нервными. - Снова понаблюдайте за каждым животным на предмет судорожного поведения. Повторите процесс для последующих клеток.
ПРИМЕЧАНИЕ: Примерный протокол мониторинга судорог можно найти в Дополнительном материале 1, стр. 6-7.
- Отчет о данных о сложных эффектах
- Проанализируйте суточную массу тела с помощью повторных измерений (РМ) ANOVA.
- Используйте ежедневные кумулятивные значения судорожной нагрузки для графического представления данных. Представьте данные об эффективности (количество животных без приступов Расина 3-5 стадий) в виде числа защищенных / числа протестированных в каждой соответствующей группе (обычно N = 20). Таким образом, сравните данные между группами, получавшими транспортное средство и лекарственное средство, для ответов (захват или незахват) с использованием точного теста Фишера.
ПРИМЕЧАНИЕ: Животное считается «защищенным» от судорог, если у него припадок 2-й стадии или менее, а у незащищенных животных судороги 3-5 стадий. - Анализируйте данные переносимости аналогично, как количество животных с поведенческими нарушениями или токсическими эффектами / количество протестированных в каждой группе. Обратите внимание на любые неблагоприятные последствия, включая смертельные случаи.
- Если менее 50% мышей, которым вводили транспортное средство, резко заклинивают, не учитывайте данные.
Результаты
Комплексное воздействие на острые судороги
Поведенческие припадки регистрируются, если они возникают во время инъекции наркотиков (DI) или во время последующих сеансов обработки/мониторинга приступов AM / PM. Судороги, наблюдаемые во время обработки судорог, можно представить в виде тепловой карты, которая показана на рисунке 2 для LEV (350 мг / кг). Для анализа судорожного бремени берется среднее значение окончательных (7-й день) кумулятивных значений судорожной нагрузки для группы, обработанной носителем, и сравнивается с помощью теста Манна-Уитни с группой, получавшей соединение (значения судорожной нагрузки включают значения, собранные при наблюдении после инъекции). Что касается эффективности соединения, точный тест Фишера определяет, существует ли статистическая разница в эффективности между группами, получавшими транспортное средство и лекарственное средство. Точно так же данные о переносимости анализируются с помощью точного теста Фишера. Анализ массы тела проводится с помощью повторных измерений ANOVA для определения изменений в ходе эксперимента, а также различий между мышами, получавшими соединения и транспортные средства.
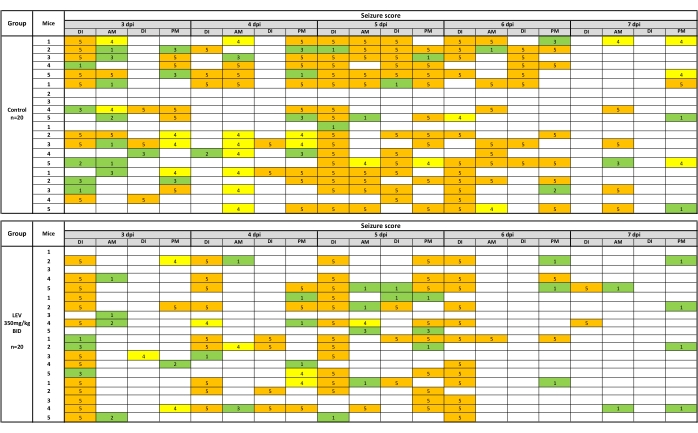
Рисунок 2: Тепловая карта поведенческих припадков после тестирования с носителем (0,5% метилцеллюлозы) или LEV (350 мг / кг). Инъекции два раза в день проводились за 1 ч до обработки и наблюдения за судорогами. Поведенческие припадки регистрировались, если они происходили во время инъекции наркотиков (DI) или во время последующих сеансов обработки/мониторинга приступов AM / PM. LEV (350 мг / кг) значительно снижает судороги, наблюдаемые во время сеансов обработки (35,9% от судорожного бремени транспортного средства) в течение 5-дневного периода наблюдения. Тепловая карта создается путем изображения приступов 1-3 стадии зеленым цветом, 4 желтым цветом и 5 оранжевым цветом. Этот новый рисунок был создан на основе опубликованного набора данных19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Хроническая эпилепсия
Помимо зарегистрированного судорожного бремени в первую неделю pi, есть несколько показаний, которые могут быть полезны в зависимости от исследования и гипотезы. Если животные содержатся в течение длительного времени, у подгруппы инфицированных животных будут развиваться спонтанные эпилептические припадки через несколько недель, которые возникают реже, чем острые припадки, и, таким образом, требуют записи ЭЭГ. Чтобы записать ЭЭГ мышей, электроды должны быть имплантированы в стереотаксическую хирургию24. На рисунке 3 показаны различные эпилептические события в хронической фазе с помощью записи ЭЭГ у мышей, инфицированных TMEV8.
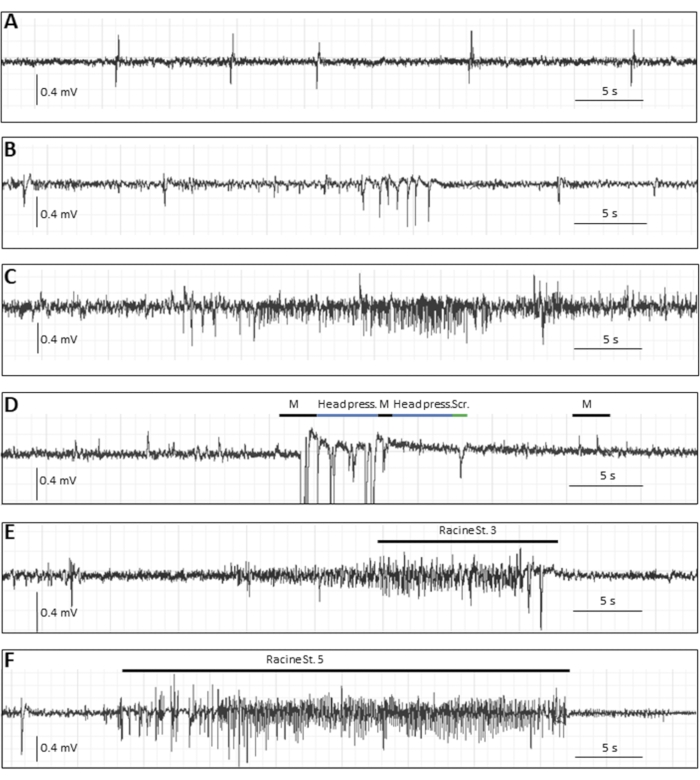
Рисунок 3: Типичные следы ЭЭГ в хронической фазе (14 недель pi) после заражения вирусом DA у мышей. (A-C) Репрезентативные события ЭЭГ, в которых не наблюдалось поведенческого моторного коррелята, т.е. (A) одиночные спайки, (B) спайковые кластеры, (C), а также электрографический, предположительно фокальный припадок. (Д-Ж) Репрезентативные события ЭЭГ с поведенческими коррелятами. У мыши, показанной в D, были судорожные события с миоклоническими подергиваниями (обозначенными буквой «М», сопровождаемыми артефактами движения), стереотипными движениями (обозначенными «нажатием на голову», когда мышь плоски прижимала голову к земле) или поведенческой остановкой; «Scr» описывает артефакт движения царапания, (E) и (F) показывают типичные изменения ЭЭГ во время генерализованных судорожных припадков: (E) приступ 3-й стадии Расина с продолжительностью 22 с и 1 Гц и (F) приступ 5-й стадии с продолжительностью 34 с и 5,4 Гц. Этот рисунок был опубликован до8 и перепечатывается с разрешения Elsevier. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Гистология
Поскольку эпилепсия и судороги обычно сопровождаются патологией гиппокампа у пациентов, которая повторяется в экспериментальных моделях, большинство лабораторий также анализируют изменения гиппокампа или влияние потенциального противосудорожного лечения на патологию. Обычно анализируемые параметры включают нейродегенерацию и сокращение гиппокампа, а также воспаление путем маркировки специфических популяций иммунных клеток. Для таких анализов в конце эксперимента мышей глубоко анестезируют до тех пор, пока не произойдет остановка дыхания и частота сердечных сокращений значительно замедлится или не проявится аритмия. Кровь удаляется путем внутрисердечной перфузии PBS с последующим введением 4% параформальдегида (PFA)25 для фиксации ткани. Затем ткань обрабатывают криосекцией и (иммунным) окрашиванием26 с последующим микроскопическим анализом.
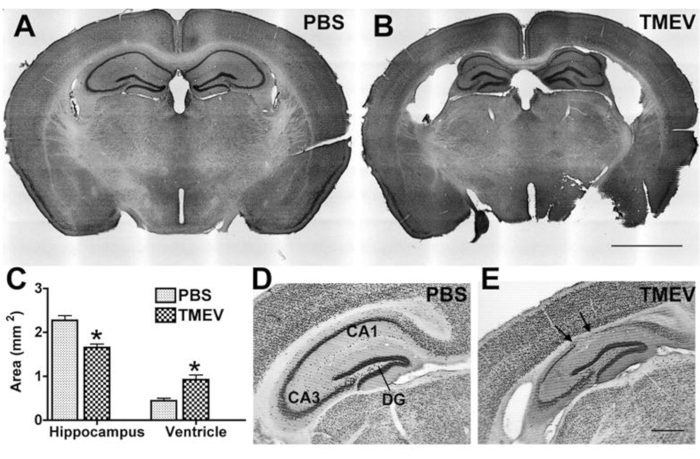
Рисунок 4: Дегенерация гиппокампа у мышей, инфицированных эпилептическим TMEV. (A, B) Окрашенные фиолетовым цветом корональные срезы Cresyl демонстрируют нормальную цитоархитектонику у мыши (A) контроля (PBS) и дегенерацию гиппокампа у мыши (B) TMEV через 2 месяца PI. Примечание: Увеличение боковых желудочков, коллапс альвеуса и истончение пирамидного клеточного слоя. (C) Количественная оценка этого повреждения показывает значительное уменьшение площади гиппокампа и соответствующее увеличение площади желудочков мышей TMEV (N = 7) по сравнению с мышами PBS (N = 6; данные являются средними ± SEM; p < 0,001; t-критерий Стьюдента). (Д,Е) Маркировка NeuN также иллюстрирует величину потери нейрональных клеток в срезах, взятых через 6 месяцев пи. Стрелками обозначены области с полной пирамидной потерей клеток. (E) Зубчатая извилина, по-видимому, относительно неповреждена даже у мышей с эпилепсией. Масштабная линейка = (A,B) 2 мм; (D,E) 0,5 мм. Этот рисунок был опубликован до6 лет и перепечатывается с разрешения издательства Oxford University Press. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
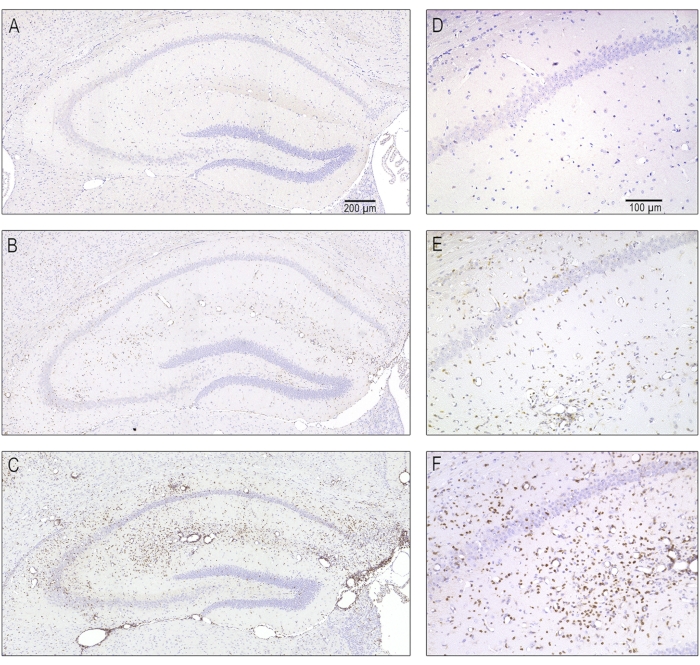
Рисунок 5: Репрезентативные микрофотографии различной степени тяжести Т-клеточной инфильтрации вследствие острого энцефалита через 7 дней после заражения. Серийные срезы, содержащие ипсилатеральный дорсальный гиппокамп, окрашивали антителами против CD3 с целью маркировки Т-лимфоцитов. (А,Д) Нормальный гиппокамп без инфильтрации Т-клеток, как это было у фиктивно инфицированных животных. (В, Е) Умеренная инфильтрация Т-клеток, наблюдаемая у большинства мышей, инфицированных TMEV. (К, Ж) Тяжелая инфильтрация Т-лимфоцитов, которая наблюдалась только у некоторых инфицированных мышей. Этот рисунок был опубликован до8 и перепечатывается с разрешения Elsevier. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Дополнительный файл состоит из формы, используемой для испытаний соединений в модели TMEV. На стр. 1 приведен обзор экспериментальной установки. Информация о составе, носителе и приготовлении раствора компаунда записана на стр. 1-2. Составное внесение описано на стр. 3. Оценочные листы на страницах 4-5 используются для записи наблюдаемых и количественно оцениваемых экспериментатором, выполняющим инъекцию соединения. На странице 4 можно собрать данные для клеток 1-4 по 5 мышей в каждой, а на странице 5 можно записать клетки 5-8, что является стандартным количеством животных для тестирования соединений в наших руках. Оценочные листы на страницах 6-7 используются слепым наблюдателем, который выполняет наблюдение, обработку и мягкое встряхивание клетки через 1 час после каждой инъекции соединения. Опять же, оценки судорог можно отметить в общей сложности для восьми клеток в этих образцовых оценочных листах. Последняя страница 8 может быть использована для записи любых других наблюдений или заметок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Это первая модель эпилепсии у грызунов, основанная на инфекции, которая позволяет исследовать развитие острых и хронических припадков. Это поможет определить лекарственные мишени и новые соединения для профилактики заболеваний или модификации для одной из наиболее распространенных этиологий эпилепсии.
Как описано выше, может потребоваться тщательное рассмотрение партии и титра вируса, чтобы гарантировать, что адекватная доля мышей, получавших TMEV, демонстрирует судороги, вызванные обработкой. Если у животных меньше судорог, чем обычно, используйте партию из N = 20 животных для проверки эффективности вируса. Если его активность снижена (менее 50%), пора делать новые аликвоты и тестировать их на N = 20 животных. Если новые аликвоты не более эффективны, следует очистить новую партию вируса. Для некоторых трансгенных линий мышей может потребоваться использование более низкого вирусного титра; Поэтому вирусный титр следует разбавлять по мере необходимости после предварительных экспериментов. Большинство доступных данных о мышах B6 поступило из лабораторий Джексона (Бар-Харбор, Мэн, США или Чарльз-Ривер, Зульцфельд, Германия); однако аналогичная частота судорог у мышей B6, полученных от Harlan (Eystrup, Германия), была подтверждена8. Частота судорог у трансгенных животных с фоном B6 сопоставима с мышами B6 дикого типа, но может отличаться, если генетические изменения влияют на инвазию вируса, воспалительную реакцию или нейродегенерацию21. Острые припадки наблюдаются спонтанно, но вызваны обращением и шумом, поэтому крайне важно обращаться со всеми животными одинаково при сравнении частоты приступов. Сеансы обработки два раза в день ранее обеспечивали высокую судорожную нагрузку и большую долю мышей, демонстрирующих судороги в течение 3-7 дней после заражения 6,8,19. Дополнительные сеансы обработки (1-й и 2-й дни) также могут быть использованы для увеличения судорожной нагрузки. Кроме того, животные могут наблюдаться перед каждым сеансом обработки, чтобы убедиться, что спонтанные припадки не возникают. Например, шумная лабораторная среда может вызвать судороги, которые, в свою очередь, могут сделать животных невосприимчивыми к судорогам, вызванным обращением, во время тестирования.
В то время как инфекция TMEV вызывает судороги, вызванные обработкой, у большинства мышей, неизвестно, почему некоторые животные устойчивы к этому лечению. Как описано выше, может случиться так, что электрографические припадки (с минимальным или отсутствующим сопутствующим поведением) возникают и обычно не количественно оцениваются без сопутствующей записи ЭЭГ. Также может случиться так, что небольшие различия в месте инъекции способствуют снижению вирусного эффекта в головном мозге; Тем не менее, судороги были зарегистрированы после корковой и стриарной инфекции 5,6,8,9 из-за тропизма вируса к гиппокампу. Для скрининговых исследований лекарств в этой модели, чтобы выявить снижение судорог (например, снижение судорожного бремени на 50%), требуется большее количество животных для каждой группы (например, N = 20). Кроме того, вариабельность судорожного поведения в этой модели требует больших различий в эффектах лекарств и транспортных средств, чтобы определить значительное снижение судорог. Поэтому одним из ограничений этой модели является требование больших размеров групп. Тем не менее, достаточные размеры групп также позволяют идентифицировать противосудорожные и противовоспалительные эффекты в этой модели19.
Подавляющее большинство наблюдаемых припадков в этой модели происходит в период острой инфекции. Несмотря на дегенерацию гиппокампа, активацию иммунных клеток и когнитивный дефицит, наблюдаемые у мышей, получавших TMEV, только у небольшой части животных, получавших лечение, в конечном итоге развиваются хронические спонтанные судороги. Это низкое общее бремя судорог потребует большого количества инфицированных мышей, чтобы должным образом изучить спонтанные судороги в этой модели, что выходит за рамки и возможности многих проектов. Имплантация глубинных электродов и мониторинг ЭЭГ также увеличат нагрузку на экспериментальных животных. В то время как глубинные электроды могут помочь в выявлении спонтанной судорожной активности, изменения в анатомии гиппокампа после инфекции могут затруднить последовательное размещение электродов.
Острая необходимость определения новых методов лечения эпилепсии требует разработки моделей, которые могут быть использованы в качестве метода быстрого скрининга противосудорожной эффективности. Эта модель предоставляет функции для удовлетворения этого срочного запроса. Более того, тот факт, что он не требует какой-либо стереотаксической хирургии, делает его подходящей и простой в исполнении моделью для исследования противосудорожных соединений.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
SB поддерживается стартовым грантом FU Berlin. KSW поддерживается R37 NS065434 и Фондом ALSAM. LAB поддерживается наградой D-SPAN 1F99NS125773-01. Мы благодарим Роберта Фудзинами, доктора философии, за предоставление нам вируса Тейлера и Центр клеточной визуализации Университета штата Юта за поддержку микроскопии.
Материалы
| Name | Company | Catalog Number | Comments |
| Absorbent paper | - | - | any |
| Analytical balance | Mettler Toledo (Columbus, OH, U.S.A.) | 30216542 | 0. 1 mg–220 g |
| Animal balance | Ohaus (Parsippany, NJ, U.S.A.) | STX2202 | 0.01 g–2200 g |
| BD Lo-Dose U-100 Insulin Syringes | BD (Mississauga, ON, Canada) | BD329461 | Lo-Dose sterile syringes with permanent BD Micro-Fine IV needle - 1 mL |
| Daniel's strain of TMEV | kindly provided by Robert Fujinami (University of Utah) | - | 3 x 105 plaque-forming units aliquot(s) |
| Disinfectant, e.g. VennoVet 1 super | Menno Chemie Vertriebsgesellschaft GmbH, Germany | - | Recommended by campus veterinarians with less than or equal to 5% alcohol |
| Fisherbrand medium sterile Alcohol prep pad C7 | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 22-363-750 | |
| Fluriso | VETone (Boise, ID, U.S.A) | 502017 | Isoflurane 250 mL, 2%–5% |
| Fume absorber | Labconco (Kansas City, MO, U.S.A.) | - | - |
| General Protection Disposable SMS White Lab Coats | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 17-100-810A | |
| GraphPad Prism version 9 | (La Jolla, CA, U.S.A.) | ||
| Ice bucket | - | - | any |
| Microsoft Excel Microsoft | (Redmond, WA, U.S.A.) | ||
| Microsoft Word Microsoft | (Redmond, WA, U.S.A.) | ||
| Mouse cage | - | - | any mouse cage holding at least 5 mice |
| PrecisionGlide needles | BD (Mississauga, ON, Canada) | 329652 | BD Slip Tip with PrecisionGlide Needle Insulin Syringes - 26 G x 3/8 - 0.45 mm x 10 mm |
| Self-Sealing Sterilizing Pouch | Fisher Scientific (Hampton, NY, U.S.A.) | NC9241087 | 12.6 x 25.5 cm |
| Small glass flask | - | - | any, volume 25 mL |
| sterile PBS | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 10010056 | |
| Stir bar | Carl Roth GmbH & CO. KG | X171.1 | size according to volume of solution |
| Stir plate | Carl Roth GmbH & CO. KG | AAN2.1 | |
| Syringe Luer-Lok | BD (Mississauga, ON, Canada) | 309628 | 1 mL syringe only |
| Ultrasonic Cleaner, Heater/Mechanical Timer | Cole-Parmer (Vernon Hills, IL, U.S.A.) | EW-08895-23 | Bath sonicator - 0.5 gal, 115 V |
| Vehicle solution | - | - | depending on compound vehicle |
| Vortex REAX | Heidolph Instruments GmbH & Co. KG, Germany | 541-10000-00 |
Ссылки
- Getts, D. R., Balcar, V. J., Matsumoto, I., Müller, M., King, N. J. Viruses and the immune system: their roles in seizure cascade development. Journal of Neurochemistry. 104 (5), 1167-1176 (2008).
- Libbey, J. E., Fujinami, R. S. Neurotropic viral infections leading to epilepsy: Focus on Theiler's murine encephalomyelitis virus. Future Virology. 6 (11), 1339-1350 (2011).
- Vezzani, A., et al. Infections, inflammation and epilepsy. Acta Neuropathologica. 131 (2), 211-234 (2016).
- Misra, U. K., Tan, C. T., Kalita, J. Viral encephalitis and epilepsy. Epilepsia. 49, 13-18 (2008).
- Libbey, J. E., et al. Seizures following picornavirus infection). Epilepsia. 49 (6), 1066-1074 (2008).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Development of postinfection epilepsy after Theiler's virus infection of C57BL/6 mice. Journal of Neuropathology and Experimental Neurology. 69 (12), 1210-1219 (2010).
- Stewart, A. M., et al. Perspectives of zebrafish models of epilepsy: What, how and where next. Brain Research Bulletin. 87 (2-3), 135-143 (2012).
- Bröer, S., et al. Brain inflammation, neurodegeneration and seizure development following picornavirus infection markedly differ among virus and mouse strains and substrains. Experimental Neurology. 279, 57-74 (2016).
- Bröer, S., et al. Viral mouse models of multiple sclerosis and epilepsy: Marked differences in neuropathogenesis following infection with two naturally occurring variants of Theiler's virus BeAn strain. Neurobiology of Disease. 99, 121-132 (2017).
- Loewen, J. L., Barker-Haliski, M. L., Dahle, E. J., White, H. S., Wilcox, K. S. Neuronal Injury, gliosis, and glial proliferation in two models of temporal lobe epilepsy. Journal of Neuropathology and Experimental Neurology. 75 (4), 366-378 (2016).
- Bell, L. A., Wallis, G. J., Wilcox, K. S. Reactivity and increased proliferation of NG2 cells following central nervous system infection with Theiler's murine encephalomyelitis virus. Journal of Neuroinflammation. 17 (1), 369 (2020).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Theiler's virus infection chronically alters seizure susceptibility. Epilepsia. 51 (8), 1418-1428 (2010).
- Buenz, E. J., Rodriguez, M., Howe, C. L. Disrupted spatial memory is a consequence of picornavirus infection. Neurobiology of Disease. 24 (2), 266-273 (2006).
- Tramoni-Negre, E., Lambert, I., Bartolomei, F., Felician, O. Long-term memory deficits in temporal lobe epilepsy. Revue Neurologique. 173 (7-8), 490-497 (2017).
- Ponds, R. W., Hendriks, M. Cognitive rehabilitation of memory problems in patients with epilepsy. Seizure. 15 (4), 267-273 (2006).
- Sloviter, R. S. Experimental status epilepticus in animals: What are we modeling. Epilepsia. 12, 11-13 (2009).
- Löscher, W. Animal models of seizures and epilepsy: Past, present, and future role for the discovery of antiseizure drugs. Neurochemical Research. 42 (7), 1873-1888 (2017).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Metcalf, C. S., et al. Screening of prototype antiseizure and anti-inflammatory compounds in the Theiler's murine encephalomyelitis virus model of epilepsy. Epilepsia Open. 7 (1), 46-58 (2021).
- Daniels, J. B., Pappenheimer, A. M., Richardson, S. Observations on encephalomyelitis of mice (DA strain). Journal of Experimental Medicine. 96 (6), 517-530 (1952).
- Käufer, C., et al. Chemokine receptors CCR2 and CX3CR1 regulate viral encephalitis-induced hippocampal damage but not seizures. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8929-8938 (2018).
- Libbey, J. E., et al. The effects of diet on the severity of central nervous system disease: One part of lab-to-lab variability. Nutrition. 32 (7-8), 877-883 (2016).
- Racine, R. J. Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Kim, J. E., Cho, K. O. The pilocarpine model of temporal lobe epilepsy and EEG monitoring using radiotelemetry system in mice. Journal of Visualized Experiments. (132), e56831 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Tu, L., et al. Free-floating immunostaining of mouse brains. Journal of Visualized Experiments. (176), e62876 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены