Method Article
Un modèle d’épilepsie d’étiologie infectieuse utilisant le virus de l’encéphalomyélite murine de Theiler
Dans cet article
Résumé
L’infection intracérébrale par le virus de l’encéphalomyélite murine de Theiler (TMEV) chez les souris C57BL/6 reproduit bon nombre des symptômes cliniques précoces et chroniques de l’encéphalite virale et de l’épilepsie subséquente chez les patients humains. Cet article décrit l’infection virale, les symptômes et l’histopathologie du modèle TMEV.
Résumé
L’une des principales causes de l’épilepsie est une infection du système nerveux central (SNC); Environ 8% des patients qui survivent à une telle infection développent une épilepsie en conséquence, les taux étant significativement plus élevés dans les pays moins développés économiquement. Ce travail donne un aperçu de la modélisation de l’épilepsie de l’étiologie infectieuse et de son utilisation comme plate-forme pour de nouveaux tests de composés antiépileptiques. Un protocole d’induction de l’épilepsie par injection intracérébrale non stéréotaxique du virus de l’encéphalomyélite murine de Theiler (TMEV) chez des souris C57BL / 6 est présenté, qui reproduit de nombreux symptômes cliniques précoces et chroniques de l’encéphalite virale et de l’épilepsie subséquente chez les patients humains. L’évaluation clinique de souris au cours de l’encéphalite pour surveiller l’activité épileptique et détecter les effets antiépileptiques potentiels de nouveaux composés est décrite. En outre, les conséquences histopathologiques de l’encéphalite virale et des convulsions telles que les lésions de l’hippocampe et la neuroinflammation sont montrées, ainsi que les conséquences à long terme telles que les crises d’épilepsie spontanées. Le modèle TMEV est l’une des premières plateformes expérimentales translationnelles axées sur les infections à permettre l’étude des mécanismes de développement de l’épilepsie à la suite d’une infection du SNC. Ainsi, il sert également à identifier des cibles thérapeutiques potentielles et des composés pour les patients à risque de développer une épilepsie suite à une infection du SNC.
Introduction
L’une des conséquences fréquentes de l’encéphalite virale est les crises d’épilepsie. De nombreuses infections virales déclenchent des crises symptomatiques pendant la phase aiguë de l’infection; Le risque de telles crises est augmenté de plus de 20% chez le grand public 1,2,3. Les patients qui survivent à l’infection ont également un risque accru de 4% à 20% de développer une épilepsie chronique dans les mois ou les années suivant l’infection 1,4. Le virus de l’encéphalomyélite murine de Theiler (TMEV) a été identifié comme un virus approprié pour étudier les crises aiguës et chroniques dans un modèle murin d’encéphalite virale 5,6,7. Le TMEV est un virus à ARN simple brin non enveloppé, de sens positif, de la famille des Picornaviridae et a traditionnellement été utilisé pour étudier la démyélinisation dans la moelle épinière des souris SJL, contre lesquelles les souris C57BL/6 (B6) sont protégées parce qu’elles ont la capacité d’éliminer le virus rapidement après l’infection. Cependant, le TMEV induit des crises aiguës chez 50% à 75% des souris B6 mâles et femelles au cours de la première semaine suivant l’infection (pi), tandis qu’environ 25% à 40% développent une épilepsie chronique de semaines à mois pi 2,5,6,8,9. Outre les convulsions, les souris présentent également l’histopathologie commune d’un hippocampe épileptique avec neurodégénérescence et gliose 5,6,8,10,11,12. De plus, les souris B6 infectées par le TMEV obtiennent des résultats significativement moins bons dans les tests comportementaux d’apprentissage et de mémoire et présentent une comorbidité cognitive, ce qui est également observé chez les patients cliniques atteints d’épilepsie13,14,15.
Traditionnellement, les modèles d’épilepsie et de convulsions utilisent soit l’application de substances chimioconvulsivantes, soit la stimulation électrique pour provoquer des crises; Cependant, ces modèles manquent de validité conceptuelle et présentent souvent des crises et des lésions cérébrales plus graves que celles observées chez les patients cliniques16. Il n’existe pas de modèle approprié pour chaque question de recherche17. L’utilisation du modèle TMEV est particulièrement intéressante si les facteurs prédisposants au développement des crises après une infection du SNC sont étudiés ou si les composés sont examinés pour leur efficacité anticonvulsive.
Depuis que le modèle TMEV a été établi et utilisé dans plusieurs laboratoires différents à l’échelle internationale, les auteurs ont identifié de nombreux détails qui permettent une mise en œuvre réussie du modèle, par exemple, la spécificité des différentes souches de virus et de souris. L’induction de crises la plus fiable a été générée avec la souche de Daniel de souris TMEV et B6J 2,5,6,8,9. Le modèle est actuellement utilisé par le National Institute of Neurological Disorders and Stroke (NINDS) comme plate-forme pour identifier de nouveaux médicaments contre l’épilepsie et les crises18,19. Cet article comprend le protocole détaillé de l’induction virale et de la surveillance clinique pour permettre à d’autres chercheurs d’utiliser ce modèle d’encéphalite virale pour approfondir la compréhension des mécanismes de la maladie, ainsi que pour les tests de médicaments.
Le protocole suivant reflète une étude conçue pour les tests de composés dans ce modèle, bien que de nombreux autres types d’études puissent être effectués. Les souris sont anesthésiées brièvement avant l’injection avec la souche de Daniel de TMEV dans la région temporale de l’hémisphère droit (postérieur et médial à l’œil droit). Selon la question de recherche, si des animaux témoins non infectés sont nécessaires, les souris reçoivent une solution saline tamponnée au phosphate stérile (PBS, pH 7,4, y compris KH 2 PO 4 [1,06 mM], NaCl [155,17 mM] et Na 2 HPO4·7H 2 O [2,97mM]) au lieu de TMEV. L’expérience antérieure chez des souris infectées par le TMEV a indiqué que les crises induites par la manipulation se produisent entre le jour 3 et le jour 7 après l’infection. La fréquence de l’injection, la voie et le moment de l’essai des composés expérimentaux varient en fonction de leurs propriétés. Il est recommandé d’effectuer l’inoculation du virus un vendredi, ce qui permet de surveiller les crises du jour 3 au 7 la semaine suivante, du lundi au vendredi. Au cours de la semaine de surveillance des crises, les composés expérimentaux peuvent être administrés (i.p.) deux fois par jour (à au moins 4 heures d’intervalle), sauf indication contraire de la cinétique ou du mécanisme d’action du composé. La surveillance des crises pendant le traitement peut être effectuée à un moment préalablement déterminé. Les temps d’injection et d’observation varient en fonction des composés individuels. Les animaux sont injectés avec la substance d’essai ou avec un véhicule à la place du composé médicamenteux. Ces deux groupes peuvent être manipulés et observés de manière analogue au groupe expérimental. Au cours de l’expérience, la seule personne manipulant les souris et marquant les crises doit être aveuglée par le traitement.
Protocole
Toutes les procédures décrites ont été autorisées par les autorités respectives. Les animaux sont maintenus conformément aux recommandations du « Guide for Care and Use of Laboratory Animals » (Conseil national de recherches) et conformément à la politique du Service de santé publique et au Comité institutionnel de soin et d’utilisation des animaux de l’Université de l’Utah, protocole animal (numéro: 21-11009, Département de pharmacologie et de toxicologie) et à la Freie Universität Berlin (protocole: G0015/21, LAGeSo Berlin, Institut de pharmacologie et de toxicologie), respectivement. Les résultats présentés à la figure 3 et à la figure 5 ont été approuvés sous 33.9-42502-04-11/0516 et 33.9-42502-04-15/1892 (LAVES Oldenburg, Département de pharmacologie, toxicologie et pharmacie, Université de médecine vétérinaire de Hanovre).
1. Considérations et préparatifs pour la conception de l’étude
- Virus
- La souche de TMEV de Daniel a été aimablement fournie par Robert Fujinami de l’Université de l’Utah. À l’origine, il a été isolé d’une souris dans la colonieHarvard 20. Renseignez-vous sur la classification et la réglementation spécifiques des agents biologiques dans les pays respectifs avant de manipuler le TMEV et discutez avec le personnel de biosécurité de l’établissement pour assurer la conformité aux réglementations. En règle générale, le TMEV est classé BSL 2, selon la souche et les modifications génétiques. La dose standard nécessaire pour induire des crises chez la majorité des animaux est de 3 x 105 unités formant des plaques (UFP).
NOTE: La dose peut devoir être adaptée, par exemple, si des souris transgéniques sont utilisées. Dans l’ensemble, des titres compris entre 2 x 104 PFU et 2,44 x 107 PFU ont été utilisés pour induire avec succès des crises. Les animaux témoins reçoivent du PBS stérile et ne présentent pas de convulsions. Le virus n’infecte pas les humains; toutefois, l’EPI (blouse de laboratoire, gants, lunettes de sécurité) devrait être porté par les expérimentateurs en tout temps, et les carcasses de souris et la litière devraient être autoclavées avant d’être éliminées.
- La souche de TMEV de Daniel a été aimablement fournie par Robert Fujinami de l’Université de l’Utah. À l’origine, il a été isolé d’une souris dans la colonieHarvard 20. Renseignez-vous sur la classification et la réglementation spécifiques des agents biologiques dans les pays respectifs avant de manipuler le TMEV et discutez avec le personnel de biosécurité de l’établissement pour assurer la conformité aux réglementations. En règle générale, le TMEV est classé BSL 2, selon la souche et les modifications génétiques. La dose standard nécessaire pour induire des crises chez la majorité des animaux est de 3 x 105 unités formant des plaques (UFP).
- Animaux
- Pour induire et étudier les crises, utilisez des souris B6J, car les autres souches de souris ne présentent pas nécessairement de crises, par exemple, les souris SJL/J, FVB/N ou Balb/c5. Il n’y a pas de différence entre les souris femelles et mâles dans la fréquence des crises aiguës5. Effectuer les expériences sur des souris adolescentes à adultes (à partir de 5-6 semaines).
- Diète
- Le régime alimentaire a été déterminé comme une source de variabilité de la gravité de la maladie d’un laboratoire à l’autre; Par conséquent, considérez le régime alimentaire comme un facteur potentiel de variation22.
- Taille du groupe
- Étant donné que tous les animaux ne développent pas de crises aiguës ou chroniques dans ce modèle, utilisez environ 20 souris/groupe pour les tests de composés.
- Bien-être animal
- Si une souris démontre des effets indésirables importants de l’infection ou de l’administration du composé expérimental (p. ex. léthargie, mauvais toilettage, rougeur excessive et écoulement purulent de la plaie) après un temps d’observation déterminé par les directives locales de l’IACUC (p. ex., 48 h), euthanasier la souris sans cruauté.
- Euthanasier toute souris présentant une perte de poids corporel extrême (>20%) pendant la période d’infection sans cruauté.
- Si les animaux ne mangent pas correctement, donnez-leur accès à des granulés supplémentaires humidifiés avec une solution électrolytique pédiatrique ou similaire.
2. Inoculation du virus
- Stérilisation de la seringue d’injection
- Retirez le capuchon de la seringue à insuline. Ajouter un tube en polyéthylène comme collier autour de l’aiguille pour assurer une profondeur d’injection adéquate de 2,5 mm. Immerger la seringue dans de l’éthanol pendant 30 min. Placez la seringue sous lumière UV pendant 30 min.
- Remettez le capuchon sur l’aiguille. Enveloppez la seringue dans un sachet stérilisant et collez-la fermée. Étiquette avec la date de préparation.
- Injection de virus
- Procurez-vous des aliquotes de la souche TMEV de Daniel dans le congélateur à −80 °C. Décongelez le virus et gardez-le sur la glace. Évitez de décongeler et de recongeler le virus. Charger la seringue avec la suspension virale (3 x 105 PFU diluées dans 20 μL de PBS ou de milieu de culture DMEM).
ATTENTION : Le virus est infectieux pour les souris mais pas pour les humains. - Nettoyez le banc avec un désinfectant et travaillez sous un absorbeur de fumée. L’inoculation du virus n’est pas stérile mais aussi propre que possible.
- Transférez la souris dans la chambre d’induction de l’anesthésie et utilisez 2% d’isoflurane dans l’oxygène pour induire l’anesthésie. Atteindre la tolérance chirurgicale prend quelques minutes; Ajustez la concentration en fonction de la respiration de l’animal et de la profondeur de l’anesthésie.
- Transférez la souris anesthésiée de la boîte d’anesthésie sous le capot. Vérifiez la tolérance chirurgicale, par exemple, en pinçant les orteils. L’ensemble de la procédure est effectué en moins de 30 s, de sorte que l’animal n’a pas besoin d’inhaler de l’isoflurane pendant l’injection. Ajouter une pommade pour les yeux pour éviter le dessèchement de la cornée.
- Nettoyez la tête de l’animal avec un tampon d’alcool. Inclinez légèrement la tête de la souris vers la gauche afin que le site d’injection pointe vers le haut.
- Tirez un peu la peau vers l’arrière, insérez l’aiguille dans la tête et injectez 20 μL par voie intracorticale à une profondeur de 2,5 mm dans la région temporale de l’hémisphère droit (postérieur et médial à l’œil droit).
- Effectuer l’injection unilatéralement dans le même hémisphère chez tous les animaux. Utilisez l’œil et l’oreille comme points de repère pour l’emplacement du cortex pariétal. Le placement a déjà été vérifié histologiquement; voir la figure 1. Les coordonnées d’injection selon l’injection stéréotaxique en relation avec le bregma sont de -2,0 (AP); +3,0 (ML); −1,5 (DV).
- Laissez la seringue en place pendant 5-15 s. Notez s’il y a une fuite de l’injection ou si des bulles d’air sont visibles - dans ce cas, préparez une nouvelle seringue. Lorsque vous retirez soigneusement la seringue, tournez-la légèrement. Appliquez une pommade pour les yeux pour prévenir la sécheresse sous anesthésie.
- FACULTATIF: Codez l’animal sur la queue ou l’oreille en fonction des procédures locales (facultatif mais facile car l’animal est inconscient).
- Transférer l’animal dans une nouvelle cage, qui est placée à moitié sur ou à moitié d’un coussin chauffant (35-40 °C) pendant la récupération de l’anesthésie. Ne laissez pas les animaux sans surveillance jusqu’à ce qu’ils aient repris suffisamment conscience pour maintenir une position couchée sternale.
REMARQUE : Les animaux peuvent être logés à nouveau en groupe après leur rétablissement (les animaux infectés ne sont pas mélangés avec des animaux infectés fictifs). Les souris infectées ne doivent pas être logées dans la même pièce que les souris non infectées. - Gardez une trace du poids des souris pendant les 7 premiers jours pi, car elles perdent du poids après l’infection et peuvent nécessiter une alimentation supplémentaire.
- Procurez-vous des aliquotes de la souche TMEV de Daniel dans le congélateur à −80 °C. Décongelez le virus et gardez-le sur la glace. Évitez de décongeler et de recongeler le virus. Charger la seringue avec la suspension virale (3 x 105 PFU diluées dans 20 μL de PBS ou de milieu de culture DMEM).
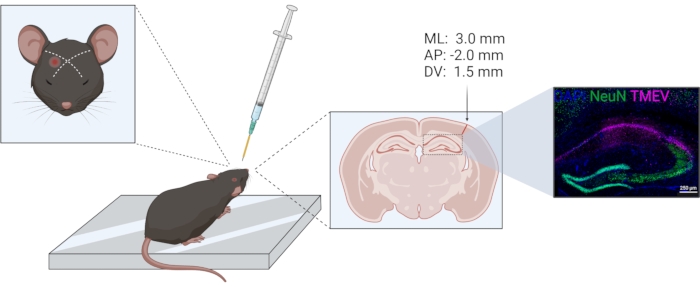
Figure 1 : Schéma de la procédure d’injection de TMEV. De gauche à droite : Pour une injection du cortex pariétal droit, l’aiguille est injectée légèrement latéralement d’une ligne imaginaire entre l’œil et l’oreille opposée. Le collier pour le contrôle de la profondeur est indiqué en jaune. Le tractus d’injection peut être vu dans la section du cerveau coronal, marquée par la flèche. Le site d’injection correspond aux coordonnées indiquées au-dessus de la flèche. L’image de droite montre la distribution du virus Theiler (violet) au sein du CA1 de la formation hippocampique. La figure a été préparée à l’aide de biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Essais de composés
- Préparation de composés
- Passez en revue les instructions de formulation. Préparer la solution du véhicule conformément aux recommandations ou aux instructions fournies. À titre d’exemple, la procédure pour le médicament antiépileptique lévétiracétam (LEV) est présentée. Le VET réduit le fardeau convulsif à 30 à 40 % des niveaux du véhicule à une dose de 350 mg/kg. Le véhicule utilisé dans cette étude est 0,5% de méthylcellulose.
- Calculer les doses en fonction du composé. Pesez le médicament selon le calcul. Pour traiter 1 kg de souris, pesez 350 mg de LEV.
- Préparer une solution mère avec le volume approprié de solution du véhicule, conformément aux instructions de formulation (p. ex., sonication, excipients du véhicule, etc.). En considérant un volume d’injection de 0,01 mL/g de souris, le volume d’injection pour 1 kg serait de 10 mL avec 350 mg de LEV, ce qui donnerait une solution de 35 mg/mL19. Indiquez le calcul, la dose en mg/kg et le volume en mL.
REMARQUE : Un exemple de protocole se trouve à la page 2 du document supplémentaire 1.
- Administration de composés
- Randomiser les cages en fonction du véhicule ou du groupe composé. Utilisez des souris simulées infectées pour des études sur les mécanismes de développement de l’épilepsie ou à des fins de validation, mais pas pour le dépistage systématique des médicaments.
- Signalez les conditions environnementales telles que la température, l’humidité, l’heure de la journée, etc.
- Vortex la solution avec le composé ainsi que la solution du véhicule. Aspirez le véhicule ou le composé dans une seringue et codez les seringues par couleur pour éviter toute confusion.
- Pesez les animaux. Assurez-vous que les souris B6J sont >18 g au jour 3 pi (non arrondi). Indiquez le poids.
- Administrer le composé (p. ex. par injection intrapéritonéale ou par d’autres voies appropriées). Écrivez l’heure et le chemin d’administration.
- Surveillez les animaux pour tout changement de comportement après l’administration du composé, en particulier après les premières injections. Si des crises se produisent, déclarez l’intensité des crises selon l’échelle de Racine23; Voir l’étape 3.2.
REMARQUE : Un exemple de protocole pour l’administration de composés se trouve dans le matériel supplémentaire 1, page 3, tandis que les convulsions observées pendant l’administration seraient consignées dans le matériel supplémentaire 1, pages 4-5.
- Surveillance des crises provoquées par la manipulation
- Effectuer cette procédure par un expérimentateur aveugle au traitement. Apportez toutes les cages sur le banc. Observez les animaux pour les convulsions 2x par jour pendant la phase de lumière.
- Noter l’activité épileptique par une échelle de Racine modifiée23: 0 = aucun changement de comportement, 1 = mouvements de la bouche et du visage, 2 = hochement de tête, 3 = clonus unilatéral des membres antérieurs, 4 = clonus bilatéral des membres antérieurs avec élevage, 5 = activité tonico-clonique généralisée avec perte de tonus postural, parfois saut, 6 = saut prolongé et excessif et hyperactivité. Indiquez le nombre et l’intensité des crises.
- Faites glisser un stylo sur la cage pour faire du bruit.
- Transférer chaque animal dans une autre boîte et inversement.
- Secouez doucement la cage en faisant un mouvement de va-et-vient, en prenant soin de ne pas secouer la cage si vigoureusement que les animaux frapperont les côtés ou le haut de la cage et risquent de subir des blessures physiques.
- Surveillez tous les animaux dans la cage pour détecter les convulsions. À tout moment, si une souris a une crise, transférez-la dans la cage de la maison et notez le niveau de la crise sans autre stimulation de la crise par le bruit ou la manipulation.
- Pour les animaux qui ne se sont pas saisis spontanément ou après une légère secousse de la cage, déclenchez des crises par une manipulation plus intense: Retournez soigneusement la souris en la retournant à sa queue de gauche à droite.
REMARQUE: Les animaux ayant des crises sont hyperexcitables et peuvent être nerveux. - Observez à nouveau chaque animal pour le comportement convulsif. Répétez le processus pour les cages suivantes.
REMARQUE : Un exemple de protocole pour la surveillance des saisies se trouve dans le document supplémentaire 1, pages 6 et 7.
- Rapport de données sur les effets composés
- Analyser le poids corporel quotidien à l’aide de l’ANOVA à mesures répétées (RM).
- Utilisez les valeurs cumulatives quotidiennes du fardeau des saisies pour obtenir une représentation graphique des données. Présentez les données d’efficacité (nombre d’animaux sans crises de Racine de stade 3 à 5) comme le nombre de personnes protégées/le nombre de tests dans chaque groupe respectif (habituellement N = 20). Par conséquent, comparez les données entre les groupes de véhicules et les groupes traités par drogue pour les réponses (saisies ou non) à l’aide d’un test de Fisher exact.
REMARQUE : Un animal est considéré comme « protégé » contre les crises d’épilepsie s’il a une crise de stade 2 ou moins et que les animaux non protégés ont des crises des stades 3 à 5. - Analyser les données de tolérabilité de la même manière, comme le nombre d’animaux présentant des troubles du comportement ou des effets toxiques / le nombre testé dans chaque groupe. Notez tous les effets indésirables, y compris les décès.
- Si moins de 50% des souris injectées avec le véhicule saisissent de manière aiguë, ne tenez pas compte des données.
Résultats
Effets composés sur les crises aiguës
Les crises comportementales sont enregistrées si elles se produisent pendant l’injection de drogues (ID) ou pendant les séances subséquentes de manipulation et de surveillance des crises AM/PM. Les convulsions observées lors des crises de manipulation peuvent être présentées sous forme de carte thermique, qui est illustrée à la figure 2 pour le VET (350 mg/kg). Pour l’analyse du fardeau épileptique, la moyenne des valeurs cumulatives finales (jour 7) de la charge convulsive pour le groupe traité par véhicule est prise et comparée par le test U de Mann-Whitney au groupe composé traité (les valeurs du fardeau convulsif comprennent celles recueillies lors de l’observation post-injection). Pour l’efficacité du composé, un test de Fisher exact détermine s’il existe une différence statistique d’efficacité entre les groupes traités par véhicule et par médicament. De même, les données de tolérabilité sont analysées avec le test exact de Fisher. L’analyse du poids corporel est effectuée par ANOVA à mesures répétées pour déterminer les changements au cours de l’expérience, ainsi que les différences entre les souris traitées par composé et par véhicule.
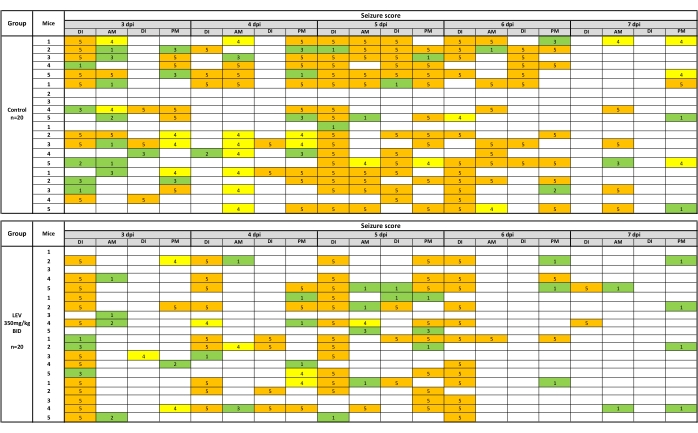
Figure 2 : Carte thermique des crises comportementales après essai avec véhicule (0,5 % de méthylcellulose) ou LEV (350 mg/kg). Des injections deux fois par jour ont eu lieu 1 heure avant les observations de manipulation et de convulsions. Les crises comportementales ont été enregistrées si elles se sont produites pendant l’injection de drogues (ID) ou au cours des séances subséquentes de manipulation et de surveillance des crises AM/PM. Le VET (350 mg/kg) réduit considérablement les crises observées pendant les séances de manutention (35,9 % de la charge de saisie du véhicule) au cours de la période d’observation de 5 jours. La carte thermique est créée en représentant les crises de stade 1 à 3 en vert, 4 en jaune et 5 en orange. Cette nouvelle figure a été créée à partir d’un ensemble de données publié19. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Épilepsie chronique
Outre le fardeau des crises signalées au cours de la première semaine pi, il existe plusieurs lectures qui pourraient être utiles selon l’étude et l’hypothèse. Si les animaux sont gardés à long terme, un sous-ensemble d’animaux infectés développera des crises d’épilepsie spontanées à plusieurs semaines pi, qui se produisent moins fréquemment que les crises aiguës et, par conséquent, nécessitent un enregistrement EEG. Afin d’enregistrer l’EEG de souris, des électrodes doivent être implantées dans une chirurgie stéréotaxique24. La figure 3 montre divers événements épileptiques dans la phase chronique par enregistrement EEG chez des souris infectées par TMEV8.
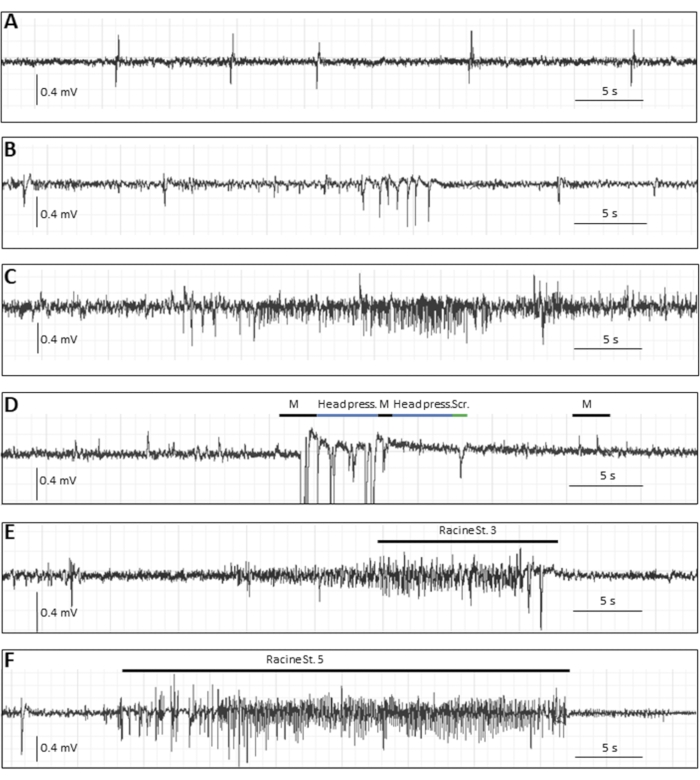
Figure 3 : Traces typiques d’EEG dans la phase chronique (14 semaines pi) suivant l’infection par le virus DA chez la souris. (A-C) Événements EEG représentatifs dans lesquels aucun corrélat moteur comportemental n’a été observé, c’est-à-dire (A) pointes simples, (B) grappes de pointes, (C) ainsi qu’une crise électrographique, vraisemblablement focale. (D-F) Événements EEG représentatifs avec corrélats comportementaux. La souris illustrée en D présentait des crises d’épilepsie avec des secousses myocloniques (indiquées par « M », accompagnées d’artefacts de mouvement), des mouvements stéréotypés (indiqués par une « pression sur la tête », lorsque la souris appuyait la tête à plat sur le sol) ou un arrêt comportemental; « Scr » décrit un artefact de mouvement de grattage, (E) et (F) montrent des altérations EEG typiques lors de crises convulsives généralisées : (E) une crise de stade Racine 3 d’une durée de 22 s et 1 Hz, et (F) une crise de stade 5 d’une durée de 34 s et 5,4 Hz. Cette figure a été publiée avantle 8 et est réimprimée avec la permission d’Elsevier. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Histologie
Étant donné que l’épilepsie et les convulsions s’accompagnent généralement d’une pathologie hippocampique chez les patients, qui est récapitulée dans des modèles expérimentaux, la plupart des laboratoires analysent également les modifications de l’hippocampe ou l’effet d’un traitement antiépileptique potentiel sur la pathologie. Les paramètres couramment analysés comprennent la neurodégénérescence et le rétrécissement de l’hippocampe, ainsi que l’inflammation par marquage pour des populations de cellules immunitaires spécifiques. Pour de telles analyses, à la fin de l’expérience, les souris sont profondément anesthésiées jusqu’à ce que l’arrêt respiratoire se produise et que la fréquence cardiaque ralentisse considérablement ou présente une arythmie. Le sang est éliminé par perfusion intracardique de PBS suivie de 4% de paraformaldéhyde (PFA)25 pour fixer le tissu. Le tissu est ensuite traité par cryosectionnement et coloration (immunitaire)26, suivie d’analyses microscopiques.
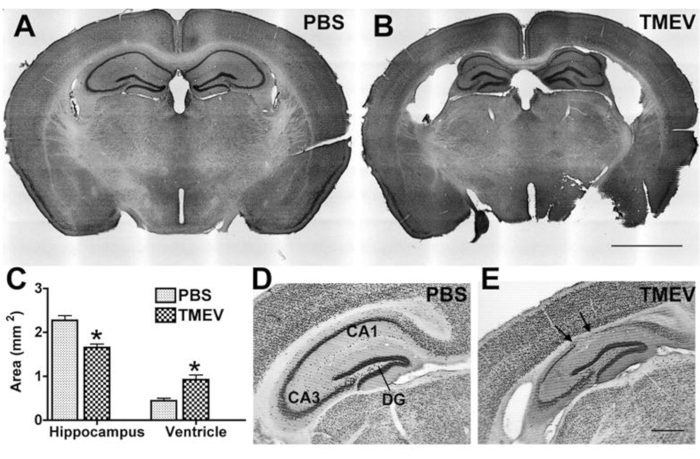
Figure 4 : Dégénérescence hippocampique chez des souris épileptiques infectées par le TMEV. (A,B) Les coupes coronales colorées au violet crésyle montrent une cytoarchitecture normale chez une souris témoin (A) (PBS) et une dégénérescence hippocampique chez une souris TMEV (B) à 2 mois pi. Remarque: ventricules latéraux élargis, effondrement de l’alvéus et amincissement de la couche cellulaire pyramidale. (C) La quantification de ces dommages montre une diminution significative de la surface de l’hippocampe et une augmentation correspondante de la surface ventriculaire des souris TMEV (N = 7) par rapport aux souris PBS (N = 6; les données sont moyennes ± SEM; p < 0,001; Test t de l’étudiant). (D, E) Le marquage NeuN illustre en outre l’ampleur de la perte de cellules neuronales dans les coupes prises à 6 mois pi. Les flèches indiquent les régions avec une perte complète de cellules pyramidales. (E) Le gyrus denté semble être relativement intact même chez les souris épileptiques. Barre d’échelle = (A,B) 2 mm; (D,E) 0,5 mm. Cette figure a été publiée avantle 6 et est reproduite avec la permission d’Oxford University Press. Veuillez cliquer ici pour voir une version agrandie de cette figure.
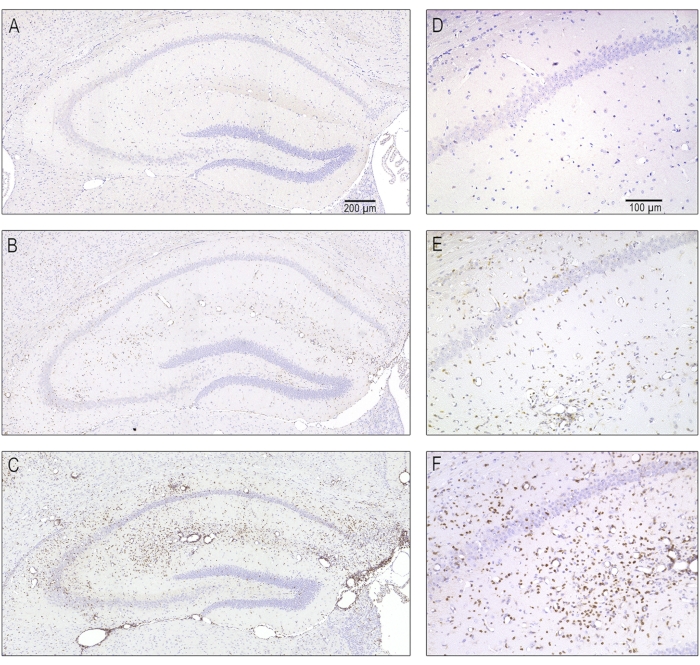
Figure 5 : Photomicrographies représentatives de différentes sévérités d’infiltration de lymphocytes T due à une encéphalite aiguë 7 jours après l’infection. Des coupes en série contenant l’hippocampe dorsal ipsilatéral ont été colorées avec des anticorps contre CD3 afin de marquer les lymphocytes T. (A,D) Un hippocampe normal sans infiltration de lymphocytes T tel qu’il est apparu chez les animaux simulés infectés. (B, E) Infiltration modérée des lymphocytes T observée chez la majorité des souris infectées par le TMEV. (C, F) Une infiltration sévère de lymphocytes T, qui n’a été observée que chez certaines des souris infectées. Cette figure a été publiée avantle 8 et est réimprimée avec la permission d’Elsevier. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Le dossier supplémentaire comprend le formulaire utilisé pour les essais de composés dans le modèle TMEV. La page 1 donne un aperçu de la configuration expérimentale. Les informations sur le composé, le véhicule et la préparation de la solution composée sont consignées aux pages 1-2. L’application composée est consignée à la page 3. Les feuilles de notation des pages 4-5 sont utilisées pour enregistrer les crises observées et quantifiées par l’expérimentateur effectuant l’injection du composé. À la page 4, des données peuvent être recueillies pour les cages 1 à 4 de 5 souris chacune, et à la page 5, les cages 5 à 8 peuvent être enregistrées, ce qui correspond au nombre standard d’animaux pour les tests composés entre nos mains. Les feuilles de notation des pages 6 et 7 sont utilisées par l’observateur en aveugle qui effectue l’observation, la manipulation et le brassage doux de la cage 1 h après chaque injection composée. Encore une fois, les scores de saisie peuvent être notés pour huit cages au total sur ces feuilles de pointage exemplaires. La dernière page 8 peut être utilisée pour enregistrer toute autre observation ou note. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Il s’agit du premier modèle de rongeurs basé sur l’infection pour l’épilepsie qui permet d’étudier le développement de crises aiguës et chroniques. Il aidera à identifier des cibles médicamenteuses et de nouveaux composés pour la prévention ou la modification de maladies pour l’une des étiologies les plus courantes de l’épilepsie.
Comme il est décrit ci-dessus, il peut être nécessaire d’examiner attentivement le lot et le titre viral pour s’assurer qu’une proportion adéquate de souris traitées par TMEV présentent des crises induites par la manipulation. Si les animaux ont moins de crises que d’habitude, utilisez un lot de N = 20 animaux pour vérifier l’efficacité du virus. Si son activité est diminuée (moins de 50%), il est temps de fabriquer de nouvelles aliquotes et de les tester avec N = 20 animaux. Si les nouvelles aliquotes ne sont pas plus efficaces, un nouveau lot du virus doit être purifié. Pour certaines lignées de souris transgéniques, il peut être nécessaire d’utiliser un titre viral inférieur; Par conséquent, le titre viral doit être dilué au besoin après des expériences préliminaires. La plupart des données disponibles sur les souris B6 provenaient des laboratoires Jackson (Bar Harbor, ME, États-Unis ou Charles River, Sulzfeld, Allemagne); cependant, des taux de saisie similaires chez les souris B6 obtenues de Harlan (Eystrup, Allemagne) ont été confirmés8. Les taux de saisie des animaux transgéniques ayant un fond B6 sont comparables à ceux des souris B6 de type sauvage, mais pourraient différer si les changements génétiques ont une influence sur l’invasion virale, la réponse inflammatoire ou la neurodégénérescence21. Les crises aiguës sont observées spontanément mais déclenchées par la manipulation et le bruit, il est donc de la plus haute importance de traiter tous les animaux de la même manière lorsque les taux de crise sont comparés. Les séances de manipulation deux fois par jour ont déjà fourni un fardeau épileptique élevé et une plus grande proportion de souris présentant des crises au cours des jours 3 à 7 suivant l’infection 6,8,19. Des séances de manipulation supplémentaires (jour 1 et jour 2) peuvent également être utilisées pour augmenter le fardeau des crises. De plus, les animaux peuvent être observés avant chaque séance de manipulation pour s’assurer qu’il n’y a pas de crises spontanées. Un environnement de laboratoire bruyant, par exemple, peut produire des convulsions, qui peuvent, à leur tour, rendre les animaux réfractaires aux crises induites par la manipulation pendant les périodes d’essai.
Bien que l’infection par le VRT produise des crises induites par la manipulation chez la majorité des souris, on ne sait pas pourquoi certains animaux sont résistants à ce traitement. Comme décrit ci-dessus, il se peut que des crises électrographiques (avec des comportements minimes ou inexistants) se produisent et ne soient normalement pas quantifiées sans enregistrement EEG concomitant. Il se peut également que de petites différences dans le lieu d’injection facilitent la réduction de l’effet viral dans le cerveau; Cependant, des convulsions ont été rapportées après une infection corticale et striatale 5,6,8,9 due au tropisme du virus à l’hippocampe. Pour les études de dépistage de drogues dans ce modèle, pour déterminer une réduction des crises (p. ex. une réduction de 50 % du fardeau épileptique), un plus grand nombre d’animaux est nécessaire pour chaque groupe (p. ex. N = 20). De plus, la variabilité des comportements épileptiques dans ce modèle nécessite de plus grandes différences dans les effets des médicaments par rapport aux véhicules pour identifier une réduction significative des crises. Par conséquent, l’une des limites de ce modèle est l’exigence de groupes de plus grande taille. Néanmoins, des tailles de groupe suffisantes permettent également d’identifier les effets anti-épileptiques et anti-inflammatoires dans ce modèle19.
La grande majorité des crises observables dans ce modèle se produisent pendant la période d’infection aiguë. Malgré la survenue d’une dégénérescence hippocampique, d’une activation des cellules immunitaires et de déficits cognitifs observés chez les souris traitées par TMEV, seule une petite partie des animaux traités finissent par développer des crises chroniques et spontanées. Ce faible fardeau global de crises nécessiterait un grand nombre de souris infectées afin d’étudier correctement les crises spontanées dans ce modèle, ce qui dépasse la portée et la capacité de nombreux projets. L’implantation d’électrodes en profondeur et la surveillance EEG augmenteraient également la charge des animaux de laboratoire. Bien que les électrodes de profondeur puissent aider à identifier l’activité épileptique spontanée, les changements dans l’anatomie de l’hippocampe après l’infection peuvent rendre difficile le placement cohérent des électrodes.
Le besoin urgent d’identifier de nouveaux traitements pour l’épilepsie nécessite le développement de modèles qui peuvent être utilisés comme méthode de dépistage rapide de l’efficacité anticonvulsivante. Ce modèle fournit des fonctionnalités pour répondre à cette demande urgente. De plus, le fait qu’il ne nécessite aucune chirurgie stéréotaxique en fait un modèle approprié et facile à réaliser pour l’investigation des composés antiépileptiques.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
SB est soutenu par une subvention de démarrage de la FU Berlin. KSW est soutenu par R37 NS065434 et la Fondation ALSAM. LAB est soutenu par un prix D-SPAN 1F99NS125773-01. Nous remercions Robert Fujinami, Ph.D. de nous avoir fourni le virus Theiler et le Cell Imaging Core Facility de l’Université de l’Utah pour son soutien en microscopie.
matériels
| Name | Company | Catalog Number | Comments |
| Absorbent paper | - | - | any |
| Analytical balance | Mettler Toledo (Columbus, OH, U.S.A.) | 30216542 | 0. 1 mg–220 g |
| Animal balance | Ohaus (Parsippany, NJ, U.S.A.) | STX2202 | 0.01 g–2200 g |
| BD Lo-Dose U-100 Insulin Syringes | BD (Mississauga, ON, Canada) | BD329461 | Lo-Dose sterile syringes with permanent BD Micro-Fine IV needle - 1 mL |
| Daniel's strain of TMEV | kindly provided by Robert Fujinami (University of Utah) | - | 3 x 105 plaque-forming units aliquot(s) |
| Disinfectant, e.g. VennoVet 1 super | Menno Chemie Vertriebsgesellschaft GmbH, Germany | - | Recommended by campus veterinarians with less than or equal to 5% alcohol |
| Fisherbrand medium sterile Alcohol prep pad C7 | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 22-363-750 | |
| Fluriso | VETone (Boise, ID, U.S.A) | 502017 | Isoflurane 250 mL, 2%–5% |
| Fume absorber | Labconco (Kansas City, MO, U.S.A.) | - | - |
| General Protection Disposable SMS White Lab Coats | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 17-100-810A | |
| GraphPad Prism version 9 | (La Jolla, CA, U.S.A.) | ||
| Ice bucket | - | - | any |
| Microsoft Excel Microsoft | (Redmond, WA, U.S.A.) | ||
| Microsoft Word Microsoft | (Redmond, WA, U.S.A.) | ||
| Mouse cage | - | - | any mouse cage holding at least 5 mice |
| PrecisionGlide needles | BD (Mississauga, ON, Canada) | 329652 | BD Slip Tip with PrecisionGlide Needle Insulin Syringes - 26 G x 3/8 - 0.45 mm x 10 mm |
| Self-Sealing Sterilizing Pouch | Fisher Scientific (Hampton, NY, U.S.A.) | NC9241087 | 12.6 x 25.5 cm |
| Small glass flask | - | - | any, volume 25 mL |
| sterile PBS | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 10010056 | |
| Stir bar | Carl Roth GmbH & CO. KG | X171.1 | size according to volume of solution |
| Stir plate | Carl Roth GmbH & CO. KG | AAN2.1 | |
| Syringe Luer-Lok | BD (Mississauga, ON, Canada) | 309628 | 1 mL syringe only |
| Ultrasonic Cleaner, Heater/Mechanical Timer | Cole-Parmer (Vernon Hills, IL, U.S.A.) | EW-08895-23 | Bath sonicator - 0.5 gal, 115 V |
| Vehicle solution | - | - | depending on compound vehicle |
| Vortex REAX | Heidolph Instruments GmbH & Co. KG, Germany | 541-10000-00 |
Références
- Getts, D. R., Balcar, V. J., Matsumoto, I., Müller, M., King, N. J. Viruses and the immune system: their roles in seizure cascade development. Journal of Neurochemistry. 104 (5), 1167-1176 (2008).
- Libbey, J. E., Fujinami, R. S. Neurotropic viral infections leading to epilepsy: Focus on Theiler's murine encephalomyelitis virus. Future Virology. 6 (11), 1339-1350 (2011).
- Vezzani, A., et al. Infections, inflammation and epilepsy. Acta Neuropathologica. 131 (2), 211-234 (2016).
- Misra, U. K., Tan, C. T., Kalita, J. Viral encephalitis and epilepsy. Epilepsia. 49, 13-18 (2008).
- Libbey, J. E., et al. Seizures following picornavirus infection). Epilepsia. 49 (6), 1066-1074 (2008).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Development of postinfection epilepsy after Theiler's virus infection of C57BL/6 mice. Journal of Neuropathology and Experimental Neurology. 69 (12), 1210-1219 (2010).
- Stewart, A. M., et al. Perspectives of zebrafish models of epilepsy: What, how and where next. Brain Research Bulletin. 87 (2-3), 135-143 (2012).
- Bröer, S., et al. Brain inflammation, neurodegeneration and seizure development following picornavirus infection markedly differ among virus and mouse strains and substrains. Experimental Neurology. 279, 57-74 (2016).
- Bröer, S., et al. Viral mouse models of multiple sclerosis and epilepsy: Marked differences in neuropathogenesis following infection with two naturally occurring variants of Theiler's virus BeAn strain. Neurobiology of Disease. 99, 121-132 (2017).
- Loewen, J. L., Barker-Haliski, M. L., Dahle, E. J., White, H. S., Wilcox, K. S. Neuronal Injury, gliosis, and glial proliferation in two models of temporal lobe epilepsy. Journal of Neuropathology and Experimental Neurology. 75 (4), 366-378 (2016).
- Bell, L. A., Wallis, G. J., Wilcox, K. S. Reactivity and increased proliferation of NG2 cells following central nervous system infection with Theiler's murine encephalomyelitis virus. Journal of Neuroinflammation. 17 (1), 369 (2020).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Theiler's virus infection chronically alters seizure susceptibility. Epilepsia. 51 (8), 1418-1428 (2010).
- Buenz, E. J., Rodriguez, M., Howe, C. L. Disrupted spatial memory is a consequence of picornavirus infection. Neurobiology of Disease. 24 (2), 266-273 (2006).
- Tramoni-Negre, E., Lambert, I., Bartolomei, F., Felician, O. Long-term memory deficits in temporal lobe epilepsy. Revue Neurologique. 173 (7-8), 490-497 (2017).
- Ponds, R. W., Hendriks, M. Cognitive rehabilitation of memory problems in patients with epilepsy. Seizure. 15 (4), 267-273 (2006).
- Sloviter, R. S. Experimental status epilepticus in animals: What are we modeling. Epilepsia. 12, 11-13 (2009).
- Löscher, W. Animal models of seizures and epilepsy: Past, present, and future role for the discovery of antiseizure drugs. Neurochemical Research. 42 (7), 1873-1888 (2017).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Metcalf, C. S., et al. Screening of prototype antiseizure and anti-inflammatory compounds in the Theiler's murine encephalomyelitis virus model of epilepsy. Epilepsia Open. 7 (1), 46-58 (2021).
- Daniels, J. B., Pappenheimer, A. M., Richardson, S. Observations on encephalomyelitis of mice (DA strain). Journal of Experimental Medicine. 96 (6), 517-530 (1952).
- Käufer, C., et al. Chemokine receptors CCR2 and CX3CR1 regulate viral encephalitis-induced hippocampal damage but not seizures. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8929-8938 (2018).
- Libbey, J. E., et al. The effects of diet on the severity of central nervous system disease: One part of lab-to-lab variability. Nutrition. 32 (7-8), 877-883 (2016).
- Racine, R. J. Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Kim, J. E., Cho, K. O. The pilocarpine model of temporal lobe epilepsy and EEG monitoring using radiotelemetry system in mice. Journal of Visualized Experiments. (132), e56831 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Tu, L., et al. Free-floating immunostaining of mouse brains. Journal of Visualized Experiments. (176), e62876 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon