Method Article
Un modello per l'epilessia di eziologia infettiva utilizzando il virus dell'encefalomielite murina di Theiler
In questo articolo
Riepilogo
L'infezione intracerebrale con il virus dell'encefalomielite murina di Theiler (TMEV) nei topi C57BL/6 replica molti dei sintomi clinici precoci e cronici dell'encefalite virale e della successiva epilessia nei pazienti umani. Questo articolo descrive l'infezione virale, i sintomi e l'istopatologia del modello TMEV.
Abstract
Una delle principali cause di epilessia è un'infezione del sistema nervoso centrale (SNC); Circa l'8% dei pazienti che sopravvivono a tale infezione sviluppano l'epilessia come conseguenza, con tassi significativamente più alti nei paesi economicamente meno sviluppati. Questo lavoro fornisce una panoramica della modellizzazione dell'epilessia dell'eziologia infettiva e del suo utilizzo come piattaforma per nuovi test di composti antiepilettici. Viene presentato un protocollo di induzione dell'epilessia mediante iniezione intracerebrale non stereotassica del virus dell'encefalomielite murina di Theiler (TMEV) nei topi C57BL/6, che replica molti dei sintomi clinici precoci e cronici dell'encefalite virale e della successiva epilessia nei pazienti umani. Viene descritta la valutazione clinica dei topi durante l'encefalite per monitorare l'attività convulsiva e rilevare i potenziali effetti anticonvulsivi di nuovi composti. Inoltre, vengono mostrate le conseguenze istopatologiche dell'encefalite virale e delle convulsioni come il danno ippocampale e la neuroinfiammazione, nonché le conseguenze a lungo termine come le crisi epilettiche spontanee. Il modello TMEV è una delle prime piattaforme sperimentali traslazionali, guidate dall'infezione, per consentire lo studio dei meccanismi di sviluppo dell'epilessia come conseguenza dell'infezione del SNC. Pertanto, serve anche a identificare potenziali bersagli terapeutici e composti per i pazienti a rischio di sviluppare l'epilessia a seguito di un'infezione del SNC.
Introduzione
Una delle frequenti conseguenze dell'encefalite virale sono le crisi epilettiche. Molte infezioni virali scatenano convulsioni sintomatiche durante la fase acuta dell'infezione; Il rischio di tali sequestri è aumentato di oltre il 20% tra la popolazione in generale 1,2,3. I pazienti che sopravvivono all'infezione hanno anche un aumentato rischio del 4% -20% di sviluppare epilessia cronica nei mesi o anni dopo l'infezione 1,4. Il virus dell'encefalomielite murina di Theiler (TMEV) è stato identificato come un virus adatto per studiare le crisi acute e croniche in un modello murino di encefalite virale 5,6,7. TMEV è un virus RNA a singolo filamento non avvolto, a senso positivo, della famiglia Picornaviridae ed è stato tradizionalmente utilizzato per studiare la demielinizzazione nel midollo spinale dei topi SJL, da cui i topi C57BL / 6 (B6) sono protetti perché hanno la capacità di eliminare rapidamente il virus dopo l'infezione. Tuttavia, TMEV induce crisi acute nel 50%-75% dei topi B6 maschi e femmine entro la prima settimana dopo l'infezione (pi), mentre circa il 25%-40% sviluppa epilessia cronica settimane o mesi pi 2,5,6,8,9. Oltre alle convulsioni, i topi mostrano anche l'istopatologia comune di un ippocampo epilettico con neurodegenerazione e gliosi 5,6,8,10,11,12. Inoltre, i topi B6 infetti da TMEV hanno prestazioni significativamente peggiori nei test comportamentali per l'apprendimento e la memoria e hanno una comorbidità cognitiva, che si osserva anche nei pazienti clinici con epilessia13,14,15.
Tradizionalmente, i modelli di epilessia e convulsioni utilizzano l'applicazione di sostanze chemioconvulsive o la stimolazione elettrica per indurre convulsioni; Tuttavia, questi modelli mancano di validità costruttiva e spesso mostrano convulsioni più gravi e danni cerebrali rispetto a quelli osservati nei pazienti clinici16. Non esiste un modello appropriato per ogni domanda di ricerca17. L'uso del modello TMEV è particolarmente interessante se vengono studiati i fattori predisponenti dello sviluppo delle crisi dopo un'infezione del SNC o se i composti vengono sottoposti a screening per la loro efficacia anticonvulsiva.
Poiché il modello TMEV è stato stabilito e utilizzato in diversi laboratori a livello internazionale, gli autori hanno identificato molti dettagli che consentono un'implementazione di successo del modello, ad esempio la specificità di diversi ceppi di virus e topi. L'induzione convulsiva più affidabile è stata generata con il ceppo di Daniel di topi TMEV e B6J 2,5,6,8,9. Il modello è attualmente utilizzato dal National Institute of Neurological Disorders and Stroke (NINDS) come piattaforma per identificare nuovi farmaci contro l'epilessia e le convulsioni18,19. Questo documento include il protocollo dettagliato di induzione del virus e monitoraggio clinico per consentire ad altri ricercatori di utilizzare questo modello di encefalite virale per approfondire la comprensione dei meccanismi della malattia, nonché per i test farmacologici.
Il seguente protocollo riflette uno studio progettato per i test composti in questo modello, sebbene possano essere eseguiti numerosi altri tipi di studi. I topi vengono anestetizzati brevemente prima dell'iniezione con il ceppo di TMEV di Daniel nella regione temporale dell'emisfero destro (posteriore e mediale all'occhio destro). A seconda della domanda di ricerca, se sono necessari animali di controllo non infetti, i topi ricevono soluzione salina sterile tamponata con fosfato (PBS, pH 7,4, inclusi KH 2 PO 4 [1,06 mM], NaCl [155,17 mM] e Na 2 HPO4·7H 2 O [2,97mM]) invece di TMEV. Precedenti esperienze in topi infetti da TMEV hanno indicato che le convulsioni indotte dalla manipolazione si verificano tra il giorno 3 e il giorno 7 dopo l'infezione. La frequenza dell'iniezione, la via e il tempo di prova dei composti sperimentali variano a seconda delle loro proprietà. Si raccomanda di eseguire l'inoculazione del virus il venerdì, il che consente il monitoraggio delle crisi epilettiche del giorno 3-7 la settimana successiva, dal lunedì al venerdì. Durante la settimana di monitoraggio delle crisi, i composti sperimentali possono essere somministrati (i.p.) due volte al giorno (almeno 4 ore di distanza) se non diversamente suggerito dalla cinetica o dal meccanismo d'azione del composto. Il monitoraggio delle crisi durante il trattamento può essere eseguito in un momento precedentemente determinato. I tempi di iniezione e osservazione variano a seconda dei singoli composti. Gli animali vengono iniettati con il composto in esame o con un veicolo al posto del composto farmacologico. Questi due gruppi possono essere gestiti e osservati analogamente al gruppo sperimentale. Durante l'esperimento, l'unica persona che maneggia i topi e segna le convulsioni dovrebbe essere cieca al trattamento.
Protocollo
Tutte le procedure descritte sono state autorizzate dalle rispettive autorità. Gli animali sono mantenuti seguendo le raccomandazioni contenute nella "Guida per la cura e l'uso degli animali da laboratorio" (Consiglio nazionale delle ricerche) e in conformità con la politica del servizio sanitario pubblico e il Comitato istituzionale per la cura e l'uso degli animali presso l'Università dello Utah, il protocollo sugli animali (numero: 21-11009, Dipartimento di farmacologia e tossicologia) e presso la Freie Universität Berlin (protocollo: G0015/21, LAGeSo Berlin, Istituto di Farmacologia e Tossicologia), rispettivamente. I risultati mostrati nella Figura 3 e nella Figura 5 sono stati approvati con 33.9-42502-04-11/0516 e 33.9-42502-04-15/1892 (LAVES Oldenburg, Dipartimento di Farmacologia, Tossicologia e Farmacia, Università di Medicina Veterinaria di Hannover).
1. Considerazioni e preparativi per la progettazione dello studio
- Virus
- Il ceppo di TMEV di Daniel è stato gentilmente fornito da Robert Fujinami dell'Università dello Utah. Originariamente, è stato isolato da un topo nella colonia di Harvard20. Consulta la classificazione e i regolamenti specifici per gli agenti biologici nei rispettivi paesi prima di maneggiare TMEV e discuti con il personale istituzionale di biosicurezza per garantire la conformità alle normative. Tipicamente, TMEV è classificato come BSL 2, a seconda del ceppo e delle modificazioni genetiche. La dose standard necessaria per indurre convulsioni nella maggior parte degli animali è di 3 x 105 unità formanti placca (PFU).
NOTA: Potrebbe essere necessario adattare la dose, ad esempio, se vengono utilizzati topi transgenici. Nel complesso, titoli compresi tra 2 x 104 PFU e 2,44 x 107 PFU sono stati utilizzati per indurre con successo le convulsioni. Gli animali di controllo ricevono PBS sterile e non hanno convulsioni. Il virus non infetta l'uomo; tuttavia, i DPI (camice da laboratorio, guanti, occhiali di sicurezza) devono essere indossati dagli sperimentatori in ogni momento e le carcasse di topo e la biancheria da letto devono essere sterilizzate in autoclave prima dello smaltimento.
- Il ceppo di TMEV di Daniel è stato gentilmente fornito da Robert Fujinami dell'Università dello Utah. Originariamente, è stato isolato da un topo nella colonia di Harvard20. Consulta la classificazione e i regolamenti specifici per gli agenti biologici nei rispettivi paesi prima di maneggiare TMEV e discuti con il personale istituzionale di biosicurezza per garantire la conformità alle normative. Tipicamente, TMEV è classificato come BSL 2, a seconda del ceppo e delle modificazioni genetiche. La dose standard necessaria per indurre convulsioni nella maggior parte degli animali è di 3 x 105 unità formanti placca (PFU).
- Animali
- Per indurre e studiare le convulsioni, utilizzare topi B6J, poiché altri ceppi di topo non mostrano necessariamente convulsioni, ad esempio topi SJL / J, FVB / N o Balb / c5. Non vi è alcuna differenza tra topi femmina e maschio nella frequenza delle crisi acute5. Eseguire gli esperimenti su topi adolescenti e adulti (a partire da 5-6 settimane di età).
- Dieta
- La dieta è stata determinata come una fonte di variabilità da laboratorio a laboratorio nella gravità della malattia; Quindi, considera la dieta come un potenziale fattore per la variazione22.
- Dimensione del gruppo
- Poiché non tutti gli animali sviluppano convulsioni acute o croniche in questo modello, utilizzare circa 20 topi / gruppo per i test composti.
- Benessere degli animali
- Se un topo dimostra effetti avversi significativi dall'infezione o dalla somministrazione del composto sperimentale (ad esempio, letargia, scarsa toelettatura, arrossamento eccessivo e secrezione purulenta dalla ferita) dopo un tempo di osservazione determinato dalle linee guida IACUC locali (ad esempio, 48 ore), eutanasia il topo umanamente.
- Eutanasia qualsiasi topo che dimostri un'estrema perdita di peso corporeo (>20%) durante il periodo di infezione umanamente.
- Se gli animali non mangiano correttamente, dare loro accesso a pellet supplementari inumiditi con soluzione elettrolitica pediatrica o simile.
2. Inoculazione di virus
- Sterilizzazione della siringa per iniezione
- Rimuovere il cappuccio della siringa da insulina. Aggiungere tubi in polietilene come collare attorno all'ago per garantire un'adeguata profondità di iniezione di 2,5 mm. Immergere la siringa in etanolo per 30 minuti. Posizionare la siringa sotto la luce UV per 30 minuti.
- Rimetti il cappuccio sull'ago. Avvolgere la siringa in un sacchetto sterilizzante e chiuderla con nastro adesivo. Etichetta con la data di preparazione.
- Iniezione di virus
- Ottieni aliquote del ceppo TMEV di Daniel dal congelatore a -80 °C. Scongelare il virus e tenerlo in ghiaccio. Evitare di scongelare e ricongelare il virus. Caricare la siringa con la sospensione virale (3 x 105 PFU diluiti in 20 μL di terreno di coltura PBS o DMEM).
ATTENZIONE: Il virus è contagioso per i topi ma non per gli esseri umani. - Pulire il banco con disinfettante e lavorare sotto un aspirafumi. L'inoculazione del virus non è sterile ma è il più pulita possibile.
- Trasferire il topo nella camera di induzione dell'anestesia e utilizzare il 2% di isoflurano nell'ossigeno per indurre l'anestesia. Raggiungere la tolleranza chirurgica richiede alcuni minuti; Regolare la concentrazione in base alla respirazione dell'animale e alla profondità dell'anestesia.
- Trasferire il topo anestetizzato dalla scatola dell'anestesia sotto il cappuccio. Controllare la tolleranza chirurgica, ad esempio, pizzicando la punta. L'intera procedura viene eseguita in meno di 30 secondi, quindi l'animale non ha bisogno di inalare isoflurano durante l'iniezione. Aggiungere unguento per gli occhi per prevenire l'essiccazione della cornea.
- Pulire la testa dell'animale con un tampone imbevuto di alcool. Inclinare leggermente la testa del mouse verso sinistra in modo che il sito di iniezione sia rivolto verso l'alto.
- Tirare la pelle un po 'indietro, inserire l'ago nella testa e iniettare 20 μL per via intracortica a una profondità di 2,5 mm nella regione temporale dell'emisfero destro (posteriore e mediale all'occhio destro).
- Eseguire l'iniezione unilateralmente nello stesso emisfero in tutti gli animali. Usa l'occhio e l'orecchio come punti di riferimento per la posizione della corteccia parietale. Il posizionamento è stato precedentemente verificato istologicamente; vedere la Figura 1. Le coordinate di iniezione secondo l'iniezione stereotassica in relazione al bregma sono −2,0 (AP); +3,0 (ML); −1,5 (DV).
- Lasciare la siringa in posizione per 5-15 s. Annotare se c'è qualche perdita dall'iniezione o se si vedono bolle d'aria - in tal caso, preparare una nuova siringa. Quando si estrae con attenzione la siringa, ruotarla leggermente. Applicare unguento per gli occhi per prevenire la secchezza durante l'anestesia.
- FACOLTATIVO: codificare l'animale sulla coda o sull'orecchio a seconda delle procedure locali (facoltativo ma facile in quanto l'animale è incosciente).
- Trasferire l'animale in una nuova gabbia, che viene posizionata a metà su / metà su una piastra elettrica (35-40 ° C) durante il recupero dall'anestesia. Non lasciare gli animali incustoditi fino a quando non hanno riacquistato sufficiente coscienza per mantenere la sdraiata sternale.
NOTA: Gli animali possono essere nuovamente alloggiati in gruppo dopo il recupero (gli animali infetti non sono mescolati con animali finti infetti). I topi infetti non devono essere alloggiati nella stessa stanza dei topi non infetti. - Tieni traccia del peso dei topi per i primi 7 giorni pi greco poiché perdono peso dopo l'infezione e potrebbero richiedere un'alimentazione aggiuntiva.
- Ottieni aliquote del ceppo TMEV di Daniel dal congelatore a -80 °C. Scongelare il virus e tenerlo in ghiaccio. Evitare di scongelare e ricongelare il virus. Caricare la siringa con la sospensione virale (3 x 105 PFU diluiti in 20 μL di terreno di coltura PBS o DMEM).
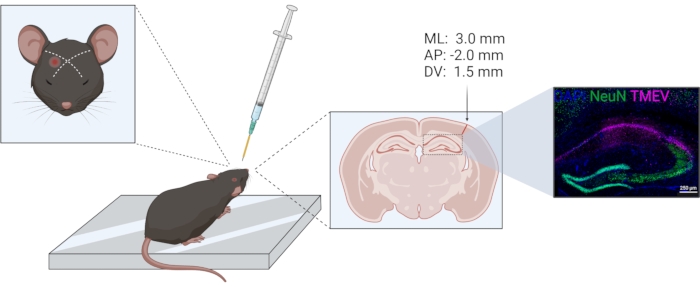
Figura 1: Schema della procedura di iniezione TMEV. Da sinistra a destra: per un'iniezione della corteccia parietale destra, l'ago viene iniettato leggermente lateralmente di una linea immaginaria tra l'occhio e l'orecchio opposto. Il collare per il controllo della profondità è indicato in giallo. Il tratto di iniezione può essere visto nella sezione del cervello coronale, contrassegnata dalla freccia. Il sito di iniezione corrisponde alle coordinate indicate sopra la freccia. L'immagine a destra mostra la distribuzione del virus Theiler (viola) all'interno del CA1 della formazione ippocampale. La figura è stata preparata utilizzando biorender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Test composti
- Preparazione del composto
- Rivedere le istruzioni di formulazione. Preparare la soluzione del veicolo secondo le raccomandazioni o le istruzioni fornite. Ad esempio, viene presentata la procedura per il farmaco antiepilettico levetiracetam (LEV). La LEV riduce il carico convulsivo al 30%-40% dei livelli del veicolo alla dose di 350 mg/kg. Il veicolo utilizzato in questo studio è lo 0,5% di metilcellulosa.
- Calcolare le dosi a seconda del composto. Pesare il farmaco secondo il calcolo. Per il trattamento di 1 kg di topi, pesare 350 mg di LEV.
- Preparare una soluzione madre con il volume appropriato di soluzione del veicolo, come indicato dalle istruzioni di formulazione (ad esempio, sonicazione, eccipienti del veicolo, ecc.). Considerando un volume di iniezione di 0,01 ml/g di topo, il volume di iniezione per 1 kg sarebbe di 10 ml con 350 mg di LEV, risultando in una soluzione di 35 mg/mL19. Riportare il calcolo e la dose in mg/kg e il volume in ml.
NOTA: Un protocollo esemplare può essere trovato a pagina 2 del materiale supplementare 1.
- Somministrazione di composti
- Randomizzare le gabbie al veicolo o al gruppo composto. Utilizzare topi finti infetti per studi sui meccanismi di sviluppo dell'epilessia o per scopi di convalida, ma non per lo screening farmacologico di routine.
- Segnala le condizioni ambientali come temperatura, umidità, ora del giorno, ecc.
- Vortice la soluzione con la mescola e la soluzione del veicolo. Aspirare il veicolo o il composto in una siringa e codificare a colori le siringhe per evitare confusioni.
- Pesare gli animali. Assicurarsi che i topi B6J siano >18 g il giorno 3 pi greco (non arrotondati). Segnala il peso.
- Somministrare il composto (ad es. mediante iniezione intraperitoneale o altre vie appropriate). Scrivi l'ora e il percorso di somministrazione.
- Monitorare gli animali per eventuali cambiamenti comportamentali dopo la somministrazione di composti, specialmente dopo le prime iniezioni. Se si verificano convulsioni, riportare l'intensità delle crisi secondo la scala Racine23; Vedere il punto 3.2.
NOTA: Un protocollo esemplare per la somministrazione di composti può essere trovato nel materiale supplementare 1, pagina 3, mentre le crisi osservate durante la somministrazione sarebbero registrate nel materiale supplementare 1, pagine 4-5.
- Monitoraggio delle crisi epilettiche indotte dalla manipolazione
- Eseguire questa procedura da uno sperimentatore cieco al trattamento. Porta tutte le gabbie in panchina. Osservare gli animali per le convulsioni 2 volte al giorno durante la fase di luce.
- Punteggio dell'attività convulsiva con una scala Racine modificata23: 0 = nessun cambiamento nel comportamento, 1 = movimenti della bocca e del viso, 2 = annuire della testa, 3 = clono unilaterale degli arti anteriori, 4 = clono bilaterale degli arti anteriori con allevamento, 5 = attività tonico-clonica generalizzata con perdita di tono posturale, a volte saltando, 6 = salto prolungato ed eccessivo e iperattività. Segnalare il numero e l'intensità delle convulsioni.
- Fai scorrere una penna sulla gabbia per fare rumore.
- Trasferisci ogni animale in un'altra scatola e viceversa.
- Scuotere delicatamente la gabbia con un movimento avanti e indietro, facendo attenzione a non scuotere la gabbia così vigorosamente che gli animali colpiscano i lati o la parte superiore della gabbia e rischino di subire lesioni fisiche.
- Monitorare tutti gli animali nella gabbia per le convulsioni. In qualsiasi momento, se un topo ha un attacco, trasferirlo di nuovo nella gabbia di casa e annotare il livello della crisi senza ulteriore stimolazione delle crisi da rumore o manipolazione.
- Per gli animali che non hanno afferrato spontaneamente o dopo un leggero scuotimento della gabbia, scatenare le convulsioni con una manipolazione più intensa: capovolgere con attenzione il mouse capovolgendolo dalla coda da sinistra a destra.
NOTA: Gli animali con convulsioni sono ipereccitabili e possono essere nervosi. - Osserva di nuovo ogni animale per il comportamento convulsivo. Ripetere il processo per le gabbie successive.
NOTA: Un protocollo esemplare per il monitoraggio delle crisi epilettiche può essere trovato nel materiale supplementare 1, pagine 6-7.
- Rapporto sui dati sugli effetti composti
- Analizzare i pesi corporei giornalieri utilizzando misure ripetute (RM) ANOVA.
- Utilizzare i valori giornalieri del carico cumulativo di sequestro per una rappresentazione grafica dei dati. Presentare i dati di efficacia (numero di animali senza crisi allo stadio Racine 3-5) come numero protetto/numero testato in ciascun rispettivo gruppo (di solito N = 20). Pertanto, confrontare i dati tra i gruppi trattati con veicoli e farmaci per le risposte (sequestro o non sequestro) utilizzando un test esatto di Fisher.
NOTA: Un animale è considerato "protetto" dalle convulsioni se ha un sequestro di stadio 2 o inferiore e gli animali non protetti hanno convulsioni degli stadi 3-5. - Analizzare i dati di tollerabilità in modo simile, come il numero di animali con disabilità comportamentali o effetti tossici / il numero testato in ciascun gruppo. Prendere nota di eventuali effetti avversi, compresi i decessi.
- Se meno del 50% dei topi iniettati con il veicolo afferra acutamente, non considerare i dati.
Risultati
Effetti composti sulle convulsioni acute
Le crisi comportamentali vengono registrate se si verificano durante l'iniezione di farmaco (DI) o durante le successive sessioni di gestione / monitoraggio delle crisi AM / PM. Le convulsioni osservate durante la manipolazione possono essere presentate come una mappa di calore, che è mostrata nella figura 2 per LEV (350 mg/kg). Per l'analisi del carico convulsivo, la media dei valori finali (giorno 7) del carico cumulativo di sequestro per il gruppo trattato con veicolo viene presa e confrontata mediante il test U di Mann-Whitney con il gruppo trattato con composti (i valori del carico convulsivo includono quelli raccolti all'osservazione post-iniezione). Per l'efficacia dei composti, un test esatto di Fisher determina se esiste una differenza statistica nell'efficacia tra i gruppi trattati con veicoli e farmaci. Allo stesso modo, i dati di tollerabilità vengono analizzati con il test esatto di Fisher. L'analisi del peso corporeo viene eseguita da ANOVA a misure ripetute per determinare i cambiamenti nel corso dell'esperimento, nonché le differenze tra topi composti e trattati con veicolo.
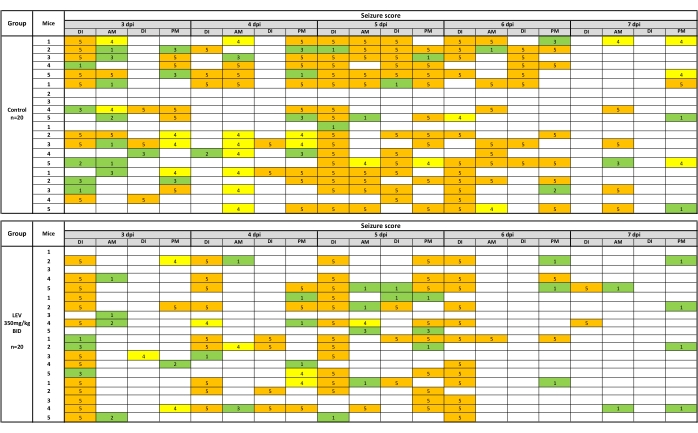
Figura 2: Una mappa termica delle convulsioni comportamentali dopo test con veicolo (0,5% metilcellulosa) o LEV (350 mg/kg). Le iniezioni due volte al giorno si sono verificate 1 ora prima della manipolazione e delle osservazioni convulsive. Le crisi comportamentali sono state registrate se si sono verificate durante l'iniezione di farmaco (DI) o durante le successive sessioni di trattamento / monitoraggio delle crisi AM / PM. LEV (350 mg/kg) riduce significativamente le convulsioni osservate durante le sessioni di manipolazione (35,9% del carico di sequestro del veicolo) durante il periodo di osservazione di 5 giorni. La mappa di calore viene creata immaginando le convulsioni fase 1-3 in verde, 4 in giallo e 5 in arancione. Questa nuova figura è stata creata da un set di dati pubblicato19. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Epilessia cronica
Oltre al carico di sequestro riportato nella prima settimana pi, ci sono diverse letture che potrebbero essere utili a seconda dello studio e dell'ipotesi. Se gli animali vengono tenuti a lungo termine, un sottogruppo di animali infetti svilupperà crisi epilettiche spontanee a diverse settimane pi, che si verificano meno frequentemente delle crisi acute e, quindi, richiedono la registrazione EEG. Per registrare l'EEG dai topi, gli elettrodi devono essere impiantati in un intervento chirurgico stereotassico24. La Figura 3 mostra vari eventi epilettici nella fase cronica mediante registrazione EEG in topi infetti da TMEV8.
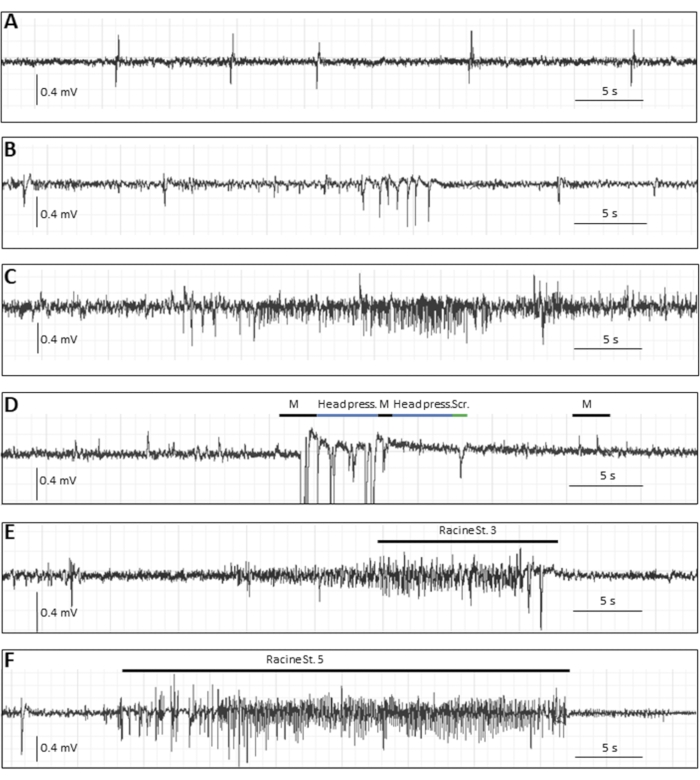
Figura 3: Tracce tipiche dell'EEG nella fase cronica (14 settimane pi) dopo l'infezione da virus DA nei topi. (A-C) Eventi EEG rappresentativi in cui non è stato osservato alcun correlato motorio comportamentale, cioè (A) picchi singoli, (B) cluster di punte, (C) nonché un attacco elettrografico, presumibilmente focale. (D-F) Eventi EEG rappresentativi con correlati comportamentali. Il topo illustrato in D ha avuto eventi simili a crisi epilettiche con contrazioni miocloniche (indicate da "M", accompagnate da artefatti di movimento), movimenti stereotipati (indicati da "head press", quando il topo premeva la testa piatta sul terreno) o arresto comportamentale; "Scr" descrive un artefatto di movimento di graffi, (E) e (F) mostrano alterazioni EEG tipiche durante le crisi convulsive generalizzate: (E) una crisi di stadio Racine 3 con una durata di 22 s e 1 Hz e (F) una crisi di stadio 5 con una durata di 34 s e 5,4 Hz. Questa cifra è stata pubblicata primadell'8 ed è stata ristampata con il permesso di Elsevier. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Istologia
Poiché l'epilessia e le convulsioni sono solitamente accompagnate da patologia ippocampale nei pazienti, che viene ricapitolata in modelli sperimentali, la maggior parte dei laboratori analizza anche i cambiamenti ippocampali o l'effetto di un potenziale trattamento antiepilettico sulla patologia. I parametri comunemente analizzati includono la neurodegenerazione e il restringimento dell'ippocampo, nonché l'infiammazione mediante etichettatura per specifiche popolazioni di cellule immunitarie. Per tali analisi, alla fine dell'esperimento, i topi vengono profondamente anestetizzati fino a quando non si verifica l'arresto respiratorio e la frequenza cardiaca rallenta significativamente o mostra aritmia. Il sangue viene rimosso mediante perfusione intracardica di PBS seguita da paraformaldeide (PFA) al 4% (PFA)25 per fissare il tessuto. Il tessuto viene quindi elaborato mediante criosezione e colorazione (immunitaria)26, seguita da analisi microscopiche.
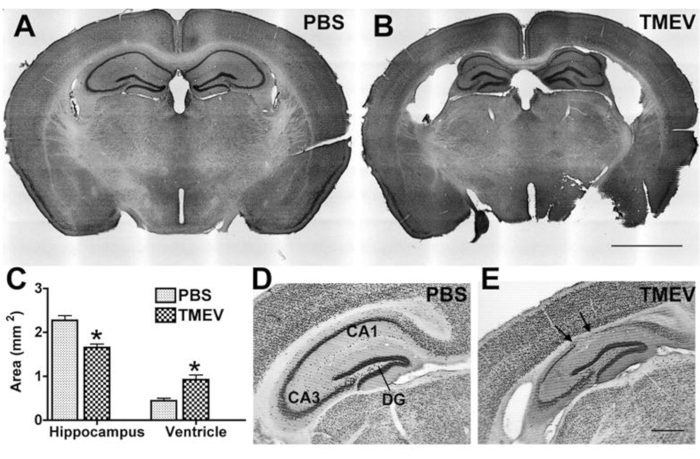
Figura 4: Degenerazione ippocampale in topi epilettici infetti da TMEV. (A,B) Le sezioni coronali colorate di viola cresil mostrano una citoarchitettura normale in un topo (A) di controllo (PBS) e la degenerazione ippocampale in un topo TMEV (B) a 2 mesi pi. Nota: ventricoli laterali allargati, collasso dell'alveo e assottigliamento dello strato cellulare piramidale. (C) La quantificazione di questo danno mostra una significativa diminuzione dell'area ippocampale e un corrispondente aumento dell'area ventricolare dei topi TMEV (N = 7) rispetto ai topi PBS (N = 6; i dati sono medi ± SEM; p < 0,001; Test t dello studente). (D,E) L'etichettatura NeuN illustra ulteriormente l'entità della perdita di cellule neuronali in sezioni prese a 6 mesi pi. Le frecce indicano regioni con perdita completa di cellule piramidali. (E) Il giro dentato sembra essere relativamente intatto anche nei topi epilettici. Barra scala = (A,B) 2 mm; (D,E) 0,5 mm. Questa figura è stata pubblicata prima del6 ed è ristampata con il permesso della Oxford University Press. Fare clic qui per visualizzare una versione ingrandita di questa figura.
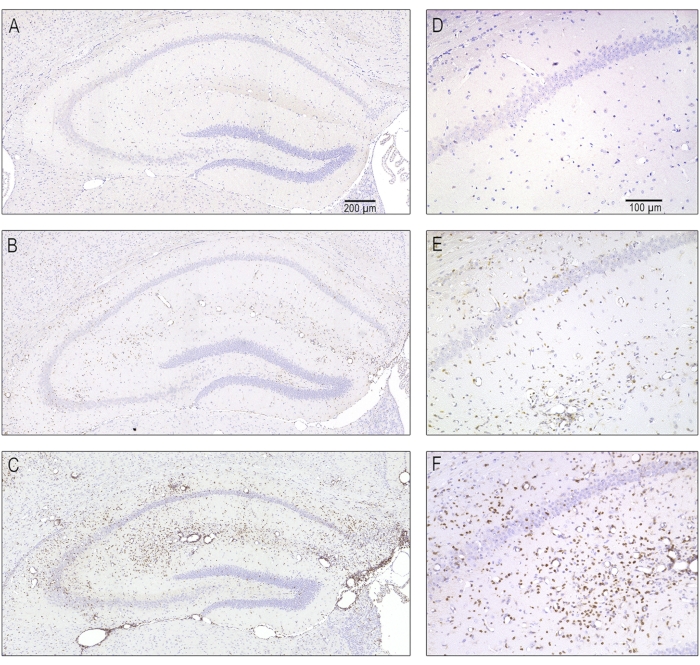
Figura 5: Fotomicrografie rappresentative di diversa gravità dell'infiltrazione delle cellule T dovuta a encefalite acuta a 7 giorni dopo l'infezione. Le sezioni seriali contenenti l'ippocampo dorsale omolaterale sono state colorate con anticorpi contro CD3 per marcare i linfociti T. (A,D) Un ippocampo normale senza infiltrazione di cellule T come appariva in animali finti infetti. (B, E) Infiltrazione moderata delle cellule T come si vede nella maggior parte dei topi infetti da TMEV. (C, F) Una grave infiltrazione di linfociti T, che è stata osservata solo in alcuni dei topi infetti. Questa cifra è stata pubblicata primadell'8 ed è stata ristampata con il permesso di Elsevier. Fare clic qui per visualizzare una versione ingrandita di questa figura.
File supplementare 1: Il file supplementare è costituito dal modulo utilizzato per le prove composte nel modello TMEV. La pagina 1 fornisce una panoramica della configurazione sperimentale. Le informazioni sulla preparazione del composto, del veicolo e della soluzione di composti sono registrate alle pagine 1-2. L'applicazione composta è registrata a pagina 3. I fogli di punteggio alle pagine 4-5 sono utilizzati per registrare le crisi osservate e quantificate dallo sperimentatore che esegue l'iniezione composta. A pagina 4 possono essere raccolti dati per le gabbie 1-4 di 5 topi ciascuna, e a pagina 5 possono essere registrate le gabbie 5-8, che è il numero standard di animali per i test composti nelle nostre mani. I fogli di punteggio alle pagine 6-7 sono utilizzati dall'osservatore cieco che sta eseguendo l'osservazione, la manipolazione e il delicato scuotimento della gabbia 1 ora dopo ogni iniezione di composto. Ancora una volta, i punteggi delle convulsioni possono essere annotati per otto gabbie in totale su questi fogli di punteggio esemplari. L'ultima pagina 8 può essere utilizzata per registrare qualsiasi altra osservazione o nota. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Questo è il primo modello di roditore basato sull'infezione per l'epilessia che consente di indagare sullo sviluppo delle crisi acute e croniche. Aiuterà a identificare bersagli farmacologici e nuovi composti per la prevenzione o la modifica delle malattie per una delle eziologie più comuni dell'epilessia.
Come descritto sopra, può essere necessaria un'attenta considerazione del lotto e del titolo virale per garantire che un'adeguata percentuale di topi trattati con TMEV dimostri convulsioni indotte dalla manipolazione. Se gli animali hanno meno convulsioni del solito, utilizzare un lotto di N = 20 animali per verificare l'efficacia del virus. Se la sua attività è diminuita (meno del 50%), è il momento di fare nuove aliquote e testarle con N = 20 animali. Se le nuove aliquote non sono più efficienti, è necessario purificare un nuovo lotto del virus. Per alcune linee di topi transgenici, potrebbe essere necessario utilizzare un titolo virale inferiore; Pertanto, il titolo virale deve essere diluito secondo necessità dopo esperimenti preliminari. La maggior parte dei dati disponibili sui topi B6 proviene dai Jackson Laboratories (Bar Harbor, ME, USA o Charles River, Sulzfeld, Germania); tuttavia, tassi di crisi simili nei topi B6 ottenuti da Harlan (Eystrup, Germania) sono stati confermati8. I tassi di sequestro di animali transgenici con un background B6 sono paragonabili ai topi B6 selvatici, ma potrebbero differire se i cambiamenti genetici hanno un'influenza sull'invasione del virus, sulla risposta infiammatoria o sulla neurodegenerazione21. Le convulsioni acute sono osservate spontaneamente ma innescate dalla manipolazione e dal rumore, quindi è della massima importanza gestire tutti gli animali in modo simile quando si confrontano i tassi di crisi. Le sessioni di manipolazione due volte al giorno hanno precedentemente fornito un elevato carico convulsivo e una percentuale maggiore di topi che hanno dimostrato convulsioni durante i giorni 3-7 dopo l'infezione 6,8,19. Ulteriori sessioni di manipolazione (giorno 1 e giorno 2) possono anche essere impiegate per aumentare il carico convulsivo. Inoltre, gli animali possono essere osservati prima di ogni sessione di manipolazione per garantire che non si verifichino convulsioni spontanee. Un ambiente di laboratorio rumoroso, ad esempio, può produrre convulsioni, che possono, a loro volta, rendere gli animali refrattari alle convulsioni indotte dalla manipolazione durante i periodi di prova.
Mentre l'infezione da TMEV produce convulsioni indotte dalla manipolazione nella maggior parte dei topi, non è noto il motivo per cui alcuni animali sono resistenti a questo trattamento. Come descritto sopra, può essere che si verifichino convulsioni elettrografiche (con comportamenti minimi o assenti) e non siano normalmente quantificate senza registrazione EEG concomitante. Può anche essere che piccole differenze nella posizione di iniezione facilitino la riduzione dell'effetto virale nel cervello; Tuttavia, sono state riportate convulsioni dopo infezione corticale e striatale 5,6,8,9 a causa del tropismo del virus all'ippocampo. Per gli studi di screening farmacologico in questo modello, per identificare una riduzione delle convulsioni (ad esempio, una riduzione del 50% del carico convulsivo), è necessario un numero maggiore di animali per ciascun gruppo (ad esempio, N = 20). Inoltre, la variabilità nei comportamenti convulsivi in questo modello richiede maggiori differenze negli effetti del farmaco rispetto al veicolo per identificare una significativa riduzione delle crisi. Pertanto, una limitazione di questo modello è il requisito di gruppi di dimensioni maggiori. Tuttavia, dimensioni sufficienti del gruppo consentono anche l'identificazione di effetti anti-sequestro e anti-infiammatori in questo modello19.
La stragrande maggioranza delle crisi osservabili in questo modello si verifica durante il periodo di infezione acuta. Nonostante l'insorgenza di degenerazione ippocampale, attivazione delle cellule immunitarie e deficit cognitivi osservati nei topi trattati con TMEV, solo una piccola parte degli animali trattati alla fine sviluppa convulsioni croniche spontanee. Questo basso carico convulsivo complessivo richiederebbe un gran numero di topi infetti per studiare adeguatamente le crisi spontanee in questo modello, che va oltre la portata e la capacità di molti progetti. L'impianto di elettrodi profondi e il monitoraggio EEG aumenterebbero anche il carico sugli animali da esperimento. Mentre gli elettrodi di profondità possono aiutare nell'identificazione dell'attività convulsiva spontanea, i cambiamenti nell'anatomia dell'ippocampo dopo l'infezione possono rendere difficile il posizionamento coerente degli elettrodi.
L'urgente necessità di identificare nuovi trattamenti per l'epilessia richiede lo sviluppo di modelli che possano essere utilizzati come metodo di screening rapido per l'efficacia antiepilettica. Questo modello fornisce funzionalità per soddisfare questa richiesta urgente. Inoltre, il fatto che non richieda alcun intervento chirurgico stereotassico lo rende un modello adatto e facile da eseguire per lo studio dei composti antiepilettici.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
SB è supportato da una sovvenzione iniziale del FU Berlin. KSW è supportato da R37 NS065434 e dalla Fondazione ALSAM. LAB è supportato da un premio D-SPAN 1F99NS125773-01. Ringraziamo Robert Fujinami, Ph.D. per averci fornito il virus Theiler e la University of Utah Cell Imaging Core Facility per il supporto alla microscopia.
Materiali
| Name | Company | Catalog Number | Comments |
| Absorbent paper | - | - | any |
| Analytical balance | Mettler Toledo (Columbus, OH, U.S.A.) | 30216542 | 0. 1 mg–220 g |
| Animal balance | Ohaus (Parsippany, NJ, U.S.A.) | STX2202 | 0.01 g–2200 g |
| BD Lo-Dose U-100 Insulin Syringes | BD (Mississauga, ON, Canada) | BD329461 | Lo-Dose sterile syringes with permanent BD Micro-Fine IV needle - 1 mL |
| Daniel's strain of TMEV | kindly provided by Robert Fujinami (University of Utah) | - | 3 x 105 plaque-forming units aliquot(s) |
| Disinfectant, e.g. VennoVet 1 super | Menno Chemie Vertriebsgesellschaft GmbH, Germany | - | Recommended by campus veterinarians with less than or equal to 5% alcohol |
| Fisherbrand medium sterile Alcohol prep pad C7 | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 22-363-750 | |
| Fluriso | VETone (Boise, ID, U.S.A) | 502017 | Isoflurane 250 mL, 2%–5% |
| Fume absorber | Labconco (Kansas City, MO, U.S.A.) | - | - |
| General Protection Disposable SMS White Lab Coats | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 17-100-810A | |
| GraphPad Prism version 9 | (La Jolla, CA, U.S.A.) | ||
| Ice bucket | - | - | any |
| Microsoft Excel Microsoft | (Redmond, WA, U.S.A.) | ||
| Microsoft Word Microsoft | (Redmond, WA, U.S.A.) | ||
| Mouse cage | - | - | any mouse cage holding at least 5 mice |
| PrecisionGlide needles | BD (Mississauga, ON, Canada) | 329652 | BD Slip Tip with PrecisionGlide Needle Insulin Syringes - 26 G x 3/8 - 0.45 mm x 10 mm |
| Self-Sealing Sterilizing Pouch | Fisher Scientific (Hampton, NY, U.S.A.) | NC9241087 | 12.6 x 25.5 cm |
| Small glass flask | - | - | any, volume 25 mL |
| sterile PBS | Thermo Fisher Scientific (Waltham, MA, U.S.A.) | 10010056 | |
| Stir bar | Carl Roth GmbH & CO. KG | X171.1 | size according to volume of solution |
| Stir plate | Carl Roth GmbH & CO. KG | AAN2.1 | |
| Syringe Luer-Lok | BD (Mississauga, ON, Canada) | 309628 | 1 mL syringe only |
| Ultrasonic Cleaner, Heater/Mechanical Timer | Cole-Parmer (Vernon Hills, IL, U.S.A.) | EW-08895-23 | Bath sonicator - 0.5 gal, 115 V |
| Vehicle solution | - | - | depending on compound vehicle |
| Vortex REAX | Heidolph Instruments GmbH & Co. KG, Germany | 541-10000-00 |
Riferimenti
- Getts, D. R., Balcar, V. J., Matsumoto, I., Müller, M., King, N. J. Viruses and the immune system: their roles in seizure cascade development. Journal of Neurochemistry. 104 (5), 1167-1176 (2008).
- Libbey, J. E., Fujinami, R. S. Neurotropic viral infections leading to epilepsy: Focus on Theiler's murine encephalomyelitis virus. Future Virology. 6 (11), 1339-1350 (2011).
- Vezzani, A., et al. Infections, inflammation and epilepsy. Acta Neuropathologica. 131 (2), 211-234 (2016).
- Misra, U. K., Tan, C. T., Kalita, J. Viral encephalitis and epilepsy. Epilepsia. 49, 13-18 (2008).
- Libbey, J. E., et al. Seizures following picornavirus infection). Epilepsia. 49 (6), 1066-1074 (2008).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Development of postinfection epilepsy after Theiler's virus infection of C57BL/6 mice. Journal of Neuropathology and Experimental Neurology. 69 (12), 1210-1219 (2010).
- Stewart, A. M., et al. Perspectives of zebrafish models of epilepsy: What, how and where next. Brain Research Bulletin. 87 (2-3), 135-143 (2012).
- Bröer, S., et al. Brain inflammation, neurodegeneration and seizure development following picornavirus infection markedly differ among virus and mouse strains and substrains. Experimental Neurology. 279, 57-74 (2016).
- Bröer, S., et al. Viral mouse models of multiple sclerosis and epilepsy: Marked differences in neuropathogenesis following infection with two naturally occurring variants of Theiler's virus BeAn strain. Neurobiology of Disease. 99, 121-132 (2017).
- Loewen, J. L., Barker-Haliski, M. L., Dahle, E. J., White, H. S., Wilcox, K. S. Neuronal Injury, gliosis, and glial proliferation in two models of temporal lobe epilepsy. Journal of Neuropathology and Experimental Neurology. 75 (4), 366-378 (2016).
- Bell, L. A., Wallis, G. J., Wilcox, K. S. Reactivity and increased proliferation of NG2 cells following central nervous system infection with Theiler's murine encephalomyelitis virus. Journal of Neuroinflammation. 17 (1), 369 (2020).
- Stewart, K. A., Wilcox, K. S., Fujinami, R. S., White, H. S. Theiler's virus infection chronically alters seizure susceptibility. Epilepsia. 51 (8), 1418-1428 (2010).
- Buenz, E. J., Rodriguez, M., Howe, C. L. Disrupted spatial memory is a consequence of picornavirus infection. Neurobiology of Disease. 24 (2), 266-273 (2006).
- Tramoni-Negre, E., Lambert, I., Bartolomei, F., Felician, O. Long-term memory deficits in temporal lobe epilepsy. Revue Neurologique. 173 (7-8), 490-497 (2017).
- Ponds, R. W., Hendriks, M. Cognitive rehabilitation of memory problems in patients with epilepsy. Seizure. 15 (4), 267-273 (2006).
- Sloviter, R. S. Experimental status epilepticus in animals: What are we modeling. Epilepsia. 12, 11-13 (2009).
- Löscher, W. Animal models of seizures and epilepsy: Past, present, and future role for the discovery of antiseizure drugs. Neurochemical Research. 42 (7), 1873-1888 (2017).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Metcalf, C. S., et al. Screening of prototype antiseizure and anti-inflammatory compounds in the Theiler's murine encephalomyelitis virus model of epilepsy. Epilepsia Open. 7 (1), 46-58 (2021).
- Daniels, J. B., Pappenheimer, A. M., Richardson, S. Observations on encephalomyelitis of mice (DA strain). Journal of Experimental Medicine. 96 (6), 517-530 (1952).
- Käufer, C., et al. Chemokine receptors CCR2 and CX3CR1 regulate viral encephalitis-induced hippocampal damage but not seizures. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8929-8938 (2018).
- Libbey, J. E., et al. The effects of diet on the severity of central nervous system disease: One part of lab-to-lab variability. Nutrition. 32 (7-8), 877-883 (2016).
- Racine, R. J. Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Kim, J. E., Cho, K. O. The pilocarpine model of temporal lobe epilepsy and EEG monitoring using radiotelemetry system in mice. Journal of Visualized Experiments. (132), e56831 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Tu, L., et al. Free-floating immunostaining of mouse brains. Journal of Visualized Experiments. (176), e62876 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon