需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于生成骨类似物的细胞悬浮液中的陶瓷全向生物打印
摘要
该协议描述了一种3D打印技术,通过将磷酸钙墨水沉积在基于明胶的颗粒载体中来制造骨状结构。印刷的骨类似物以自由形式沉积,具有直接收获印刷品或在活细胞基质内交联以进行多相构建体的灵活性。
摘要
在结构上,骨组织是一种无机有机复合材料,含有嵌入分层、高度矿化基质中的代谢活性细胞。由于骨骼的异质环境,这种组织很难复制。细胞悬浮液中的陶瓷全向生物打印(COBICS)是一种基于微凝胶的生物打印技术,可独特地复制骨骼的矿物质和细胞结构。COBICS打印复杂的生物学相关结构,无需牺牲支撑材料或苛刻的后处理步骤(例如辐射和高温烧结),这是骨模拟结构增材制造中的两个最大挑战。该技术是通过在明胶基微凝胶悬浮液中自由挤出新型磷酸钙基油墨来实现的。悬浮液的屈服应力特性允许沉积并支撑打印的骨结构。然后紫外线交联和纳米沉淀将其"锁定"到位。在充满细胞的生物材料中打印纳米结构的模拟骨陶瓷的能力提供了对宏观和微观结构的时空控制,并促进了临床环境中复杂骨骼结构的实时制造。
引言
骨骼具有非凡的再生能力,是体内为数不多的可以通过重建其正常的细胞组成、方向和机械强度来愈合的结构之一,直到内源性愈合能力受损时出现严重的缺陷大小1.骨骼与软骨和韧带一起支持和促进身体运动,同时还储存矿物质和脂肪并产生血细胞。骨作为一种坚硬、致密的结缔组织,主要由无机相、水和主要由胶原纤维组成的有机物质组成2。细胞嵌入这种高度矿化的胶原蛋白I纤维和羟基磷灰石(HA)晶体基质中,形成分层结构3。
这种组织的复杂组织使得合成替代品的制造变得异常具有挑战性3.为此,已经提出了各种材料,包括生物陶瓷,富含细胞的水凝胶和合成材料作为创建骨基质的解决方案。在支架制造技术中,基于3D打印的技术最近出现并受到组织工程界的广泛关注,因为它们具有制造高度复杂和精密结构的卓越能力,具有患者特异性治疗的巨大前景4,5,6.水凝胶一直是基质模拟物和生物墨水最受欢迎的选择,因为它们可以与细胞和生物活性分子一起打印,产生功能构建体6。然而,水凝胶缺乏骨骼的功能特性,例如机械强度和含有代谢活性细胞的高度钙化无机相。
3D打印陶瓷支架通常需要后处理步骤,包括烧结,高温处理或使用刺激性化学品,这些化学品必须在体外或体内应用之前彻底清洗5。为了解决这些限制,Lode等人7最近开发了一种由羟基磷灰石形成的α-三钙磷酸盐基糊剂,可以在生理条件下印刷和凝固。然而,这种材料仍然不能与活细胞一起打印,因为它需要在潮湿的环境中进行后处理,然后长时间浸泡水溶液。
或者,已经提出了含有无机颗粒的含有细胞的水凝胶作为3D骨基质8,9的替代品。尽管它们具有很强的支持细胞活力的能力,但它们无法概括密集的矿化骨组织环境。Thrivikarman等人10 采用了仿生方法,其中过饱和钙和磷酸盐培养基与非胶原蛋白类似物一起使用,以更好地模拟纳米级磷灰石沉积。然而,他们的结构仍然无法生成具有类似于骨骼的微观和宏观尺度架构的刚性3D结构。
本研究通过开发打印策略来解决这些缺点,以在无机和有机相中制造能够整合细胞和生长因子的骨骼模拟构建体11。COBICS使用基于微凝胶的生物打印技术独特地概括了骨骼的矿物质和细胞结构。本文中的协议描述了合成陶瓷骨墨水和基于明胶的微凝胶,然后组合实现COBICS的细胞的过程。该过程从骨墨的主要前体材料的合成开始。然后将可交联的水凝胶合成并形成微凝胶。最后,将骨墨水全向沉积在装有细胞的微凝胶的支撑浴中(图1)。
骨墨水可以打印到具有适当屈服应力特性的任何微凝胶悬浮液中,即能够以特定的剪切速率流化并随后支撑沉积结构。已经证明了两种灵活的方法:由明胶微凝胶组成的悬浮液和由甲基丙烯酸明胶(GelMA)微凝胶组成的悬浮液。前者悬浮液在温度升至37°C时溶解,悬浮水凝胶的自由形式可逆包埋(FRESH)技术12,而后者可以在印刷后进行光交联,有效地将微凝胶"缝合"在一起并将印刷的骨墨锁定到位。本研究的重点是使用GelMA作为基质,因为它提供了能够通过原 位 打印复杂骨模拟结构来支持细胞生长的独特优势。最终,这种方法能够生成具有高水平仿生学的复杂组织模型,并对疾病建模、药物发现和再生工程具有广泛的影响。
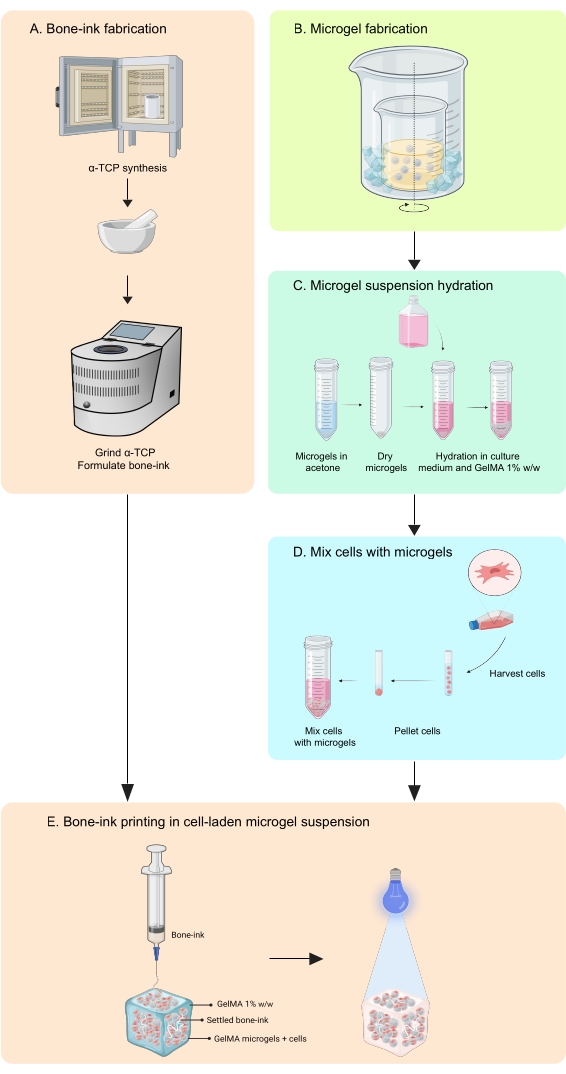
图 1:工作流程示意图 。 (A)骨墨从α-磷酸三钙合成开始,随后与甘油,聚山梨醇酯80和磷酸二铵结合。(B)GelMA微凝胶采用油包水乳液法制备。然后将获得的微凝胶(C)水合和(D)与细胞结合。然后将细胞微凝胶复合材料用作颗粒浴,其中沉积骨墨。(E)然后将整个构建体紫外线交联并转移到培养箱中进行培养。缩写:α-TCP = α-磷酸三钙;GelMA =甲基丙烯酸明胶。请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 骨墨制作
- α-磷酸三钙的合成
- 以 3:2 Ca:P 摩尔比称出磷酸氢钙 (CaHPO4) 和碳酸钙 (CaCO3) 粉末。使用刮刀,彻底均质两种粉末。
- 将磷酸氢钙-碳酸钙粉末混合物加入氧化锆坩埚中,使其不超过75%。
注意:为避免污染,请使用新的坩埚或以前用于制造相同材料的坩埚。要清洁,请用 100% 乙醇冲洗并在通风橱中风干直至完全干燥,然后再添加粉末。 - 将坩埚转移到炉子中。以5°C / min的速度加热至1,400°C并保持3小时。
- 通过从炉子中取出坩埚并将其放在耐火块上来淬灭反应。在处理之前让它完全冷却。
注意:使用适当长度的坩埚钳,并确保足够的热保护。 - 使用研钵和研杵破碎和研磨α-TCP滤饼,使所得颗粒的最大尺寸为200μm。
注意:使用标准不锈钢筛以确保正确的粒径。 - 使用行星磨机分两个阶段进一步研磨颗粒。首先,加入3毫米氧化钇稳定的氧化锆球,重量比为8:1的球:粉末,然后加入100%乙醇,重量比为3:1乙醇:粉末。盖上盖子并以180 rpm研磨2小时。
- 收集悬浮液并分离球,使用100%乙醇进行洗涤。
- 将悬浮液在120°C的烤箱中干燥24小时。
- 将干燥粉末加入带有1毫米氧化锆球和100%乙醇的研磨罐中,重量比与第一阶段相同。以180rpm研磨2小时,分开并干燥。
注意:整个合成过程如图 1A所示。
- 骨墨配方
- 要制作骨墨,将 2 克 α-TCP 粉末加入含有 630 μL 甘油和 130 μL 聚山梨酯 80 的球磨罐中,同时用刮刀连续搅拌。
- 加入100毫克磷酸氢铵((NH4)2HPO4,APD)并搅拌混合。
注意:刮刀上残留的液相过多会导致油墨成分的比例不平衡,从而导致凝固动力学失衡。 - 加入一个 25 毫米的氧化锆球,盖上盖子,然后以 180 rpm 的速度将其放入行星磨机内 60 分钟,中途暂停以用刮刀刮下罐子的侧面。
- 使用刮刀将墨水装入 1 mL 注射器中。充分包裹以避免与湿气接触。如果不立即使用,则储存在-20°C。
- 骨墨微观结构表征
- 在去离子水中打印骨墨并静置5分钟。
- 用100%乙醇洗涤样品3次,使其完全干燥。
- 涂上一层薄薄的金(15 nm 厚)。
- 使用场发射扫描电子显微镜在5 kV的加速电压下捕获显微照片。
2. 印刷用微凝胶悬浮液的制备
- 凝胶MA的合成
注意:此过程已经过由 10 g 和 20 g 明胶组成的批量大小测试。此方法详细说明了使用 10 g 的批次的测量结果。- 称取 10 g 明胶并将其加入装有 90 mL PBS 的锥形烧瓶中,在 1x 磷酸盐缓冲盐水 (PBS) 中制成 10% w/w 明胶溶液(猪,绽放强度 300)。搅拌时加热至50°C,直到明胶完全溶解。
- 加入 5.796 mL 甲基丙烯酸酐。将橡胶盖放在锥形烧瓶上,并在50°C的黑暗中继续搅拌90分钟。
注意:甲基丙烯酸酐如果吸入或吞咽是有毒的,并且对皮肤和眼睛有刺激性。仅在通风橱内处理,并使用适当的个人防护用品。 - 通过用PBS将锥形烧瓶的内容物稀释两倍来淬灭反应。
- 倒入 50 mL 管中,并在室温下以 3,000 × g 离心 3 分钟以除去未反应的甲基丙烯酸酐。
- 将14kDa截止纤维素透析管内的上清液在40°C下用去离子水透析5天,同时轻轻搅拌。每天更换去离子水。
- 通过将倾析到50 mL管中,固定盖子并将其放入冰箱中12小时来准备储存。在冰箱中存放长达 7 天。
- 使用液氮冷冻,并立即在-54°C和0.4mbar下冻干5天。
注意:确保冷冻时试管中的液体不超过 40 mL。冷冻后,用允许气体交换的盖子更换盖子,例如用松紧带固定的精致工作擦拭布。 - 将所得泡沫储存在-20°C的冰箱中,直到需要微凝胶悬浮合成。
- GelMA微凝胶的合成
注意:微凝胶使用油包水乳液方法13 合成(图2)。该方法已针对 1-10 mL 的 GelMA 溶液体积进行了测试。相同的方案可用于合成用于打印独立骨印的明胶微凝胶。- 通过称量冻干的GelMA,将其加入带有PBS的管中,并在50°C的水浴中加热直至完全水合,在PBS中制备10% w / w GelMA溶液。
- 每 1 mL GelMA 溶液向烧杯中加入 37 mL 油,确保其满量不超过 65%。
- 通过将装有油的烧杯放入较大的烧杯中,在带有磁力搅拌的热板上设置双烧杯系统。
注意:两个烧杯的尺寸应使冰可以很容易地掉入其壁之间的空间。设置如图 2 所示。 - 搅拌时加热至40°C。
注意:确保涡流没有湍流,并且深度约为烧杯中油高度的 1/3。 - 将GelMA溶液装入注射器中,并通过0.45μm过滤器将其滴加到搅拌油中。让乳液平衡10分钟。
- 将乳液的温度降低到15°C,通过在两个烧杯之间的空间中添加碎冰来热稳定球体。
- 将丙酮以1:11 GelMA溶液与丙酮的体积比添加到纺丝乳液中。
注意:通过漏斗轻轻添加丙酮,以避免破坏乳液。搅拌60分钟。 - 将烧杯的内容物倒入 50 mL 管中,确保用丙酮清洗烧杯壁。静置20分钟,让脱水的微凝胶沉降到底部。
- 弃去上清液并用丙酮洗涤至少2倍。
注意:上清液应澄清。 - 合并成一个管,加满丙酮,超声处理10秒。用丙酮清洗2倍。
- 在室温下储存在丙酮中,直到需要打印。
- 制备用于打印的GelMA微凝胶悬浮液
- 在Dulbecco的改良鹰培养基(DMEM)中制备1%w / w的GelMA溶液,方法是将冻干的GelMA称入管中,加入DMEM,然后在50°C的水浴中加热直至完全水合。
- 从脱水的微凝胶中蒸发丙酮,并将所得粉末称量到管中。加入丙酮并转移到无菌环境中。
- 为了形成微凝胶悬浮液,蒸发丙酮并加入DMEM,1%w/w GelMA溶液在DMEM中和2.5% w/w苯基-2,4,6-三甲基苯甲酰基次膦酸锂(LAP)引发剂溶液,以获得30%的最终填料分数。在室温下充分水合至少12小时。在冰箱中存放长达 7 天。使用前使其达到室温。
注意:这些试剂的体积基于微凝胶的干重,可以使用 表1中的公式计算。
| 方程 | |
| x = 干微凝胶的重量 (mg) | |
| 1% w/w 凝胶MA 在 DMEM 中的体积,a (μL) | a = 21.93x |
| DMEM 体积,b (μL) | b = 8.773x |
| 体积为 2.5% w/w LAP 溶液,c (μL) | c = 0.6267x |
| 产生的微凝胶悬浮液总量(μL) | a + b + c |
表 1:用于计算水合 GelMA 微凝胶悬浮液所需试剂体积的公式。 缩写:GelMA =甲基丙烯酸明胶;LAP = 苯基-2,4,6-三甲基苯甲酰次膦酸锂。
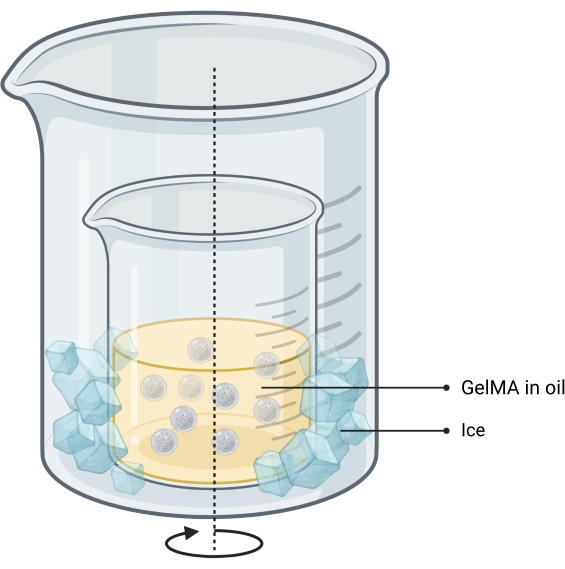
图2: 用于微凝胶合成的油乳液方法示意图。 双烧杯设置显示一个装有搅拌(箭头指示)乳液的烧杯放置在较大的烧杯内以允许冷却。缩写:GelMA = 甲基丙烯酸明胶 请点击此处查看此图的大图。
3. 将骨墨印刷到细胞悬浮液中
注意:基于明胶的微凝胶支持许多不同细胞类型的粘附,这使得该方法适用于微凝胶基质内的单个和多个细胞。该协议描述了使用脂肪来源的间充质干细胞(ADSC)的程序,因为这是肌肉骨骼组织工程的流行且强大的细胞类型。
- 在补充有10%胎牛血清和1%青霉素 - 链霉素的低葡萄糖DMEM中培养ADSC,在37°C和5%CO2 下直至汇合。
- 通过除去培养基,用无菌PBS洗涤,并在37°C和5%CO2 与0.25%胰蛋白酶孵育3分钟,将ADSC从组织培养瓶中分离。
- 通过在室温下以150 ×g 离心5分钟来沉淀细胞。
- 计数细胞并计算每 1 mL GelMA 微凝胶的 5 × 105 个细胞。如上所述,将所需体积的细胞悬液分配到单独的管和沉淀中。
- 使用移液管小心地去除尽可能多的上清液,只留下细胞沉淀。将所需体积的微凝胶悬浮液添加到沉淀中并轻轻吸出以确保细胞均匀分布。
注意:如果悬浮液中有多余的气泡,请轻轻离心以去除并上下移液以重新分布细胞。 - 使用移液管将装有细胞的微凝胶悬浮液装入反应器中。
注意:在本研究中,3D打印了体积容量为100μL的10 mm x 10 mm x 3 mm反应器。 - 使用装有 23 G 针头的 1 mL 注射器沉积骨墨水。
注意:这可以通过3D打印机完成,可以通过改装挤出系统来完成,该系统允许直接从1 mL注射器打印,或者通过将骨墨直接装入打印机的挤出盒中(图3)。 - 将含有细胞和骨墨水的GelMA微凝胶构建体与UV交联剂灯(405nm)交联90秒。立即转移到适当大小的孔板中,并用完整的DMEM盖住。
注意:上述3D打印反应器适合24孔细胞培养板。 - 在37°C和5%CO2下孵育。24小时后更换培养基,然后根据需要每48-72小时更换一次。
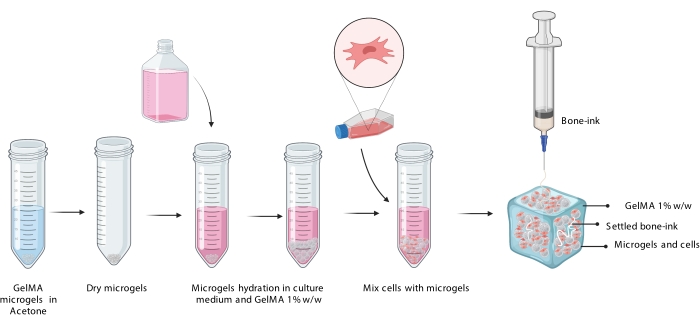
图3:COBICS程序的示意图,显示了微凝胶的水合,细胞的掺入以及随后在含有细胞的微凝胶悬浮液中打印骨墨水。缩写:COBICS =细胞悬浮液中的陶瓷全向生物打印;GelMA = 甲基丙烯酸明胶。请点击此处查看此图的大图。
4. 细胞活力和增殖评估
- 为了评估骨墨水细胞毒性,请将含有细胞的COBICS构建体保存在完整的培养基中。在24小时,72小时和120小时(或相关时间点)进行活死体测定。
- 在每个时间点,用PBS洗涤构建体,然后加入含有4mM钙黄绿素和2mM溴化乙锭的无酚DMEM溶液。在37°C和5%CO2下孵育1小时。
- 用PBS洗涤并转移到玻璃底培养皿中,用共聚焦显微镜在494/517nm和528/617nm的Ex / Em光谱下成像。
Access restricted. Please log in or start a trial to view this content.
结果
COBICS打印复杂的生物学相关结构,无需牺牲支撑材料或苛刻的后处理步骤(例如辐射和高温烧结),这是骨模拟结构增材制造中的两个最大挑战。为了证明COBISS在复杂骨结构的形成和微凝胶悬浮液中细胞的共印,拍摄了由骨墨水制成的骨样复合材料的代表性图像,并对COBISC中的ADSC活力进行了长达7天的半定量分析。 图4 显示了通过在由明胶微凝胶组成的支撑浴中沉积骨墨水?...
Access restricted. Please log in or start a trial to view this content.
讨论
开发3D打印技术COBIS是为了通过挤出成含有活细胞的可交联微凝胶悬浮液来制造矿化的骨状结构。该技术已应用于可降解微凝胶悬浮液,并且细胞在系统内显示出良好的活力、扩散和成骨分化能力11。使用这种技术创建的构造成功的关键决定因素是基于α-TCP的骨墨水的正确合成。首先,α-TCP的形成在很大程度上取决于适当的温度控制。为了形成正确的磷酸三钙相,在反应越过相界?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明他们没有任何利益冲突需要披露。
致谢
作者要感谢国家健康和医学研究委员会(批准号GNT1111694和GNT1141602)和澳大利亚研究委员会(批准号FT180100417,FL150100060和CE14100036)。作者要感谢新南威尔士大学的生物医学成像设施。图表是用 Biorender.com、Adobe Photoshop和Adobe Illustrator创建的,并已通过付费订阅导出。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
参考文献
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , CRC Press. Boca Raton, FL. 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757(2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041(2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660(2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986(2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209(2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014(2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520(2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216(2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758(2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490(2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。