È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Bioprinting omnidirezionale ceramico in sospensioni caricate di cellule per la generazione di analoghi ossei
In questo articolo
Riepilogo
Questo protocollo descrive una tecnica di stampa 3D per fabbricare strutture simili all'osso depositando un inchiostro di fosfato di calcio in un supporto granulare a base di gelatina. Gli analoghi ossei stampati sono depositati in forma libera, con flessibilità per la raccolta diretta della stampa o la reticolazione all'interno di una matrice cellulare vivente per costrutti multifasici.
Abstract
Strutturalmente, il tessuto osseo è un composito inorganico-organico contenente cellule metabolicamente attive incorporate all'interno di una matrice gerarchica altamente mineralizzata. Questa organizzazione è difficile da replicare a causa dell'ambiente eterogeneo dell'osso. Il bioprinting omnidirezionale ceramico in sospensioni cellulari (COBICS) è una tecnica di bioprinting basata su microgel che replica in modo univoco la struttura minerale e cellulare dell'osso. COBICS stampa costrutti complessi e biologicamente rilevanti senza la necessità di materiali di supporto sacrificali o fasi di post-elaborazione difficili (ad esempio, radiazioni e sinterizzazione ad alta temperatura), che sono due delle maggiori sfide nella produzione additiva di costrutti mimetici ossei. Questa tecnica è resa possibile tramite l'estrusione a forma libera di un nuovo inchiostro a base di fosfato di calcio all'interno di una sospensione di microgel a base di gelatina. Le proprietà di tensione di snervamento della sospensione consentono la deposizione e supportano la struttura ossea stampata. La reticolazione UV e la nanoprecipitazione lo "bloccano" in posizione. La capacità di stampare ceramiche nanostrutturate osseo-mimetiche all'interno di biomateriali carichi di cellule fornisce un controllo spaziotemporale sulla macro e micro-architettura e facilita la fabbricazione in tempo reale di complessi costrutti ossei in contesti clinici.
Introduzione
L'osso ha notevoli capacità di rigenerazione come una delle poche strutture del corpo che può guarire ricreando la sua normale composizione cellulare, l'orientamento e la forza meccanica fino a una dimensione critica del difetto, quando la capacità di guarigione endogena è compromessa1. L'osso, insieme alla cartilagine e al legamento, supporta e facilita il movimento del corpo, immagazzinando anche minerali e grassi e producendo cellule del sangue. Come tessuto connettivo duro e denso, l'osso è composto principalmente da una fase inorganica, acqua e materiale organico composto principalmente da fibre di collagene2. Le cellule sono incorporate all'interno di questa matrice altamente mineralizzata di fibre di collagene I e cristalli di idrossiapatite (HA), formando una struttura gerarchica3.
La complessa organizzazione di questo tessuto rende eccezionalmenteimpegnativa la fabbricazione di alternative sintetiche per replicare i micro e nano-ambienti ossei eterogenei 3. A tale scopo, una varietà di materiali, tra cui bioceramiche, idrogel carichi di cellule e materiali sintetici sono stati proposti come soluzioni per creare matrici ossee. Tra le tecniche di fabbricazione degli scaffold sono recentemente emerse tecniche basate sulla stampa 3D che hanno ricevuto molta attenzione dalla comunità dell'ingegneria tissutale grazie alla loro notevole capacità di consentire la fabbricazione di strutture altamente sofisticate e precise con grandi promesse di trattamento specifico per il paziente 4,5,6 . Gli idrogel sono stati la scelta più popolare di imitazioni a matrice e bio-inchiostri poiché possono essere stampati insieme a cellule e molecole bioattive, generando costrutti funzionali6. Tuttavia, gli idrogel mancano delle proprietà funzionali dell'osso, come la resistenza meccanica e una fase altamente calcificata e inorganica contenente cellule metabolicamente attive.
Gli scaffold ceramici stampati in 3D richiedono in genere fasi di post-elaborazione, tra cui sinterizzazione, trattamenti ad alta temperatura o utilizzo di sostanze chimiche aggressive che devono essere accuratamente lavate prima delle applicazioni in vitro o in vivo 5. Per ovviare a queste limitazioni, Lode et al.7 hanno recentemente sviluppato una pasta a base di fosfato α-tricalcico formata da idrossiapatite, che può essere stampata e impostata in condizioni fisiologiche. Tuttavia, questo materiale non può ancora essere stampato insieme a cellule vive in quanto richiede un post-trattamento in un ambiente umido e la successiva immersione in soluzione acquosa per un lungo periodo.
In alternativa, sono stati proposti idrogel carichi di cellule con particelle inorganiche incorporate in sostituzione della matrice ossea 3D 8,9. Nonostante la loro grande capacità di supportare la vitalità cellulare, non sono in grado di ricapitolare l'ambiente densamente mineralizzato del tessuto osseo. Thrivikarman et al.10 hanno adottato un approccio biomimetico in cui è stato utilizzato un mezzo supersaturo di calcio e fosfato con un analogo proteico non collagenoso per imitare meglio la deposizione di apatite su scala nanometrica. Tuttavia, i loro costrutti non possono ancora generare costrutti 3D rigidi con un'architettura su micro e macro scala simile all'osso.
Il presente studio affronta queste carenze attraverso lo sviluppo di una strategia di stampa per fabbricare costrutti che imitano l'osso, in fasi inorganiche e organiche, che sono in grado di integrare sia le cellule che i fattori di crescita11. COBICS ricapitola in modo univoco la struttura minerale e cellulare dell'osso utilizzando una tecnica di bioprinting basata su microgel. Il protocollo qui descritto descrive il processo di sintesi dell'inchiostro ceramico e dei microgel a base di gelatina e quindi la combinazione di cellule che abilitano COBICS. Il processo inizia con la sintesi del principale materiale precursore dell'inchiostro osseo. L'idrogel reticolabile viene quindi sintetizzato e formato in microgel. Infine, l'inchiostro osseo viene depositato omnidirezionalmente in un bagno di supporto dei microgel carichi di cellule (Figura 1).
L'inchiostro osseo può essere stampato in qualsiasi sospensione di microgel che hanno le appropriate caratteristiche di snervamento, cioè la capacità di fluidizzare ad una specifica velocità di taglio e successivamente sostenere la struttura depositata. Sono stati dimostrati due approcci flessibili: una sospensione costituita da microgel di gelatina e una sospensione costituita da microgel di gelatina metacrilato (GelMA). La prima sospensione si dissolve quando la temperatura viene portata a 37 °C, l'incorporazione reversibile a forma libera di idrogel sospesi (FRESH) tecnica12, mentre la seconda può essere fotoreticolata dopo la stampa, "cucendo" efficacemente i microgel insieme e bloccando l'inchiostro osseo stampato in posizione. Il presente studio si concentra sull'utilizzo di GelMA come matrice in quanto offre il vantaggio unico di essere in grado di supportare la crescita cellulare con la stampa in situ di strutture mimetiche ossee complesse. In definitiva, questo approccio consente la generazione di modelli tissutali complessi con alti livelli di biomimetica e ampie implicazioni per la modellazione delle malattie, la scoperta di farmaci e l'ingegneria rigenerativa.
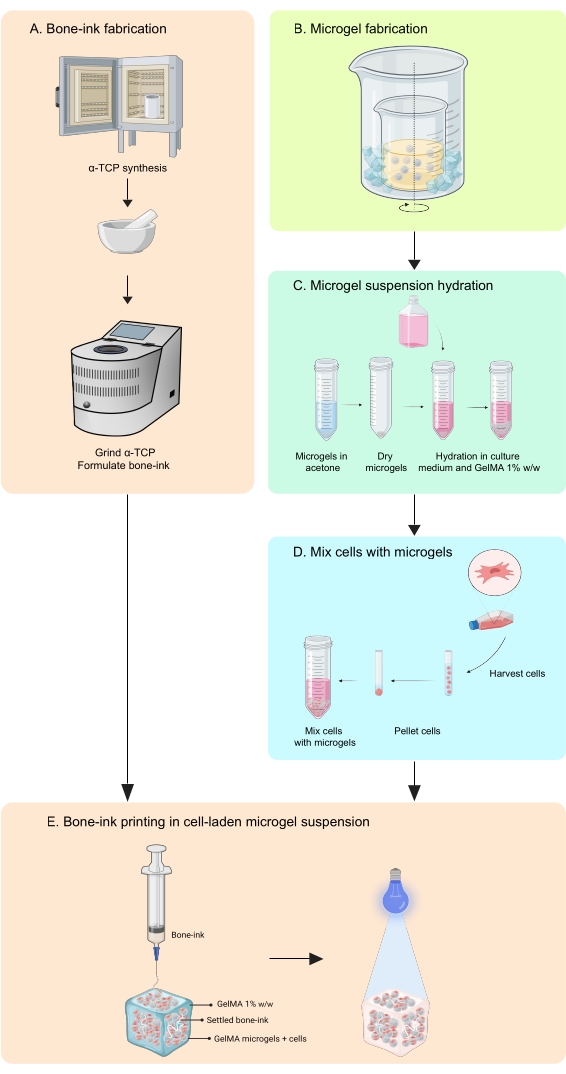
Figura 1: Schema del flusso di lavoro . (A) L'inchiostro osseo viene sintetizzato a partire dalla sintesi del fosfato α-tricalcico e dalla sua successiva combinazione con glicerolo, polisorbato 80 e fosfato di ammonio bibasico. (B) I microgel GelMA sono fabbricati con il metodo dell'emulsione acqua-in-olio. I microgel ottenuti sono quindi (C) idratati e (D) combinati con le cellule. I compositi di microgel cellulare vengono quindi utilizzati come bagno granulare in cui viene depositato l'inchiostro osseo. (E) L'intero costrutto viene quindi reticolato UV e trasferito all'incubatore per la cultura. Abbreviazioni: α-TCP = fosfato α-tricalcico; GelMA = metacrilato di gelatina. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Fabbricazione di inchiostro osseo
- Sintesi del fosfato α-tricalcico
- Pesare le polveri di idrogeno fosfato di calcio (CaHPO4) e carbonato di calcio (CaCO 3) in un rapporto molare Ca:P di3:2. Usando una spatola, omogeneizzare accuratamente le due polveri.
- Aggiungere la miscela di polvere di calcio idrogeno fosfato-carbonato di calcio in un crogiolo di zirconia in modo che non sia pieno più del 75%.
NOTA: Per evitare contaminazioni, utilizzare un nuovo crogiolo o un crogiolo precedentemente utilizzato per produrre lo stesso materiale. Per la pulizia, risciacquare con etanolo al 100% e asciugare all'aria in una cappa aspirante fino a completa asciugatura prima di aggiungere le polveri. - Trasferire il crogiolo in una fornace. Riscaldare a 1.400 °C alla velocità di 5 °C/min e conservare per 3 ore.
- Estinguere la reazione rimuovendo il crogiolo dal forno e lasciarlo in cima a un blocco refrattario. Lasciare raffreddare completamente prima di manipolarlo.
NOTA: Utilizzare pinze per crogiolo di lunghezza adeguata e garantire un'adeguata protezione dal calore. - Utilizzare un mortaio e un pestello per rompere e macinare la torta α-TCP in modo che i granuli risultanti abbiano una dimensione massima di 200 μm.
NOTA: Utilizzare un setaccio standard in acciaio inossidabile per garantire la corretta dimensione delle particelle. - Macinare ulteriormente i granuli usando un mulino planetario in due fasi. In primo luogo, aggiungere sfere di zirconia stabilizzate con ittrio da 3 mm in un rapporto di peso di 8: 1 palle: polvere, quindi etanolo al 100% in un rapporto di peso di 3: 1 etanolo: polvere. Chiudere il coperchio e macinare per 2 ore a 180 giri/min.
- Raccogliere la sospensione e separare le palline, utilizzando etanolo al 100% per il lavaggio.
- Asciugare la sospensione in forno a 120 °C per 24 ore.
- Aggiungere la polvere essiccata ai barattoli di macinazione con sfere di zirconia da 1 mm e etanolo al 100% negli stessi rapporti di peso del primo stadio. Macinare per 2 ore a 180 giri/min, separare e asciugare.
NOTA: l'intera procedura di sintesi è rappresentata nella Figura 1A.
- Formulazione di inchiostro osseo
- Per fare l'inchiostro osseo, aggiungere 2 g di polvere α-TCP in un barattolo di mulino a sfere che contiene 630 μL di glicerolo e 130 μL di polisorbato 80 mescolando continuamente con una spatola.
- Aggiungere 100 mg di fosfato bibasico di ammonio ((NH 4)2HPO4, APD) e mescolare per amalgamare.
NOTA: L'eccessivo residuo di fasi liquide lasciato sulla spatola comporterà uno squilibrio del rapporto dei componenti dell'inchiostro e, quindi, della cinetica di presa. - Aggiungere una sfera di zirconia da 25 mm, fissare il coperchio e posizionarlo all'interno di un mulino planetario per 60 minuti a 180 giri / min, fermandosi a metà strada per raschiare i lati del barattolo con una spatola.
- Utilizzando una spatola, caricare l'inchiostro in una siringa da 1 ml. Avvolgere adeguatamente per evitare il contatto con l'umidità. Conservare a -20 °C se non utilizzato immediatamente.
- Caratterizzazione della microstruttura dell'inchiostro osseo
- Stampare l'inchiostro osseo in acqua deionizzata e lasciare agire per 5 min.
- Lavare il campione 3 volte con etanolo al 100% e lasciarlo asciugare completamente.
- Rivestire con uno strato sottile (spessore 15 nm) di oro.
- Acquisire micrografie utilizzando un microscopio elettronico a scansione ad emissione di campo a una tensione di accelerazione di 5 kV.
2. Fabbricazione di sospensioni in microgel per la stampa
- Sintesi di GelMA
NOTA: Questa procedura è stata testata per lotti composti da 10 g e 20 g di gelatina. Questo metodo dettaglia le misurazioni per un lotto utilizzando 10 g.- Preparare una soluzione al 10% p/p di gelatina di tipo A (suino, Bloom strength 300) in 1x soluzione salina tamponata fosfato (PBS) pesando 10 g di gelatina e aggiungendola a un matraccio conico con 90 ml di PBS. Riscaldare a 50 °C mescolando fino a completa dissoluzione della gelatina.
- Aggiungere 5,796 ml di anidride metacrilica. Introdurre un cappuccio di gomma sul matraccio conico e continuare a mescolare al buio a 50 °C per 90 minuti.
ATTENZIONE: L'anidride metacrilica è tossica se inalata o ingerita ed è irritante per la pelle e gli occhi. Maneggiare solo all'interno di una cappa aspirante e utilizzare DPI appropriati. - Estinguere la reazione diluendo il contenuto del matraccio conico due volte con PBS.
- Decantare in provette da 50 ml e centrifugare a 3.000 × g a temperatura ambiente per 3 minuti per rimuovere l'anidride metacrilica non reagita.
- Dializzare il surnatante all'interno di tubi di dialisi di cellulosa cutoff 14 kDa contro acqua deionizzata a 40 °C per 5 giorni mescolando delicatamente. Sostituire l'acqua deionizzata ogni giorno.
- Preparare per la conservazione travasando in tubi da 50 ml, fissando il tappo e mettendolo in frigorifero per 12 ore. Conservare in frigorifero per un massimo di 7 giorni.
- Congelare con azoto liquido e liofilizzare immediatamente per 5 giorni a -54 °C e 0,4 mbar.
NOTA: Assicurarsi che i tubi non contengano più di 40 ml di liquido durante il congelamento. Una volta congelato, sostituire il cappuccio con un rivestimento che consenta lo scambio di gas, come una delicata salvietta da lavoro fissata con un elastico. - Conservare la schiuma risultante in un congelatore a -20 °C fino a quando necessario per la sintesi della sospensione di microgel.
- Sintesi dei microgel GelMA
NOTA: I microgel sono sintetizzati utilizzando un metodo di emulsione acqua-in-olio13 (Figura 2). Questo metodo è stato testato per volumi di soluzione GelMA da 1 a 10 ml. Lo stesso protocollo può essere utilizzato per sintetizzare microgel di gelatina utilizzati per stampare impronte ossee standalone.- Preparare una soluzione di GelMA al 10% p/p in PBS pesando il GelMA liofilizzato, aggiungendolo a un tubo con PBS e riscaldandolo a bagnomaria a 50 °C fino a completa idratazione.
- Aggiungere 37 ml di olio per 1 mL di soluzione di GelMA in un becher, assicurandosi che non sia pieno più del 65%.
- Impostare un sistema a doppio becher su una piastra riscaldante con agitazione magnetica posizionando il becher contenente olio all'interno di un becher più grande.
NOTA: La dimensione dei due becher dovrebbe essere tale che il ghiaccio possa essere facilmente lasciato cadere nello spazio tra le loro pareti. L'impostazione è illustrata nella Figura 2. - Riscaldare a 40 °C mescolando.
NOTA: Assicurarsi che il vortice non sia turbolento e abbia una profondità di circa 1/3 dell'altezza dell'olio nel becher. - Caricare la soluzione di GelMA in una siringa e aggiungerla goccia nell'olio di agitazione attraverso un filtro da 0,45 μm. Lasciare equilibrare l'emulsione per 10 minuti.
- Ridurre la temperatura dell'emulsione a 15 °C per stabilizzare termicamente le sfere aggiungendo ghiaccio tritato nello spazio tra i due becher.
- Aggiungere acetone all'emulsione rotante in un rapporto di volume di 1:11 soluzione GelMA ad acetone.
NOTA: Aggiungere l'acetone delicatamente attraverso un imbuto per evitare di interrompere l'emulsione. Mescolare per 60 min. - Decantare il contenuto del becher in tubi da 50 ml, assicurandosi di lavare le pareti del becher con acetone. Lasciare agire per 20 minuti per consentire ai microgel disidratati di depositarsi sul fondo.
- Scartare il surnatante e lavarne almeno 2 volte con acetone.
NOTA: Il surnatante deve essere chiaro. - Consolidare in un tubo, rabboccare con acetone e sonicare per 10 s. Lavare 2x con acetone.
- Conservare in acetone a temperatura ambiente fino a quando necessario per la stampa.
- Preparazione della sospensione in microgel GelMA per la stampa
- Preparare una soluzione all'1% p/p di GelMA nel Modified Eagle Medium (DMEM) di Dulbecco pesando il GelMA liofilizzato in un tubo, aggiungendo DMEM e riscaldando a bagnomaria a 50 °C fino a completa idratazione.
- Far evaporare l'acetone dai microgel disidratati e pesare la polvere risultante in un tubo. Aggiungere acetone e trasferire in un ambiente sterile.
- Per formare la sospensione di microgel, far evaporare l'acetone e aggiungere DMEM, soluzione di GelMA all'1% p/p in DMEM e soluzione iniziatore del 2,5% p/p di iniziatore di fenil-2,4,6-trimetilbenzoilfosfinato (LAP) al 2,5% p/p per ottenere una frazione finale di confezionamento del 30%. Lasciare idratare completamente per almeno 12 ore a temperatura ambiente. Conservare in frigorifero per un massimo di 7 giorni. Lasciare arrivare a temperatura ambiente prima dell'uso.
NOTA: I volumi di questi reagenti sono basati sul peso secco dei microgel e possono essere calcolati utilizzando le equazioni nella Tabella 1.
| Equazione | |
| x = peso dei microgel secchi (mg) | |
| Volume dell'1% p/p di GelMA in DMEM, a (μL) | a = 21,93x |
| Volume di DMEM, b (μL) | b = 8,773x |
| Volume della soluzione LAP al 2,5% p/p, c (μL) | c = 0,6267x |
| Volume totale della sospensione di microgel prodotta (μL) | a + b + c |
Tabella 1: Equazioni per il calcolo dei volumi di reagenti necessari per idratare le sospensioni di microgel GelMA. Abbreviazioni: GelMA = gelatina metacrilato; LAP = litio fenil-2,4,6-trimetilbenzoilfosfinato.
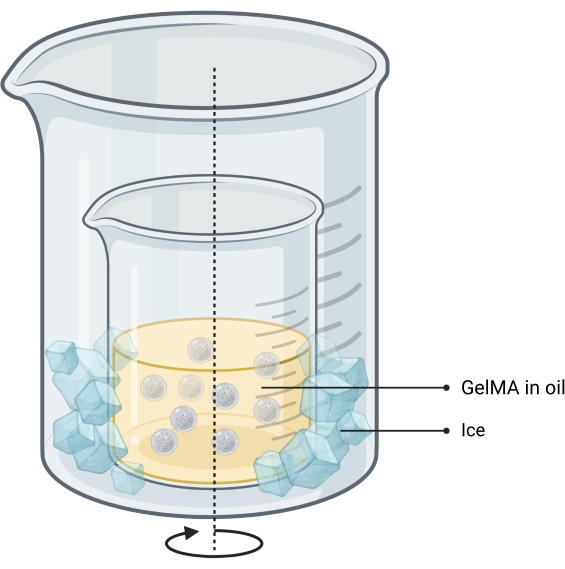
Figura 2: Schema del metodo olio-emulsione utilizzato per la sintesi di microgel. La configurazione a doppio becher mostra un becher contenente l'emulsione di agitazione (indicata da una freccia) posta all'interno di un becher più grande per consentire il raffreddamento. Abbreviazione: GelMA = gelatina metacrilato Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Stampa di inchiostro osseo in sospensioni cellulari
NOTA: I microgel a base di gelatina supportano l'adesione di molti tipi di cellule diverse, il che rende questo approccio suscettibile di cellule singole e multiple all'interno della matrice di microgel. Questo protocollo descrive la procedura per l'utilizzo di cellule staminali mesenchimali derivate dal tessuto adiposo (ADSC), in quanto si tratta di un tipo di cellula popolare e robusta per l'ingegneria del tessuto muscoloscheletrico.
- Coltura le ADSC in DMEM a basso contenuto di glucosio integrate con siero bovino fetale al 10% e penicillina-streptomicina all'1% a 37 °C e CO 2 al 5% fino alla confluente.
- Staccare gli ADSC dal matraccio di coltura tissutale rimuovendo il terreno, lavando con PBS sterile e incubando a 37 °C e 5% di CO2 con tripsina allo 0,25% per 3 minuti.
- Pellettare le celle centrifugando a 150 × g a temperatura ambiente per 5 min.
- Contare le celle e calcolare 5 × 105 celle per ogni 1 mL di microgel GelMA. Allocare il volume richiesto di sospensione cellulare a un tubo separato e pellet come sopra.
- Rimuovere con attenzione quanto più surnatante possibile usando una pipetta, lasciando solo il pellet cellulare. Aggiungere il volume richiesto di sospensione di microgel al pellet e aspirare delicatamente per garantire una distribuzione uniforme delle cellule.
NOTA: Se ci sono bolle d'aria in eccesso nella sospensione, centrifugare delicatamente per rimuovere e pipettare su e giù per ridistribuire le celle. - Caricare la sospensione di microgel carica di cellule in un reattore utilizzando una pipetta.
NOTA: Nel presente studio, sono stati stampati in 3D reattori da 10 mm x 10 mm x 3 mm con una capacità volumetrica di 100 μL. - Depositare l'inchiostro osseo utilizzando una siringa da 1 mL dotata di un ago da 23 G.
NOTA: Questo può essere fatto con una stampante 3D installando un sistema di estrusione che consente di stampare direttamente dalla siringa da 1 mL o caricando l'inchiostro osseo direttamente nella cartuccia di estrusione della stampante (Figura 3). - Reticolazione del costrutto di microgel GelMA carico di inchiostro cellulare e osseo con una lampada reticolante UV (405 nm) per 90 s. Trasferire immediatamente su una piastra del pozzo di dimensioni appropriate e coprire con DMEM completo.
NOTA: I suddetti reattori stampati in 3D si inseriscono all'interno di piastre di coltura cellulare a 24 pozzetti. - Incubare a 37 °C e 5% CO2. Sostituire il terreno di coltura dopo 24 ore, quindi ogni 48-72 ore secondo necessità.
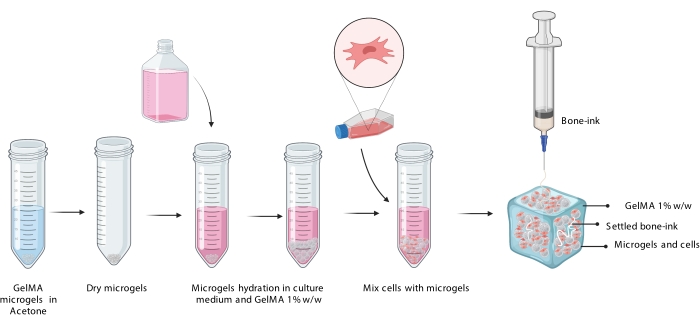
Figura 3: Rappresentazione schematica della procedura COBICS che mostra l'idratazione dei microgel, l'incorporazione delle cellule e la successiva stampa di inchiostro osseo nella sospensione di microgel carica di cellule. Abbreviazione: COBICS = ceramic omnidirectional bioprinting in cell-suspensions; GelMA = gelatina metacrilato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Valutazione della vitalità e della proliferazione cellulare
- Per valutare la citotossicità dell'inchiostro osseo, mantenere i costrutti COBICS carichi di cellule in un terreno di coltura completo. Eseguire un test Live Dead a 24 h, 72 h e 120 h (o punti temporali rilevanti).
- Ad ogni punto temporale, lavare i costrutti con PBS, quindi aggiungere una soluzione di DMEM privo di fenolo contenente 4 mM di calceina e 2 mM di bromuro di etidio. Incubare per 1 ora a 37 °C e 5% CO2.
- Lavare con PBS e trasferire su un piatto con fondo di vetro per l'imaging con un microscopio confocale a spettri Ex/Em di 494/517 nm e 528/617 nm.
Access restricted. Please log in or start a trial to view this content.
Risultati
COBICS stampa costrutti complessi e biologicamente rilevanti senza la necessità di materiali di supporto sacrificali o fasi di post-elaborazione difficili (ad esempio, radiazioni e sinterizzazione ad alta temperatura) che sono due delle maggiori sfide nella produzione additiva di costrutti mimetici ossei. Per dimostrare la formazione di COBICS di strutture ossee complesse e la co-stampa di cellule in sospensioni di microgel, sono state prese immagini rappresentative di compositi ossei fatti con l'inchiostro osseo ed è ...
Access restricted. Please log in or start a trial to view this content.
Discussione
La tecnica di stampa 3D COBICS è stata sviluppata per consentire la fabbricazione di strutture simili a ossa mineralizzate tramite estrusione in una sospensione di microgel reticolabile contenente cellule vive. La tecnica è stata applicata a una sospensione di microgel degradabile e le cellule mostrano una buona vitalità, diffusione e capacità di differenziazione osteogenica all'interno del sistema11. Un fattore determinante per il successo dei costrutti creati utilizzando questa tecnica è la...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere alcun conflitto di interessi da divulgare.
Riconoscimenti
Gli autori desiderano ringraziare il National Health and Medical Research Council (Grant no. GNT1111694 e GNT1141602) e l'Australian Research Council (Grant no. FT180100417, FL150100060 e CE14100036). Gli autori vorrebbero riconoscere la Biomedical Imaging Facility presso l'Università del New South Wales. Le figure sono state create con Biorender.com, Adobe Photoshop e Adobe Illustrator e sono state esportate con un abbonamento a pagamento.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Riferimenti
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , CRC Press. Boca Raton, FL. 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757(2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041(2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660(2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986(2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209(2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014(2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520(2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216(2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758(2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490(2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon