JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
뼈 유사체 생성을 위한 세포 함유 현탁액의 세라믹 전방향 바이오프린팅
요약
이 프로토콜은 젤라틴 기반 과립 지지체에 인산 칼슘 잉크를 증착하여 뼈와 같은 구조를 제조하는 3D 프린팅 기술을 설명합니다. 인쇄된 뼈 유사체는 다상 구축물을 위한 살아있는 세포 매트릭스 내에서 인쇄물의 직접 수확 또는 가교를 위한 유연성과 함께 자유 형태로 증착됩니다.
초록
구조적으로 뼈 조직은 계층적이고 고도로 광물화된 매트릭스 내에 내장된 대사 활성 세포를 포함하는 무기-유기 복합체입니다. 이 조직은 뼈의 이질적인 환경으로 인해 복제하기가 어렵습니다. 세포 현탁액의 세라믹 전 방향 바이오 프린팅 (COBICS)은 뼈의 미네랄 및 세포 구조를 독특하게 복제하는 마이크로 젤 기반 바이오 프린팅 기술입니다. COBICS는 뼈 모방 구조물의 적층 제조에서 가장 큰 두 가지 과제인 희생 지지 재료나 가혹한 후처리 단계(예: 방사선 및 고온 소결)가 필요 없이 복잡하고 생물학적으로 관련된 구조물을 인쇄합니다. 이 기술은 젤라틴 기반 마이크로겔 현탁액 내에서 새로운 인산칼슘 기반 잉크의 자유형 압출을 통해 가능합니다. 현탁액의 항복 응력 특성은 증착을 허용하고 인쇄된 뼈 구조를 지지합니다. UV 가교 및 나노 침전은 제자리에 "고정"됩니다. 세포가 함유된 생체 재료 내에서 나노 구조의 뼈 모방 세라믹을 인쇄하는 기능은 거시적 및 미시적 아키텍처에 대한 시공간 제어를 제공하고 임상 환경에서 복잡한 뼈 구조의 실시간 제조를 용이하게 합니다.
서문
뼈는 내인성 치유능력이 손상되었을 때 치명적인 결함 크기까지 정상적인 세포 구성, 방향 및 기계적 강도를 재현하여 치유할 수 있는 신체의 몇 안 되는 구조 중 하나로서 놀라운 재생 능력을 가지고 있습니다1. 뼈는 연골 및 인대와 함께 신체 움직임을 지원하고 촉진하는 동시에 미네랄과 지방을 저장하고 혈액 세포를 생성합니다. 단단하고 조밀 한 결합 조직으로서 뼈는 주로 무기상, 물 및 콜라겐 섬유로 주로 구성된 유기 물질로 구성됩니다2. 세포는 콜라겐 I 섬유와 수산화인회석(HA) 결정의 고도로 광물화된 매트릭스 내에 내장되어 계층적 구조3를 형성합니다.
이 조직의 복잡한 조직은 이질적인 뼈 마이크로 및 나노 환경을 복제하기 위한 합성 대안의 제조를 매우 어렵게 만듭니다3. 이를 위해 바이오 세라믹, 세포 함유 하이드로 겔 및 합성 재료를 포함한 다양한 재료가 뼈 매트릭스를 만드는 솔루션으로 제안되었습니다. 비계 제조 기술 중 3D 프린팅 기반 기술이 최근에 등장하여 환자 맞춤형 치료의 큰 가능성을 가진 매우 정교하고 정밀한 구조의 제조를 허용하는 놀라운 능력으로 인해 조직 공학 커뮤니티에서 많은 관심을 받았습니다.4,5,6 . 하이드로겔은 매트릭스 모조물 및 바이오잉크의 가장 인기 있는 선택이었으며, 이는 이들이 세포 및 생리활성 분자와 함께 인쇄되어 기능적 구축물6을 생성할 수 있기 때문이다. 그러나 하이드로겔은 기계적 강도와 대사 활성 세포를 포함하는 고도로 석회화된 무기상과 같은 뼈의 기능적 특성이 부족합니다.
3D 인쇄 된 세라믹 스캐 폴드는 일반적으로 소결, 고온 처리 또는 시험관 내 또는 생체 내 응용 프로그램 전에 철저히 세척해야하는 가혹한 화학 물질 사용을 포함한 후 처리 단계가 필요합니다5. 이러한 한계를 해결하기 위해 Lode et al.7 은 최근 생리적 조건에서 인쇄 및 설정할 수 있는 하이드록시아파타이트로 형성된 α-인산삼칼슘 기반 페이스트를 개발했습니다. 그러나 이 물질은 습한 환경에서 후처리가 필요하고 장기간 수용액에 담가야 하기 때문에 여전히 살아있는 세포와 함께 인쇄할 수 없습니다.
대안적으로, 무기 입자가 혼입된 세포 함유 하이드로겔이 3D 뼈 매트릭스 8,9의 대체물로서 제안되었다. 세포 생존력을 지원하는 뛰어난 능력에도 불구하고 조밀하게 광물화된 뼈 조직 환경을 요약할 수 없습니다. Thrivikarman et al.10은 나노 스케일 아파타이트 침착을 더 잘 모방하기 위해 비 콜라겐 단백질 유사체와 함께 과포화 칼슘 및 인산염 배지를 사용하는 생체 모방 접근법을 채택했다. 그러나 이들의 구조는 여전히 뼈대와 유사한 마이크로 및 매크로 스케일 아키텍처를 가진 견고한 3D 구조를 생성할 수 없습니다.
본 연구는 세포와 성장 인자11을 모두 통합 할 수있는 무기 및 유기 단계에서 뼈 모방 구조물을 제조하기위한 인쇄 전략의 개발을 통해 이러한 단점을 해결합니다. COBICS는 마이크로젤 기반 바이오프린팅 기술을 사용하여 뼈의 미네랄 및 세포 구조를 독특하게 요약합니다. 본원의 프로토콜은 세라믹 본-잉크 및 젤라틴-기반 마이크로겔을 합성하고, 이어서 COBICS를 가능하게 하는 세포를 조합하는 과정을 설명한다. 이 공정은 뼈 잉크의 주요 전구체 물질의 합성으로 시작됩니다. 그런 다음 가교성 하이드로겔을 합성하여 마이크로겔로 형성합니다. 마지막으로, 뼈 잉크는 세포가 담긴 마이크로젤의 지지 수조에 전방향으로 증착됩니다(그림 1).
본-잉크는 적절한 항복-응력 특성, 즉 특정 전단 속도에서 유동화하고 후속적으로 증착된 구조를 지지하는 능력을 갖는 마이크로겔의 임의의 현탁액에 인쇄될 수 있다. 두 가지 유연한 접근법이 입증되었습니다 : 젤라틴 마이크로 겔로 구성된 현탁액과 젤라틴 메타 크릴 레이트 (GelMA) 마이크로 겔로 구성된 현탁액. 전자의 현탁액은 온도가 37°C로 상승될 때, 부유된 하이드로겔의 자유형 가역적 임베딩(FRESH) 기술(12)에서 용해되는 반면, 후자는 인쇄 후에 광가교결합될 수 있고, 마이크로겔을 효과적으로 "스티칭"하고 인쇄된 뼈-잉크를 제자리에 고정시킬 수 있다. 본 연구는 복잡한 뼈 모방 구조의 현장 인쇄로 세포 성장을 지원할 수 있다는 독특한 이점을 제공하기 때문에 GelMA를 매트릭스로 사용하는 데 중점을 둡니다. 궁극적으로 이 접근 방식은 질병 모델링, 약물 발견 및 재생 공학에 대한 높은 수준의 생체 모방과 광범위한 영향을 가진 복잡한 조직 모델의 생성을 가능하게 합니다.
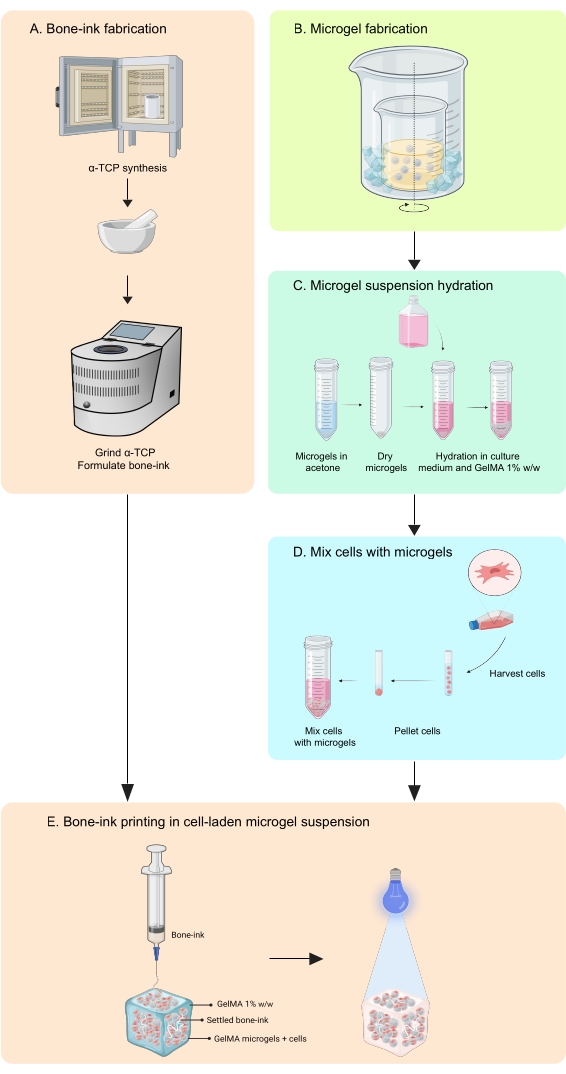
그림 1: 워크플로의 개략도 . (A) 뼈 잉크는 α-인산 삼칼슘 합성과 글리세롤, 폴리소르베이트 80 및 인산이염기성 암모늄과의 후속 조합에서 시작하여 합성됩니다. (B) GelMA 마이크로젤은 유중수 에멀젼 방법으로 제조됩니다. 수득 된 마이크로 겔은 (C) 수화되고 (D) 세포와 결합된다. 세포-마이크로겔 복합체는 뼈-잉크가 증착되는 과립 욕조로 사용됩니다. (E) 그런 다음 전체 구축물을 UV 가교하여 배양을 위해 인큐베이터로 옮깁니다. 약어 : α-TCP = α- 인산 삼 칼슘; 겔마 = 젤라틴 메타크릴레이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 뼈 잉크 제작
- α-인산삼칼슘의 합성
- 인산 수소 칼슘 (CaHPO4)과 탄산 칼슘 (CaCO 3) 분말을3 : 2 Ca:P 몰비로 계량합니다. 주걱을 사용하여 두 분말을 완전히 균질화하십시오.
- 인산 수소 칼슘-탄산 칼슘 분말 혼합물을 지르코니아 도가니에 첨가하여 75 % 이하가되도록합니다.
알림: 오염을 방지하려면 새 도가니 또는 이전에 동일한 재료를 만드는 데 사용한 도가니를 사용하십시오. 청소하려면 100% 에탄올로 헹구고 분말을 추가하기 전에 완전히 건조될 때까지 흄 후드에서 자연 건조하십시오. - 도가니를 용광로로 옮깁니다. 5 °C/min의 속도로 1,400°C로 가열하고 3시간 동안 유지합니다.
- 용광로에서 도가니를 제거하여 반응을 담금질하고 내화 블록 위에 두십시오. 취급하기 전에 완전히 식히십시오.
알림: 적절한 길이의 도가니 집게를 사용하고 적절한 열 보호를 보장하십시오. - 박격포와 유봉을 사용하여 α-TCP 케이크를 깨고 갈아서 생성 된 과립의 최대 크기가 200μm가되도록합니다.
알림: 올바른 입자 크기를 보장하기 위해 표준 스테인리스 스틸 체를 사용하십시오. - 유성 분쇄기를 사용하여 과립을 2 단계로 더 분쇄하십시오. 먼저 3mm 이트리아 안정화 지르코니아 볼을 8 : 1 볼 : 분말의 중량비로 추가 한 다음 100 % 에탄올을 3 : 1 에탄올 : 분말의 중량비로 첨가합니다. 뚜껑을 단단히 닫고 180rpm에서 2시간 동안 분쇄합니다.
- 현탁액을 모으고 세척을 위해 100 % 에탄올을 사용하여 볼을 분리하십시오.
- 현탁액을 120°C의 오븐에서 24시간 동안 건조시킨다.
- 건조 된 분말을 1mm 지르코니아 볼과 100 % 에탄올로 분쇄 용기에 첫 번째 단계와 동일한 중량비로 첨가하십시오. 180rpm에서 2시간 동안 분쇄하고 분리하고 건조시킵니다.
참고: 전체 합성 절차는 그림 1A에 나와 있습니다.
- 뼈 잉크의 배합
- 뼈 잉크를 만들려면 주걱으로 계속 저으면서 글리세롤 630μL와 폴리소르베이트 80 130μL가 포함된 볼 밀 용기에 α-TCP 분말 2g을 추가합니다.
- 인산암모늄 이염기성((NH4)2HPO4, APD) 100mg을 넣고 섞이도록 저어줍니다.
참고: 주걱에 액체 상의 과도한 잔류물이 남아 있으면 잉크 구성 요소의 비율 불균형이 발생하여 경화 역학이 발생합니다. - 25mm 지르코니아 볼을 넣고 뚜껑을 단단히 고정한 다음 180rpm에서 60분 동안 유성 밀 안에 넣고 중간에 멈춰 주걱으로 항아리의 측면을 긁어냅니다.
- 주걱을 사용하여 잉크를 1mL 주사기에 넣습니다. 습기와의 접촉을 피하기 위해 적절하게 포장하십시오. 즉시 사용하지 않을 경우 -20 ° C에서 보관하십시오.
- 뼈 잉크 미세 구조 특성화
- 뼈 잉크를 탈이온수에 인쇄하고 5분 동안 그대로 둡니다.
- 샘플을 100 % 에탄올로 3 회 세척하고 완전히 건조시킵니다.
- 얇은 금 층 (두께 15nm)으로 코팅하십시오.
- 5kV의 가속 전압에서 전계 방출 주사 전자 현미경을 사용하여 현미경 사진을 캡처합니다.
2. 인쇄용 마이크로젤 현탁액 제조
- 겔마의 합성
알림: 이 절차는 10g과 20g의 젤라틴으로 구성된 배치 크기에 대해 테스트되었습니다. 이 방법은 10g을 사용하는 배치에 대한 측정을 자세히 설명합니다.- 젤라틴 10g의 무게를 달고 90mL의 PBS가 있는 원뿔형 플라스크에 추가하여 1x 인산염 완충 식염수(PBS)에 젤라틴 유형 A(돼지, 블룸 강도 300)의 10% w/w 용액을 만듭니다. 젤라틴이 완전히 용해될 때까지 교반하면서 50°C로 가열한다.
- 메타크릴 무수물 5.796mL를 추가합니다. 원뿔형 플라스크에 고무 캡을 놓고 50 ° C의 어두운 곳에서 90 분 동안 계속 교반합니다.
주의 : 메타 크릴 무수물은 흡입하거나 삼키면 독성이 있으며 피부와 눈을 자극합니다. 흄 후드 내부만 다루고 적절한 PPE를 사용하십시오. - 원뿔형 플라스크의 내용물을 PBS로 2배 희석하여 반응을 담금질합니다.
- 50mL 튜브에 디캔트하고 실온에서 3,000× g 에서 3분 동안 원심분리하여 미반응 메타크릴산 무수물을 제거합니다.
- 상청액을 14 kDa 컷오프 셀룰로스 투석관 내부의 탈이온수에 대해 40°C에서 5일 동안 부드럽게 교반하면서 투석한다. 탈이온수를 매일 교체하십시오.
- 50mL 튜브에 디캔팅하고 캡을 고정한 다음 냉장고에 12시간 동안 넣어 보관 준비를 합니다. 냉장고에 최대 7 일 동안 보관하십시오.
- 액체 질소를 사용하여 동결하고 즉시 -54 °C 및 0.4 mbar에서 5 일 동안 동결 건조한다.
알림: 냉동 시 튜브에 40mL 이하의 액체가 들어 있는지 확인하십시오. 얼면 뚜껑을 탄성 밴드로 고정 된 섬세한 작업 물티슈와 같은 가스 교환이 가능한 덮개로 교체하십시오. - 생성된 폼을 마이크로겔 현탁액 합성에 필요할 때까지 -20°C의 냉동고에 보관하십시오.
- 겔마 마이크로젤의 합성
참고: 마이크로겔은 유중수 에멀젼 방법13 을 사용하여 합성됩니다(그림 2). 이 방법은 1-10 mL의 GelMA 용액 부피에 대해 테스트되었습니다. 동일한 프로토콜을 사용하여 독립형 뼈 인쇄물을 인쇄하는 데 사용되는 젤라틴 마이크로젤을 합성할 수 있습니다.- 동결건조된 GelMA를 칭량하고, PBS가 있는 튜브에 첨가하고, 완전히 수화될 때까지 50°C의 수조에서 가열하여 PBS에서 10% w/w GelMA 용액을 만듭니다.
- GelMA 용액 1mL당 오일 37mL를 비커에 추가하여 65% 이하로 가득 차 있는지 확인합니다.
- 더 큰 비커 내부에 오일이 포함된 비커를 배치하여 자기 교반이 가능한 핫 플레이트에 이중 비커 시스템을 설정합니다.
알림: 두 비커의 크기는 얼음이 벽 사이의 공간에 쉽게 떨어질 수 있도록 해야 합니다. 설정은 그림 2에 나와 있습니다. - 교반하면서 40 °C로 가열합니다.
알림: 와류가 난류가 아니며 비커의 오일 높이의 약 1/3 깊이인지 확인하십시오. - GelMA 용액을 주사기에 넣고 0.45μm 필터를 통해 교반 오일에 적가합니다. 에멀젼이 10분 동안 평형을 이루도록 합니다.
- 에멀젼의 온도를 15°C로 낮추어 두 비커 사이의 공간에 분쇄된 얼음을 추가하여 구체를 열적으로 안정화시킵니다.
- 아세톤에 대한 1:11 GelMA 용액의 부피비로 방사 에멀젼에 아세톤을 첨가한다.
알림: 에멀젼이 손상되지 않도록 깔때기를 통해 아세톤을 부드럽게 첨가하십시오. 60분 동안 저어줍니다. - 비커의 내용물을 50mL 튜브에 넣고 비커의 벽을 아세톤으로 씻으십시오. 탈수 된 마이크로 젤이 바닥에 가라 앉을 수 있도록 20 분 동안 그대로 두십시오.
- 상청액을 버리고 아세톤으로 최소 2x 세척하십시오.
알림: 상청액은 깨끗해야 합니다. - 하나의 튜브로 통합하고 아세톤으로 채우고 10 초 동안 초음파 처리합니다. 아세톤으로 2 번 씻으십시오.
- 인쇄에 필요할 때까지 실온에서 아세톤에 보관하십시오.
- 인쇄를 위한 GelMA 마이크로젤 현탁액 준비
- 동결 건조 된 GelMA를 튜브에 칭량하고 DMEM을 첨가하고 완전히 수화 될 때까지 50 ° C의 수조에서 가열하여 Dulbecco의 변형 된 독수리 배지 (DMEM)에서 GelMA의 1 % w / w 용액을 준비합니다.
- 탈수 된 마이크로 겔에서 아세톤을 증발시키고 생성 된 분말을 튜브에 칭량합니다. 아세톤을 첨가하고 멸균 환경으로 옮깁니다.
- 마이크로겔 현탁액을 형성하려면 아세톤을 증발시키고 DMEM, DMEM에 1% w/w GelMA 용액 및 2.5% w/w 리튬 페닐-2,4,6-트리메틸벤조일포스피네이트(LAP) 개시제 용액을 추가하여 최종 패킹 분율 30%를 달성합니다. 실온에서 최소 12시간 동안 완전히 수분을 공급하십시오. 냉장고에 최대 7 일 동안 보관하십시오. 사용하기 전에 실온에 도달하십시오.
참고: 이러한 시약의 부피는 마이크로젤의 건조 중량을 기준으로 하며 표 1의 방정식을 사용하여 계산할 수 있습니다.
| 방정식 | |
| x = 건조 마이크로젤의 중량(mg) | |
| DMEM에서 1 % w / w 겔마의 부피 (μL) | ᅡ = 21.93배 |
| DMEM의 부피, b (μL) | b = 8.773배 |
| 2.5 % w / w LAP 용액의 부피, c (μL) | 씨 = 0.6267배 |
| 생성 된 마이크로 겔 현탁액의 총 부피 (μL) | a + b + c |
표 1: GelMA 마이크로겔 현탁액을 수화하는 데 필요한 시약의 부피를 계산하기 위한 방정식. 약어 : GelMA = 젤라틴 메타 크릴 레이트; LAP = 리튬 페닐 -2,4,6- 트리메틸 벤조일 포스 피 네이트.
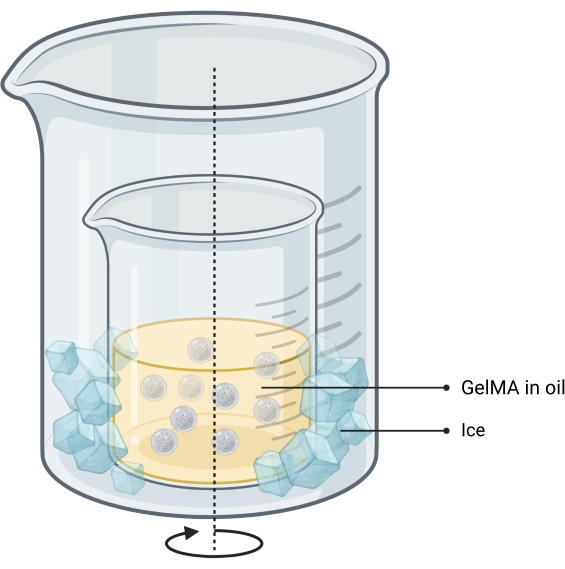
그림 2: 마이크로겔 합성에 사용되는 오일-에멀젼 방법의 개략도. 이중 비커 설정은 냉각을 허용하기 위해 더 큰 비커 내부에 배치된 교반(화살표로 표시된) 에멀젼을 포함하는 비커를 보여줍니다. 약어: GelMA = 젤라틴 메타크릴레이트 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 셀 현탁액에 뼈 잉크 인쇄
참고: 젤라틴 기반 마이크로젤은 다양한 세포 유형의 접착을 지원하므로 이 접근 방식은 마이크로젤 매트릭스 내의 단일 및 다중 세포에 적용할 수 있습니다. 이 프로토콜은 근골격계 조직 공학에 널리 사용되고 강력한 세포 유형인 지방 유래 중간엽 줄기세포(ADSC)를 사용하는 절차를 설명합니다.
- ADSC를 합류할 때까지 37°C 및 5%CO2 에서 10% 태아 소 혈청 및 1% 페니실린-스트렙토마이신이 보충된 저포도당 DMEM에서 배양한다.
- 배지를 제거하고, 멸균 PBS로 세척하고, 3분 동안 0.25% 트립신과 함께 37°C 및 5%CO2 에서 인큐베이션함으로써 조직 배양 플라스크로부터 ADSCs를 분리한다.
- 실온에서 5분 동안 150× g 으로 원심분리하여 세포를 펠릿화합니다.
- 세포를 세고 GelMA 마이크로젤 1mL당 5 ×10 5 세포를 계산합니다. 필요한 양의 세포 현탁액을 위와 같이 별도의 튜브와 펠릿에 할당합니다.
- 피펫을 사용하여 가능한 한 많은 상청액을 조심스럽게 제거하고 세포 펠릿 만 남겨 둡니다. 필요한 양의 마이크로젤 현탁액을 펠릿에 추가하고 부드럽게 흡인하여 균일한 세포 분포를 보장합니다.
알림: 현탁액에 과도한 기포가 있는 경우 부드럽게 원심분리하여 제거하고 위아래로 피펫팅하여 세포를 재분배합니다. - 세포가 함유된 마이크로겔 현탁액을 피펫을 사용하여 반응기에 로드합니다.
참고: 본 연구에서는 부피 용량이 100μL인 10mm x 10mm x 3mm 반응기를 3D 프린팅했습니다. - 23G 바늘이 장착된 1mL 주사기를 사용하여 뼈 잉크를 넣습니다.
참고: 3D 프린터에서는 1mL 주사기에서 직접 인쇄할 수 있는 압출 시스템을 개조하거나 뼈 잉크를 프린터의 압출 카트리지에 직접 로드하여 이 작업을 수행할 수 있습니다(그림 3). - 셀 및 뼈 잉크가 함유된 GelMA 마이크로겔 구조체를 UV 가교제 램프(405nm)로 90초 동안 가교결합합니다. 즉시 적절한 크기의 웰 플레이트로 옮기고 완전한 DMEM으로 덮습니다.
참고: 앞서 언급한 3D 프린팅 반응기는 24웰 세포 배양 플레이트 내부에 맞습니다. - 37°C 및 5%CO2에서 배양한다. 배양 배지를 24시간 후에 교체한 다음 필요에 따라 48-72시간마다 교체합니다.
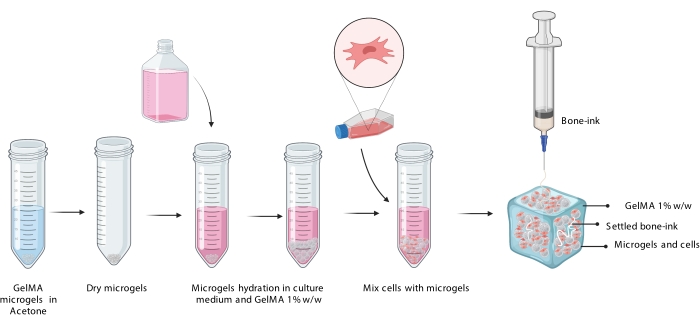
그림 3 : 마이크로 젤의 수화, 세포의 통합 및 세포가 함유 된 마이크로 젤 현탁액에서 뼈 잉크의 후속 인쇄를 보여주는 COBICS 절차의 개략적 표현. 약어 : COBICS = 세포 현탁액의 세라믹 전 방향 바이오 프린팅; 겔마 = 젤라틴 메타크릴레이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 세포 생존율 및 증식 평가
- 뼈 잉크 세포 독성을 평가하려면 세포가 함유된 COBICS 구조물을 완전한 배양 배지에 보관하십시오. 24시간, 72시간 및 120시간(또는 관련 시점)에 Live Dead 분석을 수행합니다.
- 각 시점에서, 작제물을 PBS로 세척한 다음, 4 mM 칼세인 및 2 mM 에티듐 브로마이드를 함유하는 페놀-프리 DMEM 용액을 첨가한다. 37°C 및 5%CO2에서 1시간 동안 배양한다.
- PBS로 세척하고 유리 바닥 접시로 옮겨 494/517nm 및 528/617nm의 Ex/Em 스펙트럼에서 컨포칼 현미경으로 이미징합니다.
Access restricted. Please log in or start a trial to view this content.
결과
COBICS는 뼈 모방 구조물의 적층 제조에서 가장 큰 두 가지 과제인 희생 지지 재료나 가혹한 후처리 단계(예: 방사선 및 고온 소결)가 필요 없이 복잡하고 생물학적으로 관련된 구조물을 인쇄합니다. 복잡한 뼈 구조의 COBICS 형성 및 마이크로 겔 현탁액에서 세포의 공동 인쇄를 입증하기 위해 뼈 잉크로 만든 뼈 모양의 복합체의 대표 이미지를 취하고 최대 7 일 동안 COBICS에서 ADSC 생존력의 반 정량 분?...
Access restricted. Please log in or start a trial to view this content.
토론
3D 프린팅 기술 COBICS는 압출을 통해 살아있는 세포를 포함하는 가교 결합 가능한 마이크로 겔 현탁액으로 광물화 된 뼈와 같은 구조를 제조 할 수 있도록 개발되었습니다. 상기 기술은 분해가능한 마이크로겔 현탁액에 적용되었고, 세포는 시스템(11) 내에서 양호한 생존력, 확산 및 골형성 분화 능력을 나타낸다. 이 기술을 사용하여 생성 된 구문의 성공을 결정하는 핵심 요소는 α...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 이해 상충이 없음을 선언합니다.
감사의 말
저자는 국립 보건 및 의학 연구위원회 (보조금 번호. GNT1111694 및 GNT1141602) 및 호주 연구위원회 (보조금 번호. FT180100417, FL150100060 및 CE14100036). 저자는 뉴 사우스 웨일즈 대학의 생물 의학 이미징 시설을 인정하고자합니다. 피규어는 Biorender.com, 어도비 포토샵, 어도비 일러스트레이터로 제작되었으며 유료 구독으로 내보내졌습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
참고문헌
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , CRC Press. Boca Raton, FL. 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757(2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041(2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660(2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986(2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209(2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014(2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520(2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216(2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758(2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490(2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유