Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Bio-impression omnidirectionnelle céramique dans des suspensions chargées de cellules pour la génération d’analogues osseux
Dans cet article
Résumé
Ce protocole décrit une technique d’impression 3D pour fabriquer des structures ressemblant à des os en déposant une encre au phosphate de calcium dans un support granulaire à base de gélatine. Les analogues osseux imprimés sont déposés sous forme libre, avec une flexibilité pour la récolte directe de l’empreinte ou la réticulation dans une matrice de cellules vivantes pour les constructions multiphasiques.
Résumé
Structurellement, le tissu osseux est un composite inorganique-organique contenant des cellules métaboliquement actives intégrées dans une matrice hiérarchique hautement minéralisée. Cette organisation est difficile à reproduire en raison de l’environnement hétérogène de l’os. La bioimpression céramique omnidirectionnelle en suspensions cellulaires (COBICS) est une technique de bio-impression à base de microgel qui reproduit de manière unique la structure minérale et cellulaire de l’os. COBICS imprime des constructions complexes et biologiquement pertinentes sans avoir besoin de matériaux de support sacrificiels ou d’étapes de post-traitement sévères (par exemple, rayonnement et frittage à haute température), qui sont deux des plus grands défis de la fabrication additive de constructions mimétiques osseuses. Cette technique est rendue possible par l’extrusion libre d’une nouvelle encre à base de phosphate de calcium dans une suspension de microgel à base de gélatine. Les propriétés de limite d’élasticité de la suspension permettent le dépôt et soutiennent la structure osseuse imprimée. La réticulation UV et les nanoprécipitations le « verrouillent » ensuite en place. La capacité d’imprimer des céramiques nanostructurées mimétiques osseuses dans des biomatériaux chargés de cellules fournit un contrôle spatio-temporel sur la macro et la micro-architecture et facilite la fabrication en temps réel de constructions osseuses complexes dans des contextes cliniques.
Introduction
L’os a des capacités de régénération remarquables en tant que l’une des rares structures du corps qui peut guérir en recréant sa composition cellulaire normale, son orientation et sa force mécanique jusqu’à une taille de défaut critique, lorsque la capacité de guérison endogène est compromise1. L’os, avec le cartilage et les ligaments, soutient et facilite le mouvement du corps, tout en stockant les minéraux et les graisses et en produisant des cellules sanguines. En tant que tissu conjonctif dur et dense, l’os est principalement composé d’une phase inorganique, d’eau et de matière organique composée principalement de fibres de collagène2. Les cellules sont intégrées dans cette matrice hautement minéralisée de fibres de collagène I et de cristaux d’hydroxyapatite (HA), formant une structure hiérarchique3.
L’organisation complexe de ce tissu rend la fabrication d’alternatives synthétiques pour reproduire les micro et nano-environnements osseux hétérogènes exceptionnellement difficile3. À cette fin, une variété de matériaux, y compris des biocéramiques, des hydrogels chargés de cellules et des matériaux synthétiques ont été proposés comme solutions pour créer des matrices osseuses. Parmi les techniques de fabrication d’échafaudages, les techniques basées sur l’impression 3D ont récemment émergé et ont reçu beaucoup d’attention de la communauté de l’ingénierie tissulaire en raison de leur capacité remarquable à permettre la fabrication de structures hautement sophistiquées et précises avec de grandes promesses de traitement spécifique au patient 4,5,6 . Les hydrogels ont été le choix le plus populaire d’imitations matricielles et de bio-encres car ils peuvent être imprimés avec des cellules et des molécules bioactives, générant des constructions fonctionnelles6. Cependant, les hydrogels n’ont pas les propriétés fonctionnelles de l’os, telles que la résistance mécanique et une phase inorganique hautement calcifiée contenant des cellules métaboliquement actives.
Les échafaudages en céramique imprimés en 3D nécessitent généralement des étapes de post-traitement, y compris le frittage, les traitements à haute température ou l’utilisation de produits chimiques agressifs qui doivent être soigneusement lavés avant les applications in vitro ou in vivo 5. Pour remédier à ces limitations, Lode et coll.7 ont récemment mis au point une pâte à base de phosphate α-tricalcique formée d’hydroxyapatite, qui peut être imprimée et durcie dans des conditions physiologiques. Cependant, ce matériau ne peut toujours pas être imprimé avec des cellules vivantes car il nécessite un post-traitement dans un environnement humide et une immersion ultérieure en solution aqueuse pendant une longue période.
Alternativement, des hydrogels chargés de cellules avec des particules inorganiques incorporées ont été proposés en remplacement de la matrice osseuse 3D 8,9. Malgré leur grande capacité à soutenir la viabilité cellulaire, ils ne sont pas en mesure de récapituler l’environnement du tissu osseux densément minéralisé. Thrivikarman et coll.10 ont adopté une approche biomimétique dans laquelle un milieu sursaturé de calcium et de phosphate a été utilisé avec un analogue protéique non collagène pour mieux imiter le dépôt d’apatite à l’échelle nanométrique. Cependant, leurs constructions ne peuvent toujours pas générer de constructions 3D rigides avec une architecture à l’échelle micro et macro ressemblant à de l’os.
La présente étude comble ces lacunes en élaborant une stratégie d’impression pour fabriquer des constructions imitant les os, en phases inorganiques et organiques, capables d’intégrer à la fois les cellules et les facteursde croissance 11. COBICS récapitule de manière unique la structure minérale et cellulaire de l’os en utilisant une technique de bio-impression à base de microgel. Le protocole décrit ici le processus de synthèse des microgels céramiques à base d’encre d’os et de gélatine, puis de combinaison de cellules permettant COBICS. Le processus commence par la synthèse du principal matériau précurseur de l’encre osseuse. L’hydrogel réticulable est ensuite synthétisé et formé en microgels. Enfin, l’encre osseuse est déposée de manière omnidirectionnelle dans un bain de support des microgels chargés de cellules (Figure 1).
L’encre osseuse peut être imprimée dans n’importe quelle suspension de microgels présentant les caractéristiques de limite d’élasticité appropriées, c’est-à-dire la capacité de fluidiser à une vitesse de cisaillement spécifique et de soutenir ensuite la structure déposée. Deux approches flexibles ont été démontrées : une suspension constituée de microgels de gélatine et une suspension constituée de microgels de méthacrylate de gélatine (GelMA). La première suspension se dissout lorsque la température est portée à 37 °C, la technique d’encastrement réversible d’hydrogels en suspension (FRESH)12, tandis que la seconde peut être photoréticulée après impression, ce qui permet de « coudre » efficacement les microgels ensemble et de verrouiller l’encre osseuse imprimée en place. La présente étude se concentre sur l’utilisation de GelMA comme matrice car elle offre l’avantage unique de pouvoir soutenir la croissance cellulaire avec l’impression in situ de structures mimétiques osseuses complexes. En fin de compte, cette approche permet la génération de modèles tissulaires complexes avec des niveaux élevés de biomimétisme et de vastes implications pour la modélisation de la maladie, la découverte de médicaments et l’ingénierie régénérative.
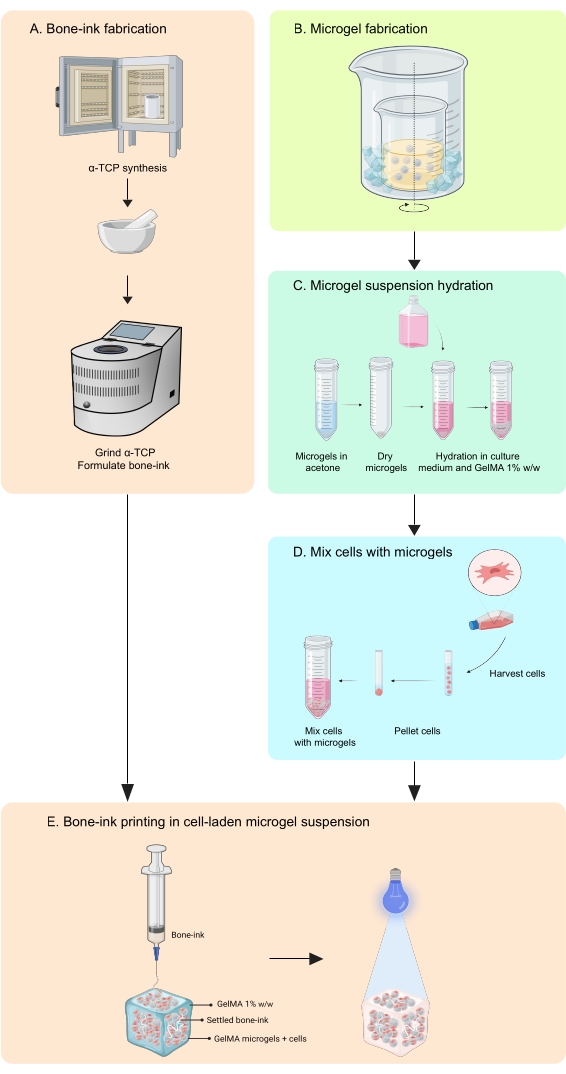
Figure 1 : Schéma du flux de travail. (A) L’encre osseuse est synthétisée à partir de la synthèse du phosphate α-tricalcique et de sa combinaison ultérieure avec du glycérol, du polysorbate 80 et du phosphate d’ammonium dibasique. (B) Les microgels GelMA sont fabriqués par la méthode de l’émulsion eau dans huile. Les microgels obtenus sont alors (C) hydratés et (D) combinés avec des cellules. Les composites cellule-microgel sont ensuite utilisés comme un bain granulaire dans lequel l’encre osseuse est déposée. (E) L’ensemble de la construction est ensuite réticulé par UV et transféré à l’incubateur pour la culture. Abréviations : α-TCP = phosphate α-tricalcique; GelMA = méthacrylate de gélatine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Fabrication à l’encre d’os
- Synthèse du phosphate α-tricalcique
- Peser les poudres d’hydrogénophosphate de calcium (CaHPO4) et de carbonate de calcium (CaCO 3) dans un rapport molaire de3:2 Ca:P. À l’aide d’une spatule, homogénéiser soigneusement les deux poudres.
- Ajouter le mélange de poudre d’hydrogénophosphate de calcium et de carbonate de calcium à un creuset en zircone de telle sorte qu’il ne soit pas rempli à plus de 75%.
REMARQUE : Pour éviter toute contamination, utilisez un creuset neuf ou un creuset précédemment utilisé pour fabriquer le même matériau. Pour nettoyer, rincer à 100% éthanol et sécher à l’air libre dans une hotte jusqu’à ce qu’elle soit complètement sèche avant d’ajouter les poudres. - Transférer le creuset dans un four. Chauffer à 1 400 °C à raison de 5 °C/min et maintenir pendant 3 h.
- Éteignez la réaction en retirant le creuset du four et laissez-le sur un bloc réfractaire. Laissez-le refroidir complètement avant de le manipuler.
NOTE: Utilisez des pinces à creuset d’une longueur appropriée et assurez-vous d’une protection adéquate contre la chaleur. - Utilisez un mortier et un pilon pour casser et broyer le gâteau α-TCP de manière à ce que les granulés obtenus aient une taille maximale de 200 μm.
REMARQUE: Utilisez un tamis standard en acier inoxydable pour vous assurer de la taille correcte des particules. - Broyer ensuite les granulés à l’aide d’un broyeur planétaire en deux étapes. Tout d’abord, ajoutez des billes de zircone stabilisées à l’yttrium de 3 mm dans un rapport de poids de 8: 1 balles: poudre, puis 100% éthanol dans un rapport pondéral de 3: 1 éthanol: poudre. Fixez le couvercle et broyez pendant 2 h à 180 tr/min.
- Récupérez la suspension et séparez les billes, en utilisant 100% d’éthanol pour le lavage.
- Sécher la suspension dans une étuve à 120 °C pendant 24 h.
- Ajouter la poudre séchée dans des bocaux de mouture avec des boules de zircone de 1 mm et 100% éthanol dans les mêmes rapports de poids qu’à la première étape. Broyer pendant 2 h à 180 tr/min, séparer et sécher.
Remarque : L’ensemble de la procédure de synthèse est représenté à la figure 1A.
- Formulation d’encre osseuse
- Pour faire l’encre d’os, ajouter 2 g de poudre α-TCP dans un bocal de broyeur à boulets qui contient 630 μL de glycérol et 130 μL de polysorbate 80 tout en remuant continuellement avec une spatule.
- Ajouter 100 mg de phosphate d’ammonium dibasique ((NH4)2HPO4, APD) et mélanger pour combiner.
REMARQUE: Un résidu excessif de phases liquides laissé sur la spatule entraînera un déséquilibre du rapport des composants de l’encre et, par conséquent, de la cinétique de prise. - Ajouter une boule de zircone de 25 mm, fixer le couvercle et la placer à l’intérieur d’un broyeur planétaire pendant 60 minutes à 180 tr / min, en s’arrêtant à mi-chemin pour gratter les côtés du pot avec une spatule.
- À l’aide d’une spatule, chargez l’encre dans une seringue de 1 mL. Enveloppez adéquatement pour éviter tout contact avec l’humidité. Conserver à −20 °C s’il n’est pas utilisé immédiatement.
- Caractérisation de la microstructure à l’encre osseuse
- Imprimez l’encre osseuse dans de l’eau désionisée et laissez reposer pendant 5 min.
- Lavez l’échantillon 3x avec de l’éthanol à 100% et laissez-le sécher complètement.
- Enduit d’une fine couche (15 nm d’épaisseur) d’or.
- Capturez des micrographies à l’aide d’un microscope électronique à balayage à émission de champ à une tension d’accélération de 5 kV.
2. Fabrication de suspensions de microgel pour l’impression
- Synthèse de GelMA
NOTE: Cette procédure a été testée pour les tailles de lots composés de 10 g et 20 g de gélatine. Cette méthode détaille les mesures pour un lot utilisant 10 g.- Préparer une solution à 10 % p/p de gélatine de type A (porcine, force Bloom 300) dans 1x solution saline tamponnée au phosphate (PBS) en pesant 10 g de gélatine et en l’ajoutant dans une fiole conique contenant 90 ml de PBS. Chauffer à 50 °C en remuant jusqu’à ce que la gélatine soit complètement dissoute.
- Ajouter 5,796 mL d’anhydride méthacrylique. Placer un capuchon en caoutchouc sur la fiole conique et continuer à agiter à l’obscurité à 50 °C pendant 90 min.
ATTENTION : L’anhydride méthacrylique est toxique s’il est inhalé ou avalé et irritant pour la peau et les yeux. Manipuler uniquement à l’intérieur d’une hotte et utiliser un EPI approprié. - Éteindre la réaction en diluant doublement le contenu de la fiole conique avec du PBS.
- Décanter dans des tubes de 50 ml et centrifuger à 3 000 × g à température ambiante pendant 3 minutes pour éliminer l’anhydride méthacrylique n’ayant pas réagi.
- Dialyser le surnageant à l’intérieur de tubes de dialyse cellulosiques de coupure de 14 kDa contre de l’eau désionisée à 40 °C pendant 5 jours en agitant doucement. Remplacez l’eau désionisée tous les jours.
- Préparez-le pour l’entreposage en le décantant dans des tubes de 50 mL, en fixant le bouchon et en le plaçant au réfrigérateur pendant 12 h. Conserver au réfrigérateur jusqu’à 7 jours.
- Congeler à l’azote liquide et lyophiliser immédiatement pendant 5 jours à −54 °C et 0,4 mbar.
REMARQUE : Assurez-vous que les tubes ne contiennent pas plus de 40 mL de liquide lors de la congélation. Une fois congelé, remplacez le capuchon par un revêtement qui permet l’échange de gaz, comme une lingette délicate sécurisée à l’aide d’une bande élastique. - Conservez la mousse obtenue dans un congélateur à −20 °C jusqu’à ce qu’elle soit nécessaire pour la synthèse de la suspension de microgel.
- Synthèse de microgels GelMA
NOTE: Les microgels sont synthétisés à l’aide d’une méthode d’émulsion eau dans huile13 (Figure 2). Cette méthode a été testée pour des volumes de solution GelMA de 1 à 10 mL. Le même protocole peut être utilisé pour synthétiser les microgels de gélatine utilisés pour imprimer des empreintes osseuses autonomes.- Faire une solution de GelMA à 10% p/p dans du PBS en pesant le GelMA lyophilisé, en l’ajoutant dans un tube avec du PBS et en le chauffant au bain-marie à 50 °C jusqu’à ce qu’il soit complètement hydraté.
- Ajouter 37 mL d’huile par 1 mL de solution GelMA à un bécher, en veillant à ce qu’il ne soit pas rempli à plus de 65%.
- Installez un système de double bécher sur une plaque chauffante sous agitation magnétique en plaçant le bécher contenant de l’huile à l’intérieur d’un bécher plus grand.
REMARQUE: La taille des deux béchers doit être telle que la glace puisse être facilement lâchée dans l’espace entre leurs murs. La configuration est illustrée à la figure 2. - Chauffer à 40 °C en agitant.
REMARQUE: Assurez-vous que le vortex n’est pas turbulent et a une profondeur d’environ 1/3 de la hauteur de l’huile dans le bécher. - Chargez la solution de GelMA dans une seringue et ajoutez-la goutte à goutte dans l’huile d’agitation à travers un filtre de 0,45 μm. Laisser l’émulsion s’équilibrer pendant 10 min.
- Réduire la température de l’émulsion à 15 °C pour stabiliser thermiquement les sphères en ajoutant de la glace pilée dans l’espace entre les deux béchers.
- Ajouter de l’acétone à l’émulsion de filature dans un rapport volumique de 1:11 solution de GelMA à acétone.
REMARQUE: Ajouter doucement l’acétone à travers un entonnoir pour éviter de perturber l’émulsion. Remuer pendant 60 min. - Décanter le contenu du bécher en tubes de 50 mL, en veillant à laver les parois du bécher avec de l’acétone. Laisser reposer 20 min pour laisser les microgels déshydratés se déposer au fond.
- Jeter le surnageant et laver au moins 2x avec de l’acétone.
REMARQUE : Le surnageant doit être clair. - Consolider en un tube, compléter avec de l’acétone et soniquer pendant 10 s. Laver 2x avec de l’acétone.
- Conserver dans de l’acétone à température ambiante jusqu’à ce qu’elle soit nécessaire pour l’impression.
- Préparation de la suspension de microgel GelMA pour l’impression
- Préparer une solution à 1 % p/p de GelMA dans le milieu Eagle modifié (DMEM) de Dulbecco en pesant le GelMA lyophilisé dans un tube, en ajoutant du DMEM et en le chauffant au bain-marie à 50 °C jusqu’à ce qu’il soit complètement hydraté.
- Évaporer l’acétone des microgels déshydratés et peser la poudre obtenue dans un tube. Ajouter l’acétone et transférer dans un environnement stérile.
- Pour former la suspension de microgel, évaporer l’acétone et ajouter du DMEM, une solution de GelMA à 1 % p/p dans du DMEM et une solution initiatrice de phényl-2,4,6-triméthylbenzoylphosphinate de lithium (LAP) à 2,5 % p/p pour obtenir une fraction de tassement finale de 30 %. Laisser hydrater complètement pendant au moins 12 h à température ambiante. Conserver au réfrigérateur jusqu’à 7 jours. Laisser remonter à température ambiante avant utilisation.
REMARQUE : Les volumes de ces réactifs sont basés sur le poids sec des microgels et peuvent être calculés à l’aide des équations du tableau 1.
| Équation | |
| x = poids des microgels secs (mg) | |
| Volume de 1 % p/p de GelMA dans le DMEM, a (μL) | a = 21,93x |
| Volume de DMEM, b (μL) | b = 8,773x |
| Volume de solution LAP à 2,5 % p/p, c (μL) | c = 0,6267x |
| Volume total de suspension de microgel produite (μL) | A + B + C |
Tableau 1 : Équations de calcul des volumes de réactifs nécessaires pour hydrater les suspensions de microgel GelMA. Abréviations : GelMA = méthacrylate de gélatine; LAP = phényl-2,4,6-triméthylbenzoylphosphinate de lithium.
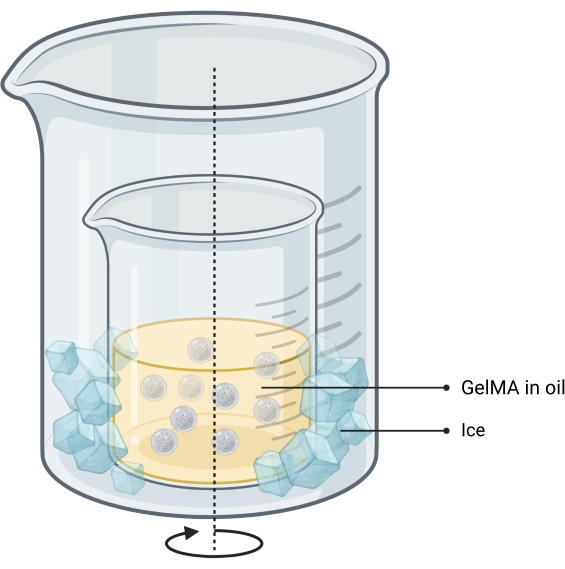
Figure 2 : Schéma de la méthode huile-émulsion utilisée pour la synthèse de microgels. La configuration à double bécher montre un bécher contenant l’émulsion agitée (indiquée par une flèche) placée à l’intérieur d’un bécher plus grand pour permettre le refroidissement. Abréviation : GelMA = méthacrylate de gélatine Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Impression d’encre osseuse dans des suspensions cellulaires
REMARQUE: Les microgels à base de gélatine soutiennent l’adhésion de nombreux types de cellules différentes, ce qui rend cette approche applicable aux cellules uniques et multiples dans la matrice de microgel. Ce protocole décrit la procédure d’utilisation des cellules souches mésenchymateuses dérivées du tissu adipeux (ADSC), car il s’agit d’un type de cellule populaire et robuste pour l’ingénierie des tissus musculo-squelettiques.
- Culture des ADSC dans du DMEM à faible teneur en glucose complété par 10 % de sérum fœtal bovin et 1 % de pénicilline-streptomycine à 37 °C et 5 % de CO2 jusqu’à confluence.
- Détacher les CSDA du ballon de culture tissulaire en retirant le milieu, en les lavant avec du PBS stérile et en les incubant à 37 °C et 5 % de CO2 avec 0,25 % de trypsine pendant 3 min.
- Enduire les cellules par centrifugation à 150 × g à température ambiante pendant 5 min.
- Comptez les cellules et calculez 5 × 105 cellules pour chaque 1 mL de microgels GelMA. Attribuer le volume requis de suspension cellulaire à un tube et à une pastille séparés comme ci-dessus.
- Retirer délicatement autant de surnageant que possible à l’aide d’une pipette, en ne laissant que la pastille de cellule. Ajouter le volume requis de suspension de microgel à la pastille et aspirer doucement pour assurer une distribution uniforme des cellules.
REMARQUE: S’il y a un excès de bulles d’air dans la suspension, centrifuger doucement pour enlever et pipeter de haut en bas pour redistribuer les cellules. - Charger la suspension de microgel chargée de cellules dans un réacteur à l’aide d’une pipette.
REMARQUE : Dans la présente étude, des réacteurs de 10 mm x 10 mm x 3 mm d’une capacité volumique de 100 μL ont été imprimés en 3D. - Déposer de l’encre non osseuse à l’aide d’une seringue de 1 mL munie d’une aiguille de 23 G.
REMARQUE : Cela peut être fait avec une imprimante 3D soit en installant un système d’extrusion qui permet d’imprimer directement à partir de la seringue de 1 mL, soit en chargeant l’encre osseuse directement dans la cartouche d’extrusion de l’imprimante (Figure 3). - Réticulez la construction de microgel GelMA chargée d’encre et de cellules avec une lampe anti-UV (405 nm) pendant 90 s. Transférer immédiatement dans une plaque de puits de taille appropriée et couvrir avec DMEM complet.
REMARQUE: Les réacteurs imprimés en 3D susmentionnés s’insèrent dans des plaques de culture cellulaire à 24 puits. - Incuber à 37 °C et 5% de CO2. Remplacez le milieu de culture après 24 h, puis toutes les 48-72 h au besoin.
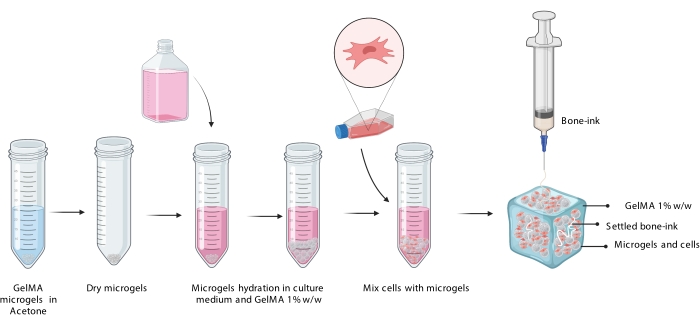
Figure 3 : Représentation schématique de la procédure COBICS montrant l’hydratation des microgels, l’incorporation des cellules et l’impression ultérieure de l’encre osseuse dans la suspension de microgel chargée de cellules. Abréviation : COBICS = bioimpression omnidirectionnelle céramique en suspensions cellulaires ; GelMA = méthacrylate de gélatine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Évaluation de la viabilité et de la prolifération des cellules
- Pour évaluer la cytotoxicité à l’encre osseuse, conserver les constructions COBICS chargées de cellules dans un milieu de culture complet. Effectuez un test Live Dead à 24 h, 72 h et 120 h (ou à des points temporels pertinents).
- À chaque point temporel, laver les constructions avec du PBS, puis ajouter une solution de DMEM sans phénol contenant 4 mM de calcéine et 2 mM de bromure d’éthidium. Incuber pendant 1 h à 37 °C et 5% de CO2.
- Laver avec du PBS et transférer dans une antenne à fond de verre pour l’imagerie au microscope confocal à des spectres Ex/Em de 494/517 nm et 528/617 nm.
Access restricted. Please log in or start a trial to view this content.
Résultats
COBICS imprime des constructions complexes et biologiquement pertinentes sans avoir besoin de matériaux de support sacrificiels ou d’étapes de post-traitement sévères (par exemple, le rayonnement et le frittage à haute température) qui sont deux des plus grands défis de la fabrication additive de constructions mimétiques osseuses. Pour démontrer la formation COBICS de structures osseuses complexes et la co-impression de cellules dans des suspensions de microgel, des images représentatives de composites osseux...
Access restricted. Please log in or start a trial to view this content.
Discussion
La technique d’impression 3D COBICS a été développée pour permettre la fabrication de structures minéralisées ressemblant à des os par extrusion dans une suspension de microgel réticulable contenant des cellules vivantes. La technique a été appliquée à une suspension de microgel dégradable, et les cellules montrent une bonne viabilité, propagation et capacité de différenciation ostéogénique dans le système11. Un déterminant clé du succès des constructions créées à l’ai...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs tiennent à remercier le National Health and Medical Research Council (subventions no. GNT1111694 et GNT1141602) et l’Australian Research Council (subvention no. FT180100417, FL150100060 et CE14100036). Les auteurs aimeraient remercier le Biomedical Imaging Facility de l’Université de Nouvelle-Galles du Sud. Les figurines ont été créées avec Biorender.com, Adobe Photoshop et Adobe Illustrator et ont été exportées dans le cadre d’un abonnement payant.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Références
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , CRC Press. Boca Raton, FL. 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757(2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041(2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660(2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986(2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209(2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014(2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520(2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216(2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758(2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490(2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon