Method Article
厌氧菌小鼠阴道定植模型
摘要
该协议提出了用厌氧培养的人阴道细菌阴道定植的小鼠模型。我们专注于 阴道加德纳菌,同时包括 对双普雷沃氏 菌和核 梭杆菌的建议。该方案也可以用作阴道接种和其他厌氧生长细菌的可行回收的指南。
摘要
哺乳动物阴道可以被许多细菌类群定植。人类阴道微生物组通常以乳酸杆菌属为主,但四分之一的女性患有细菌性阴道病,其中低水平的乳酸杆菌伴随着各种厌氧细菌的过度生长。这种情况与许多健康并发症有关,包括生殖健康和性健康的风险。虽然越来越多的证据表明微生物相互作用在人类阴道健康中的复杂性,但这些不同厌氧细菌的个体作用尚未完全了解。由于缺乏足够的模型来研究厌氧生长的阴道细菌,情况变得复杂。小鼠模型使我们能够研究这些生物体在体内的生物学和毒力。先前已经描述了阴道细菌接种的其他小鼠模型。在这里,我们描述了接种厌氧生长细菌的方法及其在常规饲养的C57Bl / 6小鼠中的可行恢复。还描述了一种新的,压力较小的阴道接种和清洗程序方法。本文详细概述了加德纳菌的接种和可行恢复,并讨论了其他厌氧菌(如双孢普雷沃氏菌和核梭杆菌)的策略。
引言
在哺乳动物中,阴道是细菌物种联盟的家园。人类阴道微生物组在哺乳动物中是独一无二的,因为它拥有丰富的乳酸杆菌属成员和相应的低阴道pH值(3.8-4.5)1,2,3,4。这种乳酸杆菌优势的破坏与各种负面的健康结果有关。
在细菌性阴道病(BV)中,乳酸杆菌较少,各种厌氧菌(如阴道加德纳菌和普雷沃氏菌5,6)的丰度增加。患有BV的女性发生性传播感染7,8,9,不孕症10,流产11,早产12,13,14,宫内感染15,宫颈感染16和癌症16,17,18的风险增加.BV 还与潜在致病细菌阴道定植的可能性更高有关,例如核梭杆菌1,19,20,一种来自羊水感染的常见分离株 21。
由于厌氧菌在人类阴道健康中的重要性,因此需要可用于研究这些生物的生物学和发病机制的动物模型。在这里,我们描述了雌激素化小鼠阴道加德纳菌阴道接种和可行恢复的方法,并提出了普雷沃氏菌和核梭杆菌的其他策略。以前已经描述了小鼠阴道定植的其他模型,但这些模型侧重于需氧培养的兼性厌氧菌的接种和恢复,例如B组链球菌22和淋病奈瑟菌23。专性厌氧菌的接种和回收可以通过适当的实验策略成功完成。我们讨论了几种细菌分类群的可行恢复方法,并建议对其他感兴趣的物种/菌株的生存条件进行实证评估。
估计活细菌定植的经典方法是菌落形成单位(CFU)的回收。在具有自己的内源性微生物群的传统饲养小鼠中,这需要在琼脂培养基上恢复,琼脂培养基选择内源性阴道微生物群的成员,同时仍然允许接种的细菌菌株生长。在这里,我们使用一种链霉素耐药的阴道 G.24 分离物,该分离物可以在含链霉素的琼脂培养基上选择性地回收。为确保培养基具有足够的选择性,并且相反,内源性微生物组中不存在链霉素耐药细菌,接种前收集的阴道灌洗液应接种在选择性(含链霉素)琼脂上。
接种物制备的最佳方法可能因细菌的种类和菌株而异。在小鼠实验开始之前,应进行初步工作以确定培养基,生长终点和接种物制备的优选条件,以及对氧气的敏感性和PBS中的活力。在对氧更敏感的细菌的情况下,可以考虑接种物的替代制剂(例如,在具有适当载体对照组的厌氧培养基中)25,26。
研究方案
所有动物实验均根据机构指南和加州大学圣地亚哥分校实验动物护理和使用指南(UCSD,协议编号:S20057,2020-起)以及在此之前在圣路易斯华盛顿大学(协议20110149,截至2020年)批准和进行。
注意:以下方案使用常规饲养的雌性C57Bl/小鼠,接种时年龄为6-11周。请注意之前在相关引用作品中使用的供应商信息和特定年龄范围。
1.β-雌二醇17-戊酸酯的制备和给药
注意:β-雌二醇17-戊酸酯是一种致癌物和生殖毒素,可以通过皮肤吸收27,28。在处理粉末和液体溶液时穿戴适当的个人防护用品。它也是一种水生毒素29;将其妥善处理在适当密封和贴有标签的容器中。
- 使用 50 mL 锥形管真空过滤系统通过 0.22 μm 过滤器对多达 50 mL 的芝麻油进行灭菌。仅在生物安全柜中打开以保持无菌。
- 计算实验所需的β-戊酸雌二醇溶液的体积:每只小鼠200 μL加上额外2-3 mL,以解决注射器填充过程中的样品损失(例如,10 只小鼠的实验总共需要4 mL)。计算制备 5 mg/mL 溶液所需的 β-戊酸雌二醇的量,并直接在 14 mL 圆底管中称量。
- 盖紧 14 mL 管并涡旋以分解粉末中的团块(这将使戊酸β-雌二醇更快地溶解)。向 14 mL 管中加入无菌过滤的芝麻油,使戊酸β-雌二醇的最终浓度为 5 mg/mL。
- 将紧密盖的14mL管置于37°C的旋转器上30-40分钟,直到固体粉末完全溶解。在注射到小鼠体内之前目视确认溶液的均匀性。在37°C下孵育可降低芝麻油的粘度,使其更易于注射。
- 将戊酸β-雌二醇溶液拉入1mL注射器(无针头)。为了在不引入气泡的情况下做到这一点,首先,吸取一点溶液,然后轻轻排出,同时将注射器的尖端保持在芝麻油中。再次缓慢地吸取溶液,略高于 100 μL 标记。
- 将 25 G x 5/8 in 针头放在注射器上。然后,通过缓慢排出芝麻油溶液来灌注针头,直到它开始从针尖出来。排出溶液,直到注射器达到100μL标记。每只小鼠准备一个注射器。
- 在接种前48小时或72小时通过腹膜内注射给予β-雌二醇17-戊酸酯。如前所述,向每只小鼠注射100μL的5mg / mL β-戊酸雌二醇溶液(0.5mg β-戊酸雌二醇/小鼠)。将剩余的溶液在4°C下储存72小时,直到下一次进样。
- 在接种当天,在小鼠阴道接种之前再次施用戊酸β-雌二醇溶液。从4°C中取出溶液,并在注射前将其置于37°C的旋转器上30分钟,以使芝麻油变热并变得不那么粘稠。按照步骤1.7中的说明继续注射。
2. 接种物的制备
注意:本节包含厌氧生长的链霉素耐药阴道加德纳菌JCP8151B-SmR24,25,31,32制备接种物的一般步骤。本节中的所有步骤都应在厌氧室中完成。
- 将任何试剂(包括制备的NYC III肉汤,琼脂和PBS)循环到厌氧室中,以便在使用前至少24小时进行平衡。
注意:在这里,使用与5%氢气混合物平衡的乙烯基厌氧室。内部氧气浓度通常保持在 0 ppm,尽管在将材料循环进入腔室时可能会有低水平的瞬态增加 (10-25 ppm)。 - 阴道接种前两天,将 加德纳菌 从冷冻甘油原液中划出到厌氧室的NYC III琼脂平板上。使用装满干冰的小容器(例如空的移液器吸头盒),以在进出腔室期间保持甘油原液冷冻。
- 阴道接种前 1 天,使用平板中的 5-10 个 单独的加德纳菌 接种 10 mL NYC III 肉汤。让液体培养物在37°C下生长过夜16小时。 包括未接种的培养基的第二个 1 mL 等分试样,并将其与接种的培养物一起孵育,以确认培养基未受污染。
- 如下所述从液体培养物制备接种物。尽可能在厌氧室中进行接种物制备。
- 通过在 1.5 mL 比色皿(1:5 稀释度)中将 200 μL 培养物添加到 800 μL 新鲜培养基中来确定培养物光密度 (OD)。使用分光光度计测量600nm波长处稀释培养物的密度(OD)(使用单独的比色皿,仅使用新鲜培养基作为空白)。将OD读数乘以5,得到16小时培养物的实际OD600 。
- 计算实验所需的接种物体积。例如,要用每只小鼠20μL的接种物感染15只小鼠,需要15 x 20μL = 300μL接种物。准备比所需多约25%的接种物,因此对于15只小鼠,准备300μL + (0.25 x 300 μL) = 375μL接种物。
- 使用在步骤2.4.1中测定的OD 600,计算需要旋转并重悬的16小时培养物的体积,以获得步骤2.4.2中计算的体积中的OD600 = 5.0接种物。例如,如果培养物的OD600为1.5,所需的接种物体积为375μL,则要旋转的培养物体积为(375μL x 5)/1.5 = 1250μL。
- 移液器吸取步骤2.4.3中计算的培养物体积。放入无菌微量离心管中。通过以16,000× g 离心1-3分钟来沉淀细菌。
- 除去上清液,以步骤2.4.2中计算的体积将沉淀重悬于厌氧PBS中。接种物现在的计算OD600 为5.0。如果适用,还要准备一管PBS作为未感染对照组中小鼠的载体对照。
- 在从厌氧室中取出接种管之前,在PBS中制备从1:10到1:10 x 106的系列稀释液。使用多通道移液管将每种稀释液的点板5重复到琼脂平板上,以确定接种物的CFU。这是预接种CFU。
3. 阴道预灌洗和接种 加德纳菌
- 在厌氧室中准备阴道灌洗/洗涤管(这可以与步骤2.4中的接种物制备同时进行)。将 70 μL 无菌厌氧 PBS 移液到 1.5 mL 标有小鼠编号的微量离心管中。每只小鼠准备一个清洗管。紧紧关闭试管并将它们循环出厌氧室。
- 用步骤3.1中制备的各个管中的50μL厌氧PBS对每只小鼠进行阴道灌洗。这些阴道灌洗是接种前的清洗液,可用于下游测量和测定。
- 施用第二β-戊酸雌二醇注射液(步骤1.8)后,将每只小鼠放在笼子或可以用前爪抓住的干净硬表面上。轻轻握住尾巴的中间部分并抬起,使后躯略微抬高并露出阴道口。
- 使用移液器和 p-200 过滤器吸头,从对应于相应鼠标的清洗管中吸取 50 μL PBS。轻轻地将移液器吸头插入阴道腔~2-3 mm,然后轻轻地移入和移出50μL体积,3x-4x。
- 将收集的洗涤材料(~50 μL)转移回其来自的同一洗涤管中,在仍含有剩余20 μLPBS的洗涤管中上下移液。如果粘液过多并且吸头堵塞,请使用干净的 p-200 吸头收集剩余材料并将其放入同一清洗管中。
- 将20μL浓缩的细菌悬浮液或载体对照阴道施用到每只小鼠的阴道中。在为该小鼠进行阴道灌洗后立即接种每只小鼠(即,在继续下一只小鼠之前按顺序对每只小鼠进行灌洗和接种)。为简化此过程,请使用两个 p200 移液器,一个设置为 50 μL 用于灌洗,另一个设置为 20 μL 用于接种。
- 按照步骤 3.2.1 中所述限制鼠标。使用 p-200 吸头,将 20 μL 细菌悬浮液移入阴道。对于使用两种不同细菌种类/菌株的共接种实验,每种细菌悬浮液使用 10 μL,并避免在接种前混合两种菌株。
注意:总接种量不应超过 20 μL,以避免溢出阴道。 - 继续保持每只小鼠的后端10-20秒,以防止施用的体积立即聚集在阴道口。然后,将鼠标放在新的笼子/容器中或与已经接种的笼子伙伴一起。
- 重复步骤 3.2。和步骤 3.3。对于每个鼠标。切勿将小鼠放回与尚未接种的动物一起的笼子中。这可以防止小鼠在接种前无意中暴露于链霉素耐药细菌。
- 按照步骤 3.2.1 中所述限制鼠标。使用 p-200 吸头,将 20 μL 细菌悬浮液移入阴道。对于使用两种不同细菌种类/菌株的共接种实验,每种细菌悬浮液使用 10 μL,并避免在接种前混合两种菌株。
- 接种完所有小鼠后,将接种管循环回厌氧室。如步骤2.5中所述制备并铺板另一种系列稀释液。这是接种后的CFU。比较接种后和接种前平板的CFU,以确定在动物接种期间在厌氧室外接种的接种活力是否降低。
- 将步骤3.2中收集的阴道灌洗液铺板。选择性琼脂(在这种情况下,1 mg / mL链霉素)。将板在37°C的厌氧室中孵育1-2天并检查生长情况。
注意:生长表明微生物组的内源性成员对选择标记具有抗性,因此可能模糊目标生物体的CFU计数。
4. 收集阴道灌洗液以确定可行的 加德纳菌 定植
- 在选定的时间点收集阴道冲洗液以分析阴道定植。按照步骤 3.2 中所述收集。
- 收集后,立即将阴道灌洗循环到厌氧室中。使用每次灌洗液 10 μL 进行连续稀释并接种到选择性琼脂上,如步骤 2.5 中所述。使用 CFU 计数作为 加德纳 菌(或其他感兴趣的厌氧菌)阴道定植的量度。
5.处死、解剖和组织均质
- 为从每只小鼠收集的每个器官准备一个 5 mL 管(例如,如果阴道、子宫颈和子宫都在收集,则每只小鼠准备三根管)。在厌氧室中用无菌厌氧1x PBS(或其他均质培养基)填充每个试管。将 1 mL PBS 用于收集阴道和宫颈的试管,将 750 μL 用于收集子宫角的试管。
- 加入PBS后,称量每个单独的试管(这是收集前的重量,将用于确定每个收获组织的总重量)。如果厌氧室中没有秤,请盖紧管子并将它们循环出腔室进行称重,然后将它们循环回去。
注意:可以在牺牲前1天进行试管制备和重量收集,但试管应保存在厌氧室中,盖子密封以防止蒸发。 - 如步骤3.1中所述准备一组阴道灌洗管。在祭祀时收集最后的灌洗。此外,准备一个 50 mL 去离子 (DI) 水烧杯和第二个 50 mL 70%-90% 乙醇烧杯,用于在牺牲期间冲洗和消毒标准钢解剖仪器。
- 从厌氧室中循环出充满PBS的器官收集管。保持管子紧闭,直到组织准备好添加。
- 使用IACUC批准的方法牺牲每只小鼠。按照步骤3.2.2中所述进行最后的灌洗。和 3.2.3.要么在祭祀前,要么紧接着牺牲。
- 开始解剖和组织收集。用70%乙醇喷洒每只小鼠的腹部和背部。在乙醇烧杯中对剪刀进行消毒,让它们干燥,然后对小鼠腹盆腔进行一次垂直切割。
- 使用无菌镊子拉回皮肤,轻轻地将肠道推出体腔并推到空旷的场地一侧,这将暴露生殖道。
注意:注意不要刺穿或刺穿肠道,因为它们可能含有链霉素耐药细菌,可能会混淆实验结果。 - 为了收集最大的阴道组织,在尸检期间打破耻骨。使用无菌剪刀,夹住耻骨的中心(耻骨联合),同时注意不要切入阴道。使用两组无菌镊子,抓住骨盆的每一侧,将骨盆横向拉开,露出下面的阴道下部。
- 用镊子轻轻握住子宫颈(与周围组织相比,子宫颈的结构更硬)。轻轻拉起子宫颈,露出隐藏在后面并与阴道紧密相连的结肠。
- 使用小剪刀将阴道从外部结缔组织中释放出来。小心地将阴道与结肠分开,避免刺穿肠道。完全释放后,用剪刀在阴道入口处侧翼,剪断以从小鼠体内释放。
- 保持对子宫颈的轻柔抓握,同时稍微向上拉,使子宫角更明显。用另一只手,直接切开左右两侧的卵巢下方,以释放子宫角。从体腔中取出现已断开的生殖道,并将其放入无菌培养皿中。
- 使用剃须刀将子宫角、子宫颈和阴道分开。将每个组织放入其各自标记的收集管中。如果要收集细胞因子,请在添加组织后将试管放在冰上。
- 加入组织后,再次称量每个试管。这是收集后的重量。从收集后的重量中减去收集前的重量,得到组织的总重量。
- 使用手持式均质机均质其收集管中的器官。对于 加德纳菌 JCP8151B,在生物安全柜(有氧)或厌氧室中执行此步骤。
- 准备几组试管,用于样品之间手持式均质机的洗涤和无菌处理。确保每组有三个 50 mL 锥形管:一个装满去离子水,一个装满 70% 乙醇,第三个装 1x PBS。为每个小鼠治疗组准备一组单独的洗涤管。
- 要清洁均质机,请将刀片降低到每个洗涤管中的液体中,然后将仪器旋转到最大速度。将均质机保持在三个管中的每一个中约3秒。洗涤的顺序是去离子水(去除物理碎屑),然后是乙醇(消毒),最后是 1x PBS(中和)。将探头摇到纸巾或一次性工作台垫上,以去除每次冲洗之间的多余液体。
- 初始冲洗后,通过将均质器探针降低到收集管的底部,将组织捕获在下面,使组织均质化。打开均质机研磨组织,轻轻上下移动探头约 5 倍,同时保持浸没状态。使每个器官均质化约15-30秒。
- 关闭并从管中取出均质器后,目视检查内容物以确保组织完全破碎。这对于子宫颈和阴道尤其重要,有时探针无法捕获它们。
注意:如果子宫角上的一些多余脂肪没有完全均匀化,也没关系。 - 重复步骤5.14.1.-5.14.4.,在每个样品之间清洗和消毒探针。为每个实验组切换到一组新的洗涤管。
- 将装有均质样品的试管移至厌氧室中。为了确定每个组织的细菌负荷,对要混合的样品进行短暂的温和涡旋,然后去除 100 μL 组织匀浆进行连续稀释并铺在选择性琼脂上以进行 CFU 测定(第一次稀释为 1 x 100)。如果需要检测下限,请对 200-250 μL 未稀释的匀浆进行铺展电镀。
结果
示例实验的示意图显示了执行所述协议的一些方法(图1)。
一些动物会在阴道微生物组中携带内源性微生物,这些微生物将在非选择性培养基上生长。这里描述的方法依赖于所研究细菌菌株的链霉素耐药分离株,以及含有链霉素的选择性培养基,以选择针对内源性细菌(图2A,B)。链霉素耐药性有可能自发发展,因此在感染前检查小鼠(第0天洗涤)可以帮助确定这是否是一个问题。
从阴道洗涤中回收活细菌是通过在琼脂培养基上连续稀释和铺板来完成的。标准培养皿最多可容纳 6 x 6 阵列的 5 μL 斑点,如果使用 10 倍连续稀释,则允许每个样品的六个数量级的六个复制点计数细菌滴度(图 3A)。该方法可用于枚举从加德纳菌到普雷沃氏菌和梭杆菌的细菌滴度(图3B-D)。
总之,这些方法允许人们测试假设并解释女性生殖道的细菌定植/感染。例如,阴道冲洗液和阴道组织匀浆中加德纳菌滴度的比较表明这些方法之间存在一致性(图4A)。同样,在阴道共接种模型中,与普雷沃氏菌单感染相比,加德纳菌共感染期间子宫组织中普雷沃氏菌的滴度显着更高(约 20 倍)(图 4B)。最后,可以在这些模型中比较野生型与突变型细菌菌株,以确定特定基因及其产物在生殖道定植/感染过程中所起的作用。例如,缺乏运输和消耗碳水化合物唾液酸能力的梭杆菌突变菌株导致接种后 3 天的定植水平降低(图 4C)。
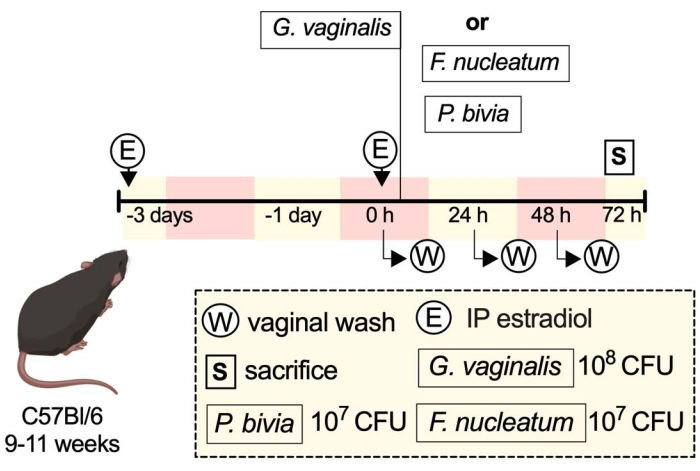
图 1:示例实验示意图33. 请点击此处查看此图的大图。
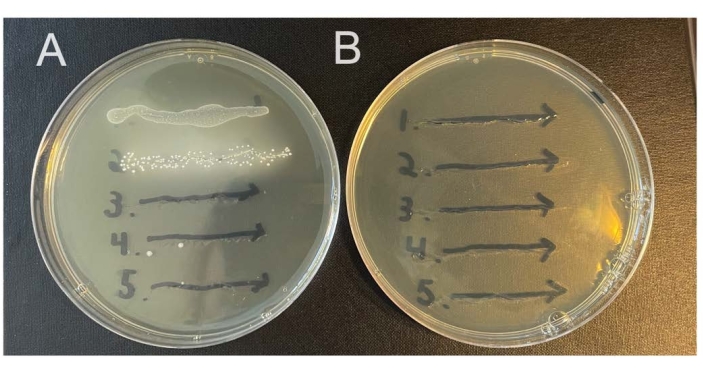
图2:选择性与非选择性琼脂上内源性鼠阴道微生物的生长。 将来自五只雌性C57Bl / 6小鼠(1-5)的阴道灌洗划到两个不同的NYC III琼脂平板上并厌氧孵育。(A)左边的板不含任何抗生素,允许内源性厌氧菌从小鼠阴道生长。(B)右边的板含有1mg / mL链霉素,并选择内源性细菌的生长。 请点击此处查看此图的大图。
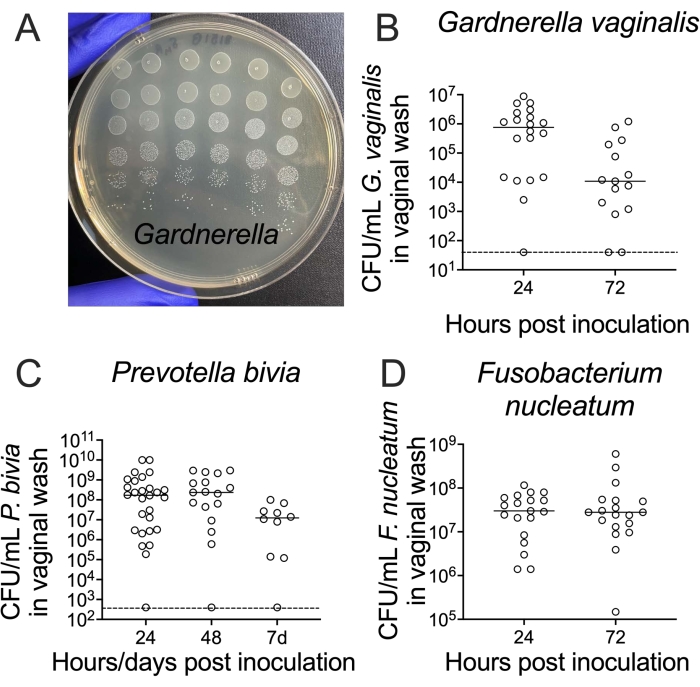
图 3:从阴道洗涤中回收活的 G. 阴道、双胞菌和 F. nucleatum CFU。 (A) 阴道 G. 阴道 JCP8151B-SmR 接种物的 CFU,作为稀释系列在 NYC III 琼脂上复制接种。(乙-四)从单感染动物的阴道灌洗中恢复活的 (B) G. vaginalis24、(C) P. bivia25 和 (D) F. nucleatum26。对于每个图(B-D),数据来自两个独立的实验,每个实验10-15只小鼠24,25,26。请点击此处查看此图的大图。
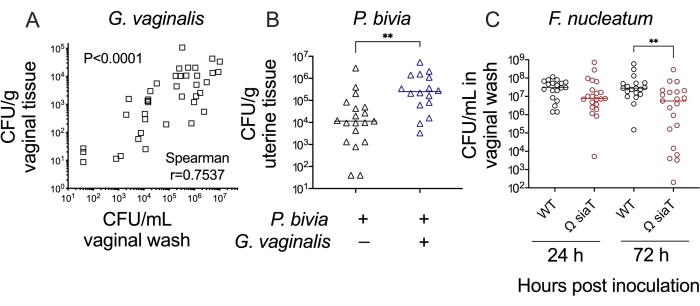
图4:小鼠阴道接种模型中厌氧细菌定植的进一步分析。 (A)阴道洗涤中的G.阴道滴度与接种后24小时和72小时从阴道组织匀浆中回收的G.阴道滴度相关(两个独立实验的组合,每个n = 10。由斯皮尔曼秩相关检验确定的显著性)24.(B)与接种后48小时双胞菌单感染动物相比,与阴道支原体的共同感染导致子宫角组织中的双胞菌滴度增加(两个独立实验的组合,每组6-10只小鼠。 由曼-惠特尼U检验确定的显著性,**p = 0.0017)25。(C)与接种后72小时野生型唾液酸转运蛋白(Ω SiaT)的F. nucleatum突变体相比,具有破坏唾液酸转运蛋白( SiaT)的单感染小鼠阴道灌洗中的滴度降低(两个独立实验的组合,每组10只小鼠。由曼-惠特尼U检验确定的显著性,**p < 0.01)26。请点击此处查看此图的大图。
补充文件1:用于在厌氧条件下生长的不同阴道细菌的方法示例。请点击此处下载此文件。
讨论
这里描述的模型与以前发表的阴道接种模型不同的最显着方式是使用厌氧培养的细菌,这需要特别考虑制备活接种物和从小鼠中回收细菌。上述方案中的具体步骤可能略有不同,具体取决于所用细菌的种类/菌株,如 补充文件1所示。此外,这份手稿描述了一种用于管理细菌和阴道冲洗的新程序方法,该方法需要研究者较少的经验,对小鼠的约束较少。如果实验者对步骤3.2中描述的约束形式感到不舒服。和步骤3.3.,可以根据实验设计和机构IACUC指南,在有或没有麻醉的情况下,将小鼠34 改为如前所述。
在小鼠模型中使用厌氧培养细菌的一个重要警告是,某些步骤(例如涉及活体动物的任何步骤)必须在厌氧室外完成。因此,该协议中最关键的步骤是将感兴趣的细菌暴露于有氧环境中的步骤,例如在接种小鼠期间。在该模型中使用任何新的厌氧菌都需要初步调查其在暴露于氧气时保持活力的能力(例如比较接种前和接种后的CFU,如步骤2.5和步骤3.4中所述)。根据生物体的氧气程度和PBS敏感性,应考虑不同的接种物制备方法(补充文件1,步骤2.4.5)。对于使用 阴道G. G. vaginalis JCP8151B的接种,我们发现可以在PBS中制备单管接种物并用于感染所有小鼠。如果使用对氧气更敏感的不同厌氧细菌,则可以在每只小鼠的单独管中制备接种物,这样就不需要重复打开/关闭管子。同样,如果感兴趣的细菌种类比 阴道G. 更苛刻/更不能在PBS中存活,则可以在培养基中制备接种。如果使用的培养基含有还原剂,例如用于培养 普雷沃氏菌 的CDC厌氧菌培养基(补充文件1,步骤2.1.和步骤2.2.),则细菌也将具有增强的氧气暴露保护。
还可以考虑用于均质化的替代方法,例如珠打22,35,这是在管盖关闭的情况下完成的,因此可以引入比手持式均质机更少的氧气。此外,对氧更敏感的生物可能需要更长的培养基平衡时间。氧指示剂如刃天青可用于检查是否已达到厌氧条件(步骤2.1)。厌氧罐等替代方法可能会影响结果,应在使用前检查细菌活力。
实验生物体的氧敏感性和挑剔性也可能在灌洗/均质化期间从小鼠成功回收活细菌中发挥作用(补充文件1,步骤3.2.和步骤5.1.)。对于高度敏感的微生物,灌洗和铺板之间的时间可能导致活力丧失,并导致人为地降低细菌阴道定植率。为了减轻这种影响,收集的灌洗液可以立即稀释到新鲜的厌氧培养基(用还原剂)中。同样,器官匀浆可以在新鲜培养基而不是PBS中进行,以增加细菌活力,也可以在厌氧室本身中进行,以尽量减少氧气暴露。
根据给定实验的目的,实验者必须注意对照组。为了测试假设,仅用载体模拟治疗的未感染对照小鼠的基线测量将有助于确定是否存在趋化因子/细胞因子的诱导或其他感染的特定结果。使用的对照载体必须与用于接种的载体相同,因此如果将细菌接种在培养基中,则必须使用未接种的培养基作为对照(补充文件1,步骤2.4.5)。
该协议中描述的方法也可以应用于能够厌氧生长的兼性细菌,但传统上使用需氧培养条件(例如 大肠杆菌 或B组 链球菌)进行研究。这可能与这些生物体在被认为含有低水平氧气的身体部位(如子宫颈)的感染尤其相关。与有氧接种相比,当厌氧制备接种物时,兼性微生物可能更成功地感染氧气较少的部位。在这样的实验中,回收用于CFU计数的活细菌可能不需要厌氧条件。
披露声明
作者声明不存在利益冲突。
致谢
我们感谢Lynne Foster在这些模型开发过程中提供的技术援助。我们感谢分子微生物学系和妇女传染病研究中心(AL)的启动资金,以及March of Dimes(Basil O'Connor奖授予AL),这有助于支持早期实验。美国国家过敏和传染病研究所(R01 AI114635)也支持这些模型的开发。
材料
| Name | Company | Catalog Number | Comments |
| β-estradiol 17-valerate | Sigma | E1631 | estrogenization of mice |
| 0.22 µm, 50 mL Steriflip vacuum filter | Fisher | SCGP00525 | sterile filtering sesame oil |
| 14 mL tube | Falcon | 352059 | estrogenization of mice |
| 190-proof ethanol | Koptec | V1105M | dissection, tissue homogenization, CDC and Columbia media |
| 1x PBS | Fisher | MT21040CM | vaginal lavage, G. vaginlalis inoculum prep, tissue collection and homogenization |
| 25 G × 5/8 -in needle | BD | 305122 | estrogenization of mice |
| 5 mL tube | Falcon | 352063 | Tissue collection and homogenization |
| Anaerobic chamber | Coy | 7200000 | Growth of anaerobic bacteria |
| Bacto agar | Fisher | DF0140074 | G. vaginalis, F. nucleatum, and P. bivia agar plates |
| Bacto peptone | Fisher | DF0118170 | CDC anaerobic media for P. bivia growth |
| Columbia broth | Fisher | DF0944170 | Columbia media for F. nucleatum growth |
| Defibrinated sheep blood | Hemostat | DSB500 | CDC anaerobic media for P. bivia growth |
| Forceps | Fine Science Tools | 11008-13 | mouse/tissue dissection |
| Glucose | Sigma | G7528 | NYCIII media for G. vaginalis growth |
| Handheld homogenizer | ISC Bio | 3305500 | Tissue homogenization |
| Hemin | Sigma | 51280 | CDC anaerobic media for P. bivia growth, Columbia media for F. nucleatum growth |
| HEPES | Cellgro | 25-060-Cl | NYCIII media for G. vaginalis growth |
| Horse serum | Hemostat | SHS500 | NYCIII media for G. vaginalis growth |
| Hydrogen gas mix (5% hydrogen, 10% CO2, 85% nitrogen) | Matheson | Gas for anaerobic chamber | |
| Isofluorane | VetOne | 502017 | mouse anaethesia at sacrifice |
| L-cysteine | Sigma | C1276 | CDC anaerobic media for P. bivia growth |
| L-glutamate | Sigma | G1626 | CDC anaerobic media for P. bivia growth |
| Milli-Q Water Purifier | Millipore | IQ-7000 | for making media and homogenization |
| NaCl | Sigma | S3014 | NYCIII media for G. vaginalis growth |
| NaOH tablets | Sigma | S5881 | CDC anaerobic media for P. bivia growth |
| Nitrogen gas | Airgas | Gas for anaerobic chamber | |
| p-200 filter tips | ISC Bio | P-1237-200 | vaginal lavages and bacterial inoculations |
| pancreatic digest of casein | Sigma | 70169 | CDC anaerobic media for P. bivia growth |
| Proteose peptone #3 | Fisher | DF-122-17-4 | NYCIII media for G. vaginalis growth |
| Scissors | Fine Science Tools | 14084-08 | mouse/tissue dissection |
| Sesame oil | Fisher | ICN15662191 | estrogenization of mice |
| Single edge surgical carbon steel razor blades | VWR | 55411-050 | tissue dissection |
| Sodium chloride | Sigma | S3014 | CDC anaerobic media for P. bivia growth |
| Spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| Streptomycin | Gibco | 11860038 | add to agar media to make selective plates |
| Tuberculin slip tip 1ml syringe | BD | 309659 | estrogenization of mice |
| Vitaim K3 | Sigma | M5625 | Columbia media for F. nucleatum growth |
| Vitamin K1 | Sigma | 95271 | CDC anaerobic media for P. bivia growth |
| Yeast extract | Fisher | DF0127-17-9 | NYCIII media for G. vaginalis growth |
参考文献
- Hillier, S. L., Krohn, M. A., Rabe, L. K., Klebanoff, S. J., Eschenbach, D. A. The normal vaginal flora, H2O2-producing lactobacilli, and bacterial vaginosis in pregnant women. Clinical Infectious Diseases. 16, 273-281 (1993).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, 4680-4687 (2011).
- Hill, G. B., Eschenbach, D. A., Holmes, K. K. Bacteriology of the vagina. Scandinavian Journal of Urology and Nephrology. 86, 23-39 (1984).
- van de Wijgert, J. The vaginal microbiome and sexually transmitted infections are interlinked: Consequences for treatment and prevention. PLoS Medicine. 14 (12), 1002478 (2017).
- Srinivasan, S., et al. Bacterial communities in women with bacterial vaginosis: high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria. PLoS One. 7 (6), 37818 (2012).
- Shipitsyna, E., et al. Composition of the vaginal microbiota in women of reproductive age-sensitive and specific molecular diagnosis of bacterial vaginosis is possible. PLoS One. 8 (4), 60670 (2013).
- Brotman, R. M., et al. Bacterial vaginosis assessed by gram stain and diminished colonization resistance to incident gonococcal, chlamydial, and trichomonal genital infection. The Journal of Infectious Diseases. 202 (12), 1907-1915 (2010).
- Peipert, J. F., et al. Bacterial vaginosis, race, and sexually transmitted infections: does race modify the association. Sexually Transmitted Diseases. 35 (4), 363-367 (2008).
- Wiesenfeld, H. C., Hillier, S. L., Krohn, M. A., Landers, D. V., Sweet, R. L. Bacterial vaginosis is a strong predictor of Neisseria gonorrhoeae and Chlamydia trachomatis infection. Clinical Infectious Diseases. 36 (5), 663-668 (2003).
- Spandorfer, S. D., Neuer, A., Giraldo, P. C., Rosenwaks, Z., Witkin, S. S. Relationship of abnormal vaginal flora, proinflammatory cytokines and idiopathic infertility in women undergoing IVF. The Journal of Reproductive Medicine. 46 (9), 806-810 (2001).
- Ralph, S. G., Rutherford, A. J., Wilson, J. D. Influence of bacterial vaginosis on conception and miscarriage in the first trimester: cohort study. BMJ. 319 (7204), 220-223 (1999).
- Holst, E., Goffeng, A. R., Andersch, B. Bacterial vaginosis and vaginal microorganisms in idiopathic premature labor and association with pregnancy outcome. Journal of Clinical Microbiology. 32 (1), 176-186 (1994).
- DiGiulio, D. B., et al. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One. 3 (8), 3056 (2008).
- Svare, J. A., Schmidt, H., Hansen, B. B., Lose, G. Bacterial vaginosis in a cohort of Danish pregnant women: Prevalence and relationship with preterm delivery, low birthweight and perinatal infections. British Journal of Obstetrics and Gynaecology. 113 (12), 1419-1425 (2006).
- Ádám, A., et al. Culture- and PCR-based detection of BV associated microbiological profile of the removed IUDs and correlation with the time period of IUD in place and the presence of the symptoms of genital tract infection. Annals of Clinical Microbiology and Antimicrobials. 17 (1), 40 (2018).
- Di Paola, M., et al. Characterization of cervico-vaginal microbiota in women developing persistent high-risk Human Papillomavirus infection. Scientific Reports. 7 (1), 10200 (2017).
- Bullman, S., et al. Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer. Science. 358 (6369), 1443-1448 (2017).
- Brennan, C. A., Garrett, W. S. Gut microbiota, inflammation, and colorectal cancer. Annual Review of Microbiology. 70, 395-411 (2016).
- Hill, G. B. Preterm birth: associations with genital and possibly oral microflora. Annals of Periodontology. 3 (1), 222-232 (1998).
- Hitti, J., et al. Vaginal indicators of amniotic fluid infection in preterm labor. Obstetrics & Gynecology. 97 (2), 211-219 (2001).
- DiGiulio, D. B. Diversity of microbes in amniotic fluid. Seminars in Fetal and Neonatal. 17 (1), 2-11 (2012).
- Patras, K. A., Doran, K. S. A murine model of Group B Streptococcus vaginal colonization. Journal of Visualized Experiments: JoVE. (117), e54708 (2016).
- Jerse, A. E., et al. Estradiol-treated female mice as surrogate hosts for Neisseria gonorrhoeae genital tract infections. Frontiers in Microbiology. 2, 107 (2011).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539 (2013).
- Gilbert, N. M., et al. Gardnerella vaginalis and Prevotella bivia trigger distinct and overlapping phenotypes in a mouse model of bacterial vaginosis. The Journal of Infectious Diseases. 220 (7), 1099-1108 (2019).
- Agarwal, K., et al. Glycan cross-feeding supports mutualism between Fusobacterium and the vaginal microbiota. PLOS Biology. 18 (8), 3000788 (2020).
- Liehr, J. G. Is estradiol a genotoxic mutagenic carcinogen. Endocrine Reviews. 21 (1), 40-54 (2000).
- Yager, J. D., Davidson, N. E. Estrogen carcinogenesis in breast cancer. The New England Journal of Medicine. 354 (3), 270-282 (2006).
- Adeel, M., Song, X., Wang, Y., Francis, D., Yang, Y. Environmental impact of estrogens on human, animal and plant life: A critical review. Environment International. 99, 107-119 (2017).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Journal of Applied Microbiology. 17 (2), 250-251 (1969).
- Lewis, W. G., Robinson, L. S., Gilbert, N. M., Perry, J. C., Lewis, A. L. Degradation, foraging, and depletion of mucus sialoglycans by the vagina-adapted Actinobacterium Gardnerella vaginalis. Journal of Biological Chemistry. 288 (17), 12067-12079 (2013).
- Robinson, L. S., et al. Genome sequences of 15 Gardnerella vaginalis strains isolated from the vaginas of women with and without bacterial vaginosis. Genome Announcements. 4 (5), 00879 (2016).
- Adapted from "mouse posterior turn" by BioRender.com. BioRender.com Available from: https://app.biorender.com/biorender-templates (2022)
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments: JoVE. (67), e2771 (2012).
- Verollet, R. A major step towards efficient sample preparation with bead-beating. Biotechniques. 44 (6), 832-833 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。