Method Article
嫌気性増殖細菌によるマウス膣コロニー形成モデル
要約
このプロトコルは、嫌気的に培養されたヒト膣細菌による膣コロニー形成のマウスモデルを提示します。ガード ネレラ膣に焦点を当て、 プレボテラビビア と フソバクテリウム核の提案を含めます。このプロトコルは、膣接種および他の嫌気性増殖細菌の生存可能な回復のためのガイドとしても使用できます。
要約
哺乳類の膣は、多くの細菌分類群によってコロニーを形成することができます。ヒトの膣内微生物叢は、多くの場合、 ラクトバチルス 種によって支配されていますが、女性の4人に1人は、低レベルの乳酸菌が多様な嫌気性細菌の異常増殖を伴う細菌性膣炎を経験しています。この状態は、生殖および性的健康へのリスクを含む多くの健康上の合併症と関連しています。ヒトの膣の健康における微生物相互作用の複雑な性質を示す証拠が増えていますが、これらの異なる嫌気性細菌の個々の役割は完全には理解されていません。これは、嫌気性的に増殖した膣内細菌を研究するための適切なモデルの欠如によって複雑になります。マウスモデルにより、これらの生物の生体内および病原性を調べる ことができます。膣内細菌接種の他のマウスモデルが以前に記載されている。ここでは、従来飼育したC57Bl/6マウスにおける嫌気性増殖菌の接種方法とその生残回収方法について述べる。膣の接種と洗浄のための新しい、ストレスの少ない手続き方法も説明されています。 ガードネレラ の接種と生存可能な回復について詳細に概説し、 プレボテラビビア や フソバクテリウム核 などの追加の嫌気性菌の戦略について説明します。
概要
哺乳類では、膣は細菌種のコンソーシアムの本拠地です。ヒト膣マイクロバイオームは、ラクトバチルス属のメンバーの豊富さと対応する低い膣pH(3.8-4.5)1,2,3,4において哺乳類の中で独特です。この乳酸菌優勢の崩壊は、さまざまな健康上の悪影響と関連しています。
細菌性膣炎(BV)では、乳酸桿菌が少なくなり、ガードネレラ膣やプレボテラビビアなどの多様な嫌気性細菌が豊富に増えています5,6。BVの女性は、性感染症7,8,9、不妊症10、妊娠喪失11、早産12,13,14、子宮内感染症15、子宮頸部感染症16、がん16,17,18のリスクが高い。.BVはまた、羊水感染症からの一般的な分離株であるフソバクテリウム核1、19、20などの潜在的に病原性細菌による膣コロニー形成のより高い可能性と関連している21。
人間の膣の健康における嫌気性細菌の重要性のために、これらの生物の生物学と病因を調査するために使用できる動物モデルが必要です。ここでは、エストロゲン化マウスにおける ガードネレラ 膣の膣接種と生存可能な回復の方法について説明し、 プレボテラビビア と フソバクテリウム核の追加戦略を提案します。マウス膣コロニー形成の他のモデルは以前に説明されていますが、これらは好気的に培養されたグループB 連鎖球菌22 や 淋菌23 などの通性嫌気性細菌の接種と回復に焦点を当てています。偏性嫌気性菌の接種と回収は、適切な実験戦略で成功裏に達成できます。いくつかの細菌分類群の実行可能な回復のためのアプローチについて議論し、関心のある追加の種/株の生存率の条件の経験的評価を提案します。
生きた細菌によるコロニー形成を推定する古典的な方法は、コロニー形成単位(CFU)の回収です。独自の内因性微生物叢を持つ従来の飼育マウスでは、接種された細菌株を増殖させながら、内因性膣内細菌叢のメンバーに対して選択する寒天培地での回復が必要です。ここでは、ストレプトマイシン含有寒天培地で選択的に回収できる G. vaginalis24 のストレプトマイシン耐性分離株を使用します。培地が十分に選択的であり、逆にストレプトマイシン耐性菌が内因性微生物叢に存在しないことを確認するために、接種直前に収集された膣洗浄剤を選択的(ストレプトマイシン含有)寒天培地に播種する必要があります。
接種材料調製のための最良の方法は、細菌の種および株によって異なり得る。マウスでの実験を開始する前に、培地の好ましい条件、成長エンドポイント、接種材料の調製、ならびにPBSの酸素に対する感受性と生存率を決定するための予備作業を実施する必要があります。より酸素感受性の細菌の場合、接種材料の代替調製を検討することができる(例えば、適切なビヒクル対照群を有する嫌気性培養培地中)25,26。
プロトコル
すべての動物実験は、カリフォルニア大学サンディエゴ校の機関ガイドラインおよび実験動物の世話と使用のためのガイド(UCSD、プロトコル番号:S20057、2020年以降)に従って承認および実施され、それ以前はセントルイスのワシントン大学(プロトコル20110149、2020年まで)。
注:以下のプロトコルは、接種時に6〜11週齢の従来の雌C57Bl /マウスを利用しています。関連する引用された作品で以前に使用されたベンダー情報と特定の年齢範囲に注意してください。
1.β-エストラジオール17-吉草酸の調製と投与
注:β-エストラジオール17-吉草酸は発がん性物質であり、皮膚から吸収される生殖毒素です27,28。粉末および液体溶液の取り扱い中は、適切なPPEを着用してください。また、水生毒素29でもあります。適切に密封され、ラベル付けされた容器に適切に廃棄してください。
- フィルター 50mLのコニカルチューブ真空フィルターシステムを使用して、0.22μmのフィルターを通して最大50mLのゴマ油を滅菌します。無菌性を維持するために、バイオセーフティキャビネット内でのみ開いてください。
- 実験に必要なβ-エストラジオール吉草酸溶液の量を計算します:マウスあたり200 μLに加えて、シリンジ充填中のサンプル損失を考慮して2〜3 mL余分に(たとえば、10マウスの実験には合計4 mLが必要です)。5 mg/mL溶液を作るのに必要な吉草酸β-エストラジオールの量を計算し、14 mLの丸底チューブで直接計量します。
- 14 mLチューブをしっかりと蓋し、ボルテックスして粉末の塊を破壊します(これにより、吉草酸β-エストラジオールがより迅速に溶解できるようになります)。滅菌ろ過したゴマ油を14 mLチューブに加えて、吉草酸β-エストラジオールの最終濃度が5 mg / mLになるようにします。
- しっかりと蓋をした14 mLチューブをローテーターに37°Cで30〜40分間置き、固体粉末が完全に溶解するまで待ちます。マウスに注射する前に溶液の均一性を視覚的に確認します。37°Cでインキュベートすると、ごま油の粘度が低下し、注入が容易になります。
- 吉草酸β-エストラジオール溶液を1 mLシリンジ(針なし)に引き出します。泡を導入せずにこれを行うには、まず少量の溶液を引き出してから、シリンジの先端をゴマ油に入れたまま静かに排出します。100 μLマークをわずかに超えて、ゆっくりと溶液を再び引き上げます。
- 25 G x 5/8インチの針をシリンジに置きます。次に、ゴマ油溶液が針先から出始めるまでゆっくりと排出して、針をプライミングします。シリンジが100μLマークになるまで溶液を排出します。マウスごとに1つのシリンジを準備します。
- 接種の48時間または72時間前に腹腔内注射によりβ-エストラジオール17-吉草酸塩を投与します。.前述のように、各マウスに100 μLの5 mg / mL β-エストラジオールバレレート溶液(0.5 mg β-エストラジオールバレレート/マウス)を注射します22,30。残りの溶液を次の注入まで4°Cで72時間保存します。
- β-エストラジオール吉草酸塩溶液を接種当日、マウスの膣接種の直前に再度投与する。溶液を4°Cから取り出し、37°Cのローテーターに30分間置いてから注入し、ゴマ油を温めて粘性を弱めます。ステップ1.7の説明に従って注射を続行します。
2.接種材料の調製
注:このセクションには、嫌気的に成長したストレプトマイシン耐性ガードネレラ膣JCP8151B-SmR24,25,31,32から接種菌を調製するための一般的な手順が含まれています。このセクションのすべてのステップは、嫌気性チャンバーで行う必要があります。
- 調製したNYC IIIブロス、寒天、PBSなどの試薬を嫌気性チャンバーに入れて、使用前に少なくとも24時間平衡化します。
注:ここでは、5%水素ガス混合物で平衡化されたビニール嫌気性チャンバーを使用しました。内部酸素濃度は通常0ppmですが、材料をチャンバーに循環させると、低レベルの過渡的な増加(10〜25 ppm)が発生する可能性があります。 - 膣接種の2日前に、凍結グリセロールストックから嫌気室のNYC III寒天プレートに ガードネレラ をストリークアウトします。ドライアイスで満たされた小さな容器(空のピペットチップボックスなど)を使用して、チャンバーへの輸送中およびチャンバーからの輸送中にグリセロールストックを凍結状態に保ちます。
- 膣接種の1日前に、プレートから5〜10個の ガードネレラ コロニーを使用して、10mLのNYC IIIブロスを接種します。液体培養液を37°Cで16時間一晩増殖させます。 接種せずに放置した培養培地の2番目の1 mLアリコートを含め、接種した培養液と一緒にインキュベートして、培地が汚染されていないことを確認します。
- 下記のように液体培養から接種材料を調製する。できるだけ嫌気室で接種剤の準備を行います。
- 1.5 mL キュベット(1:5 希釈)中の800 μLのフレッシュ培地に200 μLの培養液を加えて、培養光学密度(OD)を測定します。分光光度計を使用して、波長600 nmで希釈した培養物の密度(OD)を測定します(ブランクとして新鮮な培地のみを使用した別のキュベットを使用します)。ODの読み取り値に5を掛けて、16時間の培養の実際のOD600 を取得します。
- 実験に必要な接種材料の量を計算します。例えば、15匹のマウスに1匹あたり20 μLの接種材料を感染させるには、15 x 20 μL = 300 μLの接種材料が必要です。必要以上に約25%多くの接種材料を準備するため、15匹のマウスに対して、300 μL+(0.25 x 300 μL)= 375 μLの接種材料を準備します。
- ステップ2.4.1で決定したOD 600を使用して、ステップ2.4.2で計算された容量でOD600 = 5.0接種材料を得るためにスピンダウンして再懸濁する必要がある16時間の培養液の体積を計算します。例えば、培養液のOD600が1.5で、必要な接種量が375 μLの場合、スピンダウンする培養液量は(375 μL x 5)/1.5 = 1250 μLです。
- ステップ2.4.3で計算した培養量をピペットで入れます。滅菌マイクロ遠心チューブに入れます。16,000 x g で1〜3分間遠心分離して細菌をペレット化します。
- 上清を除去し、ステップ2.4.2で計算された容量で嫌気性PBSにペレットを再懸濁します。接種材料は、5.0の計算されたOD600 になります。該当する場合は、非感染対照群におけるマウスのビヒクル対照として機能するPBSのチューブも調製する。
- 嫌気性チャンバーから接種チューブを取り外す前に、PBSで1:10から1:10 x 106までの連続希釈シリーズを準備します。スポットプレート5は、マルチチャンネルピペットを用いて寒天プレート上に各希釈液を複製し、接種材料のCFUを測定した。これが接種前のCFUです。
3.膣の事前洗浄とガードネレラの接種
- 嫌気性チャンバーで膣洗浄/洗浄チューブを準備します(これは、ステップ2.4の接種材料の準備と同時に行うことができます)。70 μLの滅菌嫌気性PBSを、マウス番号でラベル付けされた1.5 mLマイクロ遠心チューブにピペットで入れます。マウス1匹につき1本の洗浄チューブを用意します。チューブをしっかりと閉じて、嫌気室から取り出します。
- ステップ3.1で調製した個々のチューブから50 μLの嫌気性PBSを使用して、各マウスに膣洗浄を行います。これらの膣洗浄剤は接種前の洗浄液であり、下流の測定やアッセイに使用できます。
- 2回目の吉草酸β-エストラジオール注射(ステップ1.8)の投与後、各マウスをケージまたは前足でつかむことができる清潔で硬い表面の上に置きます。尾の中央部分をそっとつかみ、後部がわずかに高くなり、膣口が露出するように持ち上げます。
- ピペットとp-200フィルターチップを使用して、適切なマウスに対応する洗浄チューブから50 μLのPBSを吸引します。ピペットチップを膣内腔~2-3 mmにそっと挿入し、50 μLの容量を3x-4xで穏やかにピペットで出し入れします。
- 回収した洗浄材(~50 μL)を元の洗浄チューブに戻し、残りの20 μLのPBSが残っている洗浄チューブ内で上下にピペッティングします。粘液が過剰でチップが詰まった場合は、きれいなp-200チップを使用して残りの材料を収集し、同じ洗浄チューブに入れます。
- 20 μLの濃縮細菌懸濁液またはビヒクルコントロールを各マウスの膣に経膣投与します。.そのマウスの膣洗浄の直後に各マウスに接種します(すなわち、次のマウスに移る前に、各マウスに対して洗浄と接種を順番に実行します)。このプロセスを簡素化するために、2台のp200ピペット(1台は洗浄用に50 μL、もう1本は接種用に20 μL)を使用します。
- 手順 3.2.1 の説明に従ってマウスを拘束します。p-200チップを使用して、20μLの細菌懸濁液を膣内にピペットで入れます。2つの異なる菌種/菌株を用いた同時接種実験では、各菌液10μLを使用し、接種前に2つの菌株を混合しないでください。
注:膣からのこぼれを避けるために、総接種量は20μLを超えてはなりません。. - 各マウスの後端を10〜20秒間保持して、投与された量が膣内口にすぐに溜まらないようにします。.次に、マウスを新しいケージ/レセプタクルに入れるか、すでに接種済みのケージメイトと一緒に置きます。
- 手順 3.2 を繰り返します。およびステップ3.3。マウスごとに。まだ接種されていない動物と一緒にケージにマウスを戻さないでください。これにより、接種前にマウスがストレプトマイシン耐性菌に不注意にさらされることを防ぎます。
- 手順 3.2.1 の説明に従ってマウスを拘束します。p-200チップを使用して、20μLの細菌懸濁液を膣内にピペットで入れます。2つの異なる菌種/菌株を用いた同時接種実験では、各菌液10μLを使用し、接種前に2つの菌株を混合しないでください。
- すべてのマウスに接種した後、接種チューブを嫌気性チャンバーに戻します。ステップ2.5で説明されているように、別の段階希釈液を調製してプレートします。これは接種後のCFUです。接種後プレートと接種前プレートのCFUを比較して、動物の接種中に嫌気室の外にいる間に接種材料の生存率が低下したかどうかを判断します。
- ステップ3.2で収集した膣洗浄液をプレートします。選択的寒天(この場合、1 mg / mLストレプトマイシン)で。プレートを37°Cの嫌気性チャンバーで1〜2日間インキュベートし、成長を調べます。
注:成長は、マイクロバイオームの内因性メンバーが選択マーカーに耐性があり、したがって、標的生物のCFU列挙を不明瞭にする可能性があることを示しています。
4.実行可能な ガードネレラ コロニー形成を決定するための膣洗浄の収集
- 選択した時点で膣洗浄を収集して、膣のコロニー形成を分析します。手順 3.2 の説明に従って収集します。
- 採取直後に、膣洗浄液を嫌気性チャンバーに入れます。各洗浄液10 μLを使用して、ステップ2.5の説明に従って、選択的寒天への段階希釈とプレーティングを行います。 ガードネレラ (または関心のある別の嫌気性菌)による膣コロニー形成の尺度としてCFUカウントを使用します。
5.犠牲、解剖、および組織の均質化
- 各マウスから採取する臓器ごとに5 mLのチューブを準備します(たとえば、膣、子宮頸部、子宮がすべて採取されている場合は、マウスごとに3本のチューブを準備します)。嫌気性チャンバー内で各チューブに滅菌嫌気性1x PBS(または他のホモジナイズ媒体)を充填します。膣と子宮頸部を採取するチューブには1 mLのPBSを使用し、子宮角の採取に使用するチューブには750 μLを使用します。
- PBSを追加したら、個々のチューブの重量を測定します(これは収集前の重量であり、採取された各組織の総重量を決定するために使用されます)。嫌気性チャンバーでスケールが利用できない場合は、チューブにしっかりと蓋をしてチャンバーから取り出して計量し、サイクルインに戻します。
注:チューブの準備と体重の収集は、犠牲の1日前に行うことができますが、チューブは、蒸発を防ぐためにキャップをしっかりと密閉した状態で嫌気性チャンバーに保管する必要があります。 - 手順3.1の説明に従って、膣洗浄チューブのセットを準備します。犠牲で最後の洗浄を集めるために。また、脱イオン(DI)水の50 mLビーカーと、犠牲中に標準的な鋼製解剖器具をすすぎおよび滅菌するために使用する70%〜90%エタノールの2番目の50 mLビーカーを準備します。
- 嫌気室からPBSで満たされた臓器収集チューブを循環させます。組織を追加する準備ができるまで、チューブをしっかりと閉じたままにします。
- IACUCが承認した方法を使用して各マウスを犠牲にします。手順3.2.2の説明に従って、最後の洗浄を実行します。および3.2.3。犠牲の直前または直後のいずれか。
- 解剖と組織採取を開始します。各マウスの腹部と背中に70%エタノールをスプレーします。エタノールのビーカーでハサミを滅菌し、乾燥させてから、マウスの腹部骨盤腔を垂直に1回切ります。
- 滅菌鉗子を使用して皮膚を引き戻し、腸を体腔から開放視野の側面にそっと押し出し、生殖管を露出させます。
注意: 実験結果を混乱させる可能性のあるストレプトマイシン耐性菌が宿っている可能性があるため、腸に穴を開けたり穴を開けたりしないように注意してください。 - 最大の膣組織を集めるには、剖検中に恥骨を壊します。滅菌ハサミを使用して、膣に食い込まないように注意しながら恥骨の中心(恥骨結合)を切り取ります。2組の滅菌鉗子を使用して、骨盤の両側をつかみ、骨盤を横方向に引き開き、下の膣の下部を露出させます。
- 鉗子を使用して子宮頸部(周囲の組織に比べて硬い構造)をそっとつかみます。子宮頸部をそっと引き上げて、後ろに隠れて膣に密接に接続されている結腸を露出させます。
- 小さなはさみを使用して、外部結合組織から膣を解放します。膣を結腸から慎重に分離し、腸管に穴を開けないようにしてください。完全に解放されたら、ハサミでイントロイトの膣を脇に置き、マウスの体から解放するために切り取ります。
- 子宮角をより目立たせるためにわずかに引き上げながら、子宮頸部を優しく握り続けます。一方、左右の卵巣の真下を切り、子宮角を解放します。切断された生殖管を体腔から取り外し、滅菌ペトリプレートに入れます。
- かみそりを使用して、子宮角、子宮頸部、および膣を分離します。各組織をそれぞれのラベル付き収集チューブに入れます。サイトカインを収集する場合は、組織を追加した後にチューブを氷の上に置きます。
- ティッシュを追加した後、各チューブの重量を再度測定します。これは収集後の重量です。収集後の重量から収集前の重量を差し引いて、組織の総重量を取得します。
- ハンドヘルドホモジナイザーを使用して、収集チューブ内の臓器を均質化します。 ガードネレラ JCP8151Bの場合、バイオセーフティキャビネット(好気性)または嫌気性チャンバーでこのステップを実行します。
- サンプル間のハンドヘルドホモジナイザーの洗浄と無菌処理のために、数セットのチューブを準備します。各セットに3つの50 mLコニカルチューブがあることを確認します:1つはDI水で満たされ、1つは70%エタノールで満たされ、3つ目は1x PBSで満たされます。マウス治療グループごとに個別の洗浄チューブセットを準備します。
- ホモジナイザーを洗浄するには、ブレードを各洗浄チューブ内の液体に下げ、機器を最高速度に回します。ホモジナイザーを3つのチューブのそれぞれに約3秒間保持します。洗浄の順序は、DI水(物理的な破片を除去するため)、次にエタノール(消毒するため)、そして最後に1x PBS(中和するため)です。プローブをペーパータオルまたは使い捨てベンチパッドに振って、各すすぎの間に余分な液体を取り除きます。
- 最初のすすぎに続いて、ホモジナイザープローブを収集チューブの底まで下げ、下の組織をトラップして組織を均質化します。ホモジナイザーをオンにして組織を粉砕し、水没したままプローブを約5倍にゆっくりと上下に動かします。各臓器を約15〜30秒間均質化します。
- ホモジナイザーの電源を切り、チューブから取り外した後、内容物を目視検査して、組織が完全に破壊されていることを確認します。これは、プローブに捕まらないことがある子宮頸部と膣にとって特に重要です。
注:子宮角の余分な脂肪が完全に均質化していなくても大丈夫です。 - 手順5.14.1.-5.14.4を繰り返し、各サンプル間でプローブを洗浄および滅菌します。実験グループごとに新しい洗浄チューブのセットに切り替えます。
- 均質化されたサンプルを含むチューブを嫌気性チャンバーに移動します。各組織の細菌負荷を決定するには、混合するサンプルを短時間穏やかにボルテックスしてから、段階希釈のために100 μLの組織ホモジネートを除去し、CFU測定のために選択寒天にプレーティングします(最初の希釈は1 x 100です)。下限の検出が必要な場合は、200〜250μLの未希釈ホモジネートのスプレッドプレーティングを実行します。
結果
実験例の概略図は、説明されているプロトコルを実行する方法のいくつかを示しています(図1)。
一部の動物は、非選択培地上で成長する膣内微生物叢に内因性微生物を運びます。ここに記載されている方法は、内因性細菌に対して選択するために、ストレプトマイシンを含む選択培地とともに、研究対象の細菌株のストレプトマイシン耐性分離株に依存しています(図2A、B)。ストレプトマイシン耐性は自然に発症する可能性があるため、感染前(0日目の洗浄)にマウスをチェックすると、これが問題である可能性があるかどうかを確認するのに役立ちます。
膣洗浄液からの生菌の回収は、寒天培地での段階希釈とメッキによって達成されます。標準的なペトリ皿は、5 μLスポットの最大6 x 6アレイを保持できるため、10倍の段階希釈を使用すると、各サンプルの6桁にわたる6つのレプリカスポットからの細菌力価を列挙できます(図3A)。この方法は、ガードネレラからプレボテラおよびフソバクテリウムまでの細菌の力価を列挙するために使用できます(図3B-D)。
一緒に、これらの方法は、仮説をテストし、女性の生殖管の細菌のコロニー形成/感染についての解釈をすることを可能にします。例えば、膣洗浄液および膣組織ホモジネート中のガードネレラ力価の比較は、これらの方法間の一致を示した(図4A)。同様に、膣同時接種モデルでは、子宮組織中のプレボテラの力価は、プレボテラ単感染と比較してガードネレラ同時感染中に有意に高かった(約20倍)(図4B)。最後に、これらのモデルで野生型細菌株と変異菌株を比較して、生殖管のコロニー形成/感染の過程で特定の遺伝子とその産物が果たす役割を確立することができます。例えば、炭水化物シアル酸を輸送および消費する能力を欠くフソバクテリウムの変異株は、接種後3日までにコロニー形成のレベルを低下させた(図4C)。
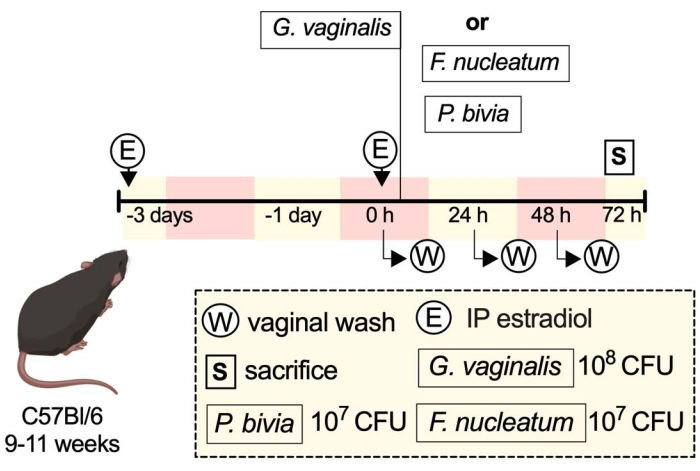
図1:実験例の概略図 33. この図の拡大版を表示するには、ここをクリックしてください。
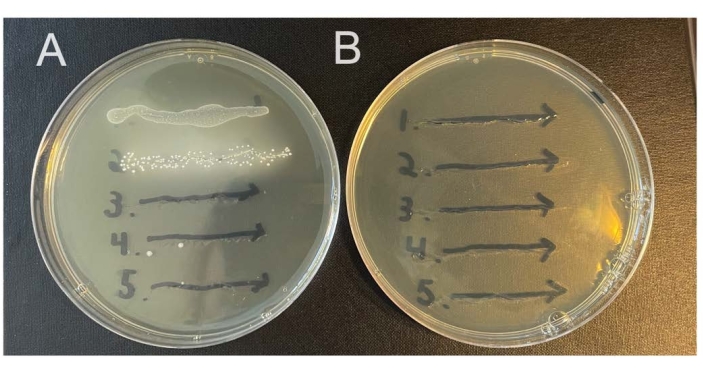
図2:選択的寒天培地と非選択的寒天培地での内因性マウス膣微生物の増殖。 5匹の雌C57Bl/6マウス(1-5)の膣洗浄液を2つの異なるNYC III寒天プレートにストリークし、嫌気的にインキュベートした。(A)左側のプレートには抗生物質が含まれておらず、マウス膣管からの内因性嫌気性細菌の増殖を可能にします。(B)右側のプレートには1 mg/mLのストレプトマイシンが含まれており、内因性細菌の増殖に対して選択します。 この図の拡大版を表示するには、ここをクリックしてください。
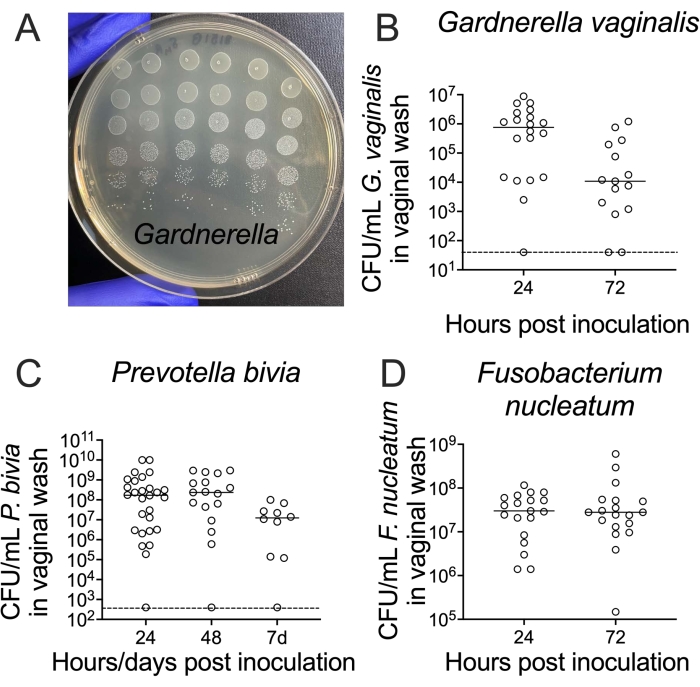
図3:膣洗浄からの生存可能なG.膣、P.ビビア、およびF.核CFUの回復。 (A)G.膣JCP8151B-SmR接種源のCFU、NYC III寒天培地に希釈系列としてレプリカメッキ。(B-D)単感染動物の膣洗浄からの生存可能な(B)G.膣24、(C)P.ビビア25、および(D)F.核26の回収。各グラフ(B−D)について、2つの独立した実験からのデータを、実験当たり10〜15匹のマウスで組み合わせる24、25、26。この図の拡大版を表示するには、ここをクリックしてください。
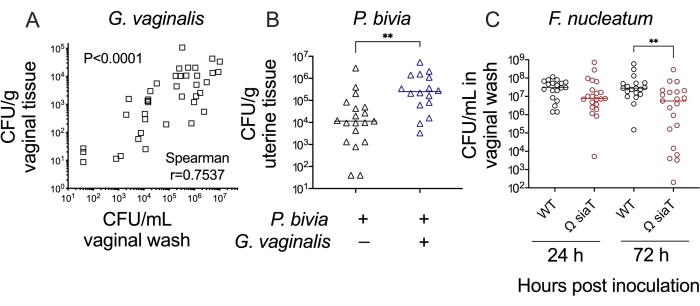
図4:マウス膣接種モデルにおける嫌気性細菌コロニー形成のさらなる分析。 (A)膣洗浄液中のG.膣力価は、接種後24時間および72時間で膣組織ホモジネートから回収されたG.膣力価と相関する(2つの独立した実験の組み合わせ、それぞれn=10。スピアマンの順位相関検定によって決定される有意性)24。(B)G.膣との同時感染は、接種後48時間でP.ビビアモノ感染動物と比較した場合、子宮角組織におけるP.ビビア力価の増加をもたらす(2つの独立した実験の組み合わせ、それぞれグループあたり6〜10匹のマウス。 有意性はマン・ホイットニーU検定によって決定され、**p = 0.0017)25。(C)シアル酸トランスポーター(Ω SiaT)を破壊したF. nucleatum変異体は、接種後72時間で野生型のF. nucleatumと比較して、単感染マウスの膣洗浄における力価が低下した(2つの独立した実験の組み合わせ、それぞれ1群あたり10匹のマウスを用いた)。有意性はマン・ホイットニーU検定、**p < 0.01)26によって決定されました。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:嫌気条件下で増殖するさまざまな膣細菌に使用される方法の例。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明するモデルが以前に公開された膣接種モデルと異なる最も重要な点は、嫌気的に培養された細菌の使用であり、生存可能な接種材料の調製とマウスからの細菌の回収に特別な配慮が必要です。上記のプロトコルの具体的な手順は、 補足ファイル1で提案されているように、使用する細菌の種/菌株によってわずかに異なる場合があります。さらに、この原稿は、細菌と膣洗浄剤を投与するための新しい手順を説明しており、研究者の経験が少なく、マウスの拘束が少なくて済みます。実験者がステップ3.2で説明されている拘束の形式に慣れていない場合。ステップ3.3.は、マウスを、実験デザインおよび施設内IACUCガイドラインに従って麻酔の有無にかかわらず、前述のように34 のように絞首刑にすることができる。
マウスモデルで嫌気的に培養された細菌を使用することに関する重要な注意点は、特定のステップ(生きている動物が関与するステップなど)は嫌気室の外で行わなければならないということです。したがって、このプロトコルの最も重要なステップは、目的の細菌がマウスの接種中などの好気性環境にさらされるステップです。このモデルで新しい嫌気性菌を使用するには、酸素への曝露時に生存能力を維持する能力に関する予備調査が必要になります(ステップ2.5およびステップ3.4で説明されている接種前と接種後のCFUの比較など)。生物の酸素およびPBS感受性の程度に応じて、接種材料の調製の異なる方法を検討する必要があります(補足ファイル1、ステップ2.4.5)。 G. vaginalis JCP8151Bを用いた接種では、1本の接種材料をPBSで調製し、すべてのマウスに感染させることができることを見出しました。酸素に敏感な別の嫌気性細菌を使用している場合は、代わりにマウスごとに別々のチューブで接種材料を調製できるため、チューブの開閉を繰り返す必要はありません。同様に、関心のある細菌種が G.膣 よりもPBSでより潔癖である/生存能力が低い場合は、代わりに培養培地で接種を調製することができます。使用される培地に、 Prevotella bivia の培養に使用されるCDC嫌気性菌培地(補足ファイル1、ステップ2.1.およびステップ2.2)などの還元剤が含まれている場合、細菌は酸素曝露からの保護も強化されます。
チューブキャップを閉じた状態で行われ、したがってハンドヘルドホモジナイザーよりも少ない酸素を導入する可能性のあるビーズビート22,35などの均質化の代替方法も検討できます。さらに、より酸素感受性の生物は、培地に対してより長い平衡時間を必要とする可能性がある。レサズリンなどの酸素インジケーターを使用して、嫌気性条件に達したことを確認できます(ステップ2.1)。嫌気性ジャーなどの代替方法は結果に影響を与える可能性があるため、使用前に細菌の生存率を精査する必要があります。
実験生物の酸素感受性と潔癖さも、洗浄/ホモジナイズ中にマウスから生菌を正常に回収する上で役割を果たす可能性があります(補足ファイル1、ステップ3.2.およびステップ5.1)。非常に敏感な生物の場合、洗浄が採取されてからメッキされるまでの時間は、生存能力の喪失につながり、細菌の膣コロニー形成の人為的に低い推定値を引き起こす可能性があります。この影響を軽減するために、収集された洗浄剤は、新鮮な嫌気性培養培地(還元剤を含む)に直ちに希釈することができます。同様に、臓器の均質化は、細菌の生存率を高めるためにPBSではなく新鮮な培養培地で行うことができ、酸素曝露を最小限に抑えるために嫌気性チャンバー自体で行うこともできます。
与えられた実験の目的に応じて、実験者は対照群に注意を払う必要があります。仮説を検証するために、ビヒクルのみで模擬処理された非感染対照マウスのベースライン測定値は、ケモカイン/サイトカインの誘導または他の特定の感染結果があるかどうかを確認するのに役立ちます。使用するコントロールビヒクルは接種に使用するビヒクルと同じでなければならないため、細菌を培地で接種する場合は、接種されていない培地をコントロールとして使用する必要があります(補足ファイル1、ステップ2.4.5)。
このプロトコルに記載されている方法は、嫌気的に増殖することができるが、好気性培養条件( 大腸 菌やグループB 連鎖球菌など)を使用して伝統的に研究されている通性細菌にも適用できます。これは、子宮頸部などの低レベルの酸素を含むと考えられている身体部位でのこれらの生物による感染症に特に関連している可能性があります。通性生物は、接種源が好気的によりも嫌気的に調製された場合、より少ない酸素でよりうまく部位に感染する可能性がある。このような実験では、CFU列挙のための生菌の回収は嫌気性条件を必要としない場合がある。
開示事項
著者は利益相反を宣言しません。
謝辞
これらのモデルの開発中に技術支援を提供してくれたリン・フォスターに感謝します。分子微生物学部門と女性感染症研究センター(ALへ)からのスタートアップ資金、および初期段階の実験を支援するのに役立ったマーチオブダイム(ALへのバジルオコナー賞)に感謝します。国立アレルギー感染症研究所(R01 AI114635)もこれらのモデルの開発を支援しました。
資料
| Name | Company | Catalog Number | Comments |
| β-estradiol 17-valerate | Sigma | E1631 | estrogenization of mice |
| 0.22 µm, 50 mL Steriflip vacuum filter | Fisher | SCGP00525 | sterile filtering sesame oil |
| 14 mL tube | Falcon | 352059 | estrogenization of mice |
| 190-proof ethanol | Koptec | V1105M | dissection, tissue homogenization, CDC and Columbia media |
| 1x PBS | Fisher | MT21040CM | vaginal lavage, G. vaginlalis inoculum prep, tissue collection and homogenization |
| 25 G × 5/8 -in needle | BD | 305122 | estrogenization of mice |
| 5 mL tube | Falcon | 352063 | Tissue collection and homogenization |
| Anaerobic chamber | Coy | 7200000 | Growth of anaerobic bacteria |
| Bacto agar | Fisher | DF0140074 | G. vaginalis, F. nucleatum, and P. bivia agar plates |
| Bacto peptone | Fisher | DF0118170 | CDC anaerobic media for P. bivia growth |
| Columbia broth | Fisher | DF0944170 | Columbia media for F. nucleatum growth |
| Defibrinated sheep blood | Hemostat | DSB500 | CDC anaerobic media for P. bivia growth |
| Forceps | Fine Science Tools | 11008-13 | mouse/tissue dissection |
| Glucose | Sigma | G7528 | NYCIII media for G. vaginalis growth |
| Handheld homogenizer | ISC Bio | 3305500 | Tissue homogenization |
| Hemin | Sigma | 51280 | CDC anaerobic media for P. bivia growth, Columbia media for F. nucleatum growth |
| HEPES | Cellgro | 25-060-Cl | NYCIII media for G. vaginalis growth |
| Horse serum | Hemostat | SHS500 | NYCIII media for G. vaginalis growth |
| Hydrogen gas mix (5% hydrogen, 10% CO2, 85% nitrogen) | Matheson | Gas for anaerobic chamber | |
| Isofluorane | VetOne | 502017 | mouse anaethesia at sacrifice |
| L-cysteine | Sigma | C1276 | CDC anaerobic media for P. bivia growth |
| L-glutamate | Sigma | G1626 | CDC anaerobic media for P. bivia growth |
| Milli-Q Water Purifier | Millipore | IQ-7000 | for making media and homogenization |
| NaCl | Sigma | S3014 | NYCIII media for G. vaginalis growth |
| NaOH tablets | Sigma | S5881 | CDC anaerobic media for P. bivia growth |
| Nitrogen gas | Airgas | Gas for anaerobic chamber | |
| p-200 filter tips | ISC Bio | P-1237-200 | vaginal lavages and bacterial inoculations |
| pancreatic digest of casein | Sigma | 70169 | CDC anaerobic media for P. bivia growth |
| Proteose peptone #3 | Fisher | DF-122-17-4 | NYCIII media for G. vaginalis growth |
| Scissors | Fine Science Tools | 14084-08 | mouse/tissue dissection |
| Sesame oil | Fisher | ICN15662191 | estrogenization of mice |
| Single edge surgical carbon steel razor blades | VWR | 55411-050 | tissue dissection |
| Sodium chloride | Sigma | S3014 | CDC anaerobic media for P. bivia growth |
| Spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| Streptomycin | Gibco | 11860038 | add to agar media to make selective plates |
| Tuberculin slip tip 1ml syringe | BD | 309659 | estrogenization of mice |
| Vitaim K3 | Sigma | M5625 | Columbia media for F. nucleatum growth |
| Vitamin K1 | Sigma | 95271 | CDC anaerobic media for P. bivia growth |
| Yeast extract | Fisher | DF0127-17-9 | NYCIII media for G. vaginalis growth |
参考文献
- Hillier, S. L., Krohn, M. A., Rabe, L. K., Klebanoff, S. J., Eschenbach, D. A. The normal vaginal flora, H2O2-producing lactobacilli, and bacterial vaginosis in pregnant women. Clinical Infectious Diseases. 16, Suppl 4 273-281 (1993).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, Supplement_1 4680-4687 (2011).
- Hill, G. B., Eschenbach, D. A., Holmes, K. K. Bacteriology of the vagina. Scandinavian Journal of Urology and Nephrology. 86, 23-39 (1984).
- van de Wijgert, J. The vaginal microbiome and sexually transmitted infections are interlinked: Consequences for treatment and prevention. PLoS Medicine. 14 (12), 1002478(2017).
- Srinivasan, S., et al. Bacterial communities in women with bacterial vaginosis: high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria. PLoS One. 7 (6), 37818(2012).
- Shipitsyna, E., et al. Composition of the vaginal microbiota in women of reproductive age-sensitive and specific molecular diagnosis of bacterial vaginosis is possible. PLoS One. 8 (4), 60670(2013).
- Brotman, R. M., et al. Bacterial vaginosis assessed by gram stain and diminished colonization resistance to incident gonococcal, chlamydial, and trichomonal genital infection. The Journal of Infectious Diseases. 202 (12), 1907-1915 (2010).
- Peipert, J. F., et al. Bacterial vaginosis, race, and sexually transmitted infections: does race modify the association. Sexually Transmitted Diseases. 35 (4), 363-367 (2008).
- Wiesenfeld, H. C., Hillier, S. L., Krohn, M. A., Landers, D. V., Sweet, R. L. Bacterial vaginosis is a strong predictor of Neisseria gonorrhoeae and Chlamydia trachomatis infection. Clinical Infectious Diseases. 36 (5), 663-668 (2003).
- Spandorfer, S. D., Neuer, A., Giraldo, P. C., Rosenwaks, Z., Witkin, S. S. Relationship of abnormal vaginal flora, proinflammatory cytokines and idiopathic infertility in women undergoing IVF. The Journal of Reproductive Medicine. 46 (9), 806-810 (2001).
- Ralph, S. G., Rutherford, A. J., Wilson, J. D. Influence of bacterial vaginosis on conception and miscarriage in the first trimester: cohort study. BMJ. 319 (7204), 220-223 (1999).
- Holst, E., Goffeng, A. R., Andersch, B. Bacterial vaginosis and vaginal microorganisms in idiopathic premature labor and association with pregnancy outcome. Journal of Clinical Microbiology. 32 (1), 176-186 (1994).
- DiGiulio, D. B., et al. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One. 3 (8), 3056(2008).
- Svare, J. A., Schmidt, H., Hansen, B. B., Lose, G. Bacterial vaginosis in a cohort of Danish pregnant women: Prevalence and relationship with preterm delivery, low birthweight and perinatal infections. British Journal of Obstetrics and Gynaecology. 113 (12), 1419-1425 (2006).
- Ádám, A., et al. Culture- and PCR-based detection of BV associated microbiological profile of the removed IUDs and correlation with the time period of IUD in place and the presence of the symptoms of genital tract infection. Annals of Clinical Microbiology and Antimicrobials. 17 (1), 40(2018).
- Di Paola, M., et al. Characterization of cervico-vaginal microbiota in women developing persistent high-risk Human Papillomavirus infection. Scientific Reports. 7 (1), 10200(2017).
- Bullman, S., et al. Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer. Science. 358 (6369), 1443-1448 (2017).
- Brennan, C. A., Garrett, W. S. Gut microbiota, inflammation, and colorectal cancer. Annual Review of Microbiology. 70, 395-411 (2016).
- Hill, G. B. Preterm birth: associations with genital and possibly oral microflora. Annals of Periodontology. 3 (1), 222-232 (1998).
- Hitti, J., et al. Vaginal indicators of amniotic fluid infection in preterm labor. Obstetrics & Gynecology. 97 (2), 211-219 (2001).
- DiGiulio, D. B. Diversity of microbes in amniotic fluid. Seminars in Fetal and Neonatal. 17 (1), 2-11 (2012).
- Patras, K. A., Doran, K. S. A murine model of Group B Streptococcus vaginal colonization. Journal of Visualized Experiments: JoVE. (117), e54708(2016).
- Jerse, A. E., et al. Estradiol-treated female mice as surrogate hosts for Neisseria gonorrhoeae genital tract infections. Frontiers in Microbiology. 2, 107(2011).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539(2013).
- Gilbert, N. M., et al. Gardnerella vaginalis and Prevotella bivia trigger distinct and overlapping phenotypes in a mouse model of bacterial vaginosis. The Journal of Infectious Diseases. 220 (7), 1099-1108 (2019).
- Agarwal, K., et al. Glycan cross-feeding supports mutualism between Fusobacterium and the vaginal microbiota. PLOS Biology. 18 (8), 3000788(2020).
- Liehr, J. G. Is estradiol a genotoxic mutagenic carcinogen. Endocrine Reviews. 21 (1), 40-54 (2000).
- Yager, J. D., Davidson, N. E. Estrogen carcinogenesis in breast cancer. The New England Journal of Medicine. 354 (3), 270-282 (2006).
- Adeel, M., Song, X., Wang, Y., Francis, D., Yang, Y. Environmental impact of estrogens on human, animal and plant life: A critical review. Environment International. 99, 107-119 (2017).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Journal of Applied Microbiology. 17 (2), 250-251 (1969).
- Lewis, W. G., Robinson, L. S., Gilbert, N. M., Perry, J. C., Lewis, A. L. Degradation, foraging, and depletion of mucus sialoglycans by the vagina-adapted Actinobacterium Gardnerella vaginalis. Journal of Biological Chemistry. 288 (17), 12067-12079 (2013).
- Robinson, L. S., et al. Genome sequences of 15 Gardnerella vaginalis strains isolated from the vaginas of women with and without bacterial vaginosis. Genome Announcements. 4 (5), 00879(2016).
- Adapted from "mouse posterior turn" by BioRender.com. BioRender.com. , Available from: https://app.biorender.com/biorender-templates (2022).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments: JoVE. (67), e2771(2012).
- Verollet, R. A major step towards efficient sample preparation with bead-beating. Biotechniques. 44 (6), 832-833 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved