Method Article
使用正电子发射断层扫描对实验性自身免疫性脑脊髓炎小鼠模型中的 CD19+ B 细胞进行成像
摘要
本文详细介绍了放射性标记人类特异性抗CD19单克隆抗体的方法,以及如何使用 体内 PET成像、 离体 伽马计数和放射自显影方法对多发性硬化症小鼠模型的中枢神经系统和外周组织中的B细胞进行定量。
摘要
多发性硬化症 (MS) 是影响年轻人的最常见的脱髓鞘中枢神经系统 (CNS) 疾病,随着疾病的进展,通常会导致神经功能缺损和残疾。B淋巴细胞在MS病理学中起着复杂而关键的作用,是临床试验中几种疗法的靶标。目前,尚无办法准确选择患者进行特异性抗B细胞治疗,也无法无创量化这些治疗对中枢神经系统和外周器官B细胞负荷的影响。正电子发射断层扫描 (PET) 成像具有巨大的潜力,可以提供有关活体受试者体内 B 细胞的 时 空分布和负荷的高度特异性定量信息。
本文报道了在成熟的 B 细胞驱动的 MS 小鼠模型(实验性自身免疫性脑脊髓炎 (EAE))中合成和使用对人 CD19+ B 细胞具有特异性的 PET 示踪剂的方法,该模型由人重组髓鞘少突胶质细胞糖蛋白 1-125 诱导。这里介绍的是使用体内PET成像检测和量化大脑和脊髓中CD19 + B细胞的优化技术。此外,本文还报道了疾病相关器官(包括骨髓、脊髓和脾脏)离体伽马计数的简化方法,以及中枢神经系统组织中 CD19 示踪剂结合的高分辨率放射自显影。
引言
多发性硬化症是一种免疫介导的神经系统疾病;每位患者的独特表现可能使患者和临床医生的管理都具有挑战性1.该疾病本身的特征是大脑和脊髓中存在脱髓鞘病变和免疫细胞浸润,导致身体和认知障碍2。多发性硬化症是一种 T 细胞介导的疾病的传统范式在利妥昔单抗 3 的具有里程碑意义的 II 期临床试验中首次受到挑战,利妥昔单抗3 是一种靶向 B 细胞 CD20+ 亚群的疗法。此后,已经开发了针对 CD19 4 的其他 B 细胞疗法,CD194 是一种泛 B 细胞生物标志物,可在更广泛的 B 细胞上表达,这在诊断和治疗上都具有优势。此外,现有的评估治疗效果的方法(即监测复发次数和磁共振成像 [MRI] 活动)无法提供早期反应测量,因此由于治疗选择和优化欠佳,患者面临中枢神经系统损伤的重大风险。因此,迫切需要实时监测多发性硬化症患者中枢神经系统和外周环境中的特定免疫细胞(如CD19 + B细胞)的策略。
PET 成像是一种强大的成像技术,允许对给定的目标靶标(如 CD19)进行 体内 全身可视化。虽然抽血、复发率记录和 通过 MRI 监测病变提供了治疗效果的快照,但 PET 成像可以让研究人员和临床医生监测整个身体的治疗效果。这种主动的治疗监测方法使临床医生能够实时评估药物的有效性,从而能够根据需要进行快速调整。监测与疾病相关的细胞群的位置和密度还允许使用患者特定的解剖学信息对严重程度进行纵向评估。因此,必须建立可重复的分析方法,以便在临床和临床前环境中可靠地利用PET成像的全部潜力。
本文描述了使用64个Cu标记的抗人CD19单克隆抗体(mAb),称为16C4-TM(64Cu-hCD19-mAb)对CD19 + B细胞进行PET成像、离体伽马计数和放射自显影(ARG)的方法(图1),在表达人CD19(hCD19)的转基因小鼠中,使用人重组髓鞘少突胶质细胞糖蛋白1-125(MOG1-125)诱导的MS的实验性自身免疫性脑脊髓炎(EAE)小鼠模型中).我们还提供了准确和可重复地评估大脑和脊髓中放射性示踪剂结合的方法,这两个发病机制的关键部位经常受到该模型和其他神经退行性模型的严重影响。这些技术可以对B细胞在疾病病理学中的作用进行非侵入性研究,并有可能在临床上转化为评估抗B细胞疗法在MS中的疗效。
研究方案
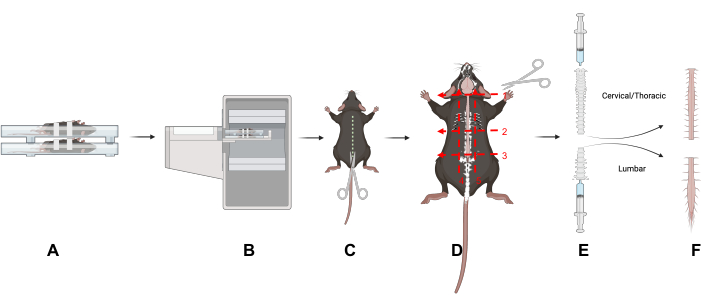
图1:研究设计。 本文中的关键技术概述。(A)将小鼠仰卧在扫描床上可减少脊柱的运动。(B)小鼠的PET/CT成像。(C) 在动物的背侧做一个切口,露出脊柱。(D) 将脊柱一分为二,分为颈椎/胸椎和腰椎部分,并移除五个指示切口之后的部分。(E) 如图所示,使用注射器将脊髓从脊柱中取出,方法是用注射器和脊柱进行密封,并从脊柱的颅端和尾端冲洗。(F) 孤立的颈椎/胸椎和腰椎脊髓节段。缩写:PET/CT=正电子发射断层扫描/计算机断层扫描。 请点击这里查看此图的较大版本.
所有动物研究均根据斯坦福大学实验动物护理管理小组 (APLAC) 进行,该计划由实验动物护理评估和认证协会 (AAALAC International) 认可。在研究开始前,小鼠在动物饲养室中适应至少7天,以尽量减少对小鼠的压力,因为压力会影响EAE诱导。
1. 雌性人源化CD19小鼠的EAE诱导
- 如前所述,使用MOG1-125诱导9-13周龄的人源化CD19 C57BL / 6J雌性小鼠的EAE。
2. EAE小鼠模型中的动物护理和评分
- 如前所述对疾病进展和小鼠护理进行评分5.简而言之,以 1-5 的等级对该模型进行评分如下:1 是尾部无力/跛行,2 是后肢无力,3 是后肢麻痹,4 是后肢瘫痪伴前肢无力,5 是垂死。
3. 单克隆抗体偶联、放射性标记和表征
- 将双功能螯合剂 1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸单-N-羟基琥珀酰亚胺酯 (DOTA-NHS-酯) 与 hCD19-mAb 偶联,用 64Cu 进行放射性标记。
- 使用脱盐柱,将hCD19-mAb储存缓冲液与HEPES缓冲液(pH 8.5-9)交换:用HEPES调节脱盐柱。根据脱盐柱样品体积和所需mAb体积计算所需柱数:0.5 mL 试管:30-130 μL 样品体积,300 μL 洗涤;2 mL 试管:200-700 μL 样品体积,1 mL 洗涤液。
- 将离心机冷却至4°C, 以便通过 脱盐柱进行缓冲液交换。
- 从冰箱中取出脱盐柱。取下脱盐柱底部,松开盖子,将柱子放入收集管中。
- 以1,500× g 离心2分钟以除去储存溶液;丢弃含有储存溶液的流出物并重复使用收集管。在色谱柱上标记一条线,使脱盐压实树脂的最高点向上倾斜。
- 将HEPES缓冲液添加到脱盐柱的下侧。将脱盐柱放入离心机中,管线朝外;以 1,500 × g 旋转 2 分钟。丢弃流出物并重复使用收集管。
- 重复步骤3.1.4和3.1.5 2x,使用相同的收集管,并在步骤之间丢弃流出物。
- 将调节的脱盐柱放入新的收集管中并贴上标签;该试管将包含 hCD19-mAb。
- 将hCD19-mAb加入条件脱盐柱的顶部,并使用HEPES缓冲液冲洗空的mAb小瓶;将其添加到脱盐塔的顶部(根据制造商的建议的总体积)。以 1,500 × g 离心 2 分钟以洗脱 hCD19-mAb。保持含有 hCD19-mAb 的流出液。
- 使用紫外/可见分光光度计测量hCD19-mAb的浓度,必要时用HEPES缓冲液调节至0.5μg/μL。
- 向hCD19-mAb溶液中加入1/50体积 的0.5 M EDTA,使EDTA在hCD19-mAb溶液中的终浓度为0.01 M。让hCD19-mAb-EDTA溶液在室温下静置15分钟。
- 从冰箱中取出DOTA-NHS-酯,使其达到室温(10-15分钟)。计算要添加到DOTA-NHS-酯中的DMSO的体积,以使DOTA浓度允许添加所需的DOTA / mAb摩尔比(通常为1-2 DOTA / mAb的量级)。
注意:添加到 hCD19-mAb 中的 DMSO-DOTA-NHS-酯的体积不应超过 mAb 体积的 10%。这应该使用电子表格来完成,以便可以快速、重复地完成。 - 根据 DOTA 与 hCD19-mAb 的所需比例,计算要添加到 hCD19-mAb 中的 DOTA-NHS-酯的量。
nmol mAb × 10 DOTA/mAb → nmol DOTA → mg DOTA → mg/mL DOTA/DMSO → mL DMSO → DOTA/DMSO 溶液的稀释倍数 - 称取1-2mg的DOTA-NHS-酯,并小心地将正确体积的DMSO(在步骤3.1.11中计算)加入DOTA-NHS-酯中;混合并旋转。
- 将计算体积的DOTA-NHS-酯溶液(步骤3.1.12)移液到hCD19-mAb溶液中;添加前擦拭移液器吸头的外部,以确保不添加额外的DOTA-NHS-酯(不改变移液器中的量)。轻轻混合并旋转。
- 放入冰箱(4°C)反应过夜(12-16小时)。
- 纯化和浓缩
- 将离心机冷却至4°C,用于离心浓缩器缓冲液交换步骤;将金属PCR管块放在干冰上,以快速冷冻偶联物。
- 从冰箱中取出 DOTA-hCD19-mAb 反应,加入生物级 TRIS 缓冲液(占总反应体积的 10%)进行淬灭。取出10-20μg样品进行质谱分析。
- 如上所述(步骤3.1.1-3.1.5)使用0.1M醋酸铵缓冲液(pH 5.5)调节脱盐柱。
- 将DOTA-hCD19-mAb溶液缓冲液交换为乙酸铵(步骤3.1.1-3.1.8)。
- 浓缩 DOTA-hCD19-mAb 溶液:按照制造商关于体积的建议,将溶液添加到 50 kDa 截留分子量离心浓缩器中。以4,000× g 离心10分钟(或直到体积减少80%-90%);丢弃流出物。
- 再重复 9 次(总共 10 次):加入足够的醋酸铵,使体积恢复到最大推荐体积。
注:总量应为最初添加的量,包括色谱柱中剩余的量,对于容量为 500 μL 的离心浓缩器,通常为 400-450 μL。- 用醋酸铵缓冲液冲洗反应瓶以取回任何残留的DOTA-hCD19-mAb;将洗涤液加入离心浓缩器中。
- 以4,000× g 离心10分钟。
注意: 如果在更短的时间内将音量降低到 80%-90%,则后续旋转的旋转时间可能会减少。
- 从离心浓缩器中取出蛋白质溶液。注意 DOTA-hCD19-mAb 的总体积。
- 在离心浓缩器2中,加入足够的醋酸铵缓冲液,总体积为100μL,然后用移液管混合。盖上离心浓缩柱并倒置。以4,000 × g 旋转2分钟以收集溶液。转移到新管中。
- 在离心浓缩器500中,使用移液器从离心浓缩器中收集mAb溶液;添加到新管中。
- 使用紫外-可见分光光度计测量浓度。如果浓度超过 2 mg/mL,则用醋酸铵稀释至 2 mg/mL。
- 每个PCR管分装100μg(约50μL);用DOTA-hCD19-mAb、日期、质量和浓度标记试管。旋转小瓶。
- 将DOTA-hCD19-mAb在冷藏的PCR模块上用干冰(或在干冰上冷冻)快速冷冻。冷冻所有样品后,将它们放入-80°C冰箱中。
- 通过质谱法测量每个 hCD19-mAb 的 DOTA 数量。保留来自每个偶联物的非偶联(纯)抗体样品以计算比率。使用下面给出的公式(1);分子量缩写为MW。
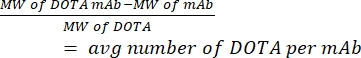 (一)
(一)
- 放射性标记
注意:按照机构规定,穿戴适当的个人防护设备 (PPE) 来处理放射性,包括实验室外套、手套以及个人身体和环形剂量计。定期检查和更换手套,以防止放射性污染。使用铅屏蔽,并尽可能用钳子处理,增加与放射源的距离。- 使用移液管将放射性从运输小瓶转移到新小瓶中。测量放射性。
- 取出第一个放射性标记反应的等分试样。每 1 mCi 的 64Cu-CuCl3 加入 50 μL 乙酸铵 (pH 5.5)。通过将 1 μL 移液到 pH 条上来测量 pH 值,其范围捕获 5.5,分辨率足以区分 5 和 6。
- 如果 pH 值不是 4-5.5,则使用 1 M NaOH 或 0.1 M HCl 进行更改。 如果 pH 值低于 4,则加入少量 1 M NaOH,如果 pH 值大于 5.5,则加入 0.1 M HCl,直到达到正确的 pH 值。每次添加时,充分混合,向下旋转,并如上所述测量pH值。注意每次添加和去除任何溶液(包括检查pH值),以便计算最终体积。
- 达到最佳pH值后,每1 mCi的 64Cu-CuCl3加入10 μg DOTA-hCD19-mAb。轻轻混合并短暂旋转。
- 将反应瓶放在设置为37°C和每分钟400转(rpm)的热混合器上。
- 30分钟后,淬灭反应:将总反应体积除以50,并将0.5M EDTA的体积加入反应混合物中。
- 使用瞬时薄层色谱 (ITLC) 测定溶液中结合铜和游离铜的百分比,以确定标记效率。
- 剪下 1 厘米宽的 TLC 纸条。在距试纸条顶部和底部 1 cm 处标记,并制备一个试管(50 mL 锥形瓶),流动相中含有少于 1 cm 的 0.1 M 柠檬酸(放入试管时,流动相的水平应低于试纸上 1 cm 标记)。
- 吸取 1 μL 反应溶液在底部 1 cm 标记(溶剂前)的试纸上,并将试纸放入试管中。观察直到溶剂前沿达到顶部 1 厘米标记,取下条带,然后用一块保鲜膜包裹。
- 将试纸放在平台上,然后通过无线电TLC成像扫描仪运行。在源位置寻找放射性标记的mAb,并寻找随流动相前沿移动的游离 64Cu(图2)。如果游离铜的百分比小于5%(标记效率为95%),则继续注射到动物体内。如果游离铜的百分比大于5%,则进行纯化。
注:游离铜的百分比通常取决于 DOTA-mAb 与 64Cu 的比例、反应时间、pH 值和温度。每个用户应针对每种新mAb优化反应条件,以确保结果一致。
- 通过一次性 DNA 级重力柱进行纯化
- 根据制造商的说明对一次性 DNA 级重力流柱(脱盐/缓冲液置换柱)进行调节。将一次性 DNA 级重力柱放在环形支架或其他仪器上,在足够的铅屏蔽层后面;确保设备稳定且易于移动。将管子放在柱子下面。
- 将粗反应混合物移液到重力流柱树脂上。等到所有液体都流入树脂中。吸取足够的PBS,使整个体积(粗品加PBS)达到500μL。
- 将色谱柱放在标有 1-10 的 1.5 mL 离心管上。向色谱柱中加入 1 mL PBS。在每个试管中收集五滴,直到流动停止。
注意:可能需要少于 10 个试管。 - 盖上色谱柱底部并测量残留放射性。用流出量测量每个小瓶。对于每个超过50μCi的小瓶,每步3.3.7准备ITLC,以测量每个馏分中的结合铜的百分比。
注:前一或两组分仅含有流动相;放射性标记的 mAb 将首先洗脱(通常是馏分 2 或 3 到 5 或 6),游离的 64Cu 将最后洗脱(有些会粘附在色谱柱上)。结合的 64Cu 百分比可能因馏分而异。 - 结合率大于 95%(游离铜含量小于 5%)的馏分;使用溶液进行注射。如果需要,进行尺寸排阻HPLC以确认放射性标记5 并计算摩尔活度。保存等分试样以在紫外-可见分光光度计衰减 10 个半衰期(127 小时或 5.3 天)后测量浓度。
4.剂量准备
注意:在处理剂量之前,请穿戴适当的个人防护装备,包括实验室外套、身体和手指剂量计以及手套。
- 在PET扫描前18-24小时注射 64Cu-DOTA-hCD19-mAb,以使放射性示踪剂在体内充分循环。
- 立即将装有 64Cu-DOTA-hCD19-mAb 的铅容器放在铅屏蔽层后面。打开盖革计数器以监测潜在的污染。
注意: 处理放射性物质时要经常更换手套。建议在抽取剂量时戴上双层手套,以方便快速更换手套。始终将受污染的锐器和垃圾放在指定的屏蔽垃圾区域。 - 在低结合的 1.5 mL 塑料离心管中将 64Cu-DOTA-hCD19-mAb 稀释至适当浓度。
注意: 如果 64Cu-DOTA-hCD19-mAb 结合力不低,则会与塑料结合; 64Cu 将与玻璃结合。- 在生理盐水中稀释放射性示踪剂,以防止放射性溶解并简化一致剂量的提取。
- 如果可能,准备在 100 μL 中给予 75 至 150 μCi 的剂量。确保最大总注射量不超过小鼠体重的 10%。
- 使用 500 μL (50 cc) 胰岛素注射器从低结合塑料管中吸取剂量。确保注射器中没有气泡,因为它将静脉注射。
- 用相应的动物编号预先标记注射器。
- 在实验室笔记本中记录剂量活性和时间以进行数据分析。
- 一旦动物被导管插入,就准备好注射剂量,以减少麻醉时间。
- 制备剂量后,准备一个标准品(模型)进行扫描以生成校准因子。
- 用水(或 PBS)稀释的 50-75 μCi 活性填充 15 mL 锥形管。
注意:确保溶液充分混合。该标准品可以游离标签剩余的 64铜。- 测量标准中的活动量并记录时间。
- 用水(或 PBS)稀释的 50-75 μCi 活性填充 15 mL 锥形管。
5. 插管和注射
注:参见前面描述的方法6,用于静脉插管注射放射性示踪剂6的小鼠。
- 如第2.1节所述,在装有1.5-3%异氟烷的敲低盒中麻醉小鼠以准备放射性示踪剂给药之前,称重并评分小鼠的疾病严重程度。
注意:这些小鼠将被注射到工作台上,而不是如前所述的PET扫描仪上。无需将导管粘在注射部位,因为小鼠不会在插管和注射之间移动。 - 插管小鼠后,将针头插入导管末端并缓慢注射。注射后,用小盐水冲洗导管,以确保注射整个剂量。
注:体积应大致等于导管的死体积,作者使用的导管为 50 μL。- 注射一块实验室擦拭布以收集任何放射性示踪剂的滴落;在测量残余剂量时包括这一点。
- 在实验室笔记本中记录注射时间。
- 注射后立即取出套管。使用剂量校准器测量套管,剂量注射器和组织,以确定未注射到小鼠中的残留剂量。
- 在实验室笔记本中记录活动和时间。
- 注射小鼠后,用笼子卡标记它们的笼子,表明小鼠具有放射性。根据机构准则记录和记录笼子。然后,将小鼠置于指定的放射性保持区域。
6. PET/CT成像
- 注射 64Cu-DOTA-hCD19-mAb后18-24小时进行PET成像。在扫描之前对小鼠进行称重和评分。
注意: 扫描仪操作说明取决于所使用的扫描仪。- 确保 PET/CT 扫描仪的 X 射线组件已预热并准备好采集。
- 在计算机上打开PET扫描仪采集软件。
- 从 "研究者登录 "下拉菜单中,单击相应的实验室信息。
- 在"项目"页面上,创建新项目或从下拉菜单中选择现有项目。
- 当屏幕上自动出现初始化提示时,单击"Home Bed"并等待"Home"到家。然后,单击预热 CT。
- 确保 CT 屏蔽门已关闭,以使 CT 预热。
- 当扫描仪预热时,对EAE小鼠进行评分,并在侧腹皮下注射0.2-0.4mL温盐水以补水。
- 扫描仪预热后,返回计算机设置研究的 PET 扫描。
注意:这些可以在扫描日之前进行设置。- 在" 最近的 研究"标题下,单击 "创建新研究"。填写 研究名称、 方案、 化合物和 受试者信息。
- 如果进行 PET/CT,请先选择 PET 方案,然后选择 CT 方案。
注意:通常,标准CT足以扫描EAE小鼠模型。CT 扫描时间为 1 分钟,在电压 80 kVp、电流 150 μA 和 720 个投影下以 2 x 2 像素合并采集。使用改进的 Feldkamp 算法重建 CT 图像。 - 对于 PET 实验方案,请选择 10-15 分钟的静态 64 铜扫描。如果此扫描尚未在可用协议列表中,请单击"标准"菜单中的"协议"选项卡"创建新协议"|"同位素下拉菜单。如果未列出所需的同位素,请单击"更多"|"从库中添加并添加所需的同位素。定义扫描持续时间,单击静态扫描的单选按钮,命名协议,然后单击保存。
- 返回 "研究 "选项卡,继续命名和设置当天所需的所有扫描。
注意:建议仅使用标准 CT 设置一次"CT 测试"扫描,以检查第一次扫描的床位置,以确保最佳位置。这应该是研究的第一次扫描运行。
- 如果进行 PET/CT,请先选择 PET 方案,然后选择 CT 方案。
- 在" 最近的 研究"标题下,单击 "创建新研究"。填写 研究名称、 方案、 化合物和 受试者信息。
- 扫描仪准备就绪后,在敲低盒中麻醉小鼠,为扫描做好准备。
注意:在这个阶段,小鼠可能病得很重;最佳做法是尽量减少麻醉时间。- 涂抹眼部凝胶。
- 确保四鼠标扫描床配备加热元件,例如加热垫或加热空气,异氟烷设置为 1.5%-2% 并打开加热垫(图 3)。将小鼠仰卧在扫描床上。
- 随着EAE疾病的进展,小鼠的脊柱变得严重弯曲。在小鼠仰卧时对其进行扫描,以尽可能地拉直脊柱,从而改善下游分析。轻轻拉动鼠标尾巴以帮助拉直脊柱。
- 一旦处于仰卧位,用柔软的显微镜胶带将每只鼠标牢固地固定到位。用一条胶带在头上,另一条轻轻地放在腹部,以尽量减少呼吸引起的运动。
- 在实验室笔记本中记录哪只鼠标处于哪个扫描位置。
- 固定鼠标后,返回扫描计算机操作扫描仪。
- 打开 "运动控制器 "菜单。单击 PET中心FOV ,将扫描床上的小鼠移动到PET环中。对于当天的第一次扫描,请单击 CT Center FOV。就位后,运行 CT 测试扫描以确保位置正确;重复上述步骤,直到床位令人满意为止。
- 在扫描床上放置一小块白色胶带,以标记研究剩余部分的正确床位置。
- 一旦床就位以进行 PET 扫描,单击" 运行"启动扫描序列。
- 等待扫描仪自动从 PET 环移动到 CT。
- 始终目视检查动物是否已移动到PET和CT的正确位置。
- 在实验室笔记本中记录扫描开始时间,以便在数据分析期间对注射剂量进行衰减校正。
- 扫描完成后,允许图像重建。在移除动物之前检查数据。
注意:静态扫描的 3D 有序子集期望最大化 (OSEM) 重建大约需要 5 分钟。 - 目视检查并批准数据,使用脾脏作为阳性对照,因为该组织含有大量 B 细胞。将动物从扫描床上取出,并将它们放入充满异氟醚的敲低盒中,以准备灌注和随后的解剖。
- 对研究中剩余的小鼠重复步骤6.5-6.12。
- 当扫描所有小鼠或扫描扫描床中具有开放位置的组时,扫描步骤4.6中制备的标准品。
7. 体 外伽马计数和放射自显影的解剖
- 在解剖之前,确保所有伽马计数和离心管都已预先称重。
- 如前所述,通过灌注进行安乐死,如前所述,用PBS和开胸术进行安乐死,同时深度麻醉小鼠(连续吸入4%异氟烷,2L / min 100%O2)。
- 要切除骨髓,请切开膝盖和骨盆处的股骨。确保两个头都从股骨上移开。
- 将两个股骨放入底部有一个孔的 0.5 mL 离心管中(使用 20 G 针头)并切掉盖子。
- 将含有股骨的 0.5 mL 管放入 1.5 mL 离心管中,盖子被切断。
- 将整个试管装置放入微型离心机中。以 4,500 × g 旋转 4 分钟。
注意:骨髓应通过 0.5 mL 离心管中的孔移出并沉淀在 1.5 mL 离心管的底部。- 将试管分开。称量0.5mL离心管中的空股骨。称量 1.5 mL 离心管中的骨髓。将每个离心管放入伽马计数管中。
- 使用镊子和剪刀切除大脑,注意保持脑干完整。将大脑放入伽马计数管中。记录干重,用PBS冲洗,并保持在冰上,直到准备好计数。
- 要切除脊髓,请执行以下步骤。
- 通过在动物的背侧切开一个切口来去除皮肤和毛发,露出脊柱(图1)。
- 通过沿着脊柱周围的三个横向平面切割,将腰椎(L)与颈椎(C)和胸部区域分开:在颈部底部(C1椎骨)(图1D,数字1);在胸腔底部(L1椎骨)(图1D,编号2);在骨盆底部(L5椎骨)(图1D,数字3)。
- 在肋骨下切开(图1D,编号2)。
- 直接切开骶骨上方,将腰椎区域分开。小心地从骨盆端修剪脊柱,直到腰椎脊髓可见(图1D,编号3)。修剪周围组织以隔离脊柱的腰椎和颈椎/胸部区域(图1D,数字4和5)。
- 要排出脊髓,请使用装有 PBS 的滑尖注射器 (3-10 mL)。使用拇指和食指在注射器和脊柱之间形成密封。
- 轻轻地将PBS推过注射器,将脊髓排出到吸收垫上(图1E);对两个脊柱区域重复上述步骤。将脊髓组织放入伽马计数管中。
- 记录干重,并加入PBS,确保组织在管底部,以免干燥。将试管放在冰上,直到准备好计数。
- 将颈椎/胸脊髓从颅端排出,将腰椎脊髓从脊柱尾端排出(图1E)。
8. 离体 伽马计数
- 打开伽玛计数器软件。导航到工作列表并选择所需的协议,例如 64Cu 的 30 秒计数协议。
- 在单独的试管中制备至少三种标准品。立即运行它们以用于分析(步骤 10.2)。目标是在三个单独的试管中进行三次重复体积和活性量。
注:500 μL 的体积可获得良好的结果。虽然活性将由所使用的机器决定,但 10 μCi 通常效果良好。 - 将标准品放在标有与所需运行协议相对应的条形码的架子中。将机架放在伽马计数器上。
- 记录器官重量后,将含有器官的试管放在含有标准品的试管之后的伽马计数架上。
注意:该模型感兴趣的器官可以包括轴向淋巴结、血液、骨髓、大脑、颈部淋巴结、股骨、心脏、肝脏、腰椎脊髓、肌肉、脾脏、尾部和颈/胸脊髓。 - 在伽马计数器的背面放置一个带有停止条形码的架子。
- 按计算机上的 "播放 "按钮。如果可能,在有多个管架或器官要运行之前,不要按 播放 ,以允许在一个文件中连续计数所有试管。确保每次运行时,伽马计数器的背面都有一个带有停止条形码的机架。
- 运行,直到所有样本都计数完毕。保存并导出文件。
9. 中枢神经系统组织的 离体 放射自显影(ARG)
- 遵循先前发表的脑和脊髓ARG步骤(同时排除Chaney等人描述的步骤2-6,因为小鼠已经从PET扫描中注射了放射性示踪剂)6。
注意: 此处列出了准备脊髓 ARG 盒的具体说明6. - 在完成腰椎和颈椎/胸椎脊髓的伽马计数后,立即将管子放在冰上,直到所有中枢神经系统组织都计数完毕。
注意:请参阅先前发表的大脑 ARG方法 6. - 轻轻地倾斜管子,让脊髓掉到吸收垫上。如果脊髓粘在管子的一侧,用冷PBS轻轻冲洗,然后再次倾斜管子。用实验室组织轻轻吸干每条脊髓,小心地擦干每条脊髓。将干燥的脊髓有组织地放在一张厚厚的黑纸上。
- 用白色笔在脊髓旁边贴上标签,以便于识别。
- 在黑纸的角落和中间留出空间,放置一堆三张显微镜载玻片,作为垫片,以防止ARG盒关闭时脊髓受压。使用 5-7 个堆栈。
- 一旦所有腰椎和颈椎/胸椎脊髓都位于黑纸上并贴上标签,小心地将这张纸放入 ARG 盒中。将打开的盒放在干冰托盘上以冷冻脊髓。
- 冷冻后,轻轻地将保鲜膜放在数字荧光粉存储屏幕和脊髓之间,然后将屏幕放在样品顶部。立即关闭盒并将其置于-20°C冰箱中约10个半衰期(~127小时)。
- 曝光时间结束后,使用荧光体成像仪扫描胶片。分析生成的数字图像(有关说明,请参阅第 12 节)。
10. 生物分布数据分析
- 设置一个"剂量校正"电子表格,以数学方式确定放射性衰变的时间校正,从而使辐射剂量标准化并允许受试者之间的比较。
- 根据注射时间对所有剂量进行衰减校正,考虑注射后留在注射器和导管中的残留活性。
- 使用步骤8.2中制备的标准品,平均活性量(μCi)和每分钟标准化计数(CPM)。将平均 CPM 除以平均标准活性量,得到 CPM/μCi。
注意:确保每个标准品的活度量经过衰减校正,直到伽马计数器计算标准品的 CPM 时。gamma 计数器应将所有 CPM 值规范化为协议的开始时间。
- 设置"结果"电子表格,计算每个样本每克组织的最终注射剂量百分比 (%ID/g)。
- 将每个样品的伽马计数器的归一化CPM衰减校正到动物的注射时间。
注意:衰减校正可以是任何时间点;确保所有剂量和 CPM 值都衰减校正到同一时间点。 - 将衰减校正后的 CPM 归一化为每个样品的质量,以确定每个样品的 CPM。通过从计算出的注入的 CPM 中减去尾部的 CPM 来计算注入的总 CPM。
注意:尾部不需要进行质量校正,因为该 CPM 值将简单地从总注射的 CPM 中减去,以考虑注射产生的任何静脉外示踪剂。 - 将每质量的 CPM 除以进样的总 CPM,以计算 %ID/g。
- 将每个样品的伽马计数器的归一化CPM衰减校正到动物的注射时间。
- 设置"摘要"电子表格以显示最终结果,以便输入到绘图软件中,以及随后的数据可视化和统计分析。
11. PET图像分析
- 打开 PET 分析软件。舔 文件|开放本地数据 |DICOM的。找到所需的文件(DICOM 格式)。打开 PET 和 CT。
- 在 数据管理器中,将 PET 和 CT 对比度 调整到所需的水平。
- 注册并裁剪单个小鼠。
- 在" 导航 "菜单中,选择" 重新定向/注册 "选项卡。
- 转到此选项卡中的 "刚性 "菜单。将 CT 扫描 (0 ) 指定为 固定 扫描,将 PET 扫描 (1) 指定为 移动 扫描。
- 选择 刚性 转换和 快速 质量。点击 注册。
- 注册完成后(5-10 分钟),单击 复选 标记以保存注册。
- 目视检查数据以确保注册成功。通过单击 "文件"|"会议 |导出。
- 接下来,在全身裁剪中裁剪每只鼠标:转到 "导航 "菜单,然后单击" 裁剪"。将每个横截面的边从外边缘向内拖动。
- 将所需的鼠标紧密裁剪后,单击 复选 标记,然后导出会话以保存。
- 接下来,使用"注册/重新定向"菜单中的手动平移、旋转和翻转裁剪并拉直每只鼠标的头部以进行大脑分析。导出以保存。
- 分析脊髓。
- 要开始分析脊髓中的感兴趣区域 (ROI),请从导航菜单中打开 3D ROI 工具。
- 在 ROI 标题下,使用菜单底部的加号创建六个 ROI:腰椎 ROI、颈椎/胸椎 ROI、腰椎骨骼、胸骨骼、腰椎脊髓、胸脊髓。
注意:腰椎和颈椎/胸部 ROI 是广义的大 ROI,将用于创建骨骼 ROI(图 4)。 - 为避免此步骤中 PET 信号的视觉干扰,请单击 F3 关闭 PET。
- 转到 3D ROI 工具运算符的顶部。单击光标符号右侧的 实心点 以打开 3D 绘画模式和侵蚀/扩张 菜单。
- 选择 "球体 "并将 大小 更改为 20 像素。将 Dilate 设置为 +5。
- 在继续之前,请转到 菜单底部。确保选择 腰椎 ROI,因为这是要绘制的第一个 ROI。
- 在 CT 上,找到脊柱的 L6 椎骨(脊柱与臀部相交的地方)。从 L6 上方的一个椎骨开始,在臀部上方的五个椎骨(L1-L5 椎骨)上画一个粗略的 ROI 腰椎 ROI 。然后,切换到 颈椎/胸椎 ROI ,并将脊柱的其余部分追踪到颅底。
注意:这不必精确,因为它用于指示步骤 11.4.8 中应发生 Otsu 阈值的位置。 - 绘制广义 ROI 后,转到 运算符的顶部。选择" 分段算法 "菜单。
- 从下拉菜单中,选择 Otsu Thresholding。对于输入,选择 Lumbar ROI。在菜单底部,确保选择了 腰椎骨骼 。在 图像旁边的下拉菜单中,确保选择了 CT 扫描 ,然后单击 应用。 对颈椎/胸椎 ROI 和 胸骨骼重复上述步骤。
- 如果 Otsu 阈值不能充分突出显示脊柱,请使用全局阈值并将最小值更改为 350,将最大值更改为 3,500 以进行手动阈值,并根据需要进行调整以隔离椎骨。
- 使用 Otsu Thresholding 创建骨架 ROI 后,返回导航菜单(光标图标)。删除粗略腰椎和颈椎/胸部 ROI 的 H(隐藏)列或选中以隐藏它们。选中两个骨架 ROI 的 I(不可变)列,使其无法编辑。
- 最后,返回到 3D ROI 工具操作员 的顶部,然后转到 3D Paint 菜单 以绘制 脊髓 ROI。
- 再次选择 "球体 "工具,追踪 腰椎 和 胸椎骨骼内的脊髓,确保在菜单底部选择正确的 ROI。
- 要 擦除 任何 ROI,请单击 Command/Control 并在要擦除的部件上绘制。
- 检查所有三个平面的脊髓 ROI,以确保没有在脊柱外绘制 ROI。
- 导出脊髓分析结果。
- 如果在步骤 11.4.3 中关闭了 PET 信号,请在绘制脊髓 ROI 后按 F3 重新打开 PET,或选择 视觉控制器 (VC) 并单击 PET 栏。
- 返回 导航 菜单(光标图标)。单击 网格 图标以 显示表格。将表格复制到电子表格软件中并保存。
- 最后,如上所述,在PET分析软件中导出文件,以保存绘制的投资回报率。
- 使用半自动 3D 图谱分析大脑。
- 打开头部裁剪文件。通过转到 "高级模块 "菜单并选择"3D 脑图谱工具"来导入小鼠 脑图谱。确保 参考 设置为 CT ,并且 裁剪 选项 未选中。 设置 输出目录的路径。
- 在 "高级设置"中,将" 变换 "更改为 "Versor-Affine"。保留所有其他默认设置。单击 "运行"。
- 在 "重新定向/配准 "菜单中手动调整图集,并使用颅骨 CT 作为拟合图集的指南。
- 如果需要缩放,请格外小心,因为这会极大地影响大脑结构体积。调整完成后单击 复选标记 。
- 在选中 导入 3D ROI 的情况下 重新运行图集。
- 导出文件以保存适合裁剪头部的图集。
- 从所需器官绘制并导出所有 ROI 后,计算标准结合校正值。如前所述,对所有数据进行衰减校正并转换为 %ID/g6.归一化为适合动物模型的器官,例如心脏,归一化为血池中存在的放射性示踪剂。
12. 离体 放射自显影分析
- 使用图像分析软件打开数字图像文件(.gel)。将 亮度 和 对比度 调整到所需的阈值。如果需要,应用合适的颜色 查找表 。
注意:为了便于可视化,建议使用皇家色或灰色色。
结果
hCD19-mAb 采用 DOTA 偶联并用 64Cu 进行放射性标记,如图 2 所示。EAE和幼稚小鼠在注射64Cu-DOTA-hCD19-mAb后18-24小时进行PET / CT扫描(图3)。使用 PET 分析软件共同配准 PET/CT 图像,并使用手动 ROI 或半自动 3D 脑图谱分析中枢神经系统组织。EAE小鼠的ROIs(图4)中的放射性示踪剂结合高于幼稚小鼠。与幼稚小鼠相比,离体伽马计数和ARG显示EAE小鼠在脊髓(腰椎和颈椎胸段)和大脑(仅ARG)中的结合增加(图5和图6)。灌注小鼠的离体γ计数也显示外周器官(包括脾脏,股骨和骨髓)中的放射性示踪剂结合减少(图5),这与该EAE模型中离开外周并浸润CNS的B细胞一致。
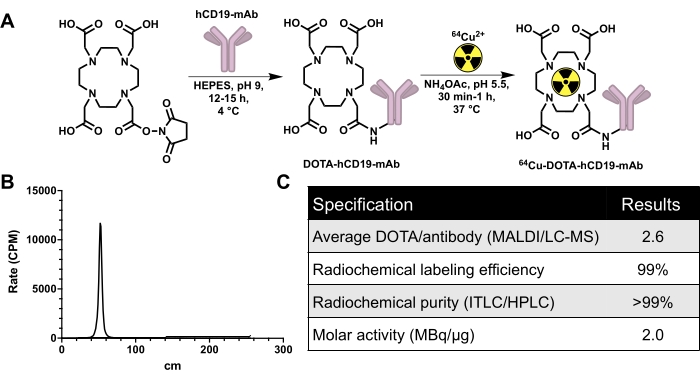
图 2:除质控数据外,用于生成 64 个 Cu 标记的人特异性 CD19 单克隆抗体 16C4-TM mAb (64 Cu-DOTA-hCD19-mAb) 的偶联和放射性标记方案。 (A) DOTA-NHS-酯与 hCD19 单克隆抗体反应生成 hCD19-DOTA 偶联物(不按比例),并与 64 Cu-CuCl3 进行放射性标记,生成 64Cu-DOTA-hCD19-mAb。(B) 具有代表性的ITLC色谱仪。40-60 cm 处的峰值为放射性标记抗体;未结合的 64Cu-CuCl3 随流动相移动,在 200 至 240 cm 范围内存在。该色谱仪中没有可检测到的游离 64Cu-CuCl3。(C)放射性标记抗体的质量控制规范。缩写:DOTA-NHS酯=1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸单-N-羟基琥珀酰亚胺酯;ITLC/HPLC=速溶薄层色谱法/高效液相色谱法;MALDI/LC-MS=基质辅助激光解吸/电离/液相色谱-质谱;CPM = 每分钟计数。请点击这里查看此图的较大版本.

图 3:照片演示了如何将小鼠固定在 PET 扫描仪内的 3D 打印床上,以实现脊髓和大脑的高质量成像,同时最大限度地减少运动 。 (A) 3D打印的四只鼠标扫描仪床(又称"老鼠酒店"),配有加热元件和麻醉管。(B)麻醉小鼠仰卧位,以最大限度地提高脊柱的挺直度;记录每只小鼠的床位。(C)将小鼠牢牢地贴在头上,以尽量减少大脑和腹部的运动,以尽量减少呼吸的运动,而不影响呼吸。(D) 鼠标床位于扫描仪内并用胶带粘在扫描床上。麻醉管从扫描仪连接到床上,异氟烷设置为2%。监测小鼠呼吸,以确保在关闭扫描仪门之前达到适当的异氟烷水平。缩写:PET=正电子发射断层扫描。 请点击这里查看此图的较大版本.
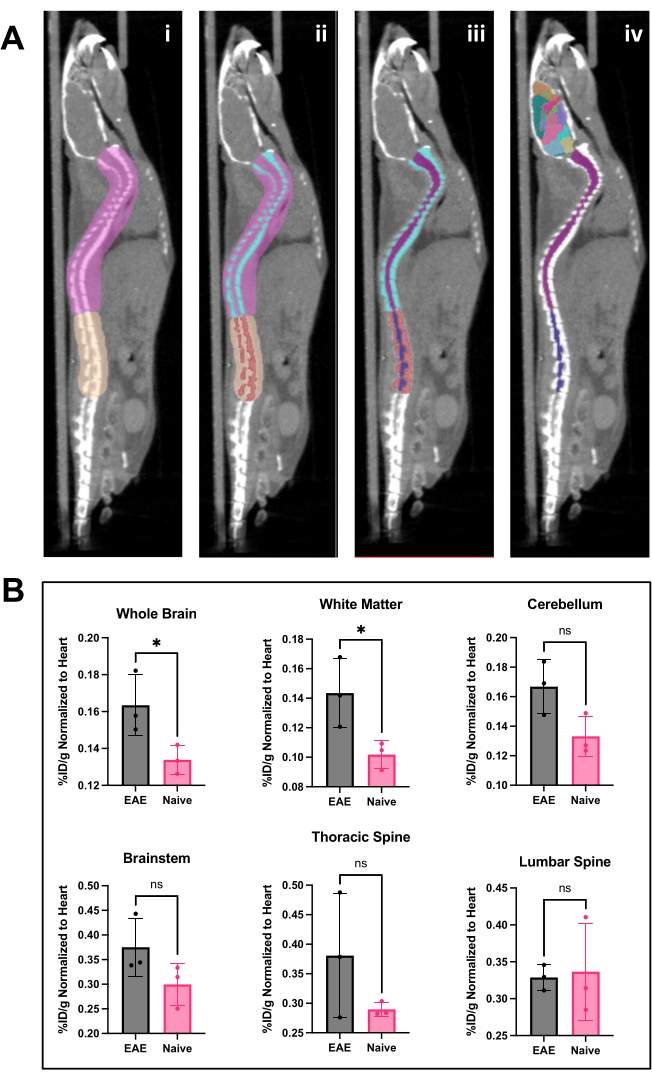
图 4:使用 PET 分析软件进行脊髓图像和大脑分析及结果 。 (A) i) 在脊柱上绘制的 ROI(粉红色和棕褐色),以将腰椎与胸椎和颈椎分开,并为 Otsu 阈值准备图像。 ii ) 脊椎骨(绿松石色和红色)使用 Otsu 阈值法分割出来。 iii ) 然后在 3D ROI 菜单中使椎骨不可变,脊髓分为颈椎/胸椎(紫色)和腰椎(海军蓝)ROI。 iv) 去除脊椎 ROI,留下脊髓 ROI 和代表性脑图谱。(B) 对来自各个 CNS 区域的 PET 结果进行代表性分析,表示为 %ID/g,归一化为每只动物心脏的 ROI。PET 采集 是通过 PET/ CT 成像进行 10 分钟的静态扫描。使用半自动脑图谱方法量化的大脑区域,如图 A 所示。 iv) 代表性结果显示大脑和胸脊髓中示踪剂结合显着或有显着增加的趋势。使用学生 t 检验 (*: p < 0.0332) 进行的统计。缩写:PET=正电子发射断层扫描;ROI = 感兴趣区域;CNS = 中枢神经系统;CT = 计算机断层扫描;%ID/g = 每克组织的注射剂量百分比;EAE = 实验性自身免疫性脑脊髓炎。 请点击这里查看此图的较大版本.
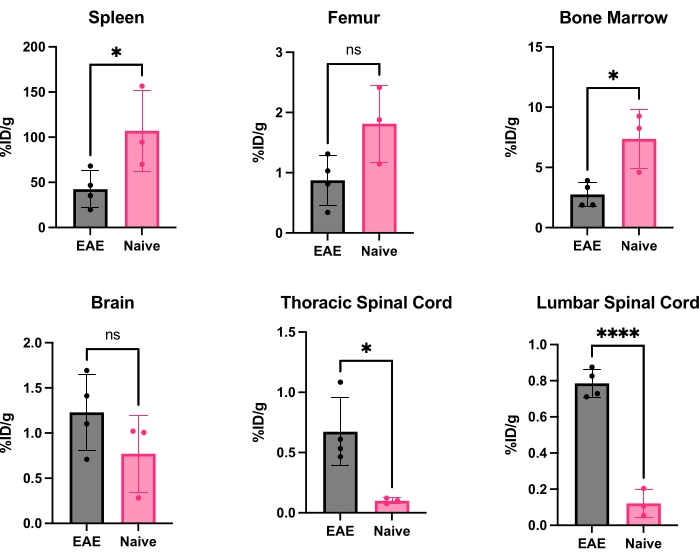
图 5:EAE 和幼稚小鼠各器官中离 体 γ 计数的代表性定量,表示为 %ID/g。 PET扫描后,用PBS灌注小鼠以去除血液中存在的放射性示踪剂,无论是游离的还是与血液驻留的CD19 + B细胞结合的,并快速解剖和称重器官以获得每个器官的准确重量。与幼稚小鼠相比,EAE小鼠的脾脏和骨髓中的示踪剂结合显着降低。在EAE小鼠的腰椎和颈椎/胸脊髓段中观察到放射性示踪剂结合增加。大脑的放射性示踪剂信号没有显着增加,尽管它有显着增加的趋势。使用学生 t 检验(*:p < 0.0332;****:p < 0.0001)进行的统计。缩写:PET=正电子发射断层扫描;%ID/g = 每克组织的注射剂量百分比;EAE = 实验性自身免疫性脑脊髓炎;PBS = 磷酸盐缓冲盐水。 请点击这里查看此图的较大版本.
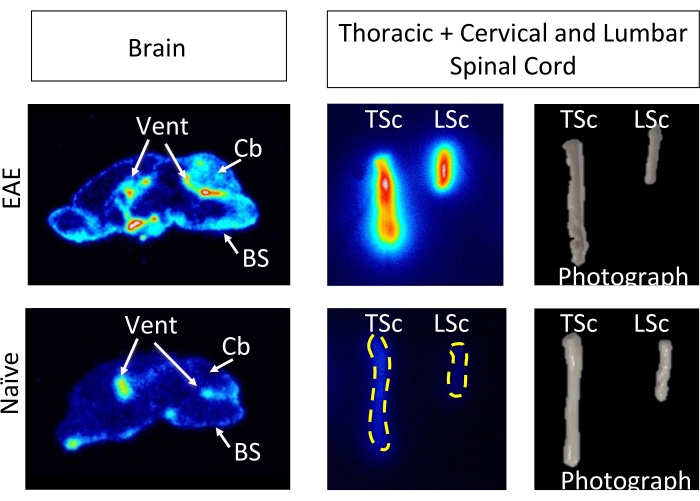
图 6:与幼稚小鼠相比, 离体 ARG 图像描绘了 EAE矢状脑切片和整个脊髓中 64 个 Cu-DOTA-hCD19-mAb 结合。 在暴露于放射性组织样品约10个半衰期(127小时或5天)后,使用荧光体成像仪扫描数字荧光体存储膜。与幼稚小鼠的大脑切片相比,由此产生的图像显示EAE小鼠大脑中的视觉信号更高,这是由于该模型中已知含有B细胞的区域5。具体来说,EAE小鼠脑切片的脑干、小脑和脑室中的示踪信号增加。EAE小鼠脑切片信号的增加反映了上述全脑PET定量中的发现。同样,与幼稚脊髓相比,颈椎/胸椎和腰椎脊髓节段的放射性示踪剂结合增加,反映了使用 离体 伽马计数的发现。缩写:PET=正电子发射断层扫描;EAE = 实验性自身免疫性脑脊髓炎;通气口=心室;Cb = 小脑;BS = 脑干;TSc = 胸脊髓和颈脊髓的结合;LSc = 腰椎脊髓。 请点击这里查看此图的较大版本.
补充图 S1:用 CD45R/B220 对幼稚和 EAE 小鼠脑组织的 CNS 组织进行染色。 在EAE小鼠的脑干,脑膜和白质中观察到B细胞(n = 7 EAE,n = 5幼稚小鼠,平均每只动物四片)。这个数字是从 5 开始的。矢状脑图像中的比例尺 = 5 mm(低放大倍率 [1x]),脑干、脑膜和小脑白质中的比例尺 = 100 μm(高放大倍率 [20x])。 请点击这里下载此文件。
讨论
本文介绍了一种使用 CD19-PET 在 MS 小鼠模型中对人 CD19+ B 细胞进行成像的简化方法。由于多发性硬化症的异质性表现和对治疗的不同反应,其在临床上的管理可能具有挑战性,迫切需要新的治疗选择和监测方法。PET成像可以作为监测疾病进展和个体对B细胞耗竭治疗反应的有力工具。除MS外,CD19-PET成像还可用于监测淋巴瘤和白血病或其他B细胞介导的疾病亚型治疗后的B细胞耗竭。该协议和代表性数据显示了B细胞成像在神经系统疾病中的效用。
为了在MS的背景下研究人CD19 + B细胞,我们选择了B细胞依赖性MOG1-125 EAE模型7。与其他 EAE 模型类似,该模型表现为进行性麻痹和免疫细胞浸润到中枢神经系统的症状。然而,MOG1-125模型的独特之处在于它是B细胞驱动的模型:小鼠在脑膜、脑干、实质和脑室的蛛网膜下腔中含有不同数量的B细胞。这些淋巴细胞可以稀疏地散布在这些区域和/或形成滤泡样结构,这在患有 MS 8,9 的人中也观察到。除了使用幼稚小鼠作为对照外,还可以使用仅使用完整的弗氏佐剂(CFA)诱导试剂盒(即,与给予不含MOG蛋白的EAE小鼠相同的诱导乳剂)。在EAE小鼠模型中,血脑屏障(BBB)功能失调,并允许较大的实体(如抗体)交叉。只有当 B 细胞存在时,CD19-mAb 放射性示踪剂才会结合并保留在中枢神经系统中;如果不存在 B 细胞,示踪剂将循环回血池。我们已经使用伽马计数和中枢神经系统组织的离体放射自显影来证明这一点,方法是在测量组织中的放射性水平之前进行灌注。我们在早期的出版物中也证明了这一点,报道了使用基于 mAb 的 PET 放射性示踪剂(即免疫 PET 成像方法)检测中枢神经系统中的 B 细胞 1,2。
之所以使用 DOTA 螯合剂,是因为它已用于铜 64 标记肽和抗体的临床 PET 成像,我们的目标是将 hCD19-mAb 翻译成 MS 患者的临床成像。DOTA 在体内对铜-64具有足够的结合亲和力。 体内 稳定性非常重要,因为游离的 64Cu 进入肝脏并会掩盖结合放射性示踪剂的信号;因此,测量肝脏中的信号以计算与其他器官相比的相对信号非常重要。肌肉通常被用作对照组织,但在 EAE 的情况下,肌肉中可能存在炎症。 64Cu 的半衰期为 12.7 小时,这为 DOTA-hCD19-mAb 与其靶标结合提供了充足的时间,同时确保可以通过 PET 测量信号。制备偶联物时,应进行小规模 (75-125 μg) 测试反应,以确定添加到 mAb 中以产生所需 DOTA/mAb 比率的 DOTA 量(例如,每 mol mAb 过量 6-10 倍的 DOTA-NHS-酯的反应可能产生 1-2 DOTA/mAb 的偶联物)。反应时间和温度(例如,在4°C或室温下2-4小时或过夜)也会影响DOTA/mAb比率,应进行优化。可以用非放射性铜进行滴定以计算每个mAb的DOTA数;但是,我们建议进行MALDI-MS和/或LC-MS以获得更可靠和准确的结果。
计算出的 DOTA/mAb 比率是特定样品的平均值,预计会有一些变化。对于MALDI时,每个样品对偶联和非偶联单克隆抗体进行多次注射。然后,我们计算偶联与非偶联的比率,以确定 DOTA/mAb 的平均数量。DOTA/mAb 比率很重要,因为过多的螯合剂会破坏抗体结合,而过多的螯合剂会导致放射性标记不一致和信号低。偶联物批次之间的比率应非常接近,以保持一致的信号强度和结合动力学;理想情况下,同一批次的偶联物应用于特定研究中的所有实验。减少可能的过度偶联对免疫反应性的潜在影响的一种有前途的技术是使用位点特异性偶联10 ,其中螯合剂偶联在抗体的重链聚糖上具有位点选择性,从而保证每个 mAb 添加 1 个螯合剂。
应优化放射性标记反应条件,以确保最高的标记效率和产量,因为抗体、DOTA/mAb 比率和 64Cu 摩尔活性等条件的差异会影响放射性标记。使用最佳的 64Cu 与 mAb 偶联物比可以使放射性示踪剂无需纯化即可使用,从而减少放射性标记所需的时间和由于重力流柱和放射性衰变造成的损失。当使用相同的 64Cu 与 mAb 偶联物比率时,也可以实现一致且可靠的摩尔活性,这在比较多个小鼠队列或影像学研究的结果时尤为重要。ITLC条件也可以修改以适应每个用户。如果需要纯化,应保存等分试样用于 HPLC 和/或紫外/可见分光光度法,以便计算摩尔活度。
需要注意的是,使用放射性标记抗体进行成像可能具有挑战性。用于放射性示踪剂的抗体必须具有生物惰性,以免产生生理效应。此外,由于抗体在血液中的驻留时间很长,因此必须等待足够长的时间才能使给定的mAb循环、结合和清除,以确保在不影响图像质量的情况下获得合适的信号与背景。通常,等待 20-48 小时以获得 64 Cu 标记的 mAb 就足够了,但在评估新的 mAb PET 示踪剂时,应在注射后 2、4、6、12、 24、48 小时成像,以确定给定啮齿动物模型中成像的最佳时间点。对于采集具有最高信噪比的ARG图像也是如此。该方案中的代表性图像是在注射后18-20小时拍摄的,尽管根据所使用的放射性同位素,可以使用其他时间点。与CD19不同表位结合的不同抗体会产生不同的结果,应严格表征。
在分析脊髓信号时,重要的是将小鼠仰卧在扫描床上,以减少呼吸引起的运动。此外,仰卧位可以帮助拉直由于EAE疾病进展而增加脊柱弯曲的小鼠的脊柱。在检测脊柱和脊髓信号时要考虑的另一个重要方面是避免在侧腹注射 MOG1-125 ,因为注射部位可以由于这些区域的相关免疫反应而结合示踪剂。注射部位的接近会干扰脊髓分析;因此,在胸部注射对于本文所述的应用是优选的。
所使用的图像分析技术是针对中枢神经系统成像的。只要PET和CT的配准准确,图像分析软件中的脑图谱工具就可以提供可重复和可靠的结果。使用半自动 3D 脑图谱并对其进行调整以适合每只小鼠的头骨,可以在动物之间实现一致的 ROI。由于目前没有自动或半自动方法来分析脊髓中的信号,因此必须手动绘制 ROI。值得注意的是,在定量CD19 + B细胞(或骨髓和脊髓中存在的任何细胞类型)时,尽可能消除来自脊柱和骨髓的信号至关重要。其原因是已知幼稚小鼠的骨髓中含有比EAE小鼠更多的CD19 + B细胞,其中B细胞离开外周浸润CNS 5,11。这种骨髓信号可以掩盖脊髓中的真实信号。
为了描绘真实的脊髓信号,同时最大限度地减少来自脊柱和骨髓的信号的贡献,CT 图像的 Otsu 阈值可用于为脊柱提供不可变的 ROI。然后可以很容易地在脊柱内绘制单独的脊髓 ROI。同样的技术也可以应用于测量股骨中的骨髓。这是一种非常有用的方法,可以深入了解脊髓中的示踪剂结合。然而,由于PET的空间分辨率相对较低,并且在扫描小鼠的小解剖区域时存在与部分体积效应有关的问题,因此使用额外的 离体 确认技术(例如,伽马计数,ARG)可以在不存在血液、脑脊液或来自脊柱的溢出信号的情况下验证脊髓中的放射性示踪剂结合。
在EAE小鼠中,颈椎/胸脊髓中的信号往往会发生变化,这取决于疾病的严重程度和适应性免疫反应期间浸润的B细胞数量。浸润的B细胞数量的这种变化,以及与幼稚小鼠的盆腔/脊髓骨髓中的B细胞相比,CNS中的少量B细胞,可以使小鼠脊髓组织的 体内 定量具有挑战性。鉴于PET在小动物成像中的空间分辨率,来自骨髓的信号可以溢出到脊髓信号上。这里完成的 离体 生物分布和放射自显影有助于验证椎骨与脊髓组织的PET信号。在解剖前灌注小鼠以除去血池中任何未结合的示踪剂,以便伽马计数和放射自显影结果反映每个器官中实际结合的示踪剂,而不是该器官血池中的示踪剂。
放射性示踪剂在血液中循环,特别是抗体示踪剂,在初次注射后数周内,血液中通常存在未结合的放射性示踪剂。由于我们正在对具有许多血管的大脑和脊髓进行成像,因此重要的是要了解信号的哪一部分真正是由于感兴趣的大脑/组织中的示踪剂结合与血池中存在的示踪剂结合。因此,有必要将大脑信号除以心脏/血池中的信号。在临床环境中,可以使用与椎骨的 Otsu 阈值和脊髓组织的 ROI 相同的图像分析技术进行定量。鉴于与小鼠相比,人类的组织体积更大,部分体积效应的影响应该要小得多,从而提高准确性并消除对 离体 技术确认 体内 发现的需求。在临床中使用PET将使临床医生能够根据每个患者的B细胞负荷为每位患者提供个性化治疗。
ARG对于获取高分辨率图像特别有用,可以更准确地描绘示踪剂结合在脑干和小脑等小区域的空间位置。可以保存相同的切片和/或相邻切片进行免疫组织化学染色,以确认 B 细胞的存在。我们之前用 CD45R/B220(补充图 S1)对 CNS 组织进行染色,以将 B 细胞数量与 PET 和 ARG 信号相关联 5,9。然后,可以在空间上将染色结果与ARG结果进行比较,以验证放射性示踪剂信号是否与染色模式匹配。B细胞可以成簇存在,也可以弥漫在整个脑干中;PET灵敏度足够高,可以测量信号,这对临床转化来说是令人鼓舞的。对于脊髓 ARG,从椎骨中取出脊髓可确保测量的信号是由于脊髓组织中的示踪剂结合,而不是骨髓和/或血液,这可能会由于部分体积效应而使 PET 图像模糊。
与ARG类似, 离体 伽马计数可以量化单个器官中的放射性信号。对于这种特殊的技术,在将试管放入伽马计数器之前,测量组织的湿重并确保它们位于各自试管的底部非常重要。试管必须标有小鼠编号和组织,以便使用正确的试管;然后将试管在校准的天平上称重,并将器官插入到最接近的十分之一微克(0.0001mg)处。有些组织非常小,前后试管质量的差异约为 0.0001 mg。解剖后应立即称量组织,以防止水分流失,从而降低质量。称重后,在冷冻这些组织进行ARG之前,应在脑和脊髓管中填充PBS,以防止干燥。
披露声明
CD19抗体由Horizon Therapeutics提供。
致谢
我们感谢斯坦福大学SCi3小动物成像设施的支持,以及Frezghi Habte博士在PET / CT方面的技术援助。 LC-MS由斯坦福大学质谱(SUMS)核心设施的核心人员执行,我们感谢工作人员提供这项服务。我们非常感谢Horizon Therapeutics提供hCD19-mAb,并特别感谢Jodi Karnell的技术指导和支持。这项工作由NIH NINDS(1 R01 NS114220-01A1)资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 mL 50 kDa MWCO Centrifugal filter | MiliporeSigma | UFC505008 | centrifugal filter |
| 64Cu-CuCl3 | Washington University in St. Louis; University of Wisonsin, Madison; or another vendor | ||
| AR-2000 Radio-TLC Imaging Scanner | Eckert & Ziegler | AR-2000 | |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 x 25 cm, screen only |
| Butterfly Needle Catheter | SAI Infusion Technologies | BLF-24 | |
| DOTA-NHS-ester | Macrocyclics | B-280 | |
| EAE Induction Kit | Hooke Laboratories | EK-2160 | |
| Geiger Counter | Ludlum | 14C | |
| GNEXT PET/CT Scanner | Sofie | GNEXT | |
| Hidex Automatic Gamma Counter | Hidex | AMG | |
| HPLC Column | Phenomenex | 00H-2146-K0 | 5 μm SEC-s3000 400 Å, 300 x 7.8 mm |
| Illustra NAP-5 column | Cytiva | 17085301 | DNA gravity column |
| Image J | NIH | ARG analysis software | |
| Low Protein Binding Collection Tubes (1.5 mL) | Thermo Scientific | PI90410 | |
| NanoDrop Lite Spectrophotometer | Thermo Scientific | 840281400 | UV-Vis micro/nano-spectrophotometer |
| PCR tubes 0.2 mL, for DNA grade | Eppendorf | 30124707 | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| VivoQuant | Invicro | Version 4 Patch 3 | PET Analysis Software; must purchase brain atlas add-on |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | Thermo Scientific | PI89882 | Desalting column |
参考文献
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Karussis, D. The diagnosis of multiple sclerosis and the various related demyelinating syndromes: A critical review. Journal of Autoimmunity. 48-49, 134-142 (2014).
- Hauser, S. L., et al. B-cell depletion with Rituximab in relapsing-remitting multiple sclerosis. The New England Journal of Medicine. 358 (7), 676-688 (2008).
- Chen, D., Gallagher, S., Monson, N. L., Herbst, R., Wang, Y. Inebilizumab, a B cell-depleting anti-CD19 antibody for the treatment of autoimmune neurological diseases: Insights from preclinical studies. Journal of Clinical Medicine. 5 (12), 107(2016).
- Stevens, M. Y., et al. Development of a CD19 PET tracer for detecting B cells in a mouse model of multiple sclerosis. Journal of Neuroinflammation. 17 (1), 275(2020).
- Chaney, A. M., Johnson, E. M., Cropper, H. C., James, M. L. PET imaging of neuroinflammation using [11C]DPA-713 in a mouse model of ischemic stroke. Journal of Visualized Experiments. (136), e57243(2018).
- Lyons, J. -A., Ramsbottom, M. J., Cross, A. H. Critical role of antigen-specific antibody in experimental autoimmune encephalomyelitis induced by recombinant myelin oligodendrocyte glycoprotein. European Journal of Immunology. 32 (7), 1905-1913 (2002).
- Haugen, M., Frederiksen, J. L., Degn, M. B. cell follicle-like structures in multiple sclerosis-With focus on the role of B cell activating factor. Journal of Neuroimmunology. 273 (1-2), 1-7 (2014).
- James, M. L., et al. Imaging B cells in a mouse model of multiple sclerosis using 64Cu-Rituximab PET. Journal of Nuclear Medicine. 58 (11), 1845-1851 (2017).
- Zeglis, B. M., et al. An enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Lyons, J. -A., et al. B cells are critical to induction of experimental allergic encephalomyelitis by protein but not by a short encephalitogenic peptide. European Journal of Immunology. 29 (11), 3432-3439 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。