Method Article
Obtención de imágenes de células B CD19+ en un modelo experimental de ratón con encefalomielitis autoinmune mediante tomografía por emisión de positrones
En este artículo
Resumen
En este artículo se detalla la metodología para el radiomarcaje de un anticuerpo monoclonal anti-CD19 específico para humanos y cómo utilizarlo para cuantificar las células B en el sistema nervioso central y los tejidos periféricos de un modelo murino de esclerosis múltiple mediante imágenes PET in vivo, recuento gamma ex vivo y enfoques de autorradiografía.
Resumen
La esclerosis múltiple (EM) es la enfermedad desmielinizante más común del sistema nervioso central (SNC) que afecta a los adultos jóvenes, lo que a menudo resulta en déficits neurológicos y discapacidad a medida que avanza la enfermedad. Los linfocitos B desempeñan un papel complejo y crítico en la patología de la EM y son el objetivo de varias terapias en ensayos clínicos. En la actualidad, no hay forma de seleccionar con precisión a los pacientes para terapias específicas con células B o de cuantificar de forma no invasiva los efectos de estos tratamientos sobre la carga de células B en el SNC y los órganos periféricos. La tomografía por emisión de positrones (PET) tiene un enorme potencial para proporcionar información cuantitativa altamente específica sobre la distribución espacio-temporal in vivo y la carga de las células B en sujetos vivos.
Este artículo informa de los métodos para sintetizar y emplear un trazador PET específico para las células B CD19+ humanas en un modelo de ratón de EM bien establecido impulsado por células B, la encefalomielitis autoinmune experimental (EAE), que se induce con la glicoproteína de oligodendrocitos de mielina recombinante humana 1-125. Aquí se describen técnicas optimizadas para detectar y cuantificar las células B CD19+ en el cerebro y la médula espinal mediante imágenes PET in vivo . Además, este artículo informa de métodos simplificados para el recuento gamma ex vivo de órganos relevantes para la enfermedad, como la médula ósea, la médula espinal y el bazo, junto con la autorradiografía de alta resolución de la unión del marcador CD19 en los tejidos del SNC.
Introducción
La esclerosis múltiple es un trastorno neurológico mediado por el sistema inmunitario; La presentación única de cada paciente puede dificultar el manejo tanto para los pacientes como para los médicos1. La enfermedad en sí se caracteriza por la presencia de lesiones desmielinizantes e infiltración de células inmunitarias en el cerebro y la médula espinal, lo que resulta en deterioro físico y cognitivo2. El paradigma tradicional de que la EM es una enfermedad mediada por células T se cuestionó por primera vez en un ensayo clínico de fase II de rituximab3, una terapia dirigida al subconjunto CD20+ de células B. Desde entonces, se han desarrollado terapias adicionales de células B que se dirigen a CD194, un biomarcador de células B panorámico que se expresa en una gama más amplia de células B, lo que puede ser ventajoso tanto desde el punto de vista diagnóstico como terapéutico. Además, los métodos existentes para evaluar la eficacia del tratamiento (es decir, la monitorización del número de recaídas y de la actividad de las imágenes por resonancia magnética [IRM]) no permiten medir la respuesta de forma temprana, lo que pone a los pacientes en un riesgo significativo de daño en el SNC debido a la selección y optimización de la terapia subóptima. Por lo tanto, existe una necesidad crítica de estrategias para monitorear células inmunitarias específicas, como las células B CD19+ , en tiempo real en el SNC y la periferia de los pacientes con EM.
La PET es una técnica de imagen robusta que permite la visualización in vivo de todo el cuerpo de un objetivo de interés determinado, como el CD19. Mientras que las extracciones de sangre, los registros de las tasas de recaída y el seguimiento de las lesiones a través de la resonancia magnética proporcionan instantáneas de la eficacia del tratamiento, las imágenes PET pueden permitir a los investigadores y médicos controlar la eficacia de una terapia en todo el cuerpo. Este enfoque proactivo de la monitorización terapéutica permite a los médicos evaluar la eficacia de la medicación en tiempo real, lo que permite realizar ajustes rápidos según sea necesario. El monitoreo de la ubicación y la densidad de las poblaciones celulares asociadas con la enfermedad también permite una evaluación longitudinal de la gravedad utilizando información anatómica específica del paciente. Por lo tanto, es esencial establecer métodos analíticos reproducibles para utilizar de forma fiable todo el potencial de las imágenes PET en entornos clínicos y preclínicos.
En este artículo se describen los métodos (Figura 1) para realizar imágenes PET, recuento gamma ex vivo y autorradiografía (ARG) de células B CD19+ con un anticuerpo monoclonal (mAb) CD19 humano marcado con 64 Cu, conocido como 16C4-TM (64Cu-hCD19-mAb), en el modelo experimental de ratón de encefalomielitis autoinmune (EAE) de EM inducida en ratones transgénicos que expresan CD19 humano (hCD19) utilizando glicoproteína 1-125 de oligodendrocitos de mielina recombinante humana (MOG1-125). También proporcionamos métodos para evaluar la unión de radiotrazadores de forma precisa y reproducible en el cerebro y la médula espinal, ambos sitios críticos de patogénesis a menudo gravemente afectados en este y otros modelos neurodegenerativos. Estas técnicas permiten la investigación no invasiva del papel de las células B en la patología de la enfermedad y tienen el potencial de traducirse clínicamente para evaluar la eficacia de las terapias anti-células B en la EM.
Protocolo
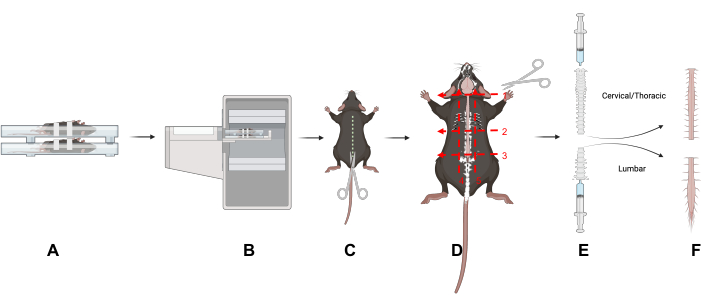
Figura 1: Diseño del estudio. En este artículo se ofrece una descripción general de las técnicas clave. (A) Colocar a los ratones en la cama de escaneo boca arriba reduce el movimiento de la columna vertebral. (B) Imágenes PET/CT de los ratones. (C) Haga una incisión en el lado dorsal del animal para exponer la columna vertebral. (D) Dividir la columna vertebral en porciones cervicales/torácicas y lumbares y eliminar las secciones siguiendo los cinco cortes indicados. (E) Use una jeringa para extraer la médula espinal de la columna vertebral haciendo un sello con la jeringa y la columna vertebral y enjuagando los extremos craneal y caudal de la columna vertebral como se muestra. (F) Segmentos aislados de la médula espinal cervical/torácica y lumbar. Abreviatura: PET/CT = Tomografía por emisión de positrones/tomografía computarizada. Haga clic aquí para ver una versión más grande de esta figura.
Todos los estudios en animales se llevaron a cabo de acuerdo con el Panel Administrativo sobre el Cuidado de Animales de Laboratorio (APLAC) de la Universidad de Stanford, un programa acreditado por la Asociación para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio (AAALAC International). Los ratones se aclimataron al vivero durante al menos 7 días antes del inicio del estudio para minimizar el estrés en los ratones, ya que el estrés puede afectar a la inducción de EAE.
1. Inducción de EAE en ratones hembra humanizados CD19
- Inducir ratones hembra CD19 C57BL/6J humanizados de 9 a 13 semanas de edad con EAE como se ha descritoanteriormente 5 utilizando MOG1-125.
2. Cuidado y puntuación de los animales en el modelo de ratón de EAE
- Puntúe la progresión de la enfermedad y el cuidado de los ratones como se describió anteriormente5. En resumen, puntúe este modelo en una escala del 1 al 5 de la siguiente manera: 1 es debilidad/flacidez de la cola, 2 es debilitamiento de las extremidades posteriores, 3 es parálisis de las extremidades posteriores, 4 es parálisis de las extremidades posteriores con debilidad de las extremidades anteriores, 5 es moribundo.
3. Conjugación, radiomarcaje y caracterización de anticuerpos monoclonales
- Conjugar el éster bifuncional quelante 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacético éster mono-N-hidroxisuccinimida (DOTA-NHS-éster) a hCD19-mAb para radiomarcarlo con 64Cu.
- Utilizando una columna de desalinización, cambie el tampón de almacenamiento de hCD19-mAb por el tampón HEPES (pH 8,5-9): acondicione la(s) columna(s) de desalinización con HEPES. Calcule el número de columnas necesarias en función de la capacidad del volumen de muestra de la columna de desalinización y el volumen de mAb requerido: tubos de 0,5 ml: 30-130 μl de volumen de muestra, 300 μl de lavado; Tubos de 2 ml: volumen de muestra de 200-700 μl, lavado de 1 ml.
- Enfríe la centrífuga a 4 °C para el intercambio de tampón a través de la columna de desalinización.
- Recupere la columna de desalinización de la nevera. Retire la parte inferior de la columna de desalinización, afloje la tapa y coloque la columna en un tubo de recolección.
- Centrifugar a 1.500 × g durante 2 min para eliminar la solución de almacenamiento; Deseche el flujo continuo que contiene la solución de almacenamiento y reutilice el tubo de recolección. Marque una línea en la columna donde el punto más alto de la resina compactada desalinizada esté inclinado hacia arriba.
- Agregue el búfer HEPES a la parte inferior de la columna de desalinización. Coloque la columna de desalinización en la centrífuga con la línea hacia afuera; Centrifugar a 1.500 × g durante 2 min. Deseche el flujo y reutilice el tubo de recolección.
- Repita los pasos 3.1.4 y 3.1.5 2 veces usando el mismo tubo de recolección y descartando el flujo entre pasos.
- Coloque la columna de desalinización acondicionada en un nuevo tubo de recolección y etiquete; este tubo contendrá el hCD19-mAb.
- Agregue hCD19-mAb en la parte superior de la(s) columna(s) de desalinización acondicionada y use tampón HEPES para enjuagar el vial de mAb vacío; Agregue esto a la parte superior de la columna de desalinización (volumen total según la recomendación del fabricante). Centrifugar a 1.500 × g durante 2 min para eluir el hCD19-mAb. Mantenga el flujo que contiene el hCD19-mAb.
- Mida la concentración de hCD19-mAb con un espectrofotómetro UV/Vis y ajústela a 0,5 μg/μL con tampón HEPES si es necesario.
- A la solución de hCD19-mAb, añadir 1/50del volumen de la solución de mAb de 0,5 M de EDTA para que la concentración final de EDTA sea de 0,01 M en la solución de hCD19-mAb. Deje reposar la solución de hCD19-mAb-EDTA a temperatura ambiente durante 15 min.
- Retire el éster DOTA-NHS del congelador y deje que alcance la temperatura ambiente (10-15 min). Calcule el volumen de DMSO que se agregará al éster de DOTA-NHS para obtener una concentración de DOTA que permita la adición de la relación molar DOTA/mAb deseada (que suele ser del orden de 1-2 DOTA/mAb).
NOTA: El volumen de éster DMSO-DOTA-NHS añadido a los anticuerpos monoclonales de hCD19 no debe exceder el 10% del volumen de anticuerpos monoclonales. Esto debe hacerse usando una hoja de cálculo para que se pueda hacer de manera rápida y repetida. - Con base en la proporción deseada de DOTA a hCD19-mAb, calcule la cantidad de DOTA-NHS-éster para agregar a hCD19-mAb.
nmol mAb × 10 DOTA/mAb → nmol DOTA → mg de DOTA → mg/mL DOTA/DMSO → mL de DMSO → factor de dilución de la solución de DOTA/DMSO - Pesar 1-2 mg del éster DOTA-NHS, y añadir con cuidado el volumen correcto (calculado en el paso 3.1.11) de DMSO al éster DOTA-NHS; Mezclar y girar.
- Pipetear el volumen calculado de la solución DOTA-NHS-éster (paso 3.1.12) en la solución de hCD19-mAb; limpie el exterior de la punta de la pipeta antes de agregarla para asegurarse de que no se agregue DOTA-NHS-ester adicional (sin cambiar la cantidad en la pipeta). Mezcle suavemente y gire.
- Introducir en la nevera (4 °C) para que reaccione durante la noche (12-16 h).
- Purificación y concentración
- Enfríe la centrífuga a 4 °C para los pasos de intercambio de tampón del concentrador centrífugo; coloque un bloque de tubo de PCR de metal sobre hielo seco para congelar rápidamente el conjugado.
- Retire la reacción DOTA-hCD19-mAb del refrigerador y enfríe agregando tampón TRIS de grado biológico: 10% del volumen total de la reacción. Extraer 10-20 μg de la muestra para el análisis por espectrometría de masas.
- Acondicione la(s) columna(s) de desalinización como se ha descrito anteriormente (pasos 3.1.1-3.1.5), utilizando tampón de acetato de amonio 0,1 M, pH 5,5.
- Intercambio tampón de la solución de DOTA-hCD19-mAb por acetato de amonio (pasos 3.1.1-3.1.8).
- Concentrar la solución DOTA-hCD19-mAb: añadir la solución a un concentrador centrífugo de corte de peso molecular de 50 kDa siguiendo las recomendaciones del fabricante sobre el volumen. Centrifugar a 4.000 × g durante 10 min (o hasta que el volumen se reduzca en un 80%-90%); Deseche el flujo.
- Repita nueve veces más (10 en total): agregue suficiente acetato de amonio para devolver el volumen al volumen máximo recomendado.
NOTA: El total debe ser lo que se agregó inicialmente, incluyendo lo que queda en la columna, generalmente 400-450 μL para un concentrador centrífugo de 500 μL de capacidad.- Enjuague el vial de reacción con tampón de acetato de amonio para recuperar cualquier residuo de DOTA-hCD19-mAb; Agregue el lavado al concentrador centrífugo.
- Centrifugar a 4.000 × g durante 10 min.
NOTA: El tiempo de centrifugado puede reducirse en giros posteriores si el volumen se reduce al 80%-90% en menos tiempo.
- Retire la solución proteica del concentrador centrífugo. Obsérvese el volumen total del DOTA-hCD19-mAb.
- En el concentrador centrífugo 2, añadir suficiente tampón de acetato de amonio para un volumen total de 100 μL y pipetear para mezclar. Tapar la columna concentradora centrífuga e invertirla. Girar a 4.000 × g durante 2 min para recoger la solución. Transfiera a un tubo nuevo.
- En el concentrador centrífugo 500, utilice una pipeta para recoger la solución de anticuerpos monoclonales del concentrador centrífugo; Añádelo a un tubo nuevo.
- Mida la concentración con un espectrofotómetro UV-Vis. Si la concentración es superior a 2 mg/ml, diluir con acetato de amonio hasta 2 mg/ml.
- Alícuota 100 μg por tubo de PCR (aproximadamente 50 μL); etiquete los tubos con DOTA-hCD19-mAb, fecha, masa y concentración. Gire hacia abajo los viales.
- Congele a presión el DOTA-hCD19-mAb en el bloque de PCR refrigerado en hielo seco (o congele en hielo seco). Una vez congeladas todas las muestras, colóquelas en un congelador a -80 °C.
- Mida el número de DOTA por hCD19-mAb mediante espectrometría de masas. Mantenga una muestra de anticuerpo no conjugado (puro) de cada conjugación para calcular la proporción. Utilice la ecuación (1) que se indica a continuación; el peso molecular se abrevia MW.
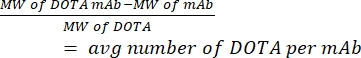 (1)
(1)
- Radiomarcaje
NOTA: Use el equipo de protección personal (EPP) adecuado para el manejo de la radiactividad, incluyendo una bata de laboratorio, guantes y un dosímetro corporal y de anillo personal, siguiendo las regulaciones institucionales. Inspeccione y cambie los guantes con regularidad para evitar la contaminación radiactiva. Use blindaje de plomo y aumente la distancia de la fuente radiactiva manipulándola con pinzas cuando sea posible.- Transfiera la radiactividad del vial de envío a un vial nuevo con una pipeta. Mide la radiactividad.
- Retire una alícuota para la primera reacción de radiomarcado. Añadir 50 μL de acetato de amonio (pH 5,5) por 1 mCi de 64Cu-CuCl3. Mida el pH pipeteando 1 μL en una tira de pH con un rango que capture 5,5 con suficiente resolución para distinguir entre 5 y 6.
- Si el pH no es de 4-5,5, modifíquelo usando 1 M de NaOH o 0,1 M de HCl. Agregue pequeñas cantidades, 1-5 μL, de 1 M de NaOH si el pH es inferior a 4 o 0,1 M de HCl si el pH es superior a 5,5 hasta alcanzar el pH correcto. Con cada adición, mezcle bien, gire hacia abajo y mida el pH como se describió anteriormente. Anote cada adición y eliminación de cualquier solución (incluso para verificar el pH) para que se pueda calcular el volumen final.
- Una vez alcanzado el pH óptimo, añadir 10 μg de DOTA-hCD19-mAb por 1 mCi de 64Cu-CuCl3. Mezcle suavemente y gire hacia abajo brevemente.
- Coloque el vial de reacción en una batidora termomezcladora ajustada a 37 °C y 400 revoluciones por minuto (rpm).
- Después de 30 minutos, apague la reacción: divida el volumen total de reacción por 50 y agregue ese volumen de 0,5 M de EDTA a la mezcla de reacción.
- Determine la eficiencia del etiquetado mediante cromatografía instantánea en capa fina (ITLC) para medir el porcentaje de cobre unido y libre en la solución.
- Corta tiras de papel TLC de 1 cm de ancho. Marque a 1 cm de la parte superior e inferior de la tira y prepare un tubo (matraz cónico de 50 ml) con fase móvil inferior a 1 cm de ácido cítrico 0,1 M (el nivel de fase móvil debe estar por debajo de la marca de 1 cm en la tira cuando se coloca en el tubo).
- Pipetear 1 μL de la solución de reacción en la tira en la marca inferior de 1 cm (frente del disolvente) y colocar la tira en el tubo. Observe hasta que el frente del solvente alcance la marca superior de 1 cm, retire la tira y envuélvala en un trozo de envoltura de plástico.
- Coloque la tira en la plataforma y pásela por un escáner de imágenes de radio-TLC. Busque el mAb radiomarcado en el origen y el 64Cu libre que viaja con el frente de fase móvil (Figura 2). Si el porcentaje de cobre libre es inferior al 5% (95% de eficiencia de etiquetado), se procederá a la inyección en animales. Si el porcentaje de cobre libre es superior al 5%, proceda a la purificación.
NOTA: El porcentaje de cobre libre generalmente depende de la proporción de DOTA-mAb a 64Cu, el tiempo de reacción, el pH y la temperatura. Las condiciones de reacción deben ser optimizadas por cada usuario para cada nuevo mAb para garantizar resultados consistentes.
- Purificación a través de una columna de gravedad desechable de grado de ADN
- Acondicione una columna de flujo por gravedad desechable de grado ADN (columna de desalinización/intercambio de tampón) de acuerdo con las instrucciones del fabricante. Coloque la columna de gravedad desechable de grado de ADN en un soporte de anillo u otro instrumento detrás de un blindaje de plomo adecuado; Asegúrese de que el aparato sea estable y fácil de mover. Coloque el tubo debajo de la columna.
- Pipetear la mezcla cruda de reacción sobre la resina de la columna de flujo por gravedad. Espera hasta que todo el líquido haya fluido hacia la resina. Pipetear suficiente PBS para llevar todo el volumen (producto crudo más PBS) a 500 μL. Deseche el flujo.
- Coloque la columna sobre tubos de centrífuga de 1,5 ml etiquetados como 1-10. Agregue 1 ml de PBS a la columna. Recoja cinco gotas en cada tubo hasta que el flujo se haya detenido.
NOTA: Es posible que se requieran menos de 10 tubos. - Tapa la parte inferior de la columna y mide la radiactividad residual. Mida cada vial con flujo. Para cada vial con más de 50 μCi, prepare un ITLC según el paso 3.3.7 para medir el porcentaje de cobre unido en cada fracción.
NOTA: La primera o dos fracciones contendrán solo la fase móvil; el AcM radiomarcado se eluirá primero (generalmente las fracciones 2 o 3 a 5 o 6) y el 64Cu libre se eluirá al final (algunos se pegarán a la columna). El porcentaje ligado a 64Cu puede variar entre fracciones. - Combinar las fracciones con más del 95% de unión (menos del 5% de cobre libre); Utilice la solución inyectable. Si lo desea, realice una HPLC de exclusión por tamaño para confirmar el radiomarcaje5 y calcular la actividad molar. Guarde una alícuota para medir la concentración en un espectrofotómetro UV-Vis después de que haya decaído 10 vidas medias (127 h o 5,3 días).
4. Preparación de la dosis
NOTA: Antes de manipular la dosis, use el EPP adecuado, incluida la bata de laboratorio, los dosímetros corporales y de dedos, y los guantes.
- Inyectar 64Cu-DOTA-hCD19-mAb 18-24 h antes de la tomografía por emisión de positrones, para permitir una circulación adecuada de la radiosonda en el organismo.
- Coloque inmediatamente el recipiente de plomo con el 64Cu-DOTA-hCD19-mAb detrás del blindaje de plomo. Encienda el contador Geiger para controlar la posible contaminación.
NOTA: Cámbiese los guantes con frecuencia cuando manipule material radiactivo. Se recomienda el uso de doble guante durante la extracción de dosis para facilitar los cambios rápidos de guante. Siempre coloque los objetos punzocortantes y la basura contaminados en el área de basura protegida designada. - Diluir el 64Cu-DOTA-hCD19-mAb a una concentración adecuada en un tubo de centrífuga de plástico de 1,5 ml de baja fijación.
NOTA: El 64Cu-DOTA-hCD19-mAb se unirá al plástico si no es de baja adhesión; 64El Cu se unirá al vidrio.- Diluya la radiosonda en solución salina para evitar la radiólisis y simplificar la extracción de dosis consistentes.
- Preparar dosis para administrar entre 75 y 150 μCi en 100 μL, si es posible. Asegúrese de que el volumen total máximo inyectado no supere el 10% del peso corporal del ratón.
- Use una jeringa de insulina de 500 μl (50 cc) para extraer la dosis del tubo de plástico de baja fijación. Asegúrese de que no haya burbujas en la jeringa, ya que se inyectará por vía intravenosa.
- Etiquete previamente las jeringas con los números de animales correspondientes.
- Registre la actividad y el tiempo de la dosis en un cuaderno de laboratorio para el análisis de datos.
- Tenga las dosis listas para la inyección tan pronto como los animales sean cateterizados para reducir el tiempo bajo anestesia.
- Una vez preparadas las dosis, prepare un patrón (maniquí) para escanear con el fin de generar un factor de calibración.
- Llene un tubo cónico de 15 ml con 50-75 μCi de actividad diluida en agua (o PBS).
NOTA: Asegúrese de mezclar bien la solución. El estándar puede ser libre de 64Cu sobrantes del etiquetado.- Mide la cantidad de actividad en el estándar y registra el tiempo.
- Llene un tubo cónico de 15 ml con 50-75 μCi de actividad diluida en agua (o PBS).
5. Canulación e inyección
NOTA: Véanse los métodos6 descritos anteriormente para la canulación intravenosa de ratones para la inyección de la radiosonda6.
- Pesar y puntuar a los ratones en función de la gravedad de la enfermedad, tal y como se describe en la sección 2.1, antes de anestesiar a los ratones en una caja desmontable llena de isoflurano al 1,5-3% en preparación para la administración de radiosondas.
NOTA: Estos ratones se inyectarán en la mesa de trabajo, no en el escáner PET como se describió anteriormente. No es necesario pegar los catéteres en su lugar para la inyección, ya que los ratones no se moverán entre la canulación y la inyección. - Una vez que se haya canulado un ratón, inserte la aguja en el extremo del catéter e inyecte lentamente. Después de la inyección, siga con un pequeño lavado de solución salina a través del catéter para asegurarse de que se inyecte toda la dosis.
NOTA: El volumen debe ser aproximadamente igual al volumen muerto del catéter, que es de 50 μL para los catéteres utilizados por los autores.- Inyecte sobre un pedazo de toallita de laboratorio para recoger cualquier gota de radiosonda; Inclúyalo cuando mida la dosis residual.
- Registre la hora de la inyección en un cuaderno de laboratorio.
- Retire la cánula inmediatamente después de la inyección. Mida la cánula, la jeringa de dosis y el tejido con un calibrador de dosis para determinar la dosis residual que no se inyectó en el ratón.
- Registre la actividad y el tiempo en un cuaderno de laboratorio.
- Después de inyectar a los ratones, etiquete sus jaulas con una tarjeta de jaula que indique que los ratones son radiactivos. Registrar y registrar las jaulas de acuerdo con los lineamientos institucionales. Luego, coloque a los ratones en un área de retención radiactiva designada.
6. Imágenes PET/CT
- Realizar la PET 18-24 h después de la inyección de 64Cu-DOTA-hCD19-mAb. Pesa y puntúa a los ratones antes de escanearlos.
NOTA: Las instrucciones de funcionamiento del escáner dependen del escáner que se esté utilizando.- Asegúrese de que el componente de rayos X del escáner PET/CT esté calentado y listo para la adquisición.
- Abra el software de adquisición del escáner PET en la computadora.
- En el menú desplegable Inicio de sesión del investigador , haga clic en la información de laboratorio correspondiente.
- En la página Proyecto , cree un nuevo proyecto o seleccione un proyecto existente en el menú desplegable.
- Cuando el mensaje de inicialización aparezca automáticamente en la pantalla, haga clic en Home Bed y espere a que la cama llegue a casa. A continuación, haz clic en Warm up CT.
- Asegúrese de que la puerta de protección de la TC esté cerrada para permitir que la TC se caliente.
- Mientras el escáner se calienta, puntúa a los ratones EAE e inyéctalos por vía subcutánea con 0,2-0,4 ml de solución salina tibia en el flanco para que se hidraten.
- Después de calentar el escáner, regrese a la computadora para configurar las exploraciones PET para el estudio.
NOTA: Estos se pueden configurar antes del día del escaneo.- En el encabezado Estudios recientes , haga clic en Crear nuevo estudio. Complete el nombre del estudio, el protocolo, el compuesto y la información del tema.
- Si realiza una PET/CT, seleccione primero el protocolo PET y, a continuación, seleccione el protocolo CT.
NOTA: Normalmente, una tomografía computarizada estándar es suficiente para escanear el modelo de ratón EAE. Una tomografía computarizada tiene una duración de 1 minuto y se adquiere con agrupamiento a 2 x 2 a una tensión de 80 kVp, una corriente de 150 μA y 720 proyecciones. Las imágenes de TC se reconstruyen utilizando un algoritmo de Feldkamp modificado. - Para el protocolo PET, elija un escaneo estático de 64 cobres de 10 a 15 minutos. Si este análisis aún no está en la lista de protocolos disponibles, agréguelo haciendo clic en la pestaña Protocolos en el menú Estándar , Crear nuevo protocolo | Menú desplegable Isótopos . Si el isótopo deseado no aparece en la lista, haga clic en Más | Agregue desde la biblioteca y agregue el isótopo deseado. Defina la duración del escaneo, haga clic en el botón de opción para Escaneo estático, asigne un nombre al protocolo y haga clic en Guardar.
- Regrese a la pestaña Estudios y continúe nombrando y configurando todos los escaneos deseados para el día.
NOTA: Se recomienda configurar también una "prueba de tomografía computarizada" utilizando solo una tomografía computarizada estándar para verificar la posición de la cama de la primera exploración para garantizar una colocación óptima. Esta debería ser la primera exploración que se realice para el estudio.
- Si realiza una PET/CT, seleccione primero el protocolo PET y, a continuación, seleccione el protocolo CT.
- En el encabezado Estudios recientes , haga clic en Crear nuevo estudio. Complete el nombre del estudio, el protocolo, el compuesto y la información del tema.
- Una vez que el escáner esté listo, anestesia a los ratones en una caja desmontable para prepararlos para el escaneo.
NOTA: En esta etapa, es probable que los ratones estén muy enfermos; Es una buena práctica minimizar el tiempo bajo anestesia.- Aplícate gel para los ojos.
- Asegúrese de que la cama de escaneo para cuatro ratones esté equipada con elementos calefactores, como almohadillas térmicas o aire caliente, con el isoflurano ajustado al 1,5 %-2 % y la almohadilla térmica encendida (Figura 3). Coloque a los ratones en posición supina sobre la cama de exploración.
- A medida que avanza la enfermedad EAE, la columna vertebral del ratón se curva severamente. Escanee a los ratones mientras están boca arriba para enderezar la columna vertebral tanto como sea posible, mejorando el análisis posterior. Tire suavemente de la cola del ratón para ayudar a enderezar la columna vertebral.
- Una vez en posición supina, pegue firmemente cada ratón en su lugar con cinta adhesiva suave para microscopio. Use una tira de cinta adhesiva sobre la cabeza y otra suavemente sobre el abdomen para minimizar el movimiento debido a la respiración.
- Registre en un cuaderno de laboratorio qué mouse está en qué posición de escaneo.
- Una vez que los ratones estén asegurados, regrese a la computadora de escaneo para operar el escáner.
- Abra el menú Controlador de movimiento . Haga clic en PET Center FOV para mover los ratones en la cama de escaneo al anillo PET. Para el primer escaneo del día, haga clic en CT Center FOV. Una vez en posición, ejecute la prueba de tomografía computarizada para asegurarse de que la posición sea correcta; Repita hasta que la posición de la cama sea satisfactoria.
- Coloque un pequeño trozo de cinta blanca en la cama de escaneo para marcar la ubicación correcta de la cama para el resto del estudio.
- Una vez que la cama esté en su lugar para la exploración PET, inicie la secuencia de escaneo haciendo clic en Ejecutar.
- Espere a que el escáner se mueva automáticamente del anillo PET al CT.
- Compruebe siempre visualmente si los animales se han colocado en la posición adecuada tanto para la PET como para la TC.
- Registre la hora de inicio de la exploración en un cuaderno de laboratorio para la corrección de la caries de la dosis inyectada durante el análisis de datos.
- Una vez finalizado el escaneo, permita que la imagen se reconstruya. Compruebe los datos antes de retirar a los animales.
NOTA: La reconstrucción de la maximización de expectativas (OSEM) de subconjuntos ordenados en 3D tardará aproximadamente 5 minutos en realizarse un escaneo estático. - Comprobar y aprobar visualmente los datos, utilizando el bazo como control positivo, ya que este tejido contiene un gran número de células B. Retire a los animales de la cama de exploración y colóquelos en una caja de desmontaje llena de isoflurano en preparación para la perfusión y la disección posterior.
- Repita los pasos 6.5-6.12 para los ratones restantes del estudio.
- Cuando se escanean todos los ratones o cuando se escanea un grupo que tiene un lugar libre en la cama de exploración, escanee el estándar preparado en el paso 4.6.
7. Disección para recuento gamma ex vivo y autorradiografía
- Antes de diseccionar, asegúrese de que todos los tubos de recuento gamma y centrífugo se hayan pesado previamente.
- Realizar la eutanasia por perfusión, como se ha descritoanteriormente 6, con PBS y toracotomía mientras los ratones están profundamente anestesiados (inhalación continua de isoflurano al 4%, 2 L/min 100%O2).
- Para extirpar la médula ósea, corte ambos fémures a la altura de la rodilla y la pelvis. Asegúrese de que ambas cabezas estén separadas del fémur.
- Coloque ambos fémures en un tubo de centrífuga de 0,5 ml que tenga un orificio en la parte inferior (con una aguja de 20 G) y que tenga la tapa cortada.
- Coloque el tubo de 0,5 ml que contiene los fémures dentro de un tubo de centrífuga de 1,5 ml con la tapa cortada.
- Coloque toda la configuración del tubo en una mini centrífuga. Centrifugar durante 4 min a 4.500 × g.
NOTA: La médula ósea debe desprenderse a través del orificio del tubo de centrífuga de 0,5 ml y depositarse en el fondo del tubo de centrífuga de 1,5 ml.- Separa los tubos. Pesar los fémures vacíos en el tubo de centrífuga de 0,5 ml. Pesar la médula ósea en el tubo de centrífuga de 1,5 ml. Coloque cada tubo de centrífuga en tubos de conteo gamma.
- Extirpe el cerebro con fórceps y tijeras, teniendo cuidado de mantener intacto el tronco encefálico. Coloque el cerebro en un tubo de conteo gamma. Registre el peso seco, enjuague con PBS y manténgalo en hielo hasta que esté listo para contar.
- Para extirpar la médula espinal, realice los siguientes pasos.
- Retire la piel y el pelaje haciendo una incisión en el lado dorsal del animal para exponer la columna vertebral (Figura 1).
- Separe las regiones lumbar (L) de las cervicales (C) y torácicas cortando a lo largo de tres planos transversales alrededor y a través de la columna vertebral: en la base del cuello (vértebra C1) (Figura 1D, Número 1); en la base de la caja torácica (vértebra L1) (Figura 1D, Número 2); en la base de la pelvis (vértebra L5) (Figura 1D, Número 3).
- Corte debajo de la caja torácica (Figura 1D, Número 2).
- Corta directamente por encima del sacro para separar la región espinal lumbar. Recorte con cuidado la columna vertebral desde el extremo pélvico hasta que la médula espinal lumbar sea visible (Figura 1D, Número 3). Recortar los tejidos circundantes para aislar las regiones lumbar y cervical/torácica de la columna vertebral (Figura 1D, números 4 y 5).
- Para expulsar la médula espinal, use una jeringa de punta deslizante (3-10 ml) llena de PBS. Crea un sello entre la jeringa y la columna vertebral con el pulgar y el índice.
- Empuje suavemente el PBS a través de la jeringa para expulsar la médula espinal sobre una almohadilla absorbente (Figura 1E); Repita para ambas regiones de la columna vertebral. Coloque los tejidos de la médula espinal en un tubo de conteo gamma.
- Registre el peso seco y agregue PBS para asegurarse de que el tejido esté en la parte inferior del tubo para evitar que se seque. Coloque el tubo sobre hielo hasta que esté listo para contar.
- Expulsar la médula espinal cervical/torácica del extremo craneal y la médula espinal lumbar del extremo caudal de la columna vertebral (Figura 1E).
8. Recuento gamma ex vivo
- Abra el software del contador gamma. Navegue a la lista de trabajo y seleccione el protocolo deseado, como un protocolo de conteo de 30 s para 64Cu.
- Prepare al menos tres patrones en tubos separados. Ejecútelos ahora para utilizarlos en el análisis (paso 10.2). Trate de hacer tres volúmenes y cantidades de actividad replicados en tres tubos separados.
NOTA: Un volumen de 500 μL da buenos resultados. Si bien la actividad estará determinada por la máquina utilizada, 10 μCi generalmente funciona bien. - Coloque los estándares en un bastidor etiquetado con el código de barras correspondiente al protocolo deseado que se va a ejecutar. Coloque la rejilla en el mostrador gamma.
- Después de registrar los pesos de los órganos, coloque los tubos que contienen los órganos en la rejilla de conteo gamma después de los tubos que contienen los estándares.
NOTA: Los órganos de interés para este modelo pueden incluir ganglios linfáticos axiales, sangre, médula ósea, cerebro, ganglios linfáticos cervicales, fémur, corazón, hígado, médula espinal lumbar, músculo, bazo, cola y médula espinal cervical/torácica. - Coloque un estante con un código de barras de parada en la parte posterior del contador gamma.
- Presione el botón Reproducir en la computadora. Si es posible, no presione Reproducir hasta que haya varios racks u órganos para ejecutar para permitir que todos los tubos se cuenten continuamente en un archivo. Asegúrese de que haya un bastidor con un código de barras de parada en la parte posterior del contador gamma para cada ejecución.
- Ejecute hasta que se hayan contado todas las muestras. Guarde y exporte el archivo.
9. Autorradiografía ex vivo (ARG) del tejido del SNC
- Siga los pasos publicados anteriormente para la ARG cerebral y de la médula espinal (excluyendo los pasos 2-6 descritos por Chaney et al., ya que los ratones ya están inyectados con radiotrazador de la tomografía por emisión de positrones)6.
NOTA: Las instrucciones específicas para preparar el casete ARG de la médula espinal se enumeran aquí6. - Una vez que se haya completado el recuento gamma de la médula espinal lumbar y cervical/torácica, coloque rápidamente los tubos en hielo hasta que se hayan contado todos los tejidos del SNC.
NOTA: Refiérase al método publicado anteriormente para ARG del cerebro6. - Incline suavemente los tubos para permitir que la médula espinal caiga sobre una almohadilla absorbente. Si la médula espinal se pega al costado de la sonda, enjuague suavemente con PBS frío y vuelva a inclinar la sonda. Seque cuidadosamente cada médula espinal secándola suavemente con un pañuelo de laboratorio. Coloque la médula espinal seca de manera organizada en una hoja de papel negro grueso.
- Etiquete junto a la médula espinal con un bolígrafo blanco para facilitar su identificación.
- Deje espacio en las esquinas y en el centro del papel negro para colocar pilas de tres portaobjetos de microscopio que actúen como espaciadores para evitar la compresión de la médula espinal cuando el casete ARG está cerrado. Usa de 5 a 7 acumulaciones.
- Una vez que todas las médulas espinales lumbares y cervicales/torácicas estén colocadas en el papel negro y etiquetadas, coloque con cuidado la hoja de papel en el casete ARG. Coloque el casete abierto en una bandeja de hielo seco para congelar la médula espinal.
- Una vez congeladas, coloque suavemente una envoltura de plástico entre la pantalla de almacenamiento de fósforo digital y la médula espinal y coloque la pantalla encima de las muestras. Cierre inmediatamente el casete y colóquelo en el congelador a -20 °C durante aproximadamente 10 semividas (~127 h).
- Cuando se complete el tiempo de exposición, escanee la película con un generador de imágenes de fósforo. Analice la imagen digital resultante (consulte la sección 12 para obtener instrucciones).
10. Análisis de los datos de biodistribución
- Configure una hoja de cálculo de "Corrección de dosis" para determinar matemáticamente la corrección temporal de la desintegración radiactiva, normalizando así las dosis de radiación y permitiendo comparaciones entre sujetos.
- Corrija todas las dosis hasta el momento de la inyección, teniendo en cuenta la actividad residual que queda en la jeringa y el catéter después de la inyección.
- Utilizando los estándares preparados en el paso 8.2, promedie la cantidad de actividad (μCi) y los recuentos normalizados por minuto (CPM). Divida el CPM promedio por la cantidad promedio de actividad estándar para obtener CPM/μCi.
NOTA: Asegúrese de que la cantidad de actividad para cada patrón esté corregida por decaimiento hasta el momento en que el contador gamma cuenta el CPM de los estándares. El contador gamma debe normalizar todos los valores de CPM a la hora de inicio del protocolo.
- Configure la hoja de cálculo "Resultados" para calcular el porcentaje final de dosis inyectada por gramo de tejido (%ID/g) para cada muestra.
- Corrija la disminución del CPM normalizado desde el contador gamma para cada muestra contada hasta el momento de la inyección del animal.
NOTA: La corrección de decaimiento puede ser en cualquier punto de tiempo; asegúrese de que todas las dosis y los valores de CPM se corrijan en función de la disminución en el mismo punto de tiempo. - Normalice el CPM corregido por decaimiento a la masa de cada muestra para determinar el CPM por muestra. Calcule el CPM total inyectado restando el CPM en la cola del CPM inyectado calculado.
NOTA: No es necesario corregir la masa de la cola, ya que este valor de CPM simplemente se restará del CPM total inyectado para tener en cuenta cualquier marcador extravenoso de la inyección. - Divida el CPM por masa por el CPM total inyectado para calcular %ID/g.
- Corrija la disminución del CPM normalizado desde el contador gamma para cada muestra contada hasta el momento de la inyección del animal.
- Configure una hoja de cálculo de "Resumen" para mostrar los resultados finales para ingresarlos en un software de gráficos y la posterior visualización de datos y análisis estadístico.
11. Análisis de imágenes PET
- Abra el software de análisis PET. lick on File |Datos Locales Abiertos | DICOM. Localice el archivo deseado (formato DICOM). Abra tanto la PET como la TC.
- En el Administrador de datos, ajuste el contraste de PET y CT a los niveles deseados.
- Registre y recorte ratones individuales.
- En el menú de navegación , seleccione la pestaña Reorientación/Registro .
- Ve al menú Rígido dentro de esta pestaña. Designe la tomografía computarizada (0 ) como la exploración fija y la exploración PET (1) como la exploración en movimiento .
- Seleccione Transformación rígida y calidad rápida . Haga clic en Registrarse.
- Una vez completado el registro (5-10 min), haga clic en la marca de verificación para guardar el registro.
- Inspeccione visualmente los datos para asegurarse de que el registro se haya realizado correctamente. Exporte la sesión haciendo clic en Archivo | Sesión | Exportación.
- A continuación, recorta cada ratón en un recorte de cuerpo completo: ve al menú de navegación y haz clic en Recortar. Arrastre los lados de cada sección transversal desde el borde exterior hacia adentro.
- Una vez que el mouse deseado esté bien recortado, haga clic en la marca de verificación y exporte la sesión para guardarla.
- A continuación, recorte y enderece las cabezas de cada ratón para el análisis del cerebro utilizando el manual Traducción, Rotaciones y Volteos en el menú Registro/Reorientación . Exporte para guardar.
- Analiza la médula espinal.
- Para comenzar el análisis de las regiones de interés (ROI) en la médula espinal, abra la herramienta ROI 3D desde el menú de navegación .
- Debajo del encabezado ROIs, use el signo más en la parte inferior del menú para crear seis ROIs: ROI lumbar, ROI cervical/torácico, Esqueleto lumbar, Esqueleto torácico, Médula espinal lumbar, Médula espinal torácica.
NOTA: Las ROI lumbares y cervicales/torácicas son ROI grandes generalizadas que se utilizarán para crear las ROI del esqueleto (Figura 4). - Para evitar la interferencia visual de la señal PET con este paso, haga clic en F3 para apagar el PET.
- Vaya a la parte superior del operador de herramientas de ROI 3D. Haga clic en el punto sólido a la derecha del símbolo del cursor para abrir el menú Modo de pintura 3D y Erosionar/Dilatar .
- Seleccione Esfera y cambie el tamaño a 20 píxeles. Establece Dilatar en +5.
- Antes de continuar, vaya a la parte inferior del menú. Asegúrese de que el ROI lumbar esté seleccionado, ya que este es el primer ROI que se extrae.
- En la tomografía computarizada, busque la vértebra L6 de la columna vertebral (donde la columna vertebral se une con las caderas). Comenzando una vértebra por encima de L6, dibuja un ROI lumbar aproximado sobre las cinco vértebras por encima de las caderas (vértebras L1-L5). A continuación, cambie a ROI cervical/torácico y trace el resto de la columna vertebral hasta la base del cráneo.
NOTA: Esto no tiene que ser preciso, ya que se utiliza para indicar dónde debe ocurrir el umbral Otsu en el paso 11.4.8. - Después de dibujar los ROI generalizados, vaya a la parte superior del operador. Seleccione el menú Algoritmos de segmentación .
- En el menú desplegable, seleccione Umbral de Otsu. Para la entrada, seleccione ROI lumbar. En la parte inferior del menú, asegúrese de que Esqueleto lumbar esté seleccionado. En el menú desplegable junto a Imagen, asegúrese de que la tomografía computarizada esté seleccionada y haga clic en Aplicar. Repita el procedimiento para el ROI cervical/torácico y el esqueleto torácico.
- Si el umbral de Otsu no resalta lo suficiente la columna vertebral, utilice el umbral global y cambie el valor mínimo a 350 y el máximo a 3.500 para el umbral manual y ajústelo según sea necesario para aislar las vértebras.
- Después de usar Otsu Thresholding para crear los ROI de esqueleto, regrese al menú de navegación (icono de cursor). Elimine o marque la columna H (ocultar) para los ROI lumbar y cervical/torácico aproximados para ocultarlos. Marque la columna I (inmutable) para ambos ROI de esqueleto para que no se puedan editar.
- Por último, vuelve a la parte superior del Operador de la herramienta ROI 3D y ve al menú Pintura 3D para dibujar los ROI de la médula espinal.
- Vuelva a seleccionar la herramienta Esfera y trace la médula espinal dentro del esqueleto tanto para lumbar como para torácico, asegurándose de seleccionar el ROI correcto en la parte inferior del menú.
- Para borrar cualquier ROI, haga clic en Comando/Control y dibuje sobre la parte que se va a borrar.
- Verifique el ROI de la médula espinal desde los tres planos para asegurarse de que no haya ROI extraído fuera de la columna vertebral.
- Exporte los resultados del análisis de la médula espinal.
- Si la señal PET se desactivó en el paso 11.4.3, presione F3 después de que se dibujen los ROI de la médula espinal para volver a encender el PET, o seleccione el controlador visual (VC) y haga clic en la barra PET.
- Vuelva al menú de navegación (icono del cursor). Haga clic en el icono de la cuadrícula para mostrar la tabla. Copie la tabla en un software de hoja de cálculo y guárdela.
- Por último, exporte el archivo en el software de análisis PET, como se describió anteriormente, para guardar los ROI dibujados.
- Analice el cerebro utilizando un atlas 3D semiautomatizado.
- Abra el archivo de recorte de cabeza. Importe el atlas del cerebro del ratón yendo al menú Módulos avanzados y seleccionando la herramienta Atlas del cerebro 3D. Asegúrese de que la referencia esté establecida en CT y que la opción de recorte esté desactivada. Establezca una ruta para el directorio de salida.
- En Configuración avanzada, cambie Transformar a Versor-Affine. Mantenga todas las demás configuraciones predeterminadas. Haga clic en Ejecutar.
- Ajuste manualmente el atlas en el menú Reorientación/Registro y utilice la TC del cráneo como guía para ajustar el atlas.
- Tenga mucho cuidado si es necesario desescalar, ya que esto puede afectar en gran medida los volúmenes de la estructura cerebral. Haga clic en la marca de verificación cuando se complete el ajuste.
- Vuelva a ejecutar el atlas con la opción Importar ROI 3D seleccionada.
- Exporte el archivo para guardar el atlas instalado en el cabezal recortado.
- Después de dibujar y exportar todas las ROI de los órganos deseados, calcule un valor de corrección de encuadernación estándar. Corrija todos los datos y conviértalos a %ID/g como se describió anteriormente6. Normalizar al órgano que se adapte al modelo animal, como el corazón para normalizar a la radiosonda presente en el charco sanguíneo.
12. Análisis de autorradiografía ex vivo
- Abra el archivo de imagen digital (.gel) con el software de análisis de imágenes. Ajuste el brillo y el contraste al umbral deseado. Aplique una tabla de búsqueda de color adecuada si lo desea.
NOTA: Se recomienda Royal o Grays para facilitar la visualización.
Resultados
El hCD19-mAb fue conjugado con DOTA y radiomarcado con 64Cu como se muestra en la Figura 2. Los ratones EAE y los ratones naïve se sometieron a la exploración PET/TC (Figura 3) 18-24 h después de la inyección con 64Cu-DOTA-hCD19-mAb. Las imágenes PET/CT se registraron conjuntamente utilizando el software de análisis PET, y los tejidos del SNC se analizaron utilizando ROI manuales o un atlas cerebral 3D semiautomatizado. La unión de radiotrazadores en ROIs (Figura 4) fue mayor en ratones EAE que en ratones naïve. El recuento gamma ex vivo y el ARG mostraron un aumento de la unión en la médula espinal (segmentos torácicos lumbares y cervicales) y en el cerebro (solo ARG) de los ratones EAE en comparación con los naïve (Figura 5 y Figura 6). El recuento gamma ex vivo de ratones perfundidos también mostró una disminución de la unión de radiotrazadores en órganos periféricos, incluidos el bazo, el fémur y la médula ósea (Figura 5), lo que es consistente con que las células B abandonan la periferia e infiltran el SNC en este modelo EAE.
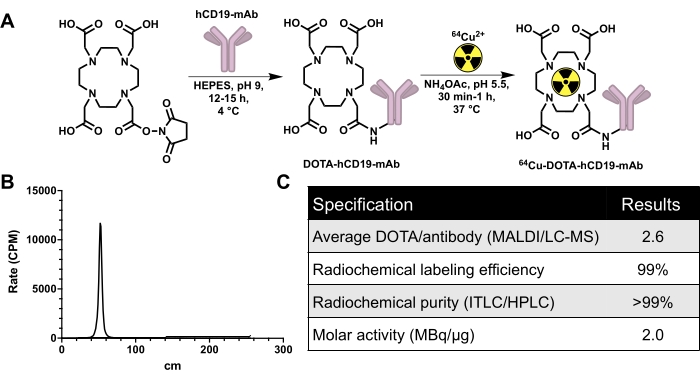
Figura 2: Esquema de conjugación y radiomarcaje para generar 64 anticuerpos monoclonales CD19 específicos para humanos marcados con Cu, 16C4-TM mAb (64Cu-DOTA-hCD19-mAb), además de datos de control de calidad. (A) Reacción del éster DOTA-NHS con el anticuerpo monoclonal hCD19 para producir el conjugado hCD19-DOTA (no a escala) y el radiomarcaje con 64 Cu-CuCl3 para producir 64Cu-DOTA-hCD19-mAb. (B) Cromatógrafo ITLC representativo. El pico a los 40-60 cm es el anticuerpo radiomarcado; El 64Cu-CuCl3 sin consolidar se desplaza con la fase móvil y estaría presente de 200 a 240 cm. No hay 64Cu-CuCl3 libre detectable en este cromatógrafo. (C) Las especificaciones de control de calidad del anticuerpo radiomarcado. Abreviaturas: éster DOTA-NHS = éster mono-N-hidroxisuccinimida del ácido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacético; ITLC/HPLC = cromatografía instantánea en capa fina/cromatografía líquida de alta resolución; MALDI/LC-MS = desorción/ionización/cromatografía líquida-espectrometría de masas por láser asistida por matriz; CPM = recuentos por minuto. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Fotografías que demuestran cómo asegurar ratones en una cama impresa en 3D dentro del escáner PET para permitir imágenes de alta calidad de la médula espinal y el cerebro mientras se minimiza el movimiento. (A) Cama de escáner de cuatro ratones impresa en 3D (también conocida como "hotel de ratones") equipada con elementos calefactores y tubos de anestesia. (B) Ratones anestesiados en posición supina para maximizar la rectitud de la columna vertebral; Se registra la posición de la cama de cada ratón. (C) Ratones pegados con cinta adhesiva a través de la cabeza para minimizar el movimiento en el cerebro y a través del vientre para minimizar el movimiento de la respiración, sin afectar la respiración. (D) Cama de ratón colocada dentro del escáner y pegada con cinta adhesiva a la base de escaneo. Los tubos de anestesia se conectaron del escáner a la cama y el isoflurano se ajustó al 2%. Se monitorizó la respiración de los ratones para garantizar un nivel adecuado de isoflurano antes de cerrar la puerta del escáner. Abreviatura: PET = Tomografía por emisión de positrones. Haga clic aquí para ver una versión más grande de esta figura.
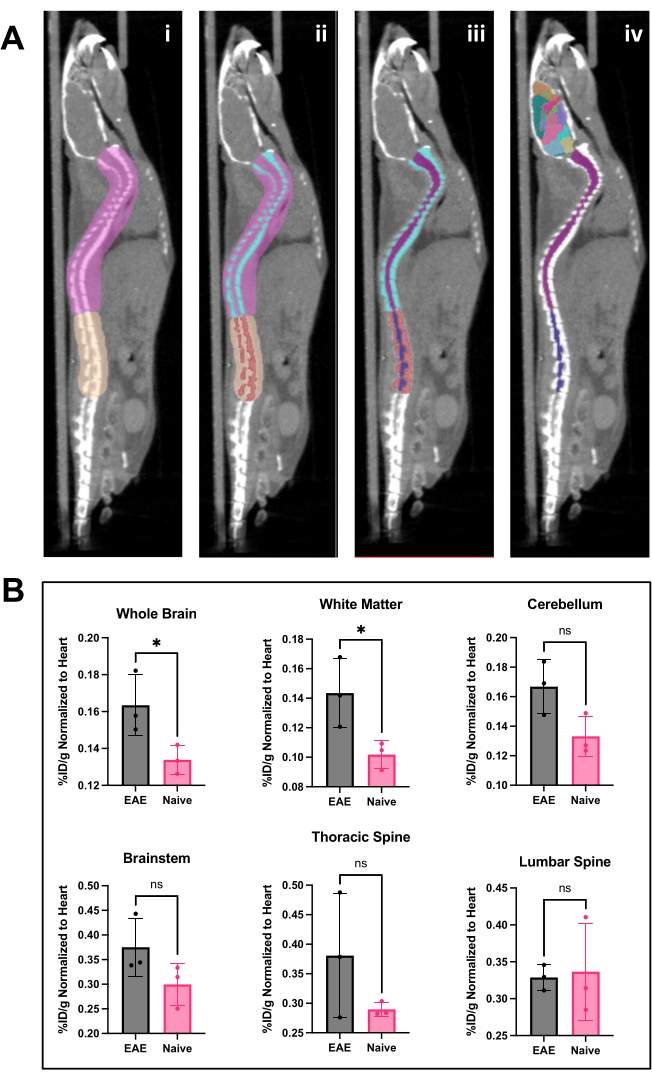
Figura 4: Imagen de la médula espinal y análisis cerebral y resultados utilizando el software de análisis PET . (A) i) ROI (rosa y bronceado ) dibujados en la columna vertebral para separar las vértebras lumbares de las torácicas y cervicales y preparar la imagen para el umbral de Otsu. ii ) Las vértebras de la columna vertebral (turquesa y rojo) se segmentaron mediante el umbral de Otsu. iii ) Las vértebras se hicieron inmutables en el menú 3D ROI, y la médula espinal se dividió en ROI cervical/torácica (púrpura) y lumbar (azul marino). iv) Se eliminó la ROI vertebral, quedando aplicadas las ROI de la médula espinal y el atlas cerebral representativo. (B) Análisis representativo de los resultados de la PET de varias regiones del SNC representadas como %ID/g normalizado al ROI del corazón dentro de cada animal. La adquisición de PET fue una exploración estática de 10 minutos a través de imágenes PET/CT. Regiones cerebrales cuantificadas utilizando un enfoque de atlas cerebral semiautomatizado, que se muestra en el panel A. iv) Los resultados representativos muestran una significación o una tendencia hacia un aumento significativo en la unión de trazadores en el cerebro y la médula espinal torácica. Estadística realizada mediante la prueba t de Student (*: p < 0,0332). Abreviaturas: PET = Tomografía por emisión de positrones; ROI = regiones de interés; SNC = sistema nervioso central; TC = tomografía computarizada; %ID/g = porcentaje de dosis inyectada por gramo de tejido; EAE = encefalomielitis autoinmune experimental. Haga clic aquí para ver una versión más grande de esta figura.
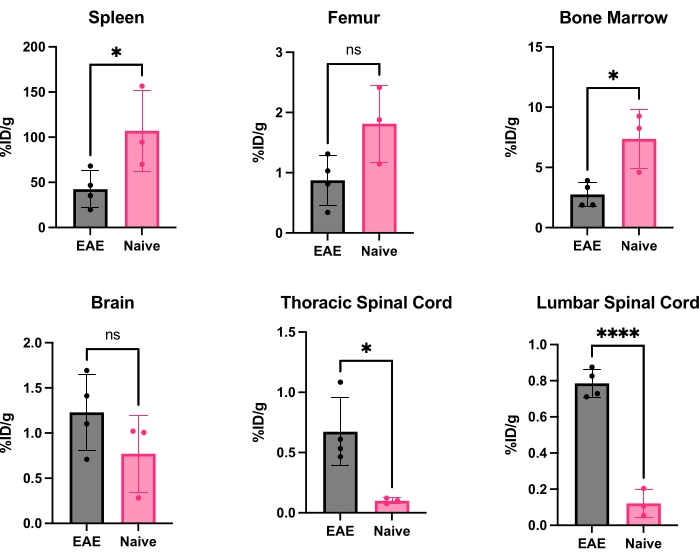
Figura 5: Cuantificación representativa del recuento gamma ex vivo en varios órganos en ratones EAE y naïve expresado como %ID/g. Después de la tomografía por emisión de positrones, los ratones se perfundieron con PBS para eliminar la radiosonda presente en la sangre, ya sea libre o unida a las células B CD19+ residentes en la sangre, y los órganos se diseccionaron y pesaron rápidamente para tener un peso exacto de cada órgano. La unión al trazador está significativamente disminuida en el bazo y la médula ósea en los ratones EAE en comparación con los naïve. Se observa un aumento de la unión de radiotrazadores tanto en los segmentos lumbares como en los cervicales/torácicos de la médula espinal de los ratones EAE. El cerebro no muestra un aumento significativo en la señal de la radiosonda, aunque tiende a un aumento significativo. Estadística realizada mediante la prueba t de Student (*: p < 0,0332; ****: p < 0,0001). Abreviaturas: PET = Tomografía por emisión de positrones; %ID/g = porcentaje de dosis inyectada por gramo de tejido; EAE = encefalomielitis autoinmune experimental; PBS = solución salina tamponada con fosfato. Haga clic aquí para ver una versión más grande de esta figura.
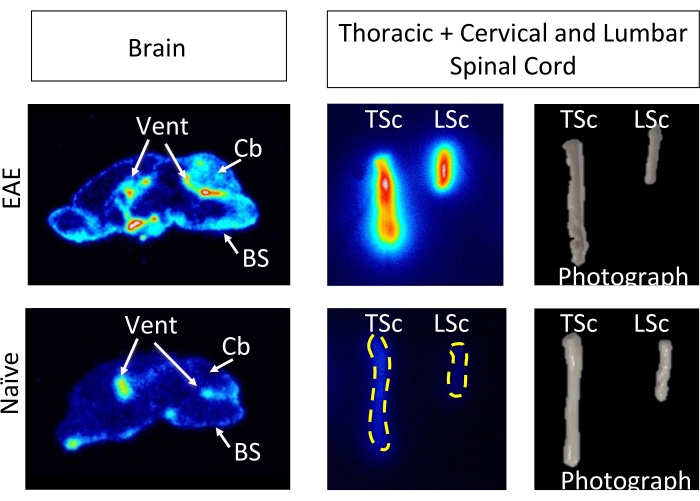
Figura 6: Las imágenes de ARG ex vivo muestran la unión de 64Cu-DOTA-hCD19-mAb en secciones cerebrales sagitales y médula espinal completa de EAE en comparación con ratones naïve. Las películas digitales de almacenamiento de fósforo se escanearon con un generador de imágenes de fósforo después de haber sido expuestas a muestras de tejido radiactivo durante aproximadamente 10 vidas medias (127 h o 5 días). Las imágenes resultantes revelan una señal visualmente mayor en el cerebro de los ratones EAE en comparación con las secciones cerebrales de los ratones naïve, lo que es esperable debido a las regiones que se sabe que contienen células B en este modelo5. En concreto, hay un aumento de la señal trazadora en el tronco encefálico, el cerebelo y los ventrículos de las secciones cerebrales de ratón EAE. Este aumento en la señal para las secciones cerebrales de ratón EAE refleja lo que se encontró en la cuantificación PET de todo el cerebro detallada anteriormente. Del mismo modo, hay un aumento en la unión de radiotrazadores en los segmentos de la médula espinal cervical/torácica y lumbar en comparación con la médula espinal ingenua, lo que refleja lo que se encontró utilizando el recuento gamma ex vivo . Abreviaturas: PET = Tomografía por emisión de positrones; EAE = encefalomielitis autoinmune experimental; Cloaca = ventrículos; Cb = cerebelo; BS = tronco encefálico; TSc = médula espinal torácica y cervical combinadas; LSc = médula espinal lumbar. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria S1: Tinción de tejidos del SNC de tejido cerebral de ratón naïve y EAE con CD45R/B220. Las células B se observan en el tronco encefálico, las meninges y la sustancia blanca de ratones EAE (n = 7 EAE, n = 5 ratones ingenuos, con un promedio de cuatro cortes por animal). Esta cifra es de 5. Barras de escala = 5 mm (aumento bajo [1x]) en imágenes cerebrales sagitales, 100 μm (aumento alto [20x]) en tronco encefálico, meninges y sustancia blanca cerebelosa. Haga clic aquí para descargar este archivo.
Discusión
En este artículo se describe un método simplificado para obtener imágenes de células B CD19+ humanas en un modelo de ratón de EM utilizando CD19-PET. Debido a la presentación heterogénea de la EM y a las diferentes respuestas a los tratamientos, su manejo en la clínica puede ser un reto y se necesitan nuevos enfoques para la selección y el seguimiento de la terapia. Las imágenes PET podrían servir como una herramienta poderosa para monitorear la progresión de la enfermedad y la respuesta individual a la terapia de agotamiento de células B. Además de la esclerosis múltiple, las imágenes por TEP-CD19 podrían utilizarse para controlar la depleción de células B después del tratamiento en subtipos de linfomas y leucemia u otras enfermedades mediadas por células B. Este protocolo y datos representativos muestran la utilidad de la obtención de imágenes de células B en enfermedades neurológicas.
Para estudiar los linfocitos B CD19+ humanos en el contexto de la EM, elegimosel modelo 7 de EAE MOG1-125 dependiente de linfocitos B. Al igual que otros modelos EAE, este modelo presenta síntomas de parálisis progresiva e infiltración de células inmunitarias en el SNC. Sin embargo, el modelo MOG1-125 es único en el sentido de que es un modelo impulsado por células B: los ratones contienen un número variable de células B en el espacio subaracnoideo de las meninges, el tronco encefálico, el parénquima y los ventrículos. Estos linfocitos pueden estar escasamente dispersos a lo largo de estas regiones y/o formar estructuras similares a folículos, que también se observan en humanos con EM 8,9. Además de utilizar ratones ingenuos como controles, se puede utilizar un kit completo de inducción solo con adyuvante de Freund (CFA) (es decir, una emulsión de inducción idéntica a la que se administra a los ratones EAE sin la proteína MOG). En el modelo de ratón EAE, la barrera hematoencefálica (BHE) es disfuncional y permite que entidades más grandes, como los anticuerpos, se crucen. La radiosonda CD19-mAb solo se unirá y permanecerá en el SNC si hay células B presentes; el marcador circulará de nuevo hacia el depósito de sangre si las células B no están presentes. Lo hemos demostrado mediante el recuento gamma y la autorradiografía ex vivo de los tejidos del SNC mediante perfusión antes de medir los niveles de radiactividad en los tejidos. También hemos demostrado esto en publicaciones anteriores que informan sobre el uso de radiotrazadores PET basados en mAb (es decir, enfoques de imagen inmunoPET) para detectar células B en el SNC 1,2.
El quelante DOTA se utilizó ya que se ha utilizado en imágenes PET clínicas con péptidos y anticuerpos marcados con cobre-64, y nuestro objetivo es traducir el hCD19-mAb para la imagen clínica de pacientes con EM. DOTA tiene una afinidad de unión adecuada al cobre-64 in vivo. La estabilidad in vivo es muy importante porque el 64Cu libre va al hígado y puede oscurecer la señal de la radiosonda unida; Por lo tanto, es importante medir la señal en el hígado para calcular la señal relativa en comparación con otros órganos. Por lo general, el músculo se toma como tejido de control, pero en el caso de EAE, puede haber inflamación presente en los músculos. La vida media de 64Cu es de 12,7 h, lo que proporciona tiempo suficiente para que el DOTA-hCD19-mAb se una a su objetivo, al tiempo que garantiza que la señal pueda medirse mediante PET. Al preparar el conjugado, se deben realizar reacciones de prueba a pequeña escala (75-125 μg) para determinar la cantidad de DOTA que se debe agregar al AcM para producir la relación DOTA/AcM deseada (p. ej., una reacción de 6-10 veces el exceso de éster de DOTA-NHS por mol de AcM puede proporcionar un conjugado de 1-2 DOTA/AcM). El tiempo de reacción y la temperatura (por ejemplo, 2-4 h o toda la noche a 4 °C o temperatura ambiente) también influyen en la relación DOTA/mAb y deben optimizarse. Se puede realizar una valoración con cobre no radiactivo para calcular el número de DOTAs por mAb; sin embargo, recomendamos realizar MALDI-MS y/o LC-MS para obtener resultados más fiables y precisos.
La relación DOTA/mAb calculada es un valor promedio para una muestra en particular y se espera cierta variación. En el caso de MALDI, se toman varias inyecciones por muestra para los anticuerpos monoclonales conjugados y no conjugados. A continuación, calculamos la relación entre conjugados y no conjugados para determinar el número medio de DOTA/mAb. La relación DOTA/mAb es importante porque demasiados quelantes interrumpirán la unión de anticuerpos y muy pocos darán lugar a un radiomarcaje inconsistente y a una señal baja. La relación debe ser muy estrecha entre los lotes de conjugados para mantener una intensidad de señal y una cinética de unión constantes; Idealmente, se debe usar el mismo lote de conjugado para todos los experimentos dentro de un estudio en particular. Una técnica prometedora para reducir los posibles efectos sobre la inmunorreactividad debido a una posible sobreconjugación es el uso de la conjugación específica del sitio10 , en la que la conjugación del quelante es selectiva del sitio en los glicanos de cadena pesada del anticuerpo, garantizando así la adición de 1 quelante por mAb.
Las condiciones de la reacción de radiomarcaje deben optimizarse para garantizar la máxima eficiencia y rendimiento de marcado, ya que las diferencias en los anticuerpos, la relación DOTA/mAb y la actividad molar de 64Cu, entre otras condiciones, afectarán al radiomarcado. El uso de la relación óptima de conjugado de 64Cu a mAb puede permitir que el radiotrazador se utilice sin purificación, lo que reduce el tiempo necesario para el radiomarcaje y la pérdida debida a la columna de flujo por gravedad y la desintegración radiactiva. También se puede lograr una actividad molar consistente y confiable cuando se utiliza la misma proporción conjugada de 64Cu a mAb, lo cual es especialmente importante cuando se comparan los resultados en múltiples cohortes de ratones o estudios de imagen. Las condiciones de ITLC también pueden ser modificadas para adaptarse a cada usuario. Si es necesaria la purificación, se debe guardar una alícuota para la espectrofotometría por HPLC y/o UV/Vis, de modo que se pueda calcular la actividad molar.
Es importante tener en cuenta que el uso de anticuerpos radiomarcados para la obtención de imágenes puede ser un desafío. Es esencial que el anticuerpo utilizado para la radiosonda sea biológicamente inerte para no tener un efecto fisiológico. Además, dado que los anticuerpos tienen una larga residencia en la sangre, se debe esperar el tiempo suficiente para la circulación, la unión y la eliminación de un mAb determinado para garantizar una señal de fondo adecuada sin comprometer la calidad de la imagen. Por lo general, es suficiente esperar de 20 a 48 h para un mAb marcado con 64 Cu, pero se deben obtener imágenes a las 2, 4, 6, 12, 24, 48 h después de la inyección cuando se evalúa un nuevo trazador PET de mAb para determinar el mejor momento para obtener imágenes en un modelo de roedor determinado. Lo mismo ocurre con la adquisición de imágenes ARG con la mayor relación señal-fondo. Las imágenes representativas de este protocolo se tomaron a las 18-20 h después de la inyección, aunque se pueden utilizar otros puntos de tiempo dependiendo del radioisótopo utilizado. Diferentes anticuerpos que se unen a diferentes epítopos de CD19 producirán resultados variables y deben caracterizarse rigurosamente.
Al analizar la señal de la médula espinal, es importante colocar a los ratones boca arriba en la cama de exploración para reducir el movimiento causado por la respiración. Además, la colocación en decúbito supino puede ayudar a enderezar la columna vertebral en ratones que tienen una mayor curvatura de la columna vertebral debido a la progresión de la enfermedad EAE. Otro aspecto importante a tener en cuenta cuando se trata de detectar señales en la columna vertebral y la médula espinal es evitar inyectar MOG1-125 en el flanco, ya que los sitios de inyección pueden unirse al trazador debido a la respuesta inmunitaria asociada en esas áreas. La proximidad del lugar de la inyección puede interferir con el análisis de la médula espinal; Por lo tanto, las inyecciones en el pecho son preferibles para la aplicación descrita en este documento.
Las técnicas de análisis de imágenes utilizadas son específicas para la obtención de imágenes del SNC. Una herramienta de atlas cerebral dentro del software de análisis de imágenes proporciona resultados reproducibles y fiables siempre que el registro de PET y CT sea preciso. El uso del atlas cerebral 3D semiautomatizado y su ajuste para que se ajuste al cráneo de cada ratón permite obtener un retorno de la inversión consistente entre los animales. Dado que actualmente no existe un enfoque automatizado o semiautomatizado para analizar la señal en la médula espinal, se deben trazar ROI manuales. En particular, al cuantificar las células B CD19+ (o cualquier tipo de célula presente tanto en la médula ósea como en la médula espinal), es fundamental eliminar la señal que surge de la columna vertebral y la médula ósea tanto como sea posible. La razón de esto es que se sabe que los ratones naïve contienen más células B CD19+ en su médula ósea que los ratones EAE, en los que las células B abandonan la periferia para infiltrarse en el SNC 5,11. Esta señal de la médula ósea puede oscurecer la verdadera señal en la médula espinal.
Para delinear la verdadera señal de la médula espinal y minimizar la contribución de la señal de la columna vertebral y la médula ósea, se puede utilizar el umbral Otsu de la imagen de TC para hacer un ROI inmutable para la columna vertebral. A continuación, se puede dibujar fácilmente una ROI separada de la médula espinal dentro de la columna vertebral. La misma técnica también se puede aplicar para medir la médula ósea en el fémur. Este es un método muy útil para obtener información sobre la unión de los trazadores en la médula espinal. Sin embargo, debido a la resolución espacial relativamente baja de la PET y a los problemas relacionados con el efecto de volumen parcial al explorar pequeñas regiones anatómicas de ratones, el uso de técnicas adicionales de confirmación ex vivo (p. ej., recuento gamma, ARG) permite la validación de la unión de radiotrazadores en la médula espinal sin la presencia de sangre, líquido cefalorraquídeo o señal de derrame de la columna vertebral.
La señal en la médula espinal cervical/torácica tiende a variar en los ratones EAE dependiendo de la gravedad de la enfermedad y de la cantidad de células B que se infiltran durante la respuesta inmunitaria adaptativa. Esta variación en el número de linfocitos B que se infiltran, así como la pequeña cantidad de linfocitos B en el SNC en comparación con los de la médula ósea pélvica/espinal de ratones naïve, puede hacer que la cuantificación in vivo del tejido de la médula espinal sea un desafío en ratones. Dada la resolución espacial de la PET en imágenes de animales pequeños, la señal de la médula ósea puede extenderse a la señal de la médula espinal. La biodistribución ex vivo y la autorradiografía completadas aquí ayudan a validar la señal PET de las vértebras frente al tejido de la médula espinal. Los ratones se perfunden antes de la disección para eliminar cualquier marcador no unido en el depósito de sangre, de modo que los resultados del recuento gamma y la autorradiografía reflejen el marcador que realmente está unido en cada órgano en lugar del marcador que está en el depósito de sangre en ese órgano.
Las radiosondas circulan a través de la sangre, y con los trazadores de anticuerpos, específicamente, a menudo hay radiosondas no unidas presentes en la sangre durante semanas después de la inyección inicial. Dado que estamos tomando imágenes del cerebro y la médula espinal, que tienen muchos vasos sanguíneos, es importante comprender qué parte de la señal se debe realmente a la unión del marcador en el cerebro/tejido de interés en comparación con la presente en la reserva de sangre. Por lo tanto, es necesario dividir la señal cerebral por señal en el corazón/piscina de sangre. En el ámbito clínico, se pueden utilizar las mismas técnicas de análisis de imágenes de umbral de Otsu de vértebras y ROI de tejidos de la médula espinal para la cuantificación. Dados los mayores volúmenes de tejido en humanos en comparación con los ratones, debería haber un impacto significativamente menor de los efectos de volumen parcial, lo que llevaría a una mayor precisión y anularía la necesidad de técnicas ex vivo para confirmar los hallazgos in vivo . El uso de PET en la clínica permitirá a los médicos personalizar la terapia para cada paciente en función de su carga individual de células B.
El ARG es particularmente útil para adquirir imágenes de alta resolución que permitan una delineación más precisa de la ubicación espacial de la unión de trazadores en regiones pequeñas como el tronco encefálico y el cerebelo. Las mismas secciones y/o secciones adyacentes se pueden guardar para tinciones inmunohistoquímicas para confirmar la presencia de células B. Previamente hemos teñido tejidos del SNC con CD45R/B220 (Figura suplementaria S1) para correlacionar el número de linfocitos B con la señal PET y ARG 5,9. A continuación, la tinción se puede comparar espacialmente con los resultados del ARG para verificar que la señal del radiotrazador coincide con el patrón de tinción. Las células B pueden estar presentes en grupos o de forma difusa en todo el tronco encefálico; La sensibilidad de la PET es lo suficientemente alta como para medir la señal, lo que es alentador para la traslación clínica. En el caso de la ARG de la médula espinal, la extracción de la médula espinal de las vértebras garantiza que la señal medida se deba a la unión del marcador en el tejido de la médula espinal en lugar de en la médula ósea y/o la sangre, lo que puede oscurecer las imágenes de la PET debido a los efectos parciales del volumen.
Al igual que el ARG, el recuento gamma ex vivo permite la cuantificación de la señal radiactiva en órganos individuales. Para esta técnica en particular, es importante medir el peso húmedo de los tejidos y asegurarse de que estén en el fondo de sus respectivos tubos antes de colocar los tubos en el contador gamma. Los tubos deben estar etiquetados con el número de ratón y el tejido, de modo que se utilice el tubo correcto; A continuación, el tubo se pesa en una balanza calibrada y se insertan los órganos con una precisión de una décima parte de microgramo (0,0001 mg). Algunos tejidos son extremadamente pequeños y la diferencia en la masa del tubo antes y después será del orden de 0,0001 mg. Los tejidos deben pesarse inmediatamente después de la disección para evitar la pérdida de humedad, lo que resulta en una masa más baja. Después del pesaje, los tubos del cerebro y la médula espinal deben llenarse con PBS para evitar que se sequen antes de congelar estos tejidos para la ARG.
Divulgaciones
El anticuerpo CD19 fue proporcionado por Horizon Therapeutics.
Agradecimientos
Estamos agradecidos por el apoyo de la instalación de imágenes de animales pequeños SCi3 en Stanford y al Dr. Frezghi Habte por su asistencia técnica con la PET/CT. La LC-MS es realizada por el personal central de la instalación central de Espectrometría de Masas de la Universidad de Stanford (SUMS) y agradecemos al personal por brindar este servicio. Agradecemos a Horizon Therapeutics por proporcionar muy amablemente el hCD19-mAb y a Jodi Karnell en particular por su orientación y apoyo técnico. Este trabajo fue financiado por el NIH NINDS (1 R01 NS114220-01A1).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5 mL 50 kDa MWCO Centrifugal filter | MiliporeSigma | UFC505008 | centrifugal filter |
| 64Cu-CuCl3 | Washington University in St. Louis; University of Wisonsin, Madison; or another vendor | ||
| AR-2000 Radio-TLC Imaging Scanner | Eckert & Ziegler | AR-2000 | |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 x 25 cm, screen only |
| Butterfly Needle Catheter | SAI Infusion Technologies | BLF-24 | |
| DOTA-NHS-ester | Macrocyclics | B-280 | |
| EAE Induction Kit | Hooke Laboratories | EK-2160 | |
| Geiger Counter | Ludlum | 14C | |
| GNEXT PET/CT Scanner | Sofie | GNEXT | |
| Hidex Automatic Gamma Counter | Hidex | AMG | |
| HPLC Column | Phenomenex | 00H-2146-K0 | 5 μm SEC-s3000 400 Å, 300 x 7.8 mm |
| Illustra NAP-5 column | Cytiva | 17085301 | DNA gravity column |
| Image J | NIH | ARG analysis software | |
| Low Protein Binding Collection Tubes (1.5 mL) | Thermo Scientific | PI90410 | |
| NanoDrop Lite Spectrophotometer | Thermo Scientific | 840281400 | UV-Vis micro/nano-spectrophotometer |
| PCR tubes 0.2 mL, for DNA grade | Eppendorf | 30124707 | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| VivoQuant | Invicro | Version 4 Patch 3 | PET Analysis Software; must purchase brain atlas add-on |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | Thermo Scientific | PI89882 | Desalting column |
Referencias
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Karussis, D. The diagnosis of multiple sclerosis and the various related demyelinating syndromes: A critical review. Journal of Autoimmunity. 48-49, 134-142 (2014).
- Hauser, S. L., et al. B-cell depletion with Rituximab in relapsing-remitting multiple sclerosis. The New England Journal of Medicine. 358 (7), 676-688 (2008).
- Chen, D., Gallagher, S., Monson, N. L., Herbst, R., Wang, Y. Inebilizumab, a B cell-depleting anti-CD19 antibody for the treatment of autoimmune neurological diseases: Insights from preclinical studies. Journal of Clinical Medicine. 5 (12), 107(2016).
- Stevens, M. Y., et al. Development of a CD19 PET tracer for detecting B cells in a mouse model of multiple sclerosis. Journal of Neuroinflammation. 17 (1), 275(2020).
- Chaney, A. M., Johnson, E. M., Cropper, H. C., James, M. L. PET imaging of neuroinflammation using [11C]DPA-713 in a mouse model of ischemic stroke. Journal of Visualized Experiments. (136), e57243(2018).
- Lyons, J. -A., Ramsbottom, M. J., Cross, A. H. Critical role of antigen-specific antibody in experimental autoimmune encephalomyelitis induced by recombinant myelin oligodendrocyte glycoprotein. European Journal of Immunology. 32 (7), 1905-1913 (2002).
- Haugen, M., Frederiksen, J. L., Degn, M. B. cell follicle-like structures in multiple sclerosis-With focus on the role of B cell activating factor. Journal of Neuroimmunology. 273 (1-2), 1-7 (2014).
- James, M. L., et al. Imaging B cells in a mouse model of multiple sclerosis using 64Cu-Rituximab PET. Journal of Nuclear Medicine. 58 (11), 1845-1851 (2017).
- Zeglis, B. M., et al. An enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Lyons, J. -A., et al. B cells are critical to induction of experimental allergic encephalomyelitis by protein but not by a short encephalitogenic peptide. European Journal of Immunology. 29 (11), 3432-3439 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados