Method Article
양전자 방출 단층 촬영을 사용한 실험적 자가면역 뇌척수염 마우스 모델에서 CD19+ B 세포 이미징
요약
이 논문은 인간 특이적 항-CD19 단클론 항체를 방사선 표지하는 방법론과 생체 내 PET 이미징, 생체 외 감마 계수 및 자가 방사선 촬영 접근법을 사용하여 다발성 경화증 마우스 모델의 중추 신경계 및 말초 조직에서 B 세포를 정량화하는 데 사용하는 방법을 자세히 설명합니다.
초록
다발성 경화증(MS)은 젊은 성인에게 영향을 미치는 가장 흔한 탈수초성 중추신경계(CNS) 질환으로, 질병이 진행됨에 따라 종종 신경학적 결손과 장애를 초래합니다. B 림프구는 다발성경화증 병리학에서 복잡하고 중요한 역할을 하며 임상 시험에서 여러 치료제의 표적이 되고 있습니다. 현재로서는 특정 항-B 세포 치료에 대한 환자를 정확하게 선택하거나 이러한 치료가 중추신경계 및 말초 장기의 B 세포 부하에 미치는 영향을 비침습적으로 정량화할 수 있는 방법이 없습니다. 양전자 방출 단층 촬영(PET) 이미징은 생체 내 시공간 분포 및 살아있는 피험자에서 B 세포의 부담에 관한 매우 구체적이고 정량적인 정보를 제공할 수 있는 엄청난 잠재력을 가지고 있습니다.
이 논문은 인간 재조합 미엘린 희소돌기아교세포 당단백질 1-125로 유도되는 실험적 자가면역 뇌척수염(EAE)의 잘 확립된 MS의 잘 정립된 B 세포 기반 마우스 모델에서 인간 CD19+ B 세포에 특이적인 PET 추적자를 합성하고 사용하는 방법을 보고합니다. 여기에서는 in vivo PET 이미징을 사용하여 뇌와 척수에서 CD19+ B 세포를 검출하고 정량화하는 데 최적화된 기술을 설명합니다. 또한 이 논문은 중추신경계 조직에서 CD19 추적자 결합의 고해상도 자가방사선 촬영과 함께 골수, 척수 및 비장을 포함한 질병 관련 장기의 생체 외 감마 계수를 위한 간소화된 방법을 보고합니다.
서문
다발성경화증은 면역 매개 신경 장애입니다. 각 환자의 고유한 증상은 환자와 임상의의 관리를 어렵게 만들 수 있습니다1. 이 질환 자체는 뇌와 척수에 탈수초성 병변과 면역세포 침윤이 존재하여 신체적, 인지적 장애를 초래하는 것이 특징이다2. 다발성경화증이 T 세포 매개 질환이라는 전통적인 패러다임은 B 세포의 CD20+ 하위 집합을 표적으로 하는 치료제인 리툭시맙3의 획기적인 2상 임상 시험에서 처음으로 도전을 받았습니다. 이후 더 넓은 범위의 B 세포에서 발현되는 pan B 세포 바이오마커인 CD194를 표적으로 하는 추가 B 세포 치료법이 개발되었으며, 이는 진단 및 치료적으로 모두 유리할 수 있습니다. 더욱이, 치료 효능을 평가하기 위한 기존 방법(즉, 재발 횟수 및 자기공명영상(MRI) 활동 모니터링)은 반응의 조기 측정을 제공하지 못하므로 환자는 차선의 치료법 선택 및 최적화로 인해 중추신경계 손상의 상당한 위험에 처하게 됩니다. 따라서 다발성경화증 환자의 중추신경계와 말초에서 CD19+ B 세포와 같은 특정 면역 세포를 실시간으로 모니터링하기 위한 전략이 절실히 필요합니다.
PET 이미징은 CD19와 같은 특정 관심 대상의 생체 내 전신 시각화를 가능하게 하는 강력한 이미징 기술입니다. 채혈, 재발률 기록, MRI를 통한 병변 모니터링은 치료 효과에 대한 스냅샷을 제공하는 반면, PET 이미징을 통해 연구자와 임상의는 전신에 걸친 치료의 효과를 모니터링할 수 있습니다. 치료 모니터링에 대한 이러한 사전 예방적 접근 방식을 통해 임상의는 실시간으로 약물 효과를 평가하여 필요에 따라 신속하게 조정할 수 있습니다. 질병과 관련된 세포 집단의 위치와 밀도를 모니터링하면 환자별 해부학적 정보를 사용하여 중증도에 대한 종단적 평가도 가능합니다. 따라서 임상 및 전임상 환경에서 PET 이미징의 잠재력을 최대한 활용할 수 있도록 재현 가능한 분석 방법을 확립하는 것이 중요합니다.
이 논문은 인간 재조합 미엘린 희소돌기아교세포 당단백질 1-125(MOG 1-125)를 사용하여 인간 CD19(hCD19)를 발현하는 형질전환 마우스에서 유도된 MS의 실험적 자가면역 뇌척수염(EAE) 마우스 모델에서 16C4-TM(64 Cu-hCD19-mAb)으로 알려진 64Cu 표지 항인간 CD19 단클론 항체(mAb)를 사용하여 CD19+ B 세포의 PET 이미징, 체외 감마 계수 및 자가 방사선 촬영(ARG)을 수행하는 방법(그림1)을 설명합니다). 또한 뇌와 척수에서 방사성 추적자 결합을 정확하고 재현 가능하게 평가하는 방법을 제공하며, 이 두 가지 중요한 발병 부위는 이 모델과 다른 신경 퇴행성 모델에서 종종 심각하게 영향을 받습니다. 이러한 기술을 통해 질병 병리학에서 B 세포의 역할에 대한 비침습적 조사가 가능하며 다발성경화증에서 항 B 세포 치료제의 효능을 평가하기 위해 임상적으로 번역될 수 있습니다.
프로토콜
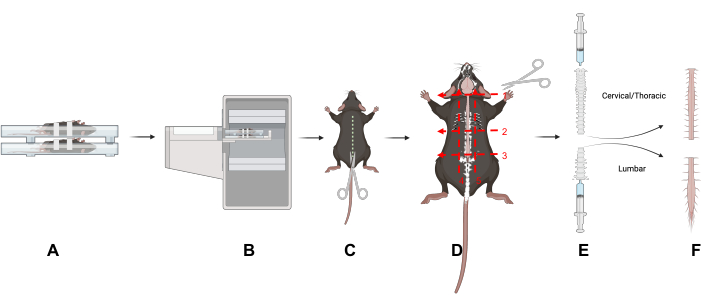
그림 1: 스터디 설계. 이 문서의 주요 기술에 대한 개요입니다. (A) 쥐를 스캐닝 베드에 등을 대고 눕히면 척추의 움직임이 줄어듭니다. (B) 마우스의 PET/CT 영상. (C) 동물의 등쪽을 절개하여 척추를 노출시킵니다. (D) 척추를 경추/흉추 및 요추 부분으로 이등분하고 표시된 5개의 절단 후 섹션을 제거합니다. (E) 주사기를 사용하여 주사기와 척추로 밀봉하고 그림과 같이 척추의 두개골과 꼬리 끝에서 씻어내어 척수에서 척수를 제거합니다. (F) 고립된 경추/흉부 및 요추 척수 분절. 약어: PET/CT = 양전자 방출 단층 촬영/컴퓨터 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
모든 동물 연구는 AAALAC International(Association for the Assessment and Accreditation of Laboratory Animal Care)의 인증을 받은 프로그램인 Stanford University의 Administrative Panel on Laboratory Animal Care(APLAC)에 따라 수행되었습니다. 생쥐는 스트레스가 EAE 유도에 영향을 미칠 수 있기 때문에 생쥐에 대한 스트레스를 최소화하기 위해 연구 시작 전 최소 7일 동안 비바리움에 적응했습니다.
1. 여성 인간화 CD19 마우스의 EAE 유도
- 앞서 설명한 바와 같이 EAE로 9-13주 된 인간화 CD19 C57BL/6J 암컷 마우스를 MOG1-125를 사용하여5로 유도합니다.
2. EAE 마우스 모델의 동물 관리 및 채점
- 앞서 설명한 대로 질병 진행 및 마우스 관리점수 매기기 5. 간단히 말해서, 이 모델을 1-5의 척도로 점수화합니다: 1은 꼬리 약화/절뚝거림, 2는 약해진 뒷다리, 3은 뒷다리 마비, 4는 앞다리 약화를 동반한 뒷다리 마비, 5는 사지 마비입니다.
3. mAb 접합, 방사선 표지 및 특성 분석
- 이중 기능 킬레이터 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid mono-N-hydroxysuccinimide ester (DOTA-NHS-ester)를 hCD19-mAb에 접합하여 64Cu로 방사선 표지합니다.
- 탈염 컬럼을 사용하여 hCD19-mAb 저장 버퍼를 HEPES 완충액(pH 8.5-9)으로 교체: 탈염 컬럼을 HEPES로 컨디셔닝합니다. 탈염 컬럼 시료 부피 용량 및 필요한 mAb 부피를 기준으로 필요한 컬럼 수 계산: 0.5mL 튜브: 30-130μL의 시료 부피, 300μL의 세척; 2 mL 튜브: 200-700 μL 시료 부피, 1 mL 세척.
- 탈염 컬럼을 통한 완충액 교환을 위해 원심분리기를 4°C로 냉각합니다.
- 냉장고에서 탈염 컬럼을 회수합니다. 탈염 컬럼의 바닥을 제거하고 캡을 풀고 컬럼을 수집 튜브에 넣습니다.
- 저장 용액을 제거하기 위해 1,500× g 에서 2분 동안 원심분리합니다. 저장 용액이 포함된 플로우스루를 폐기하고 수집 튜브를 재사용하십시오. 탈염 압축 수지의 가장 높은 지점이 위쪽으로 기울어진 기둥에 선을 표시합니다.
- 탈염 컬럼의 아래쪽에 HEPES 완충액을 추가합니다. 선이 바깥쪽을 향하도록 탈염 컬럼을 원심분리기에 놓습니다. 1,500× g 에서 2분 동안 회전합니다. 플로우스루를 버리고 수집 튜브를 재사용하십시오.
- 동일한 수집 튜브를 사용하여 3.1.4 및 3.1.5 단계를 2x 반복하고 단계 사이의 플로우스루를 버립니다.
- 조절된 탈염 컬럼을 새 수집 튜브와 라벨에 넣습니다. 이 튜브에는 hCD19-mAb가 들어 있습니다.
- 조절된 탈염 컬럼 상단에 hCD19-mAb를 추가하고 HEPES 완충액을 사용하여 빈 mAb 바이알을 헹굽니다. 이것을 탈염 컬럼의 상단에 추가합니다(제조업체의 권장 사항에 따른 총 부피). 1,500× g 에서 2분 동안 회전하여 hCD19-mAb를 용리합니다. hCD19-mAb가 포함된 플로우스루를 유지합니다.
- UV/Vis 분광광도계를 사용하여 hCD19-mAb의 농도를 측정하고 필요한 경우 HEPES 완충액을 사용하여 0.5μg/μL로 조정합니다.
- hCD19-mAb 용액에 mAb 용액 부피의 1/50 부피인 0.5M EDTA를 첨가하여 hCD19-mAb 용액에서 EDTA의 최종 농도를 0.01M으로 만듭니다. hCD19-mAb-EDTA 용액을 실온에서 15분 동안 그대로 둡니다.
- 냉동실에서 DOTA-NHS-에스테르를 꺼내 실온(10-15분)에 둡니다. 원하는 DOTA/mAb 몰비(일반적으로 1-2 DOTA/mAb 정도)를 추가할 수 있는 DOTA 농도를 만들기 위해 DOTA-NHS-에스테르에 추가할 DMSO의 부피를 계산합니다.
참고: hCD19-mAb에 첨가된 DMSO-DOTA-NHS-ester의 부피는 mAb 부피의 10%를 초과해서는 안 됩니다. 이 작업은 스프레드시트를 사용하여 수행해야 빠르고 반복적으로 수행할 수 있습니다. - 원하는 DOTA 대 hCD19-mAb 비율에 따라 hCD19-mAb에 추가할 DOTA-NHS-에스테르의 양을 계산합니다.
nmol mAb × 10 DOTA/mAb → nmol DOTA → → mg/mL DOTA/DMSO DMSO → mL DOTA/DMSO 용액의 → 희석 계수 - 1-2mg의 DOTA-NHS-에스테르를 칭량하고 DMSO의 정확한 부피(3.1.11단계에서 계산)를 DOTA-NHS-에스테르에 조심스럽게 첨가합니다. 혼합하고 스핀 다운하십시오.
- 계산된 DOTA-NHS-에스테르 용액(단계 3.1.12)을 hCD19-mAb 용액에 피펫팅합니다. 추가 DOTA-NHS-에스테르가 추가되지 않도록 추가하기 전에 피펫 팁의 외부를 닦으십시오(피펫의 양을 변경하지 않음). 부드럽게 섞고 아래로 돌립니다.
- 냉장고(4°C)에 넣어 하룻밤(12-16시간) 반응시킵니다.
- 정제 및 농축
- 원심 농축기 완충액 교환 단계를 위해 원심분리기를 4°C로 냉각합니다. 접합체를 스냅 동결하기 위해 드라이아이스 위에 금속 PCR 튜브 블록을 놓습니다.
- 냉장고에서 DOTA-hCD19-mAb 반응을 제거하고 생물학적 등급의 TRIS 완충액(총 반응 부피의 10%)을 추가하여 담금질합니다. 질량 분석 분석을 위해 샘플의 10-20 μg을 제거합니다.
- 0.1M 암모늄 아세테이트 완충액, pH 5.5를 사용하여 위에서 설명한 대로 탈염 컬럼을 컨디셔닝합니다(단계 3.1.1-3.1.5).
- 완충액을 DOTA-hCD19-mAb 용액을 암모늄 아세테이트로 교환합니다(단계 3.1.1-3.1.8).
- DOTA-hCD19-mAb 용액 농축: 부피에 대한 제조업체의 권장 사항에 따라 50kDa 분자량 차단 원심 농축기에 용액을 추가합니다. 4,000× g 에서 10분 동안(또는 부피가 80%-90% 감소할 때까지) 원심분리기; 플로우 스루를 폐기하십시오.
- 9회 더 반복(총 10회): 부피를 최대 권장 부피로 되돌리기 위해 충분한 아세트산 암모늄을 추가합니다.
참고: 총계는 컬럼에 남아 있는 양을 포함하여 처음에 추가된 것이어야 하며, 일반적으로 500μL 용량의 원심 농축기의 경우 400-450μL입니다.- 반응 바이알을 암모늄 아세테이트 완충액으로 헹구어 잔류 DOTA-hCD19-mAb를 회수합니다. 원심 농축기에 세척액을 추가합니다.
- 4,000× g 에서 10분 동안 원심분리합니다.
알림: 더 짧은 시간에 볼륨을 80%-90%로 줄이면 후속 스핀에서 탈수 시간이 줄어들 수 있습니다.
- 원심 농축기에서 단백질 용액을 제거합니다. DOTA-hCD19-mAb의 총 부피를 확인합니다.
- 원심 농축기 2에 총 부피 100μL의 충분한 아세트산 암모늄 완충액과 피펫을 추가하여 혼합합니다. 원심 농축기 컬럼을 캡하고 뒤집습니다. 4,000× g 에서 2분 동안 회전하여 용액을 수집합니다. 새 튜브로 옮깁니다.
- 원심 농축기(500)에서, 피펫을 사용하여 원심 농축기로부터 mAb 용액을 수집하고; 새 튜브에 추가합니다.
- UV-Vis 분광광도계를 사용하여 농도를 측정합니다. 농도가 2mg/mL 이상인 경우 아세트산 암모늄으로 2mg/mL로 희석합니다.
- PCR 튜브당 부분 표본 100μg(약 50μL); 튜브에 DOTA-hCD19-mAb, 날짜, 질량 및 농도를 라벨링합니다. 바이알을 아래로 돌립니다.
- 드라이아이스 위에서 냉각된 PCR 블록에 DOTA-hCD19-mAb를 스냅 동결(또는 드라이아이스 상에서 동결)합니다. 모든 샘플이 얼면 -80°C 냉동고에 넣습니다.
- 질량분석법으로 hCD19-mAb당 DOTA 수를 측정합니다. 비율을 계산하기 위해 각 접합체에서 비접합(순수) 항체 샘플을 유지합니다. 아래에 주어진 방정식 (1)을 사용하십시오. 분자량은 MW로 약칭됩니다.
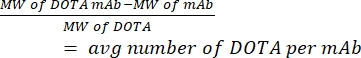 (1)
(1)
- 라디오라벨링
알림: 기관 규정에 따라 실험실 가운, 장갑, 개인 신체 및 링 선량계를 포함하여 방사능을 취급하기 위한 적절한 개인 보호 장비(PPE)를 착용하십시오. 방사능 오염을 방지하기 위해 정기적으로 조사하고 장갑을 교체하십시오. 납 차폐를 사용하고 가능하면 집게로 취급하여 방사성 소스와의 거리를 늘리십시오.- 피펫을 사용하여 배송 바이알에서 새 바이알로 방사능을 옮깁니다. 방사능을 측정합니다.
- 첫 번째 방사성 표지 반응에 대한 부분 표본을 제거합니다. 64 Cu-CuCl 3의 1 mCi당 50 μL의 암모늄 아세테이트(pH 5.5)를 추가합니다. 5와 6을 구별할 수 있는 충분한 분해능으로 5.5를 캡처하는 범위의 pH 스트립에 1μL를 피펫팅하여 pH를 측정합니다.
- pH가 4-5.5가 아닌 경우 1M NaOH 또는 0.1M HCl을 사용하여 변경하십시오. pH가 1 미만인 경우 5-4 μL의 소량 또는 pH가 0.1보다 크면 5.5M HCl을 추가합니다. 첨가할 때마다 완전히 혼합하고 스핀다운한 다음 위에서 설명한 대로 pH를 측정합니다. 최종 부피를 계산할 수 있도록 용액의 각 추가 및 제거(pH 확인 포함)를 기록하십시오.
- 최적의 pH에 도달하면 64Cu-CuCl3 1 mCi 당 10 μg의 DOTA-hCD19-mAb를 첨가합니다. 부드럽게 섞고 짧게 돌립니다.
- 반응 바이알을 37°C 및 분당 400회전(rpm)으로 설정된 열혼합기에 놓습니다.
- 30분 후 반응을 담금질합니다: 총 반응 부피를 50으로 나누고 해당 부피 0.5M EDTA를 반응 혼합물에 추가합니다.
- ITLC(Instant Thin Layer Chromatography)를 사용하여 라벨링 효율을 측정하여 용액에서 결합 및 유리 구리의 비율을 측정합니다.
- 1cm 너비의 TLC 용지를 자릅니다. 스트립의 상단과 하단에서 1cm를 표시하고 0.1M 구연산이 1cm 미만의 이동상이 있는 튜브(50mL 원뿔형 플라스크)를 준비합니다(이동상 수준은 튜브에 넣을 때 스트립의 1cm 표시 아래에 있어야 함).
- 반응 용액 1μL를 피펫팅하여 하단 1cm 표시(용매 전면)의 스트립에 놓고 스트립을 튜브에 넣습니다. 솔벤트 전면이 상단 1cm 표시에 도달할 때까지 관찰하고 스트립을 제거하고 플라스틱 랩으로 감쌉니다.
- 스트립을 플랫폼에 놓고 radio-TLC 이미징 스캐너를 통과시킵니다. 원점에서 방사성 표지된 mAb와 이동상 전면과 함께 이동하는 유리 64Cu를 찾습니다(그림 2). 유리 구리의 비율이 5% 미만(95% 라벨링 효율)인 경우 동물에 주입을 진행합니다. 유리 구리의 비율이 5%보다 크면 정제를 진행합니다.
참고: 유리 구리의 비율은 일반적으로 DOTA-mAb와 64Cu의 비율, 반응 시간, pH 및 온도에 따라 달라집니다. 일관된 결과를 보장하기 위해 각 사용자는 각각의 새로운 mAb에 대해 반응 조건을 최적화해야 합니다.
- 일회용 DNA 등급 중력 컬럼을 통한 정제
- 제조업체의 지침에 따라 일회용 DNA 등급 중력 흐름 컬럼(탈염/완충액 교환 컬럼)을 컨디셔닝합니다. 일회용 DNA 등급 중력 컬럼을 적절한 납 차폐 뒤에 있는 링 스탠드 또는 기타 기기에 놓습니다. 장치가 안정적이고 쉽게 움직일 수 있는지 확인하십시오. 컬럼 아래에 튜브를 놓습니다.
- 조잡한 반응 혼합물을 중력 유동 컬럼 수지에 피펫팅합니다. 모든 액체가 수지로 흘러 들어갈 때까지 기다리십시오. 전체 부피(원유 제품과 PBS)를 500μL로 만들기에 충분한 PBS를 피펫팅합니다. 플로우스루를 폐기하십시오.
- 컬럼을 1-10으로 표시된 1.5mL 원심분리 튜브 위에 놓습니다. 컬럼에 PBS 1mL를 추가합니다. 흐름이 멈출 때까지 각 튜브에 5방울을 떨어뜨립니다.
알림: 10개 미만의 튜브가 필요할 수 있습니다. - 컬럼 바닥을 덮고 잔류 방사능을 측정합니다. 플로우스루로 각 바이알을 측정합니다. 50μCi 이상의 각 바이알에 대해 3.3.7 단계에 따라 ITLC를 준비하여 각 분획의 결합 구리 비율을 측정합니다.
참고: 처음 하나 또는 두 개의 분획에는 이동상만 포함됩니다. 방사성 표지된 mAb가 먼저 용리되고(일반적으로 분획 2 또는 3에서 5 또는 6까지) 자유 64Cu가 마지막에 용리됩니다(일부는 컬럼에 달라붙음). 퍼센트 바운드( 64Cu)는 분획마다 다를 수 있다. - 95 % 이상의 결합 (5 % 미만의 유리 구리)과 분획을 결합하십시오. 주입을 위해 용액을 사용하십시오. 원하는 경우, 크기 배제 HPLC를 수행하여 방사선 표지5를 확인하고 몰 활성을 계산한다. UV-Vis 분광 광도계가 10번의 반감기(127시간 또는 5.3일)를 감쇠한 후 농도를 측정하기 위해 부분 표본을 저장합니다.
4. 복용량 준비
알림: 복용량을 취급하기 전에 실험실 가운, 신체 및 손가락 선량계, 장갑을 포함한 적절한 PPE를 착용하십시오.
- PET 스캔 18-24시간 전에 64Cu-DOTA-hCD19-mAb를 주입하여 체내 방사성 추적자가 적절하게 순환될 수 있도록 합니다.
- 납 차폐 뒤에 64Cu-DOTA-hCD19-mAb가 있는 납 용기를 즉시 놓습니다. 가이거 계수기를 켜서 잠재적인 오염을 모니터링합니다.
알림: 방사성 물질을 취급할 때는 장갑을 자주 교체하십시오. 빠른 글러브 교체를 위해 복용량을 뽑는 동안 더블 글러빙을 착용하는 것이 좋습니다. 오염된 날카로운 물건과 쓰레기는 항상 지정된 차폐 쓰레기 구역에 버리십시오. - 64Cu-DOTA-hCD19-mAb를 저결합 1.5mL 플라스틱 원심분리 튜브에 적절한 농도로 희석합니다.
참고: 64Cu-DOTA-hCD19-mAb는 낮은 결합력이 아닌 경우 플라스틱에 결합합니다. 64분Cu는 유리에 결합합니다.- 방사성 추적자를 식염수로 희석하여 방사선 분해를 방지하고 일정한 선량을 쉽게 추출할 수 있습니다.
- 가능하면 100 μL에 75 - 150 μCi를 투여할 수 있는 용량을 준비합니다. 최대 총 주입 부피가 마우스 체중의 10%를 초과하지 않도록 하십시오.
- 500μL(50cc) 인슐린 주사기를 사용하여 낮은 바인딩 플라스틱 튜브에서 투여량을 추출합니다. 주사기는 정맥 주사로 주입되므로 주사기에 기포가 없는지 확인하십시오.
- 주사기에 해당 동물 번호로 사전 라벨을 붙입니다.
- 데이터 분석을 위해 실험실 노트북에 투여 활동과 시간을 기록합니다.
- 마취 시간을 줄이기 위해 동물이 카테터를 삽입하자마자 주사할 수 있도록 복용량을 준비하십시오.
- 투여량이 준비된 후 보정 계수를 생성하기 위해 스캔을 위한 표준물질(팬텀)을 준비합니다.
- 15mL 원뿔형 튜브에 물(또는 PBS)에 희석된 50-75μCi의 활성을 채웁니다.
알림: 용액이 완전히 혼합되었는지 확인하십시오. 표준은 라벨링에서 남은 64Cu가 될 수 있습니다.- 표준에서 활동량을 측정하고 시간을 기록합니다.
- 15mL 원뿔형 튜브에 물(또는 PBS)에 희석된 50-75μCi의 활성을 채웁니다.
5. 캐뉼레이션 및 주입
참고: 방사성 추적자6의 주입을 위한 마우스의 정맥 캐뉼레이션에 대해서는 앞서 설명한 방법6을 참조하십시오.
- 방사성 추적자 투여를 준비하기 위해 1.5-3% 이소플루란으로 채워진 녹다운 박스에 마우스를 마취하기 전에 섹션 2.1에 설명된 대로 질병 중증도에 대해 마우스의 무게를 측정하고 점수를 매깁니다.
알림: 이 마우스는 앞에서 설명한 대로 PET 스캐너가 아닌 벤치 탑에 주입됩니다. 주입을 위해 카테터를 제자리에 붙일 필요가 없습니다., 쥐가 캐뉼레이션과 주사 사이에서 움직이지 않기 때문입니다. - 쥐가 캐뉼레이션되면 카테터 끝에 바늘을 삽입하고 천천히 주입합니다. 주사 후 카테터를 통해 작은 식염수를 세척하여 전체 용량이 주입되도록 합니다.
참고: 부피는 카테터의 죽은 부피와 거의 같아야 하며, 저자가 사용하는 카테터의 경우 50μL입니다.- 실험실 물티슈 위에 주사하여 방사성 추적자의 물방울을 수집하십시오. 잔류 선량을 측정할 때 이를 포함하십시오.
- 실험실 노트북에 주입 시간을 기록합니다.
- 주입 직후 캐뉼라를 제거하십시오. 용량 보정기를 사용하여 캐뉼라, 용량 주사기 및 조직을 측정하여 마우스에 주입되지 않은 잔류 용량을 결정합니다.
- 실습 노트북에 활동과 시간을 기록합니다.
- 쥐에게 주사를 놓은 후, 쥐가 방사능임을 나타내는 케이지 카드로 케이지에 라벨을 붙입니다. 기관 지침에 따라 케이지를 기록하고 기록하십시오. 그런 다음 지정된 방사능 보유 구역에 쥐를 놓습니다.
6. PET/CT 영상
- 64Cu-DOTA-hCD19-mAb를 주입한 후 18-24시간 후에 PET 이미징을 수행합니다. 스캔하기 전에 마우스의 무게를 측정하고 점수를 매깁니다.
알림: 스캐너 작동 지침은 사용 중인 스캐너에 따라 다릅니다.- PET/CT 스캐너의 X선 구성 요소가 예열되고 획득할 준비가 되었는지 확인합니다.
- 컴퓨터에서 PET 스캐너 수집 소프트웨어를 엽니다.
- Investigator Login(조사자 로그인) 드롭다운 메뉴에서 해당 랩 정보를 클릭합니다.
- 프로젝트 페이지에서 새 프로젝트를 만들거나 드롭다운 메뉴에서 기존 프로젝트를 선택합니다.
- 초기화 프롬프트가 화면에 자동으로 나타나면 Home Bed를 클릭하고 Bed가 Home이 될 때까지 기다립니다. 그런 다음 Warm up CT를 클릭합니다.
- CT가 예열될 수 있도록 CT 차폐 도어가 닫혀 있는지 확인합니다.
- 스캐너가 예열되는 동안 EAE 마우스에 점수를 매기고 수분 공급을 위해 측면에 0.2-0.4mL의 따뜻한 식염수를 피하 주사합니다.
- 스캐너가 예열된 후 컴퓨터로 돌아가 연구를 위한 PET 스캔을 설정합니다.
참고: 스캔일 전에 설정할 수 있습니다.- Recent Studies(최근 연구) 헤더에서 Create New Study(새 연구 만들기)를 클릭합니다. 연구 이름, 프로토콜, 화합물 및 주제 정보를 입력합니다.
- PET/CT를 수행하는 경우 먼저 PET 프로토콜을 선택한 다음 CT 프로토콜을 선택합니다.
참고: 일반적으로 표준 CT는 EAE 마우스 모델을 스캔하는 데 충분합니다. CT 스캔은 1분 길이이며 전압 80kVp, 전류 150μA 및 720 프로젝션에서 2 x 2로 비닝하여 획득합니다. CT 이미지는 Modified Feldkamp 알고리즘을 사용하여 재구성됩니다. - PET 프로토콜의 경우 10-15분 정적 64 구리 스캔을 선택합니다. 이 스캔이 사용 가능한 프로토콜 목록에 아직 없는 경우 표준 메뉴의 Protocols(프로토콜) 탭, Create New Protocol(새 프로토콜 생성) | 동위원소 드롭다운 메뉴. 원하는 동위원소가 목록에 없으면 More(더보기) | 라이브러리에서 추가하고 원하는 동위원소를 추가합니다. 스캔 기간을 정의하고, Static Scan(정적 스캔) 라디오 버튼을 클릭하고, 프로토콜의 이름을 지정하고, Save(저장)를 클릭합니다.
- 스터디 탭으로 돌아가서 계속해서 그날에 원하는 모든 스캔의 이름을 지정하고 설정합니다.
알림: 최적의 배치를 보장하기 위해 첫 번째 스캔의 베드 위치를 확인하기 위해 표준 CT만 사용하여 하나의 "CT 테스트" 스캔을 설정하는 것이 좋습니다. 이 검사는 연구에 대한 첫 번째 검사 실행이어야 합니다.
- PET/CT를 수행하는 경우 먼저 PET 프로토콜을 선택한 다음 CT 프로토콜을 선택합니다.
- Recent Studies(최근 연구) 헤더에서 Create New Study(새 연구 만들기)를 클릭합니다. 연구 이름, 프로토콜, 화합물 및 주제 정보를 입력합니다.
- 스캐너가 준비되면 녹다운 상자에 쥐를 마취하여 스캔을 준비합니다.
참고: 이 단계에서 쥐는 매우 아플 수 있습니다. 마취 시간을 최소화하는 것이 가장 좋습니다.- 아이 젤을 바릅니다.
- 4개의 마우스 스캐닝 베드에 이소플루란을 1.5%-2%로 설정하고 가열 패드를 켠 상태에서 가열 패드 또는 가열된 공기와 같은 가열 요소가 장착되어 있는지 확인합니다(그림 3). 마우스를 스캐닝 베드의 누운 자세로 놓습니다.
- EAE 병이 진행됨에 따라 쥐의 척추는 심하게 휘어집니다. 쥐가 등을 대고 있는 동안 스캔하여 척추를 최대한 곧게 펴고 분석을 다운스트림으로 개선합니다. 척추를 곧게 펴는 데 도움이 되도록 마우스 꼬리를 부드럽게 당깁니다.
- 누운 자세가 되면 부드러운 현미경 테이프로 각 마우스를 제자리에 단단히 테이프로 붙입니다. 한 줄의 테이프를 머리에 대고 다른 테이프를 배 위에 부드럽게 사용하여 호흡으로 인한 움직임을 최소화합니다.
- 어떤 마우스가 어떤 스캔 위치에 있는지 실험실 노트북에 기록합니다.
- 마우스가 고정되면 스캔 컴퓨터로 돌아가 스캐너를 작동합니다.
- 모션 컨트롤러 메뉴를 엽니다. PET Center FOV를 클릭하여 스캐닝 베드의 마우스를 PET 링으로 이동합니다. 오늘의 첫 번째 스캔을 보려면 CT Center FOV를 클릭하십시오. 위치에 있으면 CT 테스트 스캔을 실행하여 위치가 올바른지 확인하십시오. 침대 위치가 만족스러울 때까지 반복합니다.
- 스캐닝 베드에 작은 흰색 테이프를 붙여서 나머지 연구를 위한 올바른 베드 배치를 표시합니다.
- PET 스캔을 위해 침대가 제자리에 있으면 Run(실행)을 클릭하여 스캔 시퀀스를 시작합니다.
- 스캐너가 PET 링에서 CT로 자동으로 이동할 때까지 기다립니다.
- 동물이 PET와 CT를 위한 적절한 위치로 이동했는지 항상 육안으로 확인하십시오.
- 데이터 분석 중에 주입된 용량의 감쇠 보정을 위해 실험실 노트북에 스캔 시작 시간을 기록합니다.
- 스캔이 완료되면 이미지를 재구성할 수 있습니다. 동물을 제거하기 전에 데이터를 확인하십시오.
참고: 3D 순서 하위 집합 OSEM(Expectation-Maximization) 재구성은 정적 스캔에 약 5분이 걸립니다. - 이 조직에는 많은 수의 B 세포가 포함되어 있으므로 비장을 양성 대조군으로 사용하여 데이터를 육안으로 확인하고 승인합니다. 스캐닝 베드에서 동물을 꺼내 관류 및 후속 해부를 준비하기 위해 이소플루란으로 채워진 녹다운 상자에 넣습니다.
- 연구의 나머지 마우스에 대해 6.5-6.12단계를 반복합니다.
- 모든 마우스를 스캔하거나 스캐닝 베드에 빈 공간이 있는 그룹을 스캔할 때 4.6단계에서 준비한 표준물질을 스캔합니다.
7. 생체 외 감마 계수 및 자가방사선 촬영을 위한 해부
- 해부하기 전에 모든 감마 계수 및 원심분리기 튜브의 무게를 미리 측정했는지 확인하십시오.
- 마우스가 깊이 마취된 상태에서 PBS 및 개흉술을 사용하여 앞서 설명한6과 같이 관류를 통해 안락사를 수행합니다(4% 이소플루란, 2L/min 100%O2의 연속 흡입).
- 골수를 제거하려면 무릎과 골반의 양쪽 대퇴골을 자릅니다. 양쪽 머리가 대퇴골에서 제거되었는지 확인하십시오.
- 바닥에 구멍이 있는 0.5mL 원심분리 튜브(20G 바늘 사용)에 양쪽 대퇴골을 넣고 뚜껑을 잘라냅니다.
- 뚜껑을 잘라낸 상태에서 대퇴골이 들어 있는 0.5mL 튜브를 1.5mL 원심분리기 튜브 안에 넣습니다.
- 전체 튜브 설정을 미니 원심분리기에 넣습니다. 4,500× g의 속도로 4분간 회전시킵니다.
참고: 골수는 0.5mL 원심분리 튜브의 구멍을 통해 빼내고 1.5mL 원심분리기 튜브 바닥에 가라앉아야 합니다.- 튜브를 분리합니다. 0.5mL 원심분리 튜브의 빈 대퇴골의 무게를 잰다. 1.5mL 원심분리 튜브에서 골수의 무게를 잰다. 각 원심분리기 튜브를 감마 계수 튜브에 넣습니다.
- 겸자와 가위를 사용하여 뇌간을 손상되지 않도록 주의하면서 뇌를 제거합니다. 뇌를 감마 카운팅 튜브에 넣습니다. 건조 중량을 기록하고 PBS로 세척한 다음 계산할 준비가 될 때까지 얼음 위에 두십시오.
- 척수를 제거하려면 다음 단계를 수행하십시오.
- 동물의 등쪽을 절개하여 척추를 노출시켜 피부와 털을 제거합니다(그림 1).
- 척추 주위와 척추를 통과하는 세 개의 횡평면을 따라 절단하여 요추(L)를 경추(C) 및 흉부 영역에서 분리합니다: 목 기저부(C1 척추)(그림 1D, 번호 1); 흉곽 기저부(L1 척추)(그림 1D, 번호 2); 골반 기저부(L5 척추)(그림 1D, 3번).
- 흉곽 아래를 자릅니다(그림 1D, 번호 2).
- 요추 척추 부위를 분리하기 위해 천골 바로 위를 절개합니다. 요추 척수가 보일 때까지 골반 끝에서 척추를 조심스럽게 다듬습니다(그림 1D, 번호 3). 척추의 요추와 경추/흉부 부위를 분리하기 위해 주변 조직을 잘라냅니다(그림 1D, 숫자 4 및 5).
- 척수를 배출하려면 PBS로 채워진 슬립 팁 주사기(3-10mL)를 사용하십시오. 엄지와 검지를 사용하여 주사기와 척추 사이에 밀봉을 만듭니다.
- PBS를 주사기를 통해 부드럽게 밀어 척수를 흡수 패드로 배출합니다(그림 1E). 양쪽 척추 부위에 대해 반복합니다. 감마 카운팅 튜브에 척수 조직을 넣습니다.
- 건조 중량을 기록하고 PBS를 추가하여 조직이 건조를 방지하기 위해 튜브 바닥에 있는지 확인합니다. 계산할 준비가 될 때까지 튜브를 얼음 위에 놓습니다.
- 두개골 끝에서 경추/흉추 척수를 배출하고 척추의 꼬리 끝에서 요추 척수를 배출합니다(그림 1E).
8. Ex vivo 감마 카운팅
- 감마 카운터 소프트웨어를 엽니다. 작업 목록으로 이동하여 30Cu에 대한 64초 계수 프로토콜과 같은 원하는 프로토콜을 선택합니다.
- 별도의 튜브에 최소 3개의 표준물질을 준비합니다. 분석에 사용할 수 있도록 지금 실행합니다(10.2단계). 3개의 개별 튜브에서 3개의 반복 부피와 활동량을 만드는 것을 목표로 합니다.
참고: 500μL의 부피는 좋은 결과를 제공합니다. 활성은 사용하는 기계에 따라 결정되지만 일반적으로 10μCi가 잘 작동합니다. - 실행할 프로토콜에 해당하는 바코드가 표시된 랙에 표준을 배치합니다. 랙을 감마 카운터에 놓습니다.
- 장기 무게를 기록한 후 장기가 포함된 튜브를 표준물질이 포함된 튜브 뒤의 감마 계수 랙에 놓습니다.
참고: 이 모델의 관심 기관에는 축 림프절, 혈액, 골수, 뇌, 경부 림프절, 대퇴골, 심장, 간, 요추 척수, 근육, 비장, 꼬리 및 경추/흉부 척수가 포함될 수 있습니다. - 감마 카운터 뒷면에 정지 바코드가 있는 랙을 놓습니다.
- 컴퓨터에서 재생 버튼을 누릅니다. 가능하면 모든 튜브를 하나의 파일에 연속적으로 계산할 수 있도록 실행할 여러 랙이나 오르간이 있을 때까지 재생 을 누르지 마십시오. 정지 바코드가 있는 랙이 각 실행에 대해 감마 카운터의 뒷면에 있는지 확인하십시오.
- 모든 샘플이 계산될 때까지 실행합니다. 파일을 저장하고 내보냅니다.
9. 중추신경계 조직의 생체 외 자가방사선 촬영(ARG)
- 뇌 및 척수 ARG에 대해 이전에 발표된 단계를 따릅니다(쥐는 이미 PET 스캔에서 방사성 추적자를 주입받았으므로 Chaney et al.에서 설명한 2-6단계는 제외)6.
알림: 척수 ARG 카세트 준비에 대한 구체적인 지침은 여기에 나열되어 있습니다6. - 요추 및 경추/흉추 척수에 대한 감마 계산이 완료된 후 모든 CNS 조직이 계산될 때까지 즉시 튜브를 얼음 위에 놓습니다.
참고: 뇌의 ARG에 대해 이전에 발표된 방법을 참조하십시오6. - 척수가 흡수 패드 위로 떨어질 수 있도록 튜브를 부드럽게 기울입니다. 척수가 튜브 측면에 달라붙으면 차가운 PBS로 부드럽게 씻어내고 튜브를 다시 기울입니다. 실험실 티슈로 부드럽게 문질러 각 척수를 조심스럽게 말립니다. 말린 척수를 두꺼운 검은색 종이에 정리된 방식으로 놓습니다.
- 쉽게 식별할 수 있도록 척수 옆에 흰색 펜으로 라벨을 붙입니다.
- ARG 카세트를 닫을 때 척수가 압축되는 것을 방지하기 위한 스페이서 역할을 하는 3개의 현미경 슬라이드 스택을 배치하기 위해 검은색 종이의 모서리와 중앙에 공간을 남겨 둡니다. 5-7 스택을 사용하십시오.
- 모든 요추 및 경추/흉추 척수를 검은색 종이에 놓고 라벨을 붙이면 ARG 카세트에 종이를 조심스럽게 넣습니다. 열린 카세트를 드라이아이스 트레이에 올려 척수를 얼립니다.
- 얼면 디지털 형광체 보관 스크린과 척수 사이에 플라스틱 랩을 부드럽게 놓고 스크린을 샘플 위에 놓습니다. 즉시 카세트를 닫고 약 20 반감기(~10시간) 동안 -127°C 냉동실에 넣습니다.
- 노출 시간이 완료되면 형광체 이미저를 사용하여 필름을 스캔합니다. 결과 디지털 이미지를 분석합니다(지침은 섹션 12 참조).
10. 생체내 분포 데이터 분석
- 방사성 붕괴에 대한 시간 보정을 수학적으로 결정하기 위해 "선량 보정" 스프레드시트를 설정하여 방사선량을 정규화하고 피험자 간의 비교를 허용합니다.
- 주사 후 주사기와 카테터에 남아 있는 잔류 활성을 고려하여 모든 투여량을 주입 시간까지 충치-교정합니다.
- 8.2단계에서 준비된 표준을 사용하여 활동량(μCi)과 분당 정규화 카운트(CPM)의 평균을 구합니다. 평균 CPM을 평균 표준 활동량으로 나누어 CPM/μCi를 구합니다.
참고: 각 표준물질에 대한 활동량이 감마 계수기가 표준물질의 CPM을 계산하는 시간으로 감쇠 보정되었는지 확인합니다. 감마 카운터는 모든 CPM 값을 프로토콜의 시작 시간으로 정규화해야 합니다.
- "결과" 스프레드시트를 설정하여 각 샘플에 대한 조직 그램당 최종 주입 선량(%ID/g)을 계산합니다.
- 동물의 주입 시간까지 계산된 각 샘플에 대한 감마 카운터에서 정규화된 CPM을 감쇠 보정합니다.
알림: 감쇠 보정은 모든 시점에 있을 수 있습니다. 모든 용량과 CPM 값이 동일한 시점으로 감쇠 보정되었는지 확인합니다. - 감쇠 보정된 CPM을 각 샘플의 질량으로 정규화하여 샘플당 CPM을 결정합니다. 계산된 삽입된 CPM에서 테일의 CPM을 빼서 삽입된 총 CPM을 계산합니다.
참고: 이 CPM 값은 주입으로 인한 외부 추적자를 설명하기 위해 주입된 총 CPM에서 빼기만 하면 되므로 꼬리는 질량을 보정할 필요가 없습니다. - 질량당 CPM을 주입된 총 CPM으로 나누어 %ID/g를 계산합니다.
- 동물의 주입 시간까지 계산된 각 샘플에 대한 감마 카운터에서 정규화된 CPM을 감쇠 보정합니다.
- "요약" 스프레드시트를 설정하여 그래프 소프트웨어에 입력할 최종 결과와 후속 데이터 시각화 및 통계 분석을 표시합니다.
11. PET 이미지 분석
- PET 분석 소프트웨어를 엽니다. 파일에 핥기 |오픈 로컬 데이터 | DICOM입니다. 원하는 파일(DICOM 형식)을 찾습니다. PET와 CT를 모두 엽니다.
- 데이터 관리자에서 PET 및 CT 대비를 원하는 수준으로 조정합니다.
- 개별 마우스를 등록하고 자릅니다.
- Navigation( 탐색 ) 메뉴에서 Reorientation/Registration(방향 전환/등록 ) 탭을 선택합니다.
- 이 탭의 Rigid 메뉴로 이동합니다. CT 스캔(0) 을 고정 스캔으로, PET 스캔(1) 을 이동 스캔으로 지정합니다.
- 강체 변환(Rigid Transformation) 및 빠른 품질(Fast Quality)을 선택합니다. Register(등록)를 클릭합니다.
- 등록이 완료되면(5-10분) 확인 표시를 클릭하여 등록을 저장합니다.
- 데이터를 육안으로 검사하여 등록이 성공했는지 확인합니다. File(파일) | 세션 | 내보내기.
- 그런 다음 각 마우스를 전신 자르기로 자릅니다 : 탐색 메뉴로 이동하여 자르기를 클릭하십시오. 각 횡단면의 측면을 바깥쪽 가장자리에서 안쪽으로 드래그합니다.
- 원하는 마우스가 단단히 잘리면 확인 표시를 클릭하고 세션을 내보내 저장합니다.
- 그런 다음 Registration/Reorientation 메뉴의 수동 Translation, Rotations, and Flips를 사용하여 뇌 분석을 위해 각 마우스의 머리를 자르고 곧게 펴십시오. 저장하려면 내보냅니다.
- 척수를 분석합니다.
- 척수의 관심 영역(ROI) 분석을 시작하려면 탐색 메뉴에서 3D ROI 툴을 엽니다.
- ROIs 헤더 아래에서 메뉴 하단의 더하기 기호를 사용하여 요추 ROI, 경추/흉부 ROI, 요추 골격, 흉부 골격, 요추 척수, 흉부 척수의 6가지 ROI를 생성합니다.
참고: 요추 및 경추/흉부 ROI는 골격 ROI를 생성하는 데 사용되는 일반화된 대규모 ROI입니다(그림 4). - 이 단계에서 PET 신호의 시각적 간섭을 방지하려면 F3 을 클릭하여 PET를 끕니다.
- 3D ROI Tool Operator의 맨 위로 이동합니다. 커서 기호 오른쪽에 있는 실선을 클릭하여 3D 페인트 모드와 침식/팽창 메뉴를 엽니다.
- 구를 선택하고 크기를 20픽셀로 변경합니다. 확장을 +5로 설정합니다.
- 계속하기 전에 메뉴 하단으로 이동하십시오. 요추 ROI 가 첫 번째로 그려지므로 선택되었는지 확인하십시오.
- CT에서 척추의 L6 척추뼈(척추와 엉덩이가 만나는 곳)를 찾습니다. L6 위의 한 척추에서 시작하여 엉덩이 위의 5개 척추(L1-L5 척추)에 대략적인 ROI 요추 ROI 를 그립니다. 그런 다음 경추/흉부 ROI 로 전환하고 척추의 나머지 부분을 두개골 기저부까지 추적합니다.
참고: 11.4.8단계에서 Otsu 임계값이 발생해야 하는 위치를 나타내는 데 사용되므로 정확할 필요는 없습니다. - 일반화된 ROI를 도출한 후 연산자의 맨 위로 이동합니다. 세그멘테이션 알고리즘 메뉴를 선택합니다.
- 드롭다운 메뉴에서 Otsu Thresholding을 선택합니다. 입력값으로 요추 ROI를 선택합니다. 메뉴 하단에서 Lumbar Skeleton(요추 골격 )이 선택되어 있는지 확인합니다. Image(이미지) 옆의 드롭다운 메뉴에서 CT 스캔 이 선택되었는지 확인하고 Apply(적용)를 클릭합니다. 경추/흉부 ROI 및 흉부 골격에 대해 반복합니다.
- Otsu 임계값 설정이 척추를 충분히 강조 표시하지 않는 경우 글로벌 임계값을 사용하고 수동 임계값을 위해 최소 값을 350 으로, 최대 값을 3,500 으로 변경하고 필요에 따라 조정하여 척추뼈를 분리합니다.
- Otsu 임계값을 사용하여 스켈레톤 ROI를 생성한 후 탐색 메뉴(커서 아이콘)로 돌아갑니다. 거친 요추 및 경추/흉부 ROI에 대한 H(숨기기) 열을 삭제하거나 체크 표시하여 숨깁니다. 편집할 수 없도록 두 스켈레톤 ROI에 대해 I(변경 불가능) 열을 선택합니다.
- 마지막으로 3D ROI Tool Operator 의 상단으로 돌아가 3D Paint 메뉴 로 이동하여 Spinal Cord ROI를 그립니다.
- 구 도구를 다시 선택하고 요추와 흉부 모두에 대한 골격 내의 척수를 추적하여 메뉴 하단에서 올바른 ROI가 선택되었는지 확인합니다.
- ROI를 지우 려면 Command/Control 을 클릭하고 지울 부품 위에 그립니다.
- 세 평면 모두에서 척수 ROI를 확인하여 척추 외부에 ROI가 그려지지 않았는지 확인합니다.
- 척수 분석 결과를 내보냅니다.
- 11.4.3단계에서 PET 신호가 꺼진 경우 척수 ROI를 그린 후 F3 키를 눌러 PET를 다시 켜거나 VC(Visual Controller) 를 선택하고 PET 막대를 클릭합니다.
- 탐색 메뉴(커서 아이콘)로 돌아갑니다. 그리드 아이콘을 클릭하여 테이블 표시를 클릭합니다. 테이블을 스프레드시트 소프트웨어에 복사하고 저장합니다.
- 마지막으로, 위에서 설명한 대로 PET 분석 소프트웨어에서 파일을 내보내 도출된 ROI를 저장합니다.
- 반자동 3D 아틀라스를 사용하여 뇌를 분석합니다.
- 헤드 자르기 파일을 엽니다. Advanced Modules(고급 모듈 ) 메뉴로 이동하고 3D Brain Atlas Tool(3D Brain Atlas Tool)을 선택하여 마우스 브레인 아틀라스를 가져옵니다. 참조 가 CT 로 설정되어 있고 자르기 옵션이 선택 취소되어 있는지 확인합니다. 출력 디렉터리 의 경로를 설정합니다 .
- Advanced Setting(고급 설정)에서 Transform(변환)을 Versor-Affine(Versor-Affine)으로 변경합니다. 다른 모든 기본 설정을 유지합니다. 실행을 클릭합니다.
- Reorientation/Registration 메뉴에서 아틀라스를 수동으로 조정하고 두개골의 CT를 아틀라스 장착을 위한 지침으로 사용합니다.
- 스케일링이 필요한 경우 뇌 구조 볼륨에 큰 영향을 미칠 수 있으므로 각별히 주의하십시오. 조정이 완료되면 확인 표시 를 클릭합니다.
- Import 3D ROIs(3D ROI 가져오기) 를 선택한 상태에서 아틀라스를 다시 실행합니다.
- 파일을 내보내 잘린 머리에 맞는 아틀라스를 저장합니다.
- 원하는 장기에서 모든 ROI를 추출하고 내보낸 후 표준 결합 보정 값을 계산합니다. 앞에서 설명한 대로 모든 데이터를 감쇠 보정하고 %ID/g로 변환합니다6. 혈액 풀에 존재하는 방사성 추적자로 정상화하기 위해 심장 등 동물 모델에 적합한 장기로 정상화합니다.
12. 생체 외 자가방사선 촬영 분석
- 이미지 분석 소프트웨어를 사용하여 디지털 이미지 파일(.gel)을 엽니다. 밝기 와 대비 를 원하는 임계값으로 조정합니다. 원하는 경우 적절한 색상 조회 테이블을 적용합니다.
참고: 시각화 용이성을 위해 Royal 또는 Grays를 사용하는 것이 좋습니다.
결과
hCD19-mAb는 그림 2와 같이 DOTA 접합 및 64Cu로 방사성 표지되었습니다. EAE 및 순진한 마우스는 64Cu-DOTA-hCD19-mAb를 주사한 후 18-24시간 후에 PET/CT 스캔을 받았습니다(그림 3). PET/CT 이미지는 PET 분석 소프트웨어를 사용하여 공동 등록하고, CNS 조직은 수동 ROI 또는 반자동 3D 뇌 지도책을 사용하여 분석했습니다. ROI의 방사성 추적자 결합(그림 4)은 순진한 마우스보다 EAE 마우스에서 더 높았습니다. 생체 외 감마 계수 및 ARG는 순진한 마우스에 비해 EAE 마우스의 척수(요추 및 경추 흉부 분절 모두)와 뇌(ARG만 해당)의 결합이 증가했음을 보여주었습니다(그림 5 및 그림 6). 관류된 마우스의 생체 외 감마 계수는 또한 비장, 대퇴골 및 골수를 포함한 말초 장기에서 방사성 추적자 결합이 감소한 것으로 나타났으며(그림 5), 이 EAE 모델에서 B 세포가 말초를 떠나 CNS에 침투하는 것과 일치했습니다.
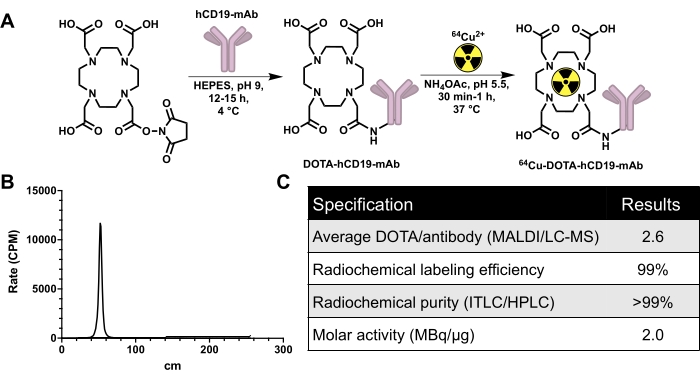
그림 2: 품질 관리 데이터 외에도 64개의 Cu 표지된 인간 특이적 CD19 단클론 항체, 16C4-TM mAb(64Cu-DOTA-hCD19-mAb)를 생성하기 위한 접합 및 방사성 표지 체계. (A) hCD19-DOTA 접합체(스케일 아님)를 생성하기 위해 DOTA-NHS-에스테르와 hCD19 단클론 항체의 반응 및 64 Cu-CuCl3와 방사선 표지를 하여 64Cu-DOTA-hCD19-mAb를 생성합니다. (B) 대표적인 ITLC 크로마토그래피. 40-60cm의 피크는 방사성 표지 항체입니다. 결합되지 않은 64Cu-CuCl3 는 이동상과 함께 이동하며 200 내지 240 cm까지 존재할 것이다. 이 크로마토그래프에는 검출 가능한 유리 64Cu-CuCl3 이 없습니다. (C) 방사성 표지 항체의 품질 관리 사양. 약어: DOTA-NHS 에스테르 = 1,4,7,10-Tetraazacyclododecane-1,4,7,10-tetraacetic acid mono-N-hydroxysuccinimide ester; ITLC/HPLC = 순간 박막 크로마토그래피/고성능 액체 크로마토그래피; MALDI/LC-MS = 매트릭스 보조 레이저 탈착/이온화/액체 크로마토그래피-질량분석법; CPM = 분당 카운트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 움직임을 최소화하면서 척수와 뇌의 고품질 이미징을 가능하게 하기 위해 PET 스캐너 내에서 3D 프린팅 베드에 마우스를 고정하는 방법을 보여주는 사진. (A) 발열체와 마취 튜브가 장착된 3D 프린팅된 4개의 마우스 스캐너 베드("마우스 호텔"이라고도 함). (B) 척추의 직진도를 최대화하기 위해 앙와위 자세에서 마취된 마우스; 각 마우스의 베드 위치가 기록됩니다. (C) 생쥐는 호흡에 영향을 주지 않으면서 뇌의 움직임을 최소화하기 위해 머리를 가로질러 테이프를 단단히 붙이고 배를 가로질러 호흡의 움직임을 최소화했습니다. (D) 마우스 베드가 스캐너 내에 배치되고 스캐닝 베드에 테이프로 고정되어 있습니다. 마취 튜브를 스캐너에서 침대로 연결하고 이소플루란을 2%로 설정했습니다. 스캐너 도어를 닫기 전에 적절한 이소플루란 수준을 보장하기 위해 마우스 호흡을 모니터링했습니다. 약어: PET = 양전자 방출 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
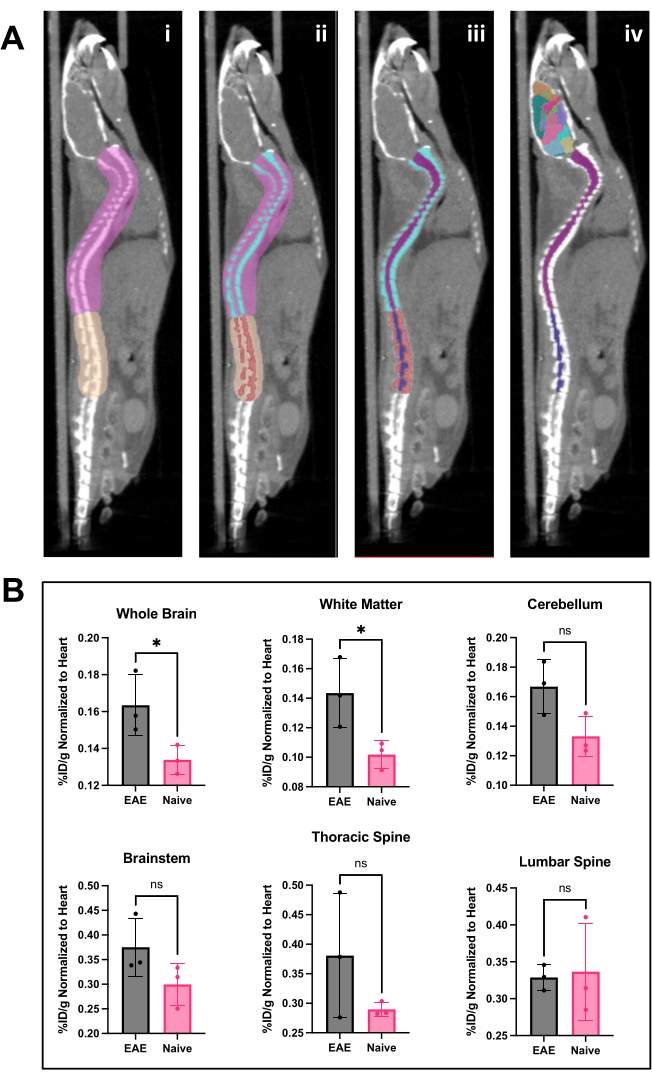
그림 4: PET 분석 소프트웨어를 사용한 척수 이미지 및 뇌 분석 및 결과. (A) i) 흉추 및 경추에서 요추를 분리하고 오츠 임계값 설정을 위한 이미지를 준비하기 위해 척추에 그려진 ROI(분홍색 및 황갈색). ii ) 척추뼈(청록색 및 빨간색)는 Otsu Thresholding을 사용하여 분할되었습니다. iii ) 그런 다음 척추뼈를 3D ROI 메뉴에서 변경할 수 없도록 만들고 척수를 경추/흉부(보라색) 및 요추(네이비) ROI로 나눕니다. iv) 척추 ROI를 제거하고 척수 ROI와 대표 뇌 아틀라스를 적용했습니다. (B) %ID/g로 표현된 다양한 중추신경계 영역의 PET 결과의 대표 분석은 각 동물 내 심장의 ROI로 정규화되었습니다. PET 획득은 PET/CT 이미징을 통한 10분 정적 스캔이었습니다. 패널 A에 표시된 반자동 뇌 아틀라스 접근 방식을 사용하여 정량화된 뇌 영역. iv) 대표적인 결과는 뇌 및 흉부 척수에서 추적자 결합의 유의성 또는 유의한 증가 경향을 보여줍니다. 스튜던트 t-검정(*: p < 0.0332)을 사용하여 수행된 통계량입니다. 약어: PET = 양전자 방출 단층 촬영; ROI = 관심 영역; CNS = 중추 신경계; CT = 컴퓨터 단층 촬영; %ID/g = 조직 그램당 주입된 투여량 비율; EAE = 실험적 자가면역 뇌척수염. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
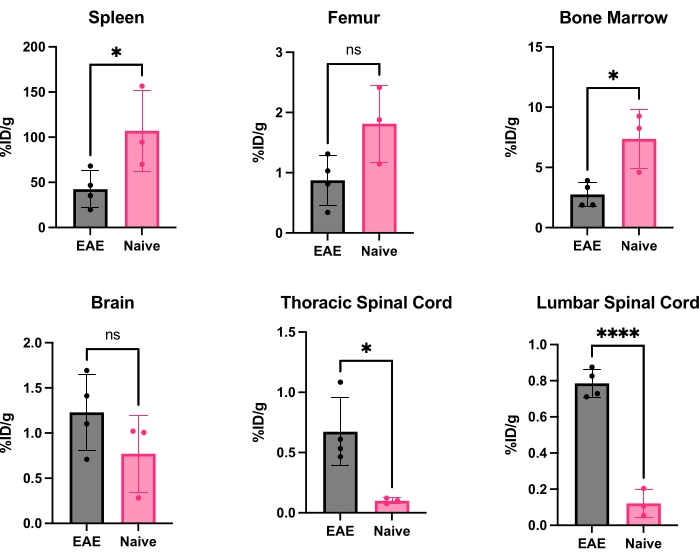
그림 5: %ID/g로 표현된 EAE 및 순진한 마우스의 다양한 장기에서 체외 감마 계수의 대표적인 정량화. PET 스캔 후, 마우스에 PBS를 관류하여 혈액에 존재하는 방사성 추적자를 제거하고, 혈액에 상주하는 CD19+ B 세포에 결합한 방사성 추적자를 제거하고, 각 장기의 정확한 무게를 갖기 위해 장기를 신속하게 해부하고 무게를 측정했습니다. EAE 마우스의 비장과 골수에서 추적자 결합이 순진한 마우스에 비해 현저히 감소합니다. 증가된 방사성 추적자 결합은 EAE 마우스의 요추 및 경추/흉부 척수 분절 모두에서 관찰됩니다. 뇌는 방사성 추적자 신호가 크게 증가하지 않았지만 상당한 증가 추세를 보이고 있습니다. 스튜던트 t-검정(*: p < 0.0332; ****: p < 0.0001)을 사용하여 수행된 통계량입니다. 약어: PET = 양전자 방출 단층 촬영; %ID/g = 조직 그램당 주입된 투여량 비율; EAE = 실험적 자가면역 뇌척수염; PBS = 인산염 완충 식염수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
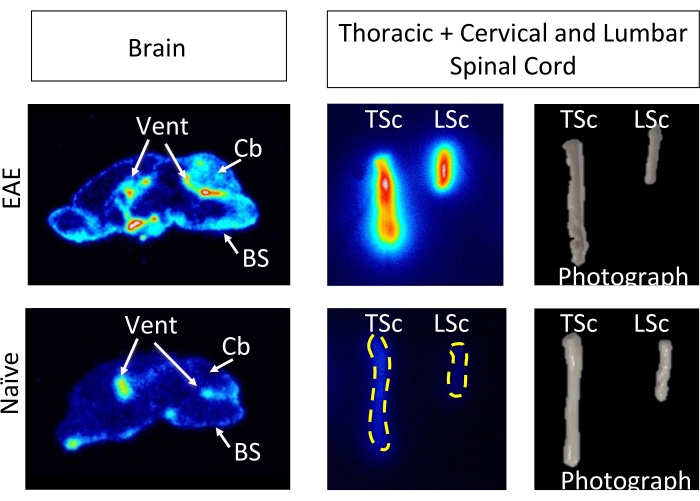
그림 6: Ex vivo ARG 이미지는 EAE의 시상 뇌 절편 및 전체 척수에서 64개의 Cu-DOTA-hCD19-mAb 결합을 순진한 마우스와 비교하여 보여줍니다. 디지털 형광체 저장 필름은 약 10번의 반감기(127시간 또는 5일) 동안 방사성 조직 샘플에 노출된 후 형광체 이미저를 사용하여 스캔했습니다. 결과 이미지는 순진한 마우스의 뇌 절편에 비해 EAE 마우스의 뇌에서 시각적으로 더 높은 신호를 보여주며, 이는 이 모델5에서 B 세포를 포함하는 것으로 알려진 영역으로 인해 예상됩니다. 특히, EAE 쥐 뇌 절편의 뇌간, 소뇌 및 심실에서 증가된 추적 신호가 있습니다. EAE 쥐 뇌 절편에 대한 신호의 이러한 증가는 위에서 자세히 설명한 전뇌 PET 정량화에서 발견된 내용을 반영합니다. 유사하게, 순진한 척수에 비해 경추/흉부 및 요추 척수 분절에서 방사성 추적자 결합이 증가했으며, 이는 생체 외 감마 계수를 사용하여 발견된 것을 반영합니다. 약어: PET = 양전자 방출 단층 촬영; EAE = 실험적 자가면역 뇌척수염; 벤트 = 심실; Cb = 소뇌; BS = 뇌간; TSc = 흉추 및 경추 척수 결합; LSc = 요추 척수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: CD45R/B220을 사용한 순진한 쥐 및 EAE 쥐 뇌 조직의 CNS 조직 염색. B 세포는 EAE 마우스의 뇌간, 수막 및 백질에서 관찰됩니다 (n = 7 EAE, n = 5 순진한 마우스, 동물 당 평균 4 개의 절편). 이 수치는 5부터입니다. 눈금 막대 = 시상 뇌 영상에서 5mm(저배율[1x]), 뇌간, 수막 및 소뇌 백질에서 100μm(고배율[20x]). 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 논문에서는 CD19-PET를 사용하여 MS의 마우스 모델에서 인간-CD19+ B 세포를 이미징하는 간소화된 방법에 대해 설명합니다. 다발성경화증의 이질적인 양상과 치료에 대한 다양한 반응으로 인해 임상에서의 관리가 어려울 수 있으며 치료법 선택 및 모니터링을 위한 새로운 접근 방식이 크게 필요합니다. PET 이미징은 질병 진행 및 B 세포 고갈 요법에 대한 개별 반응을 모니터링하는 강력한 도구 역할을 할 수 있습니다. 다발성경화증 외에도 CD19-PET 영상은 림프종 및 백혈병 또는 기타 B 세포 매개 질환의 아형에서 치료 후 B 세포 고갈을 모니터링하는 데 사용할 수 있습니다. 이 프로토콜과 대표 데이터는 신경 질환에서 B 세포 이미징의 유용성을 보여줍니다.
다발성경화증의 맥락에서 인간 CD19+ B 세포를 연구하기 위해 B 세포 의존성 MOG1-125 EAE 모델7을 선택했습니다. 다른 EAE 모델과 유사하게, 이 모델은 중추신경계(CNS)로의 면역 세포의 점진적 마비 및 침윤 증상을 나타냅니다. 그러나 MOG1-125 모델은 B 세포 기반 모델이라는 점에서 독특합니다: 마우스는 수막, 뇌간, 실질 및 심실의 지주막하 공간에 다양한 수의 B 세포를 포함합니다. 이러한 림프구는 이 부위 전체에 드문드문 흩어져 있거나 난포와 같은 구조를 형성할 수 있으며, 이는 다발성경화증 8,9 환자에서도 관찰됩니다. 순진한 마우스를 대조군으로 사용하는 것 외에도 완전한 Freund's adjuvant(CFA) 전용 유도 키트를 사용할 수 있습니다(즉, MOG 단백질을 사용하지 않고 EAE 마우스에 투여된 것과 동일한 유도 에멀젼). EAE 마우스 모델에서 혈액 뇌 장벽(BBB)은 기능 장애를 일으켜 항체와 같은 더 큰 개체가 교차할 수 있도록 합니다. CD19-mAb 방사성 추적자는 B 세포가 존재하는 경우에만 CNS에 결합하고 남아 있습니다. 추적자는 B 세포가 존재하지 않는 경우 혈액 풀로 다시 순환합니다. 우리는 감마 카운팅과 조직의 방사능 수준을 측정하기 전에 관류를 통해 CNS 조직의 생체 외 자가방사선 촬영을 사용하여 이를 입증했습니다. 또한 CNS1,2에서 B 세포를 검출하기 위해 mAb 기반 PET 방사성 추적자(즉, immunoPET 이미징 접근법)를 사용하는 것을 보고한 이전 간행물에서도 이를 입증했습니다.
DOTA 킬레이터는 구리-64 표지 펩타이드 및 항체를 사용한 임상 PET 이미징에 사용되어 왔기 때문에 사용되었으며, 다발성경화증 환자의 임상 이미징을 위해 hCD19-mAb를 번역하는 것을 목표로 하고 있습니다. DOTA는 생체 내에서 구리-64에 대한 적절한 결합 친화도를 가지고 있습니다. 생체 내 안정성은 유리 64Cu가 간으로 이동하여 결합 된 방사성 추적자의 신호를 모호하게 할 수 있기 때문에 매우 중요합니다. 따라서 다른 장기와 비교하여 상대적인 신호를 계산하기 위해 간의 신호를 측정하는 것이 중요합니다. 근육은 전형적으로 대조 조직으로 가지고 갑니다, 그러나 EAE의 경우에는, 근육에서 존재하는 염증이 있을 수 있습니다. 64Cu의 반감기는 12.7시간으로, PET로 신호를 측정할 수 있도록 하면서 DOTA-hCD19-mAb가 표적에 결합할 수 있는 충분한 시간을 제공합니다. 접합체를 준비할 때 원하는 DOTA/mAb 비율을 생성하기 위해 mAb에 추가할 DOTA의 양을 결정하기 위해 소규모(75-125μg) 테스트 반응을 수행해야 합니다(예: mol mAb당 6-10배 초과 DOTA-NHS-에스테르 반응은 1-2 DOTA/mAb의 접합체를 제공할 수 있음). 반응 시간 및 온도(예: 2-4시간 또는 4°C 또는 실온에서 야간)도 DOTA/mAb 비율에 영향을 미치므로 최적화해야 합니다. 비방사성 구리를 사용한 적정을 수행하여 mAb당 DOTA 수를 계산할 수 있습니다. 그러나 보다 안정적이고 정확한 결과를 위해 MALDI-MS 및/또는 LC-MS를 수행하는 것이 좋습니다.
계산된 DOTA/mAb 비율은 특정 샘플에 대한 평균값이며 약간의 변동이 예상됩니다. MALDI의 경우, 접합 및 비접합 mAb에 대해 샘플당 여러 번의 샷을 촬영합니다. 그런 다음 접합 대 비접합 비율을 계산하여 평균 DOTA/mAb 수를 결정합니다. DOTA/mAb 비율이 중요한 이유는 너무 많은 킬레이터가 항체 결합을 방해하고 너무 적으면 일관되지 않은 방사선 표지와 낮은 신호로 이어지기 때문입니다. 비율은 일관된 신호 강도와 결합 역학을 유지하기 위해 켤레 배치 간에 매우 가까워야 합니다. 이상적으로는 특정 연구 내의 모든 실험에 동일한 켤레 배치를 사용해야 합니다. 과접합 가능성으로 인한 면역 반응에 대한 잠재적 영향을 줄이기 위한 유망한 기술은 부위 특이적 접합(site-specific conjugation)10 을 사용하는 것인데, 이 접합체는 항체의 중쇄 글라이칸에서 부위 선택적이어서 mAb당 1개의 킬레이트제를 추가할 수 있습니다.
방사성 표지 반응 조건은 항체, DOTA/mAb 비율 및 64Cu 몰 활성의 차이가 방사성 표지에 영향을 미치기 때문에 최고의 표지 효율과 수율을 보장하도록 최적화되어야 합니다. 최적의 64Cu 대 mAb 접합체 비율을 사용하면 정제 없이 방사성 추적자를 사용할 수 있으므로 방사성 표지에 필요한 시간과 중력 흐름 컬럼 및 방사성 붕괴로 인한 손실을 줄일 수 있습니다. 동일한 64Cu to mAb 접합체 비율을 사용할 때도 일관되고 신뢰할 수 있는 몰 활성을 얻을 수 있으며, 이는 여러 마우스 코호트 또는 이미징 연구에서 결과를 비교할 때 특히 중요합니다. ITLC 조건은 각 사용자에 맞게 수정될 수도 있습니다. 정제가 필요한 경우 몰 활성을 계산할 수 있도록 HPLC 및/또는 UV/Vis 분광광도법에 대한 부분 표본을 저장해야 합니다.
이미징을 위해 방사성 표지 항체를 사용하는 것은 어려울 수 있다는 점에 유의하는 것이 중요합니다. 방사성 추적자에 사용되는 항체는 생리학적 영향을 미치지 않도록 생물학적으로 불활성이어야 합니다. 또한 항체는 혈액 체류 기간이 길기 때문에 이미지 품질을 손상시키지 않으면서 적절한 신호-배경 신호를 보장하기 위해 주어진 mAb의 순환, 결합 및 청소를 충분히 오래 기다려야 합니다. 일반적으로 64 Cu 표지 mAb의 경우 20-48시간을 기다리는 것으로 충분하지만, 주어진 설치류 모델에서 이미징을 위한 최적의 시점을 결정하기 위해 새로운 mAb PET 추적자를 평가할 때 주입 후 2, 4, 6, 12, 24, 48시간에 이미징해야 합니다. 신호 대 배경 비율이 가장 높은 ARG 이미지를 획득하는 경우에도 마찬가지입니다. 이 프로토콜의 대표 이미지는 주입 후 18-20 시간에 촬영되었지만 사용 된 방사성 동위 원소에 따라 다른 시점이 사용될 수 있습니다. CD19의 서로 다른 에피토프에 결합하는 서로 다른 항체는 다양한 결과를 생성하므로 엄격하게 특성화해야 합니다.
척수 신호를 분석할 때 호흡으로 인한 움직임을 줄이기 위해 스캐닝 베드에서 마우스를 등을 대고 앉히는 것이 중요합니다. 또한 누운 자세는 EAE 질병의 진행으로 인해 척추 만곡이 증가한 마우스의 척추를 곧게 펴는 데 도움이 될 수 있습니다. 척추와 척수의 신호 검출을 목표로 할 때 고려해야 할 또 다른 중요한 측면은 해당 부위의 관련 면역 반응으로 인해 주사 부위가 추적자와 결합할 수 있으므로 측면에 MOG1-125 를 주입하지 않는 것입니다. 주사 부위가 가까우면 척수 분석을 방해할 수 있습니다. 따라서, 흉부에서의 주사는 본원에 기재된 용도에 바람직하다.
사용되는 이미지 분석 기술은 CNS 이미징에만 해당됩니다. 이미지 분석 소프트웨어 내의 뇌 아틀라스 도구는 PET 및 CT의 등록이 정확하다면 재현 가능하고 신뢰할 수 있는 결과를 제공합니다. 반자동 3D 뇌 지도책을 사용하고 각 쥐의 두개골에 맞게 조정하면 동물 간에 일관된 ROI를 얻을 수 있습니다. 현재 척수의 신호를 분석하기 위한 자동 또는 반자동 접근 방식이 없기 때문에 수동 ROI를 도출해야 합니다. 특히, CD19+ B 세포(또는 골수와 척수 모두에 존재하는 모든 세포 유형)를 정량화할 때 척추와 골수에서 발생하는 신호를 최대한 제거하는 것이 중요합니다. 그 이유는 순진한 생쥐가 EAE 생쥐보다 골수에 더 많은 CD19+ B 세포를 포함하는 것으로 알려져 있기 때문이며, 이 생쥐에서 B 세포는 말초를 떠나 중추신경계 5,11에 침투합니다. 이 골수 신호는 척수의 실제 신호를 모호하게 할 수 있습니다.
척추와 골수에서 오는 신호의 기여를 최소화하면서 실제 척수 신호를 묘사하기 위해 CT 이미지의 Otsu 임계값을 사용하여 척추에 대한 불변의 ROI를 만들 수 있습니다. 그런 다음 척추 내에서 별도의 척수 ROI를 쉽게 그릴 수 있습니다. 대퇴골의 골수를 측정하는 데에도 동일한 기술을 적용할 수 있습니다. 이것은 척수의 추적 결합에 대한 통찰력을 얻는 데 매우 유용한 방법입니다. 그러나 PET의 공간 분해능이 상대적으로 낮고 마우스의 작은 해부학적 영역을 스캔할 때 부분 부피 효과와 관련된 문제로 인해 추가적인 생체 외 확인 기술(예: 감마 카운팅, ARG)을 사용하면 혈액, 뇌척수액 또는 척추로부터의 유출 신호의 존재 없이 척수에서 방사성 추적자 결합을 검증할 수 있습니다.
자궁경부/흉부 척수의 신호는 질병의 중증도와 적응 면역 반응 중에 얼마나 많은 B 세포가 침투하는지에 따라 EAE 마우스에서 달라지는 경향이 있습니다. 침윤하는 B 세포의 수와 순진한 쥐의 골반/척추 골수에 비해 중추신경계의 B 세포 수가 적기 때문에 생쥐에서 척수 조직의 생체 내 정량 분석이 어려울 수 있습니다. 소동물 영상에서 PET의 공간 분해능을 감안할 때, 골수의 신호가 척수 신호로 흘러 넘칠 수 있습니다. 여기에서 완료된 생체 외 생체 분포 및 자가방사선 촬영은 척추뼈와 척수 조직의 PET 신호를 검증하는 데 도움이 됩니다. 생쥐는 해부 전에 관류되어 혈액 풀에서 결합되지 않은 추적자를 제거하여 감마 계수 및 자가 방사선 촬영 결과가 해당 기관의 혈액 풀에 있는 추적자가 아닌 각 장기에 실제로 결합된 추적자를 반영하도록 합니다.
방사성 추적자는 혈액을 통해 순환하며, 특히 항체 추적자의 경우 초기 주입 후 몇 주 동안 혈액에 결합되지 않은 방사성 추적자가 존재하는 경우가 많습니다. 우리는 많은 혈관을 가지고 있는 뇌와 척수를 촬영하고 있기 때문에, 신호의 어느 부분이 실제로 관심 있는 뇌/조직의 추적자 결합에 의한 것인지와 혈액 풀에 존재하는 것의 어느 부분이 원인인지 이해하는 것이 중요합니다. 따라서 뇌 신호를 심장/혈액 웅덩이의 신호로 나눌 필요가 있습니다. 임상 환경에서는 척추뼈의 Otsu 임계값 및 척수 조직의 ROI와 동일한 이미지 분석 기술을 정량화에 사용할 수 있습니다. 생쥐에 비해 인간의 조직 부피가 더 크다는 점을 감안할 때, 부분 부피 효과의 영향이 현저히 적어 정확도가 향상되고 생체 내 결과를 확인하기 위한 생체 외 기술의 필요성이 없어집니다. 클리닉에서 PET를 사용하면 임상의가 개별 B 세포 부담에 따라 각 환자에 대한 맞춤형 치료를 할 수 있습니다.
ARG는 뇌간 및 소뇌와 같은 작은 영역에서 추적자 결합의 공간적 위치를 보다 정확하게 묘사할 수 있도록 고해상도 이미지를 획득하는 데 특히 유용합니다. 면역조직화학적 염색을 위해 동일한 절편 및/또는 인접 절편을 저장하여 B 세포의 존재를 확인할 수 있습니다. 이전에 CD45R/B220(보충 그림 S1)으로 중추신경계 조직을 염색하여 B 세포의 수를 PET 및 ARG 신호 5,9와 연관시켰습니다. 그런 다음 염색을 ARG 결과와 공간적으로 비교하여 방사성 추적자 신호가 염색 패턴과 일치하는지 확인할 수 있습니다. B 세포는 클러스터로 존재하거나 뇌간 전체에 확산될 수 있습니다. PET 감도는 신호를 측정하기에 충분히 높으며, 이는 임상 번역에 고무적입니다. 척수 ARG의 경우 척추뼈에서 척수를 제거하면 측정된 신호가 골수 및/또는 혈액이 아닌 척수 조직의 추적자 결합으로 인한 것이므로 부분적인 부피 효과로 인해 PET 이미지가 흐려질 수 있습니다.
ARG와 유사하게, 체외 감마 계수는 개별 장기의 방사성 신호를 정량화할 수 있습니다. 이 특정 기술의 경우 감마 카운터에 튜브를 배치하기 전에 조직의 습윤 중량을 측정하고 해당 튜브의 바닥에 있는지 확인하는 것이 중요합니다. 튜브에는 마우스 번호와 조직이 표시되어야 올바른 튜브가 사용됩니다. 그런 다음 교정된 저울에서 튜브의 무게를 측정하고 장기를 마이크로그램(0.0001mg)의 가장 가까운 10분의 1로 삽입합니다. 일부 조직은 매우 작으며 전후 난관 질량의 차이는 0.0001mg 정도입니다. 조직은 수분 손실을 방지하기 위해 해부 직후 무게를 측정해야 하며, 이로 인해 질량이 낮아집니다. 체중 측정 후 ARG를 위해 뇌와 척수 튜브를 동결하기 전에 건조를 방지하기 위해 PBS로 채워야 합니다.
공개
CD19 항체는 호라이즌 테라퓨틱스(Horizon Therapeutics)에서 제공했다.
감사의 말
스탠포드 대학의 SCi3 소동물 이미징 시설과 PET/CT에 대한 기술 지원을 해준 Frezghi Habte 박사의 지원에 감사드립니다. LC-MS는 스탠포드 대학 질량분석법(SUMS) 핵심 시설의 핵심 직원이 수행하며, 이 서비스를 제공해주신 직원들에게 감사드립니다. hCD19-mAb를 매우 친절하게 제공해준 Horizon Therapeutics와 특히 Jodi Karnell의 기술 지도와 지원에 감사드립니다. 이 연구는 NIH NINDS(1 R01 NS114220-01A1)의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5 mL 50 kDa MWCO Centrifugal filter | MiliporeSigma | UFC505008 | centrifugal filter |
| 64Cu-CuCl3 | Washington University in St. Louis; University of Wisonsin, Madison; or another vendor | ||
| AR-2000 Radio-TLC Imaging Scanner | Eckert & Ziegler | AR-2000 | |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 x 25 cm, screen only |
| Butterfly Needle Catheter | SAI Infusion Technologies | BLF-24 | |
| DOTA-NHS-ester | Macrocyclics | B-280 | |
| EAE Induction Kit | Hooke Laboratories | EK-2160 | |
| Geiger Counter | Ludlum | 14C | |
| GNEXT PET/CT Scanner | Sofie | GNEXT | |
| Hidex Automatic Gamma Counter | Hidex | AMG | |
| HPLC Column | Phenomenex | 00H-2146-K0 | 5 μm SEC-s3000 400 Å, 300 x 7.8 mm |
| Illustra NAP-5 column | Cytiva | 17085301 | DNA gravity column |
| Image J | NIH | ARG analysis software | |
| Low Protein Binding Collection Tubes (1.5 mL) | Thermo Scientific | PI90410 | |
| NanoDrop Lite Spectrophotometer | Thermo Scientific | 840281400 | UV-Vis micro/nano-spectrophotometer |
| PCR tubes 0.2 mL, for DNA grade | Eppendorf | 30124707 | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| VivoQuant | Invicro | Version 4 Patch 3 | PET Analysis Software; must purchase brain atlas add-on |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | Thermo Scientific | PI89882 | Desalting column |
참고문헌
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Karussis, D. The diagnosis of multiple sclerosis and the various related demyelinating syndromes: A critical review. Journal of Autoimmunity. 48-49, 134-142 (2014).
- Hauser, S. L., et al. B-cell depletion with Rituximab in relapsing-remitting multiple sclerosis. The New England Journal of Medicine. 358 (7), 676-688 (2008).
- Chen, D., Gallagher, S., Monson, N. L., Herbst, R., Wang, Y. Inebilizumab, a B cell-depleting anti-CD19 antibody for the treatment of autoimmune neurological diseases: Insights from preclinical studies. Journal of Clinical Medicine. 5 (12), 107(2016).
- Stevens, M. Y., et al. Development of a CD19 PET tracer for detecting B cells in a mouse model of multiple sclerosis. Journal of Neuroinflammation. 17 (1), 275(2020).
- Chaney, A. M., Johnson, E. M., Cropper, H. C., James, M. L. PET imaging of neuroinflammation using [11C]DPA-713 in a mouse model of ischemic stroke. Journal of Visualized Experiments. (136), e57243(2018).
- Lyons, J. -A., Ramsbottom, M. J., Cross, A. H. Critical role of antigen-specific antibody in experimental autoimmune encephalomyelitis induced by recombinant myelin oligodendrocyte glycoprotein. European Journal of Immunology. 32 (7), 1905-1913 (2002).
- Haugen, M., Frederiksen, J. L., Degn, M. B. cell follicle-like structures in multiple sclerosis-With focus on the role of B cell activating factor. Journal of Neuroimmunology. 273 (1-2), 1-7 (2014).
- James, M. L., et al. Imaging B cells in a mouse model of multiple sclerosis using 64Cu-Rituximab PET. Journal of Nuclear Medicine. 58 (11), 1845-1851 (2017).
- Zeglis, B. M., et al. An enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Lyons, J. -A., et al. B cells are critical to induction of experimental allergic encephalomyelitis by protein but not by a short encephalitogenic peptide. European Journal of Immunology. 29 (11), 3432-3439 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유