Method Article
Визуализация CD19+ В-клеток на экспериментальной мышиной модели аутоиммунного энцефаломиелита с помощью позитронно-эмиссионной томографии
В этой статье
Резюме
В данной статье подробно описывается методология радиоактивного мечения специфического моноклонального антитела к CD19 и способы ее использования для количественного определения В-клеток в центральной нервной системе и периферических тканях мышиной модели рассеянного склероза с использованием методов ПЭТ-визуализации in vivo, подсчета гамма-излучения ex vivo и авторадиографии.
Аннотация
Рассеянный склероз (РС) является наиболее распространенным демиелинизирующим заболеванием центральной нервной системы (ЦНС), поражающим молодых людей, часто приводящим к неврологическим дефицитам и инвалидности по мере прогрессирования заболевания. В-лимфоциты играют сложную и критическую роль в патологии рассеянного склероза и являются мишенью нескольких терапевтических препаратов в клинических испытаниях. В настоящее время не существует способа точного отбора пациентов для специфической анти-В-клеточной терапии или неинвазивной количественной оценки влияния этих методов лечения на нагрузку В-клеток в ЦНС и периферических органах. Позитронно-эмиссионная томография (ПЭТ) обладает огромным потенциалом для получения высокоспецифичной количественной информации о пространственно-временном распределении in vivo и нагрузке В-клеток у живых людей.
В данной работе представлены методы синтеза и использования ПЭТ-индикатора, специфичного для CD19+ В-клеток человека, в хорошо зарекомендовавшей себя В-клеточной мышиной модели рассеянного склероза, экспериментального аутоиммунного энцефаломиелита (ЭАЭ), который индуцируется гликопротеином 1-125 человеческого рекомбинантного миелина олигодендроцита. Здесь описаны оптимизированные методы обнаружения и количественного определения CD19+ В-клеток в головном и спинном мозге с использованием ПЭТ-визуализации in vivo . Кроме того, в этой статье представлены оптимизированные методы подсчета ex vivo гамма-подсчета органов, связанных с заболеванием, включая костный мозг, спинной мозг и селезенку, а также авторадиография высокого разрешения связывания CD19-индикаторов в тканях ЦНС.
Введение
Рассеянный склероз является иммуноопосредованным неврологическим расстройством; Уникальное проявление у каждого пациента может затруднить ведение пациентов как для пациентов, так и для врачей1. Само заболевание характеризуется наличием демиелинизирующих поражений и инфильтрации иммунных клеток в головном и спинном мозге, что приводит к физическим и когнитивнымнарушениям2. Традиционная парадигма о том, что рассеянный склероз является Т-клеточным заболеванием, была впервые поставлена под сомнение во II фазе клинических испытаний ритуксимаба3, терапии, нацеленной на CD20+ субпопуляцию В-клеток. С тех пор были разработаны дополнительные методы лечения В-клетками, нацеленные на CD194, пан-В-клеточный биомаркер, экспрессируемый на более широком спектре В-клеток, что может быть полезным как с диагностической, так и с терапевтической точки зрения. Более того, существующие методы оценки эффективности лечения (т.е. мониторинг количества рецидивов и активности магнитно-резонансной томографии (МРТ)) не позволяют своевременно оценить ответ, что подвергает пациентов значительному риску повреждения ЦНС из-за неоптимального подбора и оптимизации терапии. Следовательно, существует острая необходимость в стратегиях мониторинга специфических иммунных клеток, таких как CD19+ В-клетки, в режиме реального времени в ЦНС и на периферии пациентов с рассеянным склерозом.
ПЭТ-визуализация — это надежный метод визуализации, который позволяет визуализировать in vivo все тело интересующей нас мишени, такой как CD19. В то время как заборы крови, записи о частоте рецидивов и мониторинг поражения с помощью МРТ дают представление об эффективности лечения, ПЭТ-визуализация может позволить исследователям и клиницистам контролировать эффективность терапии по всему организму. Такой упреждающий подход к терапевтическому мониторингу позволяет клиницистам оценивать эффективность лекарств в режиме реального времени, что позволяет быстро вносить коррективы по мере необходимости. Мониторинг расположения и плотности клеточных популяций, ассоциированных с заболеванием, также позволяет оценить степень тяжести заболевания, используя анатомическую информацию, специфичную для конкретного пациента. Таким образом, крайне важно создать воспроизводимые аналитические методы, чтобы надежно использовать весь потенциал ПЭТ-визуализации в клинических и доклинических условиях.
В данной работе описаны методы (рис. 1) проведения ПЭТ-визуализации, подсчета гамма-излучения ex vivo и авторадиографии (АРГ) CD19+ В-клеток с помощью меченного 64 Cu античеловеческого моноклонального антитела (мАТ), известного как 16C4-TM (64Cu-hCD19-mAb), в экспериментальной мышиной модели аутоиммунного энцефаломиелита (ЭАЭ) рассеянного склероза, индуцированного у трансгенных мышей, экспрессирующих CD19 (hCD19) человека, с использованием гликопротеина 1-125 или олигодендроцитов человека (MOG1-125). Мы также предлагаем методы для точной и воспроизводимой оценки связывания радиоактивных индикаторов в головном и спинном мозге, которые являются критически важными участками патогенеза, часто серьезно затронутыми в этой и других нейродегенеративных моделях. Эти методы позволяют проводить неинвазивные исследования роли В-клеток в патологии заболеваний и имеют потенциал для клинического применения для оценки эффективности анти-В-клеточной терапии при рассеянном склерозе.
протокол
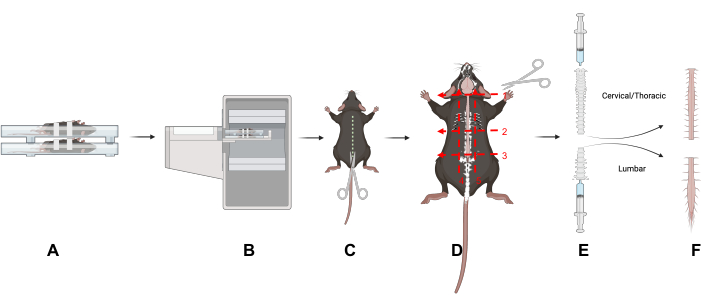
Рисунок 1: Дизайн исследования. Обзор ключевых приемов в этой статье. (А) Размещение мышей на сканирующем столе на спине уменьшает подвижность позвоночника. (B) ПЭТ/КТ визуализация мышей. (C) Сделайте надрез вдоль спинной стороны животного, чтобы обнажить позвоночный столб. (D) Разделить позвоночный столб пополам на шейный/грудной и поясничный отделы и удалить участки после пяти указанных разрезов. (E) Используйте шприц для извлечения спинного мозга из позвоночного столба, сделав уплотнение шприцем и позвоночным столбом и промывая черепные и каудальные концы позвоночного столба, как показано на рисунке. (F) Изолированные шейно-грудные и поясничные сегменты спинного мозга. Аббревиатура: ПЭТ/КТ = Позитронно-эмиссионная томография/компьютерная томография. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Все исследования на животных проводились в соответствии с Административной комиссией по уходу за лабораторными животными (APLAC) при Стэнфордском университете, программой, аккредитованной Ассоциацией по оценке и аккредитации ухода за лабораторными животными (AAALAC International). Мышей акклиматизировали в виварии не менее 7 дней до начала исследования, чтобы свести к минимуму стресс у мышей, так как стресс может повлиять на индукцию EAE.
1. Индукция ЭАЭ у самок гуманизированных CD19 мышей
- Индуцировать гуманизированных самок мышей CD19 C57BL/6J в возрасте 9-13 недель с ЭАЭ, как описано ранее5 с использованием MOG1-125.
2. Уход за животными и оценка в мышиной модели EAE
- Оценка прогрессирования заболевания и уход за мышами, как описано ранее5. Вкратце, оцените эту модель по шкале от 1 до 5 следующим образом: 1 - слабость/хромота хвоста, 2 - ослабление задних конечностей, 3 - паралич задних конечностей, 4 - паралич задних конечностей со слабостью передних конечностей, 5 - умирание.
3. Конъюгация мАТ, радиомечение и характеристика
- Конъюгируют бифункциональный хелатор 1,4,7,10-тетраазациклододекан-1,4,7,10-эфир моно-N-гидроксисукцинимида тетрауксусной кислоты (ДОТА-NHS-эфир) с hCD19-mAb до радиометки с 64Cu.
- Используя обессоливающую колонну, замените буфер для хранения hCD19-mAb на буфер HEPES (pH 8,5-9): обработайте обессоливающие колонны HEPES. Рассчитайте необходимое количество колонок, исходя из объема образца обессоливающей колонны, емкости и требуемого объема мАТ: пробирки 0,5 мл: 30-130 мкл объема пробы, 300 мкл промывки; Пробирки по 2 мл: объем образца 200-700 мкл, промывка 1 мл.
- Охладите центрифугу до 4 °C для замены буфера через обессоливающую колонну.
- Достаньте колонку для обессоливания из холодильника. Снимите нижнюю часть обессоливающей колонны, ослабьте крышку и поместите колонну в сборную трубу.
- Центрифугу при 1 500 × г в течение 2 мин для удаления раствора для хранения; Выбросьте проточный поток, содержащий раствор для хранения, и повторно используйте сборную трубку. Отметьте линию на колонне, где самая высокая точка обессоливающей уплотненной смолы наклонена вверх.
- Добавьте буфер HEPES на нижнюю сторону обессоливающей колонны. Поместите обессоливающую колонну в центрифугу линией, обращенной наружу; Отжим при 1 500 × г в течение 2 мин. Выбросьте проточную трубку и повторно используйте сборную трубку.
- Повторите шаги 3.1.4 и 3.1.5 2 раза, используя ту же сборную трубку и отбрасывая проточный канал между этапами.
- Поместите кондиционированную обессоливающую колонну в новую сборную трубку и этикетку; эта пробирка будет содержать hCD19-mAb.
- Добавьте hCD19-mAb в верхнюю часть кондиционированной обессоливающей колонны (колонок) и используйте буфер HEPES для промывки пустого флакона mAb; Добавьте его в верхнюю часть обессоливающей колонны (общий объем в соответствии с рекомендациями производителя). Отжим при 1 500 × г в течение 2 минут, чтобы хCD19-мАТ выделился. Поддерживайте проточный поток, содержащий hCD19-mAb.
- Измерьте концентрацию hCD19-mAb с помощью УФ/ВИД спектрофотометра и при необходимости отрегулируйте до 0,5 мкг/мкл с помощью буфера HEPES.
- К раствору hCD19-mAb добавляют 1/50 объема раствора мАТ 0,5 М ЭДТА, чтобы получить окончательную концентрацию ЭДТА 0,01 М в растворе hCD19-mAb. Дайте раствору hCD19-mAb-EDTA постоять при комнатной температуре в течение 15 минут.
- Достаньте эфир DOTA-NHS из морозильной камеры и дайте ему нагреться до комнатной температуры (10-15 минут). Рассчитайте объем ДМСО для добавления к сложному эфиру DOTA-NHS, чтобы получить концентрацию DOTA, которая позволит добавить желаемое молярное соотношение ДОТА/мАТ (которое обычно составляет порядка 1-2 ДОТА/мАТ).
ПРИМЕЧАНИЕ: Объем сложного эфира DMSO-DOTA-NHS, добавленный к hCD19-mAb, не должен превышать 10% от объема mAb. Это следует сделать с помощью электронной таблицы, чтобы это можно было сделать быстро и многократно. - Исходя из желаемого соотношения DOTA и hCD19-mAb, рассчитайте количество сложного эфира DOTA-NHS, которое нужно добавить к hCD19-mAb.
нмоль мАТ × 10 ДОТА/мАТ → нмоль DOTA → мг DOTA → мг/мл DOTA/DMSO → мл ДМСО → фактор разбавления раствора ДОТА/ДМСО - Взвесьте 1-2 мг эфира DOTA-NHS и осторожно добавьте правильный объем (рассчитанный на шаге 3.1.11) DMSO в эфир DOTA-NHS; Смешайте и открутите.
- Пипетку рассчитанного объема раствора сложного эфира DOTA-NHS (шаг 3.1.12) в раствор hCD19-mAb; Перед добавлением протрите наконечник пипетки снаружи, чтобы убедиться, что не добавляется дополнительный эфир DOTA-NHS (без изменения количества в пипетке). Аккуратно перемешайте и открутите.
- Поместите в холодильник (4 °C) для реакции на ночь (12-16 ч).
- Очистка и концентрация
- Охладите центрифугу до 4 °C для этапов замены буфера центробежного концентратора; поместите металлический блок ПЦР-пробирок на сухой лед для мгновенного замораживания конъюгата.
- Достаньте реакцию DOTA-hCD19-mAb из холодильника и погасите, добавив буфер TRIS биологического качества: 10% от общего объема реакции. Извлеките 10-20 мкг образца для масс-спектрометрического анализа.
- Подготовьте колонну (колонны) для обессоливания, как описано выше (шаги 3.1.1-3.1.5), используя буфер из ацетата аммония 0,1 М, pH 5,5.
- Буферный обмен раствора DOTA-hCD19-mAb на ацетат аммония (шаги 3.1.1-3.1.8).
- Концентрировать раствор DOTA-hCD19-mAb: добавить раствор в центробежный концентратор с молекулярной массой 50 кДа, следуя рекомендациям производителя по объему. Центрифуга при 4 000 × г в течение 10 мин (или до уменьшения объема на 80%-90%); Отбросьте протекание.
- Повторите еще девять раз (всего 10): добавьте достаточное количество ацетата аммония, чтобы вернуть объем к максимальному рекомендуемому объему.
ПРИМЕЧАНИЕ: Общее количество должно быть таким, как было добавлено изначально, включая то, что осталось в столбце, обычно 400-450 мкл для центробежного концентратора емкостью 500 мкл.- Промойте реакционный флакон буфером из ацетата аммония, чтобы удалить остаточный DOTA-hCD19-mAb; Добавьте промывку в центробежный концентратор.
- Центрифуга при 4 000 × г в течение 10 мин.
ПРИМЕЧАНИЕ: Время отжима может быть уменьшено при последующих вращениях, если объем уменьшится до 80%-90% за меньшее время.
- Извлеките белковый раствор из центробежного концентратора. Обратите внимание на общий объем DOTA-hCD19-mAb.
- В центробежный концентратор 2 добавьте достаточное количество буфера ацетата аммония для общего объема 100 мкл и пипетку для перемешивания. Закройте колонку центробежного концентратора и переверните. Отжим при 4 000 × г в течение 2 мин, чтобы собрать раствор. Пересадите в новую трубку.
- В центробежном концентраторе 500 используйте пипетку для сбора раствора mAb из центробежного концентратора; Добавьте в новый тюбик.
- Измерьте концентрацию с помощью УФ-ВИД спектрофотометра. Если концентрация более 2 мг/мл, разбавить ацетатом аммония до 2 мг/мл.
- Аликвота 100 мкг на ПЦР-пробирку (примерно 50 мкл); Маркируйте пробирки DOTA-hCD19-mAb, датой, массой и концентрацией. Раскрутите флаконы.
- Мгновенно заморозьте DOTA-hCD19-mAb на охлажденном ПЦР-блоке на сухом льду (или заморозьте на сухом льду). После того, как все образцы будут заморожены, поместите их в морозильную камеру с температурой -80 °C.
- Измерьте количество DOTA на hCD19-mAb с помощью масс-спектрометрии. Сохраняйте образец неконъюгированных (чистых) антител из каждой конъюгации, чтобы рассчитать соотношение. Используйте уравнение (1), приведенное ниже; молекулярная масса сокращенно MW.
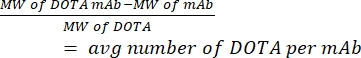 (1)
(1)
- Радиомаркировка
ПРИМЕЧАНИЕ: Носите соответствующие средства индивидуальной защиты (СИЗ) для работы с радиоактивными веществами, включая лабораторный халат, перчатки, индивидуальное тело и кольцевые дозиметры, в соответствии с институциональными правилами. Регулярно осматривайте и меняйте перчатки, чтобы предотвратить радиоактивное загрязнение. Используйте свинцовое экранирование и по возможности увеличьте расстояние до радиоактивного источника, обращаясь с ним щипцами.- Перенесите радиоактивность из транспортировочного флакона в новый флакон с помощью пипетки. Измерьте радиоактивность.
- Удалите аликвоту для первой реакции радиоактивного мечения. Добавьте 50 мкл ацетата аммония (рН 5,5) на 1 мКи 64Cu-CuCl3. Измерьте pH, пипетируя 1 мкл на pH-полоску с диапазоном 5,5 с достаточным разрешением, чтобы различать 5 и 6.
- Если рН не составляет 4-5,5, изменяйте его, используя 1 М NaOH или 0,1 М HCl. Добавляйте небольшие количества, 1-5 мкл, 1 М NaOH, если pH меньше 4, или 0,1 M HCl, если pH больше 5,5, пока не будет достигнут правильный pH. С каждым добавлением тщательно перемешивайте, отжимайте и измеряйте pH, как описано выше. Записывайте каждое добавление и удаление любого раствора (в том числе для проверки pH), чтобы можно было рассчитать окончательный объем.
- После достижения оптимального рН добавьте 10 мкг DOTA-hCD19-mAb на 1 мКи 64Cu-CuCl3. Аккуратно перемешайте и быстро перемешайте.
- Поместите реакционный флакон в термомиксер, установленный на 37 °C и 400 оборотов в минуту (об/мин).
- Через 30 мин погасите реакцию: разделите общий объем реакции на 50 и добавьте этот объем 0,5 М ЭДТА в реакционную смесь.
- Определите эффективность маркировки с помощью мгновенной тонкослойной хроматографии (ITLC) для измерения процентного содержания связанной и свободной меди в растворе.
- Нарежьте полоски бумаги TLC шириной 1 см. Отметьте по 1 см сверху и снизу полоски и подготовьте пробирку (коническую колбу объемом 50 мл) с подвижной фазой менее 1 см 0,1 М лимонной кислоты (уровень подвижной фазы должен быть ниже отметки 1 см на полоске при помещении в пробирку).
- Нанесите пипетку 1 мкл реакционного раствора на полоску на нижнюю отметку 1 см (лицевая сторона растворителя) и поместите полоску в пробирку. Следите за тем, пока передняя часть растворителя не достигнет верхней отметки в 1 см, снимите полоску и заверните ее в кусок полиэтиленовой пленки.
- Поместите полоску на платформу и пропустите ее через сканер радио-ТСХ. Найдите радиоактивно меченый мАТ в начале координат и свободный 64Cu, который перемещается вместе со подвижным фазовым фронтом (рис. 2). Если процент свободной меди составляет менее 5% (95% эффективности маркировки), приступают к введению животным. Если процент свободной меди больше 5%, приступайте к очистке.
ПРИМЕЧАНИЕ: Процентное содержание свободной меди обычно зависит от соотношения DOTA-mAb к 64Cu, времени реакции, pH и температуры. Условия реакции должны быть оптимизированы каждым пользователем для каждого нового мАТ, чтобы обеспечить стабильные результаты.
- Очистка с помощью одноразовой гравитационной колонки класса ДНК
- Подготовьте одноразовую гравитационную колонку класса ДНК (колонку для обессоливания/замены буфера) в соответствии с указаниями производителя. Поместите одноразовую гравитационную колонку класса ДНК на кольцевую подставку или другой инструмент за соответствующей свинцовой защитой; Убедитесь, что устройство устойчиво и легко перемещается. Поместите трубку под колонну.
- Пипеткой нанесите сырую реакционную смесь на смолу с гравитационной колонкой. Подождите, пока вся жидкость стечет в смолу. Пипетки достаточное количество PBS, чтобы довести весь объем (сырой продукт плюс PBS) до 500 мкл. Утилизируйте проточный поток.
- Поместите колонку на центрифужные пробирки объемом 1,5 мл с маркировкой 1-10. Добавьте в колонку 1 мл PBS. Набирайте по пять капель в каждую пробирку до тех пор, пока поток не прекратится.
ПРИМЕЧАНИЕ: Может потребоваться менее 10 пробирок. - Закройте нижнюю часть колонны и измерьте остаточную радиоактивность. Отмерьте каждый флакон с помощью проточного отверстия. Для каждого флакона с более чем 50 мкКи подготовьте ITLC на шаге 3.3.7 для измерения процентного содержания связанной меди в каждой фракции.
ПРИМЕЧАНИЕ: Первые одна или две фракции будут содержать только подвижную фазу; радиоактивно меченые мАТ будут элюировать первыми (обычно дроби от 2 или 3 до 5 или 6), а свободные 64Cu будут элюировать последними (некоторые из них будут прилипать к колонке). Процентное соотношение 64Cu может варьироваться в зависимости от фракции. - Комбинируйте фракции со связующим более 95% (менее 5% свободной меди); Используйте раствор для инъекций. При необходимости проводят ВЭЖХ с исключением размера, чтобы подтвердить радиомечение5 и рассчитать молярную активность. Сохраните аликвоту для измерения концентрации на УФ-ВИД спектрофотометре после того, как она распадется в течение 10 периодов полураспада (127 ч или 5,3 дня).
4. Приготовление дозы
ПРИМЕЧАНИЕ: Перед обращением с дозой наденьте надлежащие СИЗ, включая лабораторный халат, дозиметры для тела и пальцев и перчатки.
- Введите 64Cu-DOTA-hCD19-mAb за 18-24 часа до ПЭТ-сканирования, чтобы обеспечить адекватную циркуляцию радиоактивного индикатора в организме.
- Немедленно поместите свинцовый контейнер с 64Cu-DOTA-hCD19-mAb за свинцовое экранирование. Включите счетчик Гейгера, чтобы контролировать потенциальное загрязнение.
ПРИМЕЧАНИЕ: Часто меняйте перчатки при работе с радиоактивными материалами. Рекомендуется надевать двойные перчатки во время нанесения дозы, чтобы облегчить быструю смену перчаток. Всегда помещайте загрязненные острые предметы и мусор в специально отведенное место для мусора. - Разбавьте 64Cu-DOTA-hCD19-mAb до соответствующей концентрации в пластиковой центрифужной пробирке объемом 1,5 мл с низким связыванием.
ПРИМЕЧАНИЕ: 64Cu-DOTA-hCD19-mAb будет связываться с пластиком, если он не имеет низкой вязкости; до 64Cu свяжется со стеклом.- Разбавьте радиоактивный индикатор физиологическим раствором, чтобы предотвратить радиолиз и упростить получение согласованных доз.
- По возможности подготовьте дозы для введения от 75 до 150 мкКи в 100 мкл. Следите за тем, чтобы максимальный общий объем ввода не превышал 10% от массы тела мыши.
- Используйте инсулиновый шприц объемом 500 мкл (50 куб. см), чтобы набрать дозу из пластиковой пробирки с низким связыванием. Убедитесь, что в шприце нет пузырьков, так как он будет вводиться внутривенно.
- Предварительно маркируйте шприцы соответствующими номерами животных.
- Записывайте дозу, активность и время в лабораторный блокнот для анализа данных.
- Подготовьте дозы для инъекции сразу после катетеризации животных, чтобы сократить время под наркозом.
- После того, как дозы подготовлены, подготовьте стандарт (фантом) для сканирования для генерации калибровочного коэффициента.
- Наполните коническую пробирку объемом 15 мл 50-75 мкКи активностью, разбавленной в воде (или PBS).
ПРИМЕЧАНИЕ: Обеспечьте тщательное перемешивание раствора. Стандартом могут быть свободные 64Cu, оставшиеся от маркировки.- Измеряйте количество активности в стандарте и записывайте время.
- Наполните коническую пробирку объемом 15 мл 50-75 мкКи активностью, разбавленной в воде (или PBS).
5. Канюляция и инъекция
ПРИМЕЧАНИЕ: См. ранее описанные методы 6 для внутривенной канюляции мышей для введения радиоактивного индикатора6.
- Взвесьте и оценивайте тяжесть заболевания мышей, как описано в разделе 2.1, прежде чем обезболивать мышей в разборном боксе, наполненном 1,5-3% изофлураном, в рамках подготовки к введению радиоактивных индикаторов.
ПРИМЕЧАНИЕ: Эти мыши будут вводиться на столешнице, а не на ПЭТ-сканере, как описано выше. Нет необходимости приклеивать катетеры на место для инъекции, так как мыши не будут перемещаться между канюляцией и инъекцией. - После того, как мышь будет канюлирована, введите иглу в конец катетера и медленно вводите. После инъекции необходимо промыть катетер небольшим физиологическим раствором, чтобы убедиться, что введена вся доза.
ПРИМЕЧАНИЕ: Объем должен быть приблизительно равен мертвому объему катетера, который составляет 50 мкл для катетеров, используемых авторами.- Сделайте инъекцию поверх кусочка лабораторной салфетки, чтобы собрать капли радиоактивного индикатора; Учитывайте это при измерении остаточной дозы.
- Запишите время инъекции в лабораторный блокнот.
- Извлеките канюлю сразу после инъекции. Измерьте канюлю, шприц дозы и ткань с помощью калибратора дозы, чтобы определить остаточную дозу, которая не была введена мыши.
- Записывайте активность и время в лабораторную тетрадь.
- После того, как мышам будет введена инъекция, пометьте их клетки карточкой клетки, указывающей, что мыши радиоактивны. Регистрируйте и регистрируйте клетки в соответствии с руководящими принципами учреждения. Затем поместите мышей в специально отведенную для этого радиоактивную зону.
6. ПЭТ/КТ визуализация
- Проводят ПЭТ-визуализацию через 18-24 ч после введения 64Cu-DOTA-hCD19-mAb. Взвесьте и оцените мышей перед сканированием.
ПРИМЕЧАНИЕ: Инструкция по эксплуатации сканера зависит от используемого сканера.- Убедитесь, что рентгеновский компонент сканера ПЭТ/КТ прогрет и готов к съемке.
- Откройте программное обеспечение для сбора данных ПЭТ-сканера на компьютере.
- В раскрывающемся меню Investigator Login (Вход в систему исследователя ) нажмите на соответствующую информацию о лаборатории.
- На странице Проект создайте новый проект или выберите существующий проект в раскрывающемся меню.
- Когда на экране автоматически появится запрос на инициализацию, нажмите «Домашняя кровать» и подождите, пока кровать вернется домой. Затем нажмите «Разогреть CT».
- Убедитесь, что защитная дверца ТТ закрыта, чтобы КТ мог прогреться.
- Пока сканер разогревается, нарежьте мышей EAE и введите им подкожно 0,2-0,4 мл теплого физиологического раствора в бок для гидратации.
- После того, как сканер прогреется, вернитесь к компьютеру, чтобы настроить ПЭТ-сканирование для исследования.
ПРИМЕЧАНИЕ: Они могут быть настроены до дня сканирования.- Под заголовком « Недавние исследования » нажмите « Создать новое исследование». Заполните название исследования, протокол, состав и информацию о предмете.
- При выполнении ПЭТ/КТ сначала выберите «Протокол ПЭТ », а затем выберите «Протокол КТ».
ПРИМЕЧАНИЕ: Как правило, для сканирования модели мыши EAE достаточно стандартной компьютерной томографии. Компьютерная томография длится 1 минуту и получена с биннингом 2 x 2 при напряжении 80 кВпик, токе 150 мкА и 720 проекциях. Компьютерные томограммы реконструируются с помощью модифицированного алгоритма Фельдкампа. - Для протокола ПЭТ выберите 10-15-минутное статическое сканирование 64-медных металлов. Если этого сканирования еще нет в списке доступных протоколов, добавьте его, нажав на вкладку Протоколы в меню Стандартные , Создать новый протокол | Выпадающее меню Изотопы . Если нужного изотопа нет в списке, нажмите « Еще» | Добавить из библиотеки и добавить нужный изотоп. Определите продолжительность сканирования, нажмите на переключатель Static Scan, назовите протокол и нажмите Save.
- Вернитесь на вкладку «Исследования » и продолжите присваивать имена и настраивать все желаемые сканы на день.
ПРИМЕЧАНИЕ: Рекомендуется также настроить одно сканирование «КТ», используя только стандартную компьютерную томографию, чтобы проверить положение кровати первого сканирования, чтобы обеспечить оптимальное размещение. Это должен быть первый запуск сканирования для исследования.
- При выполнении ПЭТ/КТ сначала выберите «Протокол ПЭТ », а затем выберите «Протокол КТ».
- Под заголовком « Недавние исследования » нажмите « Создать новое исследование». Заполните название исследования, протокол, состав и информацию о предмете.
- Как только сканер будет готов, обезболивайте мышей в разборном боксе, чтобы подготовить их к сканированию.
ПРИМЕЧАНИЕ: На этой стадии мыши, скорее всего, очень больны; Рекомендуется свести к минимуму время нахождения под наркозом.- Нанесите гель для глаз.
- Убедитесь, что стол для сканирования с четырьмя мышами оснащен нагревательными элементами, такими как электрогрелки или нагретый воздух, с изофлураном, установленным на 1,5–2%, и включенной электрогрелкой (рис. 3). Поместите мышей в положение лежа на спине на сканирующем столе.
- По мере прогрессирования заболевания ЭАЭ позвоночник мыши сильно искривляется. Сканируйте мышей, когда они лежат на спине, чтобы максимально выпрямить позвоночник и улучшить последующий анализ. Осторожно потяните за хвост мыши, чтобы помочь выпрямить позвоночник.
- Оказавшись в положении лежа на спине, надежно заклейте каждую мышь мягкой лентой для микроскопа. Используйте одну полоску ленты на голове, а другую осторожно на животе, чтобы свести к минимуму движения из-за дыхания.
- Запишите в лабораторный блокнот, какая мышь находится в каком положении сканирования.
- После того, как мыши будут закреплены, вернитесь к сканирующему компьютеру, чтобы управлять сканером.
- Откройте меню «Контроллер движения ». Нажмите на поле зрения ПЭТ-центра , чтобы переместить мышей на сканирующем столе в кольцо ПЭТ. Для первого сканирования дня нажмите на CT Center FOV. После того, как вы окажетесь в нужном положении, запустите компьютерную томографию, чтобы убедиться, что положение правильное; Повторяйте до тех пор, пока положение кровати не станет удовлетворительным.
- Поместите небольшой кусочек белой ленты на сканирующую кровать, чтобы отметить правильное расположение кровати до конца исследования.
- После того, как кровать будет на месте для ПЭТ-сканирования, запустите последовательность сканирования, нажав кнопку «Выполнить».
- Подождите, пока сканер автоматически переместится с ПЭТ-кольца на КТ.
- Всегда визуально проверяйте, переместились ли животные в правильное положение как для ПЭТ, так и для КТ.
- Запишите время начала сканирования в лабораторный блокнот для коррекции затухания дозы, введенной во время анализа данных.
- После завершения сканирования дайте изображению восстановиться. Проверяйте данные перед тем, как удалять животных.
ПРИМЕЧАНИЕ: Реконструкция 3D-упорядоченных подмножеств ожидания и максимизации (OSEM) займет около 5 минут для статического сканирования. - Визуально проверьте и подтвердите данные, используя селезенку в качестве положительного контроля, так как эта ткань содержит большое количество В-клеток. Извлеките животных из сканирующего стола и поместите их в заполненный изофлураном ящик для подготовки к перфузии и последующему вскрытию.
- Повторите шаги 6.5-6.12 для оставшихся мышей в исследовании.
- Когда все мыши будут отсканированы или при сканировании группы, имеющей свободное место в сканирующем стану, просканируйте стандарт, подготовленный на шаге 4.6.
7. Диссекция для подсчета гамма-гамма ex vivo и авторадиографии
- Перед вскрытием убедитесь, что все пробирки для подсчета гамма-излучения и центрифуги предварительно взвешены.
- Эвтаназию проводят через перфузию, как описано выше, с помощью PBS и торакотомии, в то время как мыши находятся под глубоким наркозом (непрерывная ингаляция 4% изофлурана, 2 л/мин 100% O2).
- Чтобы удалить костный мозг, разрежьте обе бедренные кости в колене и тазу. Убедитесь, что обе головки удалены из бедренной кости.
- Поместите обе бедренные кости в центрифужную пробирку объемом 0,5 мл с отверстием в нижней части (с помощью иглы 20 G) и отрезанной крышкой.
- Поместите пробирку объемом 0,5 мл, содержащую бедренные кости, в центрифужную пробирку объемом 1,5 мл с отрезанной крышкой.
- Поместите всю пробирку в мини-центрифугу. Отжим в течение 4 минут при 4 500 × г.
ПРИМЕЧАНИЕ: Костный мозг должен быть вытеснен через отверстие в центрифужной пробирке объемом 0,5 мл и осесть на дне центрифужной пробирки объемом 1,5 мл.- Отделите трубки. Взвесьте пустые бедренные кости в центрифужной пробирке объемом 0,5 мл. Взвесьте костный мозг в центрифужной пробирке объемом 1,5 мл. Поместите каждую центрифужную пробирку в пробирки для подсчета гамма-излучения.
- Удалите мозг с помощью щипцов и ножниц, стараясь сохранить ствол мозга нетронутым. Поместите мозг в гамма-счетную трубку. Запишите сухой вес, промойте PBS и держите на льду до тех пор, пока не будете готовы к подсчету.
- Чтобы удалить спинной мозг, выполните следующие действия.
- Снимите кожу и шерсть, сделав надрез на спинной стороне животного, чтобы обнажить позвоночный столб (рисунок 1).
- Отделите поясничный (L) от шейного (C) и грудного отделов, разрезав по трем поперечным плоскостям вокруг и через позвоночный столб: у основания шеи (позвонок C1) (рисунок 1D, номер 1); у основания грудной клетки (позвонок L1) (рис. 1D, No 2); у основания таза (L5 позвонок) (рис. 1D, No 3).
- Разрез под грудной клеткой (рисунок 1D, No2).
- Разрез непосредственно над крестцом, чтобы отделить поясничный отдел позвоночника. Осторожно обрежьте позвоночный столб от тазового конца до тех пор, пока не станет виден поясничный отдел спинного мозга (рис. 1D, No 3). Обрежьте окружающие ткани, чтобы изолировать поясничный и шейный/грудной отделы позвоночного столба (рис. 1D, номера 4 и 5).
- Для изгнания спинного мозга используйте шприц со скользящим наконечником (3-10 мл), наполненный PBS. Создайте уплотнение между шприцем и позвоночным столбом с помощью большого и указательного пальцев.
- Осторожно протолкните PBS через шприц, чтобы вытеснить спинной мозг на впитывающую прокладку (Рисунок 1E); Повторите то же самое для обоих отделов позвоночника. Поместите ткани спинного мозга в гамма-счетную трубку.
- Запишите сухой вес и добавьте PBS, чтобы убедиться, что ткань находится на дне пробирки, чтобы избежать высыхания. Положите трубку на лед до тех пор, пока она не будет готова к счету.
- Выталкивают шейный/грудной отдел спинного мозга из краниального конца и поясничный отдел спинного мозга из каудального конца позвоночного столба (рисунок 1E).
8. Подсчет гамма-излучения ex vivo
- Откройте программное обеспечение счетчика гамма-излучения. Перейдите к рабочему списку и выберите нужный протокол, например протокол подсчета 30 с для 64Cu.
- Подготовьте не менее трех стандартов в отдельных пробирках. Запустите их сейчас для использования в анализе (шаг 10.2). Стремитесь сделать три реплицируемых объема и количества активности в трех отдельных пробирках.
ПРИМЕЧАНИЕ: Объем 500 мкл дает хорошие результаты. В то время как активность будет определяться используемой машиной, 10 мкКи, как правило, достаточно хорошо. - Поместите стандарты в стойку со штрих-кодом, соответствующим требуемому протоколу. Установите стойку на гамма-счетчик.
- После регистрации веса органов поместите пробирки с органами на стойку для подсчета гамма-излучения после пробирок, содержащих эталоны.
ПРИМЕЧАНИЕ: Органы, представляющие интерес для этой модели, могут включать аксиальные лимфатические узлы, кровь, костный мозг, головной мозг, шейные лимфатические узлы, бедренную кость, сердце, печень, поясничный отдел спинного мозга, мышцы, селезенку, хвост и шейный/грудной отдел спинного мозга. - Поставьте стойку со стоп-кодом в заднюю часть гамма-счетчика.
- Нажмите кнопку воспроизведения на компьютере. По возможности не нажимайте кнопку воспроизведения до тех пор, пока не будет запущено несколько стоек или органов, чтобы все трубки могли непрерывно подсчитываться в одном файле. Убедитесь, что стойка со штрих-кодом остановки находится в задней части гамма-счетчика для каждого запуска.
- Выполняйте до тех пор, пока не будут подсчитаны все образцы. Сохраните и экспортируйте файл.
9. Ауторадиография ex vivo (АРГ) тканей ЦНС
- Следуйте ранее опубликованным шагам для АРГ головного и спинного мозга (исключая шаги 2-6, описанные Chaney et al., поскольку мышам уже вводят радиоактивный индикатор из ПЭТ-сканирования)6.
ПРИМЕЧАНИЕ: Конкретные инструкции по подготовке кассеты ARG спинного мозга приведены здесь6. - После завершения гамма-подсчета для поясничного и шейного/грудного отделов спинного мозга немедленно поместите трубки на лед до тех пор, пока не будут подсчитаны все ткани ЦНС.
ПРИМЕЧАНИЕ: Обратитесь к ранее опубликованному методу АРГ головного мозга6. - Осторожно наклоните трубки, чтобы спинной мозг выпал на впитывающую прокладку. Если спинной мозг прилипает к стенке трубки, осторожно промойте ее холодным PBS и снова наденьте трубку. Тщательно высушите каждый спинной мозг, аккуратно промокнув лабораторной салфеткой. Положите высушенный спинной мозг в организованном виде на плотный черный лист бумаги.
- Пометьте рядом со спинным мозгом белой ручкой для легкой идентификации.
- Оставьте место в углах и в середине черной бумаги, чтобы разместить стопки из трех предметных стекол микроскопа, которые будут действовать как прокладки, предотвращающие сдавливание спинного мозга при закрытии кассеты ARG. Используйте 5-7 стопок.
- После того, как все поясничные и шейные/грудные отделы спинного мозга будут размещены на черной бумаге и помечены, осторожно поместите лист бумаги в кассету ARG. Поместите открытую кассету на поднос с сухим льдом, чтобы заморозить спинной мозг.
- После замораживания аккуратно поместите полиэтиленовую пленку между экраном для хранения цифрового люминофора и спинным мозгом и поместите экран поверх образцов. Немедленно закройте кассету и поместите ее в морозильную камеру с температурой -20 °C примерно на 10 периодов полураспада (~127 ч).
- Когда время экспозиции закончится, отсканируйте пленку с помощью люминофорного тепловизора. Проанализируйте полученное цифровое изображение (инструкции см. в разделе 12).
10. Анализ данных о биораспределении
- Создайте электронную таблицу «Коррекция дозы» для математического определения временной поправки на радиоактивный распад, тем самым нормализуя дозы облучения и позволяя сравнивать испытуемых.
- Скорректируйте все дозы до времени инъекции с учетом остаточной активности, оставшейся в шприце и катетере после инъекции.
- Используя стандарты, подготовленные на шаге 8.2, усредните количество активности (мкКи) и нормализованное количество отсчетов в минуту (CPM). Разделите среднюю цену за тысячу показов на среднюю стандартную величину активности, чтобы получить CPM/мкКи.
ПРИМЕЧАНИЕ: Убедитесь, что количество активности для каждого эталона скорректировано до того времени, когда гамма-счетчик отсчитывает CPM стандартов. Гамма-счетчик должен нормализовать все значения CPM ко времени начала протокола.
- Настройте электронную таблицу «Результаты», чтобы рассчитать окончательный процент введенной дозы на грамм ткани (%ID/г) для каждого образца.
- Коррекция с точки зрения снижения нормализованного CPM с гамма-счетчика для каждого образца, отсчитываемого до времени инъекции животного.
ПРИМЕЧАНИЕ: Коррекция затухания может быть в любой момент времени; Убедитесь, что все дозы и значения CPM скорректированы до одного и того же момента времени. - Нормализуйте CPM с поправкой на распад на массу каждого образца, чтобы определить CPM для каждого образца. Рассчитайте общую цену за тысячу показов, вычитая CPM в хвосте из рассчитанной цены за тысячу показов.
ПРИМЕЧАНИЕ: Хвост не нуждается в массовой коррекции, так как это значение CPM будет просто вычтено из общего количества введенных CPM, чтобы учесть любой экстравенный индикатор от инъекции. - Разделите CPM на массу на общее количество введенных CPM, чтобы рассчитать % ID/g.
- Коррекция с точки зрения снижения нормализованного CPM с гамма-счетчика для каждого образца, отсчитываемого до времени инъекции животного.
- Настройте электронную таблицу «Сводка» для отображения окончательных результатов для ввода в программное обеспечение для построения графиков и последующей визуализации данных и статистического анализа.
11. Анализ изображений ПЭТ
- Откройте программное обеспечение для анализа ПЭТ. облизать файл |Открытые локальные данные | ДИКОМ. Найдите нужный файл (формат DICOM). Откройте и ПЭТ, и КТ.
- В Диспетчере данных отрегулируйте контрастность ПЭТ и КТ до желаемых уровней.
- Регистрируйте и обрезайте отдельных мышей.
- В меню «Навигация» выберите вкладку «Переориентация/Регистрация».
- Перейдите в меню «Жесткий » на этой вкладке. Обозначьте компьютерную томографию (0) как фиксированную сканию, а позитронно-эмиссионную томографию (1) как движущуюся сканировку.
- Выберите «Жесткая трансформация» и «Быстрое качество». Нажмите «Зарегистрироваться».
- После завершения регистрации (5-10 минут) нажмите на галочку , чтобы сохранить регистрацию.
- Визуально проверьте данные, чтобы убедиться, что регистрация прошла успешно. Экспортируйте сессию, нажав на Файл | Сессия | Экспорт.
- Затем обрежьте каждую мышь в кадре по всему телу: перейдите в меню навигации и нажмите на Обрезка. Перетащите стороны каждого поперечного сечения от внешнего края внутрь.
- После того, как нужная мышь будет плотно обрезана, нажмите на галочку и экспортируйте сессию для сохранения.
- Затем обрежьте и выпрямите головы каждой мыши для анализа мозга с помощью ручных инструментов «Перемещение», « Повороты» и « Перевороты » в меню «Регистрация/Переориентация ». Экспорт для сохранения.
- Анализ спинного мозга.
- Чтобы начать анализ областей интереса (ROI) в спинном мозге, откройте инструмент 3D ROI из меню навигации .
- Под заголовком ROI используйте знак плюс в нижней части меню, чтобы создать шесть ROI: ROI поясничного отдела, ROI шейного/грудного отдела, поясничного скелета, грудного скелета, поясничного отдела спинного мозга, грудного отдела спинного мозга, грудного отдела спинного мозга.
ПРИМЕЧАНИЕ: Поясничный и шейный/грудной отделы являются обобщенными большими показателями ROI, которые будут использоваться для создания скелетных ROI (рис. 4). - Чтобы избежать визуальных помех от сигнала PET на этом шаге, нажмите F3 , чтобы выключить PET.
- Перейдите в верхнюю часть 3D ROI Tool Operator. Щёлкните по сплошной точке справа от символа курсора, чтобы открыть меню Режим 3D-рисования и Размытие/Расширение .
- Выберите «Сфера» и измените размер на 20 пикселей. Установите Расширение на +5.
- Прежде чем продолжить, перейдите в нижнюю часть меню. Убедитесь, что выбран ROI поясничного отдела , так как это первый ROI, который будет нарисован.
- На компьютерной томографии найдите L6-й позвонок позвоночного столба (там, где позвоночник встречается с бедрами). Начиная с одного позвонка выше L6, нарисуйте приблизительный ROI Поясничный ROI над пятью позвонками над бедрами (позвонки L1-L5). Затем переключитесь на шейный/грудной ROI и проведите оставшуюся часть позвоночника до основания черепа.
ПРИМЕЧАНИЕ: Это не обязательно должно быть точным, так как оно используется для указания того, где пороговое значение Otsu должно произойти на шаге 11.4.8. - Нарисовав обобщенные ROI, переходим в верхнюю часть оператора. Выберите меню Алгоритмы сегментации .
- В раскрывающемся меню выберите Otsu Thresholding. В качестве входных данных выберите Поясничная рентабельность инвестиций. Убедитесь, что в нижней части меню выбран Поясничный скелет . В выпадающем меню рядом с пунктом «Изображение» убедитесь, что выбран снимок компьютерной томографии , и нажмите «Применить». Повторите эти действия для шейного/ грудного отдела и грудного скелета.
- Если Пороговое значение Оцу недостаточно выделяет позвоночный столб, используйте Глобальное пороговое значение и измените Минимальное значение на 350 и Максимальное на 3,500 для ручного порогового значения и при необходимости отрегулируйте позвонки, чтобы изолировать позвонки.
- После использования Otsu Thresholding для создания скелета ROI вернитесь в меню навигации (значок курсора). Либо удалите , либо установите флажок в столбце H (скрыть) для грубых поясничных и шейных/грудных ROI , чтобы скрыть их. Установите флажок в столбце I (неизменяемый) для обоих скелетных ROI, чтобы их нельзя было редактировать.
- Наконец, вернитесь в верхнюю часть инструмента 3D ROI Operator и перейдите в меню 3D Paint , чтобы нарисовать ROI спинного мозга.
- Снова выберите инструмент «Сфера » и проведите трассировку спинного мозга в скелете как для поясничного , так и для грудного отдела, убедившись, что в нижней части меню выбран правильный ROI.
- Чтобы стереть ROI, нажмите Command/ Control и нарисуйте деталь, которую нужно стереть.
- Проверьте ROI спинного мозга во всех трех плоскостях, чтобы убедиться, что ROI не выводится за пределы позвоночного столба.
- Экспорт результатов анализа спинного мозга.
- Если сигнал ПЭТ был отключен на шаге 11.4.3, нажмите клавишу F3 после того, как будут нарисованы ROI спинного мозга, чтобы снова включить ПЭТ, или выберите визуальный контроллер (VC) и нажмите на полосу ПЭТ.
- Вернитесь в меню навигации (значок курсора). Нажмите на значок сетки , чтобы показать таблицу. Скопируйте таблицу в программу для работы с электронными таблицами и сохраните.
- Наконец, экспортируйте файл в программное обеспечение для анализа ПЭТ, как описано выше, чтобы сохранить полученные ROI.
- Анализируйте мозг с помощью полуавтоматического 3D-атласа.
- Откройте файл обрезки головы. Импортируйте атлас мозга мыши, перейдя в меню «Дополнительные модули» и выбрав инструмент «3D атлас мозга». Убедитесь, что для привязки установлено значение CT, а опция обрезки не отмечена. Задайте путь к выходному каталогу.
- В разделе «Расширенные настройки» измените « Трансформирование » на «Верзор-аффинный». Сохраните все остальные настройки по умолчанию. Нажмите « Выполнить».
- Вручную настройте атлас в меню «Переориентация/Регистрация » и используйте КТ черепа в качестве ориентира для подгонки атласа.
- Будьте очень осторожны, если необходимо скейлинг, так как это может сильно повлиять на объемы структур мозга. Нажмите на галочку , когда настройка будет завершена.
- Перезапустите атлас с выбранным параметром Импорт 3D-окупаемости инвестиций .
- Экспортируйте файл, чтобы сохранить атлас, подогнанный к обрезанной голове.
- После отрисовки и экспорта всех ROI из нужных органов рассчитайте стандартное значение коррекции привязки. Исправьте все данные и преобразуйте их в %ID/g, как описано ранее6. Нормализовать орган, который подходит животной модели, например, сердце, нормализовать радиоактивный индикатор, присутствующий в кровяном бассейне.
12. Анализ авторадиографии ex vivo
- Откройте файл цифрового изображения (.gel) с помощью программного обеспечения для анализа изображений. Отрегулируйте яркость и контрастность до нужного порога. При необходимости примените подходящую таблицу поиска цвета.
ПРИМЕЧАНИЕ: Для простоты визуализации рекомендуются оттенки Королевского или Серого.
Результаты
hCD19-mAb был конъюгирован DOTA и радиомечен 64Cu, как показано на рисунке 2. ЭАЭ и наивных мышей проводили ПЭТ/КТ сканирование (рис. 3) через 18-24 ч после введения 64Cu-DOTA-hCD19-mAb. Изображения ПЭТ/КТ регистрировались совместно с помощью программного обеспечения для ПЭТ-анализа, а ткани ЦНС анализировались с помощью ручных ROI или полуавтоматического 3D-атласа мозга. Связывание радиоактивных индикаторов в ROI (рис. 4) было выше у мышей с ЭАЭ, чем у наивных мышей. Подсчет гамма-гамма ex vivo и ARG показали повышенное связывание в спинном мозге (как поясничный, так и шейный грудной сегменты) и головном мозге (только ARG) мышей EAE по сравнению с наивными мышами (рис. 5 и рис. 6). Подсчет ex vivo гамма-излучения перфузированных мышей также показал снижение связывания радиоактивных индикаторов в периферических органах, включая селезенку, бедренную кость и костный мозг (рис. 5), что согласуется с тем, что В-клетки покидают периферию и проникают в ЦНС в этой модели ЭАЭ.
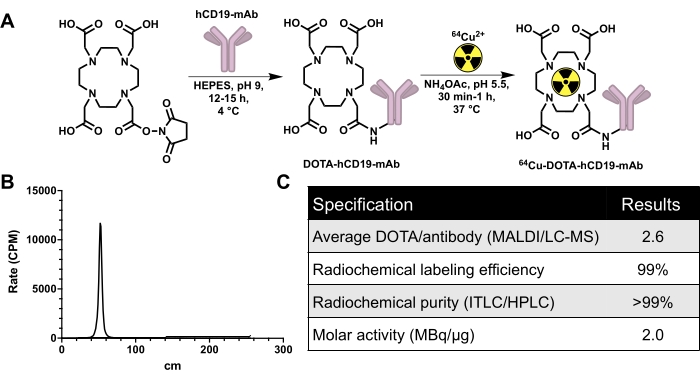
Рисунок 2: Схема конъюгации и радиоактивного мечения для получения 64-меченого Cu моноклонального антитела CD19, 16C4-TM mAb (64Cu-DOTA-hCD19-mAb), в дополнение к данным контроля качества. (A) Реакция эфира DOTA-NHS с моноклональным антителом hCD19 с образованием конъюгата hCD19-DOTA (не для масштабирования) и радиоактивное мечение с 64 Cu-CuCl3 с образованием 64Cu-DOTA-hCD19-mAb. (B) Репрезентативный хроматограф ITLC. Пик на высоте 40-60 см – это радиоактивно меченное антитело; Несвязанный 64Cu-CuCl3 перемещается вместе с подвижной фазой и будет присутствовать от 200 до 240 см. В этом хроматографе нет обнаруживаемого свободного 64Cu-CuCl3. (C) Спецификации контроля качества радиоактивно меченного антитела. Сокращения: сложный эфир DOTA-NHS = 1,4,7,10-тетраазациклододекан-1,4,7,10-эфир моно-N-гидроксисукцинимида тетрауксусной кислоты; ITLC/HPLC = мгновенная тонкослойная хроматография/высокоэффективная жидкостная хроматография; MALDI/LC-MS = матричная лазерная десорбция/ионизация/жидкостная хромато-масс-спектрометрия; CPM = количество штук в минуту. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Фотографии, демонстрирующие, как закрепить мышей в напечатанной на 3D-принтере кровати в ПЭТ-сканере, чтобы обеспечить высококачественную визуализацию спинного и головного мозга при минимальном движении. (A) Напечатанная на 3D-принтере кровать сканера с четырьмя мышами (также известная как «мышиный отель»), оснащенная нагревательными элементами и анестезиологическими трубками. (Б) Мыши под наркозом в положении лежа на спине для достижения максимальной прямоты позвоночника; Записывается положение кровати каждой мыши. (C) Мыши были надежно заклеены скотчем на голове, чтобы свести к минимуму движения в мозге, и поперек живота, чтобы свести к минимуму движения при дыхании, не влияя на дыхание. (D) Мышь расположена внутри сканера и прикреплена скотчем к столу сканирования. Анестезиологическая трубка была подключена от сканера к кровати и установлен изофлуран на 2%. Дыхание мышей контролировалось, чтобы убедиться в соответствующем уровне изофлурана перед закрытием дверцы сканера. Аббревиатура: ПЭТ = Позитронно-эмиссионная томография. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
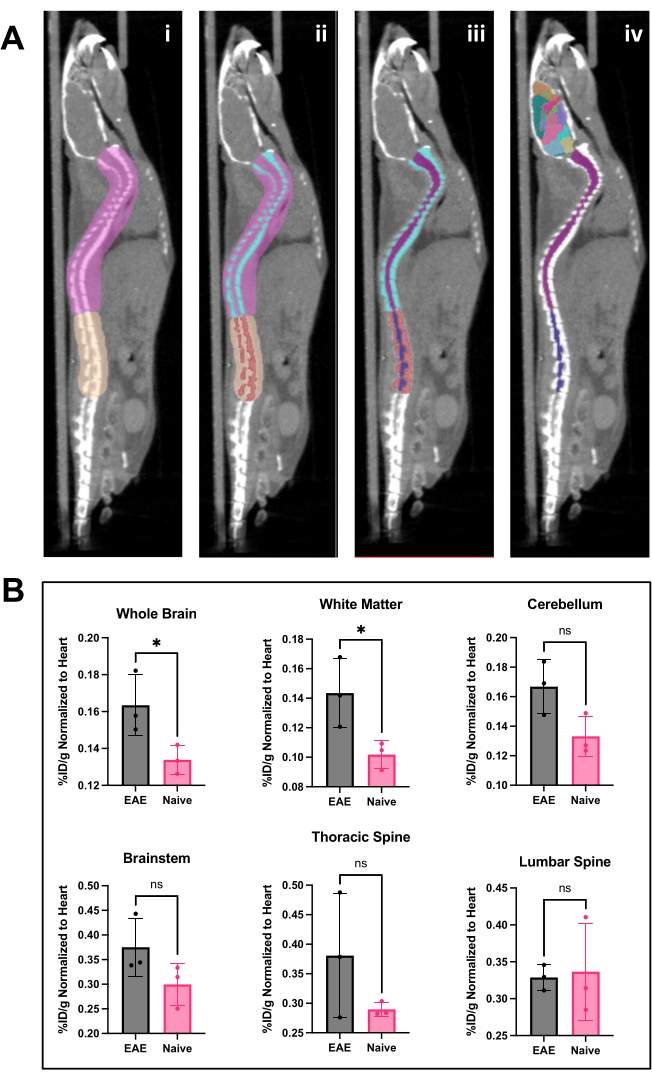
Рисунок 4: Анализ изображений спинного мозга и головного мозга с использованием программного обеспечения для ПЭТ-анализа. (A) i) ROI (розовый и коричневый), нарисованные на позвоночнике, чтобы отделить поясничный отдел от грудного и шейного позвонков и подготовить изображение для порогового значения Оцу. ii) Позвонки позвонка (бирюзовый и красный) были сегментированы с помощью порогового значения Оцу. iii) Затем позвонки стали неизменяемыми в 3D-меню ROI, а спинной мозг разделили на шейный/грудной (фиолетовый) и поясничный (темно-синий) ROI. iv) РОИ позвонков был удален, оставив РОИ спинного мозга и репрезентативный атлас головного мозга. (B) Репрезентативный анализ результатов ПЭТ из различных областей ЦНС, представленных в виде %ID/g, нормализованных к ROI сердца у каждого животного. Получение ПЭТ представляло собой 10-минутное статическое сканирование с помощью ПЭТ/КТ. Области мозга количественно определены с помощью полуавтоматического атласа мозга, показанного на панели А. iv) Репрезентативные результаты показывают либо значимость, либо тенденцию к значительному увеличению связывания индикаторов в головном и грудном отделах спинного мозга. Статистические данные выполнены с использованием t-критерия Стьюдента (*: p < 0,0332). Сокращения: ПЭТ = позитронно-эмиссионная томография; ROI = интересующие регионы; ЦНС = центральная нервная система; КТ = компьютерная томография; %ID/г = процент введенной дозы на грамм ткани; ЭАЭ = экспериментальный аутоиммунный энцефаломиелит. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
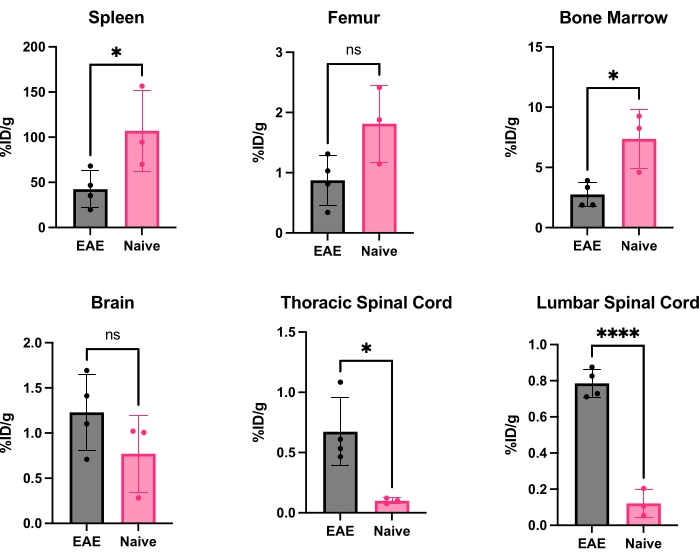
Рисунок 5: Репрезентативная количественная оценка подсчета гамма-излучения ex vivo в различных органах у ЭАЭ и наивных мышей, выраженная как %ID/g. После ПЭТ-сканирования мышам проводили перфузию PBS, чтобы удалить радиоактивный индикатор, присутствующий в крови, свободный или связанный с резидентными CD19+ В-клетками крови, а органы быстро препарировали и взвесили, чтобы получить точный вес каждого органа. Связывание индикаторов значительно снижено в селезенке и костном мозге у мышей с ЭАЭ по сравнению с наивными. Повышенное связывание радиоактивных индикаторов наблюдается как в поясничном, так и в шейном/грудном сегментах спинного мозга мышей с ЭАЭ. Мозг не показывает значительного увеличения сигнала радиоактивных индикаторов, хотя он имеет тенденцию к значительному увеличению. Статистические данные выполнены с использованием t-критерия Стьюдента (*: p < 0,0332; ****: p < 0,0001). Сокращения: ПЭТ = позитронно-эмиссионная томография; %ID/г = процент введенной дозы на грамм ткани; ЭАЭ = экспериментальный аутоиммунный энцефаломиелит; PBS = фосфатно-солевой буфер. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
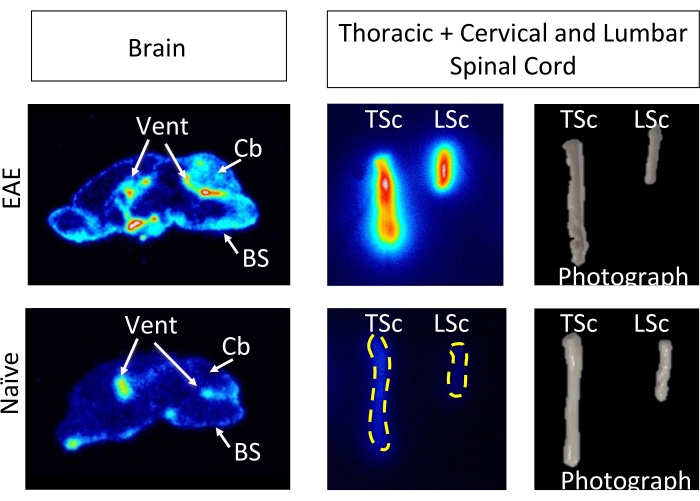
Рисунок 6: Изображения ex vivo ARG показывают связывание 64Cu-DOTA-hCD19-mAb в сагиттальных срезах головного мозга и во всем спинном мозге от EAE по сравнению с наивными мышами. Пленки для хранения цифрового люминофора сканировали с помощью люминофорного тепловизора после воздействия радиоактивных образцов тканей в течение примерно 10 периодов полураспада (127 ч или 5 дней). Полученные изображения показывают визуально более высокий сигнал в мозге мышей EAE по сравнению с участками мозга наивных мышей, что ожидаемо из-за областей, которые, как известно, содержат В-клетки вэтой модели. В частности, наблюдается повышенный сигнал индикатора в стволе головного мозга, мозжечке и желудочках участков мозга мышей с ЭАЭ. Это увеличение сигнала для участков мозга мышей с ЭАЭ отражает то, что было обнаружено при количественной оценке ПЭТ всего мозга, описанной выше. Аналогичным образом, наблюдается увеличение связывания радиоактивных индикаторов как в шейном/грудном, так и в поясничном сегментах спинного мозга по сравнению с наивным спинным мозгом, что отражает то, что было обнаружено с помощью подсчета гамма-излучения ex vivo . Сокращения: ПЭТ = позитронно-эмиссионная томография; ЭАЭ = экспериментальный аутоиммунный энцефаломиелит; Вентиляция = желудочки; Cb = мозжечок; BS = ствол мозга; TSc = грудной и шейный спинной мозг вместе взятые; LSc = поясничный отдел спинного мозга. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Дополнительный рисунок S1: Окрашивание тканей ЦНС тканей мозга наивных мышей и мышей с ЭАЭ CD45R/B220. В-клетки наблюдаются в стволе головного мозга, мозговых оболочках и белом веществе мышей с ЭАЭ (n = 7 ЭАЭ, n = 5 наивных мышей, в среднем 4 среза на животное). Эта цифра от 5. Масштабные линейки = 5 мм (малое увеличение [1x]) на сагиттальных изображениях мозга, 100 мкм (большое увеличение [20x]) на стволе мозга, мозговых оболочках и белом веществе мозжечка. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В данной статье описывается усовершенствованный метод визуализации CD19+ В-клеток человека в мышиной модели рассеянного склероза с использованием CD19-ПЭТ. Из-за неоднородной картины рассеянного склероза и различной реакции на лечение, его ведение в клинике может быть сложной задачей, и крайне необходимы новые подходы к выбору и мониторингу терапии. Позитронно-эмиссионная томография может служить мощным инструментом для мониторинга прогрессирования заболевания и индивидуальной реакции на терапию, истощающую В-клетки. В дополнение к рассеянному склерозу, CD19-ПЭТ-визуализация может быть использована для мониторинга истощения В-клеток после лечения подтипов лимфом и лейкемии или других В-клеточных заболеваний. Этот протокол и репрезентативные данные показывают полезность визуализации В-клеток при неврологических заболеваниях.
Для изучения CD19+ В-клеток человека в контексте рассеянного склероза была выбрана В-клеточная модельMOG 1-125 EAE 7. Как и другие модели ЭАЭ, эта модель проявляется симптомами прогрессирующего паралича и инфильтрации иммунных клеток в ЦНС. Тем не менее, модель MOG1-125 уникальна тем, что она основана на В-клетках: мыши содержат различное количество В-клеток в субарахноидальном пространстве в мозговых оболочках, стволе мозга, паренхиме и желудочках. Эти лимфоциты могут быть разбросаны по этим областям и/или образовывать фолликулоподобные структуры, которые также наблюдаются у людей с РС 8,9. В дополнение к использованию наивных мышей в качестве контрольной группы, может быть использован полный индукционный набор только адъюванта Фройнда (CFA) (т.е. идентичная индукционная эмульсия, аналогичная той, что вводится мышам EAE без белка MOG). В мышиной модели EAE гематоэнцефалический барьер (ГЭБ) не функционирует и позволяет проникать более крупным сущностям, таким как антитела. Радиоактивный индикатор CD19-mAb связывается и остается в ЦНС только в присутствии В-клеток; Если В-клетки отсутствуют, индикатор будет циркулировать обратно в кровяной пул. Мы продемонстрировали это с помощью гамма-подсчета и ауторадографии тканей ЦНС ex vivo методом перфузии перед измерением уровня радиоактивности в тканях. Мы также продемонстрировали это в более ранних публикациях, сообщающих об использовании радиоактивных индикаторов ПЭТ на основе мАТ (т.е. подходов иммуноПЭТ-визуализации) для обнаружения В-клеток в ЦНС 1,2.
Хелатор DOTA был использован с тех пор, как он использовался в клинической ПЭТ-визуализации с пептидами и антителами, меченными медью-64, и мы стремимся транслировать hCD19-mAb для клинической визуализации пациентов с рассеянным склерозом. DOTA обладает достаточным сродством связывания с медью-64 in vivo. Стабильность in vivo очень важна, потому что свободный 64Cu поступает в печень и может затенять сигнал связанного радиоиндикатора; Таким образом, важно измерить сигнал в печени, чтобы рассчитать относительный сигнал по сравнению с другими органами. Мышцы, как правило, воспринимаются как контрольная ткань, но в случае ЭАЭ в мышцах может присутствовать воспаление. Период полураспада 64Cu составляет 12,7 ч, что дает достаточно времени для связывания DOTA-hCD19-mAb со своей мишенью, обеспечивая при этом возможность измерения сигнала с помощью ПЭТ. При приготовлении конъюгата следует проводить мелкомасштабные (75-125 мкг) тестовые реакции для определения количества DOTA для добавления к мАТ для получения желаемого соотношения ДОТА/мАТ (например, реакция 6-10-кратного превышения ДОТА-NHS-эфира на моль мАТ может дать конъюгат 1-2 ДОТА/мАТ). Время реакции и температура (например, 2-4 ч или ночь при 4 °C или комнатной температуре) также влияют на соотношение DOTA/mAb и должны быть оптимизированы. Титрование нерадиоактивной медью может быть выполнено для расчета количества DOTA на мАТ; тем не менее, мы рекомендуем выполнять MALDI-MS и/или LC-MS для получения более надежных и точных результатов.
Рассчитанное соотношение ДОТА/мАТ является средним значением для конкретного образца, и ожидается некоторая вариация. При MALDI для каждого образца делается несколько уколов для конъюгированных и неконъюгированных мАТ. Затем мы вычисляем соотношение конъюгированных и несопряженных, чтобы определить среднее количество ДОТА/мАТ. Соотношение ДОТА/мАТ важно, потому что слишком большое количество хелаторов нарушает связывание антител, а слишком малое количество приводит к непоследовательному радиоактивному мечению и низкому сигналу. Соотношение между партиями конъюгата должно быть очень близким для поддержания постоянной интенсивности сигнала и кинетики связывания; В идеале одна и та же партия конъюгата должна использоваться для всех экспериментов в рамках конкретного исследования. Перспективным методом снижения потенциального влияния на иммунореактивность из-за возможной гиперконъюгации является использование сайт-специфической конъюгации10 , при которой конъюгация хелатора селективна по отношению к гликанам с тяжелой цепью антитела, что гарантирует добавление 1 хелатора на мАТ.
Условия реакции радиоактивного мечения должны быть оптимизированы для обеспечения максимальной эффективности и выхода мечения, поскольку различия в антителах, соотношении ДОТА/мАТ и молярной активности 64Cu, среди прочих условий, будут влиять на радиоактивное мечение. Использование оптимального соотношения конъюгатов 64Cu к мАТ может позволить использовать радиоиндикатор без очистки, сокращая время, необходимое для радиоактивного мечения, и потери из-за гравитационного потока и радиоактивного распада. Последовательная и надежная молярная активность также может быть достигнута при использовании одного и того же соотношения конъюгатов 64Cu и мАТ, что особенно важно при сравнении результатов в нескольких когортах мышей или визуализирующих исследованиях. Условия ITLC также могут быть изменены в соответствии с потребностями каждого пользователя. Если очистка необходима, аликвота должна быть сохранена для ВЭЖХ и/или УФ/ВИД спектрофотометрии, чтобы можно было рассчитать молярную активность.
Важно отметить, что использование меченых радиостанцией антител для визуализации может быть сложной задачей. Важно, чтобы антитело, используемое для радиоиндикатора, было биологически инертным, чтобы не оказывать физиологического эффекта. Более того, поскольку антитела долго находятся в крови, необходимо ждать достаточно длительного времени для циркуляции, связывания и клиренса данной мАТ, чтобы обеспечить подходящее соотношение сигнал/фон без ущерба для качества изображения. Как правило, достаточно подождать 20-48 ч для 64-меченого Cu мАТ, но при оценке нового ПЭТ-индикатора мАТ следует проводить визуализацию через 2, 4, 6, 12, 24, 48 ч после инъекции, чтобы определить наилучший момент времени для визуализации в данной модели грызуна. То же самое относится и к получению ARG-изображений с самым высоким соотношением сигнал/фон. Репрезентативные изображения в этом протоколе были сделаны через 18-20 ч после инъекции, хотя в зависимости от используемого радиоизотопа могут использоваться и другие временные точки. Различные антитела, связывающиеся с разными эпитопами CD19, дают различные результаты и должны быть строго охарактеризованы.
При анализе сигнала спинного мозга важно расположить мышей на спине в сканирующем ложе, чтобы уменьшить движение, вызванное дыханием. Кроме того, положение в положении лежа на спине может помочь выпрямить позвоночник у мышей с увеличенным искривлением позвоночника из-за прогрессирования заболевания EAE. Еще один важный аспект, который следует учитывать при обнаружении сигнала в позвоночнике и спинном мозге, заключается в том, чтобы избегать инъекций MOG1-125 на бок, поскольку места инъекции могут связывать индикатор из-за связанного иммунного ответа в этих областях. Непосредственная близость места инъекции может помешать анализу спинного мозга; Таким образом, инъекции в грудную клетку предпочтительнее для описанного здесь применения.
Используемые методы анализа изображений специфичны для визуализации ЦНС. Инструмент атласа мозга в программном обеспечении для анализа изображений обеспечивает воспроизводимые и надежные результаты при условии точности регистрации ПЭТ и КТ. Использование полуавтоматического 3D-атласа мозга и его настройка в соответствии с черепом каждой мыши позволяет обеспечить стабильную окупаемость инвестиций между животными. Поскольку в настоящее время не существует автоматизированного или полуавтоматического подхода к анализу сигнала в спинном мозге, необходимо рассчитывать ROI вручную. Примечательно, что при количественном определении CD19+ В-клеток (или любого типа клеток, присутствующих как в костном мозге, так и в спинном мозге) крайне важно максимально устранить сигнал, исходящий от позвоночного столба и костного мозга. Причина этого заключается в том, что наивные мыши, как известно, содержат больше CD19+ В-клеток в костном мозге, чем мыши EAE, у которых В-клетки покидают периферию, чтобы проникнуть в ЦНС 5,11. Этот сигнал костного мозга может затмить истинный сигнал в спинном мозге.
Чтобы очертить истинный сигнал спинного мозга при минимизации вклада сигнала от позвоночного столба и костного мозга, пороговое значение Оцу на КТ-изображении может быть использовано для создания неизменяемого ROI для позвоночного столба. В этом случае в позвоночном столбе можно легко провести отдельный ROI спинного мозга. Этот же метод может быть применен для измерения костного мозга в бедренной кости. Это очень полезный метод для получения информации о связывании индикаторов в спинном мозге. Однако из-за относительно низкого пространственного разрешения ПЭТ и проблем, связанных с эффектом частичного объема при сканировании небольших анатомических областей мышей, использование дополнительных подтверждающих методов ex vivo (например, гамма-подсчет, ARG) позволяет валидировать связывание радиоактивных индикаторов в спинном мозге без присутствия крови, спинномозговой жидкости или сигнала перелива из позвоночного столба.
Сигнал в шейном/грудном отделах спинного мозга, как правило, варьируется у мышей с ЭАЭ в зависимости от тяжести заболевания и количества В-клеток, проникающих во время адаптивного иммунного ответа. Эти различия в количестве В-клеток, которые инфильтрируются, а также небольшое количество В-клеток в ЦНС по сравнению с таковыми в тазовом/спинном костном мозге наивных мышей, могут затруднить количественное определение тканей спинного мозга in vivo у мышей. Учитывая пространственное разрешение ПЭТ при визуализации мелких животных, сигнал от костного мозга может передаваться на сигнал спинного мозга. Биораспределение ex vivo и авторадиография, выполненные здесь, помогают в валидации ПЭТ-сигнала позвонков по сравнению с тканью спинного мозга. Мышей перфузируют перед вскрытием, чтобы удалить любой несвязанный индикатор в кровяном пуле, чтобы результаты гамма-подсчета и авторадиографии отражали индикатор, который на самом деле связан в каждом органе, а не индикатор, который находится в кровяном пуле этого органа.
Радиоиндикаторы циркулируют в крови, и в случае с антителами, в частности, в крови часто присутствует несвязанный радиоиндикатор в течение нескольких недель после первоначальной инъекции. Поскольку мы визуализируем головной и спинной мозг, которые имеют множество кровеносных сосудов, важно понять, какая часть сигнала действительно обусловлена связыванием индикаторов в головном мозге/тканях, а какая присутствует в кровяном пуле. Таким образом, необходимо разделить сигнал мозга на сигнал в сердце/кровеносном пуле. В клинических условиях для количественной оценки могут быть использованы те же методы анализа изображений порогового значения позвонков по Оцу и ROI тканей спинного мозга. Учитывая больший объем тканей у людей по сравнению с мышами, влияние частичных объемных эффектов должно быть значительно меньшим, что приведет к повышению точности и сведет на нет необходимость в методах ex vivo для подтверждения результатов in vivo . Использование ПЭТ в клинике позволит клиницистам персонализировать терапию для каждого пациента в зависимости от его индивидуальной нагрузки В-клетками.
ARG особенно полезна для получения изображений с высоким разрешением, чтобы обеспечить более точное определение пространственного расположения связывания индикаторов в небольших областях, таких как ствол мозга и мозжечок. Эти же срезы и/или смежные срезы могут быть сохранены для иммуногистохимического окрашивания для подтверждения наличия В-клеток. Ранее мы окрашивали ткани ЦНС CD45R/B220 (дополнительный рисунок S1) для корреляции количества В-клеток с сигналами ПЭТ и АРГ 5,9. Затем окрашивание можно пространственно сравнить с результатами ARG, чтобы убедиться, что сигнал радиоиндикатора соответствует картине окрашивания. В-клетки могут присутствовать кластерами или диффузно по всему стволу мозга; Чувствительность ПЭТ достаточно высока для измерения сигнала, что является обнадеживающим фактором для клинической трансляции. При ARG спинного мозга удаление спинного мозга из позвонков гарантирует, что измеренный сигнал обусловлен связыванием индикаторов в ткани спинного мозга, а не в костном мозге и/или крови, которые могут затенять изображения ПЭТ из-за частичного объемного эффекта.
Как и в случае с ARG, подсчет гамма-сигналов ex vivo позволяет количественно оценить радиоактивный сигнал в отдельных органах. Для этого конкретного метода важно измерить влажный вес тканей и убедиться, что они находятся на дне соответствующих пробирок, прежде чем помещать пробирки в гамма-счетчик. Пробирки должны быть промаркированы номером мыши и тканью, чтобы использовалась правильная пробирка; Затем пробирку взвешивают на калиброванных весах и вводят органы с точностью до десятой доли микрограмма (0,0001 мг). Некоторые ткани чрезвычайно малы, и разница в массе трубки до и после будет порядка 0,0001 мг. Ткани следует взвесить сразу после вскрытия, чтобы предотвратить потерю влаги, которая приводит к уменьшению массы. После взвешивания трубки головного и спинного мозга должны быть заполнены PBS, чтобы предотвратить высыхание, прежде чем замораживать эти ткани для ARG.
Раскрытие информации
Антитела к CD19 были предоставлены компанией Horizon Therapeutics.
Благодарности
Мы благодарны за поддержку со стороны центра визуализации мелких животных SCi3 в Стэнфорде и д-ра Фрезги Хабте за его техническую помощь в проведении ПЭТ/КТ. ЖХ-МС выполняется основным персоналом основного центра масс-спектрометрии Стэнфордского университета (SUMS), и мы благодарны персоналу за предоставление этой услуги. Мы благодарим компанию Horizon Therapeutics за любезное предоставление hCD19-mAb и, в частности, Джоди Карнелл за ее техническое руководство и поддержку. Эта работа финансировалась NIH NINDS (1 R01 NS114220-01A1).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5 mL 50 kDa MWCO Centrifugal filter | MiliporeSigma | UFC505008 | centrifugal filter |
| 64Cu-CuCl3 | Washington University in St. Louis; University of Wisonsin, Madison; or another vendor | ||
| AR-2000 Radio-TLC Imaging Scanner | Eckert & Ziegler | AR-2000 | |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 x 25 cm, screen only |
| Butterfly Needle Catheter | SAI Infusion Technologies | BLF-24 | |
| DOTA-NHS-ester | Macrocyclics | B-280 | |
| EAE Induction Kit | Hooke Laboratories | EK-2160 | |
| Geiger Counter | Ludlum | 14C | |
| GNEXT PET/CT Scanner | Sofie | GNEXT | |
| Hidex Automatic Gamma Counter | Hidex | AMG | |
| HPLC Column | Phenomenex | 00H-2146-K0 | 5 μm SEC-s3000 400 Å, 300 x 7.8 mm |
| Illustra NAP-5 column | Cytiva | 17085301 | DNA gravity column |
| Image J | NIH | ARG analysis software | |
| Low Protein Binding Collection Tubes (1.5 mL) | Thermo Scientific | PI90410 | |
| NanoDrop Lite Spectrophotometer | Thermo Scientific | 840281400 | UV-Vis micro/nano-spectrophotometer |
| PCR tubes 0.2 mL, for DNA grade | Eppendorf | 30124707 | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| VivoQuant | Invicro | Version 4 Patch 3 | PET Analysis Software; must purchase brain atlas add-on |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | Thermo Scientific | PI89882 | Desalting column |
Ссылки
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Karussis, D. The diagnosis of multiple sclerosis and the various related demyelinating syndromes: A critical review. Journal of Autoimmunity. 48-49, 134-142 (2014).
- Hauser, S. L., et al. B-cell depletion with Rituximab in relapsing-remitting multiple sclerosis. The New England Journal of Medicine. 358 (7), 676-688 (2008).
- Chen, D., Gallagher, S., Monson, N. L., Herbst, R., Wang, Y. Inebilizumab, a B cell-depleting anti-CD19 antibody for the treatment of autoimmune neurological diseases: Insights from preclinical studies. Journal of Clinical Medicine. 5 (12), 107(2016).
- Stevens, M. Y., et al. Development of a CD19 PET tracer for detecting B cells in a mouse model of multiple sclerosis. Journal of Neuroinflammation. 17 (1), 275(2020).
- Chaney, A. M., Johnson, E. M., Cropper, H. C., James, M. L. PET imaging of neuroinflammation using [11C]DPA-713 in a mouse model of ischemic stroke. Journal of Visualized Experiments. (136), e57243(2018).
- Lyons, J. -A., Ramsbottom, M. J., Cross, A. H. Critical role of antigen-specific antibody in experimental autoimmune encephalomyelitis induced by recombinant myelin oligodendrocyte glycoprotein. European Journal of Immunology. 32 (7), 1905-1913 (2002).
- Haugen, M., Frederiksen, J. L., Degn, M. B. cell follicle-like structures in multiple sclerosis-With focus on the role of B cell activating factor. Journal of Neuroimmunology. 273 (1-2), 1-7 (2014).
- James, M. L., et al. Imaging B cells in a mouse model of multiple sclerosis using 64Cu-Rituximab PET. Journal of Nuclear Medicine. 58 (11), 1845-1851 (2017).
- Zeglis, B. M., et al. An enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Lyons, J. -A., et al. B cells are critical to induction of experimental allergic encephalomyelitis by protein but not by a short encephalitogenic peptide. European Journal of Immunology. 29 (11), 3432-3439 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены