Method Article
Pozitron Emisyon Tomografisi Kullanılarak Deneysel Otoimmün Ensefalomiyelit Fare Modelinde CD19+ B Hücrelerinin Görüntülenmesi
Bu Makalede
Özet
Bu makale, insana özgü bir anti-CD19 monoklonal antikorun radyo-etiketlenmesi için metodolojiyi ve bunun in vivo PET görüntüleme, ex vivo gama sayımı ve otoradyografi yaklaşımlarını kullanarak bir fare multipl skleroz modelinin periferik dokularındaki B hücrelerini ölçmek için nasıl kullanılacağını detaylandırmaktadır.
Özet
Multipl skleroz (MS), genç erişkinleri etkileyen en yaygın demiyelinizan merkezi sinir sistemi (MSS) hastalığıdır ve genellikle hastalık ilerledikçe nörolojik defisitlere ve sakatlığa neden olur. B lenfositleri MS patolojisinde karmaşık ve kritik bir rol oynar ve klinik çalışmalarda çeşitli terapötiklerin hedefidir. Şu anda, spesifik anti-B hücre tedavileri için hastaları doğru bir şekilde seçmenin veya bu tedavilerin CNS ve periferik organlardaki B hücre yükü üzerindeki etkilerini invaziv olmayan bir şekilde ölçmenin bir yolu yoktur. Pozitron emisyon tomografisi (PET) görüntüleme, canlı deneklerde B hücrelerinin in vivo uzay-zamansal dağılımı ve yükü hakkında oldukça spesifik, nicel bilgi sağlama konusunda muazzam bir potansiyele sahiptir.
Bu makale, insan rekombinant miyelin oligodendrosit glikoprotein 1-125 ile indüklenen MS'in iyi kurulmuş bir B hücresi güdümlü fare modelinde, deneysel otoimmün ensefalomiyelit (EAE) insan CD19+ B hücrelerine özgü bir PET izleyiciyi sentezleme ve kullanma yöntemlerini bildirmektedir. Burada açıklananlar, in vivo PET görüntüleme kullanılarak beyin ve omurilikteki CD19+ B hücrelerini tespit etmek ve ölçmek için optimize edilmiş tekniklerdir. Ek olarak, bu makale, kemik iliği, omurilik ve dalak dahil olmak üzere hastalıkla ilgili organların ex vivo gama sayımı için kolaylaştırılmış yöntemleri ve CNS dokularında CD19 izleyici bağlanmasının yüksek çözünürlüklü otoradyografisini bildirmektedir.
Giriş
MS, bağışıklık aracılı nörolojik bir bozukluktur; Her hastadaki benzersiz sunum, hem hastalar hem de klinisyenler için yönetimi zorlaştırabilir1. Hastalığın kendisi, beyinde ve omurilikte demiyelinizan lezyonların ve immün hücre infiltrasyonunun varlığı ile karakterizedir, bu da fiziksel ve bilişsel bozulmaya neden olur2. MS'in T hücresi aracılı bir hastalık olduğu geleneksel paradigma, ilk olarak, B hücrelerinin CD20 + alt kümesini hedef alan bir tedavi olan rituksimab3'ün dönüm noktası niteliğindeki bir faz II klinik çalışmasında sorgulandı. O zamandan beri, hem tanısal hem de terapötik olarak avantajlı olabilen, daha geniş bir B hücresi aralığında eksprese edilen bir pan B hücresi biyobelirteci olan CD194'ü hedefleyen ek B hücre tedavileri geliştirilmiştir. Ayrıca, tedavi etkinliğini değerlendirmek için mevcut yöntemler (yani, nüks sayısının ve manyetik rezonans görüntüleme [MRI] aktivitesinin izlenmesi) erken yanıt ölçümlerini sağlamaz - bu nedenle hastaları yetersiz tedavi seçimi ve optimizasyonu nedeniyle önemli CNS hasarı riskine sokar. Bu nedenle, MS hastalarının CNS ve çevresinde CD19 + B hücreleri gibi spesifik bağışıklık hücrelerini gerçek zamanlı olarak izlemek için stratejilere kritik bir ihtiyaç vardır.
PET görüntüleme, CD19 gibi belirli bir ilgilenilen hedefin in vivo, tüm vücut görselleştirmesine izin veren sağlam bir görüntüleme tekniğidir. Kan alımları, nüks oranlarının kayıtları ve MRI yoluyla lezyon izleme, tedavi etkinliğine ilişkin anlık görüntüler sağlarken, PET görüntüleme, araştırmacıların ve klinisyenlerin bir tedavinin tüm vücuttaki etkinliğini izlemesine izin verebilir. Terapötik izlemeye yönelik bu proaktif yaklaşım, klinisyenlerin ilaç etkinliğini gerçek zamanlı olarak değerlendirmesine olanak tanıyarak gerektiğinde hızlı ayarlamalar yapılmasını sağlar. Hastalıkla ilişkili hücre popülasyonlarının yerinin ve yoğunluğunun izlenmesi, hastaya özgü anatomik bilgileri kullanarak şiddetin uzunlamasına değerlendirilmesine de izin verir. Bu nedenle, klinik ve klinik öncesi ortamlarda PET görüntülemenin tüm potansiyelini güvenilir bir şekilde kullanmak için tekrarlanabilir analitik yöntemler oluşturmak esastır.
Bu makale, insan rekombinant miyelin oligodendrosit glikoprotein 1-125 (MOG 1-125). Ayrıca, her ikisi de bu ve diğer nörodejeneratif modellerde sıklıkla ciddi şekilde etkilenen kritik patogenez bölgeleri olan beyin ve omurilikte radyoizleyici bağlanmasını doğru ve tekrarlanabilir bir şekilde değerlendirmek için yöntemler sunuyoruz. Bu teknikler, hastalık patolojisinde B hücrelerinin rolünün invaziv olmayan bir şekilde araştırılmasına izin verir ve MS'de anti-B hücre tedavilerinin etkinliğini değerlendirmek için klinik olarak çevrilme potansiyeline sahiptir.
Protokol
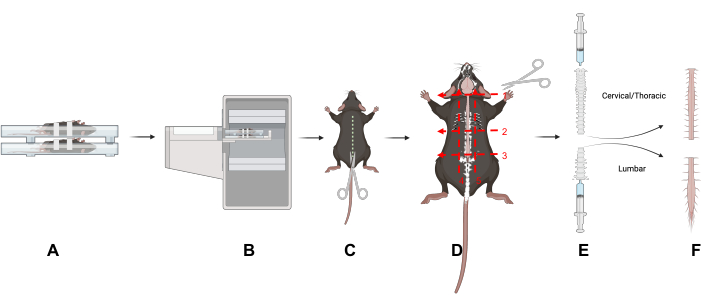
Şekil 1: Çalışma tasarımı. Bu makaledeki temel tekniklere genel bir bakış. (A) Fareleri tarama yatağına sırt üstü yerleştirmek omurgadaki hareketi azaltır. (B) Farelerin PET/CT görüntülemesi. (C) Omurgayı ortaya çıkarmak için hayvanın sırt tarafından bir kesi yapın. (D) Omurgayı servikal/torasik ve lomber kısımlara ayırın ve belirtilen beş kesiği takip eden bölümleri çıkarın. (E) Şırınga ve omurga ile bir sızdırmazlık yaparak ve gösterildiği gibi omurganın kraniyal ve kaudal uçlarından kızartarak omuriliği omurgadan çıkarmak için bir şırınga kullanın. (F) İzole servikal/torasik ve lomber omurilik segmentleri. Kısaltma: PET/CT = Pozitron emisyon tomografisi/bilgisayarlı tomografi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tüm hayvan çalışmaları, Laboratuvar Hayvanları Bakımının Değerlendirilmesi ve Akreditasyonu Derneği (AAALAC International) tarafından akredite edilmiş bir program olan Stanford Üniversitesi'ndeki Laboratuvar Hayvanları Bakımı İdari Paneli'ne (APLAC) uygun olarak gerçekleştirilmiştir. Fareler, çalışmanın başlamasından en az 7 gün önce vivaryuma alıştırıldı, çünkü stres EAE indüksiyonunu etkileyebileceğinden, fareler üzerindeki stresi en aza indirgedi.
1. Dişi insanlaştırılmış CD19 farelerinde EAE indüksiyonu
- MOG1-125 kullanarak daha önce tarif edildiği gibi 5 EAE ile 9-13 haftalık insanlaştırılmış CD19 C57BL / 6J dişi fareleri indükleyin.
2. EAE fare modelinde hayvan bakımı ve puanlama
- Daha önce tarif edildiği gibi fareler için hastalık ilerlemesini ve bakımını puanlayın5. Kısaca, bu modeli 1-5 arasında bir ölçekte şu şekilde puanlayın: 1 kuyruk zayıflığı/gevşekliği, 2 zayıflamış arka ayaklar, 3 arka bacak felci, 4 ön ayak zayıflığı ile arka bacak felci, 5 can çekişiyor.
3. mAb konjugasyonu, radyoetiketleme ve karakterizasyon
- İki işlevli şelatör 1,4,7,10-tetraazasiklododekan-1,4,7,10-tetraasetik asit mono-N-hidroksisüksinimid esteri (DOTA-NHS-ester) hCD19-mAb'ye 64Cu ile radyo-etikete eşitleyin.
- Bir tuz giderme sütunu kullanarak, hCD19-mAb depolama tamponunu HEPES tamponu (pH 8.5-9) ile değiştirin: tuz giderme kolonunu/kolonlarını HEPES ile koşullandırın. Tuzdan arındırma kolonu numune hacmi kapasitesine ve gereken mAb hacmine bağlı olarak gereken kolon sayısını hesaplayın: 0,5 mL tüpler: 30-130 μL numune hacmi, 300 μL yıkama; 2 mL tüp: 200-700 μL numune hacmi, 1 mL yıkama.
- Tuzdan arındırma kolonu aracılığıyla tampon değişimi için santrifüjü 4 °C'ye soğutun.
- Tuzdan arındırma sütununu buzdolabından alın. Tuz giderme kolonunun altını çıkarın, kapağı gevşetin ve kolonu bir toplama tüpüne yerleştirin.
- Depolama solüsyonunu çıkarmak için 1.500 × g'da 2 dakika santrifüjleyin; Depolama solüsyonunu içeren akışı atın ve toplama tüpünü yeniden kullanın. Tuz giderme sıkıştırılmış reçinenin en yüksek noktasının yukarı doğru eğimli olduğu sütun üzerinde bir çizgi işaretleyin.
- Tuzdan arındırma kolonunun alt tarafına HEPES tamponu ekleyin. Tuz giderme kolonunu, çizgi dışa bakacak şekilde santrifüje yerleştirin; 1.500 × g'da 2 dakika döndürün. Akışı atın ve toplama tüpünü yeniden kullanın.
- Aynı toplama tüpünü kullanarak ve adımlar arasındaki akışı atarak 3.1.4 ve 3.1.5 adımlarını 2x tekrarlayın.
- Şartlandırılmış tuz giderme kolonunu yeni bir toplama tüpüne ve etikete yerleştirin; bu tüp hCD19-mAb içerecektir.
- Şartlandırılmış tuzdan arındırma kolonunun/kolonlarının üstüne hCD19-mAb ekleyin ve boş mAb şişesini durulamak için HEPES tamponu kullanın; Bunu tuzdan arındırma sütununun üstüne ekleyin (üreticinin tavsiyesine göre toplam hacim). HC19-mAb'yi elüte etmek için 2 dakika boyunca 1.500 × g'da döndürün. HC19-mAb'yi içeren akışı koruyun.
- Bir UV/Vis spektrofotometresi kullanarak hCD19-mAb konsantrasyonunu ölçün ve gerekirse HEPES tamponu ile 0,5 μg/μL'ye ayarlayın.
- hCD19-mAb çözeltisine, hCD19-mAb çözeltisinde EDTA'nın nihai konsantrasyonunu 0.01 M yapmak için 0.5 M EDTA'lık mAb çözeltisinin hacminin 1/50'sini ekleyin. HC19-mAb-EDTA çözeltisini oda sıcaklığında 15 dakika bekletin.
- DOTA-NHS-ester'i dondurucudan çıkarın ve oda sıcaklığına (10-15 dakika) gelmesini bekleyin. İstenen DOTA/mAb molar oranının (tipik olarak 1-2 DOTA/mAb mertebesindedir) eklenmesine izin verecek bir DOTA konsantrasyonu yapmak için DOTA-NHS-ester'e eklenecek DMSO hacmini hesaplayın.
NOT: HC19-mAb'ye eklenen DMSO-DOTA-NHS-ester hacmi, mAb hacminin %10'unu geçmemelidir. Bu, hızlı ve tekrar tekrar yapılabilmesi için bir elektronik tablo kullanılarak yapılmalıdır. - İstenen DOTA'nın hCD19-mAb'ye oranına bağlı olarak, hCD19-mAb'ye eklenecek DOTA-NHS-ester miktarını hesaplayın.
nmol mAb × 10 DOTA/mAb → nmol DOTA → mg DOTA → mg/mL DOTA/DMSO → mL DMSO → DOTA/DMSO çözeltisinin seyreltme faktörü - 1-2 mg DOTA-NHS-ester tartın ve DMSO'nun doğru hacmini (adım 3.1.11'de hesaplanan) DOTA-NHS-esterine dikkatlice ekleyin; karıştırın ve döndürün.
- DOTA-NHS-ester çözeltisinin (adım 3.1.12) hesaplanan hacmini hCD19-mAb çözeltisine pipetleyin; ekstra DOTA-NHS-ester eklenmediğinden emin olmak için eklemeden önce pipet ucunun dışını silin (pipetteki miktarı değiştirmeden). Yavaşça karıştırın ve döndürün.
- Gece boyunca (12-16 saat) reaksiyona girmesi için buzdolabına (4 °C) koyun.
- Saflaştırma ve konsantrasyon
- Santrifüj yoğunlaştırıcı tampon değişim adımları için santrifüjü 4 °C'ye soğutun; konjugatı dondurmak için kuru buz üzerine metal bir PCR tüp bloğu yerleştirin.
- DOTA-hCD19-mAb reaksiyonunu buzdolabından çıkarın ve biyolojik sınıf TRIS tamponu ekleyerek söndürün: toplam reaksiyon hacminin %10'u. Kütle spektrometrisi analizi için numunenin 10-20 μg'ını çıkarın.
- 0,1 M amonyum asetat tamponu, pH 5,5 kullanarak tuzdan arındırma kolonunu/kolonlarını yukarıda açıklandığı gibi (adım 3.1.1-3.1.5) koşullandırın.
- DOTA-hCD19-mAb çözeltisini amonyum asetat ile tampon değişimi (adım 3.1.1-3.1.8).
- DOTA-hCD19-mAb çözeltisini konsantre edin: çözeltiyi, üreticinin hacim konusundaki tavsiyelerine uyarak 50 kDa'lık bir moleküler ağırlık kesme santrifüj yoğunlaştırıcıya ekleyin. 4.000 × g'da 10 dakika santrifüjleyin (veya hacim %80-%90 oranında azalana kadar); Akışı atın.
- Dokuz kez daha tekrarlayın (toplam 10): hacmi önerilen maksimum hacme geri getirmek için yeterli miktarda amonyum asetat ekleyin.
NOT: Toplam, sütunda kalanlar da dahil olmak üzere, genellikle 500 μL kapasiteli bir santrifüj yoğunlaştırıcı için 400-450 μL olmalıdır.- Kalan DOTA-hCD19-mAb'yi almak için reaksiyon şişesini amonyum asetat tamponu ile durulayın; Yıkamayı santrifüj yoğunlaştırıcıya ekleyin.
- 4.000 × g'da 10 dakika santrifüjleyin.
NOT: Hacim daha kısa sürede %80-90'a düşürülürse, sonraki dönüşlerde sıkma süresi azaltılabilir.
- Protein çözeltisini santrifüj yoğunlaştırıcıdan çıkarın. DOTA-hCD19-mAb'ın toplam hacmine dikkat edin.
- Santrifüj yoğunlaştırıcı 2'de, toplam 100 μL hacme yetecek kadar amonyum asetat tamponu ekleyin ve karıştırmak için pipetleyin. Santrifüj yoğunlaştırıcı kolonunu kapatın ve ters çevirin. Çözeltiyi toplamak için 4.000 × g'da 2 dakika döndürün. Yeni bir tüpe aktarın.
- Santrifüj yoğunlaştırıcı 500'de, santrifüj yoğunlaştırıcıdan mAb çözeltisini toplamak için bir pipet kullanın; Yeni bir tüpe ekleyin.
- Bir UV-Vis Spektrofotometresi kullanarak konsantrasyonu ölçün. Konsantrasyon 2 mg / mL'den fazlaysa, amonyum asetat ile 2 mg / mL'ye seyreltin.
- PCR tüpü başına 100 μg (yaklaşık 50 μL); tüpleri DOTA-hCD19-mAb, tarih, kütle ve konsantrasyon ile etiketleyin. Şişeleri aşağı doğru döndürün.
- DOTA-hCD19-mAb'ı kuru buz üzerinde soğutulmuş PCR bloğu üzerinde dondurun (veya kuru buz üzerinde dondurun). Tüm numuneler dondurulduktan sonra -80 °C'lik bir dondurucuya koyun.
- Kütle spektrometrisi ile hCD19-mAb başına DOTA sayısını ölçün. Oranı hesaplamak için her konjugasyondan bir konjuge olmayan (saf) antikor örneği tutun. Aşağıda verilen denklemi (1) kullanın; moleküler ağırlık MW olarak kısaltılır.
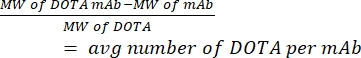 (1)
(1)
- Radyoetiketleme
NOT: Kurumsal düzenlemelere uygun olarak laboratuvar önlüğü, eldivenler ve kişisel vücut ve halka dozimetreleri dahil olmak üzere radyoaktiviteyi ele almak için uygun kişisel koruyucu ekipman (KKD) kullanın. Radyoaktif kirlenmeyi önlemek için eldivenleri düzenli olarak inceleyin ve değiştirin. Kurşun koruyucu kullanın ve mümkün olduğunda maşa ile tutarak radyoaktif kaynaktan olan mesafeyi artırın.- Bir pipet kullanarak radyoaktiviteyi nakliye şişesinden yeni bir şişeye aktarın. Radyoaktiviteyi ölçün.
- İlk radyo-etiketleme reaksiyonu için bir alikotu çıkarın. 64 Cu-CuCl3'ün 1 mC'si başına 50μL amonyum asetat (pH 5.5)ekleyin. 5 ile 6 arasında ayrım yapmak için yeterli çözünürlükle 5,5'i yakalayan bir pH şeridine 1 μL pipetleyerek pH'ı ölçün.
- PH 4-5.5 değilse, 1 M NaOH veya 0.1 M HCl kullanarak değiştirin. Doğru pH'a ulaşılana kadar pH 4'ten düşükse 1 M NaOH veya pH 5.5'ten büyükse 0.1 M HCl'den küçük miktarlarda 1-5 μL ekleyin. Her eklemede iyice karıştırın, döndürün ve pH'ı yukarıda açıklandığı gibi ölçün. Nihai hacmin hesaplanabilmesi için herhangi bir çözeltinin her eklenmesini ve çıkarılmasını (pH'ı kontrol etmek dahil) not edin.
- Optimum pH'a ulaşıldığında, 64Cu-CuCl3'ün 1 mCi'si başına 10 μg DOTA-hCD19-mAbekleyin. Yavaşça karıştırın ve kısa bir süre döndürün.
- Reaksiyon şişesini 37 °C'ye ve dakikada 400 devire (rpm) ayarlanmış bir termomiksere yerleştirin.
- 30 dakika sonra reaksiyonu söndürün: toplam reaksiyon hacmini 50'ye bölün ve bu hacmi 0.5 M EDTA'yı reaksiyon karışımına ekleyin.
- Çözeltideki bağlı ve serbest bakır yüzdesini ölçmek için anında ince tabaka kromatografisi (ITLC) kullanarak etiketleme verimliliğini belirleyin.
- TLC kağıdından 1 cm genişliğinde şeritler kesin. Şeridin üstünden ve altından 1 cm işaretleyin ve 1 cm'den daha az hareketli faza sahip bir tüp (50 mL erlen) hazırlayın 0.1 M sitrik asit (mobil faz seviyesi, tüpe yerleştirildiğinde şerit üzerindeki 1 cm işaretinin altında olmalıdır).
- Reaksiyon çözeltisinin 1 μL'sini alt 1 cm işaretindeki (çözücü önü) şerit üzerine pipetleyin ve şeridi tüpe yerleştirin. Solvent ön kısmı üst 1 cm işaretine ulaşana kadar izleyin, şeridi çıkarın ve bir parça plastik sargıya sarın.
- Şeridi platforma yerleştirin ve bir radyo-TLC görüntüleme tarayıcısından geçirin. Orijinde radyoaktif işaretli mAb'yi ve mobil faz önü ile hareket eden serbest 64Cu'yu arayın (Şekil 2). Serbest bakır yüzdesi %5'ten azsa (%95 etiketleme verimliliği), hayvanlara enjeksiyonla devam edin. Serbest bakır yüzdesi% 5'ten büyükse, saflaştırmaya devam edin.
NOT: Serbest bakır yüzdesi genellikle DOTA-mAb'nin 64Cu'ya oranına, reaksiyon süresine, pH'a ve sıcaklığa bağlıdır. Tutarlı sonuçlar elde etmek için reaksiyon koşulları her yeni mAb için her kullanıcı tarafından optimize edilmelidir.
- Tek kullanımlık DNA dereceli yerçekimi sütunu ile saflaştırma
- Üreticinin talimatlarına göre tek kullanımlık bir DNA sınıfı yerçekimi akış kolonunu (tuz giderme/tampon değişim kolonu) koşullandırın. Tek kullanımlık DNA sınıfı yerçekimi sütununu bir halka standına veya yeterli kurşun kalkanın arkasındaki başka bir alete yerleştirin; Cihazın sabit ve kolayca hareket ettirilebilir olduğundan emin olun. Tüpü kolonun altına yerleştirin.
- Ham reaksiyon karışımını yerçekimi akış kolonu reçinesine pipetleyin. Tüm sıvı reçineye akana kadar bekleyin. Tüm hacmi (ham ürün artı PBS) 500 μL'ye getirmek için yeterli PBS'yi pipetleyin.
- Kolonu 1.5-1 etiketli 10 mL santrifüj tüplerinin üzerine yerleştirin. Sütuna 1 mL PBS ekleyin. Akış durana kadar her tüpte beş damla toplayın.
NOT: 10'dan az tüp gerekebilir. - Kolonun altını kapatın ve kalan radyoaktiviteyi ölçün. Her şişeyi akışla ölçün. 50 μCi'den fazla olan her flakon için, her fraksiyondaki bağlı bakır yüzdesini ölçmek için adım 3.3.7'ye göre bir ITLC hazırlayın.
NOT: İlk bir veya iki kesir yalnızca mobil faz içerecektir; radyoaktif işaretli mAb önce elüte olur (tipik olarak 2 veya 3 ila 5 veya 6 arasındaki fraksiyonlar) ve serbest 64Cu en son elüte olur (bazıları kolona yapışır). Bağlı yüzde 64Cu, kesirler arasında değişebilir. - Fraksiyonları %95'ten fazla bağlayıcı (%5'ten az serbest bakır) ile birleştirin; Enjeksiyon için çözeltiyi kullanın. İstenirse, radyo-etiketlemeyi5 doğrulamak ve molar aktiviteyi hesaplamak için boyut dışlama HPLC'si gerçekleştirin. 10 yarı ömrü (127 saat veya 5,3 gün) bozulduktan sonra bir UV-Vis spektrofotometresindeki konsantrasyonu ölçmek için bir alikot kaydedin.
4. Doz hazırlama
NOT: Dozu kullanmadan önce, laboratuvar önlüğü, vücut ve parmak dozimetreleri ve eldivenler dahil olmak üzere uygun KKD kullanın.
- Radyoizleyicinin vücutta yeterli dolaşımını sağlamak için PET taramasından 18-24 saat önce 64Cu-DOTA-hCD19-mAb enjekte edin.
- Kurşun kabı hemen 64Cu-DOTA-hCD19-mAb ile kurşun koruyucunun arkasına yerleştirin. Potansiyel kontaminasyonu izlemek için Geiger sayacını açın.
NOT: Radyoaktif maddelerle çalışırken eldivenleri sık sık değiştirin. Hızlı eldiven değişimini kolaylaştırmak için dozları çizerken çift eldiven kullanılması önerilir. Kirlenmiş kesici aletleri ve çöpleri her zaman belirlenmiş korumalı çöp alanına koyun. - 64Cu-DOTA-hCD19-mAb'yi düşük bağlayıcı 1.5 mL plastik santrifüj tüpünde uygun bir konsantrasyona seyreltin.
NOT: 64Cu-DOTA-hCD19-mAb, düşük bağlanmamışsa plastiğe bağlanacaktır; 64Cu cama bağlanacaktır.- Radyolizi önlemek ve tutarlı dozlar çizmeyi kolaylaştırmak için radyoizleyiciyi tuzlu su ile seyreltin.
- Mümkünse 100 μL'de 75 ila 150 μCi arasında uygulanacak dozları hazırlayın. Enjekte edilen maksimum toplam hacmin farenin vücut ağırlığının %10'unu geçmediğinden emin olun.
- Dozu düşük bağlayıcı plastik tüpten çekmek için 500 μL (50 cc) insülin şırıngası kullanın. İntravenöz olarak enjekte edileceğinden şırıngada kabarcık olmadığından emin olun.
- Şırıngaları karşılık gelen hayvan numaralarıyla önceden etiketleyin.
- Veri analizi için doz aktivitesini ve süresini bir laboratuvar not defterine kaydedin.
- Anestezi altında geçen süreyi azaltmak için hayvanlar kateterize edilir edilmez dozları enjeksiyona hazır hale getirin.
- Dozlar hazırlandıktan sonra, bir kalibrasyon faktörü oluşturmak için tarama için bir standart (fantom) hazırlayın.
- 15 mL'lik bir konik tüpü suda (veya PBS) seyreltilmiş 50-75 μCi aktivite ile doldurun.
NOT: Çözeltinin iyice karıştırıldığından emin olun. Standart, etiketlemeden kalan 64Cu serbest olabilir.- Standarttaki aktivite miktarını ölçün ve zamanı kaydedin.
- 15 mL'lik bir konik tüpü suda (veya PBS) seyreltilmiş 50-75 μCi aktivite ile doldurun.
5. Kanülasyon ve Enjeksiyon
NOT: Radyoizleyici 6 enjeksiyonu için farelerin intravenöz kanülasyonu için daha önce açıklanan yöntemlere6 bakın.
- Radyoizleyici uygulamasına hazırlanırken% 2.1-1.5 izofluran ile doldurulmuş bir knockdown kutusunda fareleri uyuşturmadan önce fareleri bölüm 3'de açıklandığı gibi hastalık şiddeti açısından tartın ve puanlayın.
NOT: Bu fareler, daha önce açıklandığı gibi PET tarayıcıya değil, tezgah üstüne enjekte edilecektir. Fareler kanülasyon ve enjeksiyon arasında hareket ettirilmeyeceğinden, kateterleri enjeksiyon için yerine yapıştırmaya gerek yoktur. - Bir fare kanüle edildikten sonra, iğneyi kateterin ucuna sokun ve yavaşça enjekte edin. Enjeksiyondan sonra, tüm dozun enjekte edildiğinden emin olmak için kateterden küçük bir salin ile yıkayın.
NOT: Hacim, yazarlar tarafından kullanılan kateterler için 50 μL olan kateterin ölü hacmine yaklaşık olarak eşit olmalıdır.- Herhangi bir radyoizleyici damlasını toplamak için bir parça laboratuvar mendili üzerine enjekte edin; Kalıntı dozu ölçerken bunu dahil edin.
- Enjeksiyon zamanını bir laboratuvar not defterine kaydedin.
- Enjeksiyondan hemen sonra kanülü çıkarın. Fareye enjekte edilmeyen kalıntı dozu belirlemek için bir doz kalibratörü kullanarak kanülü, doz şırıngasını ve dokuyu ölçün.
- Etkinliği ve zamanı bir laboratuvar not defterine kaydedin.
- Fareler enjekte edildikten sonra, kafeslerini farelerin radyoaktif olduğunu gösteren bir kafes kartıyla etiketleyin. Kafesleri kurumsal yönergelere göre kaydedin ve kaydedin. Ardından, fareleri belirlenmiş bir radyoaktif tutma alanına yerleştirin.
6. PET/CT görüntüleme
- 64Cu-DOTA-hCD19-mAb enjeksiyonundan 18-24 saat sonra PET görüntüleme yapın. Taramadan önce fareleri tartın ve puanlayın.
NOT: Tarayıcı çalıştırma talimatları, kullanılan tarayıcıya bağlıdır.- PET/CT tarayıcısının X-ışını bileşeninin ısındığından ve alınmaya hazır olduğundan emin olun.
- Bilgisayarda PET tarayıcı edinme yazılımını açın.
- Araştırmacı Oturum Açma açılır menüsünden, uygun laboratuvar bilgilerine tıklayın.
- Proje sayfasında, yeni bir proje oluşturun veya açılan menüden var olan bir projeyi seçin.
- Başlatma istemi ekranda otomatik olarak göründüğünde, Ev Yatağı'na tıklayın ve yatağın eve gelmesini bekleyin. Ardından, CT'yi ısıt'a tıklayın.
- BT'nin ısınmasına izin vermek için BT koruyucu kapağın kapalı olduğundan emin olun.
- Tarayıcı ısınırken, EAE farelerini puanlayın ve hidrasyon için yan tarafa 0.2-0.4 mL ılık salin ile deri altına enjekte edin.
- Tarayıcı ısındıktan sonra, çalışma için PET taramalarını ayarlamak üzere bilgisayara geri dönün.
NOT: Bunlar, tarama gününden önce ayarlanabilir.- Son Çalışmalar başlığı altında, Yeni Çalışma Oluştur'a tıklayın. Çalışma adını, protokolü, bileşimi ve konu bilgilerini doldurun.
- PET/CT yapıyorsanız, önce PET Protokolü'nü seçin ve ardından CT Protokolü'nü seçin.
NOT: Tipik olarak, EAE fare modelini taramak için standart bir CT yeterlidir. Bir CT taraması 1 dakika uzunluğundadır ve 80 kVp voltajda, 150 μA akımda ve 720 projeksiyonda 2 x 2'de gruplama ile elde edilir. BT görüntüleri, Değiştirilmiş Feldkamp Algoritması kullanılarak yeniden oluşturulur. - PET protokolü için 10-15 dakikalık statik 64 bakır taraması seçin. Bu tarama zaten kullanılabilir protokoller listesinde değilse, Standart menüsündeki Protokoller sekmesine tıklayarak ekleyin, Yeni Protokol Oluştur | İzotoplar açılır menüsü. İstenen izotop listelenmemişse, Daha Fazla | Kitaplıktan ekleyin ve istediğiniz izotopu ekleyin. Tarama süresini tanımlayın, Statik Tarama radyo düğmesine tıklayın, protokolü adlandırın ve Kaydet'e tıklayın.
- Etütler sekmesine dönün ve gün için istenen tüm taramaları adlandırmaya ve ayarlamaya devam edin.
NOT: Optimum yerleştirmeyi sağlamak için ilk taramanın yatak konumunu kontrol etmek için yalnızca standart bir BT kullanarak bir "BT Testi" taraması yapılması önerilir. Bu, çalışma için ilk tarama çalıştırması olmalıdır.
- PET/CT yapıyorsanız, önce PET Protokolü'nü seçin ve ardından CT Protokolü'nü seçin.
- Son Çalışmalar başlığı altında, Yeni Çalışma Oluştur'a tıklayın. Çalışma adını, protokolü, bileşimi ve konu bilgilerini doldurun.
- Tarayıcı hazır olduğunda, fareleri taramaya hazırlamak için bir knockdown kutusunda uyuşturun.
NOT: Bu aşamada, fareler muhtemelen çok hastadır; Anestezi altındaki süreyi en aza indirmek en iyi uygulamadır.- Göz jeli uygulayın.
- Dört fareli tarama yatağının, izofluran %1.5-%2'ye ayarlanmış ve ısıtma yastığı açıkken, ısıtma yastıkları veya ısıtılmış hava gibi ısıtma elemanları ile donatıldığından emin olun (Şekil 3). Fareleri tarama yatağına sırtüstü pozisyonda yerleştirin.
- EAE hastalığı ilerledikçe, farenin omurgası ciddi şekilde eğrilir. Omurgayı mümkün olduğunca düzeltmek için fareleri sırt üstü yatarken tarayın ve aşağı akıştaki analizi iyileştirin. Omurgayı düzeltmeye yardımcı olması için fare kuyruğunu yavaşça çekin.
- Sırtüstü pozisyondayken, her fareyi yumuşak mikroskop bandıyla güvenli bir şekilde yerine bantlayın. Nefes alma nedeniyle hareketi en aza indirmek için başınızın üzerinde bir şerit bant ve diğerinin göbeğin üzerinde hafifçe kullanın.
- Hangi farenin hangi tarama konumunda olduğunu bir laboratuvar not defterine kaydedin.
- Fareler sabitlendikten sonra, tarayıcıyı çalıştırmak için tarama bilgisayarına geri dönün.
- Hareket Denetleyicisi menüsünü açın. Tarama yatağındaki fareleri PET halkasına taşımak için PET Center FOV'a tıklayın. Günün ilk taraması için CT Center FOV'a tıklayın. Pozisyona girdikten sonra, pozisyonun doğru olduğundan emin olmak için CT Testi taramasını çalıştırın; Yatak pozisyonu tatmin edici olana kadar tekrarlayın.
- Çalışmanın geri kalanı için doğru yatak yerleşimini işaretlemek için tarama yatağına küçük bir parça beyaz bant yerleştirin.
- PET taraması için yatak yerleştirildikten sonra, Çalıştır'a tıklayarak tarama sırasını başlatın.
- Tarayıcının PET halkasından CT'ye otomatik olarak geçmesini bekleyin.
- Hayvanların hem PET hem de CT için uygun pozisyona gelip gelmediğini her zaman görsel olarak kontrol edin.
- Veri analizi sırasında enjekte edilen dozun bozulma düzeltmesi için tarama başlangıç zamanını bir laboratuvar not defterine kaydedin.
- Tarama tamamlandıktan sonra görüntünün yeniden oluşturulmasına izin verin. Hayvanları çıkarmadan önce verileri kontrol edin.
NOT: 3D sıralı alt kümeler beklenti-maksimizasyon (OSEM) yeniden yapılandırması, statik tarama için yaklaşık 5 dakika sürecektir. - Bu doku çok sayıda B hücresi içerdiğinden, dalağı pozitif kontrol olarak kullanarak verileri görsel olarak kontrol edin ve onaylayın. Hayvanları tarama yatağından çıkarın ve perfüzyon ve müteakip diseksiyon için hazırlık olarak izofluran dolu bir deşarj kutusuna yerleştirin.
- Çalışmada kalan fareler için 6.5-6.12 adımlarını tekrarlayın.
- Tüm fareler tarandığında veya tarama yatağında açık bir yeri olan bir grubu tararken, adım 4.6'da hazırlanan standardı tarayın.
7. Ex vivo gama sayımı ve otoradyografi için diseksiyon
- Diseksiyondan önce, tüm gama sayımı ve santrifüj tüplerinin önceden tartıldığından emin olun.
- Fareler derin anestezi altındayken PBS ve torakotomi ile daha önce tarif edildiği gibi6 perfüzyon yoluyla ötenazi gerçekleştirin (% 4 izofluran, 2 L / dak% 100 O2'nin sürekli solunması).
- Kemik iliğini çıkarmak için, her iki femuru diz ve pelvisten kesin. Her iki başın da uyluk kemiğinden çıkarıldığından emin olun.
- Her iki femuru da altta bir delik bulunan (20 G'lik bir iğne kullanarak) ve kapağı kesilmiş 0,5 mL'lik bir santrifüj tüpüne yerleştirin.
- Femurları içeren 0,5 mL'lik tüpü, kapağı kesilmiş olarak 1,5 mL'lik bir santrifüj tüpünün içine yerleştirin.
- Tüm tüp kurulumunu bir mini santrifüje yerleştirin. 4.500 × g'da 4 dakika döndürün.
NOT: Kemik iliği 0,5 mL santrifüj tüpündeki delikten çıkarılmalı ve 1,5 mL santrifüj tüpünün dibine yerleşmelidir.- Tüpleri ayırın. Boş femurları 0,5 mL santrifüj tüpünde tartın. Kemik iliğini 1.5 mL santrifüj tüpünde tartın. Her santrifüj tüpünü gama sayma tüplerine yerleştirin.
- Forseps ve makas kullanarak beyni çıkarın, beyin sapını sağlam tutmaya dikkat edin. Beyni bir gama sayma tüpüne yerleştirin. Kuru ağırlığı kaydedin, PBS ile yıkayın ve saymaya hazır olana kadar buz üzerinde tutun.
- Omuriliği çıkarmak için aşağıdaki adımları uygulayın.
- Omurgayı ortaya çıkarmak için hayvanın sırt tarafından bir kesi yaparak deriyi ve kürkü çıkarın (Şekil 1).
- Lomber (L) servikal (C) ve torasik bölgelerden, omurganın etrafında ve içinden üç enine düzlem boyunca keserek ayırın: boynun tabanında (C1 omur) (Şekil 1D, Numara 1); göğüs kafesinin tabanında (L1 omur) (Şekil 1D, Numara 2); pelvisin tabanında (L5 omur) (Şekil 1D, Numara 3).
- Göğüs kafesinin altından kesin (Şekil 1D, Numara 2).
- Lomber omurga bölgesini ayırmak için doğrudan sakrumun üstünden kesin. Lomber omurilik görünene kadar omurgayı pelvik uçtan dikkatlice kesin (Şekil 1D, Numara 3). Omurganın lomber ve servikal/torasik bölgelerini izole etmek için çevre dokuları kesin (Şekil 1D, Numara 4 ve 5).
- Omuriliği çıkarmak için, PBS ile doldurulmuş bir kayma uçlu şırınga (3-10 mL) kullanın. Başparmak ve işaret parmağını kullanarak şırınga ve omurga arasında bir conta oluşturun.
- Omuriliği emici bir ped üzerine çıkarmak için PBS'yi şırıngadan yavaşça itin (Şekil 1E); Her iki omurga bölgesi için tekrarlayın. Omurilik dokularını bir gama sayma tüpüne yerleştirin.
- Kuru ağırlığı kaydedin ve kurumayı önlemek için dokunun tüpün dibinde olduğundan emin olmak için PBS ekleyin. Saymaya hazır olana kadar tüpü buzun üzerine yerleştirin.
- Servikal/torasik omuriliği kraniyal uçtan ve lomber omuriliği omurganın kaudal ucundan dışarı atın (Şekil 1E).
8. Ex vivo gama sayımı
- Gama sayacı yazılımını açın. İş listesine gidin ve 64Cu için 30 sn sayma protokolü gibi istediğiniz protokolü seçin.
- Ayrı tüplerde en az üç standart hazırlayın. Analizde kullanmak için bunları şimdi çalıştırın (adım 10.2). Üç ayrı tüpte üç çoğaltma hacmi ve aktivite miktarı yapmayı hedefleyin.
NOT: 500 μL'lik bir hacim iyi sonuçlar verir. Aktivite kullanılan makine tarafından belirlenirken, 10 μCi genellikle iyi çalışır. - Standartları, çalıştırılması istenen protokole karşılık gelen barkodla etiketlenmiş bir rafa yerleştirin. Rafı gama sayacına yerleştirin.
- Organ ağırlıklarını kaydettikten sonra, organları içeren tüpleri, standartları içeren tüplerden sonra gama sayım rafına yerleştirin.
NOT: Bu model için ilgilenilen organlar arasında eksenel lenf düğümleri, kan, kemik iliği, beyin, servikal lenf düğümleri, femur, kalp, karaciğer, lomber omurilik, kas, dalak, kuyruk ve servikal/torasik omurilik sayılabilir. - Gama sayacının arkasına durdurma barkodlu bir raf koyun.
- Bilgisayardaki Oynat düğmesine basın. Mümkünse, tüm tüplerin tek bir dosyada sürekli olarak sayılmasına izin vermek için çalıştırılacak birden fazla raf veya organ olana kadar Oynat'a basmayın. Her çalıştırma için gama sayacının arkasında durdurma barkodlu bir rafın olduğundan emin olun.
- Tüm örnekler sayılana kadar çalıştırın. Dosyayı kaydedin ve dışa aktarın.
9. CNS dokusunun ex vivo otoradyografisi (ARG)
- Hem beyin hem de omurilik ARG için daha önce yayınlanmış adımları izleyin (farelere PET taramasından zaten radyoizleyici enjekte edildiğinden, Chaney ve ark. tarafından açıklanan 2-6 arasındaki adımları hariç tutarken)6.
NOT: Omurilik ARG kasetinin hazırlanması için özel talimatlar burada listelenmiştir6. - Lomber ve servikal/torasik omurilikler için gama sayımı tamamlandıktan sonra, tüm CNS dokuları sayılana kadar tüpleri derhal buz üzerine yerleştirin.
NOT: Beynin ARG6 için daha önce yayınlanmış yöntemine bakın. - Omuriliklerin emici bir ped üzerine düşmesini sağlamak için tüpleri hafifçe eğin. Omurilik tüpün yan tarafına yapışırsa, soğuk PBS ile hafifçe yıkayın ve tüpü tekrar eğin. Her omuriliği bir laboratuar dokusuyla hafifçe kurulayarak dikkatlice kurulayın. Kurutulmuş omurilikleri kalın siyah bir kağıda düzenli bir şekilde yerleştirin.
- Kolay tanımlama için omuriliklerin yanına beyaz bir kalemle etiketleyin.
- ARG kaseti kapalıyken omuriliklerin sıkışmasını önlemek için ara parça görevi görecek üç mikroskop lamı yığınlarını yerleştirmek için siyah kağıdın köşelerinde ve ortasında boşluk bırakın. 5-7 yığın kullanın.
- Tüm lomber ve servikal/torasik omurilikler siyah kağıda yerleştirildikten ve etiketlendikten sonra, kağıt parçasını dikkatlice ARG kasetine yerleştirin. Omurilikleri dondurmak için açık kaseti kuru buz tepsisine yerleştirin.
- Dondurulduktan sonra, dijital fosfor saklama ekranı ile omurilikler arasına streç filmi nazikçe yerleştirin ve ekranı numunelerin üzerine yerleştirin. Kaseti hemen kapatın ve yaklaşık 10 yarı ömür (~127 saat) için -20 °C dondurucuya koyun.
- Pozlama süresi tamamlandığında, filmi bir fosfor görüntüleyici kullanarak tarayın. Ortaya çıkan dijital görüntüyü analiz edin (talimatlar için bölüm 12'ye bakın).
10. Biyodağılım verilerinin analizi
- Radyoaktif bozunma için zaman düzeltmesini matematiksel olarak belirlemek için bir "Doz Düzeltme" elektronik tablosu oluşturun, böylece radyasyon dozlarını normalleştirin ve denekler arasında karşılaştırmalara izin verin.
- Enjeksiyondan sonra şırınga ve kateterde kalan kalıntı aktiviteyi hesaba katarak, enjeksiyon süresine kadar tüm dozları çürümeye karşı düzeltin.
- Adım 8.2'de hazırlanan standartları kullanarak, aktivite miktarının (μCi) ve dakika başına normalleştirilmiş sayımların (CPM) ortalamasını alın. BGBM/μCi elde etmek için ortalama BGBM'yi ortalama standart etkinlik miktarına bölün.
NOT: Her standart için etkinlik miktarının, gama sayacının standartların BGBM'sini saydığı zamana göre bozulma düzeltmesi yapıldığından emin olun. Gama sayacı, tüm BGBM değerlerini protokolün başlangıç zamanına göre normalleştirmelidir.
- Her numune için doku gramı başına enjekte edilen nihai doz yüzdesini (%ID/g) hesaplamak için "Sonuçlar" elektronik tablosunu ayarlayın.
- Hayvanın enjeksiyon süresine kadar sayılan her numune için gama sayacından normalleştirilmiş CPM'yi bozma düzeltmesi.
NOT: Çürüme düzeltmesi herhangi bir zaman noktasında olabilir; tüm dozların ve CPM değerlerinin aynı zaman noktasına bozulma düzeltmesi yapıldığından emin olun. - Numune başına CPM'yi belirlemek için bozunma düzeltmeli CPM'yi her numunenin kütlesine göre normalleştirin. Hesaplanan enjekte edilen BGBM'den kuyruktaki BGBM'yi çıkararak enjekte edilen toplam BGBM'yi hesaplayın.
NOT: Bu CPM değeri, enjeksiyondan kaynaklanan herhangi bir ekstravenöz izleyiciyi hesaba katmak için enjekte edilen toplam CPM'den çıkarılacağından, kuyruğun kütle düzeltmesine gerek yoktur. - %ID/g'yi hesaplamak için kütle başına BGBM'yi enjekte edilen toplam BGBM'ye bölün.
- Hayvanın enjeksiyon süresine kadar sayılan her numune için gama sayacından normalleştirilmiş CPM'yi bozma düzeltmesi.
- Bir grafik yazılımına giriş ve ardından veri görselleştirme ve istatistiksel analiz için nihai sonuçları görüntülemek üzere bir "Özet" elektronik tablosu oluşturun.
11. PET görüntü analizi
- PET analiz yazılımını açın. Dosyada yalamak |Yerel Verileri Aç | DICOM'u seçin. İstediğiniz dosyayı bulun (DICOM formatı). Hem PET'i hem de CT'yi açın.
- Veri Yöneticisi'nde, PET ve CT kontrastını istenen seviyelere ayarlayın.
- Tek tek fareleri kaydedin ve kırpın.
- Gezinme menüsünde Yeniden Yönlendirme/Kayıt sekmesini seçin.
- Bu sekmedeki Rijit menüsüne gidin. CT taramasını (0 ) Sabit tarama ve PET taramasını (1) Hareketli tarama olarak belirleyin.
- Sert Dönüşüm ve Hızlı Kalite'yi seçin. Kaydol'a tıklayın.
- Kayıt tamamlandıktan sonra (5-10 dakika), kaydı kaydetmek için onay işaretine tıklayın.
- Kaydın başarılı olduğundan emin olmak için verileri görsel olarak inceleyin. Dosya | Oturum | İhracat.
- Ardından, her fareyi tam vücut kırpmasında kırpın: Gezinme menüsüne gidin ve Kırpma'ya tıklayın. Her kesitin kenarlarını dış kenardan içe doğru sürükleyin.
- İstenen fare sıkıca kırpıldıktan sonra, onay işaretine tıklayın ve kaydetmek için oturumu dışa aktarın.
- Ardından, Kayıt/Yeniden Yönlendirme menüsündeki manuel Çeviri, Döndürmeler ve Çevirmeleri kullanarak beyin analizi için her farenin kafalarını kırpın ve düzeltin. Kaydetmek için dışa aktarın.
- Omuriliği analiz edin.
- Omurilikteki ilgi bölgelerinin (ROI'ler) analizine başlamak için, Gezinme Menüsünden 3D ROI Aracını açın.
- ROIs başlığının altında, altı ROI oluşturmak için menünün altındaki artı işaretini kullanın: Lomber ROI, Servikal/Torasik ROI, Lomber İskelet, Torasik İskelet, Lomber Omurilik, Torasik Omurilik.
NOT: Lomber ve Servikal/Torasik ROI'ler, iskelet ROI'lerini oluşturmak için kullanılacak genelleştirilmiş büyük ROI'lerdir (Şekil 4). - Bu adımda PET sinyalinden görsel paraziti önlemek için, PET'i kapatmak için F3'e tıklayın.
- 3D ROI Aracı Operatörü'nün en üstüne gidin. 3D Boyama Modu ve Aşındır/Genişlet menüsünü açmak için imleç sembolünün sağındaki düz noktaya tıklayın.
- Küre'yi seçin ve boyutu 20 piksel olarak değiştirin. Dilate'i +5 olarak ayarlayın.
- Devam etmeden önce menünün en altına gidin. Lomber ROI'nin seçildiğinden emin olun, çünkü bu çekilecek ilk ROI'dir.
- BT'de, omurganın L6 omurunu bulun (omurganın kalçalarla birleştiği yer). L6'nın üzerinde bir omurdan başlayarak, kalçaların üzerindeki beş omurun (L1-L5 omurları) üzerine kaba bir ROI Lomber ROI çizin. Ardından, Servikal / Torasik ROI'ye geçin ve omurganın geri kalanını kafatasının tabanına kadar izleyin.
NOT: Adım 11.4.8'de Otsu eşiğinin nerede olması gerektiğini belirtmek için kullanıldığından, bunun kesin olması gerekmez. - Genelleştirilmiş ROI'leri çizdikten sonra operatörün en üstüne gidin. Segmentasyon Algoritmaları menüsünü seçin.
- Açılır menüden Otsu Thresholding'i seçin. Giriş için Lomber ROI'yi seçin. Menünün alt kısmında, Lomber İskelet'in seçili olduğundan emin olun. Görüntü'nün yanındaki açılır menüde, CT taramasının seçili olduğundan emin olun ve Uygula'ya tıklayın. Servikal / torasik ROI ve torasik iskelet için tekrarlayın.
- Otsu Eşiklemesi omurgayı yeterince vurgulamıyorsa, Global Eşiklemeyi kullanın ve manuel eşikleme için Min değerini 350 ve Maks'ı 3.500 olarak değiştirin ve omurları izole etmek için gerektiği gibi ayarlayın.
- İskelet ROI'lerini oluşturmak için Otsu Thresholding'i kullandıktan sonra, Gezinme menüsüne (imleç simgesi) dönün. Hem kaba Lomber hem de Servikal/Torasik ROI'ler için H (gizle) sütununu gizlemek için silin veya işaretleyin. Düzenlenemeyecek şekilde her iki İskelet ROI'si için I (değişmez) sütununu işaretleyin.
- Son olarak, 3D ROI Araç Operatörünün en üstüne dönün ve Omurilik ROI'lerini çizmek için 3D Boyama menüsüne gidin.
- Küre aracını tekrar seçin ve hem Lomber hem de Torasik için iskelet içindeki omuriliği izleyerek menünün alt kısmında doğru yatırım getirisinin seçildiğinden emin olun.
- Herhangi bir ROI'yi silmek için Komut/Kontrol'e tıklayın ve silinecek parçanın üzerine çizin.
- Omurganın dışına çizilen bir yatırım getirisi olmadığından emin olmak için her üç düzlemden de omurilik yatırım getirisini kontrol edin.
- Omurilik analizi sonuçlarını dışa aktarın.
- PET sinyali adım 11.4.3'te kapatıldıysa, PET'i tekrar açmak için Omurilik ROI'leri çekildikten sonra F3 tuşuna basın veya Görsel Denetleyiciyi (VC) seçin ve PET çubuğuna tıklayın.
- Gezinme menüsüne geri dönün (imleç simgesi). Tabloyu Göstermek için ızgara simgesine tıklayın. Tabloyu elektronik tablo yazılımına kopyalayın ve kaydedin.
- Son olarak, çizilen ROI'leri kaydetmek için dosyayı yukarıda açıklandığı gibi PET analiz yazılımına aktarın.
- Yarı otomatik bir 3D atlas kullanarak beyni analiz edin.
- Kafa kırpma dosyasını açın. Gelişmiş Modüller menüsüne gidip 3B Beyin Atlası Aracı'nı seçerek fare beyin atlasını içe aktarın. Referansın CT olarak ayarlandığından ve kırpma seçeneğinin işaretli olmadığından emin olun. Çıkış dizini için bir yol ayarlayın.
- Gelişmiş Ayarlar'da, Dönüştür'ü Versor-Affine olarak değiştirin. Diğer tüm varsayılan ayarları koruyun. Çalıştır'a tıklayın.
- Yeniden Yönlendirme/Kayıt menüsünde atlası manuel olarak ayarlayın ve atlası takmak için kafatasının BT'sini kılavuz olarak kullanın.
- Ölçeklendirme gerekliyse çok dikkatli olun, çünkü bu beyin yapısı hacimlerini büyük ölçüde etkileyebilir. Ayarlama tamamlandığında onay işaretine tıklayın.
- 3D ROI'leri İçe Aktar seçili olarak atlası yeniden çalıştırın.
- Kırpılan kafaya takılan atlası kaydetmek için dosyayı dışa aktarın.
- İstenen organlardan tüm ROI'leri çizdikten ve dışa aktardıktan sonra, standart bir bağlama düzeltme değeri hesaplayın. Tüm verileri bozma düzeltmesi yapın ve daha önce açıklandığı gibi %ID/g'ye dönüştürün6. Kan havuzunda bulunan radyoizleyiciye normalleşmek için kalp gibi hayvan modeline uygun organı normalleştirin.
12. Ex vivo otoradyografi analizi
- Görüntü çözümleme yazılımını kullanarak dijital görüntü dosyasını (.gel) açın. Parlaklığı ve kontrastı istenen eşiğe ayarlayın. İsterseniz uygun bir renk arama tablosu uygulayın.
NOT: Görselleştirme kolaylığı için Kraliyet veya Griler önerilir.
Sonuçlar
HC19-mAb, Şekil 2'de gösterildiği gibi DOTA konjuge edildi ve 64Cu ile radyoaktif etiketlendi. EAE ve saf farelere 64Cu-DOTA-hCD19-mAb enjeksiyonundan 18-24 saat sonra PET/BT taraması yapıldı (Şekil 3). PET/CT görüntüleri, PET analiz yazılımı kullanılarak birlikte kaydedildi ve CNS dokuları, manuel ROI'ler veya yarı otomatik bir 3D beyin atlası kullanılarak analiz edildi. ROI'lerde radyoizleyici bağlanması (Şekil 4) EAE farelerinde saf farelere göre daha yüksekti. Ex vivo gama sayımı ve ARG, EAE farelerinin omuriliğinde (hem lomber hem de servikal torasik segmentler) ve beyninde (sadece ARG) naif farelere kıyasla artmış bağlanma gösterdi (Şekil 5 ve Şekil 6). Perfüze farelerin ex vivo gama sayımı, dalak, femur ve kemik iliği dahil olmak üzere periferik organlarda radyoizleyici bağlanmasının azaldığını gösterdi (Şekil 5), bu EAE modelinde çevreyi terk eden ve CNS'ye sızan B hücreleri ile tutarlı.
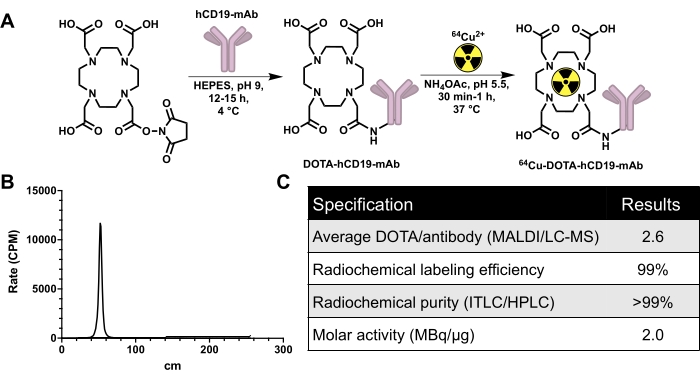
Şekil 2: Kalite kontrol verilerine ek olarak 64 Cu etiketli insana özgü CD19 monoklonal antikor, 16C4-TM mAb (64 Cu-DOTA-hCD19-mAb) üretmek için konjugasyon ve radyoetiketleme şeması. (A) DOTA-NHS-esterin hCD19-DOTA konjugatı (ölçek değil) üretmek için hCD19 monoklonal antikoru ile reaksiyonu ve 64Cu-DOTA-hCD19-mAb üretmek için 64Cu-CuCl3 ile radyo-etiketleme. (B) Temsili ITLC kromatografı. 40-60 cm'deki zirve, radyoaktif işaretli antikordur; bağlanmamış 64Cu-CuCl3 mobil faz ile hareket eder ve 200 ila 240 cm arasında mevcut olacaktır. Bu kromatografta saptanabilir serbest 64Cu-CuCl3 yoktur. (C) Radyoaktif işaretli antikorun kalite kontrol özellikleri. Kısaltmalar: DOTA-NHS ester = 1,4,7,10-Tetraazasiklododekan-1,4,7,10-tetraasetik asit mono-N-hidroksisüksinimid ester; ITLC / HPLC = anlık ince tabaka kromatografisi / yüksek performanslı sıvı kromatografisi; MALDI/LC-MS = matris destekli lazer desorpsiyon/iyonizasyon/sıvı kromatografi-kütle spektrometrisi; BGBM = dakikadaki sayım. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Hareketi en aza indirirken omurilik ve beynin yüksek kalitede görüntülenmesini sağlamak için PET tarayıcı içinde 3D baskılı bir yatakta farelerin nasıl sabitleneceğini gösteren fotoğraflar. (A) Isıtma elemanları ve anestezi tüpü ile donatılmış 3D baskılı dört fareli tarayıcı yatağı ("fare oteli" olarak da bilinir). (B) Omurganın düzlüğünü en üst düzeye çıkarmak için sırtüstü pozisyonda anestezi uygulanmış fareler; Her farenin yatak konumu kaydedilir. (C) Fareler, beyindeki hareketi en aza indirmek için başlarına ve nefes alma hareketini en aza indirmek için göbek boyunca güvenli bir şekilde bantlanmıştır. (D) Fare yatağı tarayıcının içine yerleştirilmiş ve tarama yatağına bantlanmıştır. Anestezi tüpü tarayıcıdan yatağa bağlandı ve izofluran %2'ye ayarlandı. Tarayıcı kapağını kapatmadan önce uygun izofluran seviyesini sağlamak için fare solunumu izlendi. Kısaltma: PET = Pozitron emisyon tomografisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
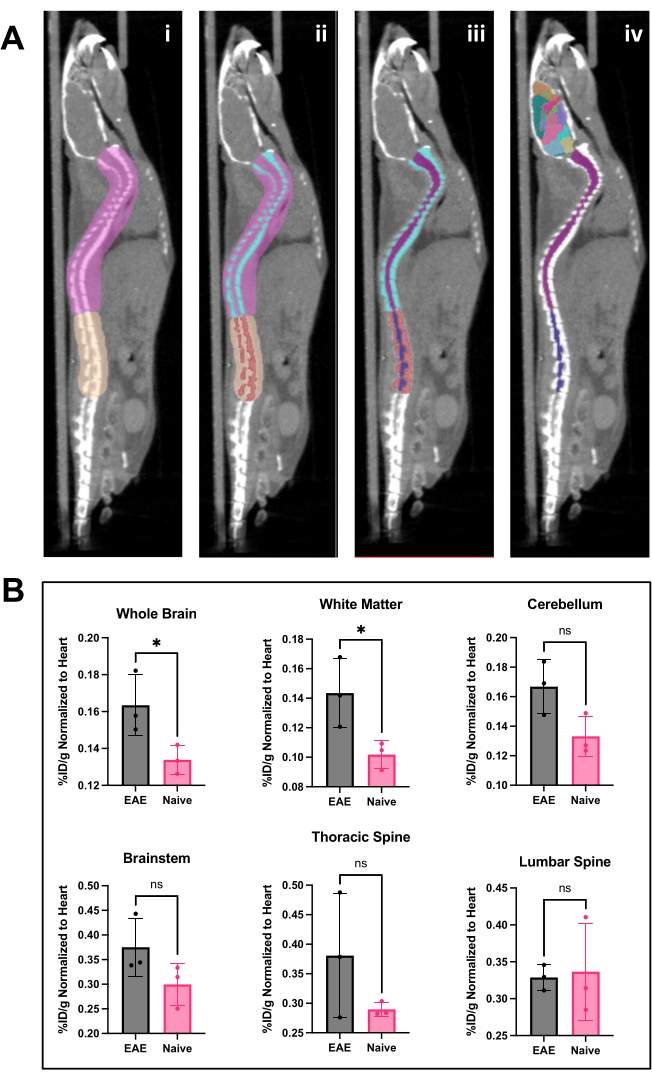
Şekil 4: PET analiz yazılımı kullanılarak omurilik görüntüsü ve beyin analizi ve sonuçları. (A) i) Lomber torasik ve servikal vertebralardan ayırmak ve Otsu eşiklemesi için görüntü hazırlamak için omurgaya çizilen ROI'ler (pembe ve ten rengi). ii ) Spinal omurlar (turkuaz ve kırmızı) Otsu Eşikleme kullanılarak bölümlere ayrıldı. iii ) Omurlar daha sonra 3D ROI menüsünde değişmez hale getirildi ve omurilik servikal/torasik (mor) ve lomber (lacivert) ROI'lere bölündü. iv) Vertebra ROI'si çıkarıldı, omurilik ROI'leri ve temsili beyin atlası uygulandı. (B) Her bir hayvandaki kalbin yatırım getirisine normalize edilmiş %ID/g olarak temsil edilen çeşitli CNS bölgelerinden elde edilen PET sonuçlarının temsili analizi. PET edinimi, PET/CT görüntüleme ile 10 dakikalık bir statik taramaydı. Beyin bölgeleri, panel A'da gösterilen yarı otomatik bir beyin atlası yaklaşımı kullanılarak ölçülmüştür. iv) Temsili sonuçlar, beyinde ve torasik omurilikte izleyici bağlanmasında önemli bir artışa doğru önem veya eğilim göstermektedir. İstatistikler Student t-testi kullanılarak yapılmıştır (*: p < 0.0332). Kısaltmalar: PET = Pozitron emisyon tomografisi; ROI'ler = ilgi alanları; CNS = merkezi sinir sistemi; BT = bilgisayarlı tomografi; %ID/g = doku gramı başına enjekte edilen doz yüzdesi; EAE = deneysel otoimmün ensefalomiyelit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
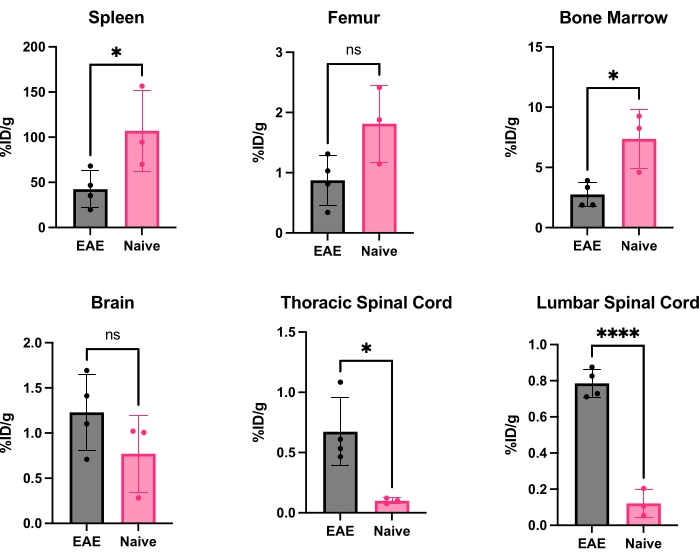
Şekil 5: EAE'de ve saf farelerde çeşitli organlarda ex vivo gama sayımının temsili miktar tayini% ID/g olarak ifade edilir. PET taraması sonrası, fareler, kanda bulunan radyoizleyiciyi serbest veya kanda yerleşik CD19 + B hücrelerine bağlı olarak çıkarmak için PBS ile perfüze edildi ve organlar, her organın doğru bir ağırlığına sahip olacak şekilde hızla diseke edildi ve tartıldı. EAE farelerinde dalak ve kemik iliğinde izleyici bağlanması, naif farelere göre önemli ölçüde azalmıştır. EAE farelerinin hem lomber hem de servikal/torasik omurilik segmentlerinde artmış radyoizleyici bağlanması gözlenir. Beyin, radyoizleyici sinyalinde önemli bir artış göstermez, ancak önemli bir artışa doğru eğilim göstermektedir. İstatistikler Student t-testi kullanılarak yapılmıştır (*: p < 0.0332; ****: p < 0.0001). Kısaltmalar: PET = Pozitron emisyon tomografisi; %ID/g = doku gramı başına enjekte edilen doz yüzdesi; EAE = deneysel otoimmün ensefalomiyelit; PBS = fosfat tamponlu salin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
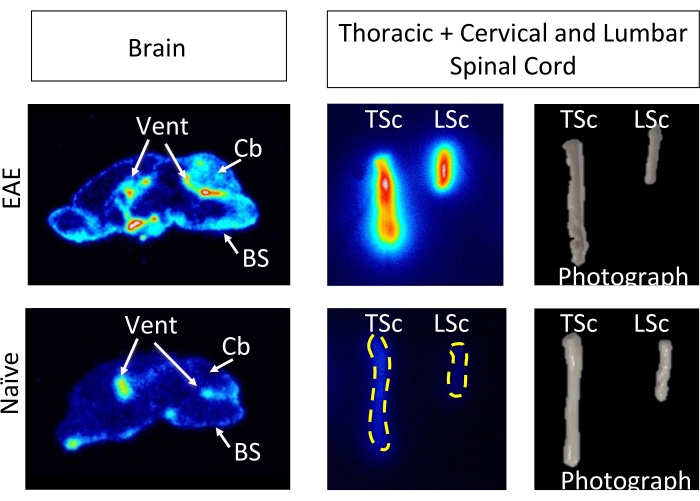
Şekil 6: Ex vivo ARG görüntüleri, naif farelerle karşılaştırıldığında EAE'den sagital beyin kesitlerinde ve tüm omuriliklerde 64Cu-DOTA-hCD19-mAb bağlanmasını göstermektedir. Dijital fosfor depolama filmleri, yaklaşık 10 yarı ömür (127 saat veya 5 gün) boyunca radyoaktif doku örneklerine maruz bırakıldıktan sonra bir fosfor görüntüleyici kullanılarak tarandı. Elde edilen görüntüler, EAE farelerinin beyninde, bu modelde B hücreleri içerdiği bilinen bölgeler nedeniyle beklenen saf farelerden alınan beyin bölümlerine kıyasla görsel olarak daha yüksek sinyal ortaya koymaktadır5. Spesifik olarak, EAE fare beyin bölümlerinin beyin sapı, beyincik ve ventriküllerinde artmış izleyici sinyali vardır. EAE fare beyin bölümleri için sinyaldeki bu artış, yukarıda ayrıntıları verilen tüm beyin PET nicelemesinde bulunanları yansıtmaktadır. Benzer şekilde, hem servikal/torasik hem de lomber omurilik segmentlerinde, naif omuriliklere kıyasla radyoizleyici bağlanmasında bir artış vardır, bu da ex vivo gama sayımı kullanılarak bulunanları yansıtır. Kısaltmalar: PET = Pozitron emisyon tomografisi; EAE = deneysel otoimmün ensefalomiyelit; Havalandırma = ventriküller; Cb = beyincik; BS = beyin sapı; TSc = torasik ve servikal omurilikler birleşik; LSc = lomber omurilik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: Naif ve EAE fare beyin dokusunun CNS dokularının CD45R/B220 ile boyanması. B hücreleri, EAE farelerinin beyin sapı, meninksleri ve beyaz cevherinde gözlenir (n = 7 EAE, n = 5 saf fare, hayvan başına ortalama dört dilim). Bu rakam 5'ten. Ölçek çubukları = sagital beyin görüntülerinde 5 mm (düşük büyütme [1x]), beyin sapı, meninksler ve serebellar beyaz cevherde 100 μm (yüksek büyütme [20x]). Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu makalede, CD19-PET kullanılarak MS'in bir fare modelinde insan-CD19+ B hücrelerinin görüntülenmesi için kolaylaştırılmış bir yöntem açıklanmaktadır. MS'in heterojen prezentasyonu ve tedavilere farklı yanıtlar nedeniyle, klinikte yönetimi zor olabilir ve tedavi seçimi ve izlemi için yeni yaklaşımlara büyük ihtiyaç vardır. PET görüntüleme, hastalığın ilerlemesini ve B hücresini tüketen tedaviye bireysel yanıtı izlemek için güçlü bir araç olarak hizmet edebilir. MS'e ek olarak, CD19-PET görüntüleme, lenfoma ve lösemi alt tiplerinde veya diğer B hücresi aracılı hastalıklarda tedaviden sonra B hücresi tükenmesini izlemek için kullanılabilir. Bu protokol ve temsili veriler, nörolojik hastalıklarda B hücrelerinin görüntülenmesinin faydasını göstermektedir.
İnsan CD19+ B hücrelerini MS bağlamında incelemek için, B hücresine bağımlı MOG1-125 EAE model7'yi seçtik. Diğer EAE modellerine benzer şekilde, bu model ilerleyici paralizi ve immün hücrelerin CNS'ye infiltrasyonu semptomları ile kendini gösterir. Bununla birlikte, MOG1-125 modeli, B hücresi güdümlü bir model olması bakımından benzersizdir: fareler, meninksler, beyin sapı, parankim ve ventriküllerdeki subaraknoid boşlukta değişen sayıda B hücresi içerir. Bu lenfositler, bu bölgeler boyunca seyrek olarak dağılabilir ve/veya MS8,9'lu insanlarda da gözlenen folikül benzeri yapılar oluşturabilir. Saf farelerin kontrol olarak kullanılmasına ek olarak, tam bir Freund'un adjuvanı (CFA) sadece indüksiyon kiti kullanılabilir (yani, MOG proteini olmayan EAE farelerine verilenle aynı indüksiyon emülsiyonu). EAE fare modelinde, kan beyin bariyeri (BBB) işlevsizdir ve antikorlar gibi daha büyük varlıkların geçmesine izin verir. CD19-mAb radyoizleyici, yalnızca B hücreleri mevcutsa bağlanır ve CNS'de kalır; B hücreleri yoksa izleyici kan havuzuna geri dönecektir. Bunu, dokulardaki radyoaktivite düzeylerini ölçmeden önce perfüze ederek CNS dokularının gama sayımı ve ex vivo otoradyografisini kullanarak gösterdik. Bunu, CNS 1,2'deki B hücrelerini tespit etmek için mAb tabanlı PET radyoizleyicilerin (yani, immünoPET görüntüleme yaklaşımları) kullanımını bildiren daha önceki yayınlarda da gösterdik.
DOTA şelatörü, bakır-64 işaretli peptitler ve antikorlar ile klinik PET görüntülemede kullanıldığı için kullanıldı ve hCD19-mAb'yi MS hastalarının klinik görüntülemesi için çevirmeyi amaçlıyoruz. DOTA, in vivo olarak bakır-64'e yeterli bağlanma afinitesine sahiptir. İn vivo stabilite çok önemlidir çünkü serbest 64Cu karaciğere gider ve bağlı radyoizleyicinin sinyalini gizleyebilir; Bu nedenle, diğer organlara kıyasla bağıl sinyali hesaplamak için karaciğerdeki sinyali ölçmek önemlidir. Kas tipik olarak bir kontrol dokusu olarak alınır, ancak EAE durumunda kaslarda iltihaplanma olabilir. 64Cu'nun yarı ömrü 12.7 saattir, bu da sinyalin PET ile ölçülebilmesini sağlarken DOTA-hCD19-mAb'ın hedefine bağlanması için yeterli zaman sağlar. Konjugatı hazırlarken, istenen DOTA/mAb oranını üretmek için mAb'ye eklenecek DOTA miktarını belirlemek için küçük ölçekli (75-125 μg) test reaksiyonları gerçekleştirilmelidir (örneğin, mol mAb başına 6-10 kat fazla DOTA-NHS-ester reaksiyonu 1-2 DOTA/mAb'lik bir konjugat). Reaksiyon süresi ve sıcaklığı (örneğin, 2-4 saat veya gece boyunca 4 °C veya oda sıcaklığında) da DOTA/mAb oranını etkiler ve optimize edilmelidir. mAb başına DOTA sayısını hesaplamak için radyoaktif olmayan bakır ile bir titrasyon gerçekleştirilebilir; ancak, daha güvenilir ve doğru sonuçlar için MALDI-MS ve/veya LC-MS yapmanızı öneririz.
Hesaplanan DOTA/mAb oranı, belirli bir numune için ortalama bir değerdir ve bazı farklılıklar beklenir. MALDI için, konjuge ve konjuge olmayan mAb'ler için numune başına birkaç çekim yapılır. Daha sonra ortalama DOTA/mAb sayısını belirlemek için konjuge ve konjuge olmayan oranını hesaplıyoruz. DOTA/mAb oranı önemlidir çünkü çok fazla şelatör antikor bağlanmasını bozar ve çok azı tutarsız radyoetiketlemeye ve düşük sinyale yol açar. Tutarlı sinyal yoğunluğunu ve bağlanma kinetiğini korumak için oran, eşlenik partileri arasında çok yakın olmalıdır; İdeal olarak, belirli bir çalışmadaki tüm deneyler için aynı eşlenik parti kullanılmalıdır. Olası aşırı konjugasyona bağlı immünoreaktivite üzerindeki potansiyel etkileri azaltmak için umut verici bir teknik, bölgeye özgü konjugasyon10'u kullanmaktır, bu sayede şelatör konjugasyonu antikorun ağır zincirli glikanları üzerinde bölge seçicidir, böylece mAb başına 1 şelatör ilavesini garanti eder.
Diğer koşulların yanı sıra antikor, DOTA/mAb oranı ve 64Cu molar aktivitedeki farklılıklar radyo-etiketlemeyi etkileyeceğinden, radyoetiketleme reaksiyon koşulları en yüksek etiketleme verimliliğini ve verimini sağlamak için optimize edilmelidir. Optimum 64Cu / mAb eşlenik oranının kullanılması, radyoizleyicinin saflaştırılmadan kullanılmasına izin vererek, yerçekimi akış kolonu ve radyoaktif bozunma nedeniyle radyo-etiketleme ve kayıp için gereken süreyi azaltabilir. Aynı 64Cu / mAb konjugat oranı kullanıldığında tutarlı ve güvenilir bir molar aktivite de elde edilebilir, bu özellikle birden fazla fare kohortu veya görüntüleme çalışmaları arasındaki sonuçları karşılaştırırken önemlidir. ITLC koşulları da her kullanıcıya uyacak şekilde değiştirilebilir. Saflaştırma gerekliyse, molar aktivitenin hesaplanabilmesi için HPLC ve/veya UV/Vis spektrofotometrisi için bir alikot kaydedilmelidir.
Görüntüleme için radyoaktif işaretli antikorların kullanılmasının zor olabileceğini unutmamak önemlidir. Radyoizleyici için kullanılan antikorun fizyolojik bir etkiye sahip olmaması için biyolojik olarak inert olması esastır. Ayrıca, antikorlar uzun bir kan ikametgahına sahip olduklarından, görüntü kalitesinden ödün vermeden uygun bir sinyal-arka plan sağlamak için belirli bir mAb'nin dolaşımı, bağlanması ve temizlenmesi için yeterince uzun süre beklenmelidir. Tipik olarak 64 Cu etiketli bir mAb için 20-48 saat beklemek yeterlidir, ancak belirli bir kemirgen modelinde görüntüleme için en iyi zaman noktasını belirlemek için yeni bir mAb PET izleyiciyi değerlendirirken enjeksiyondan 2, 4, 6, 12, 24, 48 saat sonra görüntülenmelidir. Aynısı, en yüksek sinyal-arka plan oranına sahip ARG görüntülerini elde etmek için de geçerlidir. Bu protokoldeki temsili görüntüler enjeksiyondan 18-20 saat sonra alınmıştır, ancak kullanılan radyoizotopa bağlı olarak başka zaman noktaları da kullanılabilir. CD19'un farklı epitoplarına bağlanan farklı antikorlar farklı sonuçlar verecektir ve titizlikle karakterize edilmelidir.
Omurilik sinyalini analiz ederken, solunumun neden olduğu hareketi azaltmak için fareleri tarama yatağında sırt üstü konumlandırmak önemlidir. Ek olarak, sırtüstü yerleştirme, EAE hastalığının ilerlemesi nedeniyle omurga eğriliği artmış farelerde omurgayı düzeltmeye yardımcı olabilir. Omurga ve omurilikteki sinyali tespit etmeyi hedeflerken göz önünde bulundurulması gereken bir diğer önemli husus, MOG1-125'in yan tarafa enjekte edilmesinden kaçınmaktır, çünkü enjeksiyon bölgeleri bu bölgelerdeki ilişkili bağışıklık tepkisi nedeniyle izleyiciyi bağlayabilir. Enjeksiyon bölgesinin yakınlığı omurilik analizini etkileyebilir; Bu nedenle, burada açıklanan uygulama için göğüste enjeksiyonlar tercih edilir.
Kullanılan görüntü analiz teknikleri CNS görüntülemeye özgüdür. Görüntü analiz yazılımı içindeki bir beyin atlası aracı, PET ve CT kaydı doğru olduğu sürece tekrarlanabilir ve güvenilir sonuçlar verir. Yarı otomatik 3D beyin atlasını kullanmak ve her farenin kafatasına uyacak şekilde ayarlamak, hayvanlar arasında tutarlı yatırım getirisi sağlar. Şu anda omuriliklerdeki sinyali analiz etmek için otomatik veya yarı otomatik bir yaklaşım olmadığından, manuel ROI'ler çizilmelidir. Özellikle, CD19 + B hücrelerini (veya hem kemik iliğinde hem de omurilikte bulunan herhangi bir hücre tipini) ölçerken, omurga ve kemik iliğinden kaynaklanan sinyali mümkün olduğunca ortadan kaldırmak çok önemlidir. Bunun nedeni, saf farelerin kemik iliğinde, B hücrelerinin CNS 5,11'e sızmak için çevreyi terk ettiği EAE farelerinden daha fazla CD19 + B hücresi içerdiğinin bilinmesidir. Bu kemik iliği sinyali, omurilikteki gerçek sinyali gizleyebilir.
Omurga ve kemik iliğinden gelen sinyalin katkısını en aza indirirken gerçek omurilik sinyalini tanımlamak için, BT görüntüsünün Otsu eşiklemesi, omurga için değişmez bir ROI oluşturmak için kullanılabilir. Ayrı bir omurilik ROI'si daha sonra omurga içinde kolayca çizilebilir. Aynı teknik, uyluk kemiğindeki kemik iliğini ölçmek için de uygulanabilir. Bu, omurilikteki izleyici bağlanması hakkında bilgi edinmek için çok yararlı bir yöntemdir. Bununla birlikte, PET'in nispeten düşük uzamsal çözünürlüğü ve farelerin küçük anatomik bölgelerini tararken kısmi hacim etkisi ile ilgili sorunlar nedeniyle, ek ex vivo doğrulayıcı tekniklerin (örneğin, gama sayımı, ARG) kullanılması, omurilikte kan, beyin omurilik sıvısı veya omurgadan yayılma sinyali olmadan radyoizleyici bağlanmasının doğrulanmasını sağlar.
Servikal / torasik omurilikteki sinyal, EAE farelerinde hastalığın ciddiyetine ve adaptif immün yanıt sırasında kaç B hücresinin sızdığına bağlı olarak değişme eğilimindedir. Saf farelerin pelvik / spinal kemik iliğindekilere kıyasla CNS'deki az miktarda B hücresinin yanı sıra sızan B hücrelerinin sayısındaki bu varyasyon, farelerde omurilik dokusunun in vivo kantitasyonunu zorlaştırabilir. Küçük hayvan görüntülemede PET'in uzamsal çözünürlüğü göz önüne alındığında, kemik iliğinden gelen sinyal omurilik sinyaline yayılabilir. Burada tamamlanan ex vivo biyodağılım ve otoradyografi, omurların omurilik dokusuna karşı PET sinyalinin doğrulanmasına yardımcı olur. Fareler, kan havuzundaki herhangi bir bağlanmamış izleyiciyi çıkarmak için diseksiyondan önce perfüze edilir, böylece gama sayımı ve otoradyografi sonuçları, o organdaki kan havuzundaki izleyiciden ziyade her organda gerçekten bağlı olan izleyiciyi yansıtır.
Radyoizleyiciler kanda dolaşır ve antikor izleyicileri ile, özellikle, ilk enjeksiyondan sonra haftalarca kanda genellikle bağlanmamış radyoizleyici bulunur. Birçok kan damarına sahip olan beyni ve omuriliği görüntülediğimiz için, sinyalin hangi kısmının gerçekten kan havuzunda bulunana karşı ilgilenilen beyin/dokudaki izleyici bağlanmasından kaynaklandığını anlamak önemlidir. Bu nedenle beyin sinyalini kalp/kan havuzundaki sinyale bölmek gerekir. Klinik ortamda, omurların Otsu eşiklemesi ve omurilik dokularının ROI'leri ile aynı görüntü analiz teknikleri miktar tayini için kullanılabilir. İnsanlarda farelere kıyasla daha büyük doku hacimleri göz önüne alındığında, kısmi hacim etkilerinden önemli ölçüde daha az etki olmalıdır, bu da doğruluğun artmasına ve in vivo bulguları doğrulamak için ex vivo tekniklere olan ihtiyacı ortadan kaldırır. Klinikte PET kullanımı, klinisyenlerin bireysel B hücresi yüküne bağlı olarak her hasta için tedaviyi kişiselleştirmesine olanak tanıyacaktır.
ARG, beyin sapı ve beyincik gibi küçük bölgelerde izleyici bağlanmanın uzamsal konumunun daha doğru bir şekilde tanımlanmasını sağlamak için yüksek çözünürlüklü görüntüler elde etmek için özellikle yararlıdır. Aynı kesitler ve/veya bitişik kesitler, B hücrelerinin varlığını doğrulamak için immünohistokimyasal boyalar için kaydedilebilir. Daha önce CNS dokularını CD45R/B220 (Ek Şekil S1) ile boyayarak B hücrelerinin sayısını PET ve ARG sinyali 5,9 ile ilişkilendirmiştik. Boyama daha sonra radyoizleyici sinyalinin boyama modeliyle eşleştiğini doğrulamak için ARG sonuçlarıyla uzamsal olarak karşılaştırılabilir. B hücreleri, beyin sapı boyunca kümeler halinde veya yaygın olarak bulunabilir; PET duyarlılığı, sinyali ölçmek için yeterince yüksektir, bu da klinik çeviri için cesaret vericidir. Omurilik ARG için, omuriliğin omurlardan çıkarılması, ölçülen sinyalin kemik iliği ve/veya kandan ziyade omurilik dokusundaki izleyici bağlanmasından kaynaklanmasını sağlar ve bu da kısmi hacim etkileri nedeniyle PET görüntülerini gizleyebilir.
ARG'ye benzer şekilde, ex vivo gama sayımı, tek tek organlarda radyoaktif sinyalin ölçülmesini sağlar. Bu özel teknik için, tüpleri gama sayacına yerleştirmeden önce dokuların ıslak ağırlığını ölçmek ve ilgili tüplerinin dibinde olduklarından emin olmak önemlidir. Tüpler, doğru tüpün kullanılması için fare numarası ve dokusu ile etiketlenmelidir; Tüp daha sonra kalibre edilmiş bir terazide tartılır ve organlar bir mikrogramın en yakın onda birine (0.0001 mg) yerleştirilir. Bazı dokular son derece küçüktür ve öncesi ve sonrası tüp kütlesindeki fark 0.0001 mg mertebesinde olacaktır. Nem kaybını önlemek için dokular diseksiyondan hemen sonra tartılmalıdır, bu da daha düşük bir kütle ile sonuçlanır. Tartıldıktan sonra, bu dokular ARG için dondurulmadan önce kurumasını önlemek için beyin ve omurilik tüpleri PBS ile doldurulmalıdır.
Açıklamalar
CD19 antikoru Horizon Therapeutics tarafından sağlandı.
Teşekkürler
Stanford'daki SCi3 küçük hayvan görüntüleme tesisinden ve PET/CT ile ilgili teknik yardımı için Dr. Frezghi Habte'den destek için minnettarız. LC-MS, Stanford Üniversitesi Kütle Spektrometresi (SUMS) çekirdek tesisindeki çekirdek personel tarafından gerçekleştirilir ve bu hizmeti sağlayan personele teşekkür ederiz. Horizon Therapeutics'e hCD19-mAb'ı çok nazik bir şekilde sağladığı için ve özellikle Jodi Karnell'e teknik rehberliği ve desteği için teşekkür ederiz. Bu çalışma NIH NINDS (1 R01 NS114220-01A1) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5 mL 50 kDa MWCO Centrifugal filter | MiliporeSigma | UFC505008 | centrifugal filter |
| 64Cu-CuCl3 | Washington University in St. Louis; University of Wisonsin, Madison; or another vendor | ||
| AR-2000 Radio-TLC Imaging Scanner | Eckert & Ziegler | AR-2000 | |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 x 25 cm, screen only |
| Butterfly Needle Catheter | SAI Infusion Technologies | BLF-24 | |
| DOTA-NHS-ester | Macrocyclics | B-280 | |
| EAE Induction Kit | Hooke Laboratories | EK-2160 | |
| Geiger Counter | Ludlum | 14C | |
| GNEXT PET/CT Scanner | Sofie | GNEXT | |
| Hidex Automatic Gamma Counter | Hidex | AMG | |
| HPLC Column | Phenomenex | 00H-2146-K0 | 5 μm SEC-s3000 400 Å, 300 x 7.8 mm |
| Illustra NAP-5 column | Cytiva | 17085301 | DNA gravity column |
| Image J | NIH | ARG analysis software | |
| Low Protein Binding Collection Tubes (1.5 mL) | Thermo Scientific | PI90410 | |
| NanoDrop Lite Spectrophotometer | Thermo Scientific | 840281400 | UV-Vis micro/nano-spectrophotometer |
| PCR tubes 0.2 mL, for DNA grade | Eppendorf | 30124707 | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| VivoQuant | Invicro | Version 4 Patch 3 | PET Analysis Software; must purchase brain atlas add-on |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | Thermo Scientific | PI89882 | Desalting column |
Referanslar
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Karussis, D. The diagnosis of multiple sclerosis and the various related demyelinating syndromes: A critical review. Journal of Autoimmunity. 48-49, 134-142 (2014).
- Hauser, S. L., et al. B-cell depletion with Rituximab in relapsing-remitting multiple sclerosis. The New England Journal of Medicine. 358 (7), 676-688 (2008).
- Chen, D., Gallagher, S., Monson, N. L., Herbst, R., Wang, Y. Inebilizumab, a B cell-depleting anti-CD19 antibody for the treatment of autoimmune neurological diseases: Insights from preclinical studies. Journal of Clinical Medicine. 5 (12), 107 (2016).
- Stevens, M. Y., et al. Development of a CD19 PET tracer for detecting B cells in a mouse model of multiple sclerosis. Journal of Neuroinflammation. 17 (1), 275 (2020).
- Chaney, A. M., Johnson, E. M., Cropper, H. C., James, M. L. PET imaging of neuroinflammation using [11C]DPA-713 in a mouse model of ischemic stroke. Journal of Visualized Experiments. (136), e57243 (2018).
- Lyons, J. -. A., Ramsbottom, M. J., Cross, A. H. Critical role of antigen-specific antibody in experimental autoimmune encephalomyelitis induced by recombinant myelin oligodendrocyte glycoprotein. European Journal of Immunology. 32 (7), 1905-1913 (2002).
- Haugen, M., Frederiksen, J. L., Degn, M. B. cell follicle-like structures in multiple sclerosis-With focus on the role of B cell activating factor. Journal of Neuroimmunology. 273 (1-2), 1-7 (2014).
- James, M. L., et al. Imaging B cells in a mouse model of multiple sclerosis using 64Cu-Rituximab PET. Journal of Nuclear Medicine. 58 (11), 1845-1851 (2017).
- Zeglis, B. M., et al. An enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Lyons, J. -. A., et al. B cells are critical to induction of experimental allergic encephalomyelitis by protein but not by a short encephalitogenic peptide. European Journal of Immunology. 29 (11), 3432-3439 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır