Method Article
受精卵显微注射用于在小鼠中产生基因盒敲入和絮状等位基因
* 这些作者具有相同的贡献
摘要
本协议描述了CRISPR-Cas9和供体DNA的受精卵显微注射,以有效地产生基因盒敲入和絮凝小鼠。
摘要
CRISPR-Cas技术使转基因小鼠的快速、毫不费力地产生成为可能。具体来说,小鼠和点突变小鼠很容易通过将CRISPR因子(和单链寡核苷酸DNA供体)电穿孔到受精卵中产生。相比之下,基因盒(>1kb)敲入和絮凝小鼠主要是通过将CRISPR因子和双链DNA供体显微注射到受精卵中产生的。基因组编辑技术也增加了转基因小鼠生产的灵活性。现在可以在许多有益的近交小鼠品系中在靶基因组区域中引入预期的突变。我们的团队应包括日本在内的多个国家的要求,通过受精卵显微注射CRISPR-Cas9生产了200多个基因盒敲入小鼠系,以及110多个絮凝小鼠系。其中一些基因组编辑使用BALB / c,C3H / HeJ和C57BL / 6N近交菌株,但大多数使用C57BL / 6J。与电穿孔方法不同,在各种近交系小鼠中通过受精卵显微注射进行基因组编辑并不容易。然而,单近交遗传背景上的基因盒敲入和絮凝小鼠与遗传人源化、荧光报告基因和条件基因敲除小鼠模型一样重要。因此,本文提出了在C57BL / 6J小鼠中受精卵显微注射CRISPR因子和双链DNA供体以产生基因盒敲入和絮状小鼠的方案。本文专门关注核注射而不是细胞质注射。除了受精卵显微注射外,我们还概述了生产过程和外围技术的时间表,例如诱导超排卵和胚胎移植。
引言
敲入小鼠,其中预期的外源基因被引入靶位点,在许多体内研究中被广泛使用,如基因人源化小鼠,荧光报告小鼠和Cre驱动小鼠1,2。当小鼠受精卵中的基因组编辑诱导敲入突变时,单链DNA(单链寡核苷酸DNA供体,ssODN)或双链DNA(dsDNA)被用作供体DNA2,3。ssODN主要用于敲入小于200 bp4的相对较短的基因片段。使用长 ssODN (lsODN)5,6 敲入长度超过 1 kb DNA 的片段是可能的,但它们的制备非常耗时。当使用dsDNA供体时,无需费力的供体DNA制备即可生成基因盒(>1kb)敲入小鼠7。
使用ssODN的主要优点是电穿孔8可以产生敲入小鼠。然而,dsDNA供体必须通过受精卵显微注射直接引入细胞核。需要在两个位点同时敲入以产生絮状小鼠,其中每个loxP序列在靶基因的上游和下游被敲入。有两种方法可以通过小鼠受精卵中的基因组编辑来产生絮状小鼠 - 使用两个独立的ssODN,每个ssODN携带单个loxP位点,或使用具有絮状序列的单个dsDNA(或lsDNA);前者效率非常低9,10,11。如果环境有利于受精卵显微注射,则使用dsDNA供体进行基因组编辑是产生基因盒敲入和絮凝小鼠的最简单方法。
最初,Cas9 mRNA和sgRNA的混合物或编码sgRNA和Cas9的DNA载体用于小鼠受精卵12,13的基因组编辑。由于高质量和稳定的Cas9蛋白现在以低成本获得,因此将crRNA-tracrRNA-Cas9核糖核蛋白(RNP)引入小鼠受精卵14 变得流行。最近,通过在最有可能发生敲入的细胞周期阶段将crRNA-tracrRNA-Cas9 RNP和供体DNA引入小鼠受精卵的两个原核中,已经高效地产生了敲入小鼠15。因此,本协议描述了通过该方法生产各种类型的敲入小鼠的技术。
有许多有用的实验室小鼠近交品系16。近交背景中的遗传修饰可以忽略遗传背景对表型的影响。本文描述了一种在最常用的近交系小鼠C57BL / 6J17的受精卵中诱导基因盒敲入和絮状突变的方法。此外,还讨论了转基因小鼠的产生时间表和使用的外围技术,包括诱导超排卵和胚胎移植。
研究方案
根据筑波大学动物实验条例和教育部管辖的学术研究机构正确进行动物实验和相关活动的基本准则,所有动物实验均经筑波大学机构动物实验委员会批准进行, 日本的文化、体育、科学和技术。使用10-25周龄的两性C57BL / 6J小鼠作为受精卵供体。ICR小鼠(超过10周)用作受体小鼠。小鼠是从商业来源获得的(见 材料表)。
1. 确认无细胞系统中crRNA切割活性
- 将 2 nmol的 crRNA(干)和 20 nmol的 tracrRNA(干)分别溶解在 25 μL 和 250 μL 无 RNase 的水中(参见 材料表)。
注意:使用CRISPOR选择预测具有高切割活性且尽可能少脱靶的CRISPR靶序列(参见 材料表)。在基因盒敲入的情况下,将序列靶向插入位点。使用KOnezumi选择要絮凝的外显子(见 材料表)。 - 通过基因组PCR9扩增含有靶位点的DNA片段(约0.5-1 kb)。使用常见的PCR产物提取试剂盒纯化该PCR扩增子(参见 材料表)。
- 制备 10 μL CRISPR 混合物(在 Cas9 核酸酶反应缓冲液中制备 100 ng/μL crRNA、150 ng/μL tracrRNA 和 1 ng/μL Cas9,参见 材料表)。为了构建CRISPR-Cas9复合物,将CRISPR混合物置于37°C的加热块中30分钟。
- 将总体积(10μL)的CRISPR混合物加入步骤1.2中所述的PCR产物(10μL,20ng / μL)中,并在37°C下孵育1小时。加入 1 μL RNase (500 ng/μL) 以在 37 °C 下降解 crRNA 和 tracrRNA 30 分钟,因为在电泳过程中必须不存在 RNA。使用含有十二烷基硫酸钠(2% w / v)的上样染料对上述样品进行电泳。
注意:在极少数情况下,观察到没有切割活性的crRNA。在这种情况下,建议重新设计基因组编辑设计。
2.用于受精卵显微注射的crRNA、tracrRNA、Cas9蛋白和供体DNA混合物的制备
- 在无RNase的水中制备CRISPR溶液(50 ng/μL的crRNA,200 ng / μL的tracrRNA和200 ng / μL的Cas9)。制备供体 DNA 溶液(20 ng/μL 自构建质粒 DNA 载体)。
- 通过孔径为0.22μm的无菌注射器过滤器过滤供体DNA溶液。混合等体积的CRISPR溶液和过滤的供体DNA溶液。确保每种的最终浓度为 25 ng/μL crRNA、100 ng/μL tracrRNA、100 ng/μL Cas9 和 10 ng/μL 供体 DNA。这种混合物在下文中将被称为RNPD。
注意:当切割两个位点时,例如在絮凝小鼠生产过程中,每个crRNA的浓度必须为25ng / μL。供体DNA是环状质粒DNA,可以使用普通的小型制备离心柱试剂盒纯化(参见 材料表)。必须将制备的溶液放在冰上并尽快用于显微注射。
- 通过孔径为0.22μm的无菌注射器过滤器过滤供体DNA溶液。混合等体积的CRISPR溶液和过滤的供体DNA溶液。确保每种的最终浓度为 25 ng/μL crRNA、100 ng/μL tracrRNA、100 ng/μL Cas9 和 10 ng/μL 供体 DNA。这种混合物在下文中将被称为RNPD。
3.通过自然交配获得小鼠受精卵
- 显微注射前3天将5IU妊娠母马血清促性腺激素(PMSG,见 材料表)皮下注射到C57BL / 6J雌性小鼠(10-25周龄)中。大约46-48小时后,腹膜内施用5IU人绒毛膜促性腺激素(hCG,见 材料表)。将PMSG和hCG处理的雌性小鼠与雄性C57BL / 6J小鼠共同容纳,并在第二天早上检查阴道塞。
注意:从一只雌性C57BL / 6J小鼠可以获得大约15-25个受精卵。时间线如图 1 所示。 - 准备两个用于受精卵培养的35 mm培养皿,如图 2所示。将它们放入培养箱(37°C,5%CO2)中直至使用。这些可以存放过夜。
- 通过颈椎脱位对确认阴道塞的雌性小鼠实施安乐死,并使用小剪刀从下腹部中线切开腹部皮肤和肌肉层到肋骨下方。
注意:遵循当地动物伦理委员会关于安乐死的建议。 - 收集输卵管并将其置于培养皿盖上含有0.75mg / mL透明质酸酶的20μLM2培养基中(参见 材料表)。用细尖镊子拿起一个输卵管,并通过菌毛将约 50 μL 的 M2 培养基与透明质酸酶灌注。
注意:此时,受精卵被许多积云细胞松散地包围。 - 30秒后,使用玻璃毛细管用少量培养基拾取形态正常的受精卵,并通过将它们转移到新鲜的M16中滴中来洗涤它们。将洗净的受精卵转移到培养皿(图2)中进行池化。
注意:时间线如图 1 所示。形态正常的受精卵具有雄性和雌性原核以及两个极体,这些极体没有严重损害球形15。受精卵的形态因菌株和物种而异。 - 重复步骤3.3和3.4,直到检索到所有受精卵。大约 100 个受精卵可以汇集在培养皿中的一滴 M16 中。将培养皿储存在培养箱(37°C,5%CO2)中直至显微注射。
4.显微注射针的制备
- 使用可编程移液器拉拔器拉动一些玻璃移液器(参见 材料表)。
注意:显微注射针必须具有细尖和长锥度。如果拉拔器具有用于制作用于卵胞浆内精子注射的针头的程序,则可以使用相同的程序来制作用于显微注射的针头。 - 通过撞击连接到微锻尖端的玻璃球来打破显微注射针的尖端。确保显微注射针的尖端尺寸直径约为1μm。在显微镜下以1000倍放大倍率检查尖端尺寸。
- 使用微锻件在距离尖端约2-3毫米处弯曲显微注射针。
注意: 弯曲的角度取决于显微操纵器的设置。弯曲过多会降低压电脉冲的有效性。
5.受精卵显微注射
- 将1-1.5厘米的操作液(压电效应所需的惯性体作为汞的替代品,见 材料表)注入显微注射针的中心,并将其连接到带有压电陶瓷促动器的手动微量注射器支架上。
- 此外,将保持针连接到对面的手动微量注射器支架上。将操作液以逐渐的压力移动到显微注射针尖。将两个手动显微注射器支架固定在显微操纵器上。
注意:从显微注射针尖流出的操作液可以在显微镜下以50倍放大倍率观察。调整液体发射量后,当施加压电脉冲时可以观察到液体的飞溅,确认压电脉冲是有效的。如果无法确认,请重新准备显微注射针。
- 此外,将保持针连接到对面的手动微量注射器支架上。将操作液以逐渐的压力移动到显微注射针尖。将两个手动显微注射器支架固定在显微操纵器上。
- 准备带有三个液滴的进样室:(1)10μL M2培养基;(2) 5 μL 12% 聚乙烯吡咯烷酮 (PVP) 在 M2 培养基中;(3) crRNA、tracrRNA、Cas9 蛋白和供体 DNA (RNPD) 溶液的 5 μL 混合物。以与步骤3.2相同的方式用矿物油覆盖液滴,并将注射室设置在倒置显微镜载物台上。
- 在倒置显微镜下,以50倍放大倍率,将显微注射移液管降低到12%PVP液滴中。吸出并分配 12% PVP 以清洁显微注射针尖的内部并将其转移到 RNPD 液滴中。
- 将手动显微注射器置于负压下,将RNPD溶液吸入显微注射针中。等待几分钟,直到吸出足够的体积;在放大50倍的显微镜下,用液体填充显微注射针的整个内部。
- 停止进气,通过将手动显微注射器设置为正压,逐渐排出RNPD溶液。将显微注射针的尖端移动到油中。
注意:逆时针转动手动微量注射器的旋钮进行吸入。要停止吸入,顺时针旋转旋钮并在显微镜下观察时逐渐增加压力。RNPD溶液将逐渐排出。显微注射针中的液位运动可以确认流出。
- 停止进气,通过将手动显微注射器设置为正压,逐渐排出RNPD溶液。将显微注射针的尖端移动到油中。
- 将50个受精卵放入M2液滴中,并轻轻地将保持移液管降低到同一液滴中。将显微注射针转移到含有受精卵的M2液滴上。切换到20倍物镜,并聚焦在显微注射移液器的尖端。
注意:放入尽可能多的受精卵,可以在10分钟内注射。 - 握住受精卵并通过移动显微操纵器专注于原核。将显微注射针插入受精卵,并将尖端靠近原核。一旦尖端到达原核膜,施加压电脉冲(强度:6-10,速度:1)刺穿。
- 当显微注射针刺穿原核时,注射RNPD溶液,观察原核的肿胀。一旦原核完全充气,迅速拔出针头。对女性和男性原核执行相同的程序。
注意:在显微镜下可以清楚地看到注射前核的膨胀。这种通货膨胀的程度很难用语言表达,但可以通过参考以前的报告15来确认。
- 当显微注射针刺穿原核时,注射RNPD溶液,观察原核的肿胀。一旦原核完全充气,迅速拔出针头。对女性和男性原核执行相同的程序。
- 将注射的受精卵移动到M2液滴内的另一个位置,以在注射前后识别受精卵。
- 重复步骤5.5-5.6,直到M2液滴中的所有受精卵都被注射。注射后,将受精卵转移到新鲜的M16培养皿中。
- 注射后10分钟选择存活的受精卵。去除被注射损坏的裂解受精卵,并将存活的受精卵分布到 M16 培养皿中的每个液滴中。每个液滴必须包含20-24个受精卵,供一名假怀孕女性使用。这减少了胚胎移植过程中M16培养皿暴露于培养箱外环境的时间。
注意:在最佳注射条件下,存活率为90%-95%。这取决于针尖的大小、压电脉冲的强度以及RNPD溶液的流出压力。
6. 胚胎移植到输卵管中
- 为了获得假怀孕小鼠,在发情期将每只雌性ICR小鼠与血管化的雄性ICR小鼠交配。第二天检查插头。
注意:从20对交配中获得大约15只假怀孕小鼠。 - 向假性妊娠雌性小鼠皮下施用三种类型的混合麻醉剂(0.2mg / kg美托咪定,4.0mg / kg咪达唑仑和2.5mg / kg布托酚,参见 材料表)。通过呼吸频率降低和尾部夹伤和后肢踏板撤回反射消失来确认适当的麻醉。按照当地动物伦理委员会的建议涂抹眼药膏润滑眼睛。
- 在剃刀剃须小鼠的背部区域处于俯卧位并对手术区域消毒三次后,在碘或氯己定磨砂膏和酒精之间交替,用小解剖剪刀沿脊柱切开背侧皮肤约1厘米。
- 将背侧切口伤口向腹侧一侧移动,切开可以看到卵巢的肌肉层,用镊子抓住卵巢上方的脂肪,然后取出卵巢、输卵管和子宫。
- 用细化夹固定脂肪(见 材料表)。将生殖组织放在无菌纱布上,以避免直接接触外套。
- 按以下顺序,将少量培养基(M2或M16),一些气泡作为标记,并将受精卵放入移液管中进行转移。
注意:每个输卵管转移大约 10-12 个受精卵。 - 使用微剪切(见 材料表)在壶腹和输卵管的螓毛之间做一个切口(刚好足够长以允许玻璃移液管进入),将受精卵引入切口,同时确认气泡已被引入。
- 以类似方式将植入到另一个输卵管中(步骤6.6)。
- 用自动夹缝合外皮(见 材料表)。
注意:不要缝合切开的肌肉层,除非切口伤口不可避免地很大。切开的肌肉层的理想尺寸应小于2-3毫米。如果切口大于5毫米,应使用无菌缝合针和线缝合肌肉层(见 材料表)。
7. 动物恢复
- 皮下给予小鼠盐酸阿替美唑(0.3mg / kg)。
注意:遵循当地动物伦理委员会关于术后镇痛的建议。 - 然后,将小鼠放在笼子中,并在37°C的热板上保温。
- 小鼠被唤醒后,保持它们温暖约2小时。确认小鼠没有异常行为后,将笼子放回繁殖架。
结果
使用该协议的基因盒敲入和絮状小鼠的产生结果如表 1 和 表2所示。没有说明目标基因,因为每个基因组编辑的小鼠系目前正在一个独立的,未发表的项目中使用。相反,描述了目标染色体区域。
使用先前报道的方法18进行基因分型分析。在这种基因分型方法中,将供体DNA插入意外染色体位点的小鼠不被视为阳性个体,即使诱导了所需的基因组编辑。因此,显示了真正对实际目的有用的创始小鼠的生产效率,而不是基因组编辑本身的效率。
13只独立基因盒敲入小鼠的中位生产效率为20.8%,最高为39.5%,最低为7.9%(表1)。这种效率被认为足够实用。在基因盒敲入期间,任何致命的胚胎基因都没有被靶向。在这种非致命基因靶向条件下,中位出生率为34.0%(最高43.3%,最低15.9%)。由于这与没有遗传操作的胚胎移植的出生率相当,我们认为引入的基因组编辑元件的毒性和受精卵显微注射的物理损伤不太可能影响胚胎发育。
10只独立絮凝小鼠的中位生产效率为7.7%,最高为20.7%,最低为2.1%(表2)。虽然几个靶基因的功能尚不清楚,但中位出生率为30.2%,最高为43.8%,最低为17.3%。该速率与基因盒敲入小鼠相当,表明显微注射操作对絮凝小鼠的胚胎发育的影响可以忽略不计。
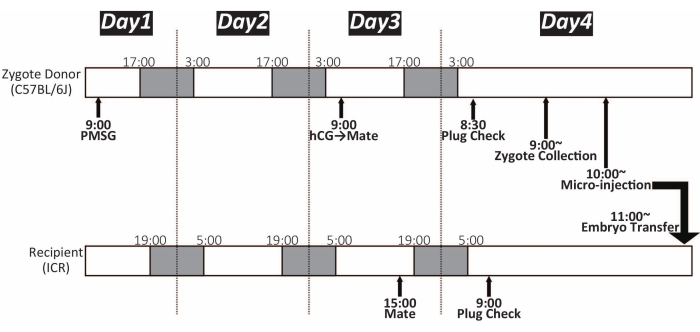
图1:受精卵显微注射的时间线。 白色和深色分别显示明暗循环。将小鼠维持在14小时光照/ 10小时黑暗循环下。PMSG:妊娠母马血清促性腺激素;hCG:人绒毛膜促性腺激素 请点击此处查看此图的大图。
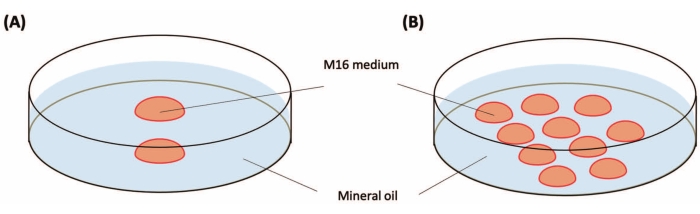
图2:培养皿的制备 。 (A)注射前用于受精卵的培养皿。将两滴 M16 培养基(每滴 20-25 μL)放入 35 mm 塑料培养皿中。(B)注射后用于受精卵的培养皿。将 10 滴(每滴 10-20 μL)M16 放入 35 mm 塑料培养皿中。滴剂用矿物油(3毫升)覆盖。 请点击此处查看此图的大图。
| 靶向染色体区域 | 数量 | 敲入插入长度 (kb) | 同源臂长 (kb) | ||||||
| 胚胎 | 新生儿 | 检查(断奶) | 敲入式无 rTG | rTGc | |||||
| 注入 | 转移 | 5' 臂 | 3' 臂 | ||||||
| 2qE2 | 349 | 331 | 114 (34.4%)a | 114 | 9 (7.9%)b | 5 (4.4%)d | 1.0 | 1.0 | 1.0 |
| 2qE2 | 231 | 215 | 78 (36.3%)a | 74 | 15 (20.3%)b | 23 (31.1%)d | 2.2 | 1.0 | 1.1 |
| 5qG2 | 288 | 262 | 90 (34.4%)a | 81 | 19 (23.5%)b | 18 (22.2%)d | 1.6 | 2.0 | 2.0 |
| 6qB1 | 278 | 259 | 58 (22.4%)a | 46 | 11 (23.9%)b | 11 (23.9%)d | 4.2 | 1.2 | 1.0 |
| 6qE3 [ROSA26] | 295 | 277 | 97 (35.0%)a | 23 | 2 (8.7%)b | 4 (17.4%)d | 6.5 | 1.1 | 3.0 |
| 6qE3 [ROSA26] | 246 | 219 | 87 (39.7%)a | 83 | 22 (26.5%)b | 18 (21.7%)d | 5.8 | 1.1 | 3.0 |
| 7qF5 | 279 | 268 | 116 (43.3%)a | 114 | 45 (39.5%)b | 44 (38.6%)d | 1.4 | 3.1 | 1.0 |
| 11qB4 | 405 | 353 | 56 (15.9%)a | 47 | 8 (17.0%)b | 12 (25.5%)d | 1.7 | 1.0 | 0.8 |
| 11qD | 310 | 294 | 100 (34.4%)a | 98 | 15 (15.3%)b | 76 (77.6%)d | 1.0 | 1.8 | 2.4 |
| 12qE | 368 | 320 | 86 (26.9%)a | 84 | 12 (14.3%)b | 19 (22.6%)d | 3.4 | 1.1 | 1.3 |
| 12qF1 | 315 | 265 | 76 (28.7%)a | 72 | 17 (23.6%)b | 28 (38.9%)d | 1.0 | 1.1 | 1.1 |
| 14qE5 | 256 | 215 | 48 (22.3%)a | 48 | 11 (22.9%)b | 21 (43.8%)d | 3.1 | 1.0 | 0.9 |
| 14qE5 | 287 | 285 | 85 (29.8%)a | 72 | 15 (20.8%)b | 19 (26.4%)d | 2.6 | 1.0 | 0.9 |
表1:通过显微注射产生敲入小鼠。 该表显示了在没有供体DNA的(W / O)随机整合(rTG)的情况下携带预期敲入等位基因的小鼠的出生率和效率。在所有项目中都可以获得具有预期敲入等位基因的小鼠。a:新生儿数量/移植胚胎数量;b:携带敲入等位基因的小鼠数量/检查小鼠的数量;C:不确定是否存在预期的等位基因;d:携带rTG等位基因的小鼠数量/检查小鼠的数量;rTG:供体载体的随机积分。W/O:没有。
| 靶向染色体区域 | 数量 | 絮凝长度 (KB) | 同源臂长 (kb) | |||||
| 胚胎 | 新生儿 | 检查(断奶) | 絮凝 W/O rTG | |||||
| 注入 | 转移 | 5' 臂 | 3' 臂 | |||||
| 3qC | 325 | 313 | 93 (29.7%)a | 87 | 9 (10.3%)b | 1.3 | 1.2 | 1.1 |
| 4qB1 | 210 | 200 | 36 (18.0%)a | 29 | 6 (20.7%)b | 1.6 | 1.2 | 0.9 |
| 4qC4 | 272 | 256 | 112 (43.8%)a | 100 | 5 (5.0%)b | 2.4 | 1.0 | 1.4 |
| 5qF | 143 | 137 | 40 (29.2%)a | 40 | 6 (15.0%)b | 1.8 | 1.0 | 1.1 |
| 5qF | 255 | 227 | 80 (35.2%)a | 76 | 2 (2.6%)b | 1.3 | 1.1 | 0.9 |
| 9qE3.1 | 289 | 261 | 80 (30.7%)a | 77 | 9 (11.7%)b | 1.2 | 1.2 | 1.2 |
| 10qB3 | 284 | 269 | 88 (32.7%)a | 78 | 3 (3.8%)b | 1.3 | 1.1 | 0.9 |
| 10qC1 | 243 | 231 | 40 (17.3%)a | 38 | 4 (10.5%)b | 2.1 | 1.0 | 1.3 |
| 14qE5 | 390 | 372 | 139 (37.4%)a | 135 | 5 (3.7%)b | 1.1 | 0.8 | 0.9 |
| 17qA3.3 | 383 | 374 | 99 (26.5%)a | 95 | 2 (2.1%)b | 2.1 | 0.6 | 0.8 |
表2:通过微注射产生絮状小鼠。 该表显示了在没有供体DNA的(W / O)随机整合(rTG)的情况下携带预期絮状等位基因的小鼠的出生率和效率。在所有项目中都可以获得具有预期絮凝等位基因的小鼠。a:新生儿数量/移植胚胎数量;B:携带的Flox等位基因小鼠数量/检查小鼠数量。rTG:随机积分或供体载体;W/O:没有。
讨论
在本研究中,从自然交配中获得的新鲜(未冻融)C57BL / 6J小鼠受精卵用于基因组编辑小鼠生产。通过在最有可能发生敲入的细胞周期阶段将crRNA-tracrRNA-Cas9和供体DNA(RNPD)注射到这些受精卵的两个原核中,产生了具有高出生率和足够的基因组编辑效率的基因盒敲入和絮状小鼠。目前的研究加强了SPRINT-CRISPR方法15的可扩展性,即使在C57BL / 6J遗传背景中,它也确保了足够的敲入效率,并且可以应用于絮状小鼠的生产。
电穿孔是一种高度通用的产生基因组编辑小鼠的方法,因为实验装置成本低且易于学习该技术8。此外,i-GONAD方法19不需要受体小鼠,其中基因组编辑是用输卵管中存在的植入前胚胎完成的。与这些方法相比,本文介绍的方法在硬件和软件方面准备和维护实验环境时既昂贵又耗时。然而,一旦实验设施建立起来,就可以仅使用市售的CRISPR元件(crRNA,tracrRNA和Cas9蛋白)和简单的少量环状质粒载体作为供体DNA生产复杂的基因盒敲入和絮凝小鼠。这意味着可以生产许多复杂的基因组编辑小鼠系,而无需耗时(或相对昂贵)的lsODN5,6 或腺相关病毒载体20 来制备。
与最初的SPRINT-CRISPR方法15不同,使用新鲜(冷冻解冻)受精卵。当通过自然交配获得新鲜受精卵时,可以忽略体 外 受精或冻融过程中可能发生的技术错误。此外,按照目前的方法,胚胎操作过程可以在大约半天内完成(图1)。另一方面,本方法的一些局限性包括需要许多雄性小鼠,对受精时间的控制松散,以及完全预测显微注射受精卵数量的能力有限。与原始的SPRINT-CRISPR方法相比,该方法可能具有更高的出生率(表1)。尽管如此,由于实验导体、靶基因、遗传背景和胚胎确认时间的差异,不能得出本方法在出生率方面更好的结论。
如 表1所示,大多数基因盒敲入项目中的大量小鼠具有随机整合等位基因。必须消除随机整合,因为它可能导致内源性基因的意外破坏和转基因的异位表达。未来的挑战是找到实验条件,以减少随机积分事件的数量,同时保持足够的敲入效率。
几乎所有使用基因组编辑效应子进行导致DNA双链断裂的小鼠受精卵基因组编辑都可能在靶位点诱导意外突变9,21。这里不描述这些意外的靶向突变的结果,因为我们没有处于可以管理下一代小鼠以提供明确证据的情况。排除由意外靶向诱变引起的混淆的担忧的最佳方法是通过将创始人与野生型小鼠交配而不是杂交创始人来获得下一代小鼠。原则上,由这种杂交产生的N1小鼠在等位基因的一侧是野生型(WT),因此如果检测到预期的敲入(KI)等位基因,它们是WT / KI杂合子。因此,靶向诱变在实验室小鼠中并不是一个关键问题,实验室小鼠的生命周期相对较快,是一种多产的动物。然而,当这项技术应用于相对较大的哺乳动物时,将需要进一步的改进。
已经证实,该技术可以在C57BL/6J以外的近交系中生产基因盒敲入小鼠,但项目数量不足,数据变化很大。因此,本研究报告不包括这一信息。据信,有必要对这一主题进行进一步研究,以推进小鼠遗传学和疾病模型研究。
披露声明
提交人宣布没有相互竞争的利益。
致谢
这项工作得到了文部科学省科学研究(B)(19H03142:至SM)、科学研究(A)(20H00444:至FS)、科学研究(A)(21H04838:至SM)和创新领域科学研究"先进动物模型支持平台"(16H06276:至ST)的支持。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。我们感谢Ryoichi Mori关于基因组编辑设计的有益讨论。
材料
| Name | Company | Catalog Number | Comments |
| Atipamezole Hydrochloride | ZENOAQ | - | |
| Autoclip Wound Clip | BD | 427631 | |
| Autoclip Wound Clip Applier | BD | 427630 | |
| Butorphanol | Meiji Seika Pharma | - | |
| C57BL/6J mice | Jackson Laboratory Japan | - | older than 10 weeks old |
| Calibrated Pipet, 100ul | Drummond Scientific Company | 2-000-100 | for collecting zygote and embryo transfer |
| Cas9 | Thermo Fisher Scientific | A36499 | |
| Cas9 Nuclease Reaction Buffer | NEB | B7203 | |
| CellTram 4r oil | Eppendorf | 5196000030 | |
| CRISPOR | http://crispor.tefor.net/ | web tool for genome editing experiments with the CRISPR-Cas9 system | |
| crRNA | IDT | - | |
| Gel/PCR Extraction Kit | FastGene | FG-91302 | |
| hCG | ASKA Animal Health | - | |
| Hyaluronidase | Merck Sigma-Aldrich | H3884 | |
| ICR mice | Jackson Laboratory Japan | - | older than 10 weeks old, weight 28 G or more |
| Inverted microscope | Leica | ||
| KOnezumi | https://www.md.tsukuba.ac.jp/LabAnimalResCNT/KOanimals/konezumi.html | a web application for automating gene disruption strategies to generate knockout mice | |
| M16 medium | Merck Sigma-Aldrich | M7292 | |
| M2 medium | Merck Sigma-Aldrich | M7167 | |
| Medetomidine | ZENOAQ | - | |
| Micro shears | Natsume Seisakusho | MB-54-1 | |
| Microforge | Narishige | MF-900 | for fire polishing of holding pipette and bending the microinjection needle |
| Micromanipulator units | Narishige | ||
| Micropipette puller | Sutter Instrument | P-1000 | programmable pipette puller |
| Midazolam | Maruishi Pharmaceutical | - | |
| MILLEX-GV 0.22 µm filter | Merck Millipore | SLGV033R | |
| Mineral oil | Nacalai | 26114-75 | for zygote culture and injection chamber |
| Petri dish (35mm, untreated) | Iwaki | 1000-035 | for zygote culture |
| PIEZO micromanipulator | PRIME TECH | PMM-150 | |
| Plasmid Mini Kit | FastGene | FG-90502 | mini prep spin column kit |
| PMM Operation Liquid | PRIME TECH | KIT-A | operation liquid for microinjection |
| PMSG | ASKA Animal Health | - | |
| Polyvinylpyrrolidone | Merck Sigma-Aldrich | P5288 | |
| RNase | QIAGEN | 19101 | |
| RNase Free Water | IDT | - | tracrRNA Accessory Reagents |
| Serrefine clamp | Natsume Seisakusho | C-18 | |
| Sodium dodecyl sulfate | SIGMA | 151-21-3 | |
| Suture needle with thread | Natsume Seisakusho | C11-60B2 | |
| Thin wall borosilicate glass without filament | Sutter Instrument | B100-75-10 | for microinjection needle and holding pipette |
| tracrRNA | IDT | - |
参考文献
- Suzuki, H., et al. Generation of bicistronic reporter knockin mice for visualizing germ layers. Experimental Animals. 68 (4), 499-509 (2019).
- Le, H. T., et al. Generation of B6-Ddx4(em1(CreERT2)Utr) , a novel CreERT2 knock-in line, for germ cell lineage by CRISPR/Cas9. Genesis. 58 (7), 23367 (2020).
- Osawa, Y., et al. EXOC1 plays an integral role in spermatogonia pseudopod elongation and spermatocyte stable syncytium formation in mice. Elife. 10, 59759 (2021).
- Funato, H., et al. Forward-genetics analysis of sleep in randomly mutagenized mice. Nature. 539 (7629), 378-383 (2016).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nature Communications. 7, 10431 (2016).
- Miura, H., Gurumurthy, C. B., Sato, T., Sato, M., Ohtsuka, M. CRISPR/Cas9-based generation of knockdown mice by intronic insertion of artificial microRNA using longer single-stranded DNA. Scientific Reports. 5, 12799 (2015).
- Murata, K., et al. Efficient induction of proximity-dependent labelling by biotin feeding in BMAL1-BioID knock-in mice. The Journal of Biochemistry. 170 (4), 453-461 (2021).
- Kaneko, T., Mashimo, T. Simple genome editing of rodent intact embryos by electroporation. PLoS One. 10 (11), 0142755 (2015).
- Kuno, A., et al. DAJIN enables multiplex genotyping to simultaneously validate intended and unintended target genome editing outcomes. PLOS Biology. 20 (1), 3001507 (2022).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318 (2018).
- Gurumurthy, C. B., et al. Reproducibility of CRISPR-Cas9 methods for generation of conditional mouse alleles: a multi-center evaluation. Genome Biology. 20 (1), 171 (2019).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Hasegawa, Y., et al. Generation of CRISPR/Cas9-mediated bicistronic knock-in ins1-cre driver mice. Experimental Animals. 65 (3), 319-327 (2016).
- Aida, T., et al. Cloning-free CRISPR/Cas system facilitates functional cassette knock-in in mice. Genome Biology. 16, 87 (2015).
- Abe, T., Inoue, K. I., Furuta, Y., Kiyonari, H. Pronuclear Microinjection during S-phase increases the efficiency of CRISPR-Cas9-assisted knockin of large DNA donors in mouse zygotes. Cell Reports. 31 (7), 107653 (2020).
- Lilue, J., et al. Sixteen diverse laboratory mouse reference genomes define strain-specific haplotypes and novel functional loci. Nature Genetics. 50 (11), 1574-1583 (2018).
- Birling, M. C., et al. A resource of targeted mutant mouse lines for 5,061 genes. Nature Genetics. 53 (4), 416-419 (2021).
- Mizuno-Iijima, S., et al. Efficient production of large deletion and gene fragment knock-in mice mediated by genome editing with Cas9-mouse Cdt1 in mouse zygotes. Methods. 191, 23-31 (2021).
- Ohtsuka, M., et al. i-GONAD: a robust method for in situ germline genome engineering using CRISPR nucleases. Genome Biology. 19 (1), 25 (2018).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/Cas9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Burgio, G., Teboul, L. Anticipating and identifying collateral damage in genome editing. Trends in Genetics. 36 (12), 905-914 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。