Method Article
Микроинъекция зиготы для создания генных кассетных нокаутных и флоксовых аллелей у мышей
* Эти авторы внесли равный вклад
В этой статье
Резюме
Настоящий протокол описывает микроинъекцию зиготы CRISPR-Cas9 и донорской ДНК для эффективного получения генных кассетных и флоксированных мышей.
Аннотация
Технология CRISPR-Cas позволила быстро и без усилий создать генетически модифицированных мышей. В частности, мыши и точечные мутантные мыши легко продуцируются путем электропорации факторов CRISPR (и одноцепочечных доноров олиго-ДНК) в зиготу. Напротив, генная кассета (>1 кб) нокаутированных и флоксированных мышей в основном генерируется путем микроинъекции факторов CRISPR и двухцепочечных доноров ДНК в зиготы. Технологии редактирования генома также повысили гибкость производства генетически модифицированных мышей. В настоящее время можно ввести предполагаемые мутации в целевые области генома в ряде полезных инбредных линий мышей. Наша команда произвела более 200 линий мышей с нокаутом с генными кассетами и более 110 линий мышей с флоксированием с помощью микроинъекции зиготы CRISPR-Cas9 по запросам из нескольких стран, включая Японию. В некоторых из этих методов редактирования генома использовались инбредные штаммы BALB/c, C3H/HeJ и C57BL/6N, однако в большинстве случаев использовался C57BL/6J. В отличие от метода электропорации, редактирование генома методом микроинъекции зиготы в различных инбредных штаммах мышей не так просто. Тем не менее, нокаутированные и флоксированные мыши на одном инбредном генетическом фоне так же важны, как и генетические гуманизированные, флуоресцентные репортерные и условно-нокаутные модели мышей. Таким образом, в данной статье представлен протокол микроинъекции зиготы CRISPR-факторов и двухцепочечных доноров ДНК у мышей C57BL/6J для генерации генных кассетных и флоксированных мышей. Эта статья посвящена исключительно ядерной инъекции, а не цитоплазматической инъекции. В дополнение к микроинъекции зиготы мы намечаем график производственного процесса и периферических методов, таких как индукция суперовуляции и перенос эмбрионов.
Введение
Нокаутированные мыши, у которых предполагаемые экзогенные гены введены в целевые локусы, широко используются во многих исследованиях in vivo в качестве мышей с гуманизированным геном, флуоресцентных репортерных мышей и мышей-драйверов Cre 1,2. Когда нокаутные мутации индуцируются редактированием генома в зиготах мышей, в качестве донорской ДНКиспользуется одноцепочечная ДНК (одноцепочечные доноры олигоДНК, ssODN) или двухцепочечная ДНК (дцДНК 2,3). ssODN в основном используется для выбивания относительно коротких фрагментов генов менее 200.н. 4. С помощью длинных ssODN (lsODN)5,6 можно вбивать фрагменты ДНК длиннее 1 кб, однако их подготовка занимает много времени. При использовании доноров дцДНК можно получить генную кассету (>1 кб) мышей с нокаутом без трудоемкой подготовки донорской ДНК7.
Основное преимущество использования ssODN заключается в том, что электропорация8 может генерировать мышей с нокаутом. Однако доноры дцДНК должны быть введены непосредственно в ядро путем микроинъекции зиготы. Одновременный нокаут на двух участках требуется для создания флоксированных мышей, у которых каждая последовательность loxP выбивается вверх и вниз по течению от гена-мишени. Существует два способа получения флоксированных мышей путем редактирования генома в зиготах мышей: с использованием двух независимых ssODN, каждый из которых несет один сайт loxP, или с использованием одной дцДНК (или лсДНК) с флоксированной последовательностью; Первый очень неэффективен 9,10,11. Редактирование генома с использованием доноров дцДНК является простейшим подходом к получению генных кассетных и флоксированных мышей, если окружающая среда благоприятствует микроинъекции зиготы.
Первоначально смеси мРНК Cas9 и sgRNA или векторы ДНК, кодирующие sgRNA и Cas9, используются для редактирования генома в зиготахмышей 12,13. Поскольку высококачественные и стабильные белки Cas9 теперь доступны по низкой цене, введение рибонуклеопротеина (РНП) крРНК-тракрРНК-Cas9 в зиготымыши 14 стало популярным. В последнее время нок-ин-мыши были получены с высокой эффективностью путем введения крРНК-тракрРНК-Cas9 РНП и донорской ДНК в оба пронуклеуса зигот мышей в фазе клеточного цикла, где наиболее вероятно произойдет нокаутирование15. Таким образом, в настоящем протоколе описываются способы получения различных типов мышей с нокаутом с помощью этого способа.
Существует много полезных инбредных линий лабораторных мышей16. Генетическая модификация в рамках инбредного фона может игнорировать влияние генетического фона на фенотип. В данной статье описывается метод индуцирования нокаутных и флоксированных мутаций в зиготе наиболее часто используемой инбредной линии мышей C57BL/6J17. Кроме того, также обсуждаются сроки создания генетически модифицированных мышей и используемые периферические методы, включая индукцию суперовуляции и перенос эмбрионов.
протокол
Все эксперименты на животных проводились гуманно с одобрения Институционального комитета по экспериментам на животных Университета Цукуба в соответствии с Правилами проведения экспериментов на животных Университета Цукуба и Основными руководящими принципами надлежащего проведения экспериментов на животных и связанной с ними деятельности в академических научно-исследовательских учреждениях, находящихся под юрисдикцией Министерства образования. Культура, спорт, наука и технологии Японии. В качестве донора зиготы использовали мышей C57BL/6J обоего пола в возрасте от 10 до 25 недель. В качестве мышей-реципиентов использовались мыши ICR (старше 10 недель). Мыши были получены из коммерческих источников (см. Таблицу материалов).
1. Подтверждение активности расщепления крРНК в бесклеточной системе
- Растворяют 2 нмоль крРНК (сухая) и 20 нмоль тракрРНК (сухая) в 25 мкл и 250 мкл воды, не содержащей РНКазы, соответственно (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Целевые последовательности CRISPR, которые, как прогнозировалось, будут иметь высокую активность расщепления и как можно меньше нецелевых объектов, отбираются с помощью CRISPOR (см. Таблицу материалов). В случае нокаута генной кассеты нацельтесь на последовательность через сайт вставки. Экзоны (экзоны), подлежащие флоксированию, были выбраны с помощью KOnezumi (см. Таблицу материалов). - Амплифицировать фрагмент ДНК (примерно 0,5-1 кб), содержащий сайт-мишень, методом геномной ПЦР9. Очистите этот ампликон ПЦР с помощью обычного набора для экстракции продукта ПЦР (см. Таблицу материалов).
- Приготовьте 10 мкл смеси CRISPR (100 нг/мкл крРНК, 150 нг/мкл тракрРНК и 1 нг/мкл Cas9 в реакционном буфере нуклеазы Cas9, см. Таблицу материалов). Чтобы построить комплекс CRISPR-Cas9, поместите смесь CRISPR в тепловой блок при температуре 37 °C на 30 минут.
- Добавьте общий объем (10 мкл) смеси CRISPR к продукту ПЦР (10 мкл, 20 нг/мкл), описанному на этапе 1.2, и инкубируйте при 37 °C в течение 1 часа. Добавьте 1 мкл РНКазы (500 нг / мкл) для разложения крРНК и тракрРНК при 37 ° C в течение 30 мин, так как РНК должны отсутствовать во время электрофореза. Электрофорез вышеуказанных образцов проводят с использованием загрузочного красителя, содержащего додецилсульфат натрия (2% мас./об.).
ПРИМЕЧАНИЕ: В редких случаях наблюдаются крРНК без активности расщепления. В таких случаях рекомендуется перепроектировать дизайн редактирования генома.
2. Приготовление смеси крРНК, тракрРНК, белка Cas9 и донорской ДНК для микроинъекции зиготы
- Приготовьте раствор CRISPR (50 нг/мкл крРНК, 200 нг/мкл тракрРНК и 200 нг/мкл Cas9 в воде, не содержащей РНКазы). Приготовьте раствор донорской ДНК (20 нг/мкл самосконструированного вектора плазмидной ДНК).
- Раствор донорской ДНК фильтруют через стерильный шприцевой фильтр с размером пор 0,22 мкм. Смешайте равные объемы раствора CRISPR и отфильтрованного раствора донорской ДНК. Убедитесь, что конечная концентрация каждого из них составляет 25 нг/мкл крРНК, 100 нг/мкл тракрРНК, 100 нг/мкл Cas9 и 10 нг/мкл донорской ДНК. В дальнейшем эта смесь будет называться RNPD.
ПРИМЕЧАНИЕ: При разрезании двух участков, например, во время производства флоксированных мышей, концентрация каждой цРНК должна составлять 25 нг / мкл. Донорская ДНК представляет собой кольцевую плазмидную ДНК и может быть очищена с помощью обычного набора мини-подготовительных спиновых колонок (см. Таблицу материалов). Приготовленный раствор необходимо поместить на лед и как можно скорее использовать для микроинъекций.
- Раствор донорской ДНК фильтруют через стерильный шприцевой фильтр с размером пор 0,22 мкм. Смешайте равные объемы раствора CRISPR и отфильтрованного раствора донорской ДНК. Убедитесь, что конечная концентрация каждого из них составляет 25 нг/мкл крРНК, 100 нг/мкл тракрРНК, 100 нг/мкл Cas9 и 10 нг/мкл донорской ДНК. В дальнейшем эта смесь будет называться RNPD.
3. Получение зигот мышей путем естественного спаривания
- За 3 дня до микроинъекции подкожно вводят 5 МЕ гонадотропина сыворотки крови беременной кобылы (ПМСГ, см. Таблицу материалов) самкам мышей C57BL / 6J (10-25 недель). Примерно через 46-48 ч вводят 5 МЕ хорионического гонадотропина человека (ХГЧ, см. Таблицу материалов) внутрибрюшинно. Совместно разместите самок мышей, обработанных PMSG и ХГЧ, с самцами мышей C57BL / 6J и проверьте вагинальные пробки на следующее утро.
ПРИМЕЧАНИЕ: Приблизительно 15-25 зигот могут быть получены от одной самки мыши C57BL / 6J. Временная шкала показана на рисунке 1. - Подготовьте две чашки Петри диаметром 35 мм для культивирования зиготы, как показано на рисунке 2. Поместите их в инкубатор (37 °C, 5% CO2) до использования. Их можно хранить в течение ночи.
- Усыпьте самок мышей с подтвержденными вагинальными пробками путем вывиха шейки матки и, используя маленькие ножницы, надрежьте кожу живота и мышечный слой от средней линии нижней части живота до ребер.
ПРИМЕЧАНИЕ: Следуйте рекомендациям местного комитета по этике животных в отношении эвтаназии. - Соберите яйцеводы и поместите их в 20 мкл капли среды М2, содержащей 0,75 мг/мл гиалуронидазы (см. Таблицу материалов) на крышке чашки Петри. Возьмите один яйцевод щипцами с тонким наконечником и перфузируйте около 50 мкл среды М2 с гиалуронидазой через фимбрии.
ПРИМЕЧАНИЕ: В это время зиготы слабо окружены многочисленными кучевыми клетками. - Через 30 с с помощью стеклянного капилляра подбирают морфологически нормальные зиготы с небольшим количеством среды и моют их, перенося на свежие капли среды М16. Переложите промытые зиготы в чашку Петри (рис. 2) для объединения.
ПРИМЕЧАНИЕ: Временная шкала показана на рисунке 1. Морфологически нормальные зиготы имеют мужской и женский пронуклеус и два полярных тельца, которые не сильно нарушили сферическую форму15. Морфология зиготы значительно различается между штаммами и видами. - Повторяйте шаги 3.3 и 3.4 до тех пор, пока не будут извлечены все зиготы. Около 100 зигот могут быть объединены в одну каплю M16 в чашке культуры. Храните блюдо в инкубаторе (37 °C, 5% CO2) до микроинъекции.
4. Подготовка иглы для микроинъекций
- Вытащите несколько стеклянных пипеток с помощью программируемого съемника пипеток (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Иглы для микроинъекций должны иметь тонкий наконечник и длинную конусность. Если у съемника есть программа для изготовления игл для интрацитоплазматической инъекции сперматозоида, эта же программа может быть использована для изготовления игл для микроинъекций. - Сломайте кончик иглы для микроинъекций, ударив по стеклянному шарику, прикрепленному к наконечнику микрокузницы. Убедитесь, что размер наконечника иглы для микроинъекций составляет около 1 мкм в диаметре. Проверьте размер наконечника под микроскопом при 1000-кратном увеличении.
- Согните иглу для микроинъекций примерно на 2-3 мм от наконечника с помощью микрокузницы.
ПРИМЕЧАНИЕ: Угол изгиба зависит от настройки микроманипулятора. Слишком сильный изгиб снизит эффективность пьезоимпульса.
5. Микроинъекция зиготы
- Введите 1-1,5 см рабочей жидкости (инерционного тела, необходимого для пьезоэффекта для проделывания отверстий в качестве альтернативы ртути, см. Таблицу материалов) в центр иглы для микроинъекций и прикрепите ее к держателю ручного микроинжектора с помощью пьезопривода.
- Далее прикрепите удерживающую иглу к противоположному ручному держателю микроинжектора. Переместите операционную жидкость на кончик иглы для микроинъекций с постепенным нажимом. Закрепите оба ручных держателя микроинжекторов на микроманипуляторе.
ПРИМЕЧАНИЕ: Рабочую жидкость, выходящую из кончика иглы для микроинъекций, можно наблюдать под микроскопом при 50-кратном увеличении. После регулировки количества испускаемой жидкости при применении пьезоимпульсов можно наблюдать разбрызгивание жидкости, подтверждая, что пьезоимпульсы эффективны. Если это не может быть подтверждено, повторно подготовьте иглу для микроинъекций.
- Далее прикрепите удерживающую иглу к противоположному ручному держателю микроинжектора. Переместите операционную жидкость на кончик иглы для микроинъекций с постепенным нажимом. Закрепите оба ручных держателя микроинжекторов на микроманипуляторе.
- Подготовьте инъекционную камеру с тремя каплями: (1) 10 мкл среды М2; (2) 5 мкл 12% поливинилпирролидона (ПВП) в среде М2; и (3) смесь 5 мкл крРНК, тракрРНК, белка Cas9 и раствора донорской ДНК (РНПД). Покройте капли минеральным маслом так же, как на шаге 3.2, и установите камеру впрыска на перевернутый столик микроскопа.
- Под перевернутым микроскопом при 50-кратном увеличении опустите пипетку для микроинъекций в 12% каплю PVP. Аспирируйте и распределите 12% PVP, чтобы очистить внутреннюю часть кончика иглы для микроинъекций и перенести ее в каплю RNPD.
- Поместите ручной микроинжектор под отрицательное давление и всосите раствор RNPD в иглу для микроинъекций. Подождите несколько минут, пока не будет аспирирован достаточный объем; Под микроскопом, увеличенным в 50 раз, заполните жидкостью всю внутреннюю часть иглы для микроинъекций.
- Прекратите впуск и дайте раствору RNPD постепенно вытесняться, установив ручной микроинжектор на положительное давление. Переместите кончик иглы для микроинъекций в масло.
ПРИМЕЧАНИЕ: Поверните ручку ручного микроинжектора против часовой стрелки для вдоха. Чтобы остановить вдох, поверните ручку по часовой стрелке и постепенно увеличивайте давление, наблюдая под микроскопом. Раствор RNPD будет постепенно сливаться. Движение уровня жидкости в игле для микроинъекций позволяет подтвердить отток.
- Прекратите впуск и дайте раствору RNPD постепенно вытесняться, установив ручной микроинжектор на положительное давление. Переместите кончик иглы для микроинъекций в масло.
- Поместите 50 зигот в каплю M2 и осторожно опустите удерживающую пипетку в ту же каплю. Перенесите иглу для микроинъекций в каплю М2, содержащую зиготы. Переключитесь на 20-кратный объектив и сфокусируйтесь на кончике пипетки для микроинъекций.
ПРИМЕЧАНИЕ: Поместите столько зигот, сколько можно ввести за 10 минут. - Удерживайте зиготу и сосредоточьтесь на пронуклеусе, перемещая микроманипулятор. Вставьте иглу для микроинъекций в зиготу и поднесите кончик близко к пронуклеусу. Как только наконечник достигнет пронуклеусной мембраны, примените пьезоимпульс (интенсивность: 6-10, скорость: 1) для прокалывания.
- Когда игла микроинъекции прокалывает пронуклеус, вводят раствор РНПД и наблюдают за набуханием пронуклеуса. Как только пронуклеус полностью надуется, быстро вытащите иглу. Проделайте одну и ту же процедуру как на женском, так и на мужском пронуклеусе.
ПРИМЕЧАНИЕ: Надувание пронуклеуса путем инъекции хорошо видно под микроскопом. Степень этой инфляции трудно описать словами, но ее можно подтвердить, обратившись к предыдущим докладам15.
- Когда игла микроинъекции прокалывает пронуклеус, вводят раствор РНПД и наблюдают за набуханием пронуклеуса. Как только пронуклеус полностью надуется, быстро вытащите иглу. Проделайте одну и ту же процедуру как на женском, так и на мужском пронуклеусе.
- Переместите введенную зиготу в другое место в капле M2, чтобы идентифицировать зиготы до и после инъекции.
- Повторяйте шаги 5.5-5.6 до тех пор, пока не будут введены все зиготы в капле M2. После инъекции перенесите зиготы в свежую чашку М16.
- Выделите выжившие зиготы через 10 мин после инъекции. Удалите лизированные зиготы, которые повреждены инъекцией, и распределите выжившие зиготы по каждой капле в чашке M16. Каждая капля должна содержать 20-24 зиготы на одну псевдобеременную самку. Это сокращает время, в течение которого чашка M16 подвергается воздействию окружающей среды вне инкубатора во время переноса эмбрионов.
ПРИМЕЧАНИЕ: При оптимальных условиях инъекции выживаемость составляет 90-95%. Это зависит от размера кончика иглы, силы пьезоимпульса и давления истечения раствора РНПД.
6. Перенос эмбрионов в яйцевод
- Для получения псевдобеременных мышей спаривайте каждую самку мыши ICR в фазе проэструса с вазолигированным самцом мыши ICR. Проверьте вилки на следующий день.
ПРИМЕЧАНИЕ: Примерно 15 псевдобеременных мышей получают из 20 спаривающихся пар. - Вводят три типа смешанных анестетиков (0,2 мг / кг медетомидина, 4,0 мг / кг мидазолама и 2,5 мг / кг буторфанола, см. Таблицу материалов) подкожно псевдобеременным самкам мышей. Подтверждают соответствующую анестезию снижением частоты дыхания и исчезновением рефлексов защемления хвоста и отвода педали задних конечностей. Нанесите офтальмологическую мазь для смазывания глаз в соответствии с рекомендациями местного комитета по этике животных.
- После бритья бритвой спинной области мыши в положении лежа и трижды продезинфицируя операционную область, чередуя скраб на основе йода или хлоргексидина и спирт, надрежьте спинную кожу примерно на 1 см вдоль позвоночника маленькими рассекающими ножницами.
- Сдвиньте рану дорсального разреза в одну сторону вентрально, надрежьте мышечный слой, через который виден яичник, захватите пинцетом жир над яичником и извлеките яичник, яйцевод и матку.
- Закрепите жир зазубренным зажимом (см. Таблицу материалов). Положите репродуктивные ткани на стерильную марлю, чтобы избежать прямого контакта с шерстью.
- В следующем порядке поместите небольшое количество питательной среды (М2 или М16), несколько пузырьков воздуха в качестве маркера и зиготы в пипетку для переноса.
ПРИМЕЧАНИЕ: Переносите примерно 10-12 зигот на яйцевод. - Сделайте надрез с помощью микросдвига (см. Таблицу материалов) между ампулой и фимбриями яйцевода (достаточно длинный, чтобы стеклянная пипетка могла войти), введите зиготы в разрез и одновременно подтвердите, что пузырь воздуха был введен.
- Аналогичным образом выполните имплантацию в другой яйцевод (шаг 6.6).
- Зашить наружную обшивку автоклипсами (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Не накладывайте швы на разрез мышечного слоя, если рана от разреза не неизбежно велика. Идеальный размер разрезаемого мышечного слоя должен быть менее 2-3 мм. Если разрез превышает 5 мм, мышечный слой следует ушивать стерилизованными шовными иглами и ниткой (см. Таблицу материалов).
7. Восстановление животных
- Вводят атипамезола гидрохлорид (0,3 мг / кг) подкожно мышам.
ПРИМЕЧАНИЕ: Следуйте рекомендациям местного комитета по этике животных в отношении послеоперационной анальгезии. - Затем поместите мышей в клетки и держите их в тепле на горячей плите при температуре 37 ° C.
- После того, как мыши проснутся, держите их в тепле около 2 часов. Убедившись, что мышей нет аномального поведения, верните клетки на стойку для разведения.
Результаты
Результаты производства мышей с нокаутом генов и флоксированных мышей, использующих этот протокол, показаны в таблицах 1 и 2. Гены-мишени не были указаны, потому что каждая линия мышей с отредактированным геномом в настоящее время используется в независимом, неопубликованном проекте. Вместо этого были описаны целевые хромосомные области.
Анализ генотипирования проводился с использованием ранее описанного метода18. В этом методе генотипирования мыши, у которых донорская ДНК вставлена в непреднамеренные хромосомные участки, не считаются положительными людьми, даже если индуцируется желаемое редактирование генома. Таким образом, была показана эффективность производства мышей-основателей, которые действительно полезны для реальных целей, а не эффективность самого редактирования генома.
Медиана продуктивной эффективности 13 независимых мышей с нокаутом генов составила 20,8%, с максимумом 39,5% и минимумом 7,9% (таблица 1). Эта эффективность была сочтена достаточно практичной. Какие-либо летальные эмбриональные гены не были нацелены во время нокаутирования генной кассеты. Медианный коэффициент рождаемости при этом нелетальном нацеливании на гены составил 34,0% (максимум 43,3% и минимум 15,9%). Поскольку это сопоставимо с рождаемостью при переносе эмбрионов без генетических манипуляций, мы посчитали, что токсичность введенных элементов редактирования генома и физическое повреждение микроинъекции зиготы вряд ли повлияют на эмбриональное развитие.
Медианная эффективность производства 10 независимых флоксированных мышей составила 7,7%, с максимумом 20,7% и минимумом 2,1% (таблица 2). Хотя функции нескольких генов-мишеней были неизвестны, медианный коэффициент рождаемости составил 30,2%, с максимумом 43,8% и минимумом 17,3%. Этот показатель был сопоставим с таковым у мышей с генной кассетой, что позволяет предположить, что операция микроинъекции оказывает незначительное влияние на эмбриональное развитие флоксированных мышей.
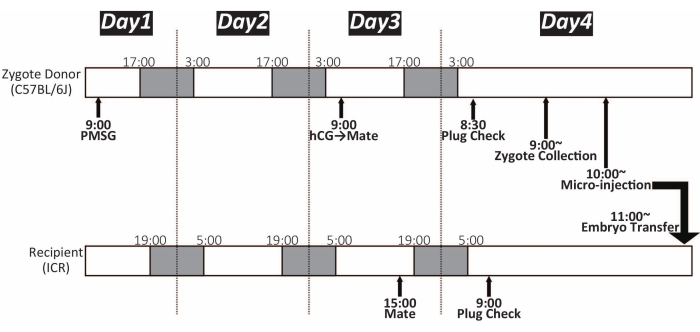
Рисунок 1: Хронология микроинъекции зиготы. Белый и темный цвет показывают светлый и темный цикл соответственно. Мышей поддерживали в 14-часовом светлом / 10-часовом темном цикле. ПМСГ: гонадотропин сыворотки крови беременной кобылы; ХГЧ: хорионический гонадотропин человека Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
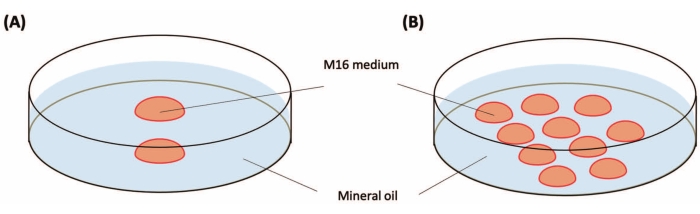
Рисунок 2: Приготовление культуральных блюд . (А) Культуральная чашка для зигот перед инъекцией. Поместите две капли среды M16 (20-25 мкл на каждую) в пластиковую чашку Петри диаметром 35 мм. (B) Культуральная чашка для зигот после инъекции. Поместите 10 капель (10-20 мкл на каждую каплю) M16 в пластиковую чашку Петри диаметром 35 мм. Капли покрывают минеральным маслом (3 мл). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Целевая хромосомная область | Количество | Длина вставки (kb) | Длина плеча гомологии (kb) | ||||||
| Эмбрионов | Новорожденных | Обследование (отъемы) | Опрокидывание без rTG | rTGc | |||||
| Вводят | Переданы | 5' рука | 3' рука | ||||||
| 2qE2 | 349 | 331 | 114 (34,4%)a | 114 | 9 (7,9%)b | 5 (4,4%)d | 1.0 | 1.0 | 1.0 |
| 2qE2 | 231 | 215 | 78 (36,3%)a | 74 | 15 (20,3%)b | 23 (31,1%)d | 2.2 | 1.0 | 1.1 |
| 5qG2 | 288 | 262 | 90 (34,4%)a | 81 | 19 (23,5%)b | 18 (22,2%)d | 1.6 | 2.0 | 2.0 |
| 6qB1 | 278 | 259 | 58 (22,4%)a | 46 | 11 (23,9%)b | 11 (23,9%)d | 4.2 | 1.2 | 1.0 |
| 6qE3 [ROSA26] | 295 | 277 | 97 (35,0%)a | 23 | 2 (8,7%)b | 4 (17,4%)d | 6.5 | 1.1 | 3.0 |
| 6qE3 [ROSA26] | 246 | 219 | 87 (39,7%)a | 83 | 22 (26,5%)b | 18 (21,7%)d | 5.8 | 1.1 | 3.0 |
| 7qF5 | 279 | 268 | 116 (43,3%)a | 114 | 45 (39,5%)b | 44 (38,6%)d | 1.4 | 3.1 | 1.0 |
| 11qB4 | 405 | 353 | 56 (15,9%)a | 47 | 8 (17,0%)b | 12 (25,5%)d | 1.7 | 1.0 | 0.8 |
| 11qD | 310 | 294 | 100 (34,4%)a | 98 | 15 (15,3%)b | 76 (77,6%)d | 1.0 | 1.8 | 2.4 |
| 12qE | 368 | 320 | 86 (26,9%)a | 84 | 12 (14,3%)b | 19 (22,6%)d | 3.4 | 1.1 | 1.3 |
| 12qF1 | 315 | 265 | 76 (28,7%)a | 72 | 17 (23,6%)b | 28 (38,9%)d | 1.0 | 1.1 | 1.1 |
| 14qE5 | 256 | 215 | 48 (22,3%)a | 48 | 11 (22,9%)b | 21 (43,8%)d | 3.1 | 1.0 | 0.9 |
| 14qE5 | 287 | 285 | 85 (29,8%)a | 72 | 15 (20,8%)b | 19 (26,4%)d | 2.6 | 1.0 | 0.9 |
Таблица 1: Получение мышей с помощью микроинъекций. В таблице показана рождаемость и эффективность получения мышей, несущих предполагаемый аллель нокаута без (W/O) случайной интеграции (rTG) донорской ДНК. Во всех проектах удалось получить мышей с предполагаемым аллелем нокаута. a: Число новорожденных/количество перенесенных эмбрионов; b: Количество мышей, перенесших нокаут-ин, / количество обследованных мышей; c: нет уверенности в том, что существует предполагаемый аллель; d: Количество мышей, несущих аллель рТГ, / количество обследованных мышей; rTG: случайная интеграция донорского вектора. Б/О: без.
| Целевая хромосомная область | Количество | Длина флокса (КБ) | Длина плеча гомологии (kb) | |||||
| Эмбрионов | Новорожденных | Обследование (отъемы) | floxed без рТГ | |||||
| Вводят | Переданы | 5' рука | 3' рука | |||||
| 3qC | 325 | 313 | 93 (29,7%)a | 87 | 9 (10,3%)b | 1.3 | 1.2 | 1.1 |
| 4qB1 | 210 | 200 | 36 (18,0%)a | 29 | 6 (20,7%)b | 1.6 | 1.2 | 0.9 |
| 4qC4 | 272 | 256 | 112 (43,8%)a | 100 | 5 (5,0%)b | 2.4 | 1.0 | 1.4 |
| 5qF | 143 | 137 | 40 (29,2%)a | 40 | 6 (15,0%)b | 1.8 | 1.0 | 1.1 |
| 5qF | 255 | 227 | 80 (35,2%)a | 76 | 2 (2,6%)b | 1.3 | 1.1 | 0.9 |
| 9qE3.1 | 289 | 261 | 80 (30,7%)a | 77 | 9 (11,7%)b | 1.2 | 1.2 | 1.2 |
| 10qB3 | 284 | 269 | 88 (32,7%)a | 78 | 3 (3,8%)b | 1.3 | 1.1 | 0.9 |
| 10qC1 | 243 | 231 | 40 (17,3%)a | 38 | 4 (10,5%)b | 2.1 | 1.0 | 1.3 |
| 14qE5 | 390 | 372 | 139 (37,4%)a | 135 | 5 (3,7%)b | 1.1 | 0.8 | 0.9 |
| 17кА3.3 | 383 | 374 | 99 (26,5%)a | 95 | 2 (2,1%)b | 2.1 | 0.6 | 0.8 |
Таблица 2: Производство флоксированных мышей путем микроинъекций. В таблице показана рождаемость и эффективность получения мышей, несущих предполагаемый аллель флокса без (W/O) случайной интеграции (rTG) донорской ДНК. Во всех проектах удалось получить мышей с предполагаемым аллелем флокса. a: Число новорожденных/количество перенесенных эмбрионов; B: Количество мышей, несущих аллель флокса/количество обследованных мышей. рТГ: случайная интеграция донорского вектора; Б/О: без.
Обсуждение
В настоящем исследовании свежие (не замороженные-размороженные) мышиные зиготы C57BL/6J, полученные в результате естественного спаривания, использовались для редактирования генома мышиного производства. Путем инъекции crRNA-tracrRNA-Cas9 и донорской ДНК (RNPD) в оба пронуклеуса этих зигот в фазе клеточного цикла, где наиболее вероятно нокаутирование, были получены мыши с кассетой генов и флоксированными мышами с высокой рождаемостью и достаточной эффективностью редактирования генома. Настоящее исследование усиливает расширяемость метода SPRINT-CRISPR15, где он обеспечивает достаточную эффективность нокаута даже в генетическом фоне C57BL / 6J и может быть применен для получения флоксированных мышей.
Электропорация является высоко обобщенным методом получения мышей с отредактированным геномом из-за низкой стоимости экспериментальных устройств и простоты изучения техники8. Кроме того, метод19 i-GONAD, в котором редактирование генома выполняется с помощью преимплантационных эмбрионов, существующих в яйцеводе, не требует мыши-реципиента. По сравнению с этими методами, представленный здесь метод является дорогостоящим и трудоемким при подготовке и обслуживании экспериментальной среды с точки зрения как аппаратного, так и программного обеспечения. Однако, как только экспериментальные установки будут созданы, сложные мыши с нокаутом генных кассет и флоксированные мыши могут быть получены только с коммерчески доступными элементами CRISPR (крРНК, тракрРНК и белок Cas9) и простым, небольшим количеством кольцевого плазмидного вектора, который будет использоваться в качестве донорской ДНК. Это означает, что многие сложные линии мышей с отредактированным геномом могут быть получены без необходимости подготовки трудоемких (или относительно дорогих) lsODN 5,6 или аденоассоциированных вирусных векторов20.
В отличие от оригинального метода SPRINT-CRISPR15, использовались свежие (замороженные-размороженные) зиготы. При получении свежих зигот путем естественного спаривания можно игнорировать технические ошибки, которые могут возникнуть при экстракорпоральном оплодотворении или замораживании и размораживании. Кроме того, процесс манипуляций с эмбрионом может быть завершен примерно за полдня (рис. 1) в соответствии с текущим подходом. С другой стороны, некоторые ограничения настоящего способа включают в себя требования к большому количеству мышей-самцов, свободный контроль времени оплодотворения и ограниченную способность полностью предсказывать количество зигот для микроинъекций. По сравнению с оригинальным методом SPRINT-CRISPR, этот метод может иметь более высокий уровень рождаемости (табл. 1). Несмотря на это, нельзя сделать вывод, что данный метод лучше с точки зрения рождаемости из-за различий в проводниках эксперимента, генах-мишенях, генетических фонах и сроках подтверждения эмбрионов.
Как показано в таблице 1, большое количество мышей в большинстве проектов нокаутирования генных кассет имели случайные аллели интеграции. Случайная интеграция должна быть устранена, потому что она может привести к непреднамеренному нарушению эндогенных генов и эктопической экспрессии трансгенов. Задача на будущее состоит в том, чтобы найти экспериментальные условия, которые уменьшат количество случайных событий интегрирования, сохраняя при этом достаточную эффективность докаутирования.
Почти все редактирование генома зиготы мыши с использованием эффекторов редактирования генома, которые приводят к двухцепочечным разрывам ДНК, вероятно, индуцирует непреднамеренные мутации на целевых участках 9,21. Результаты этих непреднамеренных мутаций-мишеней здесь не описаны, потому что мы не находимся в ситуации, в которой можно управлять следующим поколением мышей, чтобы представить четкие доказательства их существования. Лучший способ исключить беспокойство по поводу путаницы, вызванной непреднамеренным мутагенезом на мишени, - это получить следующее поколение мышей путем спаривания основателей с мышами дикого типа, а не путем скрещивания основателей. В принципе, мыши N1, полученные в результате этого скрещивания, относятся к дикому типу (WT) на одной стороне аллеля, поэтому, если обнаружен предполагаемый аллель нокаута (KI), они гетерозиготны WT/KI. Таким образом, целевой мутагенез не является критической проблемой у лабораторных мышей, которые имеют относительно быстрый жизненный цикл и являются плодовитым животным. Тем не менее, дальнейшее совершенствование будет необходимо, когда эта технология будет применена к относительно крупным млекопитающим.
Было подтверждено, что эта технология может производить мышей с нокаутом генов в инбредных штаммах, отличных от C57BL / 6J, но достаточное количество проектов не защищено, и данные сильно варьируются. По этой причине данная информация не включена в настоящее исследование. Считается, что дальнейшие исследования по этому вопросу будут необходимы для продвижения генетики мышей и исследований моделей заболеваний.
Раскрытие информации
Авторы заявили об отсутствии конкурирующих интересов.
Благодарности
Эта работа была поддержана научными исследованиями (B) (19H03142: к SM), научными исследованиями (A) (20H00444: к FS), научными исследованиями (A) (21H04838: к SM) и научными исследованиями по инновационным направлениям «Платформа поддержки передовых моделей животных» (16H06276: к ST) от Министерства образования, культуры, спорта, науки и технологий. Спонсоры не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. Мы благодарны Рёити Мори за его полезную дискуссию о дизайне редактирования генома.
Материалы
| Name | Company | Catalog Number | Comments |
| Atipamezole Hydrochloride | ZENOAQ | - | |
| Autoclip Wound Clip | BD | 427631 | |
| Autoclip Wound Clip Applier | BD | 427630 | |
| Butorphanol | Meiji Seika Pharma | - | |
| C57BL/6J mice | Jackson Laboratory Japan | - | older than 10 weeks old |
| Calibrated Pipet, 100ul | Drummond Scientific Company | 2-000-100 | for collecting zygote and embryo transfer |
| Cas9 | Thermo Fisher Scientific | A36499 | |
| Cas9 Nuclease Reaction Buffer | NEB | B7203 | |
| CellTram 4r oil | Eppendorf | 5196000030 | |
| CRISPOR | http://crispor.tefor.net/ | web tool for genome editing experiments with the CRISPR-Cas9 system | |
| crRNA | IDT | - | |
| Gel/PCR Extraction Kit | FastGene | FG-91302 | |
| hCG | ASKA Animal Health | - | |
| Hyaluronidase | Merck Sigma-Aldrich | H3884 | |
| ICR mice | Jackson Laboratory Japan | - | older than 10 weeks old, weight 28 G or more |
| Inverted microscope | Leica | ||
| KOnezumi | https://www.md.tsukuba.ac.jp/LabAnimalResCNT/KOanimals/konezumi.html | a web application for automating gene disruption strategies to generate knockout mice | |
| M16 medium | Merck Sigma-Aldrich | M7292 | |
| M2 medium | Merck Sigma-Aldrich | M7167 | |
| Medetomidine | ZENOAQ | - | |
| Micro shears | Natsume Seisakusho | MB-54-1 | |
| Microforge | Narishige | MF-900 | for fire polishing of holding pipette and bending the microinjection needle |
| Micromanipulator units | Narishige | ||
| Micropipette puller | Sutter Instrument | P-1000 | programmable pipette puller |
| Midazolam | Maruishi Pharmaceutical | - | |
| MILLEX-GV 0.22 µm filter | Merck Millipore | SLGV033R | |
| Mineral oil | Nacalai | 26114-75 | for zygote culture and injection chamber |
| Petri dish (35mm, untreated) | Iwaki | 1000-035 | for zygote culture |
| PIEZO micromanipulator | PRIME TECH | PMM-150 | |
| Plasmid Mini Kit | FastGene | FG-90502 | mini prep spin column kit |
| PMM Operation Liquid | PRIME TECH | KIT-A | operation liquid for microinjection |
| PMSG | ASKA Animal Health | - | |
| Polyvinylpyrrolidone | Merck Sigma-Aldrich | P5288 | |
| RNase | QIAGEN | 19101 | |
| RNase Free Water | IDT | - | tracrRNA Accessory Reagents |
| Serrefine clamp | Natsume Seisakusho | C-18 | |
| Sodium dodecyl sulfate | SIGMA | 151-21-3 | |
| Suture needle with thread | Natsume Seisakusho | C11-60B2 | |
| Thin wall borosilicate glass without filament | Sutter Instrument | B100-75-10 | for microinjection needle and holding pipette |
| tracrRNA | IDT | - |
Ссылки
- Suzuki, H., et al. Generation of bicistronic reporter knockin mice for visualizing germ layers. Experimental Animals. 68 (4), 499-509 (2019).
- Le, H. T., et al. Generation of B6-Ddx4(em1(CreERT2)Utr) , a novel CreERT2 knock-in line, for germ cell lineage by CRISPR/Cas9. Genesis. 58 (7), 23367 (2020).
- Osawa, Y., et al. EXOC1 plays an integral role in spermatogonia pseudopod elongation and spermatocyte stable syncytium formation in mice. Elife. 10, 59759 (2021).
- Funato, H., et al. Forward-genetics analysis of sleep in randomly mutagenized mice. Nature. 539 (7629), 378-383 (2016).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nature Communications. 7, 10431 (2016).
- Miura, H., Gurumurthy, C. B., Sato, T., Sato, M., Ohtsuka, M. CRISPR/Cas9-based generation of knockdown mice by intronic insertion of artificial microRNA using longer single-stranded DNA. Scientific Reports. 5, 12799 (2015).
- Murata, K., et al. Efficient induction of proximity-dependent labelling by biotin feeding in BMAL1-BioID knock-in mice. The Journal of Biochemistry. 170 (4), 453-461 (2021).
- Kaneko, T., Mashimo, T. Simple genome editing of rodent intact embryos by electroporation. PLoS One. 10 (11), 0142755 (2015).
- Kuno, A., et al. DAJIN enables multiplex genotyping to simultaneously validate intended and unintended target genome editing outcomes. PLOS Biology. 20 (1), 3001507 (2022).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318 (2018).
- Gurumurthy, C. B., et al. Reproducibility of CRISPR-Cas9 methods for generation of conditional mouse alleles: a multi-center evaluation. Genome Biology. 20 (1), 171 (2019).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Hasegawa, Y., et al. Generation of CRISPR/Cas9-mediated bicistronic knock-in ins1-cre driver mice. Experimental Animals. 65 (3), 319-327 (2016).
- Aida, T., et al. Cloning-free CRISPR/Cas system facilitates functional cassette knock-in in mice. Genome Biology. 16, 87 (2015).
- Abe, T., Inoue, K. I., Furuta, Y., Kiyonari, H. Pronuclear Microinjection during S-phase increases the efficiency of CRISPR-Cas9-assisted knockin of large DNA donors in mouse zygotes. Cell Reports. 31 (7), 107653 (2020).
- Lilue, J., et al. Sixteen diverse laboratory mouse reference genomes define strain-specific haplotypes and novel functional loci. Nature Genetics. 50 (11), 1574-1583 (2018).
- Birling, M. C., et al. A resource of targeted mutant mouse lines for 5,061 genes. Nature Genetics. 53 (4), 416-419 (2021).
- Mizuno-Iijima, S., et al. Efficient production of large deletion and gene fragment knock-in mice mediated by genome editing with Cas9-mouse Cdt1 in mouse zygotes. Methods. 191, 23-31 (2021).
- Ohtsuka, M., et al. i-GONAD: a robust method for in situ germline genome engineering using CRISPR nucleases. Genome Biology. 19 (1), 25 (2018).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/Cas9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Burgio, G., Teboul, L. Anticipating and identifying collateral damage in genome editing. Trends in Genetics. 36 (12), 905-914 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены