Method Article
Micro-injection de zygote pour la création d’allèles knock-in et flox de cassette génique chez la souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit la micro-injection de zygotes de CRISPR-Cas9 et d’ADN de donneur pour produire efficacement des souris frappées par cassette de gènes et floxées.
Résumé
La technologie CRISPR-Cas a permis la génération rapide et sans effort de souris génétiquement modifiées. Plus précisément, les souris et les souris mutantes ponctuelles sont facilement produites par électroporation des facteurs CRISPR (et des donneurs d’ADN oligo simple brin) dans le zygote. En revanche, les souris knock-in et floxed de cassette de gènes (>1 kb) sont principalement générées par micro-injection de facteurs CRISPR et de donneurs d’ADN double brin dans des zygotes. Les technologies d’édition du génome ont également accru la flexibilité de la production de souris génétiquement modifiées. Il est maintenant possible d’introduire les mutations prévues dans les régions génomiques cibles dans un certain nombre de souches de souris consanguines bénéfiques. Notre équipe a produit plus de 200 lignées de souris knock-in de cassettes de gènes et plus de 110 lignées de souris floxées par microinjection zygote de CRISPR-Cas9 suite à des demandes de plusieurs pays, dont le Japon. Certaines de ces modifications du génome ont utilisé des souches consanguines BALB / c, C3H / HeJ et C57BL / 6N, mais la plupart ont utilisé C57BL / 6J. Contrairement à la méthode d’électroporation, l’édition du génome par microinjection de zygote dans diverses souches consanguines de souris n’est pas si facile. Cependant, les souris knock-in et floxed sur des antécédents génétiques consanguins uniques sont aussi critiques que les modèles de souris humanisées génétiques, fluorescentes et knockout conditionnelles. Par conséquent, cet article présente le protocole pour la micro-injection zygote de facteurs CRISPR et de donneurs d’ADN double brin chez des souris C57BL / 6J pour générer des souris knock-in de cassette de gènes et floxed. Cet article se concentre exclusivement sur l’injection nucléaire plutôt que sur l’injection cytoplasmique. En plus de la micro-injection de zygote, nous décrivons le calendrier du processus de production et des techniques périphériques telles que l’induction de la superovulation et le transfert d’embryons.
Introduction
Les souris knock-in, chez lesquelles les gènes exogènes prévus sont introduits aux loci cibles, sont largement utilisées dans de nombreuses études in vivo en tant que souris humanisées par gène, souris rapporteures fluorescentes et souris pilotesCre 1,2. Lorsque des mutations knock-in sont induites par l’édition du génome chez des zygotes de souris, l’ADN simple brin (donneurs d’ADN oligo simple brin, ssODN) ou l’ADN double brin (ADNds) est utilisé comme ADN donneur 2,3. ssODN est principalement utilisé pour frapper des fragments de gènes relativement courts de moins de 200 bp4. Il est possible d’introduire des fragments de plus de 1 kb d’ADN en utilisant de longs ssODN (lsODN)5,6, mais leur préparation prend beaucoup de temps. Lorsque des donneurs d’ADNds sont utilisés, des souris knock-in à cassette génétique (>1 kb) peuvent être générées sans préparation laborieuse de l’ADN du donneur7.
Le principal avantage de l’utilisation de ssODN est que l’électroporation8 peut générer des souris knock-in. Cependant, les donneurs d’ADNds doivent être introduits directement dans le noyau par micro-injection de zygote. Un knock-in simultané sur deux sites est nécessaire pour créer des souris floxées, dans lesquelles chaque séquence loxP est frappée en amont et en aval du gène cible. Il existe deux façons de générer des souris floxed par édition du génome dans des zygotes de souris - en utilisant deux ssODN indépendants, chacun portant un seul site loxP, ou en utilisant un seul dsDNA (ou lsDNA) avec une séquence floxée; Le premier est très inefficace 9,10,11. L’édition du génome à l’aide de donneurs d’ADNds est l’approche la plus simple pour produire des souris frappées par cassette de gènes et floxed si l’environnement est propice à la micro-injection de zygote.
Initialement, des mélanges d’ARNm Cas9 et de sgRNA ou de vecteurs d’ADN codant pour l’ARNg et Cas9 sont utilisés pour l’édition du génome chez les zygotesde souris 12,13. Étant donné que des protéines Cas9 stables et de haute qualité sont maintenant disponibles à faible coût, l’introduction de la ribonucléoprotéine (RNP) ARNcr-tracrRNA-Cas9 dans les zygotesde souris 14 est devenue populaire. Récemment, des souris knock-in ont été générées avec une grande efficacité en introduisant le RNR ARNcr-tracrRNA-Cas9 RNP et l’ADN du donneur dans les deux pronuclei des zygotes de souris dans une phase de cycle cellulaire où le knock-in est le plus susceptible de se produire15. Par conséquent, le présent protocole décrit des techniques pour produire différents types de souris knock-in par cette méthode.
Il existe de nombreuses souches consanguines utiles de souris de laboratoire16. La modification génétique dans le contexte consanguin peut ignorer l’influence du fond génétique sur le phénotype. Cet article décrit une méthode pour induire des mutations de cassette de gènes knock-in et floxed dans le zygote de la lignée de souris consanguine la plus couramment utilisée, la C57BL/6J17. En outre, le calendrier de génération de souris génétiquement modifiées et les techniques périphériques utilisées sont également discutés, y compris l’induction de la superovulation et le transfert d’embryons.
Protocole
Toutes les expériences sur les animaux ont été menées sans cruauté avec l’approbation du Comité institutionnel de l’expérimentation animale de l’Université de Tsukuba, conformément au Règlement relatif à l’expérimentation animale de l’Université de Tsukuba et aux Directives fondamentales pour la bonne conduite des expériences sur les animaux et des activités connexes dans les établissements de recherche universitaires relevant du Ministère de l’éducation. Culture, sports, science et technologie du Japon. Des souris C57BL/6J des deux sexes, âgées de 10 à 25 semaines, ont été utilisées comme donneuses de zygotes. Des souris ICR (âgées de plus de 10 semaines) ont été utilisées comme souris receveuses. Les souris ont été obtenues de sources commerciales (voir le tableau des matériaux).
1. Confirmation de l’activité de clivage de l’ARNcr dans un système acellulaire
- Dissoudre 2 nmol d’ARNcr (sec) et 20 nmol d’ARNcr (sec) dans 25 μL et 250 μL d’eau exempte de RNase, respectivement (voir le tableau des matériaux).
REMARQUE : Les séquences cibles CRISPR dont on prévoyait qu’elles auraient une activité de clivage élevée et le moins possible de cibles hors cible sont sélectionnées à l’aide de CRISPOR (voir le tableau des matériaux). Dans le cas d’une cassette génétique, ciblez la séquence sur le site d’insertion. Les exons à floxer ont été sélectionnés à l’aide du KOnezumi (voir le tableau des matériaux). - Amplifier le fragment d’ADN (environ 0,5-1 kb) contenant le site cible par PCRgénomique 9. Purifiez cet amplicon PCR avec le kit d’extraction de produit PCR commun (voir Tableau des matériaux).
- Préparer 10 μL de mélange CRISPR (100 ng/μL d’ARNcr, 150 ng/μL d’ARNcr et 1 ng/μL de Cas9 dans le tampon de réaction nucléase Cas9, voir Tableau des matériaux). Pour construire le complexe CRISPR-Cas9, placer le mélange CRISPR dans un bloc thermique à 37 °C pendant 30 min.
- Ajouter le volume total (10 μL) du mélange CRISPR au produit PCR (10 μL, 20 ng/μL) décrit à l’étape 1.2 et incuber à 37 °C pendant 1 h. Ajouter 1 μL de RNase (500 ng/μL) pour dégrader l’ARNcr et l’ARNtrac à 37 °C pendant 30 min, car les ARN doivent être absents pendant l’électrophorèse. Effectuer l’électrophorèse des échantillons ci-dessus à l’aide d’un colorant de chargement contenant du dodécylsulfate de sodium (2% p/v).
NOTE: Dans de rares cas, des ARNcr sans activité de clivage sont observés. Dans de tels cas, il est recommandé de repenser la conception de l’édition du génome.
2. Préparation du mélange d’ARNcr, d’ARNtrac, de protéine Cas9 et d’ADN de donneur pour microinjection de zygote
- Préparer la solution CRISPR (50 ng/μL d’ARNcr, 200 ng/μL d’ARNcr et 200 ng/μL de Cas9 dans de l’eau exempte de RNase). Préparer une solution d’ADN donneur (20 ng/μL de vecteur d’ADN plasmidique auto-construit).
- Filtrer la solution d’ADN du donneur à travers un filtre de seringue stérile avec une taille de pores de 0,22 μm. Mélanger des volumes égaux de solution CRISPR et de solution filtrée d’ADN de donneur. S’assurer que la concentration finale de chacun est de 25 ng/μL d’ARNcr, 100 ng/μL d’ARNtrac, 100 ng/μL de Cas9 et 10 ng/μL d’ADN du donneur. Ce mélange sera ci-après dénommé RNPD.
REMARQUE : Lors de la coupe de deux sites, comme lors de la production de souris floxées, la concentration de chaque ARNcr doit être de 25 ng/μL. L’ADN du donneur est un ADN plasmidique circulaire et peut être purifié avec un kit de colonne de mini-spin de préparation commun (voir le tableau des matériaux). La solution préparée doit être placée sur de la glace et utilisée pour la micro-injection dès que possible.
- Filtrer la solution d’ADN du donneur à travers un filtre de seringue stérile avec une taille de pores de 0,22 μm. Mélanger des volumes égaux de solution CRISPR et de solution filtrée d’ADN de donneur. S’assurer que la concentration finale de chacun est de 25 ng/μL d’ARNcr, 100 ng/μL d’ARNtrac, 100 ng/μL de Cas9 et 10 ng/μL d’ADN du donneur. Ce mélange sera ci-après dénommé RNPD.
3. Obtention de zygotes de souris par accouplement naturel
- Injecter 5 UI de gonadotrophine sérique de jument gravide (PMSG, voir Tableau des matières) par voie sous-cutanée à des souris femelles C57BL/6J (âgées de 10 à 25 semaines) 3 jours avant la micro-injection. Environ 46 à 48 h plus tard, administrer 5 UI de gonadotrophine chorionique humaine (hCG, voir Tableau des matériaux) par voie intrapéritonéale. Cologer les souris femelles traitées au PMSG et à l’hCG avec des souris mâles C57BL/6J et vérifier les bouchons vaginaux le lendemain matin.
REMARQUE: Environ 15 à 25 zygotes peuvent être obtenus à partir d’une souris femelle C57BL / 6J. La chronologie est illustrée à la figure 1. - Préparer deux boîtes de Petri de 35 mm pour la culture de zygotes, comme illustré à la figure 2. Placez-les dans l’incubateur (37 °C, 5% CO2) jusqu’à utilisation. Ceux-ci peuvent être stockés pendant la nuit.
- Euthanasier les souris femelles avec des bouchons vaginaux confirmés par luxation cervicale et, à l’aide de petits ciseaux, inciser à travers la peau abdominale et la couche musculaire de la ligne médiane du bas-ventre jusqu’en dessous des côtes.
REMARQUE : Suivez les recommandations du comité local d’éthique animale pour l’euthanasie. - Recueillir les oviductes et les placer dans une goutte de 20 μL de milieu M2 contenant 0,75 mg/mL de hyaluronidase (voir le tableau des matières) sur le couvercle de la boîte de Pétri. Ramasser un oviducte avec une pince à pointe fine et perfuser environ 50 μL de milieu M2 avec de la hyaluronidase à travers les fimbriae.
REMARQUE: À ce stade, les zygotes sont entourés de nombreuses cellules cumulus. - Après 30 s, ramasser les zygotes morphologiquement normaux avec une petite quantité de milieu à l’aide d’un capillaire en verre et les laver en les transférant dans des gouttelettes fraîches de milieu M16. Transférer les zygotes lavés dans une boîte de Petri (Figure 2) pour les mettre en commun.
REMARQUE : La chronologie est illustrée à la figure 1. Les zygotes morphologiquement normaux ont un pronucleus mâle et femelle et deux corps polaires qui n’ont pas gravement compromis la forme sphérique15. La morphologie du zygote varie considérablement selon les souches et les espèces. - Répétez les étapes 3.3 et 3.4 jusqu’à ce que tous les zygotes soient récupérés. Environ 100 zygotes peuvent être regroupés dans une goutte M16 dans le plat de culture. Conserver la capsule dans l’incubateur (37 °C, 5% CO2) jusqu’à micro-injection.
4. Préparation de l’aiguille de micro-injection
- Tirez des pipettes en verre à l’aide de l’extracteur de pipettes programmable (voir le tableau des matériaux).
REMARQUE: Les aiguilles de micro-injection doivent avoir une pointe fine et une longue conicité. Si l’extracteur dispose d’un programme de fabrication d’aiguilles pour l’injection intracytoplasmique de spermatozoïdes, le même programme peut être utilisé pour fabriquer des aiguilles pour micro-injection. - Cassez la pointe de l’aiguille de micro-injection en frappant la bille de verre attachée à la pointe de la microforge. Assurez-vous que la taille de la pointe de l’aiguille de micro-injection est d’environ 1 μm de diamètre. Vérifiez la taille de la pointe au microscope à un grossissement de 1000x.
- Pliez l’aiguille de microinjection à environ 2-3 mm de la pointe à l’aide d’une microforge.
REMARQUE: L’angle de courbure dépend de la configuration du micromanipulateur. Trop de flexion réduira l’efficacité de l’impulsion piézoélectrique.
5. Micro-injection de zygote
- Injectez 1 à 1,5 cm du liquide d’opération (corps d’inertie nécessaire à l’effet piézo pour faire des trous comme alternative au mercure, voir Tableau des matériaux) au centre de l’aiguille de micro-injection et fixez-le au support de micro-injecteur manuel avec l’actionneur piézoélectrique.
- De plus, fixez l’aiguille de maintien au porte-injecteur manuel opposé. Déplacez le liquide d’opération vers l’extrémité de l’aiguille de micro-injection avec une pression progressive. Fixez les deux supports de micro-injecteur manuels sur le micromanipulateur.
REMARQUE: Le liquide opératoire sortant de la pointe de l’aiguille de micro-injection peut être observé au microscope à un grossissement de 50x. Après ajustement de la quantité de liquide émise, les éclaboussures de liquide peuvent être observées lorsque les impulsions piézoélectriques sont appliquées, confirmant que les impulsions piézoélectriques sont efficaces. Si cela ne peut pas être confirmé, repréparez l’aiguille de micro-injection.
- De plus, fixez l’aiguille de maintien au porte-injecteur manuel opposé. Déplacez le liquide d’opération vers l’extrémité de l’aiguille de micro-injection avec une pression progressive. Fixez les deux supports de micro-injecteur manuels sur le micromanipulateur.
- Préparer une chambre d’injection avec trois gouttelettes : (1) 10 μL de milieu M2 ; (2) 5 μL de polyvinylpyrrolidone (PVP) à 12 % en milieu M2; et (3) un mélange de 5 μL d’ARNcr, d’ARNtrac, de protéine Cas9 et de solution d’ADN donneur (RNPD). Couvrir les gouttelettes d’huile minérale de la même manière que l’étape 3.2 et placer la chambre d’injection sur la platine du microscope inversé.
- Sous le microscope inversé à un grossissement de 50x, abaissez la pipette de microinjection dans la goutte PVP de 12%. Aspirer et distribuer 12% de PVP pour nettoyer l’intérieur de l’extrémité de l’aiguille de micro-injection et le transférer dans la gouttelette RNPD.
- Placez le micro-injecteur manuel sous pression négative et aspirez la solution de RNPD dans l’aiguille de micro-injection. Attendez quelques minutes jusqu’à ce qu’un volume suffisant soit aspiré; Sous un microscope grossi 50x, remplissez tout l’intérieur de l’aiguille de micro-injection avec du liquide.
- Arrêtez la prise et laissez la solution RNPD être expulsée progressivement en réglant le micro-injecteur manuel à pression positive. Déplacez la pointe de l’aiguille de micro-injection dans l’huile.
REMARQUE: Tournez le bouton du micro-injecteur manuel dans le sens inverse des aiguilles d’une montre pour l’inhalation. Pour arrêter l’inhalation, tournez le bouton dans le sens des aiguilles d’une montre et augmentez progressivement la pression tout en observant au microscope. La solution de RNPD sera progressivement drainée. Le mouvement du niveau de liquide dans l’aiguille de micro-injection permet de confirmer l’écoulement.
- Arrêtez la prise et laissez la solution RNPD être expulsée progressivement en réglant le micro-injecteur manuel à pression positive. Déplacez la pointe de l’aiguille de micro-injection dans l’huile.
- Mettez 50 zygotes dans la gouttelette M2 et abaissez doucement la pipette de maintien dans la même gouttelette. Transférer l’aiguille de micro-injection dans la goutte M2 contenant des zygotes. Passez à un objectif 20x et concentrez-vous sur la pointe de la pipette de micro-injection.
REMARQUE: Mettez autant de zygotes qui peuvent être injectés en 10 min. - Tenez un zygote et concentrez-vous sur le pronucleus en déplaçant le micromanipulateur. Insérez l’aiguille de micro-injection dans le zygote et rapprochez l’embout du pronucleus. Une fois que la pointe atteint la membrane pronucleaire, appliquez l’impulsion piézoélectrique (intensité: 6-10, vitesse: 1) pour percer.
- Lorsque l’aiguille de micro-injection perce le pronucleus, injectez la solution RNPD et observez le gonflement du pronucleus. Une fois que le pronucleus est complètement gonflé, retirez rapidement l’aiguille. Effectuer la même procédure sur les pronuclei femelle et mâle.
REMARQUE: Le gonflement du pronucleus par injection peut être clairement vu au microscope. Le degré de cette inflation est difficile à verbaliser mais peut être confirmé en se référant aux rapports précédents15.
- Lorsque l’aiguille de micro-injection perce le pronucleus, injectez la solution RNPD et observez le gonflement du pronucleus. Une fois que le pronucleus est complètement gonflé, retirez rapidement l’aiguille. Effectuer la même procédure sur les pronuclei femelle et mâle.
- Déplacer le zygote injecté à un autre endroit dans la gouttelette M2 pour identifier les zygotes avant et après l’injection.
- Répétez les étapes 5.5-5.6 jusqu’à ce que tous les zygotes de la gouttelette M2 aient été injectés. Après l’injection, transférer les zygotes dans un plat frais de M16.
- Sélectionnez les zygotes survivants 10 min après l’injection. Retirer les zygotes lysés endommagés par l’injection et distribuer les zygotes survivants à chaque gouttelette de la boîte M16. Chaque gouttelette doit contenir 20 à 24 zygotes pour une femelle pseudo-gravide. Cela réduit le temps d’exposition de la boîte M16 à l’environnement extérieur de l’incubateur pendant le transfert d’embryons.
REMARQUE: Dans des conditions d’injection optimales, le taux de survie est de 90% à 95%. Cela dépend de la taille de la pointe de l’aiguille, de la force de l’impulsion piézoélectrique et de la pression d’écoulement de la solution RNPD.
6. Transfert d’embryons dans l’oviducte
- Pour obtenir des souris pseudo-gravides, accouplez chaque souris ICR femelle en phase proestrus avec une souris ICR mâle vasoliguée. Vérifiez les bouchons le lendemain.
REMARQUE: Environ 15 souris pseudo-gravides sont obtenues à partir de 20 couples d’accouplement. - Administrer trois types d’agents anesthésiques mixtes (0,2 mg/kg de médétomidine, 4,0 mg/kg de midazolam et 2,5 mg/kg de butorphanol, voir le tableau des matières) par voie sous-cutanée aux souris femelles pseudogravides. Confirmer une anesthésie appropriée par une diminution de la fréquence respiratoire et la disparition des réflexes de retrait de la pédale de la queue et des membres postérieurs. Appliquez une pommade ophtalmique pour lubrifier les yeux conformément aux recommandations du comité local d’éthique animale.
- Après avoir rasé au rasoir la région dorsale de la souris en position couchée et désinfecté la zone chirurgicale trois fois, en alternant entre un gommage à base d’iode ou de chlorhexidine et de l’alcool, inciser la peau dorsale à environ 1 cm le long de la colonne vertébrale avec de petits ciseaux disséquants.
- Déplacez la plaie de l’incision dorsale d’un côté ventralement, incisez la couche musculaire à travers laquelle l’ovaire peut être vu, saisissez la graisse au-dessus de l’ovaire avec une pince à épiler et retirez l’ovaire, l’oviducte et l’utérus.
- Fixez la graisse avec une pince serrefine (voir le tableau des matériaux). Placez les tissus reproducteurs sur de la gaze stérile pour éviter tout contact direct avec le pelage.
- Dans l’ordre suivant, placez une petite quantité de milieu de culture (M2 ou M16), quelques bulles d’air comme marqueur et les zygotes dans une pipette pour le transfert.
NOTE: Transférer environ 10-12 zygotes par oviducte. - Faites une incision à l’aide d’un micro-cisaillement (voir Tableau des matériaux) entre l’ampoule et les fimbriae de l’oviducte (juste assez longtemps pour permettre à la pipette de verre d’entrer), introduisez les zygotes dans l’incision et confirmez simultanément que la bulle d’air a été introduite.
- Effectuer l’implantation dans l’autre oviducte de la même manière (étape 6.6).
- Suturez la peau extérieure à l’aide d’autoclips (voir le tableau des matériaux).
REMARQUE: Ne suturez pas la couche musculaire incisée à moins que la plaie d’incision ne soit inévitablement grande. La taille idéale de la couche musculaire incisée doit être inférieure à 2-3 mm. Si l’incision est supérieure à 5 mm, la couche musculaire doit être suturée à l’aide d’une aiguille et d’un fil de suture stérilisés (voir le tableau des matériaux).
7. Récupération des animaux
- Administrer le chlorhydrate d’atipamézole (0,3 mg/kg) par voie sous-cutanée à des souris.
REMARQUE : Suivez les recommandations du comité local d’éthique animale pour l’analgésie postopératoire. - Ensuite, placez les souris dans des cages et gardez-les au chaud sur une plaque chauffante à 37 °C.
- Après le réveil des souris, gardez-les au chaud pendant environ 2 h. Après avoir confirmé l’absence de comportement anormal des souris, remettez les cages dans le rack de reproduction.
Résultats
Les résultats de production des souris frappées par cassette génétique et floxed utilisant ce protocole sont présentés dans les tableaux 1 et 2. Les gènes cibles n’ont pas été précisés parce que chaque lignée de souris modifiée par le génome est actuellement utilisée dans un projet indépendant non publié. Au lieu de cela, les régions chromosomiques cibles ont été décrites.
Les analyses de génotypage ont été effectuées à l’aide d’une méthode précédemment rapportée18. Dans cette méthode de génotypage, les souris chez lesquelles l’ADN du donneur est inséré dans des sites chromosomiques non intentionnels ne sont pas comptées comme des individus positifs, même si l’édition souhaitée du génome est induite. Par conséquent, l’efficacité de production des souris fondatrices qui sont vraiment utiles à des fins réelles a été montrée, plutôt que l’efficacité de l’édition du génome lui-même.
L’efficacité médiane de production de 13 souris knock-in de cassettes de gènes indépendantes était de 20,8 %, avec un maximum de 39,5 % et un minimum de 7,9 % (tableau 1). Cette efficacité a été jugée suffisamment pratique. Aucun gène embryonnaire mortel n’a été ciblé lors de la frappe de la cassette de gènes. Le taux de natalité médian pour cette condition de ciblage de gène non létal était de 34,0% (maximum 43,3% et minimum 15,9%). Comme cela est comparable au taux de natalité dans le transfert d’embryons sans manipulation génétique, nous avons considéré que la toxicité des éléments d’édition du génome introduits et les dommages physiques de la micro-injection de zygote étaient peu susceptibles d’affecter le développement embryonnaire.
L’efficacité médiane de la production des 10 souris indépendantes était de 7,7 %, avec un maximum de 20,7 % et un minimum de 2,1 % (tableau 2). Bien que les fonctions de plusieurs gènes cibles soient inconnues, le taux de natalité médian était de 30,2 %, avec un maximum de 43,8 % et un minimum de 17,3 %. Ce taux était comparable à celui des souris knock-in de cassettes génétiques, suggérant que l’opération de micro-injection a un effet négligeable sur le développement embryonnaire des souris floxées.
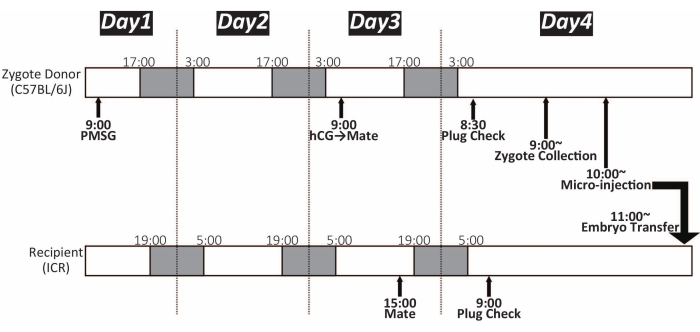
Figure 1 : Chronologie de la micro-injection de zygote. La couleur blanche et sombre montre le cycle de la lumière et de l’obscurité, respectivement. Les souris ont été maintenues sous un cycle de lumière de 14 h / 10 heures d’obscurité. PMSG : gonadotrophine sérique de jument gestante ; hCG : gonadotrophine chorionique humaine Veuillez cliquer ici pour voir une version agrandie de cette figure.
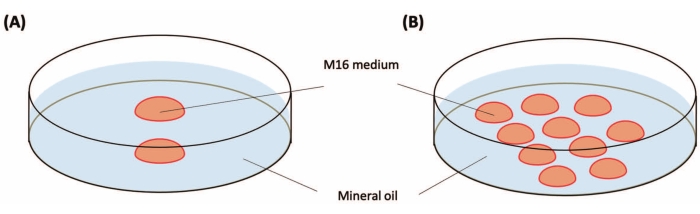
Figure 2 : Préparation des plats de culture. (A) Plat de culture pour les zygotes avant l’injection. Placer deux gouttes de milieu M16 (20-25 μL pour chacune) dans une boîte de Petri en plastique de 35 mm. (B) Plat de culture pour les zygotes après l’injection. Placer 10 gouttes (10-20 μL pour chaque goutte) de M16 dans une boîte de Petri en plastique de 35 mm. Les gouttes sont recouvertes d’huile minérale (3 mL). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Région chromosomique ciblée | Nombre de | Longueur d’insertion knock-in (kb) | Longueur de bras d’homologie (kb) | ||||||
| Embryons | Nouveau-nés | Examiné (sevrage) | Knock-in sans rTG | rTGc | |||||
| injecté | Transféré | Bras 5' | Bras 3' | ||||||
| 2qE2 | 349 | 331 | 114 (34,4 %)a | 114 | 9 (7,9 %)b | 5 (4,4 %)d | 1.0 | 1.0 | 1.0 |
| 2qE2 | 231 | 215 | 78 (36,3 %)a | 74 | 15 (20,3 %)b | 23 (31,1 %)d | 2.2 | 1.0 | 1.1 |
| 5qG2 | 288 | 262 | 90 (34,4 %)a | 81 | 19 (23,5 %)b | 18 (22,2 %)d | 1.6 | 2.0 | 2.0 |
| 6qB1 | 278 | 259 | 58 (22,4 %)a | 46 | 11 (23,9 %)b | 11 (23,9 %)d | 4.2 | 1.2 | 1.0 |
| 6qE3 [ROSA26] | 295 | 277 | 97 (35,0 %)a | 23 | 2 (8,7 %)b | 4 (17,4 %)d | 6.5 | 1.1 | 3.0 |
| 6qE3 [ROSA26] | 246 | 219 | 87 (39,7 %)a | 83 | 22 (26,5 %)b | 18 (21,7 %)d | 5.8 | 1.1 | 3.0 |
| 7qF5 | 279 | 268 | 116 (43,3 %)a | 114 | 45 (39,5 %)b | 44 (38,6 %)d | 1.4 | 3.1 | 1.0 |
| 11qB4 | 405 | 353 | 56 (15,9 %)a | 47 | 8 (17,0 %)b | 12 (25,5 %)d | 1.7 | 1.0 | 0.8 |
| 11qD | 310 | 294 | 100 (34,4 %)a | 98 | 15 (15,3 %)b | 76 (77,6 %)d | 1.0 | 1.8 | 2.4 |
| 12qE | 368 | 320 | 86 (26,9 %)a | 84 | 12 (14,3 %)b | 19 (22,6 %)d | 3.4 | 1.1 | 1.3 |
| 12qF1 | 315 | 265 | 76 (28,7 %)a | 72 | 17 (23,6 %)b | 28 (38,9 %)d | 1.0 | 1.1 | 1.1 |
| 14qE5 | 256 | 215 | 48 (22,3 %)a | 48 | 11 (22,9 %)b | 21 (43,8 %)d | 3.1 | 1.0 | 0.9 |
| 14qE5 | 287 | 285 | 85 (29,8 %)a | 72 | 15 (20,8 %)b | 19 (26,4 %)d | 2.6 | 1.0 | 0.9 |
Tableau 1 : Production de souris knock-in par micro-injection. Le tableau montre le taux de natalité et l’efficacité de la production de souris porteuses de l’allèle knock-in prévu sans intégration aléatoire (rTG) (W/O) de l’ADN du donneur. Il a été possible d’obtenir des souris avec l’allèle knock-in prévu dans tous les projets. a : Nombre de nouveau-nés/Nombre d’embryons transférés; b : Nombre d’allèles knock-in portés par des souris/nombre de souris examinées; C : il n’est pas certain qu’il y ait un allèle intentionnel ; d : Nombre de souris transportées par l’allèle rTG/nombre de souris examinées; rTG : intégration aléatoire du vecteur donneur. W/O: sans.
| Région chromosomique ciblée | Nombre de | Longueur floxed (Ko) | Longueur de bras d’homologie (kb) | |||||
| Embryons | Nouveau-nés | Examiné (sevrage) | floxed sans rTG | |||||
| injecté | Transféré | Bras 5' | Bras 3' | |||||
| 3qC | 325 | 313 | 93 (29,7 %)a | 87 | 9 (10,3 %)b | 1.3 | 1.2 | 1.1 |
| 4qB1 | 210 | 200 | 36 (18,0 %)a | 29 | 6 (20,7 %)b | 1.6 | 1.2 | 0.9 |
| 4qC4 | 272 | 256 | 112 (43,8 %)a | 100 | 5 (5,0 %)b | 2.4 | 1.0 | 1.4 |
| 5qF | 143 | 137 | 40 (29,2 %)a | 40 | 6 (15,0 %)b | 1.8 | 1.0 | 1.1 |
| 5qF | 255 | 227 | 80 (35,2 %)a | 76 | 2 (2,6 %)b | 1.3 | 1.1 | 0.9 |
| 9qE3.1 | 289 | 261 | 80 (30,7 %)a | 77 | 9 (11,7 %)b | 1.2 | 1.2 | 1.2 |
| 10qB3 | 284 | 269 | 88 (32,7 %)a | 78 | 3 (3,8 %)b | 1.3 | 1.1 | 0.9 |
| 10qC1 | 243 | 231 | 40 (17,3 %)a | 38 | 4 (10,5 %)b | 2.1 | 1.0 | 1.3 |
| 14qE5 | 390 | 372 | 139 (37,4 %)a | 135 | 5 (3,7 %)b | 1.1 | 0.8 | 0.9 |
| 17qA3.3 | 383 | 374 | 99 (26,5 %)a | 95 | 2 (2,1 %)b | 2.1 | 0.6 | 0.8 |
Tableau 2 : Production de souris Floxed par micro-injection. Le tableau montre le taux de natalité et l’efficacité de la production de souris porteuses de l’allèle flox prévu sans intégration aléatoire (rTG) (W/O) de l’ADN du donneur. Il a été possible d’obtenir des souris avec l’allèle flox prévu dans tous les projets. a : Nombre de nouveau-nés/nombre d’embryons transférés; b : nombre de souris porteuses d’allèle flox/nombre de souris examinées. rTG: intégration aléatoire du vecteur donneur; W/O: sans.
Discussion
Dans la présente étude, des zygotes de souris C57BL/6J frais (non congelés-décongelés), obtenus à partir d’accouplement naturel, ont été utilisés pour la production de souris d’édition du génome. En injectant de l’ARNcr-tracrRNA-Cas9 et de l’ADN du donneur (RNPD) dans les deux pronuclei de ces zygotes dans une phase de cycle cellulaire où le knock-in est le plus susceptible de se produire, des souris frappées par cassette de gènes et floxed ont été générées avec un taux de natalité élevé et une efficacité d’édition du génome suffisante. La présente étude renforce l’extensibilité de la méthode SPRINT-CRISPR15, où elle garantit une efficacité de knock-in suffisante même dans le fond génétique C57BL/6J, et peut être appliquée à la production de souris floxées.
L’électroporation est une méthode très généralisée de production de souris génétiquement modifiées en raison du faible coût des dispositifs expérimentaux et de la facilité d’apprentissage de la technique8. De plus, la méthode i-GONAD19, dans laquelle l’édition du génome est effectuée avec des embryons préimplantatoires existant dans l’oviducte, ne nécessite pas de souris receveuse. Par rapport à ces méthodes, la méthode actuelle présentée ici est coûteuse et prend beaucoup de temps lors de la préparation et de la maintenance d’un environnement expérimental en termes de matériel et de logiciel. Cependant, une fois les installations expérimentales mises en place, des souris complexes à cassettes de gènes knock-in et floxed peuvent être produites avec uniquement des éléments CRISPR disponibles dans le commerce (ARNcr, ARNtrac et protéine Cas9) et une simple et petite quantité de vecteur plasmidique circulaire à utiliser comme ADN de donneur. Cela signifie que de nombreuses lignées de souris complexes modifiées par le génome peuvent être produites sans avoir besoin de lsODN 5,6 ou de vecteurs de virus adéno-associés20 qui prennent beaucoup de temps (ou relativement coûteux) pour se préparer.
Contrairement à la méthode originale SPRINT-CRISPR15, des zygotes frais (congelés-décongelés) ont été utilisés. Lors de l’obtention de zygotes frais par accouplement naturel, les erreurs techniques qui peuvent survenir lors de la fécondation in vitro ou de la congélation et de la décongélation peuvent être ignorées. De plus, le processus de manipulation des embryons peut être complété en une demi-journée environ (Figure 1) suivant l’approche actuelle. D’autre part, certaines limites de la méthode actuelle incluent l’exigence de nombreuses souris mâles, le contrôle lâche du moment de la fécondation et la capacité limitée de prédire complètement le nombre de zygotes pour la micro-injection. Par rapport à la méthode originale SPRINT-CRISPR, cette méthode peut avoir un taux de natalité plus élevé (tableau 1). Malgré cela, on ne peut pas conclure que la méthode actuelle est meilleure en termes de taux de natalité en raison des différences dans les conducteurs de l’expérience, les gènes cibles, les antécédents génétiques et le moment de la confirmation de l’embryon.
Comme le montre le tableau 1, un grand nombre de souris dans la plupart des projets de knock-in de cassettes de gènes avaient des allèles d’intégration aléatoires. L’intégration aléatoire doit être éliminée car elle peut entraîner une perturbation involontaire des gènes endogènes et de l’expression ectopique des transgènes. Le défi pour l’avenir est de trouver des conditions expérimentales qui réduisent le nombre d’événements d’intégration aléatoires tout en maintenant une efficacité suffisante en matière de knock-in.
Presque toutes les modifications du génome zygote de souris utilisant des effecteurs d’édition du génome qui entraînent des cassures double brin de l’ADN sont susceptibles d’induire des mutations involontaires sur les sites cibles 9,21. Les résultats de ces mutations involontaires sur la cible ne sont pas décrits ici parce que nous ne sommes pas dans une situation dans laquelle la prochaine génération de souris peut être gérée afin d’en présenter des preuves claires. La meilleure façon d’éliminer le souci de confusion causé par la mutagénèse involontaire sur cible est d’obtenir la prochaine génération de souris en accouplant les fondateurs avec des souris de type sauvage plutôt qu’en croisant les fondateurs. En principe, les souris N1 résultant de ce croisement sont de type sauvage (WT) sur un côté de l’allèle, donc si l’allèle knock-in (KI) prévu est détecté, elles sont hétérozygotes WT/KI. Par conséquent, la mutagénèse sur cible n’est pas un problème critique chez la souris de laboratoire, qui a un cycle de vie relativement rapide et est un animal prolifique. Cependant, d’autres améliorations seront nécessaires lorsque cette technologie sera appliquée à des mammifères relativement grands.
Il a été confirmé que cette technologie peut produire des souris knock-in par cassette génétique dans des souches consanguines autres que C57BL/6J, mais un nombre suffisant de projets ne sont pas sécurisés et les données sont très variables. Pour cette raison, cette information n’est pas incluse dans la présente étude. On pense que d’autres études sur ce sujet seront nécessaires pour faire progresser la génétique de la souris et la recherche sur les modèles de maladies.
Déclarations de divulgation
Les auteurs n’ont déclaré aucun intérêt concurrent.
Remerciements
Ce travail a été soutenu par la recherche scientifique (B) (19H03142: à SM), la recherche scientifique (A) (20H00444: à FS), la recherche scientifique (A) (21H04838: à SM) et la recherche scientifique sur les domaines innovants « Platform of Advanced Animal Model Support » (16H06276: à ST) du ministère de l’Éducation, de la Culture, des Sports, de la Science et de la Technologie. Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’analyse des données, la décision de publier ou la préparation du manuscrit. Nous sommes reconnaissants à Ryoichi Mori pour sa discussion utile sur la conception de l’édition du génome.
matériels
| Name | Company | Catalog Number | Comments |
| Atipamezole Hydrochloride | ZENOAQ | - | |
| Autoclip Wound Clip | BD | 427631 | |
| Autoclip Wound Clip Applier | BD | 427630 | |
| Butorphanol | Meiji Seika Pharma | - | |
| C57BL/6J mice | Jackson Laboratory Japan | - | older than 10 weeks old |
| Calibrated Pipet, 100ul | Drummond Scientific Company | 2-000-100 | for collecting zygote and embryo transfer |
| Cas9 | Thermo Fisher Scientific | A36499 | |
| Cas9 Nuclease Reaction Buffer | NEB | B7203 | |
| CellTram 4r oil | Eppendorf | 5196000030 | |
| CRISPOR | http://crispor.tefor.net/ | web tool for genome editing experiments with the CRISPR-Cas9 system | |
| crRNA | IDT | - | |
| Gel/PCR Extraction Kit | FastGene | FG-91302 | |
| hCG | ASKA Animal Health | - | |
| Hyaluronidase | Merck Sigma-Aldrich | H3884 | |
| ICR mice | Jackson Laboratory Japan | - | older than 10 weeks old, weight 28 G or more |
| Inverted microscope | Leica | ||
| KOnezumi | https://www.md.tsukuba.ac.jp/LabAnimalResCNT/KOanimals/konezumi.html | a web application for automating gene disruption strategies to generate knockout mice | |
| M16 medium | Merck Sigma-Aldrich | M7292 | |
| M2 medium | Merck Sigma-Aldrich | M7167 | |
| Medetomidine | ZENOAQ | - | |
| Micro shears | Natsume Seisakusho | MB-54-1 | |
| Microforge | Narishige | MF-900 | for fire polishing of holding pipette and bending the microinjection needle |
| Micromanipulator units | Narishige | ||
| Micropipette puller | Sutter Instrument | P-1000 | programmable pipette puller |
| Midazolam | Maruishi Pharmaceutical | - | |
| MILLEX-GV 0.22 µm filter | Merck Millipore | SLGV033R | |
| Mineral oil | Nacalai | 26114-75 | for zygote culture and injection chamber |
| Petri dish (35mm, untreated) | Iwaki | 1000-035 | for zygote culture |
| PIEZO micromanipulator | PRIME TECH | PMM-150 | |
| Plasmid Mini Kit | FastGene | FG-90502 | mini prep spin column kit |
| PMM Operation Liquid | PRIME TECH | KIT-A | operation liquid for microinjection |
| PMSG | ASKA Animal Health | - | |
| Polyvinylpyrrolidone | Merck Sigma-Aldrich | P5288 | |
| RNase | QIAGEN | 19101 | |
| RNase Free Water | IDT | - | tracrRNA Accessory Reagents |
| Serrefine clamp | Natsume Seisakusho | C-18 | |
| Sodium dodecyl sulfate | SIGMA | 151-21-3 | |
| Suture needle with thread | Natsume Seisakusho | C11-60B2 | |
| Thin wall borosilicate glass without filament | Sutter Instrument | B100-75-10 | for microinjection needle and holding pipette |
| tracrRNA | IDT | - |
Références
- Suzuki, H., et al. Generation of bicistronic reporter knockin mice for visualizing germ layers. Experimental Animals. 68 (4), 499-509 (2019).
- Le, H. T., et al. Generation of B6-Ddx4(em1(CreERT2)Utr) , a novel CreERT2 knock-in line, for germ cell lineage by CRISPR/Cas9. Genesis. 58 (7), 23367 (2020).
- Osawa, Y., et al. EXOC1 plays an integral role in spermatogonia pseudopod elongation and spermatocyte stable syncytium formation in mice. Elife. 10, 59759 (2021).
- Funato, H., et al. Forward-genetics analysis of sleep in randomly mutagenized mice. Nature. 539 (7629), 378-383 (2016).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nature Communications. 7, 10431 (2016).
- Miura, H., Gurumurthy, C. B., Sato, T., Sato, M., Ohtsuka, M. CRISPR/Cas9-based generation of knockdown mice by intronic insertion of artificial microRNA using longer single-stranded DNA. Scientific Reports. 5, 12799 (2015).
- Murata, K., et al. Efficient induction of proximity-dependent labelling by biotin feeding in BMAL1-BioID knock-in mice. The Journal of Biochemistry. 170 (4), 453-461 (2021).
- Kaneko, T., Mashimo, T. Simple genome editing of rodent intact embryos by electroporation. PLoS One. 10 (11), 0142755 (2015).
- Kuno, A., et al. DAJIN enables multiplex genotyping to simultaneously validate intended and unintended target genome editing outcomes. PLOS Biology. 20 (1), 3001507 (2022).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318 (2018).
- Gurumurthy, C. B., et al. Reproducibility of CRISPR-Cas9 methods for generation of conditional mouse alleles: a multi-center evaluation. Genome Biology. 20 (1), 171 (2019).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Hasegawa, Y., et al. Generation of CRISPR/Cas9-mediated bicistronic knock-in ins1-cre driver mice. Experimental Animals. 65 (3), 319-327 (2016).
- Aida, T., et al. Cloning-free CRISPR/Cas system facilitates functional cassette knock-in in mice. Genome Biology. 16, 87 (2015).
- Abe, T., Inoue, K. I., Furuta, Y., Kiyonari, H. Pronuclear Microinjection during S-phase increases the efficiency of CRISPR-Cas9-assisted knockin of large DNA donors in mouse zygotes. Cell Reports. 31 (7), 107653 (2020).
- Lilue, J., et al. Sixteen diverse laboratory mouse reference genomes define strain-specific haplotypes and novel functional loci. Nature Genetics. 50 (11), 1574-1583 (2018).
- Birling, M. C., et al. A resource of targeted mutant mouse lines for 5,061 genes. Nature Genetics. 53 (4), 416-419 (2021).
- Mizuno-Iijima, S., et al. Efficient production of large deletion and gene fragment knock-in mice mediated by genome editing with Cas9-mouse Cdt1 in mouse zygotes. Methods. 191, 23-31 (2021).
- Ohtsuka, M., et al. i-GONAD: a robust method for in situ germline genome engineering using CRISPR nucleases. Genome Biology. 19 (1), 25 (2018).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/Cas9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Burgio, G., Teboul, L. Anticipating and identifying collateral damage in genome editing. Trends in Genetics. 36 (12), 905-914 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon