Method Article
双极射频切除止血装置辅助的无血腹腔镜脾部分切除术
* 这些作者具有相同的贡献
摘要
本方案描述了双极射频设备辅助腹腔镜脾部分切除术 (LPS) 是安全有效的。LPS 中的双极射频装置可以减少术中出血,达到“无血脾切口”的临床效果,值得临床应用。
摘要
在人体的淋巴系统中,脾脏是最广泛的一个,具有造血、血液滤过、储血和免疫功能。腹腔镜脾部分切除术 (LPS) 作为一种新的保留脾的方法,随着人们对微创治疗和技术设备的发展有了更深入的了解,它越来越多地应用于临床实践中。与传统的开脾切除术相比,LPS 可以尽可能保留正常的脾组织,减少全脾切除术后并发症的发生,减少术后住院时间。用于 LPS 的双极射频切除止血装置可固化脾组织,闭合小血管,减少脾横截面出血,清理手术区域,从而达到“无血脾部分切除术”的理想效果。因此,在严格掌握适应症、充分了解脾脏血管解剖结构的前提下,双极射频切除止血装置在LPS中的应用值得临床推广。
引言
脾脏是人体最广泛的淋巴系统,具有造血、血液滤过、血液储存和免疫功能。脾切除术容易出现并发症,例如血栓栓塞、出血性、感染性、邻近器官的医源性损伤以及压倒性脾切除术后感染 (OPSI)。因此,在手术过程中选择性保留脾脏逐渐引起了临床外科医生的注意 1,2,3。因此,必须保留足够的脾组织以维持脾功能,同时确保完全切除良性脾肿瘤而不复发。随着腹腔镜技术的发展,腹腔镜脾部分切除术 (LPS) 在临床实践中逐渐得到推广,其安全性和有效性得到广泛认可 4,5。LPS 于 1995 年由 Poulin 等人首次报道6。与全脾切除术相比,LPS 的优势在于降低术后并发症的发生率和住院时间。
脾脏有丰富的血液供应。如何控制和减少切除过程中的出血是一个亟待解决的问题,尤其是在 LPS 中。因此,各种止血能量装置应运而生,并应用于LPS,如超声刀7、双极射频装置8,9、双极电凝10、氩离子凝固刀11、超吸刀11、血管闭合装置12。射频电极产生的高频交流电传输到周围组织。双极射频切除止血装置因其精确的射频止血效果而被广泛用于肝切除术,但很少用于部分脾切除术13。这里描述了一种双极射频切除止血装置辅助的无血腹腔镜脾部分切除术方法。使用双极射频电极辅助 LPS 可有效减少术中出血,提高手术的安全性和有效性。该方法的主要目的是通过使用双极射频电极达到无血部分脾切除术的效果,提高手术的安全性和有效性,便于临床推广。该手术可应用于大多数需要部分脾切除术的良性脾疾病。
1 例 19 岁男性患者,无具体病史,体格检查有占据性脾病变 2 周。体格检查未见明显异常。常规血液、凝血和肝功能等实验室检查均正常。腹部彩色多普勒超声显示脾脏和肾脏之间约有 5.6 x 5.1 cm2 的实性区域,被认为起源于左肾上腺。上腹部的增强磁共振成像 (MRI) 显示一个 5.1 x 4.6 cm2 的高信号回合占据了脾脏的上极(图1)。入院诊断显示脾脏有占位性病变,可能是血管瘤。入院后进行术前评估。患者无手术禁忌症。进行 LPS 是因为患者的年龄、全脾切除术后许多可能的并发症以及他的家人愿意接受部分脾切除术。
研究方案
本人体手术方案经南方医科大学珠江医院(中国广州)批准并遵循其伦理准则。已获得患者的知情同意,以发布与其治疗相关的信息和数据。
1. 术前准备
- 手术前禁止患者进食 8 小时,禁止饮水 4 小时。
- 使用全身麻醉和气管插管2.在麻醉师进行充分麻醉后,用常规消毒皮肤和无菌毛巾床单治疗患者。
注意:用碘伏对手术区域消毒 3 次。
2. 手术技术
- 将患者置于仰卧位,双腿分开,头部高,脚低,右侧倾斜 15°。
- 通过气腹针2 建立气腹(参见 材料表)。
注意:气腹压力设置为 13 mmHg。 - 沿着脐带下缘做一个 1 厘米的弯曲切口,穿刺一个 10 毫米的套管针,然后插入腹腔镜(见 材料表)。
注意:剑突下向左穿刺 5、12、5 和 12 毫米,右侧锁骨中线胸腔下方 4 厘米,左锁骨中线与脐横线相交,左腋前线与脐横线相交,分别。 - 通过进入腹腔进行腹部探查,观察和评估 LPS 的可行性。
注:初步评估内容:脾脏大小和外周粘连程度。 - 通过抬起大网膜和横结肠来释放大网膜,并使用超声刀沿横结肠边缘向幽门释放大网膜,从胃大曲率的中间开始。
- 打开胃结肠韧带,松开胃脾韧带。
- 抬起胃,分离,并在胰腺上缘通过胃后部暴露脾动脉。将脾动脉和脾附近脾静脉的上极支分开(图2)。
- 将脾脏向右转动,将脾膈韧带转向右侧,用超声刀切开脾肾韧带的一部分(见 材料表),以完全暴露脾脏的上极。
- 用“Pug”血管阻滞钳夹住脾动脉的上极支,以阻止血液流向脾脏上极,并观察缺血线以确认肿块在缺血性脾切除术的范围内(图3)。
- 使用不可吸收的聚合物结扎夹( 材料 表)进行安全结扎,以断开脾动脉和脾静脉的上极支。
注意:在对脾下极进行部分切除时,分离、暴露、夹住和断开脾动脉和脾静脉的下极分支。 - 在夹层部位的脾动脉主干上放置一根 3.5 毫米(10 Fr)的一次性单腔橡胶导管(见 材料表),作为血管闭塞带,必要时允许阻塞。
- 使用双极射频止血装置(见 材料表)沿脾脏表面的缺血线进行凝固和消融(图4)。
注意: 首选项设置:LAP MODE,功率:120 W。 - 在建立坏死区域凝固后,用超声刀解剖脾脏,在解剖脾脏时观察到没有明显的出血(图5),直到肿块与脾脏的上极一起被切除。
- 将标本放入标本袋中,将左锁骨中线和横脐线交界处的穿刺切口扩大至 4-5 cm,以完全取出标本。
- 用 2-0 可吸收缝合线缝合切口(见 材料表)并冲洗腹腔。
- 确认腹腔无活动性出血后,将可吸收止血材料(见 材料表)放在手术伤口上,然后放置粘合膜。
- 将腹腔镜引流管(见 材料表)放在脾脏部分的内侧边缘,并从左下腹部引出。
- 逐层缝合所有 5 mm 和 12 mm 穿刺针孔。
3. 术后护理
- 通过连续实时心电图仪 (ECG,见 材料表) 监测,密切观察和记录术后前 24 小时内的生命体征。
注意:生命体征:心率、血压、呼吸和脉搏血氧饱和度。 - 术后静脉注射抗生素(头孢唑啉钠,1.5 g 和 100 mL 0.9% 氯化钠溶液,12 h)24 小时,以防止感染。
- 术后 6 小时后开始流质饮食,确保卧床休息 24 小时。
- 术后 24 小时拔除导管。
- 术后 48~72 小时拔除引流管。
结果
患者术后情况良好,被送回病房。手术持续 120 min,术中失血约 100 mL,补液约 2,600 mL,无输血。术中尿量为 600 mL。患者恢复良好,无术后并发症,术后第 6 天出院。术后病理显示脾毛细血管瘤,细胞生长活跃,大小为 4.7 x 4.0 x 3.5 cm3。用超声刀沿坏死区凝固处解剖脾脏,脾脏解剖时无明显出血。脾切片显示凝固坏死组织,无明显的活动性出血(图4,表1)。
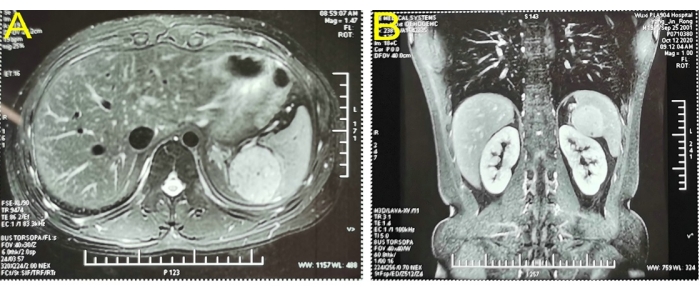
图 1:增强磁共振成像证实了占据脾上极的高信号弹药。 (A) 横断面成像。(B) 冠状位成像。 请单击此处查看此图的较大版本。
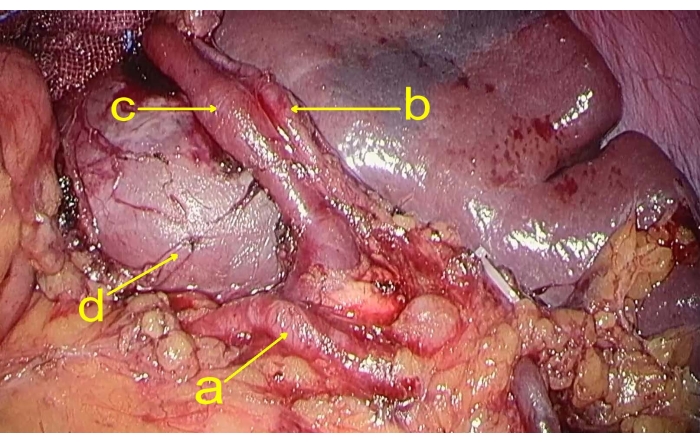
图 2:脾脏的血管分支。 该图显示了 (a) 脾动脉,(b) 脾动脉的上极支,(c) 脾静脉的上极支,以及 (d) 肿瘤。 请单击此处查看此图的较大版本。
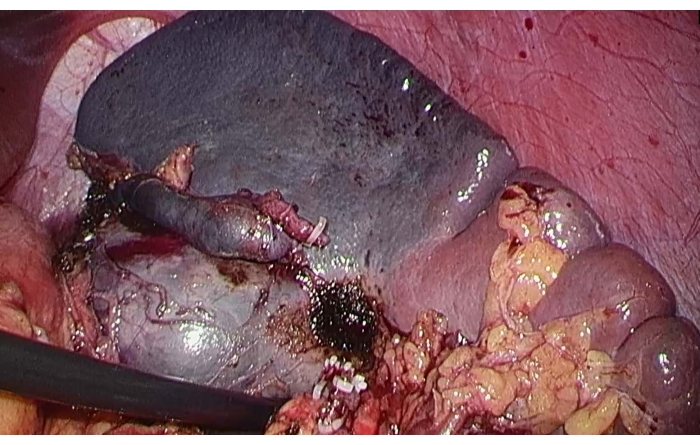
图 3:脾上极的缺血线。 为了在夹住脾动脉的上极支后阻止血液流向脾上极,观察缺血线。 请单击此处查看此图的较大版本。
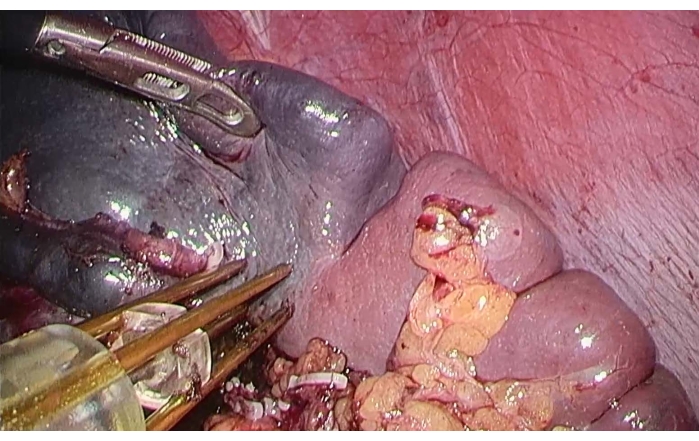
图 4:脾脏双极射频消融术。 为了用镊子抬起脾脏的上极,沿脾表面的缺血线使用双极射频止血装置进行凝固消融。 请单击此处查看此图的较大版本。
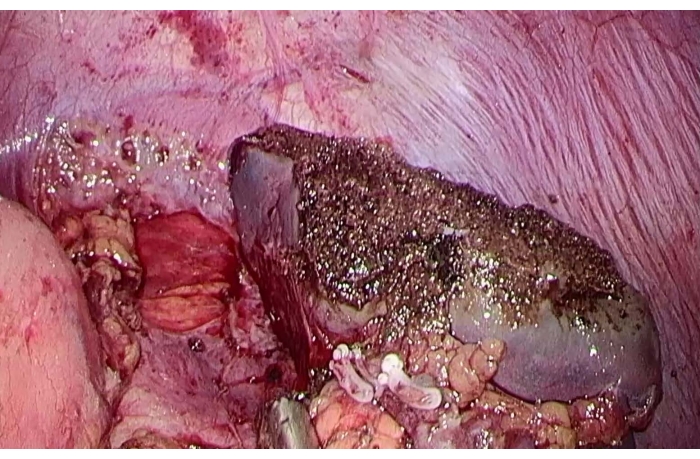
图 5:部分脾切除术后的残余脾切片。 请单击此处查看此图的较大版本。
| 项目 | 结果 |
| OP 时间 (min) | 120 |
| ABL作 (mL) | 100 |
| ABT作 (mL) | 0 |
| 补液 (mL) | 2600 |
| 术后并发症 | 没有 |
| 放电时间 | 术后第 6 天 |
表 1:LPS 的相关结果。 LPS,腹腔镜脾部分切除术;OP,作时间;ABL,失血量;ABT,输血量。
讨论
随着现代医学,尤其是免疫学的发展,人们对脾脏的解剖结构和功能有了更好的了解。过去,由于知识和手术技术的局限性,许多良恶性脾病都采用全脾切除术治疗。1992 年,Delaitre 等人首次报道了腹腔镜脾切除术,腹腔镜技术开始逐渐应用于脾脏手术14。然而,研究表明,全脾切除术后会出现血栓栓塞、出血、感染、邻近器官先天性损伤和危险的术后感染等并发症 2,3。因此,对于脾脏疾病患者,最初的盲切除治疗已逐渐被选择性保留脾治疗所取代,如脾修复缝合、部分脾切除术、脾动脉栓塞术和脾移植术。1995 年,Poulin 等人首次报道了 LPS,这开启了脾外科的新篇章6。随着对脾脏功能、脾小叶与节段性血液供应之间的解剖关系以及各种能量装置的应用有了更全面的了解,LPS 已应用于主要中心的患者 15,16,17,18。LPS 可以在去除病变组织的同时尽可能多地保留脾脏的正常组织,减少全脾切除术后的各种并发症。与开放性部分脾切除术 (OPS) 相比,LPS 需要更长的时间和更多的术中出血。然而,它不会增加术后并发症的发生率并延迟术后恢复。相反,研究表明,与 OPS 相比,LPS 的术后并发症发生率显着降低,术后住院时间显着缩短 18,19,20。
脾脏各节段的血液供应是 LPS 的解剖学基础。主要有二叶和四段类型,即脾上下段、脾中上段、脾中下段。也可分为脾门、中间和外围区域。脾动脉在脾门处分裂成脾小叶血管,包括 1、2、3 和多血管类型。最常见的类型是 2 支和 3 支血管型,其中脾动脉干从脾叶的 2 或 3 根血管分支出来,进入脾脏。在这方面,相邻的脾叶(节段)之间几乎没有动静脉吻合,形成一个不规则的平面,几乎没有血管区。这一解剖学特征在一定程度上证明了部分脾切除术的可行性。部分脾分离可以在相对无血管的区域进行,以减少出血量和出血率21,22。外科医生可以根据具体情况和脾血供应的解剖结构选择不同类型的部分脾切除术。在这种情况下,肿瘤位于脾脏的上部。释放并结扎脾上部的分支血管后,根据进行部分脾切除术的位置,脾表面出现一条清晰的缺血线。
脾血供丰富,切除时需要处理脾实质中的许多血管,导致手术时间长、出血量大、风险高。因此,出现了各种止血能量装置,并应用于 LPS7、8、9、10、11、12、23、24、25。双极射频器件是一种双极射频电极,包含两对 5 cm 长的反向电极,以矩形阵列显示。射频电极产生的高频交流电传输到周围组织。交流电通过组织后,组织中的分子相互摩擦,沿电流方向产生热量,导致细胞缺血坏死,形成约 1 cm 宽的凝固坏死区。2008 年,Habib 教授发明了 Habib 4X 双极射频切割止血电极,并将其用于肝脏切除术,效果可喜26。随后,双极射频装置在主要中心逐渐被推广用于肝切除术。Wang 等人在国内首次使用双极射频装置进行 LPS,并取得了无血脾切除术的治疗效果27。
该患者使用双极射频设备成功接受了 LPS。我们的经验总结如下:(1) 严格的适应症,包括脾外伤、良性脾肿瘤、脾囊肿、血肿,尤其是脾缘血液系统疾病,需要进行脾切除术。脾部分切除术禁用于脾胆囊附近的肿瘤。此外,一些研究表明,至少需要保留 25% 至 30% 的残余脾脏以维持正常的脾脏功能17,18。(2) 术前 CT 和术中超声检查用于阐明病灶、脾动脉及其分支之间的解剖关系。解剖脾动脉干后,放置一次性单腔橡胶导管作为预阻断带,以堵塞脾蒂,并在手术过程中出现大量出血时及时减少出血。通过拉动导管可以完全暴露脾蒂,以保护重要血管并暴露出血部位。(3) 沿脾主动脉朝脾门方向解剖脾动脉,以避免损伤胰腺。注意确定次级脾蒂分支血管的方向。准确夹住待切除的脾叶血管。观察脾脏的缺血边界。由于一些患者的脾动脉分支存在解剖学变异,因此需要仔细识别解剖关系,并且需要小心释放血管。只有当找到缺血线时,才必须切断血管。为确保脾脏的活力,在缺血线供血侧约 1 cm 处确认切除面后,可进行部分脾切除术。(4) 术中作精心,自由度适中,保留脾侧支血管,保护脾二级供血系统。保留脾上极时,不得剪断脾上部和胃韧带,以免损伤胃短血管和脾上极的血液供应。在保留脾下极时,需要保护胃脾韧带的下部(脾结肠韧带),以免损伤左侧胃肠道血管和脾下极的血液供应。(5) 必须为双极射频装置选择合适的功率,并进行深度消融和凝血。消融断开后,使用不可吸收的聚合物锁定夹住血管的破损端,或将较粗的管子结扎并缝合到脾脏部分以合并密封。该患者成功接受了手术,无并发症,验证了双极射频设备辅助 LPS 的安全性和可行性,但仍需要在多中心、大样本量中进一步探索和验证。
这种手术方法主要适用于患有良性脾瘤的年轻患者。不适用于脾大良性肿瘤、脾恶性肿瘤,以及以下情况:残余脾太小,部分切除后丧失功能,脾血管分支因粘连严重或血管异常难以暴露。
总之,双极射频设备辅助 LPS 是安全有效的。在严格掌握适应症、充分了解脾血管解剖结构的前提下,在LPS中应用双极射频装置,可以减少术中出血,达到“无血脾切开”的临床效果,值得临床应用。
披露声明
作者没有什么可披露的。
致谢
这项研究得到了中国国家自然科学基金(第 82072627 号资助)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Absorbable medical film | Shanghai Divine Medical Technology Co., Ltd | 60007 | |
| Bipolar radiofrequency excision hemostatic device | Angio Dynamics, Inc | Rita1500X | Tools for spleen resection and coagulation of small vessels |
| pneumoperitoneum needle | Unimicro Medical Systems Co.,Ltd | 150mm | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medical | 10004, 10006 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | Laparoscopic camera system and supporting display screen |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound knife | Johnson | GEN11 | Tools for spleen resection |
| Vicryl rapide | Ethicon, LLC | 2-0, VCP345H 90010 | Suture incision and Trocar hole |
| Disposable single-cavity rubber catheter | Yangzhou Huayue Technology Development Co., Ltd | 3.5mm (10Fr) | |
| Video system | Lenovo | GK309 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ecg monitoring |
参考文献
- Barmparas, G., et al. Postoperative infection risk after splenectomy: A prospective cohort study. International Journal of Surgery. 17, 10-14 (2015).
- De Pastena, M., et al. Laparoscopic hemi-splenectomy. Surgery Today. 48 (7), 735-738 (2018).
- Costi, R., et al. Spleen hydatidosis treated by hemi-splenectomy: A low-morbidity, cost-effective management by a recently improved surgical technique. International Journal of Surgery. 20, 41-45 (2015).
- Slater, B. J., Chan, F. P., Davis, K., Dutta, S. Institutional experience with laparoscopic partial splenectomy for hereditary spherocytosis. Journal of Pediatric Surgery. 45 (8), 1682-1686 (2010).
- Jiao, H. B. Experience and thinking of laparoscopic splenectomy. Chinese Journal of Clinical Physicians (Electronic Edition). 6 (21), 6660-6661 (2012).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report). Surgical Laparoscopy & Endoscopy. 5 (4), 306-310 (1995).
- Di Mauro, D., Fasano, A., Gelsomino, M., Manzelli, A. Laparoscopic partial splenectomy using the harmonic scalpel for parenchymal transection: two case reports and review of the literature. Acta Biomedica. 92, 2021137(2021).
- Quesada, R., et al. Laparoscopic partial splenectomy for giant cyst using a radiofrequency-assisted device: a case report. Surgical Case Reports. 2 (1), 82(2016).
- Wang, W. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World Journal of Gastroenterology. 21 (11), 3420-3424 (2015).
- Cai, H., et al. Laparoscopic partial splenectomy: A preferred method for select patients. Journal of Laparoendoscopic & Advanced Surgical Techniques. 26 (12), 1010-1014 (2016).
- Godiris-Petit, G., Goasguen, N., Munoz-Bongrand, N., Cattan, P., Sarfati, E. Laparoscopic partial splenectomy using the Harmonic Scalpel. Two case reports. Journal de Chirurgie (Paris). 144 (4), 339-341 (2007).
- Patrzyk, M., Glitsch, A., Hoene, A., von Bernstorff, W., Heidecke, C. D. Laparoscopic partial splenectomy using a detachable clamp with and without partial splenic embolisation). Langenbeck's Archives of Surgery. 396 (3), 397-402 (2011).
- Ma, J., et al. Application value of Habib 4X in laparoscopic partial splenectomy. Chinese Journal of Hepatic Surgery (Electronic Edition). 9 (2), 181-185 (2020).
- Delaitre, B., Maignien, B., Icard, P. Laparoscopic splenectomy). British Journal of Surgery. 79 (12), 1334(1992).
- Poulin, E. C., Mamazza, J. Laparoscopic splenectomy: lessons from the learning curve. Canadian Journal of Surgery. 41 (1), 28-36 (1998).
- Corcione, F., et al. Technical standardization of laparoscopic splenectomy: experience with 105 cases. Surgical Endoscopy. 16 (6), 972-974 (2002).
- Breitenstein, S., Scholz, T., Schafer, M., Decurtins, M., Clavien, P. A. Laparoscopic partial splenectomy. Journal of the American College of Surgeons. 204 (1), 179-181 (2007).
- Lee, S. H., Lee, J. S., Yoon, Y. C., Hong, T. H. Role of laparoscopic partial splenectomy for tumorous lesions of the spleen. Journal of Gastrointestinal Surgery. 19 (6), 1052-1058 (2015).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World Journal of Surgery. 43 (6), 1505-1518 (2019).
- Wang, L., et al. Partial splenectomy is superior to total splenectomy for selected patients with hemangiomas or cysts. World Journal of Surgery. 41 (5), 1281-1286 (2017).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surgical and Radiologic Anatomy. 27 (1), 15-18 (2005).
- Li, Y. B., Cai, Y. Q., Wang, X., Peng, B. Selective splenic pedicle occlusion in laparoscoic partial splenectomy. Chinese Journal of General Surgery. 32 (2), 122-125 (2017).
- Itamoto, T., Fukuda, S., Tashiro, H., Ohdan, H., Asahara, T. Radiofrequency-assisted partial splenectomy with a new and simple device. The American Journal of Surgery. 192 (2), 252-254 (2006).
- Zhang, Z. P., et al. Application value of secondary splenic pedicle separation technology through superior posterior approach of the pancreatic tail in laparoscopic partial splenectomy. Chinese Journal of Digestive Surgery. 17 (4), 405-409 (2018).
- Liu, L. G., et al. Laparoscopic partial splenectomy for splenic solid lesions. Chinese Journal of General Surgery. 33 (5), 398-400 (2018).
- Ayav, A., et al. Liver resection with a new multiprobe bipolar radiofrequency device. Archives of Surgery. 143 (4), 396-401 (2008).
- Wang, W. D., Chen, X. W., Ma, J., Liu, Q. B., Lin, J. Application of HabibTM4X laparoscopic partial splenectomy in the treatment of splenic lymphangioma. Chinese Journal of Surgery. 52 (8), 639-640 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。