Method Article
バイポーラ無線周波切除止血装置による無血腹腔鏡下部分脾臓切除術
* これらの著者は同等に貢献しました
要約
現在のプロトコルは、バイポーラ無線周波デバイス支援腹腔鏡下脾臓部分切除術 (LPS) が安全で効果的であることを説明しています。LPSのバイポーラ無線周波デバイスは、術中出血を減らし、「無血脾臓切開」の臨床効果を達成することができます。
要約
人体のリンパ系の中で、脾臓は最も広範なものであり、造血、血液濾過、血液貯蔵、および免疫機能を持っています。脾臓を温存する新しい方法として、腹腔鏡下脾臓部分切除術(LPS)は、低侵襲治療に対する人々の深い洞察と技術機器の開発により、臨床診療でますます適用されています。LPSは、従来の開脾郭清と比較して、正常な脾臓組織を可能な限り温存し、脾臓全摘出術後の合併症の発生を減らし、術後の入院期間を短縮することができます。LPSに使用されるバイポーラ高周波切除止血装置は、脾臓組織を固化させ、小さな血管を閉じることができるため、脾臓断面の出血を減らし、術野をクリアし、「無血部分脾臓切除術」の理想的な効果を達成することができます。したがって、適応症を厳密に習得し、脾臓の血管解剖学的構造を完全に理解することを前提として、LPSにおけるバイポーラ高周波切除止血装置の適用は、臨床推進に値します。
概要
脾臓は人体で最も広範なリンパ系であり、造血、血液濾過、血液貯蔵、および免疫機能を備えています。脾臓摘出術は、血栓塞栓症、出血性、感染性、隣接臓器への医原性損傷、圧倒的な脾臓摘出術後感染症(OPSI)などの合併症を起こしやすいです。したがって、処置中の脾臓の選択的保存は、臨床外科医1,2,3の注目を集めています。したがって、脾臓の機能を維持しながら、良性の脾臓腫瘍を再発せずに完全に切除するためには、十分な脾臓組織を温存しなければならない。腹腔鏡技術の発展に伴い、腹腔鏡下脾臓部分切除術 (LPS) は臨床現場で徐々に推進され、その安全性と有効性は広く認識されています 4,5。LPSは、1995年にPoulinらによって最初に報告されました6。脾臓全摘出術と比較して、LPSには術後合併症の発生率と入院期間を短縮できるという利点があります。
脾臓は血液供給が豊富です。切除の過程で出血をどのように制御し、減少させるかは、特にLPSにおいて緊急の問題です。したがって、超音波ナイフ7、バイポーラ無線周波デバイス8,9、バイポーラ電気凝固10、アルゴンイオン凝固ナイフ11、スーパー吸引ナイフ11、および血管閉鎖デバイス12など、さまざまな止血エネルギーデバイスが登場し、LPSに適用されます。無線周波数電極によって生成された高周波交流電流は、周囲の組織に伝達されます。バイポーラ高周波切除止血装置は、その正確な高周波止血効果のために肝切除術で広く使用されていますが、脾臓部分切除術ではほとんど使用されていません13。ここでは、バイポーラ高周波切除止血装置による無血腹腔鏡下部分脾臓摘出術の方法が説明されています。バイポーラ無線周波電極支援LPSの使用は、術中出血を効果的に減らし、手術の安全性と有効性を向上させることができます。この方法の主な目的は、バイポーラ無線周波電極を使用して血液を使わない部分脾臓摘出術の効果を達成し、手術の安全性と有効性を改善し、臨床促進を促進することです。この手順は、脾臓部分切除術を必要とするほとんどの良性脾臓疾患に適用できます。
特定の病歴のない19歳の男性患者が、身体検査で脾臓病変の占有の2週間の病歴で病院に入院しました。身体検査では大きな異常は認められませんでした。定期的な血液検査、凝固検査、肝機能などの臨床検査は正常でした。腹部のカラードップラー超音波検査により、脾臓と腎臓の間に約5.6 x 5.1 cm2 の固体領域があり、これは左副腎に由来すると考えられていました。上腹部の増強磁気共鳴画像法(MRI)では、脾臓の上極を占める5.1 x 4.6 cm2 の高信号ラウンドが示されました(図1)。入院診断の結果、脾臓に占有病変があり、おそらく血管腫であることが明らかになりました。入院時に、術前評価が行われました。この患者さんには手術に対する禁忌はありませんでした。LPSは、患者の年齢、脾臓全摘出術後に起こりうる多くの合併症、および彼の家族が脾臓部分摘出術を受ける意欲のために実施されました。
プロトコル
現在の人間の外科プロトコルはによって承認され、の倫理的なガイドラインに従っています、 朱江病院、南医科大学(広州、中国)。インフォームドコンセントは、彼の治療に関連する情報とデータの公開について患者から得られました。
1. 術前準備
- 手術前に8時間の食事と4時間の飲酒を禁止します。
- 気管挿管を伴う全身麻酔を使用する2.麻酔科医が適切な麻酔を行った後、従来の滅菌された皮膚と滅菌タオルシートで患者を治療します。
注:ヨードフォアで手術部位を3回消毒します。
2.手術手技
- 患者を仰臥位に置き、脚を分割し、頭を高く、足を低くし、右側を15°傾けます。
- 気腹針2 で気腹を確定します( 材料の表を参照)。
注:気腹圧は13mmHgに設定されています。 - へその緒の下縁に沿って1cmの湾曲した切開を行い、10mmのトロカールを穿刺してから、腹腔鏡を挿入します( 材料の表を参照)。
注: 剣状突起の下で左に 5、12、5、および 12 mm の穿刺トロカール、右鎖骨中線の胸郭から 4 cm 下、左鎖骨中央線と臍帯横線と交差し、左前腋窩線と臍帯横線をそれぞれ交差させます。 - 腹腔内に入って腹部探索を行い、LPSの実現可能性を観察および評価します。
注:予備評価内容:脾臓のサイズと末梢接着の程度。 - 大網と横結腸を持ち上げて大網を解放し、超音波ナイフを使用して、胃の大湾曲の中央から始めて、横結腸の縁に沿って幽門に向かって大網を解放します。
- 胃結腸靭帯を開き、胃脾靭帯を解放する。
- 胃を持ち上げ、分離し、膵臓の上縁で胃の後ろから脾動脈を露出させます。脾臓動脈と脾臓近くの脾静脈の上極枝を分離します(図2)。
- 脾臓を右に回し、脾横隔膜靭帯を回し、超音波ナイフ( 材料表を参照)で脾腎靭帯の一部を切断して、脾臓の上部極を完全に露出させます。
- 脾臓動脈の上極枝を「Pug」血管遮断鉗子でクランプして脾臓の上極への血流を遮断し、虚血線を観察して、腫瘤が虚血性脾臓切除の範囲内にあることを確認します(図3)。
- 非吸収性ポリマーライゲーションクリップ( 材料表を参照)を使用して安全なライゲーションを行い、脾動脈と脾静脈の上極枝を切断します。
注:脾臓の下極の部分切除を行うときは、脾臓動脈と脾静脈の下極枝を分離、露出、クランプ、および切断します。 - 3.5 mm(10 Fr)の使い捨てシングルキャビティゴム製カテーテル( 材料の表を参照)を解剖部位の脾動脈の主幹に置き、必要に応じて閉塞を可能にする血管閉塞バンドとして機能します。.
- 脾臓表面の虚血線に沿って、バイポーラ高周波止血装置( 材料の表を参照)を使用して凝固とアブレーションを行います(図4)。
メモ:環境設定:ラップモード、電力:120 W。 - 壊死領域の凝固を確立した後、超音波ナイフで脾臓を解剖し、脾臓の解剖中に腫瘤が脾臓の上極とともに除去されるまで、脾臓の解剖中に重大な出血を観察しません(図5)。
- 標本を標本袋に入れ、左鎖骨中央線と臍帯横線の交点にあるトロカール穿刺の切開部を4〜5cmに拡大して、標本を完全に除去します。
- 切開部を2-0吸収性縫合糸( 材料の表を参照)で縫合し、腹腔内を洗浄します。
- 腹腔内に活発な出血がないことを確認した後、手術創に吸収性止血剤( 材料表参照)を貼り、接着膜を貼ります。
- 腹腔鏡下ドレナージチューブ( 材料の表を参照)を脾臓部分の内側の端に配置し、左下腹部から出ます。.
- 5mmと12mmのトロカールの穴をすべて層ごとに縫合します。
3. 術後ケア
- 術後 24 時間のバイタル サインを綿密に観察し、記録します 継続的なリアルタイム心電計 (ECG、 材料の表を参照) モニタリング。
注:バイタルサイン:心拍数、血圧、呼吸、パルスオキシメトリー。 - 術後24時間、抗生物質(セファゾリンナトリウム、1.5g、0.9%塩化ナトリウム溶液100mL、12時間)を静脈内投与し、感染を予防します。
- 術後6時間後に流動食を開始し、24時間安静を確保します。
- 術後24時間でカテーテルを取り外してください。
- 術後48~72時間でドレナージチューブを取り外す。
結果
手術後、患者は元気になり、病棟に戻されました。手術は120分間続き、術中に約100mLの失血と約2,600mLの輸血が行われました。術中の尿量は600mLでした。術後合併症もなく順調に回復し、術後6日目に退院しました。術後の病理は、活発な細胞増殖と 4.7 x 4.0 x 3.5 cm3 のサイズを伴う脾臓毛細血管腫を示しました。脾臓は、壊死領域の凝固に沿って超音波ナイフで解剖され、脾臓の解剖中に重大な出血は見られませんでした。脾臓切片は、明らかな活動性出血を伴わずに凝固した壊死組織を示しました(図4、表1)。
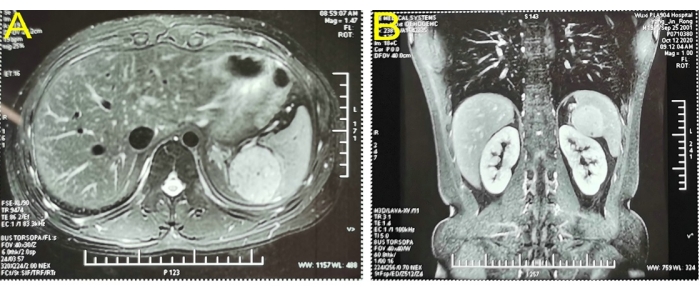
図1:磁気共鳴画像法の強化により、脾臓の上極を占める超信号ラウンドが確認されました。(B)コロナルビューイメージング。この図の拡大版を表示するには、ここをクリックしてください。
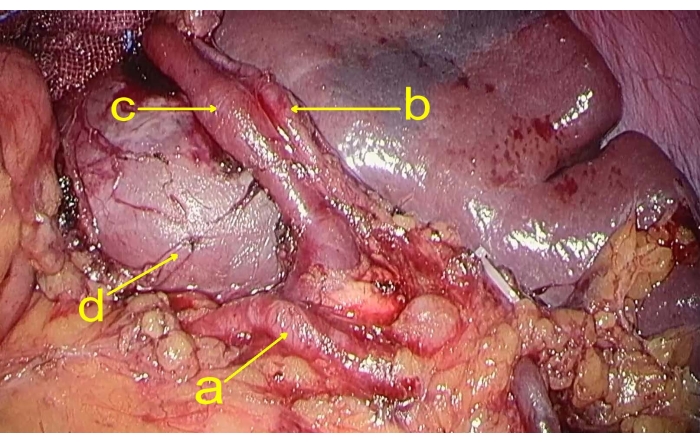
図2:脾臓の血管枝。 図は、(a)脾動脈、(b)脾動脈の上極枝、(c)脾静脈の上極枝、および(d)腫瘍を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
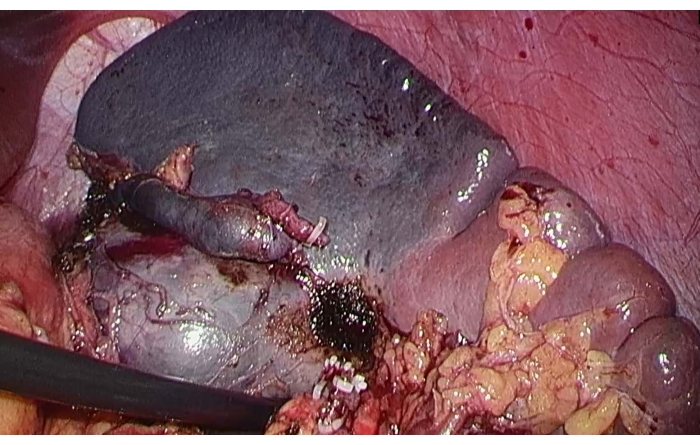
図3:脾臓の上極の虚血線。 脾動脈の上極枝をクランプした後、脾臓の上極への血流を遮断するために、虚血線が観察されました。 この図の拡大版を表示するには、ここをクリックしてください。
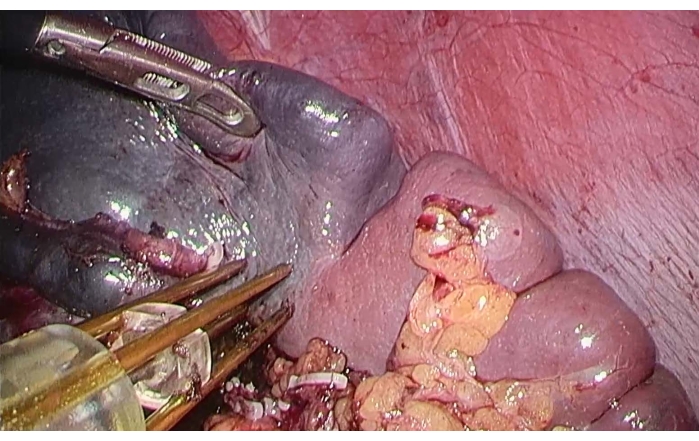
図4:脾臓のバイポーララジオ波アブレーション。 鉗子で脾臓の上極を持ち上げるために、バイポーラ無線周波止血装置を脾臓表面の虚血線に沿って使用して、凝固とアブレーションを行いました。 この図の拡大版を表示するには、ここをクリックしてください。
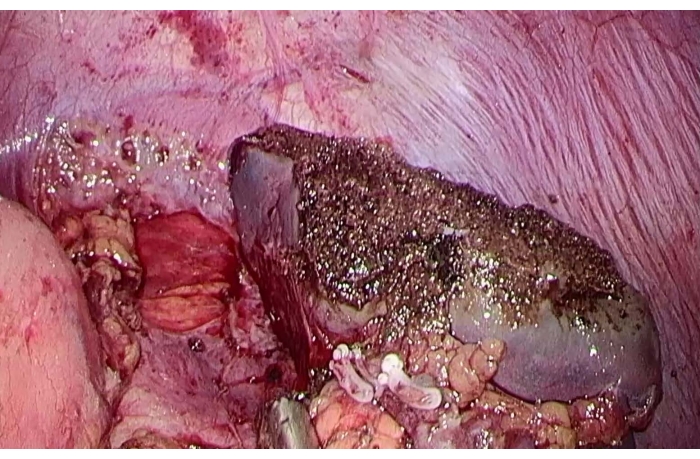
図5:脾臓部分切除術後の残存脾臓切片。 この図の拡大版を表示するには、ここをクリックしてください。
| 項目 | 業績 |
| OP時間(分) | 120 |
| オペレーションABL(mL) | 100 |
| オペレーションABT(mL) | 0 |
| 液剤補充(mL) | 2600 |
| ポストップ合併症 | 何一つ |
| 放電時間 | 術後6日目 |
表1:LPSの関連する結果。 LPS、腹腔鏡下脾臓部分切除術;OP、操作時間;ABL、失血量;ABT、輸血の量。
ディスカッション
現代医学、特に免疫学の発展に伴い、脾臓の解剖学的構造と機能についての理解が深まっています。過去には、多くの良性および悪性の脾臓疾患は、知識と外科的技術の限界のために脾臓全摘出術によって治療されていました。1992年、Delaitreらは初めて腹腔鏡下脾臓摘出術を報告し、腹腔鏡技術は徐々に脾臓手術に適用され始めた14。しかし、研究によると、血栓塞栓症、出血、感染症、隣接臓器への先天性損傷、危険な術後感染症などの合併症が脾臓全摘出術後に発生することが示されています2,3。したがって、脾臓疾患の患者にとって、最初の盲検切除治療は、脾臓修復縫合糸、部分脾臓切除術、脾動脈塞栓術、脾臓移植などの選択的脾臓温存療法に徐々に置き換えられてきました。1995年、PoulinらはLPSを初めて報告し、脾臓外科6の新しい章を開きました。脾臓の機能、脾小葉と分節血液供給との間の解剖学的関係、およびさまざまなエネルギーデバイスの適用をより包括的に理解することで、LPSは主要なセンターの患者に適用されています15,16,17,18。LPSは、脾臓の正常組織をできるだけ温存しながら、患部組織を切除することができ、脾臓全摘出術後の様々な合併症を軽減します。開腹脾臓部分切除術(OPS)と比較して、LPSはより長い時間とより多くの術中出血を必要とします。ただし、術後合併症の発生率を高めたり、術後の回復を遅らせたりすることはありません。それどころか、研究によると、LPS は OPS 18,19,20 よりも術後合併症の発生率が大幅に低く、術後入院期間が大幅に短いことが示されています。
脾臓の各セグメントへの血液供給は、LPSの解剖学的基礎です。主に2葉と4つのセグメントのタイプ、すなわち、脾臓の上部と下部のセグメント、脾臓の中央と上部のセグメント、脾の中央と下部のセグメントがあります。また、脾臓ヒラー、中期、末梢部に分けることができます。脾動脈は、脾子門で脾葉状小葉血管に分かれ、1、2、3、および多血管タイプが含まれます。最も一般的なタイプは2血管型と3血管型で、脾臓動脈の幹が脾葉の2つまたは3つの血管から分岐して脾臓に入ります。これに関して、隣接する脾臓葉(セグメント)の間には動静脈吻合がほとんどなく、血管帯がほとんどない不規則な平面を形成する。この解剖学的特徴は、脾臓部分切除の実現可能性をある程度正当化します。部分的な脾の分離は、出血の量と速度を減らすために、比較的無血管ゾーンで行うことができます21,22。外科医は、特定の状態や脾臓血液供給の解剖学的構造に応じて、さまざまなタイプの脾臓部分切除を選択できます。この場合、腫瘍は脾臓の上部にありました。脾臓の上部にある枝血管を解放して結紮した後、部分的な脾臓摘出術が行われる場所に基づいて、脾臓の表面に明確な虚血線が現れました。
脾臓は血液供給が豊富で、切除中に脾臓実質の多くの血管を処理する必要があるため、手術時間が長く、出血が多く、リスクが高くなります。したがって、さまざまな止血エネルギーデバイスが登場し、LPS7,8,9,10,11,12,23,24,25に適用されています。バイポーラ無線周波デバイスは、長方形の配列に表示された長さ5cmの逆電極を2組含むバイポーラ無線周波数電極です。無線周波数電極によって生成された高周波交流電流は、周囲の組織に伝達されます。交流電流が組織を通過した後、組織内の分子同士が擦れ合い、電流方向に沿って熱を発生し、細胞の虚血性壊死を引き起こし、幅約1cmの凝固性壊死帯を形成します。2008年、ハビブ教授はハビブ4Xバイポーラ無線周波切断止血電極を発明し、肝臓切除に使用し、有望な結果をもたらしました26。その後、バイポーラ無線周波デバイスは、主要なセンターで肝切除術のために徐々に推進されました。Wangらは、中国で初めてLPSにバイポーラ無線周波デバイスを使用し、無血脾臓摘出術の治療結果を達成しました27。
この患者は、バイポーラ無線周波デバイスを使用してLPSを成功させました。私たちの経験は次のように要約されます:(1)脾臓への外傷、良性脾臓腫瘍、脾臓嚢胞、血腫、特に脾臓縁の血液障害を含む厳格な適応症は、脾臓摘出術を必要としました。脾臓部分切除術は、脾臓胆嚢近くの腫瘍には禁忌でした。さらに、いくつかの研究では、正常な脾臓機能を維持するためには、残存脾臓の少なくとも25%から30%を保存する必要があることが示されています17,18。(2)術前CTと術中超音波検査を用いて、病変部、脾動脈、その枝との解剖学的関係を明らかにした。脾動脈幹を解剖した後、プレブロッキングバンドとして使い捨てのシングルキャビティゴムカテーテルを留置し、手術中に大量の出血があった場合に脾椎弓根を塞ぎ、時間通りに出血を減らしました。脾臓の茎は、カテーテルを引っ張って重要な血管を保護し、出血部位を露出させることで完全に露出させることができます。(3)脾臓動脈は、膵臓の損傷を避けるために、主脾動脈に沿って脾門に向かって解剖されました。二次脾茎の枝血管の方向を特定することに注意が払われました。切除する脾葉の血管は正確に固定されていました。脾臓の虚血性境界が観察された。一部の患者は脾臓動脈の枝に解剖学的変異を持っているため、解剖学的関係の慎重な識別が必要であり、血管を慎重に解放する必要があります。虚血線が見つかった場合にのみ、血管を切断する必要があります。脾臓の生存率を確保するために、虚血性ラインの血液供給側の約 1 cm の切除面を確認した後、脾臓部分切除術を行うことができます。(4)術中手術は適度な自由度で入念に行われ、脾臓の側副血管は脾臓の二次血液供給システムを保護するために保存されました。脾臓の上極を保存するときは、短い胃血管と脾臓の上極への血液供給が損傷しないように、脾臓の上部と胃靭帯を切断してはなりません。脾臓の下極を温存する場合、胃脾靭帯(脾結腸靭帯)の下部を保護して、左の胃腸血管と脾臓の下極への血液供給を損傷しないようにする必要があります。(5)バイポーラ無線周波デバイスに適した電力を選択し、深部アブレーションと凝固を行う必要があります。アブレーション切断後、血管の壊れた端を非吸収性ポリマーロッククリップを使用してクランプするか、より厚いチューブを結紮して脾臓部分に縫合し、シールをマージしました。この患者は合併症なく手術を成功裏に受け、バイポーラ無線周波デバイス支援LPSの安全性と実現可能性を検証しましたが、多施設の大きなサンプルサイズでのさらなる調査と検証がまだ必要です。
この外科的方法は、主に良性の脾臓腫瘍の若い患者に適用されます。脾臓の大きな良性腫瘍、脾臓の悪性腫瘍、および次の状況には適していません:残存脾臓が小さすぎて部分切除後に機能を失うこと、および脾臓血管の枝が深刻な癒着または血管異常のために露出するのが困難です。
結論として、バイポーラ無線周波デバイス支援LPSは安全で効果的です。適応症を厳密に習得し、脾臓の血管解剖学的構造を完全に理解することを前提として、LPSにバイポーラ高周波デバイスを適用すると、術中の出血を減らし、臨床応用に値する「無血脾臓切開」の臨床効果を達成できます。
開示事項
著者は何も開示していません。
謝辞
本研究は、中国国家自然科学基金会(Grant No. 82072627)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Absorbable medical film | Shanghai Divine Medical Technology Co., Ltd | 60007 | |
| Bipolar radiofrequency excision hemostatic device | Angio Dynamics, Inc | Rita1500X | Tools for spleen resection and coagulation of small vessels |
| pneumoperitoneum needle | Unimicro Medical Systems Co.,Ltd | 150mm | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medical | 10004, 10006 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | Laparoscopic camera system and supporting display screen |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound knife | Johnson | GEN11 | Tools for spleen resection |
| Vicryl rapide | Ethicon, LLC | 2-0, VCP345H 90010 | Suture incision and Trocar hole |
| Disposable single-cavity rubber catheter | Yangzhou Huayue Technology Development Co., Ltd | 3.5mm (10Fr) | |
| Video system | Lenovo | GK309 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ecg monitoring |
参考文献
- Barmparas, G., et al. Postoperative infection risk after splenectomy: A prospective cohort study. International Journal of Surgery. 17, 10-14 (2015).
- De Pastena, M., et al. Laparoscopic hemi-splenectomy. Surgery Today. 48 (7), 735-738 (2018).
- Costi, R., et al. Spleen hydatidosis treated by hemi-splenectomy: A low-morbidity, cost-effective management by a recently improved surgical technique. International Journal of Surgery. 20, 41-45 (2015).
- Slater, B. J., Chan, F. P., Davis, K., Dutta, S. Institutional experience with laparoscopic partial splenectomy for hereditary spherocytosis. Journal of Pediatric Surgery. 45 (8), 1682-1686 (2010).
- Jiao, H. B. Experience and thinking of laparoscopic splenectomy. Chinese Journal of Clinical Physicians (Electronic Edition). 6 (21), 6660-6661 (2012).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report). Surgical Laparoscopy & Endoscopy. 5 (4), 306-310 (1995).
- Di Mauro, D., Fasano, A., Gelsomino, M., Manzelli, A. Laparoscopic partial splenectomy using the harmonic scalpel for parenchymal transection: two case reports and review of the literature. Acta Biomedica. 92, 2021137(2021).
- Quesada, R., et al. Laparoscopic partial splenectomy for giant cyst using a radiofrequency-assisted device: a case report. Surgical Case Reports. 2 (1), 82(2016).
- Wang, W. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World Journal of Gastroenterology. 21 (11), 3420-3424 (2015).
- Cai, H., et al. Laparoscopic partial splenectomy: A preferred method for select patients. Journal of Laparoendoscopic & Advanced Surgical Techniques. 26 (12), 1010-1014 (2016).
- Godiris-Petit, G., Goasguen, N., Munoz-Bongrand, N., Cattan, P., Sarfati, E. Laparoscopic partial splenectomy using the Harmonic Scalpel. Two case reports. Journal de Chirurgie (Paris). 144 (4), 339-341 (2007).
- Patrzyk, M., Glitsch, A., Hoene, A., von Bernstorff, W., Heidecke, C. D. Laparoscopic partial splenectomy using a detachable clamp with and without partial splenic embolisation). Langenbeck's Archives of Surgery. 396 (3), 397-402 (2011).
- Ma, J., et al. Application value of Habib 4X in laparoscopic partial splenectomy. Chinese Journal of Hepatic Surgery (Electronic Edition). 9 (2), 181-185 (2020).
- Delaitre, B., Maignien, B., Icard, P. Laparoscopic splenectomy). British Journal of Surgery. 79 (12), 1334(1992).
- Poulin, E. C., Mamazza, J. Laparoscopic splenectomy: lessons from the learning curve. Canadian Journal of Surgery. 41 (1), 28-36 (1998).
- Corcione, F., et al. Technical standardization of laparoscopic splenectomy: experience with 105 cases. Surgical Endoscopy. 16 (6), 972-974 (2002).
- Breitenstein, S., Scholz, T., Schafer, M., Decurtins, M., Clavien, P. A. Laparoscopic partial splenectomy. Journal of the American College of Surgeons. 204 (1), 179-181 (2007).
- Lee, S. H., Lee, J. S., Yoon, Y. C., Hong, T. H. Role of laparoscopic partial splenectomy for tumorous lesions of the spleen. Journal of Gastrointestinal Surgery. 19 (6), 1052-1058 (2015).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World Journal of Surgery. 43 (6), 1505-1518 (2019).
- Wang, L., et al. Partial splenectomy is superior to total splenectomy for selected patients with hemangiomas or cysts. World Journal of Surgery. 41 (5), 1281-1286 (2017).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surgical and Radiologic Anatomy. 27 (1), 15-18 (2005).
- Li, Y. B., Cai, Y. Q., Wang, X., Peng, B. Selective splenic pedicle occlusion in laparoscoic partial splenectomy. Chinese Journal of General Surgery. 32 (2), 122-125 (2017).
- Itamoto, T., Fukuda, S., Tashiro, H., Ohdan, H., Asahara, T. Radiofrequency-assisted partial splenectomy with a new and simple device. The American Journal of Surgery. 192 (2), 252-254 (2006).
- Zhang, Z. P., et al. Application value of secondary splenic pedicle separation technology through superior posterior approach of the pancreatic tail in laparoscopic partial splenectomy. Chinese Journal of Digestive Surgery. 17 (4), 405-409 (2018).
- Liu, L. G., et al. Laparoscopic partial splenectomy for splenic solid lesions. Chinese Journal of General Surgery. 33 (5), 398-400 (2018).
- Ayav, A., et al. Liver resection with a new multiprobe bipolar radiofrequency device. Archives of Surgery. 143 (4), 396-401 (2008).
- Wang, W. D., Chen, X. W., Ma, J., Liu, Q. B., Lin, J. Application of HabibTM4X laparoscopic partial splenectomy in the treatment of splenic lymphangioma. Chinese Journal of Surgery. 52 (8), 639-640 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved