Method Article
形成、限制和观察基于微管的主动向列
摘要
这里介绍的是从微管和驱动蛋白马达制备活性向列的方法,包括蛋白质制备和构建以及使用孔进行主动向列限制。
摘要
生物聚合物活性相的形成已成为有兴趣探索活性液晶新兴领域及其在细胞生物学中可能作用的研究人员的重要技术。这些新型系统由自我驱动的子单元组成,这些子单元在本地消耗能量,产生不平衡的动态流体。为了形成本报告中描述的活性液晶相,将包括生物聚合物和分子马达在内的纯化蛋白质组分组合在一起,并且在三磷酸腺苷(ATP)存在下自发形成活性向列相。为了观察向列状态,必须将材料限制在合适的几何形状中,以便以足够高的密度进行显微镜检查。本文描述了使用微管和驱动蛋白马达形成活性向列相的两种不同方法:在油水界面组装二维活性层和使用弹性井在油层下组装。还描述了将活性材料插入不同形状的小孔中的技术。
引言
活性流体由能量驱动的颗粒或元素组成,这些颗粒或元素从当地环境中吸取燃料。在适当的条件下,这些运动活性元件可以共同作用,在长尺度上产生涌现的流体动力学。在文献中有很多这种失衡相行为的例子,活跃相可以在生命系统的光谱中找到。一些值得注意的例子是细菌菌落1,细胞片2,3和生物群或成群4,5。活性相也在细胞骨架丝的浓缩相中被广泛研究,无论是作为细胞6的一部分,还是在设计用于利用生物提取成分7,8,9的合成系统中。在由生物提取物组装的天然和合成系统中,液晶有序和拓扑缺陷的形成是研究界特别感兴趣的。近年来,研究小组已经研究了这些系统,它们的基本物理性质以及它们与生物学的相关性2,3,10,11。
本文重点研究微管和驱动蛋白运动蛋白组合形成活性向列状态。传统的向列液晶是物质的平衡相,其中组成分子表现出取向顺序。例如,由相对刚性的棒状分子组成的流体可能既表现出向列相,又在较高温度下表现出非定向各向同性流体相12。活性向列期的第一个实验实例是由Sanchez等人开发的13,它改编了早期的体外实验14,其中使用运动蛋白簇在相邻微管束之间产生剪切运动。当这个微管系统被限制在薄层中时,出现了自发的向列顺序。近年来,几个实验15,16和理论17,18研究小组对主动向列状态进行了深入研究,重点是活动湍流(流体产生自我驱动的混沌流的状态19)和移动拓扑缺陷等现象。本文描述了在不同实验几何形状中从微管和驱动蛋白马达制备和形成活性向列态的方法。首先,描述了不同组分溶液的制备方法,然后描述了使用两种不同流动室几何形状形成活性向列的方法。图中显示了典型的成像结果。最后,描述了将活性向列限制在井和渠道中的方法。
研究方案
1. 准备活性材料
注意:2D 主动向列通过三步过程组装。首先,制备两种单独的溶液:a)聚合的稳定微管和b)MIX(含有驱动蛋白马达的溶液)。这些被结合,并在添加三磷酸腺苷(ATP)时开始活性。然后将材料限制在合适的几何形状中,使其密度足够高以出现向列顺序。包括用于制备所有必要组分以及如何组装活性相的协议。
- 驱动蛋白簇制备
- 按照Edgar C. Young20的方案,从大肠杆菌中表达和纯化重组K401-BIO运动蛋白(K401马达)。
注意:K401-BIO运动蛋白是二聚体的,由两个与螺旋柄连接的头部组成。这些电机由布兰代斯生物材料设施提供,并按照先前报道的16使用。为了形成活性向列,驱动蛋白分子被生物素化,然后通过链霉亲和素键连接以形成多达四个电机的驱动蛋白簇13,15,21,22。用绿色荧光蛋白(GFP)标签表达驱动蛋白是有帮助的。 - 在冰上纯化和孵育链霉亲和素和马达40分钟后,将K401马达在液氮中以5μL等分试样以0.7mg / mL的终浓度快速冷冻,并储存在-80°C。
注意:实验可以在此处暂停。需要时轻轻解冻驱动蛋白,不要重新冷冻。 - 通过在 4 °C 下将 24 体积% 的 0.7 mg/mL K401 马达、27 体积% 的 0.325 mg/mL 链霉亲和素和 3 体积% 的 5 mM 二硫苏糖醇 (DTT)(以防止聚集)在 46 体积% M2B 缓冲液(80 mM 管道 [1,4-哌嗪二烷磺酸,pH 6.8]、2 mM MgCl2 和 1 mM EGTA [乙二醇-双(β-氨基乙醚)-N,N,N′,N′-四乙酸])。让KSA在冰上孵育40分钟。
- 按照Edgar C. Young20的方案,从大肠杆菌中表达和纯化重组K401-BIO运动蛋白(K401马达)。
- 微管溶液制备
注意:鸟苷-5'-[(α,β)-甲基烯基]三磷酸钠盐(GMPCPP)是鸟苷三磷酸(GTP)的缓慢水解类似物,在GMPCPP存在下形成的微管比GTP微管23 硬三倍或更短。使用短而硬的微管有利于活性向列相的形成,因为这些因素结合在一起促进液晶排序。- 使用0.6mM GMPPPP以6mg / mL的微管蛋白浓度聚合未标记的环状微管蛋白(99%,参见 材料表)。
注意:高质量的微管蛋白也可以按照既定的方案从牛或猪脑中纯化,或者从其他可靠的来源获得,例如布兰迪斯生物材料设施,在那里材料可以冷冻运输以防止损坏。对于从牛脑中纯化微管蛋白,请参阅Bate等人发表的方案24。对于从猪脑中纯化微管蛋白,请参阅Castoldi等人25 和Tayar等人26发表的协议。 - 在准备聚合时,准备37°C的热浴并将离心机预冷至4°C。 将 M2B 缓冲液(步骤 1.1.3)中的未标记微管蛋白溶液与 4 mol% 罗丹明标记的微管蛋白(参见 材料表)合并到 500 μL 超速离心管中,以聚合后产生 4% 标记的微管。
- 使用布拉德福德测定法验证微管蛋白浓度27.离心管中的总微管蛋白浓度应为6.5-6.9mg / mL。
- 将微管蛋白混合物在冰上孵育10分钟,并在4°C下以352,700× g 超速离心10分钟。 此步骤可去除功能失调的微管蛋白,该微管蛋白将位于颗粒中。
- 使用移液管,小心地将含有功能性微管蛋白的上清液提取到微量离心管中。加入GMPPPP至终浓度为0.6mM以诱导微管蛋白聚合,DTT加入至终浓度为1mM以防止蛋白质聚集。
- 将混合物在37°C的热浴中孵育30分钟,然后在室温下以14,000× g 再次离心10分钟。除去上清液,然后用 M2B 缓冲液稀释沉淀,以达到 6 mg/mL 的最终微管浓度。
注意:该溶液可以在使用前在室温下储存至少4小时。 - 为了检查微管是否已成功聚合,用M2B缓冲液和移液器在显微镜载玻片上以100:1稀释1μL微管溶液。盖上盖玻片,使用荧光显微镜(参见 材料表)和40倍物镜进行成像。
注意:根据微管上使用的荧光标记选择激发和发射波长。在该协议中,使用罗丹明标记(参见步骤1.2.2),因此使用515-560nm的激发带和590nm长通滤光片进行成像。 图 1 显示了一个代表性示例。 - 聚合完成后,将微管作为2μL等分试样在液氮中滴冷冻并储存在-80°C(如果需要)。
- 使用0.6mM GMPPPP以6mg / mL的微管蛋白浓度聚合未标记的环状微管蛋白(99%,参见 材料表)。
- 混合体的制备
注意:MIX是一种水溶液,包括驱动蛋白-链霉亲和素簇(KSA)。制备的MIX应在实验前以4μL等分试样储存在-80°C。当MIX在室温下与ATP和步骤1.2中描述的微管溶液结合时,活性开始。MIX的制备方法如下13,19。- 通过混合两种抗氧化剂溶液来制备防止荧光褪色(抗褪色)的溶液。以 1:1 的体积比组合 AO1(250 mM DTT,65 mM 过氧化氢酶)和 AO2(750 μM 过氧化氢酶,3 mM 葡萄糖氧化酶)。包括 20 mM Trolox,另一种用于减少荧光显微镜造成的损害的抗氧化剂。
- 通过制备KSA溶液(如步骤1.1.3中所述)来制备MIX,该溶液包括6wt%20kDa聚乙二醇(PEG)以诱导微管捆绑,3体积%抗淬灭和5体积%丙酮酸激酶/乳酸脱氢酶(PKLDH)在70mg / mL用于ATP再生。
2. 创建主动向列
注意:材料中的活性由 ATP 添加启动。通过添加浓度足够高的ATP来诱导运动活动,为每个实验新鲜准备活性网络。为了形成均匀的,完全发育的活性向列相,微管必须具有足够高的密度。这可以通过将微管限制在两个不混溶流体之间以形成二维(2D)活性向列层来实现。该方法最初是在布兰迪斯大学13 开发的,并且仍然是生产均匀,高质量,活性向列相的流行技术。
- 用于主动向列形成的流通池法
- 用丙烯酰胺涂层制备亲水盖玻片。
- 用肥皂水,乙醇和0.1M NaOH彻底清洁盖玻片,并使用纳米纯水交替冲洗。冲洗后,用由 100 mL 乙醇、1 mL 乙酸和 500 μL 3-(三甲氧基硅基)丙基甲基丙烯酸酯组成的硅烷溶液涂覆盖玻片 15 分钟,然后用纳米纯水冲洗。
- 从95mL纳米纯水和5mL40wt%丙烯酰胺制备丙烯酰胺溶液,然后在真空烤箱中脱气30分钟。
- 加入 35 μL 四甲基乙二胺 (TEMED) 以获得 2.3 mM 终浓度,然后加入 0.07 g 过硫酸铵。将丙烯酰胺溶液倒在盖玻片上,同时面朝上并在室温下孵育过夜。
- 准备疏水显微镜载玻片。将 100 μL 憎水溶液(参见 材料表)移液到干净的玻璃显微镜载玻片上,然后将另一张干净的载玻片放在顶部。这确保了防水溶液在其放置的表面上均匀涂覆2分钟。2分钟后,取出第二张载玻片,用纳米纯水彻底冲洗第一张载玻片,然后用氮气干燥。用丙酮轻轻清洁胶带放置的区域(图案周围),以确保防水溶液不会阻止粘附到玻璃上。
- 准备含有1.8%(v / v)008-氟表面活性剂的工程油混合物(见 材料表)。
- 使用40μm双面粘性垫片将载玻片和盖玻片与流通池底部的疏水载玻片和亲水盖玻片组装为三明治几何形状的上表面。将间隔1.5毫米的垫片放在疏水显微镜载玻片上。然后将丙烯酰胺涂层的盖玻片放在垫片的顶部,处理过的面朝下以粘附。确保在钝器的压力下完成粘附。
注意:目标是组装内部具有扁平油/水界面的流通池(图2A,B)。这是活动层将形成的地方。替代间隔带和薄膜也可用于生产类似的细胞厚度。 - 构建流通池后,立即将油混合物移液到流通池中,填充封闭空间。
- 使用移液器,在单独的小瓶中将 6 μL 活性材料与 3.73 μL MIX、1 μL 微管溶液、0.6 μL ATP 溶液(浓度可以变化以改变微管速度)和 0.67 μL M2B 缓冲液轻轻混合。
- 将新鲜混合的活性材料移液到流通池的一个开口端中,体积会有所不同,但应超过流通池的体积(大约 3-6 μL)。一些油在注入通道时会被水溶液置换;这可以用一小张薄纸在流道的另一端吸干。
- 填充后,用环氧胶密封流通池的两侧(参见 材料表),当暴露在紫外线下20秒时会变硬。
注意:此时,活性材料形成一个3D网络,该网络仍然悬浮在水层中。 - 为了将活性层限制在准2D层中的两种不混溶流体之间,请将流通池置于水平桶离心机中(参见 材料表),水相在顶部,致密油层在下面。以212 x g 离心10分钟。完成此步骤后,可以将流通池带到落射荧光显微镜,用10倍或20倍放大镜进行成像。 图2C,D 显示了此步骤之前和之后的典型图像。
- 用丙烯酰胺涂层制备亲水盖玻片。
- 活性向列形成的倒置方法
注意:步骤2.1中描述的另一种方法是将活性向列层组装在限制在PDMS深井28中的厚油层之下。这种方法产生类似的结果,并且更容易掌握;但是,使用这种方法的图像质量通常不如流通池方法好。- 使用弹性体固化剂和弹性体基料制备聚二甲基硅氧烷(PDMS)(见 材料表)。使用金属刮刀以 1:10 的比例混合两种成分。混合过程中会出现难以去除的微小气泡,混合物呈乳白色。要去除这些气泡,请将混合物置于真空下脱气1小时,之后未固化的PDMS应呈透明。
注意:PDMS现在可以使用模具形成任何形状,或者它可以在容器中固化,然后以所需的图案进行切割或冲孔。 - 将PDMS倒入合适的模具中,放置过夜,在60°C下固化。
注意:未经处理,固化的PDMS表面是疏水的,但通过表面处理,它可以变得亲水。 - 为了制备亲水性PDMS表面,用丙烯酰胺聚合物刷29涂覆PDMS。此步骤还可以防止蛋白质粘附在表面。
- 首先用乙醇和异丙醇清洁PDMS10分钟,然后用去离子水彻底冲洗3x并干燥。使用等离子清洁剂5分钟清洁干燥,固化的PDMS。此步骤使表面更具亲水性。
- 接下来,制备硅烷溶液(98.5重量%乙醇,1重量%乙酸和0.5重量%甲基丙烯酸三甲氧基硅基丙酯),并将底物浸入该溶液中15分钟以准备丙烯酰胺涂层。用去离子水彻底冲洗底物并浸入丙烯酰胺溶液(2 wt% 丙烯酰胺/双溶液、2.3 mM TEMED 和 3 mM 过硫酸铵)。
注意:这些基质可以在室温下储存在玻璃培养皿中的丙烯酰胺溶液中,应在2周内使用。
- 准备使用时,用去离子水冲洗表面并用氮气干燥以立即使用。将活性混合物(如步骤2.1.6中所述)加入孔中,并立即在顶部加入硅油至约2毫米的厚度。
注意:在此阶段,活性混合物将夹在PDMS上的油和亲水涂层之间,但它仍然有些三维。 - 为了将材料进一步推入2D层,将PDMS设备粘在载玻片上,将其放入摆动桶离心机中,并以212 x g 离心12分钟。设备的位置需要使硅油位于水层的顶部。代表性结果如图 3所示。
- 使用弹性体固化剂和弹性体基料制备聚二甲基硅氧烷(PDMS)(见 材料表)。使用金属刮刀以 1:10 的比例混合两种成分。混合过程中会出现难以去除的微小气泡,混合物呈乳白色。要去除这些气泡,请将混合物置于真空下脱气1小时,之后未固化的PDMS应呈透明。
3. 在受限几何形状中制备主动向列
注意:诸如这种准二维系统的主动向列可能具有挑战性,以限制在诸如孔或通道之类的小微流体几何形状中。本文描述了一种将材料限制在不同形状的PDMS孔中的可靠方法。
- 首先,为 PDMS 设计一个主模具。这可以通过在基材上3D打印支柱来实现。3D打印树脂主模具后,用异丙醇清洁,然后在紫外灯下固化模具45分钟,并在120°C的烤箱中固化2小时(图4)。
注意:在紫外光固化和热后固化下固化通过去除树脂30中的单体和光抑制剂残留物来提高PDMS中的复制质量。 - 使用母模从 PDMS 创建孔。按照步骤 2.2.1 中所述准备 PDMS。将母模浸入未固化的PDMS中,并在60°C的烘箱中固化过夜。
- PDMS固化完成后,小心地取出母模并根据需要切割PDMS以与孔一起工作(图4)。按照步骤 2.2.3 中的说明处理 PDMS 表面。在实验之前,可以用环氧胶将表面附着在载玻片上,以使成像更容易。
- 将步骤2.1.6中描述的活性混合物的1μL移液到PDMS底物上,并立即在活性网络液滴顶部加入粘度为100-1000cSt的硅油28 。活动网络将进入井中;此过程最多需要60分钟(图4)。如步骤2.2.5中所述,可以通过在水平桶离心机中以212× g旋转PDMS孔12分钟来增强2D网络。
结果
图1显示了由GMPCPP微管蛋白制备的单个微管的代表性图像。该图像描绘了相似长度的短微管(存在一些分散性)。充分稀释微管溶液应产生分离良好的微管图像以进行长度验证。单个微管由于其体积小而难以成像。使用专为荧光显微镜设计的高灵敏度相机最适合此应用。图2和图3分别显示了使用流通池法(第2.1节)和倒置法(第2.2节)进行的成功实验的示例荧光显微镜图像。形成良好的活性向列层在纹理上是均匀的,没有明显的空隙区域和移动拓扑缺陷。但请注意,缺陷磁芯中可能存在一些可接受的小空隙。除了图 2 和图 3 所示的示例外,还包括三个补充影片(影片 1、影片 2 和影片 3),以演示活性向列在成功实验中应如何出现。所有电影都展示了主动向列相的平稳连续运动。材料达到稳定状态后,微管浓度没有明显变化。只要系统中存在足够的ATP,材料就会继续均匀移动。
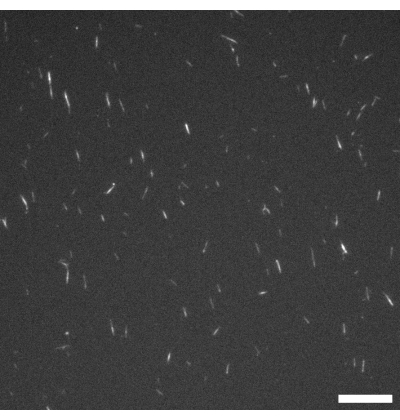
图1:GMPCPP微管的荧光显微镜图像。 将GMPPPP微管用罗丹明微管蛋白标记4%,并在37°C聚合20分钟。 在室温下进行成像。比例尺 = 10 μm。 请点击此处查看此图的大图。
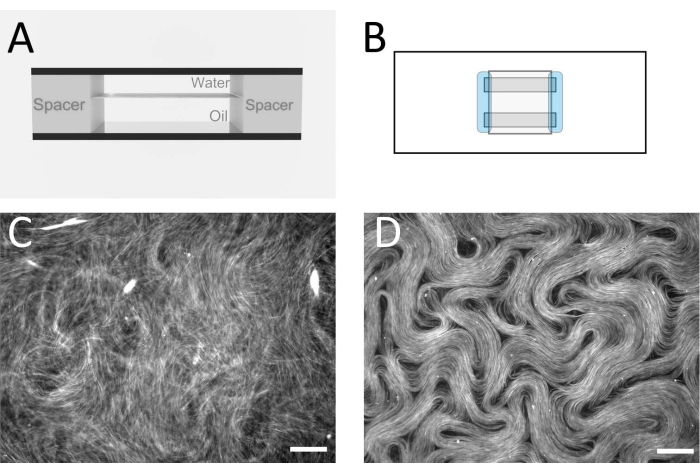
图 2:流通池中的微管向列。 (A) 流通池的横截面示意图,1 mm x 18 mm 几何形状。(B) 流通池的顶视图示意图。(C)荧光显微镜图像,显示活性溶液在油/水界面组装前的典型外观。(D)在流通池内的油/水界面组装的活性向列相的荧光显微镜图像。比例尺 = 100 μm。 请点击此处查看此图的大图。

图3:荧光显微镜图像显示使用倒置方法制备的活性向列 。比例尺 = 200 μm。 请点击此处查看此图的大图。
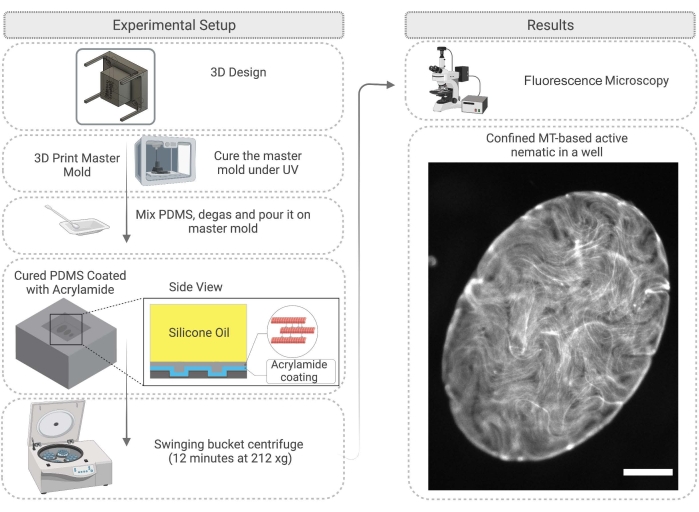
图 4:说明 PDMS 井中主动向列约束方法的流程图,包括模具制造和表面处理。右图上的比例尺(受限活性材料)= 200 μm。 请点击此处查看此图的大图。
视频1:使用流通池法制备的活性向列的代表性结果。请点击这里下载此影片。
视频2:使用倒置法制备的活性向列的代表性结果。请点击这里下载此影片。
视频3:使用倒置方法制备的活性向列的代表性结果仅限于椭圆井。请点击这里下载此影片。
讨论
在整个协议中,实验者可以在几个点上进行一些重要的检查。在用活性材料填充任一装置之前,应使用荧光显微镜(见 图1)来检查微管是否聚合,理想情况下长度为~2-3μm。如果在显微镜下看不到微管,它们可能已经解聚并且不会形成活性向列。由于单个微管非常小,因此直接通过显微镜观察它们可能具有挑战性。在这项研究中,将专为具有挑战性的低光应用而设计的高质量荧光相机与相关软件一起使用,以验证灯丝生长。在此阶段不应存在显着的荧光聚集体,因为这可能表明解聚或存在变性蛋白质。通过以与协议中描述的相同比例组合微管、MIX 和 ATP 来制作简单的显微镜测试载玻片也是一个好主意。活动应从组合组件开始,材料应看起来类似于 图2C 所示,存在束,并且在整个过程中可见明显的灯丝运动。
使用流通池方法时,流通池的离心时间和方向对于形成均匀的活性层非常重要。此步骤可能需要根据所使用的离心机类型进行一些微调。使用垂直于旋转平面的活性平面离心流通池可提供最佳结果,因为材料可以均匀地推到流体界面上。离心前仔细检查流通池是否密封。
当使用倒置方法产生受限活性向列时,有几个步骤需要优化。首先,使用产生高分辨率结构的3D打印方法很重要。不均匀的侧壁会导致微管捕获,从而破坏流动。井不应太深(本研究使用150-200μm深的井,上覆油层厚2毫米)。实验者可能需要通过反复试验稍微调整这些参数以获得最佳结果。
不同的作者使用流通池法和倒置法来研究影响活动流动的各种效应,包括不同的油12 和浸没结构13。方法的选择取决于实验目标。使用流通池方法,由于上覆流体不同,从活性层上方的光学成像比倒置方法更清晰。在流通池方法中,成像是通过玻璃盖玻片和一层薄薄的水进行的,而倒置方法设计为将油层放在顶部。这意味着倒置方法需要长工作距离物镜,并且图像质量会降低。通过分别比较图 2D (流通池法)和 图3 (倒置法)以及 视频1 和 电影2,可以看到图像质量差异。图 3 需要比 图2更远的低倍率镜头,工作距离更长。如果有合适的倒置显微镜,并结合具有适当工作距离的显微镜载玻片基板的物镜,则可以避免倒置方法的这些成像缺点。较薄的玻璃可用作基板,以允许使用标准工作距离物镜。
优点是,倒置的几何形状允许使用更广泛的油粘度,不一定需要水平吊桶离心(如果不可用),并且一旦准备好模具,系统的准备相对容易。然而,对于使用倒置方法的孔中的限制,一些离心对于将材料放入定义明确的 2D 层中可能很重要。
流通池方法最近在需要连续活性层的实验中得到了非常成功的应用。我们最近的工作着眼于活性层中拓扑缺陷的动力学,其中高质量的成像和纹理分析很重要19。此外,流通池法已被用于研究油浸式微观结构对活动流16 和柱子的影响,以捕获活动流31中的缺陷。这种方法对于形成连续的活性层非常有效,并且图像质量非常好。然而,用于产生最终2D活性层的离心步骤可能难以进行,并且流通池容易发生泄漏和气泡。倒置方法是一种非常有用的替代方案,具有很高的成功率,易于构建,并且可用于任何基板图案或几何形状,前提是可以创建高分辨率的3D打印母模。这种方法对于观察几何约束对主动向列动力学的影响也很有用,因为它使填充孔相对简单。
在本文中,描述了从微管和驱动蛋白马达形成活性向列的两种方法,以及将材料限制在孔中的技术。所介绍的系统代表了目前文献中活跃向列阶段的最干净的例子,并已被世界各地的几个小组复制。这种材料的意义不仅在于其成分的生物学起源,还因为它在活性有序流体中开辟了一个全新的方向。通过使用该系统并阐明其基本性质,科学家们可以转向全合成活性相的设计。
专注于约束对主动向列的影响的实验有可能回答有关拓扑约束下活动流动行为和拓扑缺陷动力学的基本问题。这里介绍的方法将有助于执行各种以几何为重点的实验及其分析,包括微流体和活性混合。
披露声明
这项工作中使用的一些材料由Cytoskeleton Inc.(美国丹佛)免费提供。
致谢
作者要感谢美国国家科学基金会(NSF)授予DMR-1808926的慷慨资助。该项目还得到了NSF通过科学与技术卓越研究中心的支持:加州大学默塞德分校细胞和生物分子机器中心(HRD-1547848)和布兰迪斯生物材料设施材料研究科学与工程中心(DMR-2011486)。我们要感谢加州大学默塞德分校的刘斌博士在3D打印模具方面的帮助,以及Jordi Ignes博士在开发倒置实验方法期间提供的科学建议。
材料
| Name | Company | Catalog Number | Comments |
| 20 kD PEG (polyethylene glycol)) | Sigma Aldrich | 1419109 | Depletion agent CAS Number: 125061-88-3 |
| 3-(trimethoxysilyl)propyl methacrylate | Sigma Aldrich | M6514-50ML | CAS Number: 2530-85-0 |
| 3D printer & Resin | Phrozen | Phrozen sonic mini 8K 3D printer - Aqua Gray 8K resin | |
| 40% Acrylamide Solution | BIO-RAD | 1610140 | CAS Number: 7732-18-5, 79-06-1 |
| Acetic Acid | Fisher | CAS Number: 64-19-7 | |
| Acetone | Sigma Aldrich | CAS Number: 67-64-1 | |
| Adhesive sheets (NOTE: "Parafilm" is an alternative) | Grace Bio-Labs | 620001 | SecureSeal |
| Ammonium Persulfate | Sigma Aldrich | A3678 | CAS Number: 7727-54-0 |
| Aquapel (NOTE: "RainX" is an alternative) | Aquapel Glass Treatment | hydrophobic glass treatment | |
| ATP (Adenosine triphosphate) | Sigma Aldrich | A1852 | CAS Number: 34369-07-8 |
| Beakers | VWR | ||
| Catalase | Sigma Aldrich | C9322 | CAS Number: "9001-05-2" |
| Desiccator | Bel-art | ||
| Digital CMOS camera | Hamamatsu | ORCA - Flash4.0 LT+ | |
| DTT (Dithiothreitol) | Sigma Aldrich | D9779 | CAS Number: "3483-12-3" |
| EGTA (3,12-bis(carboxymethyl)-6,9-dioxa-3,12-diazatetradecane-1,14-dioic acid) | Sigma Aldrich | MFCD00004291 | CAS Number: 67-42-5 |
| Ethanol | Sigma Aldrich | CAS Number: 64-17-5 | |
| Fluorescence microscope | Leica | DM 2500P | |
| Glass Coverslips | VWR | 48368-040 | |
| Glass Slides | VWR | 16004-430 | |
| Glucose | Sigma Aldrich | G7021 | CAS Number: 50-99-7 |
| Glucose Oxidase | Sigma Aldrich | 345386 | CAS Number: 9001-37-0 |
| GMPCPP (guanylyl 5'-α,β-methylenediphosphonate) | Jena Bioscience | NU-405S | CAS Number: 14997-54-7 |
| HFE7500 Oil | 3M | ||
| Hot Plate | Fisher Scientific | Thermix hot plate model 100M | |
| Isopropyl Alcohol | VWR | ||
| KCl (potassium chloride) | Sigma Aldrich | P5405 | CAS Number: 7447-40-7 |
| Methanol | Sigma Aldrich | CAS Number: 67-56-1 | |
| MgCl2 (Magnesium Chloride) | Sigma Aldrich | 208337 | CAS Number: 7786-30-3 |
| Microcentrifuge tubes | Eppendorf - Thermo Fisher | 1.5 mL | |
| Nanopure water purifier | Sartorius | arium mini | |
| NaOH (Sodium hydroxide) | Sigma Aldrich | SX0603 | CAS Number: 1310-73-2 |
| Petri Dishes | VWR | ||
| PH Meter | Thermo Scientist | Orion 3 STAR | |
| Phosphoenol-pyruvate (PEP) | Sigma Aldrich | MFCD00044476 | CAS Number: 4265-07-0 |
| PIPES (1,4-Piperazinediethanesulfonic acid) | Sigma Aldrich | CAS Number: 5625-37-6 | |
| Pipettes (0.2 - 1000 µl) | VWR | ||
| Pluronic F-127 | Sigma Aldrich | 2594628 | |
| RAN Surfactant (NOTE: "FluoSurf" from Emulso is an alternative) | Ran Biotechnologies | 008-FluoroSurfactant-2wtH-50G | |
| Silicon Oil (100mpa s-1000 mpa s) | Sigma Aldrich | CAS Number: 63148-52-7 | |
| Streptavidin | Thermofisher | S888 | |
| Swinging Bucket Centrifuge | Thermo Scientist | Sorvall legend RT+ | |
| Sylgard 184 Elastomer base | World Precision Instruments | SYLG184 | |
| Sylgard 184 Elastomer Curing agent | World Precision Instruments | SYLG184 | |
| Table top centrifuge | Eppendorf | MiniSpin Plus | |
| TEMED (Tetramethylethylenediamine) | BIO-RAD | 1610800 | CAS Number: 110-18-9 |
| Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid) | Sigma Aldrich | MFCD00006846 | CAS Number: 53188-07-1 |
| Tubulin | Cytoskeleton | T240-B | |
| Tubulin (Rhodamine labeled) | Cytoskeleton | TL590M-A | |
| Ultracentrifuge | Beckman | Optima Max-TL | |
| UV Light | RapidFix | ||
| UV-curable glue (NOTE: "Norland NO81" is an alternative) | RapidFix | ||
| Water Bath | Thelco | ||
| Whatman Filter paper | Sigma Aldrich | WHA1001325 |
参考文献
- Sokolov, A., Aranson, I. S., Kessler, J. O., Goldstein, R. E. Concentration dependence of the collective dynamics of swimming bacteria. Physics Review Letters. 98 (15), 158102 (2007).
- Saw, T. B., et al. Topological defects in epithelia govern cell death and extrusion. Nature. 544 (7649), 212-216 (2017).
- Kawaguchi, K., Kageyama, R., Sano, M. Topological defects control collective dynamics in neural progenitor cell cultures. Nature. 545 (97654), 327-331 (2017).
- Toner, J., Tu, Y. Long-range order in a two-dimensional dynamical XY model: how birds fly together. Physics Review Letters. 75 (23), 4326-4329 (1995).
- Katz, Y., Tunstrøm, K., Ioannou, C. C., Huepe, C., Couzin, I. D. Inferring the structure and dynamics of interactions in schooling fish. Proceedings of the National Academy of Sciences. 108 (46), 18720-18725 (2011).
- Needleman, D., Dogic, Z. Active matter at the interface between materials science and cell biology. Nature Reviews Materials. 2 (9), 17048 (2017).
- Weirich, K., Dasbiswas, K., Witten, T. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences. 116 (23), 11125-11130 (2019).
- Memarian, F. L., et al. Active nematic order and dynamic lane formation of microtubules driven by membrane-bound diffusing motors. Proceedings of the National Academy of Sciences. 118 (52), (2021).
- Bausch, A., Sciortino, A. R. Pattern formation and polarity sorting of driven actin filaments on lipid membranes. Proceedings of the National Academy of Sciences. 118 (6), (2021).
- Maroudas-Sacks, Y., et al. Topological defects in the nematic order of actin fibres as organization centres of Hydra morphogenesis. Nature Physics. 17 (2), 251-259 (2021).
- Liu, J., et al. Topological braiding and virtual particles on the cell membrane. Proceedings of the National Academy of Sciences. 118 (34), (2021).
- Hirst, L. S. . Fundamentals of Soft Matter Science 2nd ed. , (2019).
- Sanchez, T., Chen, D., DeCamp, S., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Guillamat, P., Ignés-Mullol, J., Sagués, F. Taming active turbulence with patterned soft interfaces. Nature Communications. 8, 564 (2017).
- Thijssen, K., et al. Submersed micropatterned structures control active nematic flow, topology, and concentration. Proceedings of the National Academy of Sciences. 118 (38), (2021).
- Shendruk, T. N., Doostmohammadi, A., Thijssen, K., Yeomans, J. M. Dancing disclinations in confined active nematics. Soft Matter. 13 (21), 3853-3862 (2017).
- Giomi, L. Geometry and topology of turbulence in active nematics. Physical Review X. 5 (3), 031003 (2015).
- Tan, A. J., et al. Topological chaos in active nematics. Nature Physics. 15 (10), 1033-1039 (2019).
- Young, E. C., Berliner, E., Mahtani, H. K., Perez-Ramirez, B., Gelles, J. Subunit interactions in dimeric kinesin heavy chain derivatives that lack the kinesin rod. The Journal of Biological Chemistry. 270 (8), 3926-3931 (1995).
- Gilbert, S. P., Johnson, K. A. Expression, purification, and characterization of the Drosophila kinesin motor domain produced in Escherichia coli. Biochemistry. 32 (17), 4677-4684 (1993).
- Kuznetsov, S. A., Gelfand, V. I., Vernos, I. . Kinesin Protocol. 164, (2001).
- Hawkins, T. L., Sept, D., Mogessie, B., Straube, A., Ross, J. L. Mechanical properties of doubly stabilized microtubule filaments. Biophysics Journal. 104 (7), 1517-1528 (2013).
- Bate, T. E., Jarvis, E. J., Varney, M. E., Wu, K. Controlling flow speeds of microtubule-based 3D active fluids using temperature. Journal of Visualized Experiments. (153), e60484 (2019).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Tayar, A. M., Lemma, L. M., Dogic, Z. Assembling microtubule-based active matter.. Microtubules. , 151-183 (2022).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Guillamat, P., Ignés-Mullol, J., Shankar, S., Marchetti, M. C., Sagués, F. Probing the shear viscosity of an active nematic film. Physical Review E. 94 (6), 060602 (2016).
- Rudy, A., et al. Lubricous hydrogel surface coatings on polydimethylsiloxane (PDMS). Tribology Letters. 65, 3 (2017).
- Venzac, B., et al. PDMS curing inhibition on 3D-printed molds: Why? Also, how to avoid it. Analytical Chemistry. 93 (19), 7180-7187 (2021).
- Khaladj, D. A., Hirst, L. S. Using curved fluid boundaries to confine active nematic flows. Frontiers of Physics. 10, 880941 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。