Method Article
Formen, Einschließen und Beobachten von Mikrotubuli-basierten aktiven Nematiken
In diesem Artikel
Zusammenfassung
Hier werden Verfahren zur Herstellung aktiver Nematika aus Mikrotubuli und Kinesinmotoren vorgestellt, einschließlich Proteinpräparation und -aufbau sowie der Verwendung von Vertiefungen für den aktiven nematischen Einschluss.
Zusammenfassung
Die Bildung von aktiven Phasen auf Biopolymerbasis ist zu einer wichtigen Technik für Forscher geworden, die daran interessiert sind, das aufstrebende Gebiet der aktiven Flüssigkristalle und ihre möglichen Rollen in der Zellbiologie zu erforschen. Diese neuartigen Systeme bestehen aus selbstfahrenden Untereinheiten, die lokal Energie verbrauchen und eine aus dem Gleichgewicht geratene dynamische Flüssigkeit erzeugen. Um die in diesem Bericht beschriebene aktive Flüssigkristallphase zu bilden, werden gereinigte Proteinkomponenten einschließlich Biopolymere und molekulare Motoren kombiniert, und die aktive nematische Phase bildet sich spontan in Gegenwart von Adenosintriphosphat (ATP). Um den nematischen Zustand zu beobachten, muss das Material in einer für die Mikroskopie geeigneten Geometrie mit einer ausreichend hohen Dichte eingeschlossen werden. Dieser Artikel beschreibt zwei verschiedene Methoden zur Bildung einer aktiven nematischen Phase unter Verwendung von Mikrotubuli und Kinesinmotoren: Montage einer zweidimensionalen aktiven Schicht an einer Öl- und Wassergrenzfläche und Montage unter einer Ölschicht unter Verwendung einer Elastomermulde. Techniken zum Einführen des aktiven Materials in kleine Vertiefungen unterschiedlicher Form werden ebenfalls beschrieben.
Einleitung
Aktive Flüssigkeiten bestehen aus energiegetriebenen Partikeln oder Elementen, die Kraftstoff aus ihrer lokalen Umgebung beziehen. Unter den richtigen Bedingungen können diese beweglichen aktiven Elemente kollektiv wirken, um emergente Strömungsdynamik über lange Längenskalen zu erzeugen. Es gibt eine Vielzahl von Beispielen für ein solches aus dem Gleichgewicht geratenes Phasenverhalten in der Literatur und aktive Phasen finden sich im gesamten Spektrum lebender Systeme. Einige bemerkenswerte Beispiele sind Bakterienkolonien1, Zellblätter2,3 und das Beflocken oder Schwärmen von Organismen 4,5. Aktive Phasen wurden auch ausführlich in kondensierten Phasen von Zytoskelettfilamenten untersucht, entweder als Teil der Zelle6 oder in synthetischen Systemen, die entwickelt wurden, um biologisch extrahierte Komponenten 7,8,9 zu verwenden. Flüssigkristalline Ordnung und die Bildung topologischer Defekte sowohl in natürlich vorkommenden als auch in synthetischen Systemen, die aus biologischen Extrakten zusammengesetzt sind, sind für die Forschungsgemeinschaft von besonderem Interesse. In den letzten Jahren haben Forschungsgruppen solche Systeme, ihre grundlegenden physikalischen Eigenschaften und ihre Relevanz für die Biologie untersucht 2,3,10,11.
Diese Arbeit konzentriert sich auf die Bildung des aktiven nematischen Zustands aus einer Kombination von Mikrotubuli und Kinesin-Motorproteinen. Der traditionelle nematische Flüssigkristall ist eine Gleichgewichtsphase der Materie, in der die konstituierenden Moleküle eine Orientierungsordnung aufweisen. Zum Beispiel kann eine Flüssigkeit, die aus relativ starren stäbchenartigen Molekülen besteht, sowohl die nematische Phase als auch bei höheren Temperaturen eine unorientierte isotrope Flüssigkeit der Phase12 aufweisen. Das erste experimentelle Beispiel einer aktiven nematischen Phase wurde von Sanchez et al.13 entwickelt, wobei ein früheres In-vitro-Experiment 14 adaptiert wurde, in dem Cluster von Motorproteinen verwendet wurden, um eine Scherbewegung zwischen benachbarten Mikrotubulibündeln zu erzeugen. Wenn dieses Mikrotubulisystem auf eine dünne Schicht beschränkt war, entstand eine spontane nematische Ordnung. In den letzten Jahren wurde der aktive nematische Zustand von mehreren experimentellen 15,16 und theoretischen 17,18 Forschungsgruppen intensiv untersucht, wobei der Schwerpunkt auf Phänomenen wie aktiver Turbulenz – einem Zustand, in dem die Flüssigkeit selbstgesteuerte chaotische Strömungen erzeugt 19 – und mobilen topologischen Defekten lag. Dieser Artikel beschreibt Methoden zur Herstellung und Bildung des aktiven nematischen Zustands aus Mikrotubuli und Kinesinmotoren in verschiedenen experimentellen Geometrien. Zunächst werden Präparationsverfahren für die verschiedenen Komponentenlösungen beschrieben, gefolgt von Verfahren zur Umformung der aktiven Nematik unter Verwendung von zwei unterschiedlichen Strömungskammergeometrien. Typische Bildgebungsergebnisse werden gezeigt. Schließlich werden Verfahren zum Einschluss der aktiven Nematik in Vertiefungen und Kanälen beschrieben.
Protokoll
1. Vorbereitung des aktiven Materials
HINWEIS: Die 2D-aktive Nematik wird in einem dreistufigen Prozess zusammengebaut. Zunächst werden zwei separate Lösungen hergestellt: a) polymerisierte, stabilisierte Mikrotubuli und b) MIX (eine Lösung, die Kinesinmotoren enthält). Diese werden kombiniert und die Aktivität wird durch Zugabe von Adenosintriphosphat (ATP) eingeleitet. Das Material wird dann in einer geeigneten Geometrie eingeschlossen, so dass seine Dichte hoch genug ist, um eine nematische Ordnung entstehen zu lassen. Protokolle sind für die Vorbereitung aller notwendigen Komponenten und den Zusammenbau der aktiven Phase enthalten.
- Kinesin Motor Protein Cluster Vorbereitung
- Expression und Reinigung rekombinanter K401-BIO-Motorproteine (K401-Motoren) aus Escherichia coli nach dem Protokoll von Edgar C. Young20.
HINWEIS: K401-BIO Motorproteine sind dimer und bestehen aus zwei Köpfen, die mit einem helikalen Stiel verbunden sind. Die Motoren wurden von der Brandeis Biomaterials Facility geliefert und wie bereits berichtet16 eingesetzt. Um eine aktive Nematik zu bilden, werden die Kinesinmoleküle biotinyliert und dann über eine Streptavidin-Verknüpfung verbunden, um Kinesin-Cluster von bis zu vier Motoren zu bilden13,15,21,22. Es ist hilfreich, das Kinesin mit einem grün fluoreszierenden Protein (GFP) zu exprimieren. - Nach der Reinigung und Inkubation von Streptavidin und Motoren auf Eis für 40 min die K401-Motoren in flüssigem Stickstoff in 5 μL Aliquots bei einer Endkonzentration von 0,7 mg/ml schockgefrieren und bei -80 °C lagern.
HINWEIS: Das Experiment kann hier pausiert werden. Das Kinesin bei Bedarf vorsichtig auftauen und nicht wieder einfrieren. - Herstellung von Clustern von Biotin-markiertem Kinesin (KSA) durch Mischen von 24 Vol.-% 0,7 mg/ml K401-Motoren, 27 Vol.-% 0,325 mg/ml Streptavidin und 3 Vol.-% 5 mM Dithiothreitol (DTT) (zur Verhinderung der Aggregation) bei 4 °C in 46 Vol.-% M2B-Puffer (80 mM PIPES [1,4-Piperazindiethansulfonsäure, pH 6,8], 2 mMMgCl2 und 1 mM EGTA [ethylenglykol-bis(β-aminoethylether)-N, N,N′,N′-Tetraessigsäure]). KSA 40 min auf Eis brüten lassen.
- Expression und Reinigung rekombinanter K401-BIO-Motorproteine (K401-Motoren) aus Escherichia coli nach dem Protokoll von Edgar C. Young20.
- Herstellung der Mikrotubuli-Lösung
HINWEIS: Guanosin-5'-[(α,β)-methyleno]triphosphat, Natriumsalz (GMPCPP) ist ein langsam hydrolysierbares Analogon von Guanosintriphosphat (GTP), und Mikrotubuli, die in Gegenwart von GMPCPP gebildet werden, sind dreimal steifer als GTP-Mikrotubuli23 und kürzer. Die Verwendung kurzer, steifer Mikrotubuli ist günstig für die Bildung der aktiven nematischen Phase, da diese Faktoren zusammen die flüssigkristalline Ordnung fördern.- Polymerisieren Sie unmarkiertes zyklisches Tubulin (99%, siehe Materialtabelle) unter Verwendung von 0,6 mM GMPCPP bei einer Tubulinkonzentration von 6 mg/ml.
HINWEIS: Hochwertiges Tubulin kann auch aus dem Gehirn von Rindern oder Schweinen nach etablierten Protokollen gereinigt oder von einer anderen zuverlässigen Quelle wie der Brandeis Biomaterials Facility bezogen werden, wo Materialien eingefroren transportiert werden können, um Schäden zu vermeiden. Für die Tubulinreinigung aus dem Rinderhirn verweisen wir auf das veröffentlichte Protokoll von Bate et al.24. Zur Tubulinreinigung aus dem Schweinegehirn siehe die veröffentlichten Protokolle von Castoldi et al.25 und Tayar et al.26. - Zur Vorbereitung der Polymerisation ein Hitzebad bei 37 °C vorbereiten und die Zentrifuge auf 4 °C vorkühlen. Kombinieren Sie die unmarkierte Tubulinlösung in M2B-Puffer (Schritt 1.1.3) in einem 500-μL-Ultrazentrifugenröhrchen mit 4 Mol-% Rhodamin-markiertem Tubulin (siehe Materialtabelle), um nach der Polymerisation 4 % markierte Mikrotubuli herzustellen.
- Überprüfen Sie die Tubulinkonzentration mit einem Bradford-Assay27. Die Gesamttubulinkonzentration im Zentrifugenröhrchen sollte 6,5-6,9 mg / ml betragen.
- Die Tubulinmischung 10 min auf Eis inkubieren und 10 min bei 352.700 x g bei 4 °C ultrazentrifugieren. Dieser Schritt entfernt dysfunktionales Tubulin, das sich im Pellet befindet.
- Extrahieren Sie den Überstand mit funktionellem Tubulin vorsichtig mit einer Pipette in ein Mikrozentrifugenröhrchen. Fügen Sie GMPCPP zu einer Endkonzentration von 0,6 mM hinzu, um die Tubulinpolymerisation zu induzieren, und DTT zu einer Endkonzentration von 1 mM, um eine Proteinaggregation zu verhindern.
- Die Mischung im Wärmebad bei 37 °C für 30 min inkubieren, dann erneut 10 min bei 14.000 x g bei Raumtemperatur zentrifugieren. Entfernen Sie den Überstand und verdünnen Sie das Pellet mit M2B-Puffer, um eine endgültige Mikrotubulikonzentration von 6 mg / ml zu erreichen.
HINWEIS: Diese Lösung kann vor Gebrauch mindestens 4 h bei Raumtemperatur gelagert werden. - Um zu überprüfen, ob die Mikrotubuli erfolgreich polymerisiert sind, verdünnen Sie 1 μL der Mikrotubulilösung 100:1 mit M2B-Puffer und Pipette auf einem Objektträger. Abdeckung mit einem Deckblatt für die Bildgebung mit einem Fluoreszenzmikroskop (siehe Materialtabelle) mit einem 40-fachen Objektiv.
HINWEIS: Die Anregungs- und Emissionswellenlängen werden entsprechend der Fluoreszenzmarkierung ausgewählt, die auf den Mikrotubuli verwendet wird. In diesem Protokoll wird die Rhodaminmarkierung verwendet (siehe Schritt 1.2.2), so dass die Bildgebung mit einem Anregungsband von 515-560 nm und einem 590 nm Langpassfilter durchgeführt wird. Abbildung 1 zeigt ein repräsentatives Beispiel. - Nach Abschluss der Polymerisation die Mikrotubuli als 2 μL Aliquots in flüssigem Stickstoff einfrieren und bei -80 °C lagern (falls erforderlich).
- Polymerisieren Sie unmarkiertes zyklisches Tubulin (99%, siehe Materialtabelle) unter Verwendung von 0,6 mM GMPCPP bei einer Tubulinkonzentration von 6 mg/ml.
- Vorbereitung von MIX
HINWEIS: MIX ist eine wässrige Lösung, die die Kinesin-Streptavidin-Cluster (KSA) enthält. Vorbereitete MIX sollte vor dem Versuch bei -80 °C in 4 μL Aliquots gelagert werden. Wenn MIX mit ATP und der in Schritt 1.2 beschriebenen Mikrotubulilösung bei Raumtemperatur kombiniert wird, wird die Aktivität eingeleitet. MIX wird wie folgt zubereitet13,19.- Bereiten Sie eine Lösung zur Verhinderung des Fluoreszenzfadens (ANTIFADE) vor, indem Sie zwei antioxidative Lösungen mischen. Kombinieren Sie AO1 (250 mM DTT, 65 mM Katalase) und AO2 (750 μM Katalase, 3 mM Glucoseoxidase) in einem 1:1 Volumenverhältnis. Enthalten Sie 20 mM Trolox, ein weiteres Antioxidans, das verwendet wird, um Schäden durch Fluoreszenzmikroskopie zu reduzieren.
- Bereiten Sie MIX vor, indem Sie eine Lösung von KSA (beschrieben in Schritt 1.1.3) herstellen, die 6 Gew.-% 20 kDa Polyethylenglykol (PEG) enthält, um eine Bündelung der Mikrotubuli, 3 Vol.-% ANTIFADE und 5 Vol.-% Pyruvatkinase/Milchsäuredehydrogenase (PKLDH) bei 70 mg/ml zur ATP-Regeneration zu induzieren.
2. Erstellen der aktiven nematic
HINWEIS: Die Aktivität im Material wird durch ATP-Addition initiiert. Das aktive Netzwerk wird für jedes Experiment frisch vorbereitet, indem ATP in einer Konzentration hinzugefügt wird, die hoch genug ist, um motorische Aktivität zu induzieren. Um eine gleichmäßige, voll entwickelte aktive nematische Phase zu bilden, müssen die Mikrotubuli eine ausreichend hohe Dichte aufweisen. Dies kann erreicht werden, indem die Mikrotubuli zwischen zwei nicht mischbaren Flüssigkeiten eingeschlossen werden, um eine zweidimensionale (2D) aktive nematische Schicht zu bilden. Diese Methode wurde ursprünglich an der Brandeis University13 entwickelt und ist nach wie vor eine beliebte Technik zur Erzeugung einer homogenen, qualitativ hochwertigen und aktiven nematischen Phase.
- Flusszellenmethode zur aktiven nematischen Bildung
- Bereiten Sie hydrophile Deckgläser mit einer Acrylamidbeschichtung vor.
- Reinigen Sie die Deckgläser gründlich mit Seifenwasser, Ethanol und 0,1 M NaOH mit abwechselnden Spülungen mit Reinstwasser. Nach dem Spülen die Deckgläser mit einer Silanlösung aus 100 ml Ethanol, 1 ml Essigsäure und 500 μL 3-(Trimethoxysilyl) propylmethacrylat für 15 min beschichten und dann mit Reinstwasser abspülen.
- Eine Acrylamidlösung aus 95 mL Reinstwasser und 5 mL 40 Gew.-% Acrylamid wird hergestellt und dann die Lösung für 30 min in einem Vakuumofen entgast.
- Man fügt 35 μL Tetramethylethylendiamin (TEMED) für eine Endkonzentration von 2,3 mM und dann 0,07 g Ammoniumpersulfat hinzu. Die Acrylamidlösung mit dem Gesicht nach oben über die Deckgläser gießen und über Nacht bei Raumtemperatur inkubieren.
- Hydrophobe Objektträger vorbereiten. Pipettieren Sie 100 μL einer wasserabweisenden Lösung (siehe Materialtabelle) auf einen sauberen Glasobjektträger und legen Sie dann einen weiteren sauberen Objektträger darauf. Dies gewährleistet eine gleichmäßige Beschichtung der wasserabweisenden Lösung auf der Oberfläche, wo sie für 2 min sitzt. Nach 2 min den zweiten Objektträger entfernen und den ersten Objektträger gründlich mit Reinstwasser abspülen, dann mit Stickstoffgas trocknen. Reinigen Sie vorsichtig den Bereich, in dem das Klebeband (um das Muster herum) platziert wird, mit Aceton, um sicherzustellen, dass die wasserabweisende Lösung das Anhaften am Glas nicht verhindert.
- Bereiten Sie eine Mischung aus technisch hergestelltem Öl vor, das 1,8% (v/v) 008-Fluortensid enthält (siehe Materialtabelle).
- Glasobjektträger und Deckglas mit dem hydrophoben Glasobjektträger auf der Unterseite der Durchflusszelle und dem hydrophilen Deckglas als Oberseite in einer Sandwichgeometrie mit 40 μm doppelseitigen Klebeabstandshaltern montieren. Platzieren Sie die Abstandshalter im Abstand von 1,5 mm auf dem hydrophoben Objektträger. Legen Sie dann das acrylamidbeschichtete Deckglas mit der behandelten Seite nach unten auf die Abstandshalter, um zu haften. Stellen Sie sicher, dass die Haftung durch den Druck eines stumpfen Objekts vollständig ist.
HINWEIS: Ziel ist es, eine Durchflusszelle mit einer flachen Öl/Wasser-Schnittstelle im Inneren zusammenzubauen (Abbildung 2A,B). Hier bildet sich die aktive Schicht. Alternative Abstandsbänder und -folien können auch verwendet werden, um eine ähnliche Zelldicke zu erzeugen. - Nachdem die Durchflusszelle konstruiert wurde, pipetten Sie das Ölgemisch sofort in die Durchflusszelle und füllen den geschlossenen Raum.
- Mischen Sie unter Verwendung einer Pipette in einer separaten Durchstechflasche vorsichtig 6 μL Aktivmaterial mit 3,73 μL MIX, 1 μL Mikrotubulilösung, 0,6 μL ATP-Lösung (die Konzentration kann variiert werden, um die Mikrotubuligeschwindigkeit zu variieren) und 0,67 μL M2B-Puffer.
- Pipetten Sie frisch gemischtes aktives Material in ein offenes Ende der Durchflusszelle, die Volumina variieren, sollten aber das Volumen der Durchflusszelle (ca. 3-6 μL) überschreiten. Etwas Öl wird durch die wässrige Lösung verdrängt, wenn es in den Kanal injiziert wird; Dieser kann am gegenüberliegenden Ende des Strömungskanals mit einem kleinen Stück Seidenpapier versenkt werden.
- Verschließen Sie nach dem Befüllen beide Seiten der Durchflusszelle mit einem Epoxidkleber (siehe Materialtabelle), der bei 20 s UV-Licht aushärtet.
HINWEIS: An diesem Punkt bildet das aktive Material ein 3D-Netzwerk, das in der Wasserschicht suspendiert bleibt. - Um die aktive Schicht zwischen den beiden nicht mischbaren Flüssigkeiten in einer Quasi-2D-Schicht einzuschließen, legen Sie die Durchflusszelle in eine schwingende Eimerzentrifuge (siehe Materialtabelle) mit der wässrigen Phase oben und der dichteren Ölschicht darunter. Zentrifugieren bei 212 x g für 10 min. Nach Abschluss dieses Schritts kann die Flusszelle zur Bildgebung mit einem 10- oder 20-fachen Vergrößerungsobjektiv zu einem Epifluoreszenzmikroskop gebracht werden. Abbildung 2C,D zeigt typische Bilder vor und nach diesem Schritt.
- Bereiten Sie hydrophile Deckgläser mit einer Acrylamidbeschichtung vor.
- Invertierte Methode zur aktiven nematischen Bildung
HINWEIS: Eine alternative Methode zu der in Schritt 2.1 beschriebenen besteht darin, die aktive nematische Schicht unter einer dicken Ölschicht zusammenzubauen, die auf eine tiefe PDMS-Bohrung28 beschränkt ist. Diese Methode führt zu ähnlichen Ergebnissen und ist etwas einfacher zu meistern. Die Bildqualität mit dieser Methode ist jedoch in der Regel nicht so gut wie mit der Flusszellenmethode.- Das Polydimethylsiloxan (PDMS) wird unter Verwendung eines Elastomerhärters und einer Elastomerbasis hergestellt (siehe Materialtabelle). Mischen Sie die beiden Komponenten im Verhältnis 1:10 mit einem Metallspatel. Beim Mischen entstehen winzige Blasen, die schwer zu entfernen sind, und die Mischung erscheint milchig. Um diese Blasen zu entfernen, stellen Sie die Mischung unter Vakuum, um sie für 1 h zu entgasen, danach sollte das nicht ausgehärtete PDMS transparent erscheinen.
HINWEIS: Das PDMS ist jetzt bereit, jede Form mit einer Form zu formen, oder es kann im Behälter aushärten und dann im gewünschten Muster geschnitten oder gestanzt werden. - Das PDMS in eine geeignete Form geben und über Nacht bei 60 °C aushärten lassen.
HINWEIS: Unbehandelt ist die Oberfläche von ausgehärtetem PDMS hydrophob, aber mit Oberflächenbehandlung kann es hydrophil gemacht werden. - Um eine hydrophile PDMS-Oberfläche herzustellen, beschichten Sie das PDMS mit einer Acrylamid-Polymerbürste29. Dieser Schritt verhindert auch, dass Proteine an der Oberfläche haften.
- Beginnen Sie mit der Reinigung des PDMS für 10 Minuten mit Ethanol und Isopropanol, spülen Sie dann gründlich mit entionisiertem Wasser 3x und trocknen Sie es. Verwenden Sie einen Plasmareiniger für 5 Minuten, um das trockene, ausgehärtete PDMS zu reinigen. Dieser Schritt macht die Oberfläche hydrophiler.
- Als nächstes wird eine Silanlösung (98,5 Gew.-% Ethanol, 1 Gew.-% Essigsäure und 0,5 Gew.-% Trimethoxysilylpropylmethacrylat) hergestellt und das Substrat für 15 min in diese Lösung getaucht, um die Acrylamidbeschichtung vorzubereiten. Spülen Sie das Substrat gründlich mit entionisiertem Wasser ab und tauchen Sie in Acrylamidlösung (2 Gew.-% Acrylamid/Bis-Lösung, 2,3 mM TEMED und 3 mM Ammoniumpersulfat).
HINWEIS: Diese Substrate können bei Raumtemperatur bedeckt mit Acrylamidlösung in einer Glas-Petrischale gelagert werden und sollten innerhalb von 2 Wochen verwendet werden.
- Wenn Sie gebrauchsfertig sind, spülen Sie die Oberfläche mit entionisiertem Wasser ab und trocknen Sie sie mit Stickstoff für den sofortigen Gebrauch. Die aktive Mischung (beschrieben in Schritt 2.1.6) in die Vertiefungen geben und sofort Silikonöl auf eine Dicke von ca. 2 mm auftragen.
HINWEIS: In diesem Stadium wird die aktive Mischung zwischen dem Öl und der hydrophilen Beschichtung auf dem PDMS eingeklemmt, aber sie wird immer noch etwas dreidimensional sein. - Um das Material weiter in eine 2D-Schicht zu drücken, kleben Sie das PDMS-Gerät auf einen Glasobjektträger, legen Sie es in eine schwingende Eimerzentrifuge und drehen Sie es für 12 min bei 212 x g. Das Gerät muss so positioniert werden, dass sich das Silikonöl auf der Oberseite der wässrigen Schicht befindet. Repräsentative Ergebnisse sind in Abbildung 3 dargestellt.
- Das Polydimethylsiloxan (PDMS) wird unter Verwendung eines Elastomerhärters und einer Elastomerbasis hergestellt (siehe Materialtabelle). Mischen Sie die beiden Komponenten im Verhältnis 1:10 mit einem Metallspatel. Beim Mischen entstehen winzige Blasen, die schwer zu entfernen sind, und die Mischung erscheint milchig. Um diese Blasen zu entfernen, stellen Sie die Mischung unter Vakuum, um sie für 1 h zu entgasen, danach sollte das nicht ausgehärtete PDMS transparent erscheinen.
3. Herstellung aktiver Nematiken in engen Geometrien
HINWEIS: Aktive Nematik wie dieses quasi-zweidimensionale System kann schwierig sein, sie auf kleine mikrofluidische Geometrien wie Vertiefungen oder Kanäle zu beschränken. Hier wird eine zuverlässige Methode beschrieben, um das Material in unterschiedlich geformte PDMS-Vertiefungen einzuschließen.
- Entwerfen Sie zunächst eine Masterform für das PDMS. Dies kann durch 3D-Drucksäulen auf einem Substrat erreicht werden. Nach dem 3D-Druck der Harz-Masterform mit Isopropanol reinigen und dann die Form unter einer UV-Lampe für 45 min und im Ofen bei 120 °C für 2 h aushärten (Abbildung 4).
HINWEIS: Die Aushärtung unter UV- und thermischer Nachhärtung verbessert die Qualität der Replikation in PDMS, indem Monomere und Photoinhibitorrückstände aus dem Harzentfernt werden 30. - Verwenden Sie die Master-Form, um Wells aus PDMS zu erstellen. Bereiten Sie das PDMS wie in Schritt 2.2.1 beschrieben vor. Die Masterform in ungehärtetes PDMS tauchen und über Nacht im Ofen bei 60 °C aushärten.
- Entfernen Sie nach Abschluss der PDMS-Aushärtung vorsichtig die Masterform und schneiden Sie das PDMS wie gewünscht zu, um mit den Vertiefungen zu arbeiten (Abbildung 4). Behandeln Sie die PDMS-Oberfläche wie in Schritt 2.2.3 beschrieben. Vor dem Experiment kann die Oberfläche mit Epoxidkleber an einem Glasobjektträger befestigt werden, um die Bildgebung zu erleichtern.
- 1 μL des in Schritt 2.1.6 beschriebenen Wirkstoffgemisches auf das PDMS-Substrat pipettieren und sofort Silikonöl mit 100-1000 cSt Viskosität28 auf den aktiven Netzwerktröpfchen geben. Das aktive Netzwerk wird in den Brunnen einziehen; Dieser Vorgang dauert bis zu 60 Minuten (Abbildung 4). Wie in Schritt 2.2.5 beschrieben, kann das 2D-Netzwerk erweitert werden, indem die PDMS-Vertiefung in der Schaufelzentrifuge für 12 min bei 212 x g heruntergedreht wird.
Ergebnisse
Abbildung 1 zeigt ein repräsentatives Bild einzelner Mikrotubuli, die aus GMPCPP-Tubulin hergestellt wurden. Das Bild zeigt kurze Mikrotubuli ähnlicher Länge (mit einer gewissen Streuung). Eine ausreichende Verdünnung der Mikrotubulilösung sollte ein Bild von gut getrennten Mikrotubuli zur Längenüberprüfung erzeugen. Die einzelnen Mikrotubuli können aufgrund ihrer geringen Größe schwierig abzubilden sein. Die Verwendung einer hochempfindlichen Kamera, die für die Fluoreszenzmikroskopie entwickelt wurde, ist für diese Anwendung am besten geeignet. Abbildung 2 und Abbildung 3 zeigen beispielhafte fluoreszenzmikroskopische Bilder erfolgreicher Experimente, die mit der Flusszellenmethode (Abschnitt 2.1) bzw. der inversen Methode (Abschnitt 2.2) durchgeführt wurden. Eine gut geformte aktive nematische Schicht ist homogen in der Textur, ohne signifikante Hohlraumbereiche und mobile topologische Defekte. Beachten Sie jedoch, dass es einige akzeptable kleine Hohlräume in den Fehlerkernen geben kann. Zusätzlich zu den Beispielen in Abbildung 2 und Abbildung 3 wurden drei ergänzende Filme (Film 1, Film 2 und Film 3) aufgenommen, um zu demonstrieren, wie die aktive Nematik in einem erfolgreichen Experiment aussehen sollte. Alle Filme zeigen die gleichmäßige kontinuierliche Bewegung der aktiven nematischen Phase. Es sind keine Schwankungen der Mikrotubulikonzentration erkennbar, nachdem das Material seinen stationären Zustand erreicht hat. Solange genügend ATP im System vorhanden ist, bewegt sich das Material weiterhin gleichmäßig.
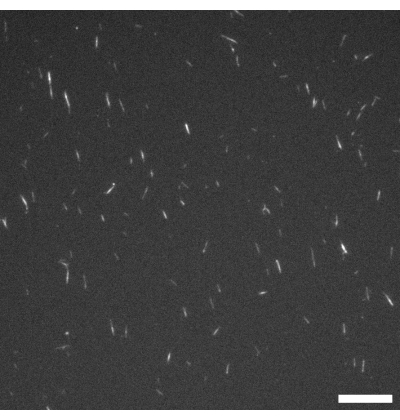
Abbildung 1: Fluoreszenzmikroskopische Aufnahme von GMPCPP-Mikrotubuli. Die GMPCPP-Mikrotubuli wurden zu 4% mit Rhodamintubulin markiert und für 20 min bei 37 °C polymerisiert. Die Bildgebung wurde bei Raumtemperatur durchgeführt. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
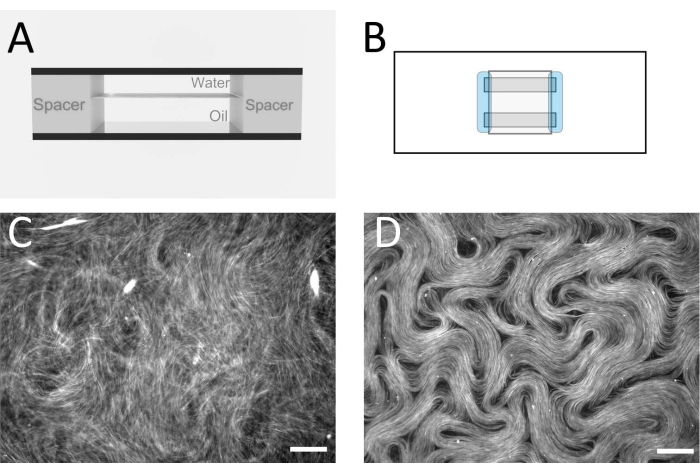
Abbildung 2: Mikrotubuli-Nematik in einer Durchflusszelle. (A) Querschnittsschema der Durchflusszelle, 1 mm x 18 mm Geometrie. (B) Schematische Darstellung der Durchflusszelle von oben. (C) Fluoreszenzmikroskopisches Bild, das das typische Aussehen der aktiven Lösung vor der Montage an der Öl-Wasser-Grenzfläche zeigt. (D) Fluoreszenzmikroskopische Aufnahme der aktiven nematischen Phase, die an der Öl/Wasser-Grenzfläche innerhalb der Durchflusszelle zusammengesetzt ist. Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Fluoreszenzmikroskopische Aufnahme einer aktiven Nematik, die mit der inversen Methode hergestellt wurde. Maßstabsbalken = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
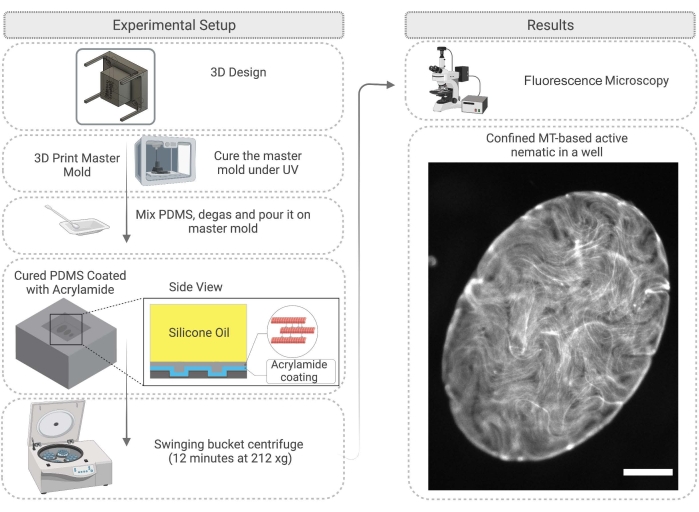
Abbildung 4: Flussdiagramm, das das Verfahren zum aktiven nematischen Einschluss in einer PDMS-Bohrung veranschaulicht, einschließlich Formenbau und Oberflächenbehandlung. Maßstabsbalken auf dem rechten Bild (begrenztes Aktivmaterial) = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Film 1: Repräsentatives Ergebnis für aktive nematische Herstellung mit der Flusszellenmethode. Bitte klicken Sie hier, um diesen Film herunterzuladen.
Film 2: Repräsentatives Ergebnis für aktive Nematik, hergestellt nach der invertierten Methode. Bitte klicken Sie hier, um diesen Film herunterzuladen.
Film 3: Repräsentatives Ergebnis für aktive Nematik, hergestellt mit der invertierten Methode, die auf eine elliptische Vertiefung beschränkt ist. Bitte klicken Sie hier, um diesen Film herunterzuladen.
Diskussion
Es gibt einige Punkte in den Protokollen, an denen der Experimentator einige wichtige Überprüfungen vornehmen kann. Bevor eines der Geräte mit aktivem Material gefüllt wird, sollte mittels Fluoreszenzmikroskopie (siehe Abbildung 1) überprüft werden, ob die Mikrotubuli polymerisiert und idealerweise ~2-3 μm lang sind. Wenn Mikrotubuli unter dem Mikroskop nicht sichtbar sind, können sie depolymerisiert sein und das aktive Nematikum wird sich nicht bilden. Da einzelne Mikrotubuli sehr klein sind, kann es schwierig sein, sie direkt durch das Mikroskop zu beobachten. In dieser Studie wurde eine hochwertige Fluoreszenzkamera, die für anspruchsvolle Low-Light-Anwendungen entwickelt wurde, mit der zugehörigen Software verwendet, um das Filamentwachstum zu überprüfen. Signifikante fluoreszierende Aggregate sollten in diesem Stadium nicht vorhanden sein, da dies auf eine Depolymerisation oder das Vorhandensein von denaturiertem Protein hinweisen kann. Es ist auch eine gute Idee, einen einfachen Mikroskop-Objektträger herzustellen, indem Mikrotubuli, MIX und ATP in den gleichen Verhältnissen wie in den Protokollen beschrieben kombiniert werden. Die Aktivität sollte mit der Kombination der Komponenten beginnen, und das Material sollte ähnlich wie in Abbildung 2C dargestellt aussehen, wobei Bündel vorhanden sind und spürbare Filamentbewegungen überall sichtbar sind.
Bei der Anwendung des Durchflusszellenverfahrens sind Zentrifugenzeit und Orientierung der Durchflusszelle wichtig für die Bildung einer gleichmäßigen aktiven Schicht. Dieser Schritt kann je nach verwendetem Zentrifugentyp eine Feinabstimmung erfordern. Das Zentrifugieren der Durchflusszelle mit der aktiven Ebene, die senkrecht zur Rotationsebene ausgerichtet ist, liefert die besten Ergebnisse, da das Material gleichmäßig auf die Fluidgrenzfläche gedrückt werden kann. Überprüfen Sie, ob die Durchflusszelle vor dem Zentrifugieren sorgfältig verschlossen ist.
Bei der Verwendung der invertierten Methode zur Erzeugung von beschränkten aktiven Nematiken gibt es mehrere Schritte zur Optimierung. Zunächst ist es wichtig, ein 3D-Druckverfahren zu verwenden, das hochauflösende Strukturen erzeugt. Unebene Seitenwände können dazu führen, dass sich die Mikrotubuli verfangen, was die Strömungen stört. Die Vertiefungen sollten nicht zu tief sein (in dieser Studie wurden 150-200 μm tiefe Bohrungen mit einer 2 mm dicken darüber liegenden Ölschicht verwendet). Experimentatoren müssen diese Parameter möglicherweise durch Versuch und Irrtum leicht anpassen, um das beste Ergebnis zu erzielen.
Die Flusszellenmethode und die invertierte Methode wurden von verschiedenen Autoren verwendet, um eine Vielzahl von Effekten zu untersuchen, die sich auf die aktiven Strömungen auswirken, einschließlich verschiedener Öle12 und untergetauchter Strukturen13. Die Wahl der Methode hängt vom experimentellen Ziel ab. Bei der Durchflusszellenmethode ist die optische Abbildung von oberhalb der aktiven Schicht aufgrund der unterschiedlich darüber liegenden Flüssigkeiten klarer als bei der inversen Methode. Bei der Durchflusszellenmethode erfolgt die Bildgebung durch einen Glasdeckel und eine dünne Wasserschicht, während die umgekehrte Methode so konzipiert ist, dass die Ölschicht oben liegt. Dies bedeutet, dass für die invertierte Methode ein Objektiv mit großem Arbeitsabstand erforderlich ist und die Bildqualität verringert wird. Unterschiede in der Bildqualität können durch den Vergleich von Abbildung 2D (Flusszellenmethode) und Abbildung 3 (invertierte Methode) bzw. Film 1 bzw. Film 2 gesehen werden. Für Abbildung 3 war ein Objektiv mit geringerer Vergrößerung und einem längeren Arbeitsabstand erforderlich als für Abbildung 2. Diese Abbildungsnachteile für das invertierte Verfahren können vermieden werden, wenn ein geeignetes inverses Mikroskop zur Verfügung steht, kombiniert mit Objektiven mit einem geeigneten Arbeitsabstand für die Objektträgersubstrate. Dünneres Glas kann als Substrat verwendet werden, um die Verwendung von Standard-Arbeitsabstandsobjektiven zu ermöglichen.
Als Vorteil ermöglicht die invertierte Geometrie die Verwendung eines breiteren Bereichs von Ölviskositäten, erfordert nicht unbedingt eine Schwenkschaufelzentrifugation (falls diese nicht verfügbar ist) und die Vorbereitung des Systems ist relativ einfacher, sobald die Form vorbereitet ist. Für den Einschluss in Bohrlöchern mit der invertierten Methode kann jedoch eine gewisse Zentrifugation wichtig sein, um das Material in eine gut definierte 2D-Schicht zu bringen.
Die Flusszellenmethode wird in jüngster Zeit sehr erfolgreich in Experimenten eingesetzt, bei denen eine kontinuierliche aktive Schicht erforderlich ist. Unsere jüngsten Arbeiten haben die Dynamik topologischer Defekte in der aktiven Schicht untersucht, wobei qualitativ hochwertige Bildgebung und Texturanalyse wichtig sind19. Darüber hinaus wurde die Flusszellenmethode verwendet, um die Auswirkungen von ölgetauchten Mikrostrukturen auf aktive Strömungen16 und Säulen zu untersuchen, um Defekte in den aktiven Strömungen31 einzufangen. Diese Methode eignet sich sehr gut für die Bildung einer kontinuierlichen aktiven Schicht und die Bildqualität ist ausgezeichnet. Der Zentrifugationsschritt, der zur Herstellung der endgültigen aktiven 2D-Schicht verwendet wird, kann jedoch schwierig durchzuführen sein, und die Durchflusszellen sind anfällig für Leckagen und Luftblasen. Die invertierte Methode ist eine sehr nützliche Alternative mit einer hohen Erfolgsquote, ist einfach zu konstruieren und kann für jedes Substratmuster oder jede Geometrie verwendet werden, sofern eine hochauflösende 3D-gedruckte Masterform erstellt werden kann. Diese Methode ist auch nützlich, um die Auswirkungen des geometrischen Einschlusses auf die aktive nematische Dynamik zu untersuchen, da sie das Füllen von Vertiefungen relativ einfach macht.
In dieser Arbeit werden zwei Möglichkeiten zur Bildung eines aktiven Nematikums aus Mikrotubuli und Kinesinmotoren sowie eine Technik zum Einschließen der Materialien in Vertiefungen beschrieben. Das vorgestellte System stellt das sauberste Beispiel für eine aktive nematische Phase dar, das derzeit in der Literatur ist und von mehreren Gruppen auf der ganzen Welt reproduziert wurde. Die Bedeutung dieses Materials liegt nicht nur in der biologischen Herkunft seiner Bestandteile, sondern auch, weil es eine völlig neue Richtung in aktiv geordneten Fluiden eröffnet. Durch die Arbeit mit diesem System und die Aufklärung seiner grundlegenden Eigenschaften können Wissenschaftler zum Design vollsynthetischer aktiver Phasen übergehen.
Die Experimente, die sich auf die Auswirkungen von Confinement auf aktive Nematika konzentrieren, haben das Potenzial, grundlegende Fragen zum Verhalten aktiver Strömungen und zur topologischen Defektdynamik unter topologischem Einschluss zu beantworten. Die hier vorgestellte Methode wird bei der Durchführung einer Vielzahl von geometriefokussierten Experimenten und deren Analyse, einschließlich Mikrofluidik und aktivem Mischen, helfen.
Offenlegungen
Einige Materialien, die in dieser Arbeit verwendet wurden, wurden von Cytoskeleton Inc. (Denver, USA) kostenlos zur Verfügung gestellt.
Danksagungen
Die Autoren möchten den Preis der National Science Foundation (NSF) DMR-1808926 für die großzügige Finanzierung würdigen. Das Projekt wurde auch von der NSF durch das Center of Research Excellence in Science and Technology: Center for Cellular and Biomolecular Machines an der University of California Merced (HRD-1547848) und das Brandeis Biomaterials Facility Materials Research Science and Engineering Center (DMR-2011486) unterstützt. Wir danken Dr. Bin Liu von der University of California Merced für die Unterstützung beim 3D-Druck der Form und Dr. Jordi Ignes für die wissenschaftliche Beratung bei der Entwicklung der inversen experimentellen Methode.
Materialien
| Name | Company | Catalog Number | Comments |
| 20 kD PEG (polyethylene glycol)) | Sigma Aldrich | 1419109 | Depletion agent CAS Number: 125061-88-3 |
| 3-(trimethoxysilyl)propyl methacrylate | Sigma Aldrich | M6514-50ML | CAS Number: 2530-85-0 |
| 3D printer & Resin | Phrozen | Phrozen sonic mini 8K 3D printer - Aqua Gray 8K resin | |
| 40% Acrylamide Solution | BIO-RAD | 1610140 | CAS Number: 7732-18-5, 79-06-1 |
| Acetic Acid | Fisher | CAS Number: 64-19-7 | |
| Acetone | Sigma Aldrich | CAS Number: 67-64-1 | |
| Adhesive sheets (NOTE: "Parafilm" is an alternative) | Grace Bio-Labs | 620001 | SecureSeal |
| Ammonium Persulfate | Sigma Aldrich | A3678 | CAS Number: 7727-54-0 |
| Aquapel (NOTE: "RainX" is an alternative) | Aquapel Glass Treatment | hydrophobic glass treatment | |
| ATP (Adenosine triphosphate) | Sigma Aldrich | A1852 | CAS Number: 34369-07-8 |
| Beakers | VWR | ||
| Catalase | Sigma Aldrich | C9322 | CAS Number: "9001-05-2" |
| Desiccator | Bel-art | ||
| Digital CMOS camera | Hamamatsu | ORCA - Flash4.0 LT+ | |
| DTT (Dithiothreitol) | Sigma Aldrich | D9779 | CAS Number: "3483-12-3" |
| EGTA (3,12-bis(carboxymethyl)-6,9-dioxa-3,12-diazatetradecane-1,14-dioic acid) | Sigma Aldrich | MFCD00004291 | CAS Number: 67-42-5 |
| Ethanol | Sigma Aldrich | CAS Number: 64-17-5 | |
| Fluorescence microscope | Leica | DM 2500P | |
| Glass Coverslips | VWR | 48368-040 | |
| Glass Slides | VWR | 16004-430 | |
| Glucose | Sigma Aldrich | G7021 | CAS Number: 50-99-7 |
| Glucose Oxidase | Sigma Aldrich | 345386 | CAS Number: 9001-37-0 |
| GMPCPP (guanylyl 5'-α,β-methylenediphosphonate) | Jena Bioscience | NU-405S | CAS Number: 14997-54-7 |
| HFE7500 Oil | 3M | ||
| Hot Plate | Fisher Scientific | Thermix hot plate model 100M | |
| Isopropyl Alcohol | VWR | ||
| KCl (potassium chloride) | Sigma Aldrich | P5405 | CAS Number: 7447-40-7 |
| Methanol | Sigma Aldrich | CAS Number: 67-56-1 | |
| MgCl2 (Magnesium Chloride) | Sigma Aldrich | 208337 | CAS Number: 7786-30-3 |
| Microcentrifuge tubes | Eppendorf - Thermo Fisher | 1.5 mL | |
| Nanopure water purifier | Sartorius | arium mini | |
| NaOH (Sodium hydroxide) | Sigma Aldrich | SX0603 | CAS Number: 1310-73-2 |
| Petri Dishes | VWR | ||
| PH Meter | Thermo Scientist | Orion 3 STAR | |
| Phosphoenol-pyruvate (PEP) | Sigma Aldrich | MFCD00044476 | CAS Number: 4265-07-0 |
| PIPES (1,4-Piperazinediethanesulfonic acid) | Sigma Aldrich | CAS Number: 5625-37-6 | |
| Pipettes (0.2 - 1000 µl) | VWR | ||
| Pluronic F-127 | Sigma Aldrich | 2594628 | |
| RAN Surfactant (NOTE: "FluoSurf" from Emulso is an alternative) | Ran Biotechnologies | 008-FluoroSurfactant-2wtH-50G | |
| Silicon Oil (100mpa s-1000 mpa s) | Sigma Aldrich | CAS Number: 63148-52-7 | |
| Streptavidin | Thermofisher | S888 | |
| Swinging Bucket Centrifuge | Thermo Scientist | Sorvall legend RT+ | |
| Sylgard 184 Elastomer base | World Precision Instruments | SYLG184 | |
| Sylgard 184 Elastomer Curing agent | World Precision Instruments | SYLG184 | |
| Table top centrifuge | Eppendorf | MiniSpin Plus | |
| TEMED (Tetramethylethylenediamine) | BIO-RAD | 1610800 | CAS Number: 110-18-9 |
| Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid) | Sigma Aldrich | MFCD00006846 | CAS Number: 53188-07-1 |
| Tubulin | Cytoskeleton | T240-B | |
| Tubulin (Rhodamine labeled) | Cytoskeleton | TL590M-A | |
| Ultracentrifuge | Beckman | Optima Max-TL | |
| UV Light | RapidFix | ||
| UV-curable glue (NOTE: "Norland NO81" is an alternative) | RapidFix | ||
| Water Bath | Thelco | ||
| Whatman Filter paper | Sigma Aldrich | WHA1001325 |
Referenzen
- Sokolov, A., Aranson, I. S., Kessler, J. O., Goldstein, R. E. Concentration dependence of the collective dynamics of swimming bacteria. Physics Review Letters. 98 (15), 158102 (2007).
- Saw, T. B., et al. Topological defects in epithelia govern cell death and extrusion. Nature. 544 (7649), 212-216 (2017).
- Kawaguchi, K., Kageyama, R., Sano, M. Topological defects control collective dynamics in neural progenitor cell cultures. Nature. 545 (97654), 327-331 (2017).
- Toner, J., Tu, Y. Long-range order in a two-dimensional dynamical XY model: how birds fly together. Physics Review Letters. 75 (23), 4326-4329 (1995).
- Katz, Y., Tunstrøm, K., Ioannou, C. C., Huepe, C., Couzin, I. D. Inferring the structure and dynamics of interactions in schooling fish. Proceedings of the National Academy of Sciences. 108 (46), 18720-18725 (2011).
- Needleman, D., Dogic, Z. Active matter at the interface between materials science and cell biology. Nature Reviews Materials. 2 (9), 17048 (2017).
- Weirich, K., Dasbiswas, K., Witten, T. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences. 116 (23), 11125-11130 (2019).
- Memarian, F. L., et al. Active nematic order and dynamic lane formation of microtubules driven by membrane-bound diffusing motors. Proceedings of the National Academy of Sciences. 118 (52), (2021).
- Bausch, A., Sciortino, A. R. Pattern formation and polarity sorting of driven actin filaments on lipid membranes. Proceedings of the National Academy of Sciences. 118 (6), (2021).
- Maroudas-Sacks, Y., et al. Topological defects in the nematic order of actin fibres as organization centres of Hydra morphogenesis. Nature Physics. 17 (2), 251-259 (2021).
- Liu, J., et al. Topological braiding and virtual particles on the cell membrane. Proceedings of the National Academy of Sciences. 118 (34), (2021).
- Hirst, L. S. . Fundamentals of Soft Matter Science 2nd ed. , (2019).
- Sanchez, T., Chen, D., DeCamp, S., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Guillamat, P., Ignés-Mullol, J., Sagués, F. Taming active turbulence with patterned soft interfaces. Nature Communications. 8, 564 (2017).
- Thijssen, K., et al. Submersed micropatterned structures control active nematic flow, topology, and concentration. Proceedings of the National Academy of Sciences. 118 (38), (2021).
- Shendruk, T. N., Doostmohammadi, A., Thijssen, K., Yeomans, J. M. Dancing disclinations in confined active nematics. Soft Matter. 13 (21), 3853-3862 (2017).
- Giomi, L. Geometry and topology of turbulence in active nematics. Physical Review X. 5 (3), 031003 (2015).
- Tan, A. J., et al. Topological chaos in active nematics. Nature Physics. 15 (10), 1033-1039 (2019).
- Young, E. C., Berliner, E., Mahtani, H. K., Perez-Ramirez, B., Gelles, J. Subunit interactions in dimeric kinesin heavy chain derivatives that lack the kinesin rod. The Journal of Biological Chemistry. 270 (8), 3926-3931 (1995).
- Gilbert, S. P., Johnson, K. A. Expression, purification, and characterization of the Drosophila kinesin motor domain produced in Escherichia coli. Biochemistry. 32 (17), 4677-4684 (1993).
- Kuznetsov, S. A., Gelfand, V. I., Vernos, I. . Kinesin Protocol. 164, (2001).
- Hawkins, T. L., Sept, D., Mogessie, B., Straube, A., Ross, J. L. Mechanical properties of doubly stabilized microtubule filaments. Biophysics Journal. 104 (7), 1517-1528 (2013).
- Bate, T. E., Jarvis, E. J., Varney, M. E., Wu, K. Controlling flow speeds of microtubule-based 3D active fluids using temperature. Journal of Visualized Experiments. (153), e60484 (2019).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Tayar, A. M., Lemma, L. M., Dogic, Z. Assembling microtubule-based active matter.. Microtubules. , 151-183 (2022).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Guillamat, P., Ignés-Mullol, J., Shankar, S., Marchetti, M. C., Sagués, F. Probing the shear viscosity of an active nematic film. Physical Review E. 94 (6), 060602 (2016).
- Rudy, A., et al. Lubricous hydrogel surface coatings on polydimethylsiloxane (PDMS). Tribology Letters. 65, 3 (2017).
- Venzac, B., et al. PDMS curing inhibition on 3D-printed molds: Why? Also, how to avoid it. Analytical Chemistry. 93 (19), 7180-7187 (2021).
- Khaladj, D. A., Hirst, L. S. Using curved fluid boundaries to confine active nematic flows. Frontiers of Physics. 10, 880941 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten