Method Article
Mikrotübül Tabanlı Aktif Nematiklerin Oluşturulması, Sınırlandırılması ve Gözlemlenmesi
Bu Makalede
Özet
Burada, protein hazırlama ve yapım ve aktif nematik hapsetme için kuyuların kullanımı da dahil olmak üzere mikrotübüllerden ve kinesin motorlarından aktif nematiklerin hazırlanması için yöntemler sunulmaktadır.
Özet
Biyopolimer bazlı aktif fazların oluşumu, ortaya çıkan aktif sıvı kristal alanını ve hücre biyolojisindeki olası rollerini araştırmak isteyen araştırmacılar için önemli bir teknik haline gelmiştir. Bu yeni sistemler, yerel olarak enerji tüketen ve dengesiz bir dinamik sıvı üreten kendinden tahrikli alt birimlerden oluşur. Bu raporda tarif edilen aktif sıvı kristal fazı oluşturmak için, biyopolimerler ve moleküler motorlar dahil olmak üzere saflaştırılmış protein bileşenleri birleştirilir ve aktif nematik faz, adenozin trifosfat (ATP) varlığında kendiliğinden oluşur. Nematik durumu gözlemlemek için, malzeme yeterince yüksek bir yoğunlukta mikroskopi için uygun bir geometride sınırlandırılmalıdır. Bu makalede, mikrotübüller ve kinesin motorları kullanılarak aktif bir nematik fazın oluşumu için iki farklı yöntem açıklanmaktadır: bir yağ ve su arayüzünde iki boyutlu bir aktif tabakanın montajı ve elastomerik bir kuyu kullanılarak bir yağ tabakası altında montaj. Aktif malzemeyi farklı şekillerde küçük kuyucuklara yerleştirme teknikleri de açıklanmaktadır.
Giriş
Aktif sıvılar, enerji tahrikli parçacıklardan veya yerel ortamlarından yakıt çeken elementlerden oluşur. Doğru koşullar altında, bu hareketli aktif elementler, uzun uzunluk ölçeklerinde ortaya çıkan akışkanlar dinamiğini üretmek için toplu olarak hareket edebilir. Literatürde bu tür denge dışı faz davranışının çeşitli örnekleri vardır ve aktif fazlar canlı sistemlerin spektrumunda bulunabilir. Bazı dikkate değer örnekler bakteri kolonileri1, hücre tabakaları2,3 ve organizmaların sürüsü veya kaynaşması 4,5'tir. Aktif fazlar ayrıca, hücre6'nın bir parçası olarak veya biyolojik olarak ekstrakte edilmiş bileşenlerin 7,8,9'unu kullanmak için tasarlanmış sentetik sistemlerde, hücre iskelet filamentlerinin yoğunlaştırılmış fazlarında kapsamlı bir şekilde incelenmiştir. Sıvı kristalin sıralama ve biyolojik ekstraktlardan toplanan hem doğal olarak oluşan hem de sentetik sistemlerde topolojik kusurların oluşumu, araştırma topluluğunun özellikle ilgisini çekmektedir. Son yıllarda, araştırma grupları bu tür sistemleri, temel fiziksel özelliklerini ve biyoloji ile ilgilerini incelemiştir 2,3,10,11.
Bu yazıda mikrotübüller ve kinesin motor proteinlerinin kombinasyonundan aktif nematik durumun oluşumu üzerinde durulmuştur. Geleneksel nematik sıvı kristal, kurucu moleküllerin oryantasyonel düzen sergilediği maddenin bir denge fazıdır. Örneğin, nispeten sert çubuk benzeri moleküllerden oluşan bir sıvı hem nematik fazı hem de daha yüksek sıcaklıklarda yönlendirilmemiş bir izotropik sıvı fazı12'yi sergileyebilir. Aktif bir nematik fazın ilk deneysel örneği, Sanchez ve ark.13 tarafından, komşu mikrotübül demetleri arasında bir kesme hareketi üretmek için motor protein kümelerinin kullanıldığı daha önceki bir in vitro deney14'ü uyarlayarak geliştirilmiştir. Bu mikrotübül sistemi ince bir tabaka ile sınırlandığında, kendiliğinden nematik düzen ortaya çıktı. Son yıllarda, aktif nematik durum, birkaç deneysel 15,16 ve teorik 17,18 araştırma grubu tarafından, aktif türbülans - akışkanın kendi kendine yönlendirilen kaotik akışlar ürettiği bir durum 19 - ve mobil topolojik kusurlar gibi fenomenlere odaklanarak yoğun bir şekilde incelenmiştir. Bu yazıda mikrotübüllerden ve kinesin motorlarından aktif nematik durumun farklı deneysel geometrilerde hazırlanması ve oluşturulması yöntemleri anlatılmaktadır. İlk olarak, farklı bileşen çözeltileri için hazırlama yöntemleri, ardından iki farklı akış odası geometrisi kullanarak aktif nematik oluşturma yöntemleri açıklanmaktadır. Tipik görüntüleme sonuçları gösterilmiştir. Son olarak, aktif nematiği kuyucuklarda ve kanallarda sınırlama yöntemleri açıklanmaktadır.
Protokol
1. Aktif malzemenin hazırlanması
NOT: 2D aktif nematik üç aşamalı bir işlemle monte edilir. İlk olarak, iki ayrı çözelti hazırlanır: a) polimerize, stabilize mikrotübüller ve b) MIX (kinesin motorları içeren bir çözelti). Bunlar birleştirilir ve adenozin trifosfat (ATP) eklenerek aktivite başlatılır. Malzeme daha sonra uygun bir geometride sınırlandırılır, böylece yoğunluğu nematik düzenin ortaya çıkması için yeterince yüksektir. Gerekli tüm bileşenlerin hazırlanması ve aktif fazın nasıl monte edileceği için protokoller dahil edilmiştir.
- Kinesin motor protein kümesi hazırlama
- Edgar C. Young 20 tarafından protokolü izleyerek Escherichia coli'den rekombinant K401-BIO motor proteinlerini (K401 motorları) eksprese edin ve saflaştırın.
NOT: K401-BIO motor proteinleri dimeriktir ve sarmal bir sapla bağlanmış iki kafadan oluşur. Motorlar Brandeis Biyomalzemeler Tesisi tarafından tedarik edildi ve daha önce bildirildiği gibi kullanıldı16. Aktif bir nemetik oluşturmak amacıyla, kinesin molekülleri biyotinillenir ve daha sonra dört motora kadar kinesin kümeleri oluşturmak için bir streptavidin bağlantısı ile bağlanır 13,15,21,22. Kinezini yeşil floresan protein (GFP) etiketi ile ifade etmek yararlıdır. - Streptavidin ve motorların 40 dakika boyunca buz üzerinde saflaştırılması ve inkübasyonundan sonra, K401 motorlarını sıvı azot içinde 5 μL alikotta 0,7 mg/mL'lik son konsantrasyonda flaşla dondurun ve -80 °C'de saklayın.
NOT: Deney burada duraklatılabilir. Gerektiğinde kinezini yavaşça çözün ve tekrar dondurmayın. - 0,7 mg/mL K401 motorların %24 vol'ünü, 0,325 mg/mL streptavidin'in 27 vol'unu ve 5 mM ditiyotreitolün (DTT) 3 volesini (agregasyonu önlemek için) 4 °C'de %46 hacimli M2B tamponunda (80 mM BORULAR [1,4-Piperazinedietanesülfonik asit, pH 6,8], 2 mM MgCl2 ve 1 mM EGTA [etilen glikol-bis(β-aminoetil eter)-N, N,N′,N′-tetraasetik asit]). KSA'nın 40 dakika boyunca buz üzerinde kuluçkaya yatmasına izin verin.
- Edgar C. Young 20 tarafından protokolü izleyerek Escherichia coli'den rekombinant K401-BIO motor proteinlerini (K401 motorları) eksprese edin ve saflaştırın.
- Mikrotübül çözeltisi hazırlama
NOT: Guanosin-5'-[(α,β)-metileno]trifosfat, sodyum tuzu (GMPCPP), Guanozin trifosfatın (GTP) yavaş hidrolize edilebilir bir analoğudur ve GMPCPP varlığında oluşan mikrotübüller, GTP mikrotübülleri23 ve daha kısasından üç kat daha serttir. Kısa, sert mikrotübüllerin kullanımı, aktif nematik fazın oluşumu için elverişlidir, çünkü bu faktörler sıvı kristalin sıralamayı teşvik etmek için birleşir.- 6 mg / mL'lik bir tübülin konsantrasyonunda 0.6 mM GMPCPP kullanarak etiketsiz döngüsel tübülini (% 99, Malzeme Tablosuna bakınız) polimerize edin.
NOT: Yüksek kaliteli tübülin, belirlenmiş protokolleri takiben sığır veya domuz beyninden de arındırılabilir veya malzemelerin hasarı önlemek için dondurulmuş olarak gönderilebileceği Brandeis Biyomalzemeler Tesisi gibi başka bir güvenilir kaynaktan elde edilebilir. Sığır beyninden tübülin saflaştırılması için lütfen Bate ve ark.24'ün yayınladığı protokole bakın. Domuz beyninden tübülin saflaştırılması için, Castoldi ve ark.25 ve Tayar ve ark.26'nın yayınlanmış protokollerine bakın. - Polimerizasyona hazırlık olarak, 37 ° C'de bir ısı banyosu hazırlayın ve santrifüjü 4 ° C'ye kadar önceden soğutun. Polimerizasyondan sonra% 4 etiketli mikrotübüller üretmek için etiketsiz tübülin çözeltisini M2B tamponunda (adım 1.1.3) 500 μL'lik bir ultrasantrifüj tüpünde% 4 mol rodamin etiketli tübülin ile birleştirin (bkz.
- Bradford testi27 kullanarak tübülin konsantrasyonunu doğrulayın. Santrifüj tüpündeki toplam tübülin konsantrasyonu 6.5-6.9 mg/mL olmalıdır.
- Tübülin karışımını 10 dakika boyunca buz üzerinde ve 4 ° C'de 352.700 x g'de 10 dakika boyunca ultrasantrifüj ile inkübe edin. Bu adım, pelette olacak işlevsiz tübülini ortadan kaldırır.
- Bir pipet kullanarak, fonksiyonel tübülin içeren süpernatantı dikkatlice bir mikrosantrifüj tüpüne çıkarın. Tübülin polimerizasyonunu indüklemek için GMPCPP'yi 0,6 mM'lik bir son konsantrasyona ve protein agregasyonunu önlemek için DTT'yi 1 mM'lik bir nihai konsantrasyona ekleyin.
- Karışımı 37 ° C'de ısı banyosunda 30 dakika boyunca inkübe edin, ardından oda sıcaklığında 14.000 x g'da 10 dakika boyunca tekrar santrifüj yapın. Süpernatanı çıkarın, ardından 6 mg / mL'lik son bir mikrotübül konsantrasyonuna ulaşmak için peleti M2B tamponu ile seyreltin.
NOT: Bu çözelti, kullanımdan önce oda sıcaklığında en az 4 saat saklanabilir. - Mikrotübüllerin başarılı bir şekilde polimerize olup olmadığını kontrol etmek için, mikrotübül çözeltisi 100:1'in 1 μL'sini mikroskop sürgüsü üzerinde M2B tamponu ve pipet ile seyreltin. 40x objektif lensle floresan mikroskobu kullanarak görüntüleme için bir kapak fişi ile örtün (bkz.
NOT: Uyarma ve emisyon dalga boyları, mikrotübüller üzerinde kullanılan floresan etiketlemeye göre seçilir. Bu protokolde, rodamin etiketleme kullanılır (bkz. adım 1.2.2), bu nedenle görüntüleme 515-560 nm'lik bir uyarma bandı ve 590 nm uzun geçiş filtresi kullanılarak gerçekleştirilir. Şekil 1'de temsili bir örnek gösterilmektedir. - Polimerizasyon tamamlandıktan sonra, mikrotübülleri sıvı azotta 2 μL alikot olarak damlatın ve -80 ° C'de (gerekirse) saklayın.
- 6 mg / mL'lik bir tübülin konsantrasyonunda 0.6 mM GMPCPP kullanarak etiketsiz döngüsel tübülini (% 99, Malzeme Tablosuna bakınız) polimerize edin.
- MIX'in hazırlanması
NOT: MIX, kinezin-streptavidin kümelerini (KSA) içeren sulu bir çözeltidir. Hazırlanan MIX, deneyden önce 4 μL alikotta -80 °C'de saklanmalıdır. MIX, oda sıcaklığında ATP ve adım 1.2'de açıklanan mikrotübül çözeltisi ile birleştirildiğinde, aktivite başlatılır. MIXaşağıdaki 13,19 şeklinde hazırlanır.- İki antioksidan çözeltiyi karıştırarak floresan solmasını (ANTIFADE) önlemek için bir çözelti hazırlayın. AO1 (250 mM DTT, 65 mM katalaz) ve AO2'yi (750 μM katalaz, 3 mM glikoz oksidaz) 1:1 hacim oranında birleştirin. Floresan mikroskobunun neden olduğu hasarı azaltmak için kullanılan başka bir antioksidan olan 20 mM Trolox'u dahil edin.
- ATP rejenerasyonu için 70 mg / mL'de mikrotübüllerin paketlenmesini indüklemek için ağırlıkça% 6 20 kDa polietilen glikol (PEG), 3 hacimli% ANTIFADE ve% 5 vol% piruvat kinaz / laktik dehidrogenaz (PKLDH) içeren bir KSA çözeltisi (adım 1.1.3'te açıklanmıştır) yaparak MIX'i hazırlayın.
2. Aktif nematik oluşturma
NOT: Malzemedeki aktivite ATP ilavesi ile başlatılır. Aktif ağ, motor aktiviteyi indükleyecek kadar yüksek bir konsantrasyonda ATP eklenerek her deney için taze olarak hazırlanır. Üniforma, tamamen gelişmiş bir aktif nematik faz oluşturmak için, mikrotübüller yeterince yüksek bir yoğunlukta olmalıdır. Bu, iki boyutlu (2D) aktif bir nematik tabaka oluşturmak için mikrotübülleri iki karışmaz sıvı arasında sınırlandırarak elde edilebilir. Bu yöntem ilk olarak Brandeis Üniversitesi13'te geliştirilmiştir ve homojen, yüksek kaliteli, aktif bir nematik faz üretmek için popüler bir teknik olmaya devam etmektedir.
- Aktif nematik oluşum için akış hücresi yöntemi
- Akrilamid kaplamalı hidrofilik kapaklar hazırlayın.
- Kapakları sabunlu su, etanol ve 0,1 M NaOH ile nanosaf su kullanarak alternatif durulamalarla iyice temizleyin. Durulandıktan sonra, kapakları 100 mL etanol, 1 mL asetik asit ve 500 μL 3-(trimethoxysilyl) propilmetakrilattan oluşan bir silan çözeltisi ile 15 dakika boyunca kaplayın, ardından nanosaf su ile durulayın.
- 95 mL nanosaf sudan ve 5 mL ağırlıkça% 40 akrilamid çözeltisinden bir akrilamid çözeltisi hazırlayın, ardından çözeltiyi vakumlu bir fırında 30 dakika boyunca gazdan arındırın.
- 2.3 mM nihai konsantrasyon için 35 μL tetrametilenilendiamin (TEMED) ve daha sonra 0.07 g amonyum persülfat ekleyin. Akrilamid çözeltisini yukarı bakacak şekilde kapakların üzerine dökün ve gece boyunca oda sıcaklığında inkübe edin.
- Hidrofobik mikroskop slaytları hazırlayın. 100 μL'lik su itici bir çözelti pipetiyle (bkz. Malzeme Tablosu) temiz bir cam mikroskop slaydının üzerine yerleştirin, ardından üstüne başka bir temiz cam slayt yerleştirin. Bu, su itici çözeltinin 2 dakika boyunca oturduğu yüzeyde eşit bir şekilde kaplanmasını sağlar. 2 dakika sonra, ikinci cam sürgüyü çıkarın ve ilk slaytı nano-saf suyla iyice durulayın, ardından azot gazı ile kurulayın. Su itici çözeltinin cama yapışmayı önlemediğinden emin olmak için bandın yerleştirileceği bölgeyi (desenin etrafında) asetonla nazikçe temizleyin.
- %1,8 (v/v) 008-FloroSürfaktan içeren bir mühendislik yağı karışımı hazırlayın (bkz.
- Cam sürgüyü ve kapak kaymasını, akış hücresinin altındaki hidrofobik cam slayt ve hidrofilik kapak kayması ile 40 μm çift taraflı yapışkan ara parçalar kullanarak bir sandviç geometrisinde üst yüzey olarak monte edin. Ara parçaları hidrofobik mikroskop sürgüsüne 1,5 mm aralıklarla yerleştirin. Daha sonra, akrilamid kaplı kapak kayışını, yapışması için tedavi edilen yan yüzü aşağı bakacak şekilde ara parçaların üzerine yerleştirin. Yapışmanın künt bir nesneden gelen basınçla tamamlandığından emin olun.
NOT: Amaç, içinde düz bir yağ/su arayüzü bulunan bir akış hücresinin monte edilmesidir (Şekil 2A,B). Aktif katmanın oluşacağı yer burasıdır. Benzer bir hücre kalınlığı üretmek için alternatif ara bantlar ve filmler de kullanılabilir. - Akış hücresi oluşturulduktan sonra, yağ karışımını derhal akış hücresine pipetleyin ve kapalı alanı doldurun.
- Bir pipet kullanarak, ayrı bir şişede 6 μL aktif malzemeyi 3.73 μL MIX, 1 μL mikrotübül çözeltisi, 0.6 μL ATP çözeltisi (konsantrasyon mikrotübül hızını değiştirecek şekilde değiştirilebilir) ve 0.67 μL M2B tamponu ile yavaşça karıştırın.
- Pipet, akış hücresinin bir açık ucuna taze karıştırılmış aktif malzeme, hacimler değişecektir, ancak akış hücresinin hacmini (kabaca 3-6 μL) aşmalıdır. Bazı yağlar, kanala enjekte edildiğinde sulu çözelti tarafından yer değiştirecektir; bu, küçük bir kağıt mendil parçası kullanılarak akış kanalının karşı ucunda kötülenebilir.
- Doldurduktan sonra, akış hücresinin her iki tarafını 20 sn UV ışığına maruz kaldığında sertleşen bir epoksi yapıştırıcı (bkz.
NOT: Bu noktada, aktif malzeme su tabakasında asılı kalan bir 3D ağ oluşturur. - Aktif tabakayı iki karışmaz sıvı arasında yarı-2B bir tabakada sınırlamak için, akış hücresini sallanan bir kova santrifüjüne yerleştirin (bkz. Malzeme Tablosu) üstte sulu faz ve altında daha yoğun yağ tabakası bulunur. 10 dakika boyunca 212 x g'de santrifüj. Bu adım tamamlandıktan sonra, akış hücresi 10x veya 20x büyütme hedefi ile görüntüleme için bir epi-floresan mikroskobuna alınabilir. Şekil 2C,D, bu adımdan önce ve sonra tipik görüntüleri gösterir.
- Akrilamid kaplamalı hidrofilik kapaklar hazırlayın.
- Aktif nematik oluşum için ters çevrilmiş yöntem
NOT: Adım 2.1'de açıklananlara alternatif bir yöntem, aktif nematik tabakayı derin bir PDMS kuyusu28 ile sınırlı kalın bir yağ tabakasının altına monte etmektir. Bu yöntem benzer sonuçlar verir ve ustalaşması biraz daha kolaydır; ancak, bu yöntemi kullanan görüntü kalitesi genellikle akış hücresi yöntemi kadar iyi değildir.- Polidimetilsiloksanı (PDMS) bir elastomer kürleme maddesi ve bir elastomer baz kullanarak hazırlayın (bkz. İki bileşeni metal spatula kullanarak 1:10 oranında karıştırın. Karıştırma sırasında çıkarılması zor olan küçük kabarcıklar ortaya çıkar ve karışım sütlü görünür. Bu kabarcıkları çıkarmak için, karışımı 1 saat boyunca gazdan arındırmak için bir vakum altına yerleştirin, bundan sonra kürlenmemiş PDMS şeffaf görünmelidir.
NOT: PDMS artık bir kalıp kullanarak herhangi bir şekil oluşturmaya hazırdır veya kapta kürlenebilir ve daha sonra istenen desende kesilebilir veya delinebilir. - PDMS'yi uygun bir kalıba dökün ve 60 ° C'de kürlenmek üzere gece boyunca bekletin.
NOT: Tedavi edilmemiş, kürlenmiş PDMS'nin yüzeyi hidrofobiktir, ancak yüzey işlemi ile hidrofilik hale getirilebilir. - Hidrofilik bir PDMS yüzeyi hazırlamak için, PDMS'yi bir akrilamid polimer fırça29 ile kaplayın. Bu adım aynı zamanda proteinlerin yüzeye yapışmasını da önler.
- PDMS'yi hem etanol hem de izopropanol ile 10 dakika temizleyerek başlayın, ardından 3x deiyonize su ile iyice durulayın ve kurutun. Kuru, kürlenmiş PDMS'yi temizlemek için 5 dakika boyunca bir plazma temizleyici kullanın. Bu adım yüzeyi daha hidrofilik hale getirir.
- Daha sonra, bir silan çözeltisi hazırlayın (ağırlıkça% 98.5 etanol, ağırlıkça% 1 asetik asit ve% 0.5 Trimetoksisilil propil metakrilat) ve akrilamid kaplamaya hazırlanmak için substratı bu çözeltiye 15 dakika batırın. Substratı deiyonize suyla iyice durulayın ve akrilamid çözeltisine daldırın (ağırlıkça% 2 akrilamid / bis çözeltisi, 2.3 mM TEMED ve 3 mM amonyum persülfat).
NOT: Bu substratlar, bir cam Petri kabında akrilamid çözeltisi ile kaplı oda sıcaklığında saklanabilir ve 2 hafta içinde kullanılmalıdır.
- Kullanıma hazır olduğunda, yüzeyi deiyonize suyla durulayın ve hemen kullanım için azotla kurulayın. Aktif karışımı (adım 2.1.6'da tanımlanmıştır) kuyucuklara ekleyin ve hemen üstüne yaklaşık 2 mm kalınlığa silikon yağı ekleyin.
NOT: Bu aşamada, aktif karışım PDMS üzerindeki yağ ve hidrofilik kaplama arasına sıkıştırılacaktır, ancak yine de biraz üç boyutlu olacaktır. - Malzemeyi bir 2B katmana daha fazla itmek için, PDMS cihazını bir cam kızağa yapıştırın, sallanan bir kova santrifüjüne yerleştirin ve 212 x g'de 12 dakika boyunca döndürün. Cihazın, silikon yağı sulu tabakanın üstünde olacak şekilde konumlandırılması gerekecektir. Temsili sonuçlar Şekil 3'te gösterilmiştir.
- Polidimetilsiloksanı (PDMS) bir elastomer kürleme maddesi ve bir elastomer baz kullanarak hazırlayın (bkz. İki bileşeni metal spatula kullanarak 1:10 oranında karıştırın. Karıştırma sırasında çıkarılması zor olan küçük kabarcıklar ortaya çıkar ve karışım sütlü görünür. Bu kabarcıkları çıkarmak için, karışımı 1 saat boyunca gazdan arındırmak için bir vakum altına yerleştirin, bundan sonra kürlenmemiş PDMS şeffaf görünmelidir.
3. Sınırlı geometrilerde aktif nematiklerin hazırlanması
NOT: Bu yarı-iki boyutlu sistem gibi aktif nematiklerin, kuyular veya kanallar gibi küçük mikroakışkan geometrilerle sınırlandırılması zor olabilir. Burada, malzemeyi farklı şekilli PDMS kuyucuklarına sınırlamak için güvenilir bir yöntem açıklanmaktadır.
- İlk olarak, PDMS için bir ana kalıp tasarlayın. Bu, bir alt tabaka üzerindeki 3D baskı sütunları ile elde edilebilir. Reçine ana kalıbını 3D yazdırdıktan sonra, izopropanol ile temizleyin ve daha sonra kalıbı 45 dakika boyunca bir UV lambası altında ve fırında 2 saat boyunca 120 ° C'de kürleyin (Şekil 4).
NOT: UV altında kürleme ve termal kürleme sonrası kürleme, reçine30'dan monomerleri ve foto inhibitör kalıntılarını gidererek PDMS'de replikasyon kalitesini artırır. - PDMS'den kuyucuklar oluşturmak için ana kalıbı kullanın. PDMS'yi adım 2.2.1'de açıklandığı gibi hazırlayın. Ana kalıbı kürlenmemiş PDMS'ye batırın ve gece boyunca 60 ° C'de bir fırında kürleyin.
- PDMS kürlemesi tamamlandıktan sonra, ana kalıbı dikkatlice çıkarın ve PDMS'yi kuyucuklarla çalışmak üzere istediğiniz gibi kesin (Şekil 4). PDMS yüzeyini adım 2.2.3'te açıklandığı gibi ele alın. Deneyden önce, görüntülemeyi kolaylaştırmak için yüzey epoksi yapıştırıcı ile bir cam slayta tutturulabilir.
- Adım 2.1.6'da tanımlanan aktif karışımın 1 μL'lik pipeti, PDMS substratı üzerine derhal aktif ağ damlacığının üzerine 100-1000 cSt viskozitesi28 olan silikon yağı ekleyin. Aktif ağ kuyuya taşınacaktır; bu işlem 60 dakika kadar sürer (Şekil 4). Adım 2.2.5'te açıklandığı gibi, 2D ağ, PDMS'yi sallanan kova santrifüjünde 212 x g'de 12 dakika boyunca iyice döndürerek geliştirilebilir.
Sonuçlar
Şekil 1, GMPCPP tübülinden hazırlanan tek mikrotübüllerin temsili bir görüntüsünü göstermektedir. Görüntü, benzer uzunluklardaki kısa mikrotübülleri göstermektedir (bazı dağılımlar mevcuttur). Mikrotübül çözeltisinin yeterli seyreltilmesi, uzunluk doğrulaması için iyi ayrılmış mikrotübüllerin bir görüntüsünü üretmelidir. Bireysel mikrotübüller, küçük boyutlarından dolayı görüntü almak zor olabilir. Floresan mikroskobu için tasarlanmış yüksek hassasiyetli bir kameranın kullanılması bu uygulama için en iyisidir. Şekil 2 ve Şekil 3, sırasıyla akış hücresi yöntemi (bölüm 2.1) ve ters çevrilmiş yöntem (bölüm 2.2) kullanılarak gerçekleştirilen başarılı deneylerin örnek floresan mikroskopi görüntülerini göstermektedir. İyi biçimlendirilmiş bir aktif nematik tabaka dokuda homojendir, önemli boşluk alanları ve hareketli topolojik kusurlar mevcut değildir. Bununla birlikte, kusur çekirdeklerinde bazı kabul edilebilir küçük boşluklar olabileceğini unutmayın. Şekil 2 ve Şekil 3'te gösterilen örneklere ek olarak, aktif nematiğin başarılı bir deneyde nasıl görünmesi gerektiğini göstermek için üç ek film (Film 1, Film 2 ve Film 3) eklenmiştir. Tüm filmler aktif nematik fazın pürüzsüz sürekli hareketini gösterir. Malzeme kararlı durumuna ulaştıktan sonra mikrotübül konsantrasyonunda herhangi bir değişiklik görülmez. Sistemde yeterli ATP mevcut olduğu sürece, malzeme düzgün bir şekilde hareket etmeye devam edecektir.
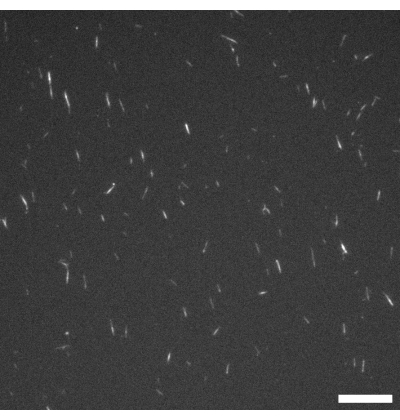
Resim 1: GMPCPP mikrotübüllerinin floresan mikroskop görüntüsü. GMPCPP mikrotübülleri, rodamin tübülin ile% 4 oranında etiketlendi ve 37 ° C'de 20 dakika boyunca polimerize edildi. Görüntüleme oda sıcaklığında yapıldı. Ölçek çubuğu = 10 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
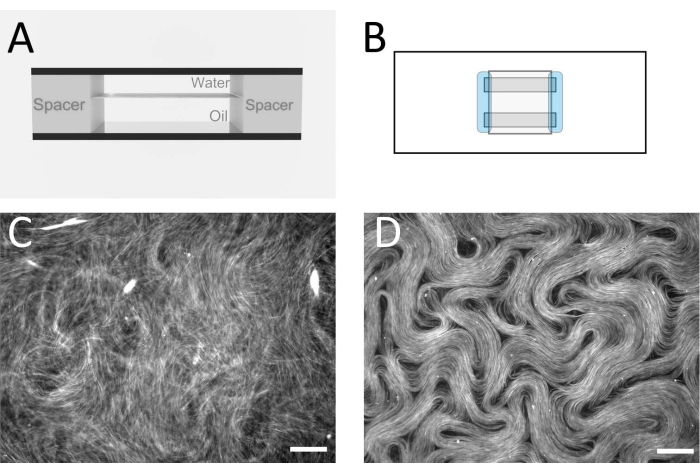
Resim 2: Bir akış hücresinde mikrotübül nematiği . (A) Akış hücresinin kesit şeması, 1 mm x 18 mm geometri. (B) Akış hücresinin üstten görünüm şeması. (C) Aktif çözeltinin yağ/su arayüzünde montajdan önceki tipik görünümünü gösteren floresan mikroskopi görüntüsü. (D) Akış hücresi içindeki yağ/su arayüzünde monte edilen aktif nematik fazın floresan mikroskopi görüntüsü. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Ters çevrilmiş yöntem kullanılarak hazırlanan aktif bir nematistiği gösteren floresan mikroskop görüntüsü. Ölçek çubuğu = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
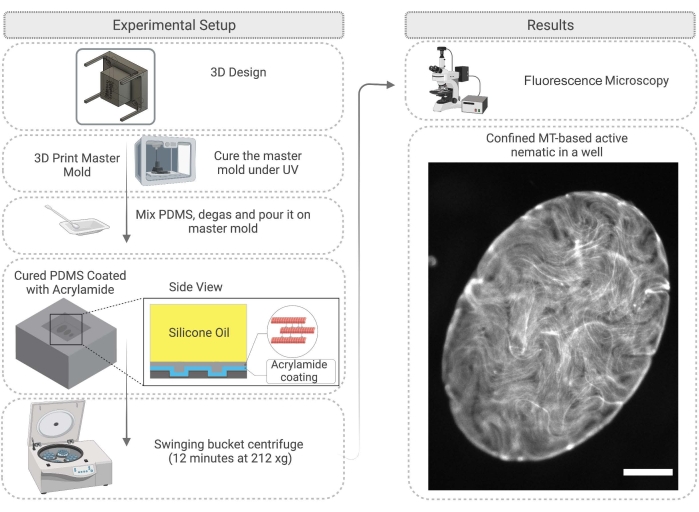
Şekil 4: Kalıp imalatı ve yüzey işleme dahil olmak üzere bir PDMS kuyusunda aktif nematik hapsetme yöntemini gösteren akış diyagramı. Sağdaki ölçek çubuğu (sınırlı aktif malzeme) = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Film 1: Akış hücresi yöntemi kullanılarak hazırlanan aktif nematik için temsili sonuç. Bu Filmi indirmek için lütfen tıklayınız.
Film 2: Ters çevrilmiş yöntem kullanılarak hazırlanan aktif nematik için temsili sonuç. Bu Filmi indirmek için lütfen tıklayınız.
Film 3: Eliptik bir kuyu ile sınırlı ters çevrilmiş yöntem kullanılarak hazırlanan aktif nematik için temsili sonuç. Bu Filmi indirmek için lütfen tıklayınız.
Tartışmalar
Protokoller boyunca, deneycinin bazı önemli kontroller yapabileceği birkaç nokta vardır. Cihazlardan herhangi birini aktif malzeme ile doldurmadan önce, mikrotübüllerin polimerize olduğunu ve ideal olarak ~ 2-3 μm uzunluğunda olup olmadığını kontrol etmek için floresan mikroskobu (bkz. Şekil 1) kullanılmalıdır. Mikrotübüller mikroskop altında görülmüyorsa, depolimerize olmuş olabilirler ve aktif nematik oluşmaz. Bireysel mikrotübüller çok küçük olduğundan, onları doğrudan mikroskopla gözlemlemek zor olabilir. Bu çalışmada, düşük ışıklı uygulamalara meydan okumak için tasarlanmış yüksek kaliteli bir floresan kamera, filament büyümesini doğrulamak için ilgili yazılımla birlikte kullanılmıştır. Bu aşamada önemli floresan agregaları bulunmamalıdır, çünkü bu depolimerizasyonu veya denatüre proteinin varlığını gösterebilir. Mikrotübülleri, MIX ve ATP'yi protokollerde açıklandığı gibi aynı oranlarda birleştirerek basit bir mikroskop testi slaytı yapmak da iyi bir fikirdir. Aktivite, bileşenlerin birleştirilmesiyle başlamalı ve malzeme, Şekil 2C'de gösterilene benzer görünmeli, mevcut demetler ve gözle görülür filament hareketleri ile birlikte görünmelidir.
Akış hücresi yöntemini kullanırken, santrifüj süresi ve akış hücresinin oryantasyonu, düzgün bir aktif tabakanın oluşumu için önemlidir. Bu adım, kullanılan santrifüj tipine bağlı olarak bazı ince ayarlar gerektirebilir. Akış hücresini, dönme düzlemine dik aktif düzlem yönelimli santrifüjlemek, malzeme akışkan arayüzüne eşit şekilde itilebildiği için en iyi sonuçları verir. Santrifüjlemeden önce akış hücresinin dikkatlice kapatıldığını iki kez kontrol edin.
Sınırlı aktif nematikler üretmek için ters çevrilmiş yöntemi kullanırken, optimize etmek için birkaç adım vardır. İlk olarak, yüksek çözünürlüklü yapılar üreten bir 3D baskı yöntemi kullanmak önemlidir. Düzensiz yan duvarlar, mikrotübüllerin yakalanmasına neden olabilir ve bu da akışları bozar. Kuyular çok derin olmamalıdır (bu çalışmada 2 mm kalınlığında üstte yağ tabakası olan 150-200 μm derinliğinde kuyucuklar kullanılmıştır). Deneycilerin en iyi sonucu elde etmek için bu parametreleri deneme yanılma yoluyla biraz ayarlamaları gerekebilir.
Akış hücresi yöntemi ve ters çevrilmiş yöntem, farklı yazarlar tarafından, farklı yağlar12 ve batırılmış yapılar13 dahil olmak üzere aktif akışları etkileyen çeşitli etkilere bakmak için kullanılmıştır. Yöntem seçimi deneysel amaca bağlıdır. Akış hücresi yöntemini kullanarak, aktif tabakanın üstünden optik görüntüleme, farklı üstteki sıvılar nedeniyle ters çevrilmiş yöntemden daha nettir. Akış hücresi yönteminde, görüntüleme bir cam kapak kayması ve ince bir su tabakası ile gerçekleştirilirken, ters çevrilmiş yöntem, yağ tabakasının üstte olması için tasarlanmıştır. Bu, ters çevrilmiş yöntem için uzun bir çalışma mesafesi hedefine ihtiyaç duyulduğu ve görüntü kalitesinin düştüğü anlamına gelir. Görüntü kalitesi farklılıkları, sırasıyla Şekil 2D (akış hücresi yöntemi) ve Şekil 3 (ters çevrilmiş yöntem) ve Film 1 ve Film 2 karşılaştırılarak görülebilir. Şekil 3 için Şekil 2 için kullanılandan daha uzun bir çalışma mesafesine sahip daha düşük bir büyütme lensi gerekiyordu. Ters çevrilmiş yöntem için bu görüntüleme dezavantajları, mikroskop slayt substratları için uygun bir çalışma mesafesine sahip hedeflerle birleştirildiğinde, uygun bir ters çevrilmiş mikroskop mevcutsa önlenebilir. Daha ince cam, standart çalışma mesafesi hedeflerinin kullanılmasına izin vermek için bir substrat olarak kullanılabilir.
Bir avantaj olarak, ters çevrilmiş geometri, daha geniş bir yağ viskozitesi aralığının kullanılmasına izin verir, mutlaka sallanan kova santrifüjlemesi gerektirmez (bu mevcut değilse) ve kalıp hazırlandıktan sonra sistemin hazırlanması nispeten daha kolaydır. Bununla birlikte, ters çevrilmiş yöntemi kullanarak kuyucuklarda hapsedilmek için, malzemeyi iyi tanımlanmış bir 2D katmana almak için bazı santrifüjleme önemli olabilir.
Akış hücresi yöntemi son zamanlarda sürekli aktif bir katmanın gerekli olduğu deneylerde çok başarılı bir şekilde kullanılmıştır. Son çalışmalarımız, yüksek kaliteli görüntüleme ve doku analizinin önemli olduğu aktif tabakadaki topolojik kusurların dinamiklerine baktı19. Ek olarak, akış hücresi yöntemi, yağa batırılmış mikroyapıların aktif akışlar16 ve aktif akışlardaki kusurları yakalamak için sütunlar üzerindeki etkilerini araştırmak için kullanılmıştır31. Bu yöntem, sürekli aktif bir katmanın oluşumu için çok iyi çalışıyor ve görüntü kalitesi mükemmel. Bununla birlikte, son 2D aktif katmanı üretmek için kullanılan santrifüjleme adımının gerçekleştirilmesi zor olabilir ve akış hücreleri sızıntılara ve hava kabarcıklarına eğilimlidir. Ters çevrilmiş yöntem, yüksek başarı oranına sahip çok kullanışlı bir alternatiftir, yapımı kolaydır ve yüksek çözünürlüklü bir 3D baskılı ana kalıp oluşturulabilmesi koşuluyla herhangi bir substrat deseni veya geometrisi için kullanılabilir. Bu yöntem, geometrik hapsetmenin aktif nematik dinamikler üzerindeki etkilerine bakmak için de yararlıdır, çünkü doldurma kuyularını nispeten basit hale getirir.
Bu yazıda, mikrotübüllerden ve kinesin motorlarından aktif bir nematik oluşturmanın iki yolu, ayrıca malzemeleri kuyucuklarda sınırlamak için bir teknik açıklanmaktadır. Sunulan sistem, şu anda literatürde bulunan aktif bir nematik fazın en temiz örneğini temsil etmektedir ve dünya çapında çeşitli gruplar tarafından çoğaltılmıştır. Bu malzemenin önemi sadece bileşenlerinin biyolojik kökenlerinde değil, aynı zamanda aktif sıralı sıvılarda tamamen yeni bir yön açtığı için de yatmaktadır. Bu sistemle çalışarak ve temel özelliklerini aydınlatarak, bilim adamları tamamen sentetik aktif fazların tasarımına doğru ilerleyebilirler.
Hapsedilmenin aktif nematikler üzerindeki etkilerine odaklanan deneyler, topolojik sınırlama altındaki aktif akışların davranışı ve topolojik kusur dinamikleri ile ilgili temel soruları cevaplama potansiyeline sahiptir. Burada sunulan yöntem, mikroakışkanlar ve aktif karıştırma dahil olmak üzere çeşitli geometri odaklı deneylerin ve analizlerinin gerçekleştirilmesine yardımcı olacaktır.
Açıklamalar
Bu çalışmada kullanılan bazı materyaller Cytoskeleton Inc. (Denver, ABD) tarafından ücretsiz olarak sağlanmıştır.
Teşekkürler
Yazarlar, cömert finansman için Ulusal Bilim Vakfı (NSF) ödülü DMR-1808926'ya teşekkür etmek istiyor. Proje ayrıca NSF tarafından Bilim ve Teknoloji Araştırma Mükemmeliyet Merkezi: California Merced Üniversitesi Hücresel ve Biyomoleküler Makineler Merkezi (HRD-1547848) ve Brandeis Biyomalzemeler Tesisi Malzeme Araştırma Bilim ve Mühendislik Merkezi (DMR-2011486) aracılığıyla desteklenmiştir. Kaliforniya Merced Üniversitesi'nden Dr. Bin Liu'ya kalıbın 3D baskısında yardım için ve ters deneysel yöntemin geliştirilmesi sırasında bilimsel tavsiyeler için Dr. Jordi Ignes'e teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 20 kD PEG (polyethylene glycol)) | Sigma Aldrich | 1419109 | Depletion agent CAS Number: 125061-88-3 |
| 3-(trimethoxysilyl)propyl methacrylate | Sigma Aldrich | M6514-50ML | CAS Number: 2530-85-0 |
| 3D printer & Resin | Phrozen | Phrozen sonic mini 8K 3D printer - Aqua Gray 8K resin | |
| 40% Acrylamide Solution | BIO-RAD | 1610140 | CAS Number: 7732-18-5, 79-06-1 |
| Acetic Acid | Fisher | CAS Number: 64-19-7 | |
| Acetone | Sigma Aldrich | CAS Number: 67-64-1 | |
| Adhesive sheets (NOTE: "Parafilm" is an alternative) | Grace Bio-Labs | 620001 | SecureSeal |
| Ammonium Persulfate | Sigma Aldrich | A3678 | CAS Number: 7727-54-0 |
| Aquapel (NOTE: "RainX" is an alternative) | Aquapel Glass Treatment | hydrophobic glass treatment | |
| ATP (Adenosine triphosphate) | Sigma Aldrich | A1852 | CAS Number: 34369-07-8 |
| Beakers | VWR | ||
| Catalase | Sigma Aldrich | C9322 | CAS Number: "9001-05-2" |
| Desiccator | Bel-art | ||
| Digital CMOS camera | Hamamatsu | ORCA - Flash4.0 LT+ | |
| DTT (Dithiothreitol) | Sigma Aldrich | D9779 | CAS Number: "3483-12-3" |
| EGTA (3,12-bis(carboxymethyl)-6,9-dioxa-3,12-diazatetradecane-1,14-dioic acid) | Sigma Aldrich | MFCD00004291 | CAS Number: 67-42-5 |
| Ethanol | Sigma Aldrich | CAS Number: 64-17-5 | |
| Fluorescence microscope | Leica | DM 2500P | |
| Glass Coverslips | VWR | 48368-040 | |
| Glass Slides | VWR | 16004-430 | |
| Glucose | Sigma Aldrich | G7021 | CAS Number: 50-99-7 |
| Glucose Oxidase | Sigma Aldrich | 345386 | CAS Number: 9001-37-0 |
| GMPCPP (guanylyl 5'-α,β-methylenediphosphonate) | Jena Bioscience | NU-405S | CAS Number: 14997-54-7 |
| HFE7500 Oil | 3M | ||
| Hot Plate | Fisher Scientific | Thermix hot plate model 100M | |
| Isopropyl Alcohol | VWR | ||
| KCl (potassium chloride) | Sigma Aldrich | P5405 | CAS Number: 7447-40-7 |
| Methanol | Sigma Aldrich | CAS Number: 67-56-1 | |
| MgCl2 (Magnesium Chloride) | Sigma Aldrich | 208337 | CAS Number: 7786-30-3 |
| Microcentrifuge tubes | Eppendorf - Thermo Fisher | 1.5 mL | |
| Nanopure water purifier | Sartorius | arium mini | |
| NaOH (Sodium hydroxide) | Sigma Aldrich | SX0603 | CAS Number: 1310-73-2 |
| Petri Dishes | VWR | ||
| PH Meter | Thermo Scientist | Orion 3 STAR | |
| Phosphoenol-pyruvate (PEP) | Sigma Aldrich | MFCD00044476 | CAS Number: 4265-07-0 |
| PIPES (1,4-Piperazinediethanesulfonic acid) | Sigma Aldrich | CAS Number: 5625-37-6 | |
| Pipettes (0.2 - 1000 µl) | VWR | ||
| Pluronic F-127 | Sigma Aldrich | 2594628 | |
| RAN Surfactant (NOTE: "FluoSurf" from Emulso is an alternative) | Ran Biotechnologies | 008-FluoroSurfactant-2wtH-50G | |
| Silicon Oil (100mpa s-1000 mpa s) | Sigma Aldrich | CAS Number: 63148-52-7 | |
| Streptavidin | Thermofisher | S888 | |
| Swinging Bucket Centrifuge | Thermo Scientist | Sorvall legend RT+ | |
| Sylgard 184 Elastomer base | World Precision Instruments | SYLG184 | |
| Sylgard 184 Elastomer Curing agent | World Precision Instruments | SYLG184 | |
| Table top centrifuge | Eppendorf | MiniSpin Plus | |
| TEMED (Tetramethylethylenediamine) | BIO-RAD | 1610800 | CAS Number: 110-18-9 |
| Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid) | Sigma Aldrich | MFCD00006846 | CAS Number: 53188-07-1 |
| Tubulin | Cytoskeleton | T240-B | |
| Tubulin (Rhodamine labeled) | Cytoskeleton | TL590M-A | |
| Ultracentrifuge | Beckman | Optima Max-TL | |
| UV Light | RapidFix | ||
| UV-curable glue (NOTE: "Norland NO81" is an alternative) | RapidFix | ||
| Water Bath | Thelco | ||
| Whatman Filter paper | Sigma Aldrich | WHA1001325 |
Referanslar
- Sokolov, A., Aranson, I. S., Kessler, J. O., Goldstein, R. E. Concentration dependence of the collective dynamics of swimming bacteria. Physics Review Letters. 98 (15), 158102 (2007).
- Saw, T. B., et al. Topological defects in epithelia govern cell death and extrusion. Nature. 544 (7649), 212-216 (2017).
- Kawaguchi, K., Kageyama, R., Sano, M. Topological defects control collective dynamics in neural progenitor cell cultures. Nature. 545 (97654), 327-331 (2017).
- Toner, J., Tu, Y. Long-range order in a two-dimensional dynamical XY model: how birds fly together. Physics Review Letters. 75 (23), 4326-4329 (1995).
- Katz, Y., Tunstrøm, K., Ioannou, C. C., Huepe, C., Couzin, I. D. Inferring the structure and dynamics of interactions in schooling fish. Proceedings of the National Academy of Sciences. 108 (46), 18720-18725 (2011).
- Needleman, D., Dogic, Z. Active matter at the interface between materials science and cell biology. Nature Reviews Materials. 2 (9), 17048 (2017).
- Weirich, K., Dasbiswas, K., Witten, T. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences. 116 (23), 11125-11130 (2019).
- Memarian, F. L., et al. Active nematic order and dynamic lane formation of microtubules driven by membrane-bound diffusing motors. Proceedings of the National Academy of Sciences. 118 (52), (2021).
- Bausch, A., Sciortino, A. R. Pattern formation and polarity sorting of driven actin filaments on lipid membranes. Proceedings of the National Academy of Sciences. 118 (6), (2021).
- Maroudas-Sacks, Y., et al. Topological defects in the nematic order of actin fibres as organization centres of Hydra morphogenesis. Nature Physics. 17 (2), 251-259 (2021).
- Liu, J., et al. Topological braiding and virtual particles on the cell membrane. Proceedings of the National Academy of Sciences. 118 (34), (2021).
- Hirst, L. S. . Fundamentals of Soft Matter Science 2nd ed. , (2019).
- Sanchez, T., Chen, D., DeCamp, S., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Guillamat, P., Ignés-Mullol, J., Sagués, F. Taming active turbulence with patterned soft interfaces. Nature Communications. 8, 564 (2017).
- Thijssen, K., et al. Submersed micropatterned structures control active nematic flow, topology, and concentration. Proceedings of the National Academy of Sciences. 118 (38), (2021).
- Shendruk, T. N., Doostmohammadi, A., Thijssen, K., Yeomans, J. M. Dancing disclinations in confined active nematics. Soft Matter. 13 (21), 3853-3862 (2017).
- Giomi, L. Geometry and topology of turbulence in active nematics. Physical Review X. 5 (3), 031003 (2015).
- Tan, A. J., et al. Topological chaos in active nematics. Nature Physics. 15 (10), 1033-1039 (2019).
- Young, E. C., Berliner, E., Mahtani, H. K., Perez-Ramirez, B., Gelles, J. Subunit interactions in dimeric kinesin heavy chain derivatives that lack the kinesin rod. The Journal of Biological Chemistry. 270 (8), 3926-3931 (1995).
- Gilbert, S. P., Johnson, K. A. Expression, purification, and characterization of the Drosophila kinesin motor domain produced in Escherichia coli. Biochemistry. 32 (17), 4677-4684 (1993).
- Kuznetsov, S. A., Gelfand, V. I., Vernos, I. . Kinesin Protocol. 164, (2001).
- Hawkins, T. L., Sept, D., Mogessie, B., Straube, A., Ross, J. L. Mechanical properties of doubly stabilized microtubule filaments. Biophysics Journal. 104 (7), 1517-1528 (2013).
- Bate, T. E., Jarvis, E. J., Varney, M. E., Wu, K. Controlling flow speeds of microtubule-based 3D active fluids using temperature. Journal of Visualized Experiments. (153), e60484 (2019).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Tayar, A. M., Lemma, L. M., Dogic, Z. Assembling microtubule-based active matter.. Microtubules. , 151-183 (2022).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Guillamat, P., Ignés-Mullol, J., Shankar, S., Marchetti, M. C., Sagués, F. Probing the shear viscosity of an active nematic film. Physical Review E. 94 (6), 060602 (2016).
- Rudy, A., et al. Lubricous hydrogel surface coatings on polydimethylsiloxane (PDMS). Tribology Letters. 65, 3 (2017).
- Venzac, B., et al. PDMS curing inhibition on 3D-printed molds: Why? Also, how to avoid it. Analytical Chemistry. 93 (19), 7180-7187 (2021).
- Khaladj, D. A., Hirst, L. S. Using curved fluid boundaries to confine active nematic flows. Frontiers of Physics. 10, 880941 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır