Method Article
可扩展的3D工程肌肉组织中的临床前药物测试
摘要
该协议提供了生成3D工程心脏和骨骼肌组织的方法,并描述了它们在临床前药物筛选模式中的使用。所描述的方法利用磁传感系统来促进同时评估24个组织。
摘要
在 体外准确 模拟健康和疾病状况对于开发新的治疗策略和治疗方法至关重要。对于心脏和骨骼肌疾病,收缩力和动力学是评估肌肉功能的关键指标。从诱导多能干细胞生成工程肌肉组织(EMT)的新的和改进的方法使体 外 疾病建模对收缩组织更加可靠;然而,从悬浮细胞培养物中可重复地制造组织并测量其收缩力具有挑战性。此类技术通常受到高故障率的困扰,需要复杂的仪器和定制的数据分析例程。利用3D EMT与无标记,高度并行且自动化友好的收缩性测定相结合的新平台和设备绕过了许多这些障碍。该平台几乎可以使用任何细胞源轻松且可重复地制造3D EMT。然后通过同时测量 24 个组织的仪器 测量 组织收缩力,而无需复杂的软件分析程序。该仪器可以可靠地测量微牛顿力的变化,允许剂量依赖性化合物筛选以测量药物或治疗对收缩输出的影响。用这种装置制成的工程组织功能齐全,在电刺激下产生抽搐和破伤风收缩,并且可以在培养物中纵向分析数周或数月。在这里,我们展示了使用已知毒物的急性和慢性剂量下的心肌EMT的数据,包括一种药物(BMS-986094),该药物是在患者因意外心脏毒性而死亡后从临床试验中提取的。还介绍了肌球蛋白抑制剂治疗后工程组织中骨骼肌功能改变。该平台使研究人员能够将复杂、信息丰富的生物工程模型系统集成到他们的药物发现工作流程中,只需最少的额外培训或技能。
引言
诱导多能干细胞(iPSC)模型正日益成为治疗发现和开发的临床前管道以及基础生物学研究和疾病建模的关键参与者1,2,3,4,5。收缩组织,例如源自iPSCs的心脏和骨骼肌,在提高人类体外研究的预测能力方面具有巨大潜力,因为直接评估肌肉收缩力和动力学是研究整体组织功能的定量指标4,6,7,8。通常,收缩力的测量是通过对基板偏转9,10的光学跟踪间接获得的,也可以通过将细胞/组织直接连接到力传感器4,11,12来获得。这些方法虽然准确,但本质上是低通量,通常需要高技能的操作员来收集和分析数据。
以前的研究表明,磁场传感可以绕过这些障碍,并提供一种替代方法来同时评估多个组织结构的工程肌肉功能13。Mantarray(用于eNgineered组织阵列的磁力分析仪)3D收缩力平台基于该技术,使用能够以高度并行方式测量工程肌肉组织收缩力的设备,利用3D细胞模型的复杂性进行更高通量筛选14。该平台能够对标准细胞培养箱内外的心脏和骨骼肌组织的收缩功能进行无标记、定量、实时监测,无需基于光学的收缩成像和分析。该技术有助于直接比较健康和患病细胞系,并能够测量药物对收缩组织的影响,为新的和现有的治疗化合物建立可量化的 体外安全性和有效性数据。
可以使用Mantarray易损的24孔浇注板以高度可重复的方式在两个柱之间制造工程3D肌肉组织(图1)。一个柱子是刚性的,而另一个柱子是柔性的,包含一个小磁铁。当组织结构收缩时,它会取代柔性柱和嵌入的磁铁。EMT板位于仪器内,通过板架下方电路板上的磁传感器阵列 测量 后位移。使用数学算法将磁场中测量的变化转换为绝对收缩力。该仪器采用快速数据采样率,能够收集有关所测定细胞类型的功能容量和成熟度的详细信息,包括收缩频率、速度和衰减时间。这些功能测量可以通过磁传感平台同时在所有24孔中获得,也可以使用传统的光学方法单独和顺序获得。
本研究描述了一种高度可重复的方法,用于在基于纤维蛋白的水凝胶中工程 3D 骨骼肌和心脏微组织。在短暂的80分钟反应中,凝血酶催化纤维蛋白原转化为纤维蛋白,为肌肉细胞在悬浮培养物中发育提供支架15。基质细胞有助于重塑基质,组织变得收缩,因为肌肉细胞在水凝胶内形成合胞体。在化合物暴露之前和之后,使用磁感应方法分析了这些组织的收缩性,验证了这种方式用于剂量反应药物研究。来自健康供体活检的原代人成肌细胞在商业上获得并根据供应商的方案进行 2D 培养。使用骨骼肌生长培养基通过三个传代扩增细胞,以产生足够的细胞数量来制造3D组织。根据供应商的方案将基质细胞和hiPSC来源的心肌细胞培养3天,以便在将细胞注入组织之前从冷冻保存中恢复。提供了代表性结果,说明了可以使用磁传感平台收集的数据集类型。还解决了与使用这些方法生成工程组织相关的常见陷阱。
研究方案
1. 细胞培养方案
- 原代人肌母细胞培养
- 在冰上以 1:100 的比例在 8 mL DMEM/F12 培养基中稀释细胞外基质 (ECM)。
- 将8mL的ECM溶液施入一个T175烧瓶中,并在细胞接种前在37°C下孵育至少1小时,但不超过24小时。确保ECM溶液覆盖整个烧瓶底部。
- 将 5 mL 骨骼肌生长培养基等分到 15 mL 锥形管中。
- 在37°C的水浴中解冻冷冻细胞(5.0 x 105 个成肌细胞)2分钟或直到冰刚刚融化。用70%乙醇喷洒小瓶并将其转移到生物安全柜(BSC)中。
- 使用P1000将细胞转移到等分培养基中。不要磨擦。将细胞以300× g 离心3分钟。
- 吸出上清液并使用P1000移液管将细胞重悬于1 mL生长培养基中,以获得单细胞悬液。
- 用 15 mL DPBS 洗涤 ECM 包被的烧瓶。吸出DPBS,然后将30mL生长培养基加入烧瓶中。
- 向细胞中加入4mL生长培养基,混合并将细胞悬液分配到T-175烧瓶中。确保总体积为 35 mL。将烧瓶沿工作台向左和向右轻轻滑动5-6次,然后向前和向后滑动5-6次,以确保细胞在烧瓶表面上均匀分布。
- 将T-175烧瓶放入37°C和5%CO2的细胞培养箱中。培养细胞3天或直到它们达到不超过70%的汇合度,然后传代细胞。
- 传代原代人成肌细胞
- 在冰上以 1:100 的比例在 30 mL DMEM/F12 培养基中稀释 ECM。
- 将10mL的ECM溶液施用于三个T225烧瓶中,并在细胞接种前在37°C下孵育至少1小时,但不超过24小时。确保ECM溶液覆盖整个烧瓶底部。
- 用 15 mL DPBS 洗涤细胞。根据供应商的方案吸出并添加解离试剂。
- 取出细胞后,根据供应商的方案停止反应,并将细胞收集到锥形管中。将细胞以300× g 离心3分钟。
- 吸出上清液并使用P1000移液管将细胞重悬于1 mL生长培养基中,以获得单细胞悬液。
- 用15mL DPBS洗涤ECM包被烧瓶。吸出DPBS,然后将40mL生长培养基加入每个T225烧瓶中。
- 向细胞悬液中加入 14 mL 生长培养基,混合并将 5 mL 细胞悬液分配到每个 T225 烧瓶中。确保每个烧瓶中的总体积为 45 mL。将烧瓶沿工作台面向左和向右轻轻滑动 5-6 次,然后向前和向后滑动 5-6 次,以确保均匀分布。
- 将烧瓶放入37°C和5%CO2的细胞培养箱中。
- 培养细胞2-3天或直到它们达到不超过70%的汇合度,然后传代。在每次传代时以 1:3 或 1:4 分裂细胞,并在 3 x 103 和 1 x 104 个细胞/cm2 之间播种。
- hiPSC 来源的心肌细胞培养
- 在冰上以 1:60 的比例在 12 mL DMEM/F12 培养基中稀释 ECM。
- 将1mL的ECM溶液施用于两个6孔板的每个孔中,并在细胞接种前在37°C下孵育至少1小时,但不超过24小时。
- 在37°C的水浴中解冻冷冻的心肌细胞小瓶2分钟或直到冰刚刚融化。
- 用70%乙醇喷洒小瓶并将其转移到BSC中。
- 使用 p1000 移液器将解冻的细胞转移到 50 mL 锥形管中。
- 用 1 mL 室温 (RT) 电镀培养基冲洗空冷冻管以回收任何剩余细胞。
- 在90秒的过程中缓慢地将1mL冲洗培养基滴入细胞锥形管中(每5秒一滴)。在缓慢添加培养基期间连续旋转试管以混合细胞。
- 使用 10 mL 血清移液管将 8 mL 电镀培养基缓慢加入 50 mL 锥形细胞管中。
- 分配所有培养基后,轻轻上下移液 3 次以彻底混合细胞。使用血细胞计数器和台盼蓝计数细胞。
- 将细胞在 50 mL 锥形管中以 300 x g 离心 3 分钟。
- 细胞沉淀后,吸出上清液。
- 使用 p1000 移液器将 1 mL 电镀介质转移到试管中,并通过缓慢上下移液 3-5 次轻轻分解沉淀。用额外的电镀介质重悬细胞。
- 在 2 mL 电镀培养基中接种 2-4 x 10 6个细胞的 6 孔板。
- 用DPBS(2 mL /孔)清洗ECM包被的6孔板。
- 每孔 2 mL 6 孔板移液 2 mL 细胞悬液。沿着工作台向左和向右轻轻移动板 5-6 次,然后向前和向后移动 5-6 次,以确保细胞在板表面上均匀分布。
- 将板放入37°C和5%CO2的细胞培养箱中。
- 对要解冻的所有细胞小瓶重复步骤1.3.3-1.3.16。
- 接种后第二天更换为3-5 mL(取决于细胞系和密度)的维持培养基,然后每隔一天更换一次培养基。在将细胞浇铸成3D组织之前培养细胞3-4天。
- 基质细胞培养
- 将30mL的ECM溶液施加到T175烧瓶中,并在细胞接种前在37°C下孵育至少1小时,但不超过24小时。
- 将 5 mL 基质细胞培养基分装到 15 mL 锥形管中。
- 在37°C的水浴中解冻冷冻的基质细胞小瓶2分钟或直到冰刚刚融化。
- 用70%乙醇喷洒小瓶并将其转移到BSC中。
- 使用 p1000 移液器将 1 mL 基质细胞培养基缓慢添加到小瓶中解冻的细胞中。
- 将细胞悬液从小瓶转移到锥形管中剩余的解冻培养基中。使用 5 mL 血清移液管混合细胞。上下移液3次。
- 使用血细胞计数器和台盼蓝计数细胞。不要降低单元格转速。
- 用 15 mL DPBS 洗涤 ECM 包被的 T175 烧瓶。
- 将基质细胞以3-4 x 103 细胞/ cm2的密度转移到烧瓶中。将烧瓶沿工作台向左和向右轻轻滑动5-6次,然后向前和向后滑动5-6次,以确保细胞在烧瓶表面上均匀分布。
- 第二天用 45 mL 加热的基质细胞培养基更换培养基。在将细胞浇铸成3D组织之前培养细胞3-4天。
2. 材料准备
- 纤维蛋白原
注意:重建纤维蛋白原时,请注意最大化纤维蛋白原粉末分层的表面积。在该协议中,使用的稀释剂的量被优化为所用容器的大小,即,刚好使用足够的稀释剂来覆盖培养皿的底部。例如,在 100 mm 培养皿而不是 50 mL 离心管中将 0.5 g 纤维蛋白原层叠在 10 mL PBS 上。最大化稀释剂的表面积将减少重建纤维蛋白原所需的时间,并减少蛋白质的潜在结块。- 重构
- 将 10 mL PBS 转移到 100 mm 细胞培养皿中,并在细胞培养箱中加热至 37 °C。
- 将0.5g纤维蛋白原粉末层放在温暖的PBS的整个表面上,并保持在37°C,直到纤维蛋白原完全溶解。这应该不超过2小时。溶解粉末可以轻轻旋转,但不要剧烈摇晃培养皿。
- 无菌过滤
- 粉末完全溶解后,将溶液通过 100 μm 过滤器并将其收集到 50 mL 锥形管中以去除任何凝胶纤维蛋白原团块。
- 将过滤后的溶液倒入装有0.2μm过滤器的10mL注射器中。将溶液推入过滤器并将其收集到新的 50 mL 锥形管中。可能需要多次更换过滤器才能对所有 10 mL 溶液进行灭菌。
- 将300mL无菌纤维蛋白原分装到1.5mL微量离心管中,并储存在-20°C。 根据需要在冰上或4°C下解冻等分试样。避免反复冻融。
- 重构
- 凝血酶
- 将 6 mL PBS 和 4 mL diH2O 直接加入一瓶凝血酶 (1 KU) 中,制成 100 U/mL 凝血酶储备溶液。
- 用0.2μm过滤器过滤灭菌,等分试样,并在-20°C下储存在1.5mL塑料微量离心管中,因为凝血酶吸附到玻璃上。避免反复冻融。
- 聚亚乙基亚胺溶液
注意:爱德华王子岛有毒。使用制造商指定的适当个人防护装备。
注意:PEI以50%w/v溶液的形式提供。它非常粘稠,难以移液。从 10% 储备溶液中制备 0.1% 溶液,而不是直接从 50% w/v 溶液中制备溶液。- 在 50 mL 锥形管中测量 5 mL 50% w/v PEI 溶液。
- 加入 20 mL diH2O 并混合,得到 10% 储备溶液。这种高度浓缩的储备溶液不能无菌过滤。
- 要制备用于细胞培养的 0.1% 溶液,使用 500 mL 滤瓶将 5 mL 10% 储备液加入 495 mL diH2O 无菌过滤器中,并在室温下储存不超过 1 周。
- 戊 二 醛
注意:戊二醛是有毒的。使用制造商指定的适当个人防护装备。- 戊二醛以25%溶液的形式提供。要制备 0.01% 溶液,请将 40 μL 加入 99.6 mL diH2O 无菌过滤器中,并在 4 °C 下储存不超过 1 周。
- 后期准备
- 将耗材组织铸造套件放入无菌培养罩内。铸造套件包含一个盖子、一个可容纳 24 对柱子的柱子(24 孔板的每个孔一对柱子)和一个包含 24 个铸造孔的专用 24 孔板底部。每个铸造孔在孔底部包含一个沟槽,用于固定细胞/水凝胶组件,并在水凝胶聚合时将它们模制成管状组织(图1B)。
- 用 1.5 mL/孔的 0.1% PEI 溶液填充 24 孔板的孔,并将柱子放入板中,使每对柱子的尖端浸没。让它静置10分钟,PEI将在柱子上沉积正电荷,以便在组织铸造过程中水凝胶中的蛋白质牢固地附着在柱子上。
- 用 2 mL/孔的无菌 diH2O 填充第二个 24 孔板的孔并转移柱子。静置1分钟。
- 在第三个 24 孔板中,用 1.5 mL/孔的 0.01% 戊二醛 (GA) 填充孔并转移柱子。让它静置 30 分钟,GA 会将从 PEI 到柱子的正电荷固定下来。
- 当柱子位于戊二醛中时,吸出diH 2 O孔,用2 mL /孔的无菌diH 2 O洗涤,吸出并重新填充2mL /孔的无菌diH2O。可以使用新鲜的 24 孔板代替冲洗。
- 当30分钟结束时,将柱子转移到无菌diH 2 O的2mL /孔中。静置1分钟。
- 吸出diH 2 O,并加入另外2 mL /孔的无菌diH2O。静置5分钟。
- 将柱子转移到24孔板中干燥(约15分钟)。
- 干燥后,重新组装铸件套件。封口膜边缘将盖子和板密封在一起,然后在细胞接种前在4°C下储存长达72小时。更长的存储时间可能是可能的,但尚未经过测试。
3. 组织铸造方案
- 铸板准备
- 在4°C下预冷组织铸造套件。
- 将一桶冰转移到平衡计分卡中。在冰上,每孔制备 50 μL 凝血酶溶液(3 μL 凝血酶原液 + 47 μL EMT 培养基)。
注意:有关 EMT 介质的详细信息,请参阅步骤 3.2.1。 - 从冰箱中取出冷却的浇注套件,并将其放在细胞培养罩内的冷块或冰块上。将铸造板平放在冰上,然后将后晶格从铸造板移动到新的无菌 24 孔板中。
- 将 50 μL 凝血酶溶液移液到铸板的每个预冷孔中。
- 重新组装套件并将其放回冰箱,直到需要组织铸造。除孔外,在凝血酶的3小时内铸造组织。
- 细胞制备
- 准备EMT基础培养基,无菌过滤器,然后放在冰上。
注意:如果细胞特异性浇注培养基含有FBS,请使用热灭活的FBS,因为它可能与纤维蛋白原相互作用并导致过早聚合。- 准备心脏 EMT 培养基:加入 500 mL RPMI 培养基、10 mL B27 和 2.5 g 氨基己酸。(可选)加入 10 mM ROCK 抑制剂(仅添加到用于铸造组织的 EMT 培养基中,而不是添加到整个 500 mL 体积中)。
- 制备骨骼 EMT 培养基:加入 50 mL F10 培养基和 0.25 g 氨基己酸 (ACA) 用于原发性 EMT,0.1 g ACA 用于 iPSC 衍生的 EMT。
- 将细胞培养级解离试剂加热至37°C。 加热等体积的EMT培养基以稀释解离试剂。
注意:使用的蛋白酶完全失活至关重要。活性蛋白酶会干扰3D组织的形成和粘附后。 - 用PBS洗涤细胞(图1A)。将 2 mL/孔用于 6 孔板。分别使用 6 mL、15 mL 和 15 mL 用于 100 mm 培养皿、T175 烧瓶和 T225 烧瓶。
- 加入加热的细胞培养级解离试剂以提起细胞并在37°C下孵育5分钟或直到细胞解除。对于心脏培养,请使用 10x 解离试剂。对于基质细胞和骨骼肌成肌细胞,请使用 1x 解离试剂。6 孔板使用 1 mL/孔,100 mm 培养皿使用 3 mL,T175 培养瓶使用 8 mL,T225 培养瓶使用 10 mL。
- 通过敲击板的侧面每2-3分钟检查一次培养物。
- 细胞抬起后,将其转移到 50 mL 锥形管中,并用 P1000 移液器研磨以确保单细胞悬液。
- 用额外的EMT培养基洗涤板或烧瓶以收集剩余的细胞并将它们添加到锥形管中。6 孔板使用 1 mL/孔 EMT 培养基,100 mm 培养皿使用 2 mL,T175 培养瓶使用 5 mL,T225 培养瓶使用 5 mL。
- 研磨细胞以确保单细胞悬液。
- 加入EMT培养基以终止解离过程,然后取细胞悬浮液样品以进行细胞计数。6 孔板使用 1 mL/孔,100 mm 培养皿使用 3 mL,T175 培养瓶使用 8 mL,T225 培养瓶使用 10 mL。
- 以200 x g 离心细胞4分钟。在离心悬浮液的同时,使用血细胞计数器和台盼蓝进行细胞计数。
- 吸出上清液并将细胞重悬于 5 mL EMT 基培养基中以除去残留的解离试剂。
- 将细胞以200× g 离心4分钟。吸出上清液并以适当的密度制备细胞悬液。
- 通过在EMT培养基中添加10%-20%的ECM蛋白来增加3D骨骼肌EMT的寿命和功能14,16。
- 种子干细胞来源的心肌细胞及其基质细胞分别为每个组织构建体5 x 105 个细胞和7.5 x 104 个细胞。以每个组织构建体 7.5 x 105 个细胞播种骨骼肌成肌细胞。
- 心脏组织
- 吸出上清液,在EMT培养基中以2.5 x 10 6个细胞/mL的密度重悬基质细胞, 并将它们放在冰上。每个EMT使用30μL这种悬浮液。
- 吸出上清液并以 8.3 x 10 6个细胞/ mL 的密度在 EMT 培养基中重悬 CM,然后将它们放在冰上。每个 EMT 使用 60 μL 这种悬浮液。
- 骨骼肌组织
- 吸出上清液,在EMT培养基中以8.3 x 106个细胞 /mL的密度重悬骨骼肌细胞,并将它们放在冰上。每个EMT使用90μL这种悬浮液。
- 计算构成所需组织数量所需的每种细胞溶液的体积(例如,每个EMT制备的CM为60μL,制备的基质细胞为30μL,骨骼肌细胞为90μL)。
- 将计算出的细胞体积移液到 15 mL 锥形管中。
- 每个EMT向细胞悬液中加入10μL纤维蛋白原,并将其放在冰上。
- 每个 EMT 的总试剂和细胞体积:确保每个 EMT 含有 90 μL 细胞、10 μL 纤维蛋白原和 50 μL 凝血酶溶液。
- 准备EMT基础培养基,无菌过滤器,然后放在冰上。
- 组织铸造
- 将组织铸造套件转移到细胞培养罩中并取下盖子(包含柔性和刚性柱的柱格应保留在铸造板上; 图 1B)。保持铸板,后晶格平放在冰上。
- 混合细胞/纤维蛋白原混合物,用 P200 移液器吸取 100 μL。
- 将 100 μL 混合物加入用 50 μL 凝血酶溶液制备的孔中,并研磨 5 次以充分混合。请勿将移液器推过第一挡,并在研磨后取下吸头,以免产生任何气泡。
- 在此阶段,直到柱晶格准备好从铸造板上提起(步骤3.3.10),晶格的任何移动都可能损害组织与柱子的长期附着。用一只手的食指和拇指同时握住晶格和铸造孔板,以避免晶格的任何移动。
- 对每个组织重复一个新的P200尖端,直到所有组织都石膏固定。在 15 mL 锥形管中混合细胞悬液,然后随着细胞快速沉降而浇注每个组织。
- 小心地将种子套件转移到培养箱中,确保不要移动晶格。播种后晶格的移动可能导致将组织移出铸造孔的成功率降低。在37°C孵育80分钟,无论细胞类型如何。这将开始水凝胶的聚合并允许蛋白质附着在柱子上。
- 同时,准备一个新鲜的 24 孔板,其中包含 2 mL/孔的 EMT 培养基,用于心脏组织。如果需要,可以将10mM ROCK抑制剂添加到EMT培养基中。将板在37°C孵育以加热培养基。
- 制备 2 mL/孔的生长培养基,其中含有 5 g/L 氨基己酸(0.2 mm 无菌过滤),用于原代骨骼肌组织,或 2 g/L ACA 用于 iPSC 衍生的 EMT。将板在37°C孵育以加热培养基。
- 孵育后,轻轻地将1mL的EMT培养基添加到铸孔的边缘,并在37°C下再孵育10分钟,无论细胞类型如何。这将使水凝胶从铸造孔的边缘脱落,并允许组织轻松转移。
- 10分钟后,小心地提起柱晶格并将组织从铸造板转移到准备好的带有培养基的24孔板中(图1C)。将带有组织的板返回到37°C的细胞培养箱中。
- 保养
- 24小时后,将管型组织转移到具有2mL /孔EMT培养基的新鲜24孔板中(如果包括ROCK抑制剂,则不含ROCK抑制剂),并在37°C下孵育。 对于骨骼肌细胞,将生长培养基切换到分化培养基以促进肌母细胞融合。
- 每2-3天将心脏组织转移到具有2mL /孔EMT培养基的新鲜孔中。
- 每2-3天将骨骼肌组织转移到含有5 g / L氨基己酸(0.2 mm无菌过滤)的2 mL /孔分化培养基的新鲜孔中。将 2 g/L ACA 用于 iPSC 来源的组织。
- 为了帮助更换培养基,请将后晶格转移到新的 24 孔板中,而不是在同一板中更换培养基以避免损坏 3D 组织。用EMT培养基准备第二个24孔板,并将组织转移到新鲜培养基中。将装有旧培养基的培养基与活性培养物一起保存,以用于下一次培养基更换。在整个培养期间,在两个板之间来回转移柱格。或者,每次更换培养基时使用新鲜板。
- 通过后偏转的光学跟踪(图1D)或磁传感硬件13,14测量EMT收缩。心脏组织在培养3-4天后开始自发跳动。培养 7 天后,骨骼肌组织通常在电场刺激下收缩。
结果
将细胞浇铸到2柱消耗板中的工程肌肉组织中(图1)。成功的EMT将看起来是均匀的,矩阵将在帖子之间均匀分布(图2A)。基质还应缠绕在两个柱子周围,为组织产生等效的锚点。这种方法很少发生铸造失败,目视检查通常很明显。不成功的EMT生产范围从灾难性故障,例如组织从柱子上脱落(图2B)到更微妙的结构缺陷,如气泡和松散的柱子附着(图2C,D)。有轻微缺陷的组织可能仍然可行,但应仔细检查来自这些组织的数据,以确保其与未受损的EMT相当。例如,随着组织随着时间的推移而压缩,EMT内的气泡可能会被挤出,从而形成功能齐全的构建体,而没有收缩缺陷。然而,这些组织必须根据具体情况进行评估,因为气泡的位置可能会影响功能恢复。例如,在柱子上产生的气泡可能会影响组织附着,这可能会阻碍对柱子的长期粘附。
组织在前24小时内开始压缩,因为细胞重塑水凝胶内的基质(图3)。压实是一个渐进的过程,通常在培养的前2-4周进行。总体而言,组织和生物学重复之间的组织压实是一致的(图4)。随着组织随着时间的推移而成熟,某些细胞系比其他细胞系更压实基质是正常的。构建体中肌源性细胞的百分比会影响EMT压实的速率和总体程度。心脏和骨骼肌细胞系的总肌源性含量应高于 80%,以尽量减少工程组织之间的差异。在比较细胞系之间的收缩力和动力学时,这一点尤其重要。
在石膏转换后的最初几天内,心肌细胞开始在培养物中自发跳动,随着每次肌肉收缩有节奏地弯曲柔性柱。骨骼肌在开始分化后第 7 天响应电刺激构建收缩。通过连接到定制24孔电极盖的外部刺激 器对 骨骼肌组织施加场刺激。盖子由每个孔的一对碳电极制成,位于24孔组织板的顶部,同时刺激每个EMT诱导肌肉收缩。在功能测量期间,使用10 V刺激在1 Hz下对组织进行10 ms脉冲持续时间的起搏。收缩组织表明骨骼成肌细胞已经融合,形成带有功能性肌节和收缩机制的肌管。骨骼 EMT 肌球蛋白重链 (MyHC) 染色呈阳性,肌营养不良蛋白位于肌管膜上,在横断面免疫组织化学分析中显示出经典的环形(图 5)。一旦EMT发挥作用,就可以每天在磁感应仪器中测量收缩性,随着结构随着时间的推移而发展和成熟,跟踪力和动力学。心脏和骨骼肌组织在3D培养中保持收缩数周至数月(图6),可用于广泛的收缩性研究。
磁性检测方法可用于同时测量结构心脏毒物的急性和慢性影响,例如阿霉素(图7)和BMS-986094(图8),以及其他影响肌肉收缩力的药物。也可以使用收缩检测的光学跟踪方法,但在研究急性药物效应时必须小心,因为必须按顺序进行测量。心脏和骨骼EMT在3D培养中的延长寿命使得可以在这些组织中进行长期的药物研究。这允许用户探索重复给药的影响,以及持续、长期暴露于可能随着时间的推移显示出心脏毒性作用的化合物,如阿霉素发生的情况。多柔比星(dox)是一种抗癌化疗药物17。给予患者的药物量各不相同,具体取决于癌症的类型,患者的年龄,患者的身高和体重以及其他因素。因此,在各种浓度和交付时间表中测试人肉搜索的效果非常重要。在这里,用三种不同浓度(0.1μM,1μM和10μM)的人肉干治疗心脏EMT在27天内(图7)。通过推注处理或每72小时更换培养基连续给药来处理每个浓度的EMTs,进一步分层。给予Dox推注治疗的井在三个不同的时间点暴露于药物,允许在给药之间恢复。在整个研究中,两种最高剂量的推注和持续暴露显示收缩力的产生立即和长期停止。根据给药方法的不同,中间和最低浓度对组织有不同的影响。在最低浓度的药物中,推注组与对照组没有差异。然而,连续暴露 2 周后收缩力减弱。药物的中等浓度具有有趣的效果。虽然连续给药在治疗的前几天减少了力量并持续了整个实验,但推注组在3天后将药物洗掉时显示出收缩力恢复到对照水平。然而,药物的第二次推注导致完全停止用力,随后没有恢复(图7),表明以该浓度重复给药可能对用该药物治疗的患者产生心脏毒性作用。这项研究的广泛范围,无论是在时间和实验条件下,都突出了3D工程组织在毒性筛选中的实用性,因为它们在较长时间内保持收缩和对化学暴露的反应,允许在一组肌肉组织中进行长期药物研究。这不仅有助于识别慢性暴露可能具有心脏毒性作用的化合物,还有助于检测潜在的心脏毒性给药时间。
在工程人体肌肉组织中进行体外毒性测试是帮助确保人类患者在临床试验中安全的一种方法。BMS-986094是一种核苷酸聚合酶(NS5B)抑制剂,用于治疗丙型肝炎。该药物处于II期临床开发阶段,当时百时美施贵宝因患者18,19的几例意外心力衰竭而停止开发。在这里,BMS-986094被应用于心脏EMT,以测试3D工程肌肉组织是否会对药物产生心脏毒性反应(图8)。施用三种不同浓度的药物,并在13天内监测组织。收缩力随着药物的加入而以剂量依赖性方式下降(图8A)。抽搐频率也受到显着影响,因为心跳率减慢并最终如预期的那样停止,继续暴露于心脏毒性化合物(p < 0.05,图8B)。这些结果证明了如何使用3D工程人体肌肉组织来促进将新药推向市场,并标记最终因心脏毒性而失败的化合物。此外,这项技术可以通过在临床试验中将危险药物投入患者之前暴露出来挽救生命。
测量急性和长期应用药物对人类收缩组织的影响的能力是研究安全性和有效性疗法的重要第一步。然而,重要的是要知道,所施用药物的浓度具有生理相关性,适合 体外 测试。骨骼肌组织用于在全剂量反应曲线中建立2,3-丁二酮一肟(BDM)的IC50 值。该药物是骨骼肌肌球蛋白-II 20的ATP酶抑制剂。BDM 通过防止肌球蛋白与肌节中的肌动蛋白丝形成交叉桥来抑制肌肉收缩21.此处显示的结果显示,当施用药物时,绝对力的剂量依赖性降低,当药物被洗掉时,收缩力完全恢复,表明瞬时效应是防止肌肉收缩,而不仅仅是杀死组织内的细胞(图9A)。此外,在检查的七种浓度中测量了完整的剂量反应曲线,在这些人体微组织中建立了3.2mM的IC50 (图9B)。

图 1:2 柱 Mantarray 易损件 24 孔板中的 EMT 铸件 。 (A)在组织铸造之前在2D表面上培养肌源性和基质细胞。(B)将细胞从2D表面提起并与细胞外基质蛋白混合在一起,以在插图所示的单个板铸造孔中形成水凝胶。(C)每孔中含有工程组织的24孔板。(D)代表性组织显示放松和收缩的工程肌肉,比较磁柱的位移(绿条)。 请点击此处查看此图的大图。
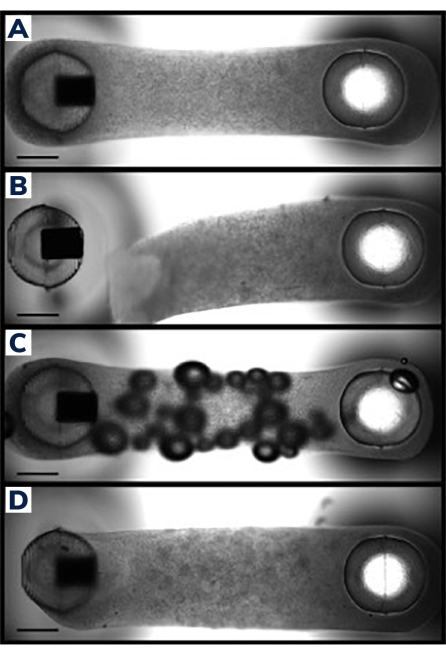
图 2:成功和不成功的 EMT 铸造。 (A)理想的工程肌肉组织在铸造后24小时均匀压实在整个组织中均匀的细胞/基质组成柱周围。(B)EMT失败,显示水凝胶从柔性柱上脱落。 (C)EMT在整个组织中含有气泡。(D)两个柱子周围的组织沉积不等。组织松散地固定在一侧的柔性柱上。比例尺为 1 毫米。 请点击此处查看此图的大图。
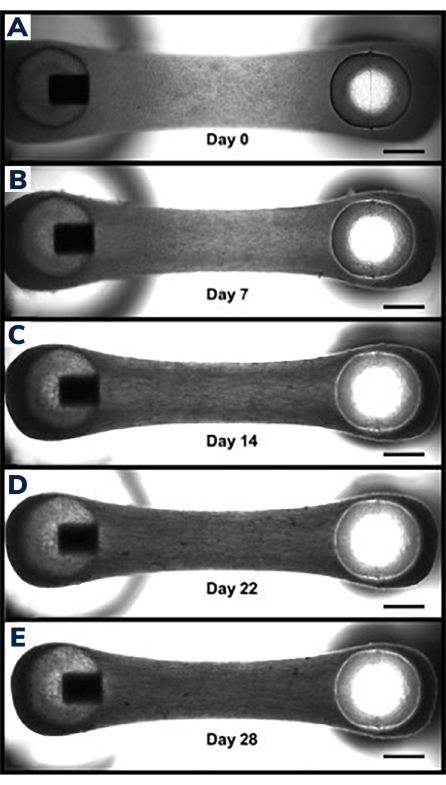
图 3:随着时间的推移,工程肌肉组织中的压实。 (A)铸造后1天显示的EMT结构。将组织转移到分化培养基中,开始细胞融合和水凝胶压实的第0天。(乙-E)在第7天到第21天的相同EMT显示,随着时间的推移,两个帖子之间的总长度略短,并且通过EMT的中间部分测量时宽度较小。比例尺为 1 毫米。 请点击此处查看此图的大图。
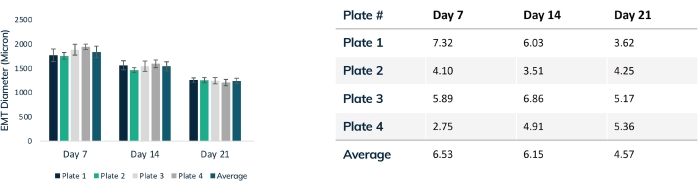
图 4:EMT 直径随时间的变化。 在21天内跟踪四块组织板,比较整个压实过程中的EMT直径。每周使用光学显微镜通过中段测量每个组织。时间点显示板之间的EMT大小一致。随着基质重塑的稳定,在第 21 天达到最大压实度。该表显示了每块组织板内压实的标准偏差(占总数的百分比)和所有板的平均偏差。彩色条是单独的板。误差线是板内EMT的SD。 请点击此处查看此图的大图。
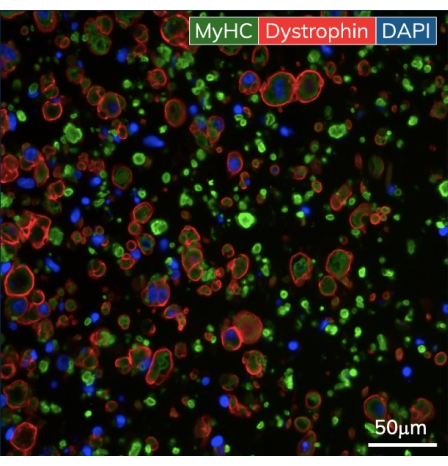
图 5:工程骨骼肌组织的免疫组织化学。 EMTs在培养的第10天固定并嵌入石蜡中。在成像前,用肌球蛋白重链和肌营养不良蛋白的抗体染色薄横截面(7μm)。绿色 = MyHC,红色 = 肌营养不良蛋白,蓝色 = DAPI。物镜放大倍率为40X;比例尺为 50 μm。 请点击此处查看此图的大图。
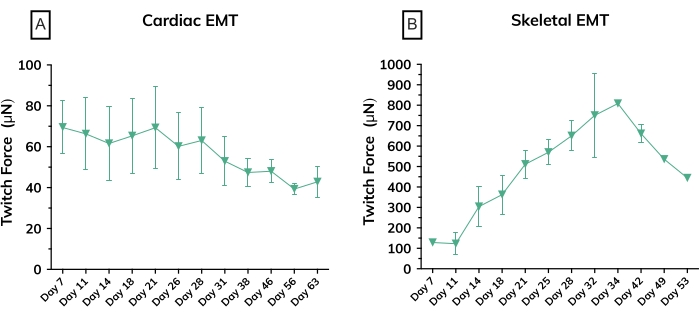
图 6:工程肌肉组织随时间推移的收缩力。 (A)从培养中第7天到第63天从心脏EMT测量的平均绝对抽搐力;n = 每组 3 个。(B)培养中第7天至第53天源自原代细胞系的骨骼EMT的平均绝对抽搐力;n = 3。两个图形的误差线均为SD。 请点击此处查看此图的大图。
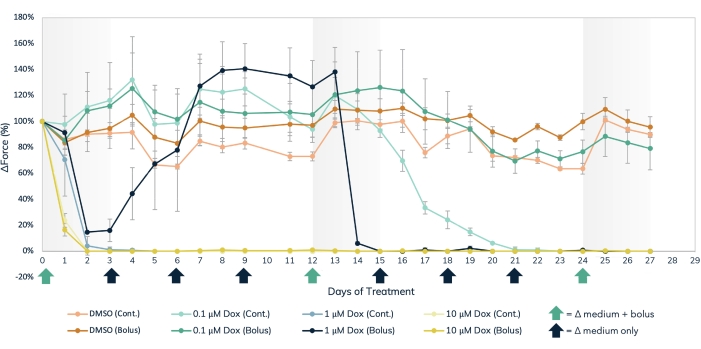
图 7:工程肌肉组织中的急性和慢性阿霉素治疗。 在27天内以推注或连续给药至工程肌肉组织的三种不同剂量浓度的dox,0.1μM,1μM和10μM。在第0、12和24天的培养基变化时加入推注剂量的药物,由X轴上的绿色箭头表示。每次更换培养基时将药物添加到培养基中以进行连续给药,由X轴上的黑色和绿色箭头表示。与基线值(药物治疗前)相比力的百分比变化在Y轴上,治疗天数的时间在X轴上。浅橙色 = DMSO 连续对照,深橙色 = DMSO 推注对照,浅绿色 = 0.1 μM 连续人肉量,深绿色 = 0.1 μM 人肉量推注,浅蓝色 = 1 μM 连续人肉,深蓝色 = 1 μM 点心推注,浅黄色 = 10 μM 连续人肉,深黄色 = 10 μM 人肉推注。误差线是标清的;n = 每个条件 3。 请点击此处查看此图的大图。
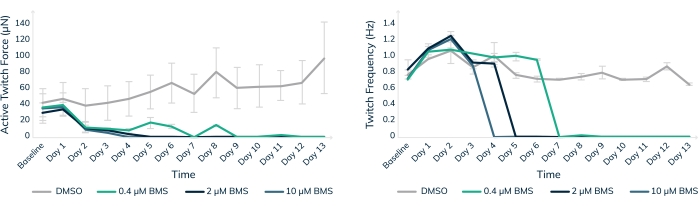
图 8:在工程肌肉组织中使用 BMS-986094 进行慢性治疗。 EMT在13天内用0.4μM(绿色),2μM(深蓝色)和10μM(浅蓝色)BMS-986094处理。(A)在前2天内,收缩抽搐力(Y轴)在所有药物浓度下降低,而DMSO中的对照组织随着时间的推移继续变得更强(X轴)。(B)心跳频率或抽搐频率以剂量依赖性方式停止,与图A所示的收缩力停止同时停止.DMSO(灰色)中的对照组织在整个实验中保持规律的搏动率。误差线是标清的;n = 每个条件 3。 请点击此处查看此图的大图。
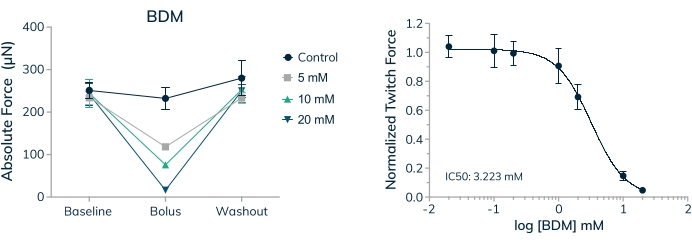
图 9:工程骨骼肌组织中对 BDM 的剂量反应。 (A)当原代细胞来源的EMT在3D培养的第16天暴露于2,3-丁二酮单肟(BDM)时,绝对抽搐力以剂量依赖性方式降低。当药物被洗掉时,绝对抽搐力恢复到接近基线值。(B)当暴露于BDM时,归一化为基线值的绝对抽搐力以剂量依赖性方式减少,产生完整的剂量反应曲线和IC50 值;n = 4 每剂。误差线是SD的。 请点击这里查看此图的大图。
讨论
本研究描述了在 24 孔易损件铸造套件中生成 3D 工程心脏和骨骼肌组织的方法。通过遵循这些方法,可以始终如一地获得24个组织的完整阵列,而后续的药物筛选没有铸造失败。实现这种结果的关键考虑因素是确保在浇注过程中所有步骤都在冰上进行以防止水凝胶过早聚合,在组织铸造之前去除细胞解离试剂,彻底混合每个组织的细胞和水凝胶悬液,更换组织之间的移液器吸头,以及使用热灭活的FBS(如果使用的话)。此外,重要的是要确保铸件开始后晶格不会移动,并且在形成水凝胶后轻轻转移。
主要修改包括使用不同的细胞类型来实现心脏与骨骼EMT,以及用不同浓度的基底膜蛋白掺杂水凝胶以促进细胞成熟和组织稳定性。这种兴奋剂的有益效果必须逐案测试,但已被证明在某些情况下可以改善功能结果和组织寿命14,16,22。还值得注意的是,列出的细胞密度仅供参考,可能需要针对不同的细胞系进行优化。替代水凝胶组合物也可以被认为是改变所实现的EMT的结构和功能特性的手段23,24,25。天然肌肉微环境还包含支持细胞类型,以促进血管化、神经支配和基质沉积,以支持形式和功能的肌细胞26,27。虽然这里描述的系统目前将成纤维细胞整合到3D心脏组织中,但其他细胞类型可能会创建一个更具生理相关性的模型来研究体外治疗化合物的安全性和有效性。此前,一系列支持细胞类型已成功整合到3D工程组织中,为使用磁感应收缩性平台28,29,30的未来研究提供了一个令人兴奋的模板。
该协议的故障排除集中在铸造过程中形成不可靠或不一致的组织。必须注意避免在浇注水凝胶时在水凝胶中形成气泡,同时在混合过程中仍促进细胞的均匀分布。每种新细胞类型可能需要进行优化实验,以确定理想的细胞密度、细胞比例和基质组成。
该技术的一个主要限制是建立24个EMT的完整板所需的大量细胞。对于此处提供的数据,每个板使用1500万个心肌细胞和1800万个骨骼成肌细胞。某些研究人员可能无法获得如此庞大的细胞物质池,这可能会抑制他们充分利用该平台的能力。如果最终用户无法使用磁传感硬件,则需要以光学方式进行后偏转测量,这会大大降低吞吐量并阻止同时记录多个孔的肌肉收缩。然而,Mantarray 硬件克服了这些限制,提供了第一个能够同时对多个结构的 EMT 收缩进行连续、非侵入性分析的商业系统。
跨 24 孔的磁感应有助于实时对 EMT 功能发育进行纵向研究,并允许准确测量对化学、环境或基因操作的急性反应。虽然磁感应具有多个优点,例如跨多个组织同时测量,并且不需要复杂的数据分析,但光学检测方法确实可以同时测量生理指标,例如钙通量或电压映射。然而,诸如结果部分中所示的数据集证明了该技术在药物开发领域的应用范围。鉴于市场上很少有检测方法提供直接评估工程肌肉收缩输出的方法,这些方法有可能彻底改变临床前开发管道。
披露声明
所有作者都是Curi Bio Inc.的员工和股东,该公司将Mantarray硬件和相关软件商业化。
致谢
这项工作得到了美国食品和药物管理局(U01 FD006676-01授予健康与环境科学研究所)和美国国立卫生研究院(HL151094给Geisse博士)的部分资助。我们感谢Alec S. T. Smith博士协助编写这份手稿。
材料
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | CELLTREAT | 229485 | |
| 100 mm cell culture dish | ThermoFisher | 150466 | |
| 50 mL Steriflip filter | MilliporeSigma | SCGP00525 | |
| 500 mL filter flask | MilliporeSigma | S2GVU05RE | |
| 6-aminocaproic acid | Sigma | A2504 | |
| B27 | Gibco | 17504044 | |
| Cardiosight Maintenance Medium | NEXEL | CM-002A | |
| Cardiosight Plating Medium | NEXEL | CM-020A | |
| C-Pace EM stimulator | IonOptix | EM | |
| Curi Bio Muscle Differentiation Media Kit | Primary - DIFF | ||
| Curi Bio Muscle Maintenance Media Kit | Curi Bio | Primary - MAINT | |
| DAPI | Invitrogen | D1306 | |
| DMEM, high glucose, GlutaMAX | Gibco | 10566-016 | |
| Dnase | Sigma | 11284932001 | |
| DPBS | Gibco | 14190-250 | |
| Dystrophin antibody | Abcam | ab154168 | |
| Fetal bovine serum (FBS) | Thermo Scientific | 10082147 | Must be heat-inactivated |
| Fibrinogen (Bovine) | Sigma | E8630 | |
| Glutaraldehyde | Sigma | 354400 | |
| Ham's F10 | Gibco | 11550043 | |
| Hemacytometer | Sigma | Z359629 | |
| HS-27A Fibroblasts | ATCC | CRL-2496 | |
| Human Skeletal Muscle Myoblasts | Lonza | CC-2580 | |
| Luer Lock 0.2 µm syringe filter | Corning | 431219 | |
| Luer Lock 10 mL syringe | BH Supplies | BH10LL | |
| Mantarray Instrument | Curi Bio | MANTA-24-B1 | System |
| Mantarray Plate Kits | Curi Bio | MA-24-SKM-5 | Pack of 5 kits |
| Mantarray stimulation lid | Curi Bio | EM | |
| Matrigel (ECM) | Corning | 356231 | |
| Nexel Cardiosight-S, Cardiomyocytes | NEXEL | C-002 | |
| Optical Microscope | Nikon Ti2E | MEA54000 | |
| Pan Myosin Heavy Chain antibody | DSHB | MF-20 | |
| Poly(ethyleneimine) | Sigma | P3143 | |
| ROCK inhibitor | StemCell Technologies | Y-27632 | |
| RPMI | Gibco | 11875-093 | |
| Skeletal Muscle Growth Medium (SkGM-2) | Lonza | CC-3245 | |
| Standard 24-well plates | Greiner | M8812 | Other manufacturer's plates will not fit |
| Standard 6-well plates | ThermoFisher | 140675 | |
| Stromal medium (DMEM + 20% FBS) | |||
| T175 Filter Flask | ThermoFisher | 159910 | |
| T225 Filter Flask | ThermoFisher | 159934 | |
| Thrombin | Sigma | T4648 | |
| Trypan Blue solution, 0.4% | ThermoFisher | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Scientific | A1217702 | |
| TrypLE Select Enzyme (1x) | Thermo Scientific | 12563011 |
参考文献
- Sharma, A., Wu, J. C., Wu, S. M. Induced pluripotent stem cell-derived cardiomyocytes for cardiovascular disease modeling and drug screening. Stem Cell Research & Therapy. 4, 150 (2013).
- Mudera, V., Smith, A. S. T., Brady, M. A., Lewis, M. P. The effect of cell density on the maturation and contractile ability of muscle derived cells in a 3D tissue-engineered skeletal muscle model and determination of the cellular and mechanical stimuli required for the synthesis of a postural phenotype. Journal of Cellular Physiology. 225 (3), 646-653 (2010).
- Vandenburgh, H., et al. Tissue-engineered skeletal muscle organoids for reversible gene therapy. Human Gene Therapy. 7 (17), 2195-2200 (1996).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nature Communications. 9 (1), 126 (2018).
- Fleming, J. W., et al. Bioengineered human skeletal muscle capable of functional regeneration. BMC Biology. 18 (1), 145 (2020).
- Madden, L., Juhas, M., Kraus, W. E., Truskey, G. A., Bursac, N. Bioengineered human myobundles mimic clinical responses of skeletal muscle to drugs. eLife. 4, 04885 (2015).
- Urciuolo, A., et al. Engineering a 3D in vitro model of human skeletal muscle at the single fiber scale. PLOS One. 15 (5), 0232081 (2020).
- Afshar, M. E., et al. A 96-well culture platform enables longitudinal analyses of engineered human skeletal muscle microtissue strength. Scientific Reports. 10, 6918 (2020).
- Sakar, M. S., et al. Formation and optogenetic control of engineered 3D skeletal muscle bioactuators. Lab on a Chip. 12 (23), 4976-4985 (2012).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Khodabukus, A., Baar, K. Defined electrical stimulation emphasizing excitability for the development and testing of engineered skeletal muscle. Tissue Engineering Part C: Methods. 18 (5), 349-357 (2011).
- Vandenburgh, H., et al. Drug-screening platform based on the contractility of tissue-engineered muscle. Muscle & Nerve. 37 (4), 438-447 (2008).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Enineering Part C Methods. 22 (10), 932-940 (2016).
- Smith, A. S. T., et al. High-throughput, real-time monitoring of engineered skeletal muscle function using magnetic sensing. bioRxiv. , 492879 (2022).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Hinds, S., Bian, W., Dennis, R. G., Bursac, N. The role of extracellular matrix composition in structure and function of bioengineered skeletal muscle. Biomaterials. 32 (14), 3575-3583 (2011).
- Carvalho, C., et al. Doxorubicin: the good, the bad and the ugly effect. Current Medicinal Chemistry. 16 (25), 3267-3285 (2009).
- Ahmad, T., et al. Cardiac dysfunction associated with a nucleotide polymerase inhibitor for treatment of hepatitis C. Hepatology. 62 (2), 409-416 (2015).
- Gill, M., et al. From the cover: Investigative nonclinical cardiovascular safety and toxicology studies with BMS-986094, an NS5b RNA-dependent RNA polymerase inhibitor. Toxicological Sciences. 155 (2), 348-362 (2017).
- Ostap, E. M. 2,3-Butanedione monoxime (BDM) as a myosin inhibitor. Journal of Muscle Research and Cell Motility. 23 (4), 305-308 (2002).
- Fryer, M. W., Gage, P. W., Neering, I. R., Dulhunty, A. F., Lamb, G. D. Paralysis of skeletal muscle by butanedione monoxime, a chemical phosphatase. Pflügers Archiv: European Journal of Physiology. 411 (1), 76-79 (1988).
- Fleming, J. W., et al. Functional regeneration of tissue engineered skeletal muscle in vitro is dependent on the inclusion of basement membrane proteins. Cytoskeleton. 76 (6), 371-382 (2019).
- Capel, A. J., et al. Scalable 3D printed molds for human tissue engineered skeletal muscle. Frontiers in Bioengineering and Biotechnology. 7, 20 (2019).
- Tsui, J. H., et al. Tunable electroconductive decellularized extracellular matrix hydrogels for engineering human cardiac microphysiological systems. Biomaterials. 272, 120764 (2021).
- Tsui, J. H., et al. Conductive silk-polypyrrole composite scaffolds with bioinspired nanotopographic cues for cardiac tissue engineering. Journal of Materials Chemistry B. 6 (44), 7185-7196 (2018).
- Gabella, G. Muscle cells, nerves, fibroblasts and vessels in the detrusor of the rat urinary bladder. Journal of Smooth Muscle Research. 55, 34-67 (2019).
- Christov, C., et al. Muscle satellite cells and endothelial cells: close neighbors and privileged partners. Molecular Biology of the Cell. 18 (4), 1397-1409 (2007).
- Bersini, S., et al. Engineering an environment for the study of fibrosis: A 3D human muscle model with endothelium specificity and endomysium. Cell Reports. 25 (13), 3858-3868 (2018).
- Gilbert-Honick, J., et al. Engineering functional and histological regeneration of vascularized skeletal muscle. Biomaterials. 164, 70-79 (2018).
- Maffioletti, S. M., et al. Three-dimensional human iPSC-derived artificial skeletal muscles model muscular dystrophies and enable multilineage tissue engineering. Cell Reports. 23 (3), 899-908 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。