Method Article
확장 가능한 3D 엔지니어링 근육 조직의 전임상 약물 테스트
요약
이 프로토콜은 3D 엔지니어링된 심장 및 골격근 조직을 생성하는 방법을 제공하고 전임상 약물 스크리닝 양식에서의 사용을 설명합니다. 설명된 방법은 자기 감지 시스템을 사용하여 24개의 조직을 동시에 동시에 평가할 수 있습니다.
초록
체외에서 건강 및 질병 상태를 정확하게 모델링하는 것은 새로운 치료 전략 및 치료법 개발에 매우 중요합니다. 심장 및 골격근 질환의 경우 수축력과 동역학이 근육 기능을 평가하기 위한 핵심 지표를 구성합니다. 유도 만능 줄기 세포로부터 조작된 근육 조직(EMT)을 생성하는 새롭고 개선된 방법은 수축 조직에 대한 시험관 내 질병 모델링을 보다 신뢰할 수 있게 만들었습니다. 그러나 부유 세포 배양에서 조직을 재현 가능하게 제작하고 수축성을 측정하는 것은 어려운 일입니다. 이러한 기술은 종종 높은 고장률로 어려움을 겪고 복잡한 계측 및 맞춤형 데이터 분석 루틴이 필요합니다. 3D EMT를 무표지, 고도의 병렬 및 자동화 친화적인 수축성 분석과 함께 활용하는 새로운 플랫폼 및 장치는 이러한 많은 장애물을 우회합니다. 이 플랫폼을 사용하면 거의 모든 셀 소스를 사용하여 3D EMT를 쉽고 재현 가능하게 제작할 수 있습니다. 그런 다음 복잡한 소프트웨어 분석 루틴 없이 24개의 조직을 동시에 측정하는 기기를 통해 조직 수축성을 측정합니다. 이 기기는 마이크로뉴턴의 힘 변화를 안정적으로 측정할 수 있으므로 용량 의존적 화합물 스크리닝을 통해 약물 또는 치료제가 수축 출력에 미치는 영향을 측정할 수 있습니다. 이 장치로 만든 조작된 조직은 완전히 기능하여 전기 자극 시 경련 및 파상풍 수축을 생성하며 몇 주 또는 몇 달에 걸쳐 배양에서 종단으로 분석할 수 있습니다. 여기에서는 예상치 못한 심장 독성으로 인해 환자 사망 후 임상 시험에서 가져온 약물(BMS-986094)을 포함하여 알려진 독성 물질을 급성 및 만성 투여 중인 심장 근육 EMT의 데이터를 보여줍니다. 미오신 억제제 치료에 대한 반응으로 조작된 조직에서 변경된 골격근 기능도 제시됩니다. 이 플랫폼을 통해 연구원은 최소한의 추가 교육이나 기술로 복잡하고 정보가 풍부한 생체 공학 모델 시스템을 약물 발견 워크플로에 통합할 수 있습니다.
서문
유도만능줄기세포(iPSC) 모델은 기초 생물학적 연구 및 질병 모델링 1,2,3,4,5뿐만 아니라 치료제 발견 및 개발을 위한 전임상 파이프라인에서 점점 더 핵심적인 역할을 하고 있습니다. iPSC에서 파생된 심장 및 골격근과 같은 수축 조직은 근육 수축력 및 동역학의 직접적인 평가가 전체 조직 기능을 연구하기 위한 정량적 지표이기 때문에 인간 시험관 내 연구의 예측력을 향상시킬 수 있는 큰 잠재력을 가지고 있습니다 4,6,7,8. 전형적으로, 수축력의 측정은 기판 편향(9,10)의 광학적 추적에 의해 간접적으로 또는 힘 변환기(4,11,12)에 세포/조직을 부착함으로써 직접적으로 얻어졌다. 이러한 방법은 정확하지만 본질적으로 처리량이 낮으며 일반적으로 데이터를 수집하고 분석하려면 고도로 숙련된 작업자가 필요합니다.
이전 연구에서는 자기장 감지가 이러한 장애물을 우회하고 여러 조직 구조에 걸쳐 공학적 근육 기능을 동시에 평가하는 대체 방법을 제공한다는 것을 보여주었습니다13. Mantarray(Magnetometric Analyzer for eNgineered Tissue ARRAY) 3D 수축성 플랫폼은 이 기술을 기반으로 하며, 고처리량 스크리닝을 통해 3D 세포 모델의 복잡성을 활용하는 고도로 평행한 방식으로 조작된 근육 조직의 수축성을 측정할 수 있는 장치를 사용합니다14. 이 플랫폼은 표준 세포 배양 인큐베이터 내부 또는 외부의 심장 및 골격근 조직의 수축 기능에 대한 라벨 없는 정량적 실시간 모니터링을 가능하게 하여 광학 기반 수축성 이미징 및 분석의 필요성을 제거합니다. 이 기술은 건강한 세포주와 질병에 걸린 세포주의 직접적인 비교를 용이하게 하고 수축 조직에 대한 약물의 효과를 측정하여 신규 및 기존 치료 화합물에 대한 정량화 가능한 시험관 내, 안전성 및 효능 데이터를 확립합니다.
엔지니어링된 3D 근육 조직은 Mantarray 소모품인 24웰 주조 플레이트를 사용하여 재현성이 높은 방식으로 두 기둥 사이에서 제작할 수 있습니다(그림 1). 한 기둥은 단단하고 다른 기둥은 유연하고 작은 자석이 있습니다. 조직 구조가 수축하면 유연한 기둥과 내장된 자석을 대체합니다. EMT 플레이트는 기기 내에 배치되며 플레이트 홀더 아래의 회로 기판에 있는 일련의 자기 센서를 통해 사후 변위를 측정합니다. 측정된 자기장의 변화는 수학적 알고리즘을 사용하여 절대 수축력으로 변환됩니다. 이 기기는 빠른 데이터 샘플링 속도를 사용하여 수축 빈도, 속도 및 감쇠 시간을 포함하여 분석 중인 세포 유형의 기능적 용량 및 성숙도에 대한 자세한 정보를 수집할 수 있습니다. 이러한 기능 측정은 자기 감지 플랫폼을 사용하여 24개 웰 모두에서 동시에 또는 기존의 광학 방법을 사용하여 개별적으로 순차적으로 얻을 수 있습니다.
이 연구는 피브린 기반 하이드로겔에서 3D 골격근 및 심장 미세조직을 엔지니어링하기 위한 재현성이 높은 방법을 설명합니다. 80분간의 짧은 반응 동안, 트롬빈은 피브리노겐이 피브린으로 전환되는 것을 촉매하여, 근육 세포가 부유 배양액에서 발달할 수 있는 스캐폴드를 제공한다15. 기질 세포는 매트릭스를 리모델링하는 데 도움이 되며 근육 세포가 하이드로겔 내에서 융합체를 형성함에 따라 조직이 수축하게 됩니다. 이러한 조직의 수축성은 화합물 노출 전후에 자기 감지 접근 방식을 사용하여 분석되었으며, 용량-반응 약물 연구에 사용하기 위해 이 양식을 검증했습니다. 건강한 기증자 생검에서 얻은 1차 인간 근모세포는 상업적으로 입수하여 공급업체의 프로토콜에 따라 2D로 배양했습니다. 세포는 3D 조직을 제작하기에 충분한 세포 수를 생성하기 위해 3개의 계대를 통해 골격근 성장 배지를 사용하여 확장되었습니다. 기질 세포 및 hiPSC 유래 심근 세포를 3일 동안 공급업체의 프로토콜에 따라 배양하여 세포를 조직으로 캐스팅하기 전에 냉동 보존에서 회복할 수 있도록 했습니다. 자기 감지 플랫폼을 사용하여 수집할 수 있는 데이터 세트의 유형을 보여주는 대표적인 결과가 제공됩니다. 이러한 방법을 사용하여 조작된 조직의 생성과 관련된 일반적인 함정도 해결됩니다.
프로토콜
1. 세포 배양 프로토콜
- 일차 인간 근모세포 배양
- 세포외 기질(ECM)을 얼음 위의 DMEM/F100 배지 8mL에 1:12의 비율로 희석합니다.
- 8mL의 ECM 용액을 하나의 T175 플라스크에 적용하고 세포 파종 전에 최소 1시간 동안 37°C에서 배양하되 24시간 이하로 배양합니다. ECM 용액이 전체 플라스크 바닥을 덮는지 확인합니다.
- 골격근 성장 배지 5 mL를 15 mL 원뿔형 튜브에 분취한다.
- 냉동된 세포 바이알(5.0 x 105 근모세포)을 37°C의 수조에서 2분 동안 또는 얼음이 녹을 때까지 해동합니다. 바이알에 70% 에탄올을 뿌리고 생물안전 캐비닛(BSC)으로 옮깁니다.
- P1000을 사용하여 분취된 배지로 세포를 옮깁니다. 삼갈매지 마십시오. 세포를 300 x g 에서 3분 동안 원심분리합니다.
- 상층액을 흡인하고 P1000 피펫을 사용하여 성장 배지 1mL에 세포를 재현탁하여 단일 세포 현탁액을 얻습니다.
- ECM 코팅된 플라스크를 DPBS 15mL로 세척합니다. DPBS를 흡인한 다음, 30mL의 성장 배지를 플라스크에 첨가한다.
- 성장 배지 4mL를 세포에 넣고 혼합한 후 세포 현탁액을 T-175 플라스크에 분배합니다. 총 부피가 35mL인지 확인합니다. 플라스크를 작업 표면을 따라 왼쪽과 오른쪽으로 5-6회 부드럽게 밀고 앞뒤로 5-6회 밀어 플라스크 표면에 세포가 고르게 분포되도록 합니다.
- T-175 플라스크를 37°C 및 5%CO2의 세포배양 배양기에 넣는다. 세포를 3일 동안 또는 70% 이하의 밀도에 도달할 때까지 배양한 다음 세포를 계대배양합니다.
- 통과 원시 인간 근모세포
- 얼음 위의 DMEM/F100 배지 30mL에 ECM을 1:12의 비율로 희석합니다.
- ECM 용액 10mL를 3개의 T225 플라스크에 적용하고 세포 파종 전에 최소 1시간 동안 37°C에서 배양하되 24시간 이하로 배양합니다. ECM 용액이 전체 플라스크 바닥을 덮는지 확인하십시오.
- 세포를 15mL의 DPBS로 세척합니다. 공급업체의 프로토콜에 따라 해리 시약을 흡인하고 추가합니다.
- 세포가 들어 올려지면 공급 업체의 프로토콜에 따라 반응을 중지하고 세포를 원뿔형 튜브에 수집합니다. 세포를 300 x g 에서 3분 동안 원심분리합니다.
- 상층액을 흡인하고 P1000 피펫을 사용하여 성장 배지 1mL에 세포를 재현탁하여 단일 세포 현탁액을 얻습니다.
- ECM 코팅 플라스크를 15mL의 DPBS로 세척합니다. DPBS를 흡인한 다음, 각 T225 플라스크에 40mL의 성장 배지를 첨가한다.
- 14 mL의 성장 배지를 세포 현탁액에 첨가하고, 5 mL의 세포 현탁액을 혼합하고, 각각의 T225 플라스크에 분배한다. 각 플라스크의 총 부피가 45mL인지 확인합니다. 플라스크를 작업 표면을 따라 왼쪽과 오른쪽으로 5-6회 부드럽게 밀고 앞뒤로 5-6회 밀어 균일한 분포를 보장합니다.
- 플라스크를 37°C 및 5%CO2에서 세포 배양 배양기에 넣는다.
- 세포를 2-3일 동안 또는 70% 이하의 밀도에 도달할 때까지 배양한 다음 계대배양합니다. 각 통로에서 세포를 1:3 또는 1:4로 분할하고 3 x 103 과 1 x 104 cells/cm2 사이에 시드합니다.
- hiPSC 유래 심근세포 배양
- 얼음 위의 DMEM/F12 배지 1mL에 ECM을 60:12의 비율로 희석합니다.
- ECM 용액 1mL를 2개의 6-웰 플레이트의 각 웰에 적용하고 세포 파종 전에 최소 1시간 동안 37°C에서 배양하되 24시간 이하로 배양합니다.
- 냉동 심근 세포 바이알을 37°C의 수조에서 2분 동안 또는 얼음이 녹을 때까지 해동합니다.
- 바이알에 70% 에탄올을 분사하고 BSC로 옮깁니다.
- p1000 피펫을 사용하여 해동된 세포를 50mL 코니컬 튜브에 옮깁니다.
- 빈 극저온 액체를 1mL의 실온(RT) 도금 배지로 헹구어 나머지 세포를 회수합니다.
- 1mL의 헹굼 매체를 90초 동안 세포의 원뿔형 튜브에 천천히 떨어뜨립니다(5초마다 한 방울). 느린 배지 첨가 동안 세포를 혼합하기 위해 튜브를 지속적으로 소용돌이칩니다.
- 10mL 혈청학적 피펫을 사용하여 8mL의 도금 배지를 세포의 50mL 원뿔형 튜브에 천천히 추가합니다.
- 모든 배지를 분주된 후 위아래로 부드럽게 3회 피펫하여 세포를 완전히 혼합합니다. hemacytometer와 trypan blue를 사용하여 세포를 계수합니다.
- 50mL 원뿔형 튜브의 세포를 300 x g 에서 3분 동안 원심분리합니다.
- 세포가 펠릿화 된 후, 상층액을 흡인한다.
- p1000 피펫을 사용하여 1mL의 도금 매체를 튜브에 옮기고 천천히 위아래로 3-5회 피펫팅하여 펠릿을 부드럽게 분해합니다. 추가 도금 매체로 세포를 재현탁합니다.
- 2 mL의 도금 배지에서 6 웰 플레이트의 웰 당2-4 x 10 세포 사이에 시드한다.
- ECM 코팅된 6웰 플레이트를 DPBS(2mL/웰)로 세척합니다.
- 6 웰 플레이트의 웰 당 2 mL의 세포 현탁액을 피펫팅한다. 플레이트를 작업 표면을 따라 왼쪽과 오른쪽으로 5-6회 부드럽게 움직인 다음 앞뒤로 5-6회 움직여 플레이트 표면에 셀이 고르게 분포되도록 합니다.
- 플레이트를 37°C 및 5%CO2의 세포 배양 배양기에 넣는다.
- 해동할 세포의 모든 바이알에 대해 1.3.3-1.3.16단계를 반복합니다.
- 도금 후 다음날 유지 배지를 3-5 mL(세포주 및 밀도에 따라 다름)로 변경한 다음 격일로 배지를 교체합니다. 세포를 3D 조직으로 캐스팅하기 전에 3-4일 동안 배양합니다.
- 기질 세포 배양
- ECM 용액 30mL를 T175 플라스크에 적용하고 세포 파종 전에 최소 1시간 동안 37°C에서 배양하되 24시간 이하로 배양합니다.
- 기질 세포 배지 5 mL를 15 mL 코니컬 튜브에 분취한다.
- 37°C의 수조에서 2분 동안 또는 얼음이 막 녹을 때까지 냉동 기질 세포 바이알을 해동합니다.
- 바이알에 70% 에탄올을 분사하고 BSC로 옮깁니다.
- p1000 피펫을 사용하여 바이알의 해동된 세포에 기질 세포 배지 1mL를 천천히 추가합니다.
- 세포 현탁액을 바이알에서 원뿔형 튜브의 나머지 해동 매체로 옮깁니다. 5mL 혈청학적 피펫을 사용하여 세포를 혼합합니다. 피펫을 위아래로 3 번 피펫합니다.
- hemacytometer와 trypan blue를 사용하여 세포를 계수합니다. 세포를 회전시키지 마십시오.
- ECM 코팅된 T175 플라스크를 15mL의 DPBS로 세척합니다.
- 기질 세포를 3-4 x 103 cells/cm2의 밀도로 플라스크에 옮깁니다. 플라스크를 작업 표면을 따라 왼쪽과 오른쪽으로 5-6회 부드럽게 밀고 앞뒤로 5-6회 밀어 플라스크 표면에 세포가 고르게 분포되도록 합니다.
- 다음날 45mL의 가온된 기질 세포 배지로 배지를 교체합니다. 3D 조직으로 캐스팅하기 전에 세포를 3-4일 동안 배양합니다.
2. 재료 준비
- 피브리노겐
알림: 피브리노겐을 재구성할 때 피브리노겐 분말이 겹쳐지는 표면적의 양을 최대화하도록 주의하십시오. 이 프로토콜에서, 사용된 희석제의 양은 사용되는 용기의 크기에 최적화되었고, 즉, 단지 충분한 희석제가 접시의 바닥을 덮기 위해 사용되었다. 예를 들어, 50mL 원심분리기 튜브가 아닌 100mm 접시에 PBS 10mL 위에 0.5g의 피브리노겐을 적층합니다. 희석제의 표면적을 최대화하면 피브리노겐을 재구성하는 데 필요한 시간이 줄어들고 단백질의 잠재적 응집이 줄어 듭니다.- 재구성
- PBS 10 mL를 100 mm 세포 배양 접시에 옮기고 세포 배양 배양기에서 37°C로 가온한다.
- 따뜻한 PBS의 전체 표면에 0.5g의 피브리노겐 분말을 적층하고 피브리노겐이 완전히 용해될 때까지 37°C에서 유지합니다. 이 작업은 2 시간 이상 걸리지 않아야합니다. 용해 분말은 부드럽게 소용돌이 칠 수 있지만 접시를 세게 흔들지 마십시오.
- 제균 여과
- 분말이 완전히 용해되면 용액을 100μm 필터에 통과시키고 50mL 원추형 튜브에 모아 겔화된 피브리노겐 덩어리를 제거합니다.
- 여과된 용액을 0.2μm 필터로 덮인 10mL 주사기에 붓습니다. 필터를 통해 용액을 밀어 넣고 새 50mL 원뿔형 튜브에 수집합니다. 10mL의 용액을 모두 멸균하려면 필터를 두 번 이상 교체해야 할 수도 있습니다.
- 멸균 피브리노겐 300mL를 1.5mL 미세원심분리기 튜브에 분취하여 -20°C에서 보관합니다. 필요에 따라 분취량을 얼음 또는 4°C에서 해동합니다. 반복적인 동결/해동을 피하십시오.
- 재구성
- 트롬빈
- 6mL의 PBS와 4mL의diH2O를 하나의 트롬빈 바이알(1KU)에 직접 추가하여 100U/mL 트롬빈 원액을 만듭니다.
- 0.2μm 필터로 필터를 멸균하고 분취액을 주입하고 트롬빈이 유리에 흡착될 때 -20°C에서 1.5mL 플라스틱 미세 원심분리기 튜브에 보관합니다. 반복적인 동결/해동을 피하십시오.
- 폴리 (에틸렌 이민) 용액 (PEI)
주의: PEI는 독성이 있습니다. 제조업체에서 지정한 적절한 PPE를 사용하십시오.
참고: PEI는 50% w/v 용액으로 제공됩니다. 점성이 높고 피펫팅하기가 어렵습니다. 50% w/v 솔루션에서 직접 추출하지 않고 10% 원액에서 0.1% 솔루션을 만듭니다.- 50mL 원뿔형 튜브에서 50% w/v PEI 용액 5mL를 측정합니다.
- 20mL의diH2O를 첨가하고 혼합하여 10% 원액을 수득한다. 이 고농축 원액은 멸균 여과할 수 없습니다.
- 세포 배양을 위한 0.1% 용액을 만들기 위해, 500 mL 필터 플라스크를 사용하여 495 mLdiH2O. 멸균 필터에 5 mL의 10% 스톡을 첨가하고, 1주일 이하의 기간 동안 RT에서 저장한다.
- 글루타르알데히드
주의: 글루타르알데히드는 독성이 있습니다. 제조업체에서 지정한 적절한 PPE를 사용하십시오.- 글루 타르 알데히드는 25 % 용액으로 공급됩니다. 0.01 % 용액을 만들기 위해, 99.6 mL의 diH2O에 40 μL를 첨가한다. 멸균 필터, 4 °C에서 1 주일 이상 보관하지 않는다.
- 사후 준비
- 소모품 조직 캐스팅 키트를 멸균 배양 후드 안에 넣습니다. 주조 키트에는 뚜껑, 24쌍의 기둥(24웰 플레이트의 웰당 한 쌍의 기둥)을 고정하는 기둥 격자 및 24개의 주조 웰을 포함하는 특수 24웰 플레이트 바닥이 포함되어 있습니다. 각 주조 웰에는 웰 바닥에 트렌치가 있어 세포/하이드로겔 구성 요소를 고정하고 하이드로겔이 중합될 때 튜브 모양의 조직으로 성형합니다(그림 1B).
- 24웰 플레이트의 웰을 1.5mL/웰의 0.1% PEI 용액으로 채우고 각 포스트 쌍의 팁이 잠기도록 플레이트에 포스트를 놓습니다. 10분 동안 그대로 두십시오. PEI는 기둥에 양전하를 띠어 하이드로겔의 단백질이 조직 주조 중에 기둥에 단단히 부착되도록 합니다.
- 두 번째 24웰 플레이트의 웰을 2mL/웰의 멸균diH2O로 채우고 포스트를 옮깁니다. 1분 동안 그대로 두십시오.
- 세 번째 24웰 플레이트에서 0.01% 글루타르알데히드(GA) 1.5mL/웰로 웰을 채우고 포스트를 옮깁니다. 30분 동안 그대로 두십시오. GA는 PEI에서 게시물로 양전하를 고정합니다.
- 포스트가 글루타르알데히드에 있는 동안 diH2O 웰을 흡인하고 멸균diH2O2mL/웰로 세척하고 흡인하고 멸균diH2O2mL/웰로 다시 채웁니다. 헹굼 대신 신선한 24웰 플레이트를 사용할 수 있습니다.
- 30분이 지나면 포스트를 멸균 diH2O의 2mL/웰로 옮깁니다. 1분 동안 그대로 두십시오.
- diH 2 O를 흡인하고 멸균 diH 2 O2mL / 웰을 추가합니다. 5분 동안 그대로 두십시오.
- 포스트를 24웰 플레이트로 옮겨 건조시킵니다(약 15분).
- 건조되면 주조 키트를 다시 조립합니다. 가장자리를 파라필름으로 막아 뚜껑과 플레이트를 함께 밀봉한 다음 세포 파종 전에 최대 72시간 동안 4°C에서 보관합니다. 더 긴 보관 시간이 가능할 수 있지만 테스트되지 않았습니다.
3. 조직 주조 프로토콜
- 주판 준비
- 조직 캐스팅 키트를 4°C에서 미리 냉각합니다.
- 얼음 양동이를 BSC로 옮깁니다. 얼음 위에서 웰당 50μL의 트롬빈 용액(트롬빈 스톡 3μL + EMT 배지 47μL)을 준비하여 캐스팅합니다.
알림: EMT 매체에 대한 자세한 내용은 3.2.1단계를 참조하십시오. - 냉장고에서 식힌 주조 키트를 꺼내 세포 배양 후드 내부의 차가운 블록이나 얼음 위에 놓습니다. 주조 판을 얼음 위에 평평하게 놓고 주조 판에서 새로운 멸균 24웰 판으로 포스트 격자를 옮깁니다.
- 50 μL의 트롬빈 용액을 캐스팅 플레이트의 각 미리 냉각된 웰에 피펫팅합니다.
- 키트를 다시 조립하고 티슈 캐스팅에 필요할 때까지 냉장고에 다시 넣습니다. 웰에 트롬빈을 첨가한 후 3시간 이내에 조직을 캐스팅합니다.
- 세포 준비
- EMT 기본 매체, 멸균 필터를 준비하고 얼음 위에 둡니다.
참고: 세포 특이적 캐스팅 배지에 FBS가 포함되어 있는 경우 피브리노겐과 상호 작용하여 조기 중합을 유발할 수 있으므로 열 비활성화 FBS를 사용하십시오.- 심장 EMT 배지 준비: RPMI 배지 500mL, B27 10mL, 아미노카프로산 2.5g을 추가합니다. (선택 사항) 10mM ROCK 억제제를 추가합니다(전체 500mL 부피가 아닌 조직 캐스팅에 사용되는 EMT 배지에만 추가).
- 골격 EMT 배지 준비: 1차 EMT의 경우 F10 배지 50mL와 아미노카프로산(ACA) 0.25g, iPSC 유래 EMT의 경우 ACA 0.1g을 추가합니다.
- 세포 배양 등급 해리 시약을 37°C로 가온한다. 해리 시약을 희석하기 위해 동일한 부피의 EMT 배지를 따뜻하게 합니다.
알림: 사용된 프로테아제를 완전히 비활성화하는 것이 중요합니다. 활성 프로테아제는 3D 조직 형성 및 부착 후 간섭을 방해합니다. - 세포를 PBS로 세척(도 1A). 2-웰 플레이트의 경우 6mL/웰을 사용합니다. 100mm 접시, T175 플라스크 및 T225 플라스크에 각각 6mL, 15mL 및 15mL를 사용합니다.
- 가온된 세포 배양 등급 해리 시약을 첨가하여 세포를 들어 올리고 37°C에서 5분 동안 또는 세포가 들어 올려질 때까지 인큐베이션합니다. 심장 배양의 경우 10x 해리 시약을 사용하십시오. 기질 세포 및 골격근 근모세포의 경우 1x 해리 시약을 사용하십시오. 6웰 플레이트의 경우 1mL/웰, 100mm 접시의 경우 3mL, T175 플라스크의 경우 8mL, T225 플라스크의 경우 10mL를 사용합니다.
- 접시의 측면을 두드려 2-3분마다 배양액을 확인하십시오.
- 세포가 들어 올려지면 50mL 원뿔형 튜브로 옮기고 P1000 피펫으로 분쇄하여 단일 세포 현탁액을 보장합니다.
- 플레이트 또는 플라스크를 추가 EMT 배지로 세척하여 나머지 세포를 수집하고 원추형 튜브에 추가합니다. 6웰 플레이트의 경우 EMT 배지 1mL/웰, 100mm 접시의 경우 2mL, T175 플라스크의 경우 5mL, T225 플라스크의 경우 5mL를 사용합니다.
- 단일 세포 현탁액을 보장하기 위해 세포를 분쇄합니다.
- EMT 배지를 추가하여 해리 과정을 종료한 다음 세포 계수를 위해 세포 현탁액 샘플을 채취합니다. 6웰 플레이트의 경우 1mL/웰, 100mm 접시의 경우 3mL, T175 플라스크의 경우 8mL, T225 플라스크의 경우 10mL를 사용합니다.
- 세포를 200 x g 에서 4분 동안 회전시킵니다. 현탁액이 원심분리되는 동안 혈구계와 trypan blue를 사용하여 세포 계수를 수행합니다.
- 상층액을 흡인하고 5mL의 EMT 염기 배지에 세포를 재현탁하여 잔류 해리 시약을 제거합니다.
- 세포를 200 x g 에서 4분 동안 원심분리합니다. 상청액을 흡인하고 적절한 밀도로 세포 현탁액을 준비합니다.
- EMT 배지 14,16에10%-20% ECM 단백질을 추가하여 3D 골격근 EMT의 수명과 기능을 증가시킵니다.
- 종자 줄기 세포 유래 심근 세포 및 그 간질 세포는 각각 조직 작제물 당 5 x 105 세포 및 7.5 x 104 세포입니다. 골격근 근모세포를 조직 구성물당 7.5 x 105 세포로 시드합니다.
- 심장 조직
- 상청액을 흡인하고 EMT 배지에서 mL당 2.5 x 106 세포의 밀도로 기질 세포를 재현탁하고 얼음 위에 놓습니다. EMT당 이 현탁액 30μL를 사용하십시오.
- 상층액을 흡인하고 EMT 배지에서 mL당 8.3 x 106 세포의 밀도로 CM을 재현탁하고 얼음 위에 놓습니다. EMT당 이 현탁액 60μL를 사용하십시오.
- 골격근 조직
- 상층액을 흡인하고 골격근 세포를 EMT 배지에서 mL당 8.3 x 106 세포의 밀도로 재현탁하고 얼음 위에 놓습니다. EMT당 이 현탁액 90μL를 사용하십시오.
- 원하는 수의 조직을 구성하는 데 필요한 각 세포 용액의 부피를 계산합니다(예: 준비된 CM 60μL 및 준비된 기질 세포 30μL 또는 EMT당 골격근 세포 90μL).
- 계산된 부피의 세포를 15mL 원뿔형 튜브에 피펫팅합니다.
- EMT 당 10 μL의 피브리노겐을 세포 현탁액에 첨가하고 얼음 위에 보관하십시오.
- EMT당 총 시약 및 세포 부피: 각 EMT에 90μL의 세포, 10μL의 피브리노겐 및 50μL의 트롬빈 용액이 있는지 확인합니다.
- EMT 기본 매체, 멸균 필터를 준비하고 얼음 위에 둡니다.
- 조직 주조
- 조직 캐스팅 키트를 세포 배양 후드로 옮기고 뚜껑을 제거합니다(유연하고 단단한 포스트를 포함하는 포스트 격자는 캐스팅 플레이트에 남아 있어야 합니다. 그림 1B). 기둥 격자가 있는 주판을 얼음 위에 평평하게 놓으십시오.
- 세포/피브리노겐 혼합물을 혼합하고 P200 피펫으로 100μL를 추출합니다.
- 50 μL의 트롬빈 용액으로 준비된 웰에 혼합물 100 μL를 넣고 잘 섞이도록 5 번 분쇄합니다. 기포가 생기지 않도록 피펫을 첫 번째 스톱 지점으로 밀지 말고 분쇄 후 팁을 제거하십시오.
- 이 단계에서, 그리고 포스트 격자가 캐스팅 플레이트로부터 들어 올려질 준비가 될 때까지(단계 3.3.10), 격자의 임의의 움직임은 포스트에 대한 조직의 장기간의 부착을 손상시킬 수 있다. 격자의 움직임을 피하기 위해 한 손의 포인터 손가락과 엄지 손가락을 사용하여 격자와 주조 우물 판을 동시에 잡습니다.
- 모든 조직이 주조될 때까지 각 조직에 대해 새 P200 팁으로 반복합니다. 세포가 빠르게 침전될 때 각 조직을 캐스팅하기 전에 15mL 원뿔형 튜브에 세포 현탁액을 혼합합니다.
- 조심스럽게 시드 키트를 인큐베이터로 옮기고 격자를 움직이지 않도록하십시오. 파종 후 격자의 이동은 주조 우물에서 조직을 옮기는 성공률을 감소시킬 수 있습니다. 세포 유형에 관계없이 37°C에서 80분 동안 배양합니다. 이것은 하이드로겔의 중합을 시작하고 단백질이 포스트에 부착되도록 합니다.
- 한편, 심장 조직용 EMT 배지 2mL/웰이 포함된 신선한 24웰 플레이트를 준비합니다. 10 mM ROCK 억제제는 원한다면 EMT 배지에 첨가될 수 있다. 플레이트를 37°C에서 인큐베이션하여 배지를 따뜻하게 한다.
- 일차 골격근 조직의 경우 5g/L 아미노카프로산(0.2mm 멸균 여과) 또는 iPSC 유래 EMT의 경우 2g/L ACA를 포함하는 2mL/웰의 성장 배지를 준비합니다. 플레이트를 37°C에서 인큐베이션하여 배지를 따뜻하게 한다.
- 배양 후, EMT 배지 1mL를 캐스팅 웰의 가장자리에 부드럽게 첨가하고 세포 유형에 관계없이 37°C에서 10분 동안 추가로 배양합니다. 이렇게 하면 주물 웰의 가장자리에서 하이드로겔이 제거되고 조직이 쉽게 이동할 수 있습니다.
- 10분 후, 포스트 격자를 조심스럽게 들어 올리고 조직을 캐스팅 플레이트에서 배지가 있는 준비된 24웰 플레이트로 옮깁니다(그림 1C). 조직과 함께 플레이트를 37°C의 세포 배양 배양기로 되돌립니다.
- 정비
- 24시간 후, 캐스트 조직을 EMT 배지 2mL/웰(포함된 경우 ROCK 억제제 없이)이 포함된 신선한 24웰 플레이트로 옮기고 37°C에서 배양합니다. 골격근 세포의 경우, 성장 배지를 분화 배지로 전환하여 근원세포 융합을 촉진합니다.
- 2-3일마다 EMT 배지 2mL/웰이 있는 신선한 웰로 심장 조직을 옮깁니다.
- 골격근 조직을 2-3일마다 5g/L 아미노카프로산(0.2mm 멸균 여과)이 포함된 2mL/웰 분화 배지를 사용하여 신선한 웰로 옮깁니다. iPSC 유래 조직에는 2g/L ACA를 사용합니다.
- 배지 변경을 돕기 위해 3D 조직의 손상을 방지하기 위해 동일한 플레이트에서 배지를 변경하는 대신 포스트 격자를 새로운 24웰 플레이트로 옮깁니다. EMT 배지로 두 번째 24웰 플레이트를 준비하고 조직을 새로운 배지로 옮깁니다. 다음 배지 교체에 사용할 수 있도록 활성 배양과 함께 오래된 배지가 있는 플레이트를 보관하십시오. 배양 기간 동안 두 플레이트 사이에서 포스트 격자를 앞뒤로 옮깁니다. 또는 각 매체 교체에 대해 새 플레이트를 사용하십시오.
- 포스트 편향의 광학 추적(그림 1D) 또는 자기 감지 하드웨어13,14를 통해 EMT 수축을 측정합니다. 심장 조직은 배양 후 3-4 일 후에 자발적으로 뛰기 시작합니다. 골격근 조직은 전형적으로 배양 7일 후에 전기장 자극으로 수축한다.
결과
세포는 2-포스트 소모성 플레이트에서 조작된 근육 조직으로 캐스팅되었습니다(그림 1). 성공적인 EMT는 균일하게 나타나고 매트릭스는 기둥 사이에 고르게 분포됩니다(그림 2A). 매트릭스는 또한 두 기둥을 감싸서 조직에 대한 동등한 앵커 포인트를 생성해야 합니다. 이 방법에서는 주조 실패가 드물며 일반적으로 육안 검사로 분명합니다. 실패한 EMT 생산은 포스트에서 조직 분리(그림 2B)와 같은 치명적인 실패에서 기포 및 포스트에 대한 느슨한 부착과 같은 보다 미묘한 구조적 결함(그림 2C, D)에 이르기까지 다양할 수 있습니다. 경미한 결함이 있는 조직은 여전히 실행 가능할 수 있지만 이러한 조직의 데이터를 주의 깊게 검사하여 손상되지 않은 EMT와 비교할 수 있는지 확인해야 합니다. 예를 들어, EMT 내의 기포는 시간이 지남에 따라 조직이 압축됨에 따라 압착되어 수축 결함 없이 완전한 기능을 하는 구조를 만들 수 있습니다. 그러나 이러한 조직은 기포의 위치가 기능 회복에 영향을 미칠 수 있으므로 사례별로 평가해야 합니다. 예를 들어, 기둥에서 생성된 기포는 조직 부착에 영향을 미쳐 기둥에 대한 장기적인 부착을 방해할 수 있습니다.
조직은 세포가 하이드로겔 내의 매트릭스를 리모델링함에 따라 처음 24시간 이내에 압축되기 시작합니다(그림 3). 압축은 점진적인 과정이며 일반적으로 배양의 처음 2-4 주 동안 진행됩니다. 전반적으로 조직 압축은 기술적 복제물과 생물학적 복제물 간에 일관됩니다(그림 4). 일부 세포주는 시간이 지남에 따라 조직이 성숙함에 따라 다른 세포주보다 매트릭스를 더 압축하는 것이 정상입니다. 작제물 내의 근형성 세포의 비율은 EMT 압축의 속도 및 전반적인 정도에 영향을 미친다. 심장 및 골격근 세포주의 총 근형성 함량은 조작된 조직 간의 변화를 최소화하기 위해 80% 이상이어야 합니다. 이는 세포주 전반에 걸쳐 수축력과 동역학을 비교할 때 특히 중요합니다.
캐스팅 후 처음 며칠 이내에 심근 세포는 배양에서 자발적으로 뛰기 시작하여 각 근육 수축과 함께 유연한 포스트를 리드미컬하게 구부립니다. 골격근 구조는 분화 시작 후 7일까지 전기 자극에 반응하여 수축합니다. 현장 자극은 맞춤형 24웰 전극 뚜껑에 부착된 외부 자극기를 통해 골격근 조직에 적용되었습니다. 각 웰에 대해 한 쌍의 탄소 전극으로 제작 된 뚜껑은 24 웰 조직 플레이트 위에 놓여 있으며 동시에 각 EMT를 자극하여 근육 수축을 유도합니다. 조직은 기능 측정 동안 1Hz에서 10ms 펄스 지속 시간 동안 10V 자극을 사용하여 속도를 조절했습니다. 수축 조직은 융합된 골격 근모세포를 나타내며, 기능적 육관과 수축 기계로 완성된 근관을 형성합니다. 골격 EMT는 미오신 중쇄(MyHC)에 대해 양성으로 염색되고 디스트로핀은 근관막에 국한되어 단면 면역조직화학 분석에서 고전적인 고리 모양을 나타냅니다(그림 5). EMT가 작동하면 자기 감지 장비에서 수축성을 매일 측정할 수 있으며, 시간이 지남에 따라 구조가 발달하고 성숙함에 따라 추적력과 동역학을 추적할 수 있습니다. 심장 및 골격근 조직은 모두 3D 배양에서 몇 주에서 몇 달 동안 수축 상태를 유지하며(그림 6) 광범위한 수축성 연구에 사용할 수 있습니다.
자기 검출 접근법은 독소루비신(그림 7) 및 BMS-986094(그림 8)와 같은 구조적 심장 독성 물질과 근육 수축력에 영향을 미치는 기타 약물의 급성 및 만성 영향을 동시에 측정하는 데 사용할 수 있습니다. 수축 감지의 광학 추적 방법도 사용할 수 있지만 측정이 순차적으로 수행되어야 하므로 급성 약물 효과를 연구할 때는 주의해야 합니다. 3D 배양에서 심장 및 골격 EMT의 수명이 연장되어 이러한 조직에서 장기적인 약물 연구가 가능합니다. 이를 통해 사용자는 독소루비신에서 발생하는 것처럼 시간이 지남에 따라 심장 독성 효과를 나타낼 수 있는 화합물에 대한 지속적이고 장기간 노출뿐만 아니라 반복 투여의 효과를 탐색할 수 있습니다. 독소루비신(Doxuruvicin, dox)은 항암화학요법 약물이다17. 환자에게 투여되는 약물의 양은 암의 유형, 환자의 나이, 환자의 키와 몸무게 및 기타 요인에 따라 다릅니다. 이러한 이유로 광범위한 농도 및 전달 일정에 걸쳐 dox의 효과를 테스트하는 것이 중요합니다. 여기에서 심장 EMT는 27일 동안 세 가지 개별 농도(0.1μM, 1μM 및 10μM)의 dox로 처리되었습니다(그림 7). 그룹은 각 농도에서 EMT를 볼루스 처리 또는 72시간마다 중간 교체와 함께 연속 투여로 처리하여 추가로 계층화되었습니다. dox의 볼루스 치료를 받은 웰은 3개의 개별 시점에서 약물에 노출되어 투여 사이에 회복이 가능했습니다. 두 번의 가장 높은 용량의 볼루스와 지속적인 노출은 연구 전반에 걸쳐 수축력 생성의 즉각적이고 장기간의 중단을 보여주었습니다. 중간 농도와 가장 낮은 농도는 투여 방법에 따라 조직에 다양한 영향을 미쳤다. 약물의 가장 낮은 농도에서, bolus 그룹은 대조군과 차이를 보이지 않았다. 그러나 수축력은 2주간의 연속 노출 후에 감소했습니다. 약물의 중간 범위 농도는 흥미로운 효과가있었습니다. 연속 투여는 치료 첫 이틀 동안 힘을 감소시키고 실험 내내 지속되었지만, 볼루스 그룹은 3일 후에 약물이 씻겨 나갔을 때 수축력이 대조군 수준으로 회복되는 것으로 나타났습니다. 그러나 약물의 두 번째 볼루스는 힘의 완전한 중단을 일으킨 후 회복되지 않았으며(그림 7), 이는 이 농도로 반복적으로 투여하면 이 약물로 치료받은 환자에게 심장 독성 효과가 있을 수 있음을 나타냅니다. 이 연구의 광범위한 범위는 시간 및 실험 조건 모두에서 독성 스크리닝에서 3D 엔지니어링 조직의 유용성을 강조하며, 이는 수축성을 유지하고 장기간에 걸쳐 화학 물질 노출에 반응하여 단일 근육 조직 세트 내에서 장기적인 약물 연구를 가능하게 하기 때문입니다. 이는 만성 노출로 인해 심장 독성 효과를 가질 수 있는 화합물을 식별할 뿐만 아니라 잠재적인 심장 독성 투여 시기를 감지하는 데 도움이 됩니다.
조작된 인간 근육 조직의 체외 독성 테스트는 임상 시험에서 인간 환자를 안전하게 보호하는 데 도움이 되는 한 가지 방법입니다. BMS-986094는 C형 간염 치료에 사용되는 뉴클레오티드 중합효소(NS5B) 억제제입니다. 이 약물은 Bristol-Myers Squibb가 환자18,19의 예상치 못한 심부전 사례로 인해 개발을 중단했을 때 2 상 임상 개발 중이었습니다. 여기에서 BMS-986094를 심장 EMT에 적용하여 3D 엔지니어링 근육 조직이 약물에 대한 심장 독성 반응을 일으키는지 여부를 테스트했습니다(그림 8). 세 가지 다른 농도의 약물을 적용하고 13일 동안 조직을 모니터링했습니다. 수축력은 용량 의존적 방식으로 약물의 첨가와 함께 감소하였다(도 8A). Twitch 빈도는 또한 박동률이 느려지고 심장 독성 화합물에 계속 노출되면 예상대로 중단됨에 따라 상당한 영향을 받았습니다(p < 0.05, 그림 8B). 이러한 결과는 3D 공학적 인간 근육 조직이 어떻게 신약 출시를 촉진하고 심장 독성으로 인해 결국 실패하는 화합물에 플래그를 지정하는 데 사용될 수 있는지 보여줍니다. 더욱이 이 기술은 위험한 약물이 임상 시험에서 환자에게 투여되기 전에 노출시켜 잠재적으로 생명을 구할 수 있습니다.
인간 수축 조직에 대한 급성 및 만성 적용 약물의 효과를 측정하는 능력은 안전성과 효능에 대한 치료법을 조사할 때 중요한 첫 번째 단계입니다. 그러나 적용되는 약물의 농도가 생리학적으로 적절하고 체외 테스트에 적합하다는 것을 아는 것이 중요합니다. 골격근 조직은 가득 차있는 복용량 반응 곡선에 있는 2,3-Butanedione monoxime (BDM)를 위한IC50 가치를 확립하기 위하여 이용되었습니다. 이 약물은 골격근 myosin-II20의 잘 특성화 된 ATPase 억제제입니다. BDM은 육종에서 액틴 필라멘트와 함께 미오신 교차 다리 형성을 방지하여 근육 수축을 억제합니다21. 여기에 표시된 결과는 약물을 적용했을 때 절대 힘의 용량 의존적 감소와 약물이 씻겨 나갔을 때 수축력의 완전한 회복을 보여 주며, 일시적인 효과가 단순히 조직 내 세포를 죽이는 것이 아니라 근육 수축을 방지한다는 것을 나타냅니다(그림 9A). 또한, 조사된 7개 농도에 걸쳐 전체 용량-반응 곡선을 측정하여 이들 인간 미세조직에서 3.2mM의IC50 을 확립하였다(도 9B).

그림 1: 2-post Mantarray 소모품 24웰 플레이트에서의 EMT 주조 . (A) Myogenic 및 stromal 세포는 조직 캐스팅 전에 2D 표면에서 배양되었습니다. (B) 세포는 2D 표면에서 들어 올려지고 세포외 기질 단백질과 함께 혼합되어 삽입물에 표시된 개별 플레이트 캐스팅 웰에서 하이드로겔을 형성합니다. (C) 모든 웰에 조작된 조직을 포함하는 24웰 플레이트. (D) 자기 기둥의 변위를 비교하는 이완되고 수축된 공학적 근육을 보여주는 대표적인 조직(녹색 막대). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
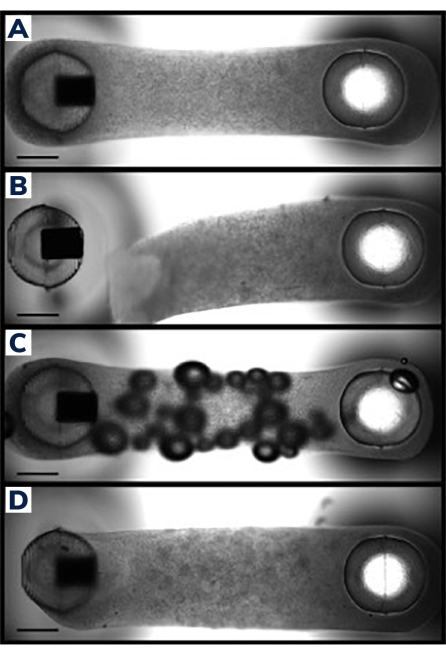
그림 2: EMT 캐스팅 성공 및 실패 . (A) 조직 전체에 걸쳐 균질한 세포/매트릭스 구성으로 기둥 주위를 균일하게 압축한 24시간 후 캐스팅에 이상적인 엔지니어링 근육 조직. (B) 플렉시블 포스트로부터 하이드로겔의 분리를 보여주는 실패한 EMT. (C) 조직 전체에 걸쳐 기포를 포함하는 EMT. (D) 두 기둥 주위에 불균등한 조직 침착. 조직은 한쪽의 유연한 포스트에 느슨하게 고정되어 있습니다. 스케일 바는 1mm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
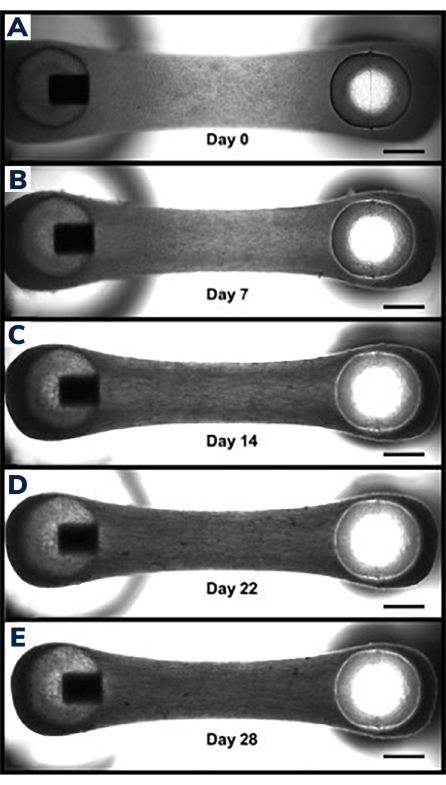
그림 3: 시간 경과에 따른 조작된 근육 조직의 압축. (A) 캐스팅 1일 후에 나타난 EMT 구성물. 조직은 분화 배지로 옮겨지고, 세포 융합 및 하이드로겔 압축의 0일째를 시작한다. (B-E) 7일차부터 21일차까지의 동일한 EMT는 시간이 지남에 따라 두 기둥 사이의 전체 길이가 약간 짧아지고 EMT의 중간 부분을 통해 측정할 때 너비가 더 작아집니다. 스케일 바는 1mm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
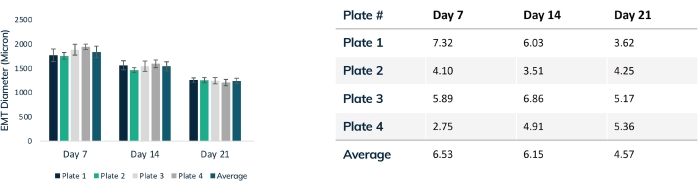
그림 4: 시간 경과에 따른 EMT 직경. 21일 동안 4개의 조직 플레이트를 추적하여 압축 전반에 걸쳐 EMT 직경을 비교했습니다. 각 조직은 광학 현미경을 사용하여 매주 중간 섹션을 통해 측정되었습니다. 시점은 플레이트 사이에 일관된 EMT 크기를 보여줍니다. 매트릭스 리모델링이 안정화됨에 따라 21일째에 최대 압축에 도달합니다. 표는 조직의 각 플레이트 내 압축의 표준 편차(전체의 %)와 모든 플레이트에 대한 평균 편차를 보여줍니다. 컬러 막대는 개별 플레이트입니다. 오차 막대는 플레이트 내의 EMT의 SD입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
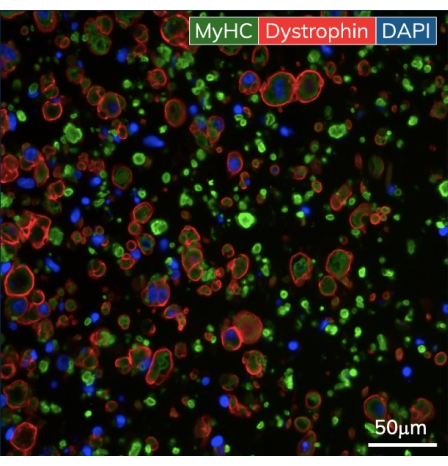
그림 5: 조작된 골격근 조직의 면역조직화학. EMT는 배양 10일째에 고정되고 파라핀에 포매되었습니다. 얇은 단면(7μm)을 이미징 전에 미오신 중쇄 및 디스트로핀에 대한 항체로 염색했습니다. 녹색 = MyHC, 빨간색 = 디스트로핀, 파란색 = DAPI. 대물 배율은 40X입니다. 스케일 바는 50μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
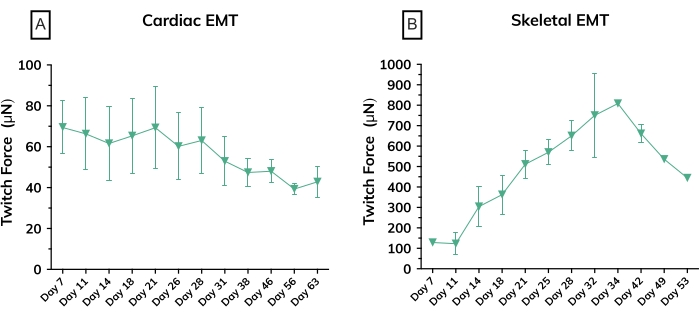
그림 6: 시간 경과에 따른 조작된 근육 조직의 수축력. (A) 배양에서 7일째부터 63일째까지 심장 EMT에서 측정한 평균 절대 경련력; n = 그룹당 3개. (B) 배양 7일째부터 53일째까지 일차 세포주로부터 유래된 골격 EMT의 평균 절대 트위치 힘; n = 3입니다. 오차 막대는 두 그래프 모두 SD입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
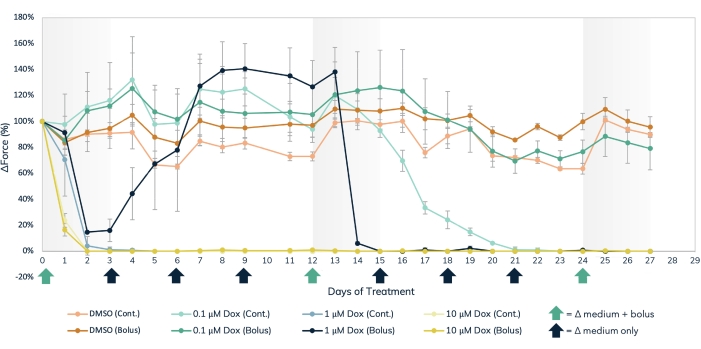
그림 7: 조작된 근육 조직에서의 급성 및 만성 독소루비신 치료. 0.1μM, 1μM 및 10μM의 세 가지 개별 용량 농도의 dox를 일시 투여하거나 27일 동안 조작된 근육 조직에 지속적으로 투여했습니다. 약물의 볼루스 용량은 0일, 12일 및 24일의 배지 변경 시 추가되었으며 X축의 녹색 화살표로 표시되었습니다. 약물은 연속 투여를 위해 모든 배지 교체에서 배지에 첨가되었으며, X축에 검은색 및 녹색 화살표로 표시되었습니다. 기준선 값(약물 전 치료)에서 힘의 변화율은 Y축에 있고 치료 일수(일)는 X축에 있습니다. 밝은 주황색 = DMSO 연속 제어, 짙은 주황색 = DMSO 볼루스 제어, 밝은 녹색 = 0.1μM dox 연속, 짙은 녹색 = 0.1μM dox 볼루스, 밝은 파란색 = 1μM dox 연속, 진한 파란색 = 1μM Dox 볼루스, 밝은 노란색 = 10μM Dox 연속, 짙은 노란색 = 10μM Dox 볼루스. 오차 막대는 SD입니다. 조건당 n = 3. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
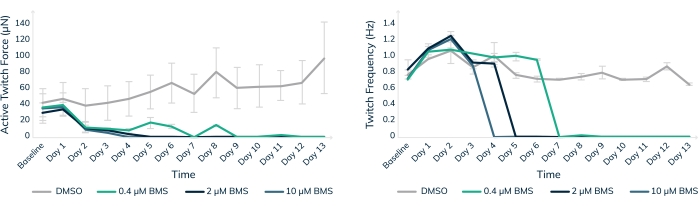
그림 8: 조작된 근육 조직에서 BMS-986094를 사용한 만성 치료. EMT는 13일 동안 0.4μM(녹색), 2μM(진한 파란색) 및 10μM(연한 파란색) BMS-986094로 처리되었습니다. (A) 수축성 경련력(Y축)은 처음 2일 동안 모든 약물 농도에서 감소하는 반면, DMSO의 대조군 조직은 시간이 지남에 따라 계속 강해집니다(X축). (B) 심장 박동률 또는 경련 빈도는 그래프 A에 표시된 수축력의 중단과 함께 용량 의존적 방식으로 중단됩니다. DMSO(회색)의 대조군 조직은 실험 내내 규칙적인 박동수를 유지합니다. 오차 막대는 SD입니다. 조건당 n = 3. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
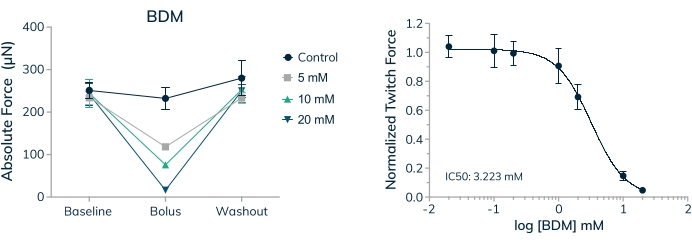
그림 9: 조작된 골격근 조직에서 BDM에 대한 용량 반응 . (A) 1차 세포 유래 EMT가 3D 배양에서 16일째 2,3-부탄디온 모노심(BDM)에 노출될 때 절대 경련력은 용량 의존적 방식으로 감소합니다. 절대 경련력은 약물이 씻겨 나갈 때 거의 기준선 값으로 돌아갑니다. (B) 기준선 값으로 정규화된 절대 트위치 힘은 전체 용량-반응 곡선 및IC50 값을 산출하는 BDM에 노출될 때 용량 의존적 방식으로 감소합니다. 투여량당 n = 4. 오차 막대는 SD입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 연구는 24웰 소모품 주조 키트 내에서 3D 엔지니어링 심장 및 골격근 조직을 생성하는 방법을 설명합니다. 이러한 방법을 따르면 후속 약물 스크리닝을 위한 캐스팅 실패 없이 24개 조직의 완전한 배열을 일관되게 달성할 수 있습니다. 이러한 결과를 달성하기 위한 중요한 고려 사항은 캐스팅 중에 하이드로겔의 조기 중합을 방지하기 위해 모든 단계를 얼음 위에서 수행하고, 조직 캐스팅 전에 세포 해리 시약을 제거하고, 각 조직에 대한 세포와 하이드로겔 현탁액의 철저한 혼합, 조직 간 피펫 팁 교체, 열 비활성화 FBS(전혀 사용하지 않는 경우)의 사용을 보장합니다. 또한 주조가 시작되면 포스트 격자가 움직이지 않고 하이드로겔이 형성되면 부드럽게 이동되도록 하는 것이 중요합니다.
주요 변형에는 심장 대 골격 EMT를 달성하기 위한 다양한 세포 유형의 사용과 세포 성숙 및 조직 안정성을 촉진하기 위해 다양한 농도의 기저막 단백질로 하이드로겔을 도핑하는 것이 포함됩니다. 이러한 도핑의 유익한 효과는 사례별로 테스트되어야 하지만 특정 상황에서 기능적 결과와 조직 수명을 향상시키는 것으로 나타났습니다14,16,22. 또한 나열된 세포 밀도는 지침이며 다른 세포주에 맞게 최적화해야 할 수도 있습니다. 대안적인 하이드로겔 조성물은 또한 달성된 EMTs23,24,25의 구조적 및 기능적 특성을 변형시키는 수단으로서 고려될 수 있다. 천연 근육 미세 환경에는 또한 형태와 기능에서 근세포를 지원하기 위해 혈관 형성, 신경 분포 및 매트릭스 침착을 촉진하는 지지 세포 유형이 포함되어 있습니다26,27. 여기에 설명된 시스템은 현재 섬유아세포를 3D 심장 조직에 통합하지만, 추가 세포 유형은 시험관 내에서 치료 화합물의 안전성과 효능을 연구하기 위해 보다 생리학적으로 관련된 모델을 생성할 수 있습니다. 이전에는 다양한 지지 세포 유형이 3D 엔지니어링 조직에 성공적으로 통합되어 자기 감지 수축성 플랫폼 28,29,30을 사용하여 향후 연구를 위한 흥미로운 템플릿을 제시했습니다.
이 프로토콜의 문제 해결은 주조 공정 중 신뢰할 수 없거나 일관되지 않은 조직의 형성에 중점을 둡니다. 하이드로겔은 혼합하는 동안 세포의 균일한 분포를 촉진하면서 캐스팅될 때 기포가 형성되지 않도록 주의해야 합니다. 이상적인 세포 밀도, 세포 비율 및 매트릭스 구성을 식별하기 위해 각각의 새로운 세포 유형에 대해 최적화 실험이 필요할 수 있습니다.
이 기술의 주요 한계는 24개의 EMT로 구성된 전체 플레이트를 설정하는 데 필요한 상당한 수의 셀입니다. 여기에 제시된 데이터의 경우 플레이트당 1,500만 개의 심근 세포와 1,800만 개의 골격 근모세포가 사용되었습니다. 특정 연구자들은 이러한 대규모 세포 물질 풀에 접근하지 못할 수 있으며, 이로 인해 이 플랫폼을 최대한 활용하는 능력이 저해될 수 있습니다. 최종 사용자가 자기 감지 하드웨어에 액세스할 수 없는 경우 사후 처짐 측정을 광학적으로 수행해야 하므로 처리량이 크게 감소하고 여러 웰에서 근육 수축이 동시에 기록되지 않습니다. 그러나 Mantarray 하드웨어는 이러한 한계를 극복하여 여러 구조에서 동시에 EMT 수축을 지속적이고 비침습적으로 분석할 수 있는 최초의 상용 시스템을 제공합니다.
24웰에 걸친 자기 감지는 EMT 기능 발달에 대한 종단 연구를 실시간으로 용이하게 하고 화학적, 환경적 또는 유전자 조작에 대한 급성 반응을 정확하게 측정할 수 있습니다. 자기 감지는 여러 조직에서 동시에 측정할 수 있고 복잡한 데이터 분석이 필요하지 않은 몇 가지 장점이 있지만, 광학 감지 방법을 사용하면 칼슘 플럭스 또는 전압 매핑과 같은 생리학적 지표를 동시에 측정할 수 있습니다. 그러나 결과 섹션에 설명된 것과 같은 데이터 세트는 이 기술이 약물 개발 분야에서 가지고 있는 응용 프로그램의 폭을 보여줍니다. 시중에 나와 있는 분석법이 공학적 근육의 수축 출력을 직접 평가할 수 있는 수단을 제공한다는 점을 감안할 때 이러한 방법은 전임상 개발 파이프라인에 혁명을 일으킬 잠재력을 가지고 있습니다.
공개
모든 저자는 Mantarray 하드웨어 및 관련 소프트웨어를 상용화하는 회사인 Curi Bio Inc.의 직원 및 지분 보유자입니다.
감사의 말
이 작업은 식품의약국(U01 FD006676-01, 보건 및 환경 과학 연구소에 수여)과 국립 보건원(HL151094에서 Dr. Geisse)의 자금 지원으로 부분적으로 지원되었습니다. 이 원고를 준비하는 데 도움을 주신 Alec S. T. Smith 박사에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | CELLTREAT | 229485 | |
| 100 mm cell culture dish | ThermoFisher | 150466 | |
| 50 mL Steriflip filter | MilliporeSigma | SCGP00525 | |
| 500 mL filter flask | MilliporeSigma | S2GVU05RE | |
| 6-aminocaproic acid | Sigma | A2504 | |
| B27 | Gibco | 17504044 | |
| Cardiosight Maintenance Medium | NEXEL | CM-002A | |
| Cardiosight Plating Medium | NEXEL | CM-020A | |
| C-Pace EM stimulator | IonOptix | EM | |
| Curi Bio Muscle Differentiation Media Kit | Primary - DIFF | ||
| Curi Bio Muscle Maintenance Media Kit | Curi Bio | Primary - MAINT | |
| DAPI | Invitrogen | D1306 | |
| DMEM, high glucose, GlutaMAX | Gibco | 10566-016 | |
| Dnase | Sigma | 11284932001 | |
| DPBS | Gibco | 14190-250 | |
| Dystrophin antibody | Abcam | ab154168 | |
| Fetal bovine serum (FBS) | Thermo Scientific | 10082147 | Must be heat-inactivated |
| Fibrinogen (Bovine) | Sigma | E8630 | |
| Glutaraldehyde | Sigma | 354400 | |
| Ham's F10 | Gibco | 11550043 | |
| Hemacytometer | Sigma | Z359629 | |
| HS-27A Fibroblasts | ATCC | CRL-2496 | |
| Human Skeletal Muscle Myoblasts | Lonza | CC-2580 | |
| Luer Lock 0.2 µm syringe filter | Corning | 431219 | |
| Luer Lock 10 mL syringe | BH Supplies | BH10LL | |
| Mantarray Instrument | Curi Bio | MANTA-24-B1 | System |
| Mantarray Plate Kits | Curi Bio | MA-24-SKM-5 | Pack of 5 kits |
| Mantarray stimulation lid | Curi Bio | EM | |
| Matrigel (ECM) | Corning | 356231 | |
| Nexel Cardiosight-S, Cardiomyocytes | NEXEL | C-002 | |
| Optical Microscope | Nikon Ti2E | MEA54000 | |
| Pan Myosin Heavy Chain antibody | DSHB | MF-20 | |
| Poly(ethyleneimine) | Sigma | P3143 | |
| ROCK inhibitor | StemCell Technologies | Y-27632 | |
| RPMI | Gibco | 11875-093 | |
| Skeletal Muscle Growth Medium (SkGM-2) | Lonza | CC-3245 | |
| Standard 24-well plates | Greiner | M8812 | Other manufacturer's plates will not fit |
| Standard 6-well plates | ThermoFisher | 140675 | |
| Stromal medium (DMEM + 20% FBS) | |||
| T175 Filter Flask | ThermoFisher | 159910 | |
| T225 Filter Flask | ThermoFisher | 159934 | |
| Thrombin | Sigma | T4648 | |
| Trypan Blue solution, 0.4% | ThermoFisher | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Scientific | A1217702 | |
| TrypLE Select Enzyme (1x) | Thermo Scientific | 12563011 |
참고문헌
- Sharma, A., Wu, J. C., Wu, S. M. Induced pluripotent stem cell-derived cardiomyocytes for cardiovascular disease modeling and drug screening. Stem Cell Research & Therapy. 4, 150 (2013).
- Mudera, V., Smith, A. S. T., Brady, M. A., Lewis, M. P. The effect of cell density on the maturation and contractile ability of muscle derived cells in a 3D tissue-engineered skeletal muscle model and determination of the cellular and mechanical stimuli required for the synthesis of a postural phenotype. Journal of Cellular Physiology. 225 (3), 646-653 (2010).
- Vandenburgh, H., et al. Tissue-engineered skeletal muscle organoids for reversible gene therapy. Human Gene Therapy. 7 (17), 2195-2200 (1996).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nature Communications. 9 (1), 126 (2018).
- Fleming, J. W., et al. Bioengineered human skeletal muscle capable of functional regeneration. BMC Biology. 18 (1), 145 (2020).
- Madden, L., Juhas, M., Kraus, W. E., Truskey, G. A., Bursac, N. Bioengineered human myobundles mimic clinical responses of skeletal muscle to drugs. eLife. 4, 04885 (2015).
- Urciuolo, A., et al. Engineering a 3D in vitro model of human skeletal muscle at the single fiber scale. PLOS One. 15 (5), 0232081 (2020).
- Afshar, M. E., et al. A 96-well culture platform enables longitudinal analyses of engineered human skeletal muscle microtissue strength. Scientific Reports. 10, 6918 (2020).
- Sakar, M. S., et al. Formation and optogenetic control of engineered 3D skeletal muscle bioactuators. Lab on a Chip. 12 (23), 4976-4985 (2012).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Khodabukus, A., Baar, K. Defined electrical stimulation emphasizing excitability for the development and testing of engineered skeletal muscle. Tissue Engineering Part C: Methods. 18 (5), 349-357 (2011).
- Vandenburgh, H., et al. Drug-screening platform based on the contractility of tissue-engineered muscle. Muscle & Nerve. 37 (4), 438-447 (2008).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Enineering Part C Methods. 22 (10), 932-940 (2016).
- Smith, A. S. T., et al. High-throughput, real-time monitoring of engineered skeletal muscle function using magnetic sensing. bioRxiv. , 492879 (2022).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Hinds, S., Bian, W., Dennis, R. G., Bursac, N. The role of extracellular matrix composition in structure and function of bioengineered skeletal muscle. Biomaterials. 32 (14), 3575-3583 (2011).
- Carvalho, C., et al. Doxorubicin: the good, the bad and the ugly effect. Current Medicinal Chemistry. 16 (25), 3267-3285 (2009).
- Ahmad, T., et al. Cardiac dysfunction associated with a nucleotide polymerase inhibitor for treatment of hepatitis C. Hepatology. 62 (2), 409-416 (2015).
- Gill, M., et al. From the cover: Investigative nonclinical cardiovascular safety and toxicology studies with BMS-986094, an NS5b RNA-dependent RNA polymerase inhibitor. Toxicological Sciences. 155 (2), 348-362 (2017).
- Ostap, E. M. 2,3-Butanedione monoxime (BDM) as a myosin inhibitor. Journal of Muscle Research and Cell Motility. 23 (4), 305-308 (2002).
- Fryer, M. W., Gage, P. W., Neering, I. R., Dulhunty, A. F., Lamb, G. D. Paralysis of skeletal muscle by butanedione monoxime, a chemical phosphatase. Pflügers Archiv: European Journal of Physiology. 411 (1), 76-79 (1988).
- Fleming, J. W., et al. Functional regeneration of tissue engineered skeletal muscle in vitro is dependent on the inclusion of basement membrane proteins. Cytoskeleton. 76 (6), 371-382 (2019).
- Capel, A. J., et al. Scalable 3D printed molds for human tissue engineered skeletal muscle. Frontiers in Bioengineering and Biotechnology. 7, 20 (2019).
- Tsui, J. H., et al. Tunable electroconductive decellularized extracellular matrix hydrogels for engineering human cardiac microphysiological systems. Biomaterials. 272, 120764 (2021).
- Tsui, J. H., et al. Conductive silk-polypyrrole composite scaffolds with bioinspired nanotopographic cues for cardiac tissue engineering. Journal of Materials Chemistry B. 6 (44), 7185-7196 (2018).
- Gabella, G. Muscle cells, nerves, fibroblasts and vessels in the detrusor of the rat urinary bladder. Journal of Smooth Muscle Research. 55, 34-67 (2019).
- Christov, C., et al. Muscle satellite cells and endothelial cells: close neighbors and privileged partners. Molecular Biology of the Cell. 18 (4), 1397-1409 (2007).
- Bersini, S., et al. Engineering an environment for the study of fibrosis: A 3D human muscle model with endothelium specificity and endomysium. Cell Reports. 25 (13), 3858-3868 (2018).
- Gilbert-Honick, J., et al. Engineering functional and histological regeneration of vascularized skeletal muscle. Biomaterials. 164, 70-79 (2018).
- Maffioletti, S. M., et al. Three-dimensional human iPSC-derived artificial skeletal muscles model muscular dystrophies and enable multilineage tissue engineering. Cell Reports. 23 (3), 899-908 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유