Method Article
Tests précliniques de médicaments dans des tissus musculaires 3D évolutifs
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole fournit des méthodes pour générer des tissus cardiaques et musculaires squelettiques modifiés en 3D et décrit leur utilisation dans les modalités de dépistage préclinique des médicaments. Les méthodes décrites utilisent un système de détection magnétique pour faciliter l’évaluation simultanée de 24 tissus en parallèle.
Résumé
La modélisation précise in vitro des conditions saines et des maladies est essentielle au développement de nouvelles stratégies de traitement et de traitements. Pour les maladies cardiaques et musculaires squelettiques, la force contractile et la cinétique constituent des paramètres clés pour évaluer la fonction musculaire. Des méthodes nouvelles et améliorées de génération de tissus musculaires modifiés (EMT) à partir de cellules souches pluripotentes induites ont rendu la modélisation in vitro des maladies plus fiable pour les tissus contractiles; Cependant, il est difficile de fabriquer de manière reproductible des tissus à partir de cultures cellulaires en suspension et de mesurer leur contractilité. Ces techniques sont souvent en proie à des taux de défaillance élevés et nécessitent une instrumentation complexe et des routines d’analyse de données personnalisées. Une nouvelle plate-forme et un nouvel appareil qui utilise des EMT 3D en conjonction avec un test de contractilité sans étiquette, hautement parallèle et convivial pour l’automatisation contournent bon nombre de ces obstacles. La plate-forme permet la fabrication facile et reproductible d’EMT 3D en utilisant pratiquement n’importe quelle source de cellules. La contractilité tissulaire est ensuite mesurée à l’aide d’un instrument qui mesure simultanément 24 tissus sans avoir besoin de routines d’analyse logicielle complexes. L’instrument peut mesurer de manière fiable les changements de force du micronewton, ce qui permet un criblage de composés dose-dépendants pour mesurer l’effet d’un médicament ou d’un traitement sur la production contractile. Les tissus fabriqués avec cet appareil sont entièrement fonctionnels, générant des contractions tranchées et tétaniques lors de la stimulation électrique, et peuvent être analysés longitudinalement en culture pendant des semaines ou des mois. Ici, nous montrons les données des ambulanciers du muscle cardiaque sous administration aiguë et chronique avec des substances toxiques connues, y compris un médicament (BMS-986094) qui a été retiré des essais cliniques après des décès de patients dus à une cardiotoxicité imprévue. Une altération de la fonction des muscles squelettiques dans les tissus modifiés en réponse à un traitement avec un inhibiteur de la myosine est également présentée. Cette plate-forme permet au chercheur d’intégrer des systèmes de modèles de bioingénierie complexes et riches en informations dans son flux de travail de découverte de médicaments avec un minimum de formation ou de compétences supplémentaires requises.
Introduction
Les modèles de cellules souches pluripotentes induites (CSPi) deviennent de plus en plus des acteurs clés dans le pipeline préclinique pour la découverte et le développement thérapeutiques, ainsi que la recherche biologique fondamentale et la modélisation des maladies 1,2,3,4,5. Les tissus contractiles, tels que les muscles cardiaques et squelettiques dérivés des CSPi, présentent un grand potentiel pour améliorer le pouvoir prédictif des études in vitro humaines, car l’évaluation directe de la force contractile musculaire et de la cinétique sont des paramètres quantitatifs pour étudier la fonction tissulaire globale 4,6,7,8. Typiquement, les mesures de force contractile ont été obtenues soit indirectement par suivi optique de la déviation du substrat 9,10, soit directement par fixation de cellules/tissus à un transducteur de force4,11,12. Ces méthodes, bien que précises, sont intrinsèquement à faible débit et nécessitent généralement des opérateurs hautement qualifiés pour collecter et analyser les données.
Des travaux antérieurs ont montré que la détection de champ magnétique contourne ces obstacles et fournit une méthode alternative pour évaluer simultanément la fonction musculaire modifiée sur plusieurs constructions tissulaires13. La plate-forme de contractilité 3D Mantarray (Magnetometric Analyzer for eNgineered Tissue ARRAY) s’appuie sur cette technologie à l’aide d’un dispositif capable de mesurer la contractilité des tissus musculaires modifiés d’une manière hautement parallèle qui exploite la complexité des modèles cellulaires 3D avec un criblage à débit plusélevé 14. La plateforme permet une surveillance quantitative, en temps réel et sans marquage de la fonction contractile dans les tissus musculaires cardiaques et squelettiques à l’intérieur ou à l’extérieur d’un incubateur de culture cellulaire standard, éliminant ainsi le besoin d’imagerie et d’analyse contractiles optiques. Cette technologie facilite la comparaison directe de lignées cellulaires saines et malades et permet de mesurer l’effet d’un médicament sur les tissus contractiles, en établissant des données quantifiables, in vitro, d’innocuité et d’efficacité pour les composés thérapeutiques nouveaux et existants.
Les tissus musculaires 3D modifiés peuvent être fabriqués entre deux poteaux de manière hautement reproductible à l’aide de la plaque de coulée consommable Mantarray à 24 puits (Figure 1). Un poteau est rigide, tandis que l’autre poteau est flexible et contient un petit aimant. Lorsque la construction du tissu se contracte, elle déplace le poteau flexible et l’aimant intégré. La plaque EMT est positionnée à l’intérieur de l’instrument et le post-déplacement est mesuré via un réseau de capteurs magnétiques sur une carte de circuit imprimé sous le support de plaque. Les changements mesurés dans le champ magnétique sont convertis en force contractile absolue à l’aide d’un algorithme mathématique. L’instrument utilise des taux d’échantillonnage de données rapides pour permettre la collecte d’informations détaillées sur la capacité fonctionnelle et la maturité du ou des types de cellules testés, y compris la fréquence de contraction, la vitesse et le temps de désintégration. Ces mesures fonctionnelles peuvent être obtenues sur les 24 puits simultanément avec la plate-forme de détection magnétique ou individuellement et séquentiellement à l’aide de méthodes optiques traditionnelles.
Cette étude décrit une méthode hautement reproductible pour l’ingénierie des microtissus musculaires et cardiaques squelettiques 3D dans un hydrogel à base de fibrine. Au cours d’une brève réaction de 80 minutes, la thrombine catalyse la conversion du fibrinogène en fibrine, fournissant un échafaudage pour que les cellules musculaires se développent en culture suspendue15. Les cellules stromales aident à remodeler la matrice et les tissus deviennent contractiles lorsque les cellules musculaires forment un syncytium dans l’hydrogel. La contractilité de ces tissus a été analysée à l’aide de l’approche de détection magnétique, avant et après l’exposition au composé, validant cette modalité pour une utilisation dans les études dose-réponse médicamenteuse. Les myoblastes humains primaires provenant d’une biopsie de donneur sain ont été obtenus commercialement et cultivés en 2D selon les protocoles du fournisseur. Les cellules ont été dilatées à l’aide d’un milieu de croissance musculaire squelettique à travers trois passages pour générer un nombre suffisant de cellules pour fabriquer des tissus 3D. Les cellules stromales et les cardiomyocytes dérivés de l’hiPSC ont été cultivés selon le protocole du fournisseur pendant 3 jours pour permettre la récupération de la cryoconservation avant de couler les cellules dans les tissus. Des résultats représentatifs sont fournis illustrant les types d’ensembles de données qui peuvent être collectés à l’aide de la plate-forme de détection magnétique. Les pièges courants associés à la génération de tissus modifiés à l’aide de ces méthodes sont également abordés.
Protocole
1. Protocole de culture cellulaire
- Culture primaire de myoblastes humains
- Diluer la matrice extracellulaire (MEC) dans un rapport de 1:100 dans 8 mL de milieu DMEM/F12 sur glace.
- Appliquer 8 mL de solution ECM sur une fiole T175 et incuber à 37 °C pendant au moins 1 h avant l’ensemencement cellulaire, mais pas plus de 24 h. Assurez-vous que la solution ECM couvre tout le fond du flacon.
- Aliquote 5 mL du milieu de croissance des muscles squelettiques dans un tube conique de 15 mL.
- Décongeler un flacon congelé de cellules (5,0 x 105 myoblastes) au bain-marie à 37 °C pendant 2 minutes ou jusqu’à ce que la glace soit fondue. Vaporiser le flacon avec de l’éthanol à 70 % et le transférer dans une enceinte de biosécurité (ESB).
- Transférer les cellules dans le milieu aliquote à l’aide d’un P1000. Ne triturez pas. Centrifuger les cellules à 300 x g pendant 3 min.
- Aspirer le surnageant et remettre les cellules en suspension dans 1 mL du milieu de croissance à l’aide d’une pipette P1000 pour obtenir une suspension unicellulaire.
- Laver la fiole revêtue d’ECM avec 15 ml de DPBS. Aspirer le DPBS, puis ajouter 30 mL du milieu de croissance dans la fiole.
- Ajouter 4 mL du milieu de croissance aux cellules, mélanger et répartir la suspension cellulaire dans le ballon T-175. Assurez-vous que le volume total est de 35 mL. Faire glisser doucement la fiole le long de la surface de travail vers la gauche et la droite 5 à 6 fois, puis vers l’avant et vers l’arrière 5 à 6 fois pour assurer une répartition uniforme des cellules sur la surface du flacon.
- Placer la fiole T-175 dans un incubateur de culture cellulaire à 37 °C et 5 % de CO2. Cultivez les cellules pendant 3 jours ou jusqu’à ce qu’elles n’atteignent pas plus de 70% de confluence, puis passez les cellules.
- Passage des myoblastes humains primaires
- Diluer l’ECM dans un rapport de 1:100 dans 30 mL de milieu DMEM/F12 sur glace.
- Appliquer 10 mL de la solution ECM sur trois flacons T225 et incuber à 37 °C pendant au moins 1 h avant l’ensemencement cellulaire, mais pas plus de 24 h. Assurez-vous que la solution ECM couvre tout le fond du flacon.
- Lavez les cellules avec 15 ml de DPBS. Aspirer et ajouter le réactif de dissociation selon le protocole du fournisseur.
- Une fois les cellules soulevées, arrêtez la réaction selon le protocole du fournisseur et collectez les cellules dans un tube conique. Centrifuger les cellules à 300 x g pendant 3 min.
- Aspirer le surnageant et remettre les cellules en suspension dans 1 mL du milieu de croissance à l’aide d’une pipette P1000 pour obtenir une suspension unicellulaire.
- Laver la fiole revêtue d’ECM avec 15 mL de DPBS. Aspirer le DPBS, puis ajouter 40 ml du milieu de croissance dans chaque fiole T225.
- Ajouter 14 mL du milieu de croissance à la suspension cellulaire, mélanger et répartir 5 mL de la suspension cellulaire dans chaque fiole T225. S’assurer que le volume total dans chaque fiole est de 45 mL. Faire glisser doucement la fiole le long de la surface de travail vers la gauche et la droite 5 à 6 fois, puis 5 à 6 fois vers l’avant et vers l’arrière pour assurer une répartition uniforme.
- Placer les flacons dans l’incubateur de culture cellulaire à 37 °C et 5 % de CO2.
- Cellules de culture pendant 2-3 jours ou jusqu’à ce qu’elles n’atteignent pas plus de 70% de confluence, puis passage. Diviser les cellules à 1:3 ou 1:4 à chaque passage et semer entre 3 x 103 et 1 x 104 cellules/cm2.
- Culture de cardiomyocytes dérivés de l’hiPSC
- Diluer l’ECM dans un rapport de 1:60 dans 12 mL de milieu DMEM/F12 sur glace.
- Appliquer 1 mL de la solution ECM sur chaque puits de deux plaques à 6 puits et incuber à 37 °C pendant au moins 1 h avant l’ensemencement cellulaire, mais pas plus de 24 h.
- Décongeler un flacon congelé de cardiomyocytes au bain-marie à 37 °C pendant 2 min ou jusqu’à ce que la glace soit fondue.
- Vaporiser le flacon avec de l’éthanol à 70% et le transférer dans l’ESB.
- Utilisez une pipette p1000 pour transférer les cellules décongelées dans un tube conique de 50 mL.
- Rincer le cryovide avec 1 mL de milieu de placage à température ambiante (RT) pour récupérer les cellules restantes.
- Distribuer lentement 1 mL de produit de rinçage goutte à goutte (une goutte toutes les 5 s) dans le tube conique des cellules pendant 90 s. Faites tourner continuellement le tube pour mélanger les cellules pendant l’ajout lent de média.
- Ajouter lentement 8 mL du milieu de placage à l’aide d’une pipette sérologique de 10 mL dans le tube conique de 50 mL des cellules.
- Une fois que tout le média est distribué, pipeter doucement de haut en bas 3 fois pour bien mélanger les cellules. Comptez les cellules à l’aide d’un hémocytomètre et d’un bleu de trypan.
- Centrifuger les cellules dans le tube conique de 50 ml à 300 x g pendant 3 min.
- Une fois que les cellules ont été granulées, aspirer le surnageant.
- Utilisez une pipette p1000 pour transférer 1 mL du fluide de placage dans le tube et briser doucement la pastille en pipetant lentement de haut en bas 3 à 5 fois. Remettez les cellules en suspension avec un support de placage supplémentaire.
- Ensemencer entre 2-4 x 10 6 cellules par puits d’une plaque de6 puits dans 2 mL du milieu de placage.
- Lavez les plaques à 6 puits revêtues d’ECM avec DPBS (2 mL/puits).
- Pipeter 2 mL de suspension cellulaire par puits d’une plaque de 6 puits. Déplacez doucement les plaques le long de la surface de travail vers la gauche et la droite 5-6 fois, suivies d’avant et de recul 5-6 fois pour assurer une répartition uniforme des cellules sur les surfaces de la plaque.
- Placer la plaque dans l’incubateur de culture cellulaire à 37 °C et 5% de CO2.
- Répétez les étapes 1.3.3 à 1.3.16 pour tous les flacons des cellules à décongeler.
- Passer à 3-5 mL (selon la lignée cellulaire et la densité) de milieu d’entretien le lendemain du placage, puis changer le milieu tous les deux jours. Culture de cellules pendant 3-4 jours avant de les couler dans des tissus 3D.
- Culture de cellules stromales
- Appliquer 30 mL de la solution ECM sur une fiole T175 et incuber à 37 °C pendant au moins 1 h avant l’ensemencement cellulaire, mais pas plus de 24 h.
- Aliquote 5 mL du milieu cellulaire stromal dans un tube conique de 15 mL.
- Décongeler un flacon congelé de cellules stromales au bain-marie à 37 °C pendant 2 min ou jusqu’à ce que la glace vienne de fondre.
- Vaporiser le flacon avec de l’éthanol à 70% et le transférer dans l’ESB.
- Utilisez une pipette p1000 pour ajouter lentement 1 mL du milieu cellulaire stromal aux cellules décongelées dans le flacon.
- Transférer la suspension cellulaire du flacon au milieu de décongélation restant dans le tube conique. Utilisez une pipette sérologique de 5 mL pour mélanger les cellules. Pipeter de haut en bas 3 fois.
- Comptez les cellules à l’aide d’un hémocytomètre et du bleu de trypan. Ne faites pas tourner les cellules.
- Laver la fiole T175 revêtue d’ECM avec 15 ml de DPBS.
- Transférer les cellules stromales dans la fiole à une densité de 3-4 x 103 cellules/cm2. Faire glisser doucement la fiole le long de la surface de travail vers la gauche et la droite 5 à 6 fois, puis vers l’avant et vers l’arrière 5 à 6 fois pour assurer une répartition uniforme des cellules sur la surface du flacon.
- Changez de milieu le lendemain avec 45 mL de milieu de cellules stromales chauffé. Culture des cellules pendant 3-4 jours avant de les couler dans des tissus 3D.
2. Préparation du matériel
- Fibrinogène
REMARQUE: Lors de la reconstitution du fibrinogène, veillez à maximiser la surface sur laquelle la poudre de fibrinogène est superposée. Dans ce protocole, la quantité de diluant utilisée a été optimisée en fonction de la taille du contenant utilisé, c’est-à-dire que juste assez de diluant a été utilisé pour couvrir le fond de la boîte. Par exemple, superposez 0,5 g de fibrinogène sur 10 mL de PBS dans une boîte de 100 mm plutôt que dans un tube à centrifuger de 50 mL. Maximiser la surface du diluant réduira le temps nécessaire pour reconstituer le fibrinogène et réduire l’agglutination potentielle des protéines.- Reconstitution
- Transvaser 10 mL de PBS dans une boîte de culture cellulaire de 100 mm et chauffer à 37 °C dans un incubateur de culture cellulaire.
- Déposer 0,5 g de poudre de fibrinogène sur toute la surface du PBS chaud et maintenir à 37 °C jusqu’à dissolution complète du fibrinogène. Cela ne devrait pas prendre plus de 2 h. La poudre dissolvante peut être doucement tourbillonnée, mais ne pas agiter vigoureusement le plat.
- Filtration stérile
- Une fois la poudre complètement dissoute, passez la solution à travers un filtre de 100 μm et recueillez-la dans un tube conique de 50 ml pour éliminer les amas de fibrinogène gélifié.
- Verser la solution filtrée dans une seringue de 10 mL recouverte d’un filtre de 0,2 μm. Poussez la solution à travers le filtre et recueillez-la dans un nouveau tube conique de 50 mL. Il peut être nécessaire de changer le filtre plus d’une fois pour stériliser les 10 ml de solution.
- Aliquote 300 mL de fibrinogène stérile dans des tubes microcentrifugés de 1,5 mL et conserver à -20 °C. Décongeler les aliquotes sur la glace ou à 4 °C au besoin. Évitez les gels/dégels répétés.
- Reconstitution
- Thrombine
- Ajouter 6 mL de PBS et 4 mL de diH2O directement dans un flacon de thrombine (1 KU) pour obtenir une solution mère de thrombine de 100 U/mL.
- Filtrer stériliser avec un filtre de 0,2 μm, aliquote, et conserver à -20 °C dans des tubes microcentrifugeuses en plastique de 1,5 mL pendant que la thrombine s’adsorbe sur le verre. Évitez les gels/dégels répétés.
- Solution de poly(éthylèneimine) (PEI)
ATTENTION : L’Î.-P.-É. est toxique. Utiliser l’EPI approprié tel que désigné par le fabricant.
REMARQUE: PEI est fourni sous forme de solution à 50% p / v. Il est très visqueux et difficile à pipetter. Fabriquez une solution à 0,1 % à partir d’une solution mère à 10 % plutôt que directement à partir de la solution à 50 % p/v.- Mesurer 5 mL de solution de PEI à 50 % p/v dans un tube conique de 50 mL.
- Ajouter 20 mL dediH2Oet mélanger pour obtenir une solution mère à 10%. Cette solution mère hautement concentrée ne peut pas être filtrée stérile.
- Pour obtenir une solution à 0,1 % pour la culture cellulaire, ajouter 5 mL de bouillon à 10 % à 495 mL de diH2O. Filtre stérile à l’aide d’une fiole filtrante de 500 mL et conserver à TA pendant au plus 1 semaine.
- Glutaraldéhyde
ATTENTION : Le glutaraldéhyde est toxique. Utiliser l’EPI approprié tel que désigné par le fabricant.- Le glutaraldéhyde est fourni sous forme de solution à 25%. Pour obtenir une solution à 0,01 %, ajouter 40 μL à 99,6 mL de diH2O. Filtre stérile et conserver à 4 °C pendant 1 semaine au maximum.
- Préparation du poste
- Placez le kit de moulage de tissus consommable à l’intérieur d’une hotte de culture stérile. Le kit de coulée contient un couvercle, un treillis de poteaux contenant 24 paires de poteaux (une paire de poteaux par puits d’une plaque de 24 puits) et un fond de plaque spécialisé de 24 puits contenant 24 puits de coulée. Chaque puits de coulée contient une tranchée au fond du puits pour contenir les composants de la cellule ou de l’hydrogel et les mouler en un tissu en forme de tube au fur et à mesure que l’hydrogel polymérise (figure 1B).
- Remplir les puits d’une plaque de 24 puits avec 1,5 mL/puits d’une solution d’Île-du-Prince-Édouard à 0,1 % et placer les poteaux dans la plaque de manière à ce que les extrémités de chaque paire de poteaux soient immergées. Laissez-le reposer pendant 10 min. PEI déposera une charge positive sur les poteaux afin que les protéines de l’hydrogel se fixent fermement aux poteaux pendant le moulage des tissus.
- Remplir les puits d’une deuxième plaque de 24 puits avec 2 mL/puits de diH2O stérile et transférer les poteaux. Laisser reposer pendant 1 min.
- Dans une troisième plaque de 24 puits, remplir les puits avec 1,5 mL/puits de glutaraldéhyde (GA) à 0,01 % et transférer les poteaux. Laissez-le reposer pendant 30 minutes. GA fixera la charge positive de l’Île-du-Prince-Édouard aux poteaux.
- Pendant que les poteaux sont assis dans du glutaraldéhyde, aspirerles puits diH 2 O, laver avec 2 mL/puits de diH 2 O stérile, aspirer et remplir à nouveau avec 2 mL/puits de diH2O stérile. Une plaque fraîche de 24 puits peut être utilisée au lieu du rinçage.
- Lorsque 30 min sont écoulés, transférer les poteaux dans les 2 mL/puits de diH2O stériles. Laisser reposer pendant 1 min.
- Aspirer le diH 2 O et ajouter 2 mL/puits de diH2Ostérile. Laisser reposer pendant 5 min.
- Transférer les poteaux dans une plaque de 24 puits pour les faire sécher (environ 15 min).
- Une fois sec, remontez le kit de coulée. Parafilmez les bords pour sceller le couvercle et la plaque ensemble, puis stockez à 4 °C jusqu’à 72 heures avant l’ensemencement cellulaire. Des durées de stockage plus longues sont probablement possibles, mais n’ont pas été testées.
3. Protocole de moulage tissulaire
- Préparation de la plaque de coulée
- Pré-refroidir le kit de moulage de tissus à 4 °C.
- Transférer un seau de glace dans l’ESB. Sur la glace, préparer 50 μL de solution de thrombine (3 μL de stock de thrombine + 47 μL de milieu EMT) par puits à couler.
REMARQUE : Voir l’étape 3.2.1 pour plus de détails sur le support EMT. - Retirez le kit de coulée réfrigéré du réfrigérateur et placez-le sur un bloc froid ou de la glace à l’intérieur de la hotte de culture cellulaire. Posez la plaque de coulée à plat sur la glace et déplacez le treillis de poteau de la plaque de coulée vers une nouvelle plaque stérile de 24 puits.
- Pipeter 50 μL de solution de thrombine dans chaque puits prérefroidi de la plaque de coulée.
- Remontez la trousse et remettez-la au réfrigérateur jusqu’à ce qu’elle soit nécessaire pour le moulage des tissus. Jeter les tissus dans les 3 heures de la thrombine en plus des puits.
- Préparation cellulaire
- Préparer le milieu de base EMT, le filtre stérile et laisser sur la glace.
REMARQUE: Si le milieu de coulée spécifique à la cellule contient du FBS, utilisez du FBS inactivé par la chaleur car il peut interagir avec le fibrinogène et provoquer une polymérisation prématurée.- Préparer le milieu EMT cardiaque : Ajouter 500 mL de milieu RPMI, 10 mL de B27 et 2,5 g d’acide aminocaproïque. (Facultatif) Ajouter 10 mM d’inhibiteur de ROCK (ajouter uniquement au milieu EMT utilisé pour mouler les tissus et non le volume total de 500 mL).
- Préparer le milieu EMT squelettique : Ajouter 50 mL de milieu F10 et 0,25 g d’acide aminocaproïque (ACA) pour les EMT primaires et 0,1 g d’ACA pour les EMT dérivés de iPSC.
- Réchauffer le réactif de dissociation de qualité culture cellulaire à 37 °C. Réchauffer un volume égal de milieu EMT pour diluer le réactif de dissociation.
REMARQUE: Il est essentiel que la protéase utilisée soit complètement inactivée. La protéase active interférera avec la formation de tissus 3D et post-observance. - Lavez les cellules (Figure 1A) avec du PBS. Utiliser 2 mL/puits pour une plaque à 6 puits. Utiliser 6 mL, 15 mL et 15 mL pour une capsule de 100 mm, une fiole T175 et une fiole T225, respectivement.
- Ajouter le réactif de dissociation de qualité culture cellulaire chauffée pour soulever les cellules et incuber à 37 °C pendant 5 min ou jusqu’à ce que les cellules se soient soulevées. Pour les cultures cardiaques, utilisez le réactif de dissociation 10x. Pour les cellules stromales et les myoblastes des muscles squelettiques, utilisez un réactif de dissociation 1x. Utiliser 1 mL/puits pour une plaque à 6 puits, 3 mL pour une boîte de 100 mm, 8 mL pour une fiole T175 et 10 mL pour une fiole T225.
- Vérifiez les cultures toutes les 2-3 minutes en tapotant le côté de la plaque.
- Une fois les cellules soulevées, transférez-les dans un tube conique de 50 ml et triturez avec une pipette P1000 pour assurer une suspension unicellulaire.
- Lavez la plaque ou la fiole avec un milieu EMT supplémentaire pour recueillir les cellules restantes et les ajouter au tube conique. Utiliser 1 mL/puits de milieu EMT pour une plaque à 6 puits, 2 mL pour une boîte de 100 mm, 5 mL pour une fiole T175 et 5 mL pour une fiole T225.
- Triturer les cellules pour assurer une suspension unicellulaire.
- Ajouter un milieu EMT pour mettre fin au processus de dissociation, puis prélever des échantillons des suspensions cellulaires pour le nombre de cellules. Utiliser 1 mL/puits pour une plaque à 6 puits, 3 mL pour une boîte de 100 mm, 8 mL pour une fiole T175 et 10 mL pour une fiole T225.
- Faites tourner les cellules à 200 x g pendant 4 min. Effectuer le comptage cellulaire à l’aide d’un hémocytomètre et d’un bleu de trypan pendant que les suspensions sont centrifugées.
- Aspirer le surnageant et remettre les cellules en suspension dans 5 mL de milieu basique EMT pour éliminer le réactif de dissociation résiduel.
- Centrifuger les cellules à 200 x g pendant 4 min. Aspirer le surnageant et préparer les suspensions cellulaires aux densités appropriées.
- Augmenter la longévité et la fonction des EMT musculaires squelettiques 3D avec l’ajout de 10% à 20% de protéines ECM dans le milieu EMT14,16.
- Cardiomyocytes dérivés de cellules souches de graines et leurs cellules stromales à 5 x 10 5 cellules et7,5 x 104 cellules par construction tissulaire, respectivement. Ensemencer les myoblastes du muscle squelettique à 7,5 x 105 cellules par construction tissulaire.
- Tissus cardiaques
- Aspirer le surnageant et remettre en suspension les cellules stromales à une densité de 2,5 x 106 cellules par mL dans un milieu EMT et les mettre sur de la glace. Utilisez 30 μL de cette suspension par EMT.
- Aspirer le surnageant et remettre en suspension les CM à une densité de 8,3 x 106 cellules par mL dans un milieu EMT et les mettre sur de la glace. Utilisez 60 μL de cette suspension par EMT.
- Tissus musculaires squelettiques
- Aspirer le surnageant et remettre en suspension les cellules musculaires squelettiques à une densité de 8,3 x 106 cellules par mL dans un milieu EMT et les mettre sur de la glace. Utilisez 90 μL de cette suspension par EMT.
- Calculer les volumes de chaque solution cellulaire nécessaire pour constituer le nombre désiré de tissus (p. ex., 60 μL des CM préparées et 30 μL des cellules stromales préparées ou 90 μL des cellules musculaires squelettiques par EMT).
- Pipeter les volumes calculés de cellules dans un tube conique de 15 mL.
- Ajoutez 10 μL de fibrinogène par EMT à la suspension cellulaire et maintenez-la sur la glace.
- Réactifs totaux et volumes cellulaires par EMT : Assurez-vous que chaque EMT contient 90 μL de cellules, 10 μL de fibrinogène et 50 μL de solution de thrombine.
- Préparer le milieu de base EMT, le filtre stérile et laisser sur la glace.
- Moulage de tissus
- Transférer le kit de coulée tissulaire dans un capot de culture cellulaire et retirer le couvercle (le poteau contenant des poteaux flexibles et rigides doit rester sur la plaque de coulée; Figure 1B). Gardez la plaque de coulée avec le treillis de poteau posé à plat sur la glace.
- Mélanger le mélange cellule/fibrinogène et aspirer 100 μL avec une pipette P200.
- Ajouter 100 μL du mélange dans des puits préparés avec 50 μL de solution de thrombine et triturer 5 fois pour bien mélanger. Ne poussez pas la pipette au-delà de la première butée et retirez l’embout après la trituration pour éviter de créer des bulles.
- À ce stade, et jusqu’à ce que le réseau de poteaux soit prêt à être soulevé de la plaque de coulée (étape 3.3.10), tout mouvement du réseau peut compromettre la fixation à long terme du tissu aux poteaux. Tenez simultanément le treillis et la plaque de coulée à l’aide du doigt et du pouce d’une main pour éviter tout mouvement du réseau.
- Répétez avec un nouvel embout P200 pour chaque tissu jusqu’à ce que tous les tissus soient moulés. Mélanger la suspension cellulaire dans un tube conique de 15 ml avant de couler chaque tissu pendant que les cellules se déposent rapidement.
- Transférez soigneusement le kit ensemencé dans l’incubateur, en veillant à ne pas déplacer le treillis. Le mouvement du réseau après l’ensemencement peut entraîner une diminution du succès du transfert des tissus hors des puits de coulée. Incuber à 37 °C pendant 80 min, quel que soit le type de cellule. Cela commencera la polymérisation de l’hydrogel et permettra aux protéines de se fixer aux poteaux.
- Pendant ce temps, préparez une nouvelle plaque de 24 puits avec 2 mL/puits du milieu EMT pour les tissus cardiaques. Un inhibiteur de ROCK de 10 mM peut être ajouté au milieu EMT si désiré. Incuber la plaque à 37 °C pour réchauffer le milieu.
- Préparer 2 mL/puits de milieu de croissance contenant 5 g/L d’acide aminocaproïque (0,2 mm filtré stérile) pour les tissus musculaires squelettiques primaires ou 2 g/L d’ACA pour les EMT dérivés des CSPi. Incuber la plaque à 37 °C pour réchauffer le milieu.
- Après l’incubation, ajouter doucement 1 mL du milieu EMT au bord des puits de coulée et incuber pendant encore 10 minutes à 37 °C, quel que soit le type de cellule. Cela délogera l’hydrogel des bords du puits de coulée et permettra un transfert facile du tissu.
- Après 10 min, soulever délicatement le post-treillis et transférer les tissus de la plaque de coulée vers une plaque préparée à 24 puits avec milieu (figure 1C). Remettre les plaques avec les mouchoirs dans l’incubateur de culture cellulaire à 37 °C.
- Entretien
- Après 24 h, transférer les tissus coulés dans une nouvelle plaque de 24 puits avec 2 mL/puits de milieu EMT (sans l’inhibiteur ROCK s’il a été inclus) et incuber à 37 °C. Pour les cellules musculaires squelettiques, basculez le milieu de croissance vers le milieu de différenciation pour favoriser la fusion des myoblastes.
- Transférer les tissus cardiaques dans des puits frais avec 2 mL/puits du milieu EMT tous les 2-3 jours.
- Transférer les tissus musculaires squelettiques dans des puits frais avec 2 mL/milieu de différenciation du puits contenant 5 g/L d’acide aminocaproïque (0,2 mm filtré stérile) tous les 2-3 jours. Utilisez 2 g/L d’ACA pour les tissus dérivés des CSPi.
- Pour faciliter les changements de milieu, transférez le réseau de poteaux sur une nouvelle plaque de 24 puits plutôt que de changer le milieu dans la même plaque pour éviter d’endommager les tissus 3D. Préparer une deuxième assiette de 24 puits avec le milieu EMT et transférer les tissus dans le milieu frais. Conservez l’assiette avec l’ancien milieu à côté de la culture active à utiliser pour le prochain changement de milieu. Transférez le treillis de poteaux entre les deux plaques tout au long de la période de culture. Vous pouvez également utiliser une assiette fraîche pour chaque changement de milieu.
- Mesurer la contraction EMT soit par suivi optique de la post-déviation (Figure 1D), soit par matériel de détection magnétique13,14. Les tissus cardiaques commencent à battre spontanément après 3-4 jours en culture. Les tissus musculaires squelettiques sont généralement contractiles avec la stimulation du champ électrique après 7 jours en culture.
Résultats
Les cellules ont été coulées dans des tissus musculaires modifiés dans la plaque consommable à 2 poteaux (Figure 1). Les équipes d’urgence qui réussissent sembleront uniformes et la matrice sera répartie uniformément entre les postes (figure 2A). La matrice doit également s’enrouler autour des deux poteaux, produisant des points d’ancrage équivalents pour le tissu. Les défaillances dans la coulée sont rares avec cette méthode et sont généralement évidentes avec une inspection visuelle. L’échec de la production de TME peut aller de défaillances catastrophiques, telles que le détachement des tissus des poteaux (figure 2B) à des défauts structurels plus subtils, tels que des bulles d’air et une fixation lâche aux poteaux (figure 2C, D). Les tissus présentant des défauts mineurs peuvent encore être viables, mais les données de ces tissus doivent être examinées attentivement pour s’assurer qu’elles sont comparables aux EMT non compromis. Par exemple, les bulles d’air dans un EMT peuvent être expulsées à mesure que le tissu se compacte au fil du temps, rendant une construction entièrement fonctionnelle sans déficiences contractiles. Ces tissus doivent toutefois être évalués au cas par cas, car l’emplacement des bulles d’air peut affecter la récupération fonctionnelle. Les bulles d’air générées aux poteaux, par exemple, peuvent affecter la fixation des tissus, ce qui pourrait entraver l’adhérence à long terme au poteau.
Les tissus commencent à se compacter dans les premières 24 heures lorsque les cellules remodèlent la matrice dans l’hydrogel (Figure 3). Le compactage est un processus graduel et se déroule généralement au cours des 2 à 4 premières semaines de culture. Dans l’ensemble, le compactage tissulaire est cohérent entre les réplications techniques et biologiques (figure 4). Il est normal que certaines lignées cellulaires compactent la matrice plus que d’autres à mesure que les tissus mûrissent avec le temps. Le pourcentage de cellules myogéniques dans une construction influence le taux et le degré global de compactage EMT. Le contenu myogénique total des lignées cellulaires cardiaques et squelettiques doit être supérieur à 80% afin de minimiser la variation entre les tissus modifiés. Ceci est particulièrement important lors de la comparaison des forces contractiles et de la cinétique entre les lignées cellulaires.
Dans les premiers jours après le moulage, les cardiomyocytes commencent à battre spontanément en culture, pliant rythmiquement le poteau flexible à chaque contraction musculaire. Les constructions musculaires squelettiques se contractent en réponse à la stimulation électrique au jour 7 après le début de la différenciation. La stimulation de champ a été appliquée aux tissus musculaires squelettiques via un stimulateur externe attaché à un couvercle d’électrode personnalisé de 24 puits. Le couvercle, fabriqué avec une paire d’électrodes de carbone pour chaque puits, se trouve au-dessus de la plaque de tissus de 24 puits, stimulant simultanément chaque EMT pour induire des contractions musculaires. Les tissus ont été rythmés à l’aide d’un stimulus de 10 V pendant des durées d’impulsion de 10 ms à 1 Hz pendant les mesures fonctionnelles. Les tissus contractiles indiquent des myoblastes squelettiques qui ont fusionné, formant des myotubes complets avec des sarcomères fonctionnels et des machines contractiles. La coloration des ambulanciers squelettiques est positive pour la chaîne lourde de myosine (MyHC) et la dystrophine est localisée à la membrane du myotube, révélant une forme d’anneau classique dans l’analyse immunohistochimique transversale (Figure 5). Une fois que les EMT sont fonctionnels, la contractilité peut être mesurée quotidiennement dans l’instrument de détection magnétique, la force de suivi et la cinétique à mesure que les constructions se développent et mûrissent au fil du temps. Les tissus musculaires cardiaques et squelettiques restent contractiles pendant des semaines ou des mois en culture 3D (Figure 6), et ils peuvent être utilisés pour un large éventail d’études de contractilité.
L’approche de détection magnétique peut être utilisée pour mesurer simultanément les effets aigus et chroniques des cardiotoxiques structurels, tels que la doxorubicine (Figure 7) et le BMS-986094 (Figure 8), ainsi que d’autres médicaments qui affectent la contractilité musculaire. Des méthodes de suivi optique de détection de contraction peuvent également être utilisées, mais il faut faire preuve de prudence lors de l’étude des effets aigus des médicaments, car les mesures doivent être prises séquentiellement. La longévité prolongée des ambulanciers cardiaques et squelettiques en culture 3D permet des études médicamenteuses à long terme dans ces tissus. Cela permet aux utilisateurs d’explorer les effets de doses répétées, ainsi que l’exposition continue et à long terme à des composés qui peuvent présenter des effets cardiotoxiques au fil du temps, comme cela se produit avec la doxorubicine. La doxorubicine (dox) est un agent chimiothérapeutiqueanticancéreux 17. La quantité de médicament administrée aux patients varie en fonction du type de cancer, de l’âge du patient, de la taille et du poids du patient, ainsi que d’autres facteurs. Pour cette raison, il est important de tester l’effet du dox sur une large gamme de concentrations et de calendriers de livraison. Ici, les ambulanciers cardiaques ont été traités pendant 27 jours avec trois concentrations distinctes (0,1 μM, 1 μM et 10 μM) de dox (Figure 7). Les groupes ont été stratifiés davantage en traitant les EMT à chaque concentration avec un traitement en bolus ou une administration continue avec un changement moyen toutes les 72 heures. Les puits recevant des traitements en bolus de dox ont été exposés au médicament à trois moments différents, ce qui a permis une récupération entre les doses. Les deux doses les plus élevées de bolus et d’exposition continue ont montré un arrêt immédiat et prolongé de la génération de force contractile tout au long de l’étude. Les concentrations moyennes et les plus faibles ont eu des effets variables sur les tissus, selon la méthode d’administration. Dans la concentration la plus faible du médicament, le groupe bolus n’a montré aucune différence par rapport aux témoins. Cependant, la force contractile a diminué après 2 semaines d’exposition continue. La concentration moyenne du médicament a eu un effet intéressant. Alors que le dosage continu a réduit la force au cours des deux premiers jours de traitement et a duré tout au long de l’expérience, le groupe bolus a montré une récupération de la force contractile aux niveaux de contrôle lorsque le médicament a été lavé après 3 jours. Cependant, le deuxième bolus du médicament a provoqué un arrêt complet de la force, suivi de l’absence de récupération (Figure 7), ce qui indique qu’une administration répétée à cette concentration peut avoir un effet cardiotoxique chez les patients traités avec ce médicament. La vaste portée de cette étude, à la fois dans le temps et dans les conditions expérimentales, met en évidence l’utilité des tissus modifiés en 3D dans le dépistage de la toxicité, car ils restent contractiles et sensibles à l’exposition chimique sur de longues périodes, ce qui permet des études médicamenteuses à long terme dans un seul ensemble de tissus musculaires. Cela facilite non seulement l’identification des composés qui peuvent avoir un effet cardiotoxique avec une exposition chronique, mais aussi la détection du moment potentiel de l’administration cardiotoxique.
Les tests de toxicité in vitro dans les tissus musculaires humains modifiés sont un moyen d’aider à assurer la sécurité des patients humains dans les essais cliniques. BMS-986094 est un inhibiteur nucléotidique de la polymérase (NS5B) utilisé pour traiter l’hépatite C. Le médicament était en phase II de développement clinique lorsque Bristol-Myers Squibb a interrompu le développement en raison de plusieurs cas d’insuffisance cardiaque inattendue chez les patients18,19. Ici, BMS-986094 a été appliqué aux ambulanciers cardiaques pour tester si les tissus musculaires modifiés en 3D développeraient une réaction cardiotoxique au médicament (Figure 8). Trois concentrations différentes du médicament ont été appliquées et les tissus ont été surveillés pendant 13 jours. La force contractile a diminué avec l’ajout du médicament d’une manière dose-dépendante (Figure 8A). La fréquence des contractions a également été significativement affectée car le taux de battement a ralenti et s’est finalement arrêté comme prévu avec une exposition continue au composé cardiotoxique (p < 0,05, Figure 8B). Ces résultats démontrent comment les tissus musculaires humains conçus en 3D peuvent être utilisés pour faciliter la mise sur le marché de nouveaux médicaments et signaler les composés qui finissent par échouer en raison de la cardiotoxicité. De plus, cette technologie pourrait potentiellement sauver des vies en exposant des médicaments dangereux avant qu’ils ne soient mis à la disposition des patients dans le cadre d’essais cliniques.
La capacité de mesurer l’effet des médicaments aigus et appliqués de façon chronique sur le tissu contractile humain est une première étape essentielle lors de la recherche de produits thérapeutiques pour l’innocuité et l’efficacité. Il est important de savoir, cependant, que la concentration des médicaments appliqués est physiologiquement pertinente et appropriée pour les tests in vitro . Les tissus musculaires squelettiques ont été utilisés pour établir une CI50 pour le monoxime de 2,3-butanedione (BDM) dans une courbe dose-réponse complète. Ce médicament est un inhibiteur de l’ATPase bien caractérisé de la myosine-II20 du muscle squelettique. Le BDM inhibe les contractions musculaires en empêchant la formation de ponts croisés de myosine avec le filament d’actine dans les sarcomères21. Les résultats présentés ici révèlent une diminution dose-dépendante de la force absolue lorsque le médicament est appliqué et une récupération complète de la force contractile lorsque le médicament est lavé, ce qui indique que l’effet transitoire empêche les contractions musculaires et ne tue pas simplement les cellules dans le tissu (Figure 9A). De plus, une courbe dose-réponse complète a été mesurée pour les sept concentrations examinées, établissant une CI50 de 3,2 mM dans ces microtissus humains (figure 9B).

Figure 1 : Coulée EMT dans la plaque consommable à 2 poteaux Mantarray à 24 puits. (A) Les cellules myogéniques et stromales ont été cultivées sur des surfaces 2D avant la coulée des tissus. (B) Les cellules sont extraites des surfaces 2D et mélangées avec des protéines de la matrice extracellulaire pour former des hydrogels dans les puits individuels de coulée de plaques montrés dans l’encart de coulée. (C) Plaque de 24 puits contenant des tissus manufacturés dans chaque puits. (D) Tissus représentatifs montrant un muscle artificiel détendu et contracté, comparant le déplacement du poteau magnétique (barres vertes). Veuillez cliquer ici pour voir une version agrandie de cette figure.
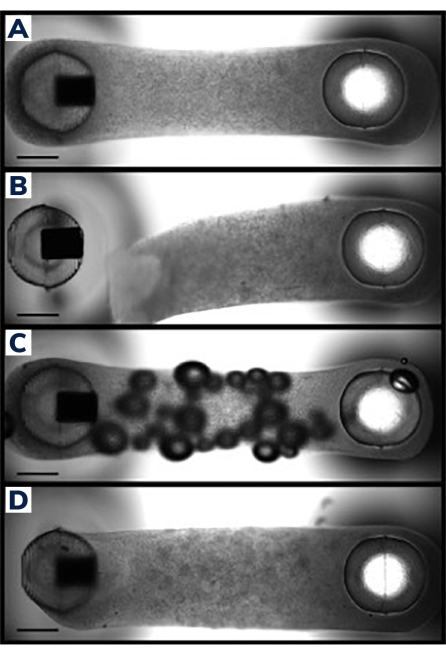
Figure 2 : Coulée EMT réussie et infructueuse. (A) Tissu musculaire artificiel idéal 24 heures après la coulée uniformément compacté autour des poteaux avec une composition cellulaire / matricielle homogène dans tout le tissu. (B) Échec de l’EMT montrant le détachement de l’hydrogel du poteau flexible. (C) EMT contenant des bulles d’air dans tout le tissu. D) Dépôt tissulaire inégal autour des deux poteaux. Le tissu est faiblement ancré au poteau flexible d’un côté. Les barres d’échelle sont de 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
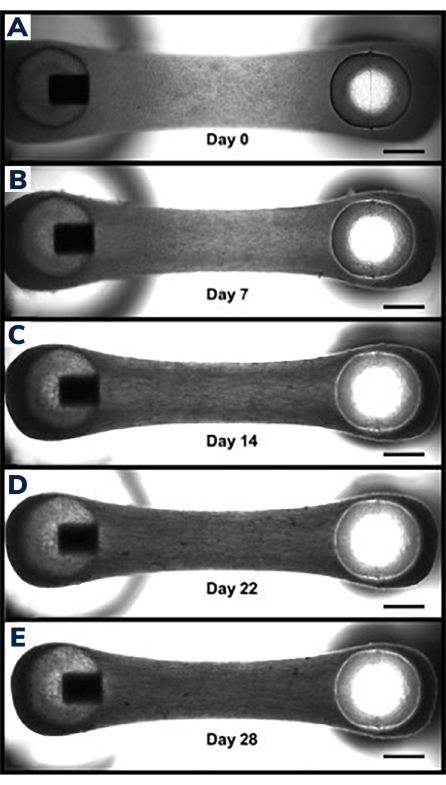
Figure 3 : Compactage dans le tissu musculaire modifié au fil du temps. (A) Construction EMT montrée 1 jour après la coulée. Les tissus sont transférés dans un milieu de différenciation, à partir du jour 0 de la fusion cellulaire et du compactage de l’hydrogel. (B-E) Le même EMT du jour 7 au jour 21 montrant une longueur totale légèrement plus courte entre les deux poteaux au fil du temps et une largeur plus petite lorsqu’elle est mesurée à travers la section centrale de l’EMT. Les barres d’échelle sont de 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
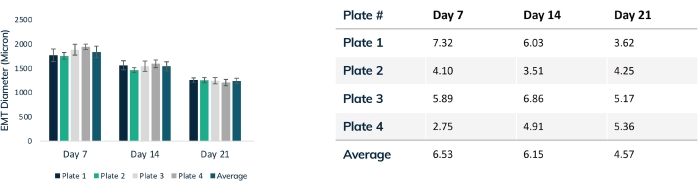
Figure 4 : Diamètre de l’EMT dans le temps. Quatre plaques de tissus ont été suivies pendant 21 jours, comparant le diamètre EMT tout au long du compactage. Chaque tissu a été mesuré à travers la section médiane chaque semaine à l’aide de la microscopie optique. Les points temporels montrent une taille EMT cohérente entre les plaques. Le compactage maximal est atteint au jour 21 lorsque le remodelage de la matrice est stabilisé. Le tableau montre l’écart type (% du total) du compactage à l’intérieur de chaque plaque de tissus et l’écart moyen pour toutes les plaques. Les barres colorées sont des plaques individuelles. Les barres d’erreur sont SD des EMT dans les plaques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
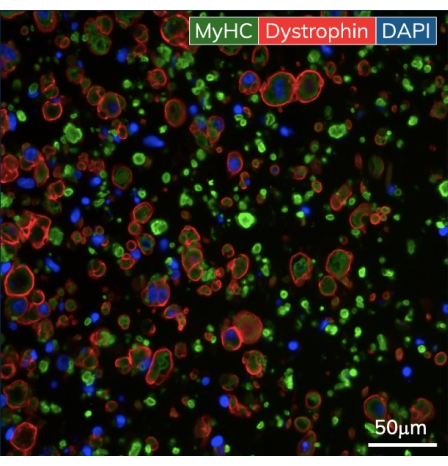
Figure 5 : Immunohistochimie des tissus musculaires squelettiques modifiés. Les EMT ont été fixés au jour 10 de culture et incorporés dans de la paraffine. Des coupes transversales minces (7 μm) ont été colorées avec des anticorps contre la chaîne lourde de myosine et la dystrophine avant l’imagerie. Vert = MyHC, rouge = Dystrophine, bleu = DAPI. Le grossissement de l’objectif est de 40X; La barre d’échelle est de 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
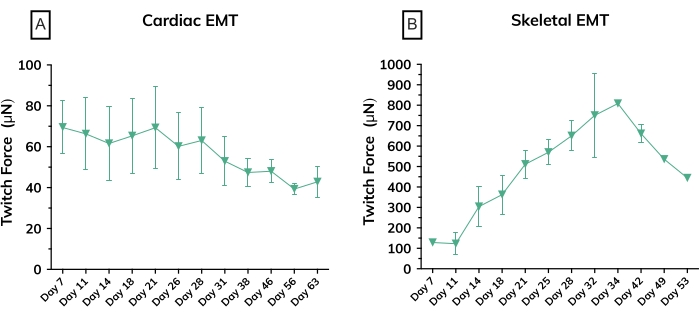
Figure 6 : Force contractile dans les tissus musculaires modifiés au fil du temps. (A) Force de contraction absolue moyenne mesurée à partir des ambulanciers cardiaques du jour 7 au jour 63 en culture; n = 3 par groupe. (B) Force de contraction absolue moyenne dans les équipes médicales d’urgence squelettiques dérivées d’une lignée cellulaire primaire du jour 7 au jour 53 en culture; n = 3. Les barres d’erreur sont SD pour les deux graphiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
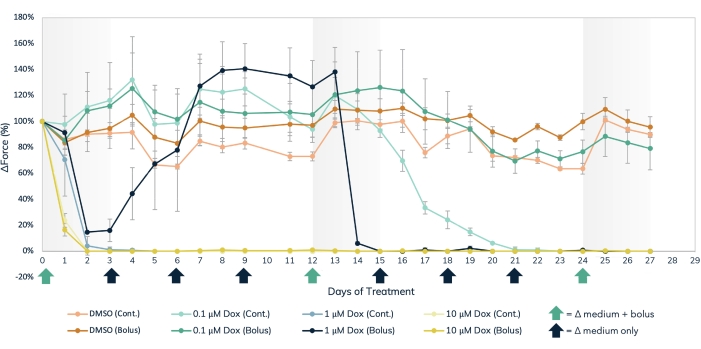
Figure 7 : Traitement aigu et chronique à la doxorubicine dans le tissu musculaire modifié. Trois doses distinctes de dox, 0,1 μM, 1 μM et 10 μM, ont été administrées en bolus ou administrées en continu aux tissus musculaires modifiés pendant 27 jours. Des doses en bolus du médicament ont été ajoutées lors des changements de milieux les jours 0, 12 et 24, notés par les flèches vertes sur l’axe des abscisses. Le médicament a été ajouté au milieu à chaque changement de média pour un dosage continu, noté par les flèches noires et vertes sur l’axe X. Le pourcentage de variation de la force par rapport aux valeurs de base (traitement prémédicamenteux) est sur l’axe des Y, et le temps en jours de traitement est sur l’axe des X. Orange clair = contrôle continu DMSO, orange foncé = bolus de DMSO, vert clair = 0,1 μM dox continu, vert foncé = 0,1 μM bolus dox, bleu clair = 1 μM dox continu, bleu foncé = 1 μM bolus dox, jaune clair = 10 μM dox continu, jaune foncé = 10 μM dox bolus. Les barres d’erreur sont SD ; n = 3 par condition. Veuillez cliquer ici pour voir une version agrandie de cette figure.
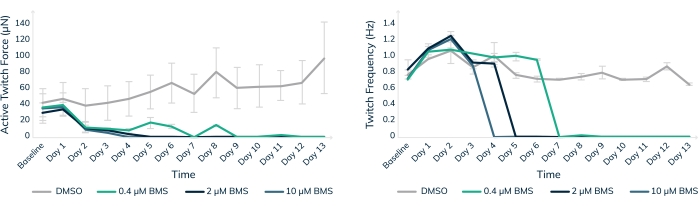
Figure 8 : Traitement chronique par BMS-986094 dans le tissu musculaire modifié. Les ambulanciers ont été traités avec 0,4 μM (vert), 2 μM (bleu foncé) et 10 μM (bleu clair) BMS-986094 sur 13 jours. (A) La force de contraction contractile (axe Y) diminue à toutes les concentrations de médicament au cours des 2 premiers jours, tandis que les tissus témoins dans le DMSO continuent de se renforcer avec le temps (axe X). (B) La fréquence de battement cardiaque, ou fréquence de contraction, cesse d’une manière dose-dépendante en tandem avec un arrêt de la force contractile illustré dans le graphique A. Les tissus témoins en DMSO (gris) maintiennent un rythme de battement régulier tout au long de l’expérience. Les barres d’erreur sont SD ; n = 3 par condition. Veuillez cliquer ici pour voir une version agrandie de cette figure.
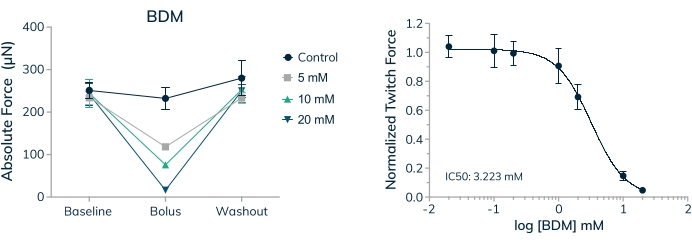
Figure 9 : Dose-réponse à la BDM dans les tissus musculaires squelettiques modifiés. (A) La force de contraction absolue diminue d’une manière dose-dépendante lorsque les EMT dérivés de cellules primaires sont exposés au monoxime de 2,3-butanedione (BDM) le jour 16 en culture 3D. La force de contraction absolue revient à des valeurs proches de la base lorsque le médicament est éliminé. (B) La force de contraction absolue normalisée aux valeurs de référence diminue d’une manière dose-dépendante lorsqu’elle est exposée au BDM, ce qui donne une courbe dose-réponse complète et une valeur IC50; n = 4 par dose. Les barres d’erreur sont SD. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude décrit des méthodes pour générer des tissus cardiaques et musculaires squelettiques modifiés en 3D dans un kit de coulée consommable de 24 puits. En suivant ces méthodes, il est possible d’obtenir systématiquement un ensemble complet de 24 tissus sans échec de coulée pour le dépistage ultérieur des médicaments. Les considérations essentielles pour obtenir un tel résultat sont de s’assurer que pendant la coulée toutes les étapes sont effectuées sur de la glace pour éviter la polymérisation prématurée des hydrogels, l’élimination du réactif de dissociation cellulaire avant la coulée des tissus, le mélange complet de la cellule et de la suspension d’hydrogel pour chaque tissu, le remplacement des pointes de pipette entre les tissus et l’utilisation de FBS inactivé par la chaleur (le cas échéant). En outre, il est important de s’assurer que le réseau de poteaux n’est pas déplacé une fois que la coulée commence et est transféré doucement une fois que les hydrogels se sont formés.
Les modifications majeures comprennent l’utilisation de différents types de cellules pour obtenir des EMT cardiaques par rapport aux cellules d’urgence squelettiques et le dopage d’hydrogels à concentrations variables de protéines de la membrane basale pour favoriser la maturation cellulaire et la stabilité des tissus. Les effets bénéfiques d’un tel dopage doivent être testés au cas par cas, mais il a été démontré qu’ils améliorent les résultats fonctionnels et la longévité des tissus dans certaines circonstances14,16,22. Il convient également de noter que les densités cellulaires énumérées sont un guide et peuvent avoir besoin d’être optimisées pour différentes lignées cellulaires. D’autres compositions d’hydrogel pourraient également être considérées comme un moyen de modifier les propriétés structurelles et fonctionnelles des EMT 23,24,25 obtenues. Le microenvironnement musculaire natif contient également des types de cellules de soutien pour favoriser la vascularisation, l’innervation et le dépôt de matrice pour soutenir les myocytes dans la forme et la fonction26,27. Alors que le système décrit ici incorpore actuellement des fibroblastes dans les tissus cardiaques 3D, d’autres types de cellules peuvent créer un modèle plus pertinent sur le plan physiologique pour étudier l’innocuité et l’efficacité des composés thérapeutiques in vitro. Auparavant, une gamme de types de cellules de soutien ont été intégrées avec succès dans des tissus conçus en 3D, ce qui présente un modèle passionnant pour une étude future utilisant la plate-forme de contractilité de détection magnétique28,29,30.
Le dépannage de ce protocole est centré sur la formation de tissus peu fiables ou incohérents pendant le processus de coulée. Il faut prendre soin d’éviter la formation de bulles dans les hydrogels lorsqu’ils sont coulés tout en facilitant une distribution uniforme des cellules pendant le mélange. Des expériences d’optimisation seront probablement nécessaires pour chaque nouveau type de cellule afin d’identifier les densités cellulaires idéales, les rapports cellulaires et la composition matricielle.
Une limitation majeure de cette technique est le nombre important de cellules nécessaires pour établir une plaque complète de 24 EMT. Pour les données présentées ici, 15 millions de cardiomyocytes et 18 millions de myoblastes squelettiques ont été utilisés par plaque. Certains chercheurs peuvent ne pas avoir accès à de tels bassins de matériel cellulaire, ce qui peut nuire à leur capacité d’utiliser pleinement cette plateforme. Si les utilisateurs finaux n’ont pas accès à du matériel de détection magnétique, les mesures des post-déflexions doivent être effectuées optiquement, ce qui réduit considérablement le débit et empêche l’enregistrement simultané des contractions musculaires sur plusieurs puits. Cependant, le matériel Mantarray surmonte ces limitations pour offrir le premier système commercial capable d’analyser en continu et non invasif la contraction EMT simultanément sur plusieurs constructions.
La détection magnétique à travers 24 puits facilite les études longitudinales du développement fonctionnel de l’EMT en temps réel et permet une mesure précise des réponses aiguës à des manipulations chimiques, environnementales ou génétiques. Bien que la détection magnétique présente plusieurs avantages, tels que la mesure simultanée sur plusieurs tissus, et ne nécessite pas d’analyse de données compliquée, les méthodes de détection optique permettent de mesurer simultanément des mesures physiologiques telles que le flux de calcium ou la cartographie de tension. Cependant, des ensembles de données tels que ceux illustrés dans la section des résultats démontrent l’étendue des applications de cette technologie dans le domaine du développement de médicaments. Étant donné que peu de tests sur le marché offrent les moyens d’effectuer une évaluation directe du débit contractile dans le muscle modifié, ces méthodes ont le potentiel de révolutionner le pipeline de développement préclinique.
Déclarations de divulgation
Tous les auteurs sont des employés et des actionnaires de Curi Bio Inc., la société qui commercialise le matériel Mantarray et les logiciels associés.
Remerciements
Ce travail a été partiellement financé par la Food and Drug Administration (U01 FD006676-01 attribué à l’Institut des sciences de la santé et de l’environnement) et par le financement des National Institutes of Health (HL151094 au Dr Geisse). Nous remercions le Dr Alec S. T. Smith pour son aide dans la préparation de ce manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | CELLTREAT | 229485 | |
| 100 mm cell culture dish | ThermoFisher | 150466 | |
| 50 mL Steriflip filter | MilliporeSigma | SCGP00525 | |
| 500 mL filter flask | MilliporeSigma | S2GVU05RE | |
| 6-aminocaproic acid | Sigma | A2504 | |
| B27 | Gibco | 17504044 | |
| Cardiosight Maintenance Medium | NEXEL | CM-002A | |
| Cardiosight Plating Medium | NEXEL | CM-020A | |
| C-Pace EM stimulator | IonOptix | EM | |
| Curi Bio Muscle Differentiation Media Kit | Primary - DIFF | ||
| Curi Bio Muscle Maintenance Media Kit | Curi Bio | Primary - MAINT | |
| DAPI | Invitrogen | D1306 | |
| DMEM, high glucose, GlutaMAX | Gibco | 10566-016 | |
| Dnase | Sigma | 11284932001 | |
| DPBS | Gibco | 14190-250 | |
| Dystrophin antibody | Abcam | ab154168 | |
| Fetal bovine serum (FBS) | Thermo Scientific | 10082147 | Must be heat-inactivated |
| Fibrinogen (Bovine) | Sigma | E8630 | |
| Glutaraldehyde | Sigma | 354400 | |
| Ham's F10 | Gibco | 11550043 | |
| Hemacytometer | Sigma | Z359629 | |
| HS-27A Fibroblasts | ATCC | CRL-2496 | |
| Human Skeletal Muscle Myoblasts | Lonza | CC-2580 | |
| Luer Lock 0.2 µm syringe filter | Corning | 431219 | |
| Luer Lock 10 mL syringe | BH Supplies | BH10LL | |
| Mantarray Instrument | Curi Bio | MANTA-24-B1 | System |
| Mantarray Plate Kits | Curi Bio | MA-24-SKM-5 | Pack of 5 kits |
| Mantarray stimulation lid | Curi Bio | EM | |
| Matrigel (ECM) | Corning | 356231 | |
| Nexel Cardiosight-S, Cardiomyocytes | NEXEL | C-002 | |
| Optical Microscope | Nikon Ti2E | MEA54000 | |
| Pan Myosin Heavy Chain antibody | DSHB | MF-20 | |
| Poly(ethyleneimine) | Sigma | P3143 | |
| ROCK inhibitor | StemCell Technologies | Y-27632 | |
| RPMI | Gibco | 11875-093 | |
| Skeletal Muscle Growth Medium (SkGM-2) | Lonza | CC-3245 | |
| Standard 24-well plates | Greiner | M8812 | Other manufacturer's plates will not fit |
| Standard 6-well plates | ThermoFisher | 140675 | |
| Stromal medium (DMEM + 20% FBS) | |||
| T175 Filter Flask | ThermoFisher | 159910 | |
| T225 Filter Flask | ThermoFisher | 159934 | |
| Thrombin | Sigma | T4648 | |
| Trypan Blue solution, 0.4% | ThermoFisher | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Scientific | A1217702 | |
| TrypLE Select Enzyme (1x) | Thermo Scientific | 12563011 |
Références
- Sharma, A., Wu, J. C., Wu, S. M. Induced pluripotent stem cell-derived cardiomyocytes for cardiovascular disease modeling and drug screening. Stem Cell Research & Therapy. 4, 150 (2013).
- Mudera, V., Smith, A. S. T., Brady, M. A., Lewis, M. P. The effect of cell density on the maturation and contractile ability of muscle derived cells in a 3D tissue-engineered skeletal muscle model and determination of the cellular and mechanical stimuli required for the synthesis of a postural phenotype. Journal of Cellular Physiology. 225 (3), 646-653 (2010).
- Vandenburgh, H., et al. Tissue-engineered skeletal muscle organoids for reversible gene therapy. Human Gene Therapy. 7 (17), 2195-2200 (1996).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nature Communications. 9 (1), 126 (2018).
- Fleming, J. W., et al. Bioengineered human skeletal muscle capable of functional regeneration. BMC Biology. 18 (1), 145 (2020).
- Madden, L., Juhas, M., Kraus, W. E., Truskey, G. A., Bursac, N. Bioengineered human myobundles mimic clinical responses of skeletal muscle to drugs. eLife. 4, 04885 (2015).
- Urciuolo, A., et al. Engineering a 3D in vitro model of human skeletal muscle at the single fiber scale. PLOS One. 15 (5), 0232081 (2020).
- Afshar, M. E., et al. A 96-well culture platform enables longitudinal analyses of engineered human skeletal muscle microtissue strength. Scientific Reports. 10, 6918 (2020).
- Sakar, M. S., et al. Formation and optogenetic control of engineered 3D skeletal muscle bioactuators. Lab on a Chip. 12 (23), 4976-4985 (2012).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Khodabukus, A., Baar, K. Defined electrical stimulation emphasizing excitability for the development and testing of engineered skeletal muscle. Tissue Engineering Part C: Methods. 18 (5), 349-357 (2011).
- Vandenburgh, H., et al. Drug-screening platform based on the contractility of tissue-engineered muscle. Muscle & Nerve. 37 (4), 438-447 (2008).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Enineering Part C Methods. 22 (10), 932-940 (2016).
- Smith, A. S. T., et al. High-throughput, real-time monitoring of engineered skeletal muscle function using magnetic sensing. bioRxiv. , 492879 (2022).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Hinds, S., Bian, W., Dennis, R. G., Bursac, N. The role of extracellular matrix composition in structure and function of bioengineered skeletal muscle. Biomaterials. 32 (14), 3575-3583 (2011).
- Carvalho, C., et al. Doxorubicin: the good, the bad and the ugly effect. Current Medicinal Chemistry. 16 (25), 3267-3285 (2009).
- Ahmad, T., et al. Cardiac dysfunction associated with a nucleotide polymerase inhibitor for treatment of hepatitis C. Hepatology. 62 (2), 409-416 (2015).
- Gill, M., et al. From the cover: Investigative nonclinical cardiovascular safety and toxicology studies with BMS-986094, an NS5b RNA-dependent RNA polymerase inhibitor. Toxicological Sciences. 155 (2), 348-362 (2017).
- Ostap, E. M. 2,3-Butanedione monoxime (BDM) as a myosin inhibitor. Journal of Muscle Research and Cell Motility. 23 (4), 305-308 (2002).
- Fryer, M. W., Gage, P. W., Neering, I. R., Dulhunty, A. F., Lamb, G. D. Paralysis of skeletal muscle by butanedione monoxime, a chemical phosphatase. Pflügers Archiv: European Journal of Physiology. 411 (1), 76-79 (1988).
- Fleming, J. W., et al. Functional regeneration of tissue engineered skeletal muscle in vitro is dependent on the inclusion of basement membrane proteins. Cytoskeleton. 76 (6), 371-382 (2019).
- Capel, A. J., et al. Scalable 3D printed molds for human tissue engineered skeletal muscle. Frontiers in Bioengineering and Biotechnology. 7, 20 (2019).
- Tsui, J. H., et al. Tunable electroconductive decellularized extracellular matrix hydrogels for engineering human cardiac microphysiological systems. Biomaterials. 272, 120764 (2021).
- Tsui, J. H., et al. Conductive silk-polypyrrole composite scaffolds with bioinspired nanotopographic cues for cardiac tissue engineering. Journal of Materials Chemistry B. 6 (44), 7185-7196 (2018).
- Gabella, G. Muscle cells, nerves, fibroblasts and vessels in the detrusor of the rat urinary bladder. Journal of Smooth Muscle Research. 55, 34-67 (2019).
- Christov, C., et al. Muscle satellite cells and endothelial cells: close neighbors and privileged partners. Molecular Biology of the Cell. 18 (4), 1397-1409 (2007).
- Bersini, S., et al. Engineering an environment for the study of fibrosis: A 3D human muscle model with endothelium specificity and endomysium. Cell Reports. 25 (13), 3858-3868 (2018).
- Gilbert-Honick, J., et al. Engineering functional and histological regeneration of vascularized skeletal muscle. Biomaterials. 164, 70-79 (2018).
- Maffioletti, S. M., et al. Three-dimensional human iPSC-derived artificial skeletal muscles model muscular dystrophies and enable multilineage tissue engineering. Cell Reports. 23 (3), 899-908 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon