Method Article
Teste pré-clínico de drogas em tecidos musculares escaláveis de engenharia 3D
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo fornece métodos para gerar tecidos cardíacos e musculares esqueléticos modificados em 3D e descreve seu uso em modalidades de triagem pré-clínica de medicamentos. Os métodos descritos utilizam um sistema de detecção magnética para facilitar a avaliação simultânea de 24 tecidos em paralelo.
Resumo
Modelar com precisão as condições saudáveis e de doença in vitro é vital para o desenvolvimento de novas estratégias de tratamento e terapêuticas. Para doenças cardíacas e musculares esqueléticas, a força contrátil e a cinética constituem métricas-chave para avaliar a função muscular. Métodos novos e aprimorados para gerar tecidos musculares modificados (EMTs) a partir de células-tronco pluripotentes induzidas tornaram a modelagem de doenças in vitro mais confiável para tecidos contráteis; no entanto, fabricar de forma reprodutível tecidos a partir de culturas de células suspensas e medir sua contratilidade é um desafio. Tais técnicas são frequentemente atormentadas por altas taxas de falha e exigem instrumentação complexa e rotinas personalizadas de análise de dados. Uma nova plataforma e dispositivo que utiliza EMTs 3D em conjunto com um ensaio de contratilidade sem rótulos, altamente paralelo e amigável à automação contorna muitos desses obstáculos. A plataforma permite a fabricação fácil e reprodutível de EMTs 3D usando praticamente qualquer fonte de célula. A contratilidade tecidual é então medida através de um instrumento que mede simultaneamente 24 tecidos sem a necessidade de rotinas complexas de análise de software. O instrumento pode medir de forma confiável as mudanças de micronewton em vigor, permitindo a triagem de compostos dependentes da dose para medir o efeito de uma droga ou terapêutica na saída contrátil. Os tecidos modificados feitos com este dispositivo são totalmente funcionais, gerando contrações tônicas e tetânicas após a estimulação elétrica, e podem ser analisados longitudinalmente em cultura ao longo de semanas ou meses. Aqui, mostramos dados de EMTs de músculos cardíacos sob dosagem aguda e crônica com tóxicos conhecidos, incluindo uma droga (BMS-986094) que foi retirada de ensaios clínicos após mortes de pacientes devido a cardiotoxicidade imprevista. A função alterada do músculo esquelético em tecidos modificados em resposta ao tratamento com um inibidor de miosina também é apresentada. Essa plataforma permite que o pesquisador integre sistemas de modelos de bioengenharia complexos e ricos em informações em seu fluxo de trabalho de descoberta de medicamentos com o mínimo de treinamento adicional ou habilidades necessárias.
Introdução
Os modelos de células-tronco pluripotentes induzidas (iPSC) estão se tornando cada vez mais atores-chave no pipeline pré-clínico para a descoberta e o desenvolvimento terapêutico, bem como a pesquisa biológica básica e a modelagem de doenças 1,2,3,4,5. Tecidos contráteis, como músculos cardíacos e esqueléticos derivados de iPSCs, possuem grande potencial para melhorar o poder preditivo de estudos in vitro em humanos, pois a avaliação direta da força contrátil muscular e da cinética são métricas quantitativas para estudar a função tecidual geral 4,6,7,8. Tipicamente, as medidas da força contrátil têm sido obtidas indiretamente pelo rastreamento óptico da deflexão do substrato 9,10 ou diretamente pela fixação de células/tecidos a um transdutor de força4,11,12. Esses métodos, embora precisos, são inerentemente de baixo rendimento e normalmente exigem operadores altamente qualificados para coletar e analisar dados.
Trabalhos anteriores mostraram que a detecção do campo magnético contorna esses obstáculos e fornece um método alternativo para avaliar a função muscular projetada simultaneamente em vários construtos teciduais13. A Plataforma de Contratilidade 3D Mantarray (Magnetometric Analyzer for eNgineered Tissue ARRAY) baseia-se nessa tecnologia usando um dispositivo capaz de medir a contratilidade de tecidos musculares projetados de maneira altamente paralela que aproveita a complexidade de modelos celulares 3D com triagem de maior rendimento14. A plataforma permite o monitoramento em tempo real, quantitativo e livre de rótulos da função contrátil nos tecidos musculares cardíacos e esqueléticos dentro ou fora de uma incubadora de cultura celular padrão, eliminando a necessidade de imagens e análises contráteis baseadas em óptica. Essa tecnologia facilita a comparação direta de linhagens celulares saudáveis e doentes e permite a medição do efeito de uma droga em tecidos contráteis, estabelecendo dados quantificáveis, in vitro, de segurança e eficácia para compostos terapêuticos novos e existentes.
Os tecidos musculares 3D projetados podem ser fabricados entre dois postes de maneira altamente reprodutível usando a placa de fundição de 24 poços consumível Mantarray (Figura 1). Um poste é rígido, enquanto o outro poste é flexível e contém um pequeno ímã. Quando a construção do tecido se contrai, ela desloca o poste flexível e o ímã incorporado. A placa EMT é posicionada dentro do instrumento, e o deslocamento do poste é medido através de uma matriz de sensores magnéticos em uma placa de circuito abaixo do suporte da placa. As mudanças medidas no campo magnético são convertidas em força contrátil absoluta usando um algoritmo matemático. O instrumento emprega taxas rápidas de amostragem de dados para permitir a coleta de informações detalhadas sobre a capacidade funcional e a maturidade do(s) tipo(s) de célula(s) a ser ensaiado(s), incluindo frequência de contração, velocidade e tempo de decaimento. Essas medições funcionais podem ser obtidas em todos os 24 poços simultaneamente com a plataforma de detecção magnética ou individual e sequencialmente usando métodos ópticos tradicionais.
Este estudo descreve um método altamente reprodutível para a engenharia de músculos esqueléticos 3D e microtecidos cardíacos em um hidrogel à base de fibrina. Durante uma breve reação de 80 minutos, a trombina catalisa a conversão de fibrinogênio em fibrina, fornecendo um andaime para que as células musculares se desenvolvam em cultura suspensa15. As células estromais ajudam a remodelar a matriz e os tecidos tornam-se contráteis à medida que as células musculares formam um sincício dentro do hidrogel. A contratilidade desses tecidos foi analisada por meio da abordagem de sensoriamento magnético, tanto antes quanto após a exposição composta, validando essa modalidade para uso em estudos de fármacos dose-resposta. Os mioblastos humanos primários de uma biópsia de doador saudável foram obtidos comercialmente e cultivados em 2D de acordo com os protocolos do fornecedor. As células foram expandidas usando um meio de crescimento muscular esquelético através de três passagens para gerar números de células suficientes para fabricar tecidos 3D. Células estromais e cardiomiócitos derivados de hiPSC foram cultivados de acordo com o protocolo do fornecedor por 3 dias para permitir a recuperação da criopreservação antes da fundição de células nos tecidos. Resultados representativos são fornecidos ilustrando os tipos de conjuntos de dados que podem ser coletados usando a plataforma de detecção magnética. Armadilhas comuns associadas à geração de tecidos modificados usando esses métodos também são abordadas.
Protocolo
1. Protocolo de cultura celular
- Cultura primária de mioblastos humanos
- Diluir a matriz extracelular (MEC) na proporção de 1:100 em 8 mL de meio DMEM/F12 em gelo.
- Aplicar 8 ml de solução de MEC num balão de T175 e incubar a 37 °C durante, pelo menos, 1 h antes da semeadura celular, mas não mais de 24 h. Assegurar que a solução de ECM cobre todo o fundo do balão.
- Aliquota de 5 mL do meio de crescimento muscular esquelético a um tubo cônico de 15 mL.
- Descongele um frasco para injetáveis congelado de células (5,0 x 105 mioblastos) em banho-maria a 37 °C durante 2 minutos ou até que o gelo esteja derretido. Pulverize o frasco para injetáveis com etanol a 70% e transfira-o para um armário de biossegurança (BSC).
- Transfira as células para o meio alíquotado usando um P1000. Não triturar. Centrifugar as células a 300 x g durante 3 min.
- Aspirar o sobrenadante e ressuspender as células em 1 ml do meio de crescimento utilizando uma pipeta P1000 para obter uma única suspensão celular.
- Lavar o balão revestido de ECM com 15 ml de DPBS. Aspirar a DPBS e, em seguida, adicionar 30 ml do meio de crescimento ao balão.
- Adicionar 4 ml do meio de crescimento às células, misturar e distribuir a suspensão celular no balão T-175. Certifique-se de que o volume total é de 35 mL. Deslizar o balão suavemente ao longo da superfície de trabalho para a esquerda e para a direita 5-6 vezes, seguido de 5-6 vezes para a frente e para trás 5-6 vezes para garantir uma distribuição uniforme das células na superfície do balão.
- Colocar o balão T-175 numa incubadora de cultura celular a 37 °C e a 5% de CO2. Corte as células por 3 dias ou até que elas não atinjam mais de 70% de confluência e, em seguida, passe as células.
- Mioblastos humanos primários de passagem
- Diluir a MEC na proporção de 1:100 em 30 mL de meio DMEM/F12 em gelo.
- Aplicar 10 ml da solução de MEC em três frascos de T225 e incubar a 37 °C durante, pelo menos, 1 h antes da semeadura celular, mas não mais de 24 h. Certifique-se de que a solução de ECM cobre todo o fundo do balão.
- Lave as células com 15 mL de DPBS. Aspirar e adicionar o reagente de dissociação de acordo com o protocolo do fornecedor.
- Uma vez que as células são levantadas, pare a reação de acordo com o protocolo do fornecedor e colete as células em um tubo cônico. Centrifugar as células a 300 x g durante 3 min.
- Aspirar o sobrenadante e ressuspender as células em 1 ml do meio de crescimento utilizando uma pipeta P1000 para obter uma única suspensão celular.
- Lavar o balão revestido de ECM com 15 ml de DPBS. Aspirar a DPBS e, em seguida, adicionar 40 ml do meio de crescimento a cada balão T225.
- Adicionar 14 ml do meio de crescimento à suspensão celular, misturar e distribuir 5 ml da suspensão celular por cada balão T225. Certificar-se de que o volume total de cada balão é de 45 ml. Deslize o balão suavemente ao longo da superfície de trabalho para a esquerda e para a direita 5-6 vezes, seguido de 5-6 vezes para a frente e para trás 5-6 vezes para garantir uma distribuição uniforme.
- Colocar os frascos na incubadora de cultura celular a 37 °C e a 5% de CO2.
- Células de cultura por 2-3 dias ou até atingirem não mais de 70% de confluência e, em seguida, passagem. Divida as células em 1:3 ou 1:4 em cada passagem e semeie entre 3 x 103 e 1 x 104 células/cm2.
- Cultura de cardiomiócitos derivados de hiPSC
- Diluir a MEC na proporção de 1:60 em 12 mL de meio DMEM/F12 em gelo.
- Aplicar 1 ml da solução de MEC em cada alvéolo de duas placas de 6 poços e incubar a 37 °C durante, pelo menos, 1 h antes da semeadura celular, mas não mais de 24 h.
- Descongele um frasco congelado de cardiomiócitos em banho-maria a 37 °C durante 2 minutos ou até que o gelo esteja derretido.
- Pulverize o frasco para injetáveis com etanol a 70% e transfira-o para o BSC.
- Use uma pipeta p1000 para transferir as células descongeladas para um tubo cônico de 50 mL.
- Enxaguar o criovial vazio com 1 mL de meio de revestimento à temperatura ambiente (RT) para recuperar as células restantes.
- Dispense lentamente o 1 mL de meio de enxágue gota a gota (uma gota a cada 5 s) no tubo cônico de células ao longo de 90 s. Gire continuamente o tubo para misturar as células durante a lenta adição de meio.
- Adicionar lentamente 8 mL do meio de revestimento usando uma pipeta sorológica de 10 mL ao tubo cônico de células de 50 mL.
- Depois que todo o meio for dispensado, pipete suavemente para cima e para baixo 3 vezes para misturar as células completamente. Conte as células usando um hemacitômetro e azul de tripano.
- Centrifugar as células no tubo cônico de 50 mL a 300 x g por 3 min.
- Depois que as células tiverem sido peletizadas, aspirar o sobrenadante.
- Use uma pipeta p1000 para transferir 1 mL do meio de revestimento para o tubo e quebre suavemente o pellet pipetando lentamente para cima e para baixo 3-5 vezes. Ressuspenda as células com um meio de chapeamento adicional.
- Semear entre 2-4 x 10 6 células por poço de uma placa de6 poços em 2 mL do meio de chapeamento.
- Lave as placas de 6 poços revestidas de ECM com DPBS (2 mL/poço).
- Pipeta 2 mL de suspensão celular por poço de uma placa de 6 poços. Mova as placas suavemente ao longo da superfície de trabalho para a esquerda e para a direita 5-6 vezes, seguido de 5-6 vezes para a frente e para trás 5-6 vezes para garantir a distribuição uniforme das células nas superfícies da placa.
- Colocar a placa na incubadora de cultura celular a 37 °C e a 5% de CO2.
- Repita os passos 1.3.3-1.3.16 para todos os frascos para injetáveis das células a descongelar.
- Mude para 3-5 mL (dependendo da linhagem celular e densidade) do meio de manutenção no dia seguinte após o revestimento e, em seguida, mude o meio a cada dois dias. Células de cultura por 3-4 dias antes de fundir em tecidos 3D.
- Cultura de células estromais
- Aplicar 30 ml da solução de MEC num balão de T175 e incubar a 37 °C durante, pelo menos, 1 h antes da semeadura celular, mas não mais de 24 h.
- Aliquota de 5 mL do meio de células estromais em um tubo cônico de 15 mL.
- Descongele um frasco congelado de células estromais em banho-maria a 37 °C durante 2 minutos ou até que o gelo tenha acabado de derreter.
- Pulverize o frasco para injetáveis com etanol a 70% e transfira-o para o BSC.
- Utilize uma pipeta p1000 para adicionar lentamente 1 ml do meio de células estromais às células descongeladas no frasco para injetáveis.
- Transfira a suspensão celular do frasco para injetáveis para o meio de descongelamento restante no tubo cónico. Use uma pipeta sorológica de 5 mL para misturar as células. Pipeta para cima e para baixo 3 vezes.
- Conte as células usando um hemacitômetro e azul de tripano. Não gire para baixo as células.
- Lavar o balão T175 revestido de ECM com 15 ml de DPBS.
- Transferir as células estromais para o balão a uma densidade de 3-4 x 103 células/cm2. Deslizar o balão suavemente ao longo da superfície de trabalho para a esquerda e para a direita 5-6 vezes, seguido de 5-6 vezes para a frente e para trás 5-6 vezes para garantir uma distribuição uniforme das células na superfície do balão.
- Trocar meio no dia seguinte com 45 mL de meio de células estromais aquecidas. Cultive as células por 3-4 dias antes de fundir em tecidos 3D.
2. Preparação do material
- Fibrinogênio
NOTA: Ao reconstituir o fibrinogênio, tome cuidado para maximizar a quantidade de área de superfície em que o pó de fibrinogênio está sendo colocado em camadas. Neste protocolo, a quantidade de diluente utilizada foi otimizada para o tamanho do recipiente utilizado, ou seja, apenas diluente suficiente foi utilizado para cobrir o fundo do prato. Por exemplo, camada de 0,5 g de fibrinogênio sobre 10 mL de PBS em um prato de 100 mm, em vez de um tubo de centrífuga de 50 mL. Maximizar a quantidade de área de superfície do diluente reduzirá a quantidade de tempo necessária para reconstituir o fibrinogênio e reduzir a potencial aglomeração de proteínas.- Reconstituição
- Transfira 10 mL de PBS para uma placa de cultura celular de 100 mm e aqueça a 37 °C em uma incubadora de cultura celular.
- Colocar 0,5 g de pó de fibrinogénio sobre toda a superfície do PBS quente e manter a 37 °C até que o fibrinogénio se dissolva totalmente. Isso não deve levar mais de 2 h. O pó de dissolução pode ser suavemente agitado, mas não agite vigorosamente o prato.
- Filtração estéril
- Uma vez que o pó tenha se dissolvido completamente, passe a solução através de um filtro de 100 μm e colete-a em um tubo cônico de 50 mL para remover quaisquer aglomerados de fibrinogênio gelilado.
- Deite a solução filtrada numa seringa de 10 ml coberta com um filtro de 0,2 μm. Empurre a solução através do filtro e colete-a para um novo tubo cônico de 50 mL. O filtro pode precisar ser trocado mais de uma vez para esterilizar todos os 10 mL de solução.
- Aliquota 300 mL de fibrinogênio estéril em tubos de microcentrífuga de 1,5 mL e armazene a -20 °C. Descongelar as alíquotas no gelo ou a 4 °C, conforme necessário. Evite congelamentos/descongelamentos repetidos.
- Reconstituição
- Trombina
- Adicionar 6 ml de PBS e 4 ml de diH2O diretamente num frasco para injetáveis de trombina (1 KU) para obter uma solução-mãe de trombina a 100 U/ml.
- Esterilizar o filtro com um filtro de 0,2 μm, alíquota e armazenar a -20 °C em tubos de microcentrífuga de plástico de 1,5 mL como adsorventes de trombina ao vidro. Evite congelamentos/descongelamentos repetidos.
- Solução de poli(etilenoimina) (PEI)
CUIDADO: PEI é tóxico. Utilize os EPI adequados, conforme designado pelo fabricante.
NOTA: O PEI é fornecido como uma solução a 50% p/v. É altamente viscoso e difícil de pipetar. Faça uma solução de 0,1% a partir de uma solução de estoque de 10% em vez de diretamente da solução de 50% p/v.- Meça 5 mL de solução de PEI a 50% p/v em um tubo cônico de 50 mL.
- Adicionar 20 ml de diH2O e misturar para obter uma solução-mãe a 10%. Esta solução-mãe altamente concentrada não pode ser filtrada estéril.
- Para fazer uma solução a 0,1% para cultura celular, adicionar 5 mL de 10% de estoque a 495 mL de diH2O. Filtro estéril usando um frasco de filtro de 500 mL e armazenar em RT por não mais de 1 semana.
- Glutaraldeído
CUIDADO: O glutaraldeído é tóxico. Utilize os EPI adequados, conforme designado pelo fabricante.- O glutaraldeído é fornecido como uma solução a 25%. Para fazer uma solução a 0,01%, adicionar 40 μL a 99,6 ml de diH2O. Filtro estéril e conservar a 4 °C durante não mais de 1 semana.
- Pós-preparação
- Coloque o kit de fundição de tecido consumível dentro de um exaustor de cultura estéril. O kit de fundição contém uma tampa, uma rede de poste contendo 24 pares de postes (um par de postes por poço de uma placa de 24 poços) e um fundo de placa especializado de 24 poços contendo 24 poços de fundição. Cada poço de fundição contém uma trincheira no fundo do poço para segurar os componentes da célula/hidrogel e moldá-los em um tecido em forma de tubo à medida que o hidrogel polimeriza (Figura 1B).
- Encha os poços de uma placa de 24 poços com 1,5 mL/poço de uma solução de PEI a 0,1% e coloque postes na placa para que as pontas de cada par de postes fiquem submersas. Deixe descansar por 10 min. PEI irá depositar uma carga positiva sobre os postes para que as proteínas no hidrogel se liguem firmemente aos postes durante a fundição do tecido.
- Encha os poços de uma segunda placa de 24 poços com 2 mL/poço de diH2O estéril e transfira os postes. Deixe descansar por 1 min.
- Em uma terceira placa de 24 poços, encha os poços com 1,5 mL/poço de glutaraldeído (GA) a 0,01% e transfira os postes. Deixe descansar por 30 min. GA irá corrigir a carga positiva de PEI para os postes.
- Enquanto os postes ficam em glutaraldeído, aspirar os poçosde diH 2 O, lavar com 2 mL/poço de diH 2 O estéril, aspirar e reabastecer com 2 mL/poço de diH2O estéril. Uma placa fresca de 24 poços pode ser usada em vez de enxaguar.
- Quando 30 min acabar, transfira os postes para os 2 mL/poço de diH2 O estéril. Deixe descansar por 1 min.
- Aspirar o diH 2 Oe adicionar mais 2 mL/poço de diH2O estéril. Deixe descansar por 5 min.
- Transfira os postes para uma placa de 24 poços para secar (aproximadamente 15 min).
- Uma vez seco, remonte o Kit de fundição. Parafilme as bordas para selar a tampa e a placa juntas e, em seguida, armazenar a 4 °C por até 72 h antes da semeadura da célula. Tempos de armazenamento mais longos provavelmente são possíveis, mas não foram testados.
3. Protocolo de fundição de tecidos
- Preparação da placa de fundição
- Pré-arrefecer o kit de fundição de tecidos a 4 °C.
- Transfira um balde de gelo para o BSC. No gelo, preparar 50 μL de solução de trombina (3 μL de caldo de trombina + 47 μL de meio EMT) por poço a fundir.
Observação : consulte a etapa 3.2.1 para obter detalhes sobre a mídia EMT. - Retire o kit de fundição refrigerado da geladeira e coloque-o em um bloco frio ou gelo dentro do exaustor de cultura de células. Coloque a placa de fundição plana no gelo e mova a treliça do poste da placa de fundição para uma nova placa estéril de 24 poços.
- Pipetar 50 μL de solução de trombina para cada poço pré-refrigerado da placa de fundição.
- Remonte o kit e devolva-o à geladeira até que seja necessário para a fundição do tecido. Lançar os tecidos dentro de 3 h de trombina, além dos poços.
- Preparação celular
- Prepare o meio de base EMT, filtro estéril e deixe no gelo.
NOTA: Se o meio de fundição específico da célula contiver FBS, use FBS inativado pelo calor, pois ele pode interagir com o fibrinogênio e causar polimerização prematura.- Preparar meio EMT cardíaco: Adicione 500 mL de meio RPMI, 10 mL de B27 e 2,5 g de ácido aminocapróico. (Opcional) Adicionar inibidor de ROCK de 10 mM (adicionar apenas ao meio EMT utilizado para fundir tecidos e não todo o volume de 500 ml).
- Preparar meio EMT esquelético: Adicionar 50 mL de meio F10 e 0,25 g de ácido aminocapróico (ACA) para EMTs primários e 0,1 g de ACA para EMTs derivados de iPSC.
- Aqueça o reagente de dissociação do grau de cultura celular a 37 °C. Aqueça um volume igual de meio EMT para diluir o reagente de dissociação.
NOTA: É fundamental que a protease utilizada esteja completamente inactivada. A protease ativa interferirá na formação de tecido 3D e na pós-adesão. - Lave as células (Figura 1A) com PBS. Use 2 mL/poço para uma placa de 6 poços. Use 6 mL, 15 mL e 15 mL para um prato de 100 mm, balão T175 e frasco T225, respectivamente.
- Adicionar o reagente de dissociação de grau de cultura celular aquecido para levantar as células e incubar a 37 °C durante 5 minutos ou até que as células tenham levantado. Para culturas cardíacas, use o reagente de dissociação 10x. Para células estromais e mioblastos musculares esqueléticos, use um reagente de dissociação 1x. Use 1 mL/poço para um prato de 6 poços, 3 mL para um prato de 100 mm, 8 mL para um frasco T175 e 10 mL para um frasco T225.
- Verifique as culturas a cada 2-3 minutos, tocando no lado da placa.
- Uma vez que as células tenham levantado, transfira-as para um tubo cônico de 50 mL e triture com uma pipeta P1000 para garantir uma suspensão de célula única.
- Lavar a placa ou o balão com um meio EMT adicional para recolher as células restantes e adicioná-las ao tubo cónico. Use 1 mL/poço do meio EMT para uma placa de 6 poços, 2 mL para um prato de 100 mm, 5 mL para um frasco T175 e 5 mL para um frasco T225.
- Triturar as células para garantir uma única suspensão celular.
- Adicione o meio EMT para encerrar o processo de dissociação e, em seguida, tire amostras das suspensões celulares para contagens de células. Use 1 mL/poço para um prato de 6 poços, 3 mL para um prato de 100 mm, 8 mL para um frasco T175 e 10 mL para um frasco T225.
- Gire as células a 200 x g por 4 min. Realize contagens de células usando um hemacitômetro e azul de tripano enquanto as suspensões são centrifugadas.
- Aspirar o sobrenadante e ressuspender as células em 5 mL de meio de base EMT para remover o reagente de dissociação residual.
- Centrifugar as células a 200 x g durante 4 min. Aspirar o sobrenadante e preparar as suspensões celulares nas densidades apropriadas.
- Aumentar a longevidade e a função dos EMTs do músculo esquelético 3D com a adição de proteínas ECM de 10% a 20% no meio EMT14,16.
- Sementes de cardiomiócitos derivados de células-tronco e suas células estromais em 5 x 10 5 células e7,5 x 104 células por tecido constrangimento, respectivamente. Semeia os mioblastos do músculo esquelético em 7,5 x 105 células por construção de tecido.
- Tecidos cardíacos
- Aspirar o sobrenadante e ressuspender as células estromais a uma densidade de 2,5 x 106 células por ml em meio EMT e colocá-las no gelo. Utilizar 30 μL desta suspensão por EMT.
- Aspirar o sobrenadante e ressuspender os MCs a uma densidade de 8,3 x 106 células por mL em meio EMT e colocá-los no gelo. Utilizar 60 μL desta suspensão por EMT.
- Tecidos musculares esqueléticos
- Aspirar o sobrenadante e ressuspender as células musculares esqueléticas a uma densidade de 8,3 x 106 células por mL em meio EMT e colocá-las no gelo. Utilizar 90 μL desta suspensão por EMT.
- Calcule os volumes de cada solução celular necessária para compor o número desejado de tecidos (por exemplo, 60 μL dos MCs preparados e 30 μL das células estromais preparadas ou 90 μL das células musculares esqueléticas por EMT).
- Pipetar os volumes calculados de células para um tubo cônico de 15 mL.
- Adicione 10 μL de fibrinogênio por EMT à suspensão celular e mantenha-a no gelo.
- Reagentes totais e volumes celulares por EMT: Certifique-se de que cada EMT tenha 90 μL de células, 10 μL de fibrinogênio e 50 μL de solução de trombina.
- Prepare o meio de base EMT, filtro estéril e deixe no gelo.
- Fundição de tecidos
- Transfira o kit de fundição de tecido para um exaustor de cultura de células e remova a tampa (pós-treliça contendo postes flexíveis e rígidos devem permanecer na placa de fundição; Figura 1B). Mantenha a placa de fundição com poste de treliça apoiada no gelo.
- Misture a mistura célula/fibrinogénio e desenhe 100 μL com uma pipeta P200.
- Adicionar 100 μL da mistura a poços preparados com 50 μL de solução de trombina e triturar 5 vezes para misturar bem. Não empurre a pipeta para além da primeira paragem e remova a ponta após a trituração para evitar a criação de bolhas.
- Nesta fase, e até que a rede pós-treliça esteja pronta para ser levantada da placa de fundição (passo 3.3.10), qualquer movimento da rede pode comprometer a fixação a longo prazo do tecido aos postes. Segure a treliça e a placa do poço de fundição simultaneamente usando o dedo indicador e o polegar de uma mão para evitar qualquer movimento da rede.
- Repita com uma ponta P200 fresca para cada tecido até que todos os tecidos estejam moldados. Misture a suspensão celular em um tubo cônico de 15 mL antes de moldar cada tecido à medida que as células se depositam rapidamente.
- Transfira cuidadosamente o kit semeado para a incubadora, certificando-se de não mover a rede. O movimento da rede após a semeadura pode resultar em diminuição do sucesso na transferência de tecidos para fora dos poços de fundição. Incubar a 37 °C durante 80 min, independentemente do tipo de célula. Isso iniciará a polimerização do hidrogel e permitirá que as proteínas se liguem aos postes.
- Enquanto isso, prepare uma placa fresca de 24 poços com 2 mL/poço do meio EMT para tecidos cardíacos. O inibidor de ROCK de 10 mM pode ser adicionado ao meio EMT, se desejado. Incubar a placa a 37 °C para aquecer o meio.
- Preparar 2 mL/poço de meio de crescimento contendo 5 g/L de ácido aminocapróico (0,2 mm de filtro estéril) para tecidos musculares esqueléticos primários ou 2 g/L de ACA para EMTs derivados de iPSC. Incubar a placa a 37 °C para aquecer o meio.
- Após a incubação, adicionar suavemente 1 ml do meio EMT à borda dos poços de fundição e incubar por mais 10 min a 37 °C, independentemente do tipo de célula. Isso desalojará o hidrogel das bordas do poço de fundição e permitirá uma fácil transferência do tecido.
- Após 10 min, levantar cuidadosamente a pós-treliça e transferir os tecidos da placa de fundição para uma placa preparada de 24 poços com meio (Figura 1C). Devolver as placas com tecidos à incubadora de cultura celular a 37 °C.
- Manutenção
- Após 24 h, transferir os tecidos fundidos para uma placa fresca de 24 poços com 2 mL/poço do meio EMT (sem o inibidor de ROCK, se incluído) e incubar a 37 °C. Para as células musculares esqueléticas, mude o meio de crescimento para o meio de diferenciação para promover a fusão de mioblastos.
- Transfira os tecidos cardíacos para poços frescos com 2 mL/poço do meio EMT a cada 2-3 dias.
- Transfira os tecidos musculares esqueléticos para poços frescos com meio de diferenciação de 2 mL/poço contendo 5 g/L de ácido aminocapróico (0,2 mm de filtro estéril) a cada 2-3 dias. Use 2 g / L de ACA para tecidos derivados de iPSC.
- Para ajudar nas mudanças de meio, transfira a rede de pós-poste para uma placa fresca de 24 poços em vez de mudar o meio na mesma placa para evitar danificar os tecidos 3D. Prepare uma segunda placa de 24 poços com o meio EMT e transfira os tecidos para o meio fresco. Mantenha a placa com o meio antigo ao lado da cultura ativa para usar na próxima mudança de meio. Transfira a rede de postes para frente e para trás entre as duas placas durante todo o período de cultura. Alternativamente, use um prato fresco para cada mudança de meio.
- Medir a contração EMT por meio de rastreamento óptico de pós-deflexão (Figura 1D) ou hardware de detecção magnética13,14. Os tecidos cardíacos começam a bater espontaneamente após 3-4 dias em cultura. Os tecidos musculares esqueléticos são tipicamente contráteis com estimulação elétrica do campo após 7 dias em cultura.
Resultados
As células foram moldadas em tecidos musculares modificados na placa consumível de 2 pós (Figura 1). Os EMTs bem-sucedidos aparecerão uniformes e a matriz será distribuída uniformemente entre os postes (Figura 2A). A matriz também deve envolver ambos os postes, produzindo pontos de ancoragem equivalentes para o tecido. Falhas na fundição são raras com este método e geralmente são óbvias com uma inspeção visual. A produção malsucedida de EMT pode variar de falhas catastróficas, como o descolamento de tecido dos postes (Figura 2B) a falhas estruturais mais sutis, como bolhas de ar e fixação solta aos postes (Figura 2C,D). Tecidos com pequenas falhas ainda podem ser viáveis, mas os dados desses tecidos devem ser examinados cuidadosamente para garantir que sejam comparáveis aos EMTs não comprometidos. Por exemplo, bolhas de ar dentro de um EMT podem ser espremidas à medida que o tecido se compacta ao longo do tempo, tornando uma construção totalmente funcional sem deficiências contráteis. Esses tecidos devem ser avaliados caso a caso, no entanto, pois a localização das bolhas de ar pode afetar a recuperação funcional. As bolhas de ar geradas nos postes, por exemplo, podem afetar a fixação tecidual, o que poderia impedir a adesão a longo prazo ao poste.
Os tecidos começam a se compactar nas primeiras 24 h à medida que as células remodelam a matriz dentro do hidrogel (Figura 3). A compactação é um processo gradual e geralmente prossegue ao longo das primeiras 2-4 semanas de cultura. No geral, a compactação tecidual é consistente entre as replicações técnicas e biológicas (Figura 4). É normal que algumas linhagens celulares compactem a matriz mais do que outras, à medida que os tecidos amadurecem ao longo do tempo. A porcentagem de células miogênicas dentro de um construto influencia a taxa e o grau geral de compactação da EMT. O conteúdo miogênico total para linhagens celulares de músculo cardíaco e esquelético deve estar acima de 80% para minimizar a variação entre os tecidos modificados. Isto é particularmente importante quando se compara forças contráteis e cinética entre linhagens celulares.
Nos primeiros dias após a fundição, os cardiomiócitos começam a bater espontaneamente em cultura, dobrando ritmicamente o poste flexível a cada contração muscular. Os construtos do músculo esquelético se contraem em resposta à estimulação elétrica no dia 7 após o início da diferenciação. A estimulação de campo foi aplicada aos tecidos musculares esqueléticos através de um estimulador externo ligado a uma tampa de eletrodo personalizada de 24 poços. A tampa, fabricada com um par de eletrodos de carbono para cada poço, fica em cima da placa de 24 poços de tecidos, estimulando simultaneamente cada EMT a induzir contrações musculares. Os tecidos foram estimulados utilizando-se um estímulo de 10 V por uma duração de pulso de 10 ms a 1 Hz durante as medidas funcionais. Os tecidos contráteis indicam mioblastos esqueléticos que se fundiram, formando miotubos completos com sarcômeros funcionais e máquinas contráteis. Os EMTs esqueléticos são positivos para cadeia pesada de miosina (MyHC) e a distrofina está localizada na membrana do miotubo, revelando uma forma clássica de anel na análise imuno-histoquímica transversal (Figura 5). Uma vez que os EMTs são funcionais, a contratilidade pode ser medida diariamente no instrumento de detecção magnética, força de rastreamento e cinética à medida que as construções se desenvolvem e amadurecem ao longo do tempo. Tanto os tecidos cardíacos quanto os do músculo esquelético permanecem contráteis por semanas a meses em cultura 3D (Figura 6), e podem ser usados para uma ampla gama de estudos de contratilidade.
A abordagem de detecção magnética pode ser utilizada para medir simultaneamente os efeitos agudos e crônicos de cardiotóxicos estruturais, como a doxorrubicina (Figura 7) e o BMS-986094 (Figura 8), além de outras drogas que afetam a contratilidade muscular. Métodos de rastreamento óptico de detecção de contração também podem ser usados, mas deve-se tomar cuidado ao estudar os efeitos agudos da droga, pois as medições devem ser tomadas sequencialmente. A longevidade prolongada dos EMTs cardíacos e esqueléticos em cultura 3D permite estudos de drogas de longo prazo nesses tecidos. Isso permite que os usuários explorem os efeitos da dosagem repetida, bem como a exposição contínua e a longo prazo a compostos que podem mostrar efeitos cardiotóxicos ao longo do tempo, como ocorre com a doxorrubicina. A doxorrubicina (dox) é um quimioterápico anticâncer17. A quantidade de droga administrada aos pacientes varia, dependendo do tipo de câncer, idade do paciente, altura e peso do paciente, bem como outros fatores. Por esta razão, é importante testar o efeito da dox em uma ampla gama de concentrações e cronogramas de entrega. Aqui, os EMTs cardíacos foram tratados ao longo de 27 dias com três concentrações separadas (0,1 μM, 1 μM e 10 μM) de dox (Figura 7). Os grupos foram estratificados ainda mais pelo tratamento de EMTs em cada concentração com um tratamento em bolus ou administração contínua com uma mudança média a cada 72 h. Os poços que receberam tratamentos em bolus de dox foram expostos à droga em três pontos de tempo separados, permitindo a recuperação entre a dosagem. As duas maiores doses de bolus e exposição contínua mostraram uma cessação imediata e prolongada da geração de força contrátil ao longo do estudo. As concentrações média e mais baixa tiveram efeitos variados sobre os tecidos, dependendo do método de administração. Na menor concentração da droga, o grupo bolus não apresentou diferença em relação aos controles. No entanto, a força contrátil diminuiu após 2 semanas de exposição contínua. A concentração de médio alcance da droga teve um efeito interessante. Enquanto a dosagem contínua reduziu a força nos primeiros dois dias de tratamento e durou todo o experimento, o grupo bolus mostrou uma recuperação da força contrátil de volta aos níveis de controle quando a droga foi lavada após 3 dias. No entanto, o segundo bolus da droga causou uma cessação total da força, seguida de nenhuma recuperação (Figura 7), indicando que a dosagem repetida nessa concentração pode ter um efeito cardiotóxico em pacientes tratados com essa droga. O amplo escopo deste estudo, tanto no tempo quanto em condições experimentais, destaca a utilidade dos tecidos modificados em 3D na triagem de toxicidade, pois permanecem contráteis e responsivos à exposição química por longos períodos de tempo, permitindo estudos de drogas de longo prazo dentro de um único conjunto de tecidos musculares. Isso facilita não apenas a identificação de compostos que podem ter um efeito cardiotóxico com exposição crônica, mas também a detecção de possíveis momentos cardiotóxicos de administração.
O teste de toxicidade in vitro em tecidos musculares humanos modificados é uma maneira de ajudar a manter os pacientes humanos seguros em ensaios clínicos. BMS-986094 é um inibidor da nucleotídeo polimerase (NS5B) usado para tratar a hepatite C. A droga estava em desenvolvimento clínico de Fase II quando Bristol-Myers Squibb interrompeu o desenvolvimento devido a vários casos de insuficiência cardíaca inesperada em pacientes18,19. Aqui, o BMS-986094 foi aplicado a EMTs cardíacos para testar se os tecidos musculares modificados em 3D desenvolveriam uma reação cardiotóxica à droga (Figura 8). Três concentrações diferentes da droga foram aplicadas, e os tecidos foram monitorados ao longo de 13 dias. A força contrátil caiu com a adição do fármaco de forma dose-dependente (Figura 8A). A frequência de contração também foi significativamente afetada à medida que a taxa de batimento diminuiu e, eventualmente, parou como esperado com a exposição contínua ao composto cardiotóxico (p < 0,05, Figura 8B). Esses resultados demonstram como os tecidos musculares humanos modificados em 3D podem ser usados para facilitar a introdução de novas drogas no mercado e sinalizar compostos que eventualmente falham devido à cardiotoxicidade. Além disso, essa tecnologia poderia potencialmente salvar vidas, expondo drogas perigosas antes de serem colocadas em pacientes em ensaios clínicos.
A capacidade de medir o efeito de drogas agudas e cronicamente aplicadas no tecido contrátil humano é um primeiro passo vital ao investigar a terapêutica quanto à segurança e eficácia. É importante saber, no entanto, que a concentração de fármacos aplicados é fisiologicamente relevante e apropriada para testes in vitro . Tecidos musculares esqueléticos foram utilizados para estabelecer um valor de IC50 para o monóxido de 2,3-butanodiona (BDM) em uma curva dose-resposta completa. Esta droga é um inibidor da ATPase bem caracterizado da miosina II do músculo esquelético20. O BDM inibe as contrações musculares, impedindo a formação de pontes cruzadas de miosina com o filamento de actina em sarcômeros21. Os resultados aqui apresentados revelam uma diminuição dose-dependente da força absoluta quando a droga é aplicada e a recuperação completa da força contrátil quando a droga é lavada, indicando que o efeito transitório está prevenindo contrações musculares e não apenas matando células dentro do tecido (Figura 9A). Além disso, uma curva dose-resposta completa foi medida nas sete concentrações examinadas, estabelecendo um CI50 de 3,2 mM nesses microtecidos humanos (Figura 9B).

Figura 1: Fundição EMT na placa de 24 poços consumível Mantarray de 2 postes . (A) Células miogênicas e estromais foram cultivadas em superfícies 2D antes da fundição do tecido. (B) As células são retiradas de superfícies 2D e misturadas com proteínas da matriz extracelular para formar hidrogéis nos poços de fundição de placas individuais mostrados na inserção. (C) Placa de 24 poços contendo tecidos modificados em cada poço. (D) Tecidos representativos mostrando músculo modificado relaxado e contraído, comparando o deslocamento do poste magnético (barras verdes). Por favor, clique aqui para ver uma versão maior desta figura.
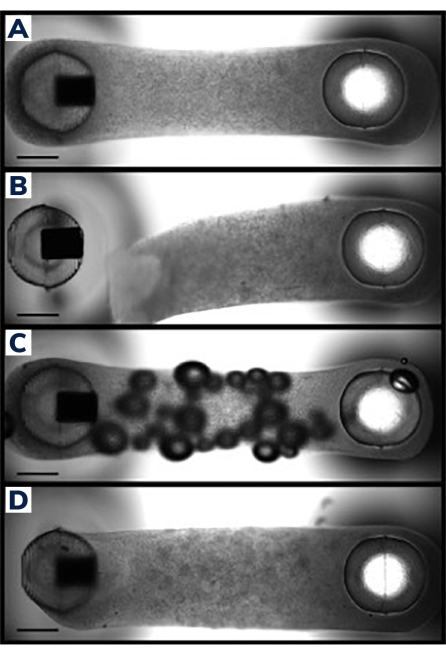
Figura 2: Fundição EMT bem-sucedida e malsucedida . (A) Tecido muscular projetado ideal 24 h pós-fundição uniformemente compactado em torno dos postes com composição homogênea de célula/matriz em todo o tecido. (B) EMT com falha mostrando descolamento do hidrogel do poste flexível. (C) EMT contendo bolhas de ar em todo o tecido. (D) Deposição desigual de tecido em torno de ambos os postos. O tecido é frouxamente ancorado ao poste flexível de um lado. As barras de escala são de 1 mm. Clique aqui para ver uma versão maior desta figura.
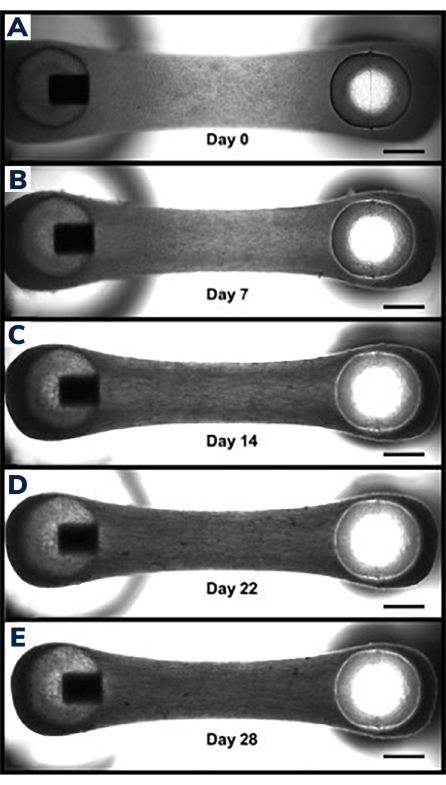
Figura 3: Compactação no tecido muscular modificado ao longo do tempo. (A) Construto EMT mostrado 1 dia após a fundição. Os tecidos são transferidos para o meio de diferenciação, a partir do dia 0 de fusão celular e compactação em hidrogel. (B-E) O mesmo EMT no dia 7 até o dia 21 mostrando um comprimento total ligeiramente menor entre os dois postes ao longo do tempo e menor largura quando medido através da seção do meio do EMT. As barras de escala são de 1 mm. Clique aqui para ver uma versão maior desta figura.
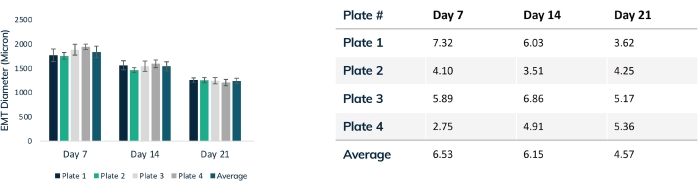
Figura 4: Diâmetro da EMT ao longo do tempo. Quatro placas de tecidos foram rastreadas ao longo de 21 dias, comparando-se o diâmetro da EMT ao longo da compactação. Cada tecido foi medido através da seção intermediária a cada semana usando microscopia óptica. Os pontos de tempo mostram o tamanho consistente do EMT entre as placas. A compactação máxima é alcançada no dia 21 à medida que a remodelação da matriz é estabilizada. A tabela mostra o desvio padrão (% do total) de compactação dentro de cada placa de tecidos e o desvio médio para todas as placas. Barras coloridas são placas individuais. As barras de erro são SD de EMTs dentro de placas. Por favor, clique aqui para ver uma versão maior desta figura.
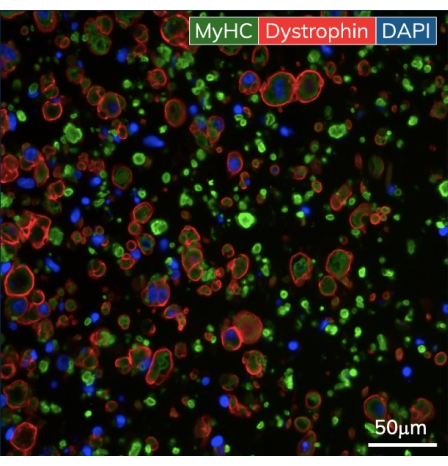
Figura 5: Imuno-histoquímica dos tecidos musculares esqueléticos modificados. Os EMTs foram fixados no dia 10 de cultura e embutidos em parafina. Cortes transversais finos (7 μm) foram corados com anticorpos contra a cadeia pesada da miosina e distrofina antes da imagem. Verde = MyHC, vermelho = distrofina, azul = DAPI. A ampliação objetiva é de 40X; barra de escala é de 50 μm. Por favor, clique aqui para ver uma versão maior desta figura.
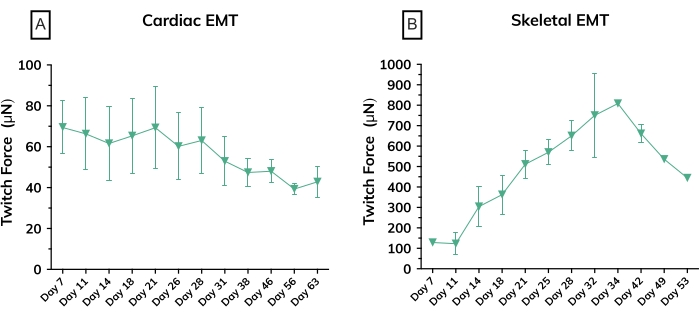
Figura 6: Força contrátil em tecidos musculares modificados ao longo do tempo. (A) Força de contração absoluta média medida a partir de EMTs cardíacos do dia 7 ao dia 63 em cultura; n = 3 por grupo. (B) Força de contração absoluta média em EMTs esqueléticos derivados de uma linhagem celular primária no dia 7 até o dia 53 em cultura; n = 3. As barras de erro são SD para ambos os gráficos. Por favor, clique aqui para ver uma versão maior desta figura.
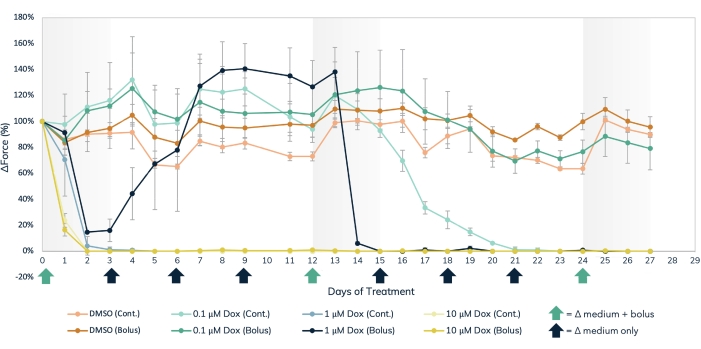
Figura 7: Tratamento agudo e crônico com doxorrubicina no tecido muscular modificado. Três concentrações de dose separadas de dox, 0,1 μM, 1 μM e 10 μM, foram administradas em bolus ou administradas continuamente aos tecidos musculares modificados ao longo de 27 dias. Doses em bolus da droga foram adicionadas em mudanças de mídia nos dias 0, 12 e 24, observadas pelas setas verdes no eixo X. A droga foi adicionada à mídia a cada mudança de mídia para dosagem contínua, notada pelas setas pretas e verdes no eixo X. A variação percentual em vigor em relação aos valores basais (pré-tratamento medicamentoso) está no eixo Y, e o tempo em dias de tratamento está no eixo X. Laranja claro = controle contínuo DMSO, laranja escuro = controle DMSO bolus, verde claro = 0,1 μM dox contínuo, verde escuro = 0,1 μM dox bolus, azul claro = 1 μM dox contínuo, azul escuro = 1 μM Dox bolus, amarelo claro = 10 μM dox contínuo, amarelo escuro = 10 μM dox bolus. As barras de erro são SD; n = 3 por condição. Por favor, clique aqui para ver uma versão maior desta figura.
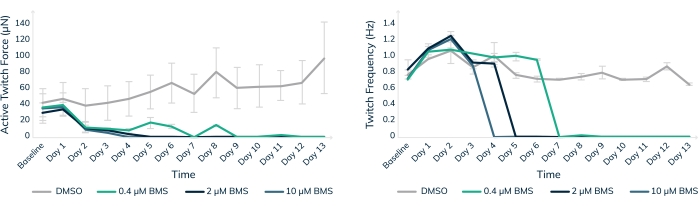
Figura 8: Tratamento crônico com BMS-986094 em tecido muscular modificado. Os EMTs foram tratados com 0,4 μM (verde), 2 μM (azul escuro) e 10 μM (azul claro) BMS-986094 durante 13 dias. (A) A força de contração contrátil (eixo Y) diminui em todas as concentrações de drogas nos primeiros 2 dias, enquanto os tecidos de controle no DMSO continuam a ficar mais fortes ao longo do tempo (eixo X). (B) A frequência de batimento cardíaco, ou frequência de contração, cessa de maneira semelhante à dose-dependente em conjunto com uma cessação da força contrátil mostrada no gráfico A. Os tecidos de controle no DMSO (cinza) mantêm uma taxa de batimento regular durante todo o experimento. As barras de erro são SD; n = 3 por condição. Por favor, clique aqui para ver uma versão maior desta figura.
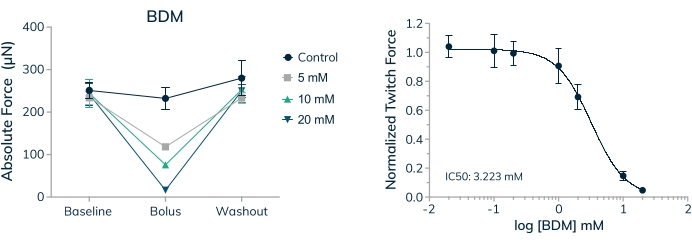
Figura 9: Dose-resposta ao BDM em tecidos musculares esqueléticos modificados . (A) A força de contração absoluta diminui de maneira dose-dependente quando os EMTs primários derivados de células são expostos ao monóxido de 2,3-butanodiona (BDM) no dia 16 em cultura 3D. A força de contração absoluta retorna aos valores basais próximos quando a droga é lavada. (B) A força de contração absoluta normalizada para valores basais diminui de forma dose-dependente quando exposta ao BDM, produzindo uma curva dose-resposta completa e um valor de IC50 ; n = 4 por dose. As barras de erro são SD. Clique aqui para ver uma versão maior desta figura.
Discussão
Este estudo descreve métodos para gerar tecidos cardíacos e musculares esqueléticos modificados em 3D dentro de um kit de fundição consumível de 24 poços. Seguindo esses métodos, é possível alcançar consistentemente uma matriz completa de 24 tecidos sem falhas de fundição para triagem subsequente de drogas. Considerações críticas para alcançar tal resultado são garantir que, durante a fundição, todas as etapas sejam realizadas no gelo para evitar a polimerização prematura dos hidrogéis, a remoção do reagente de dissociação celular antes da fundição do tecido, a mistura completa da suspensão de células e hidrogel para cada tecido, a substituição das pontas da pipeta entre os tecidos e o uso de FBS inativado pelo calor (se usado). Além disso, é importante garantir que a rede de pós-rede não seja movida uma vez que a fundição comece e seja transferida suavemente uma vez que os hidrogéis tenham se formado.
As principais modificações incluem o uso de diferentes tipos de células para alcançar EMTs cardíacos versus esqueléticos e o doping de hidrogéis com concentrações variáveis de proteínas da membrana basal para promover a maturação celular e a estabilidade tecidual. Os efeitos benéficos desse doping devem ser testados caso a caso, mas tem demonstrado melhorar os resultados funcionais e a longevidade tecidual em determinadas circunstâncias14,16,22. Também é digno de nota que as densidades celulares listadas são um guia e podem precisar ser otimizadas para diferentes linhagens celulares. Composições alternativas de hidrogel também podem ser consideradas como um meio de modificar as propriedades estruturais e funcionais dos EMTs alcançados23,24,25. O microambiente muscular nativo também contém tipos de células de suporte para promover vascularização, inervação e deposição de matriz para apoiar os miócitos na forma e função26,27. Embora o sistema descrito aqui atualmente incorpore fibroblastos em tecidos cardíacos 3D, tipos adicionais de células podem criar um modelo mais fisiológico relevante para estudar a segurança e a eficácia de compostos terapêuticos in vitro. Anteriormente, uma variedade de tipos de células de suporte foram integradas com sucesso em tecidos de engenharia 3D, apresentando um modelo empolgante para estudos futuros usando a plataforma de contratilidade de detecção magnética28,29,30.
A solução de problemas para este protocolo centra-se na formação de tecidos não confiáveis ou inconsistentes durante o processo de fundição. Deve-se tomar cuidado para evitar a formação de bolhas nos hidrogéis à medida que são fundidos, facilitando a distribuição uniforme das células durante a mistura. Experimentos de otimização provavelmente serão necessários para cada novo tipo de célula para identificar densidades celulares ideais, proporções celulares e composição de matrizes.
Uma grande limitação para esta técnica é o número significativo de células necessárias para estabelecer uma placa cheia de 24 EMTs. Para os dados aqui apresentados, foram utilizados 15 milhões de cardiomiócitos e 18 milhões de mioblastos esqueléticos por placa. Certos pesquisadores podem não ter acesso a piscinas tão grandes de material celular, o que pode inibir sua capacidade de usar essa plataforma em toda a sua extensão. Se os usuários finais não tiverem acesso ao hardware de detecção magnética, as medições de pós-deflexões precisam ser realizadas opticamente, o que reduz significativamente a taxa de transferência e impede o registro simultâneo de contrações musculares em vários poços. No entanto, o hardware Mantarray supera essas limitações para oferecer o primeiro sistema comercial capaz de análise contínua e não invasiva da contração EMT simultaneamente em várias construções.
A detecção magnética em 24 poços facilita estudos longitudinais do desenvolvimento funcional da EMT em tempo real e permite a medição precisa de respostas agudas à manipulação química, ambiental ou genética. Embora a detecção magnética tenha várias vantagens, como a medição simultânea em vários tecidos, e não exija análise de dados complicada, os métodos de detecção óptica permitem a medição simultânea de métricas fisiológicas, como fluxo de cálcio ou mapeamento de tensão. No entanto, conjuntos de dados como os ilustrados na seção de resultados demonstram a amplitude das aplicações que essa tecnologia tem no espaço de desenvolvimento de medicamentos. Dado que poucos ensaios no mercado oferecem os meios para realizar uma avaliação direta da produção contrátil no músculo projetado, esses métodos têm o potencial de revolucionar o pipeline de desenvolvimento pré-clínico.
Divulgações
Todos os autores são funcionários e acionistas da Curi Bio Inc., a empresa que comercializa o hardware Mantarray e o software associado.
Agradecimentos
Este trabalho foi parcialmente apoiado pelo financiamento da Food and Drug Administration (U01 FD006676-01 concedido ao Instituto de Ciências da Saúde e do Ambiente) e pelo financiamento dos Institutos Nacionais de Saúde (HL151094 para o Dr. Geisse). Agradecemos ao Dr. Alec S. T. Smith por sua assistência na preparação deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | CELLTREAT | 229485 | |
| 100 mm cell culture dish | ThermoFisher | 150466 | |
| 50 mL Steriflip filter | MilliporeSigma | SCGP00525 | |
| 500 mL filter flask | MilliporeSigma | S2GVU05RE | |
| 6-aminocaproic acid | Sigma | A2504 | |
| B27 | Gibco | 17504044 | |
| Cardiosight Maintenance Medium | NEXEL | CM-002A | |
| Cardiosight Plating Medium | NEXEL | CM-020A | |
| C-Pace EM stimulator | IonOptix | EM | |
| Curi Bio Muscle Differentiation Media Kit | Primary - DIFF | ||
| Curi Bio Muscle Maintenance Media Kit | Curi Bio | Primary - MAINT | |
| DAPI | Invitrogen | D1306 | |
| DMEM, high glucose, GlutaMAX | Gibco | 10566-016 | |
| Dnase | Sigma | 11284932001 | |
| DPBS | Gibco | 14190-250 | |
| Dystrophin antibody | Abcam | ab154168 | |
| Fetal bovine serum (FBS) | Thermo Scientific | 10082147 | Must be heat-inactivated |
| Fibrinogen (Bovine) | Sigma | E8630 | |
| Glutaraldehyde | Sigma | 354400 | |
| Ham's F10 | Gibco | 11550043 | |
| Hemacytometer | Sigma | Z359629 | |
| HS-27A Fibroblasts | ATCC | CRL-2496 | |
| Human Skeletal Muscle Myoblasts | Lonza | CC-2580 | |
| Luer Lock 0.2 µm syringe filter | Corning | 431219 | |
| Luer Lock 10 mL syringe | BH Supplies | BH10LL | |
| Mantarray Instrument | Curi Bio | MANTA-24-B1 | System |
| Mantarray Plate Kits | Curi Bio | MA-24-SKM-5 | Pack of 5 kits |
| Mantarray stimulation lid | Curi Bio | EM | |
| Matrigel (ECM) | Corning | 356231 | |
| Nexel Cardiosight-S, Cardiomyocytes | NEXEL | C-002 | |
| Optical Microscope | Nikon Ti2E | MEA54000 | |
| Pan Myosin Heavy Chain antibody | DSHB | MF-20 | |
| Poly(ethyleneimine) | Sigma | P3143 | |
| ROCK inhibitor | StemCell Technologies | Y-27632 | |
| RPMI | Gibco | 11875-093 | |
| Skeletal Muscle Growth Medium (SkGM-2) | Lonza | CC-3245 | |
| Standard 24-well plates | Greiner | M8812 | Other manufacturer's plates will not fit |
| Standard 6-well plates | ThermoFisher | 140675 | |
| Stromal medium (DMEM + 20% FBS) | |||
| T175 Filter Flask | ThermoFisher | 159910 | |
| T225 Filter Flask | ThermoFisher | 159934 | |
| Thrombin | Sigma | T4648 | |
| Trypan Blue solution, 0.4% | ThermoFisher | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Scientific | A1217702 | |
| TrypLE Select Enzyme (1x) | Thermo Scientific | 12563011 |
Referências
- Sharma, A., Wu, J. C., Wu, S. M. Induced pluripotent stem cell-derived cardiomyocytes for cardiovascular disease modeling and drug screening. Stem Cell Research & Therapy. 4, 150 (2013).
- Mudera, V., Smith, A. S. T., Brady, M. A., Lewis, M. P. The effect of cell density on the maturation and contractile ability of muscle derived cells in a 3D tissue-engineered skeletal muscle model and determination of the cellular and mechanical stimuli required for the synthesis of a postural phenotype. Journal of Cellular Physiology. 225 (3), 646-653 (2010).
- Vandenburgh, H., et al. Tissue-engineered skeletal muscle organoids for reversible gene therapy. Human Gene Therapy. 7 (17), 2195-2200 (1996).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nature Communications. 9 (1), 126 (2018).
- Fleming, J. W., et al. Bioengineered human skeletal muscle capable of functional regeneration. BMC Biology. 18 (1), 145 (2020).
- Madden, L., Juhas, M., Kraus, W. E., Truskey, G. A., Bursac, N. Bioengineered human myobundles mimic clinical responses of skeletal muscle to drugs. eLife. 4, 04885 (2015).
- Urciuolo, A., et al. Engineering a 3D in vitro model of human skeletal muscle at the single fiber scale. PLOS One. 15 (5), 0232081 (2020).
- Afshar, M. E., et al. A 96-well culture platform enables longitudinal analyses of engineered human skeletal muscle microtissue strength. Scientific Reports. 10, 6918 (2020).
- Sakar, M. S., et al. Formation and optogenetic control of engineered 3D skeletal muscle bioactuators. Lab on a Chip. 12 (23), 4976-4985 (2012).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Khodabukus, A., Baar, K. Defined electrical stimulation emphasizing excitability for the development and testing of engineered skeletal muscle. Tissue Engineering Part C: Methods. 18 (5), 349-357 (2011).
- Vandenburgh, H., et al. Drug-screening platform based on the contractility of tissue-engineered muscle. Muscle & Nerve. 37 (4), 438-447 (2008).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Enineering Part C Methods. 22 (10), 932-940 (2016).
- Smith, A. S. T., et al. High-throughput, real-time monitoring of engineered skeletal muscle function using magnetic sensing. bioRxiv. , 492879 (2022).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Hinds, S., Bian, W., Dennis, R. G., Bursac, N. The role of extracellular matrix composition in structure and function of bioengineered skeletal muscle. Biomaterials. 32 (14), 3575-3583 (2011).
- Carvalho, C., et al. Doxorubicin: the good, the bad and the ugly effect. Current Medicinal Chemistry. 16 (25), 3267-3285 (2009).
- Ahmad, T., et al. Cardiac dysfunction associated with a nucleotide polymerase inhibitor for treatment of hepatitis C. Hepatology. 62 (2), 409-416 (2015).
- Gill, M., et al. From the cover: Investigative nonclinical cardiovascular safety and toxicology studies with BMS-986094, an NS5b RNA-dependent RNA polymerase inhibitor. Toxicological Sciences. 155 (2), 348-362 (2017).
- Ostap, E. M. 2,3-Butanedione monoxime (BDM) as a myosin inhibitor. Journal of Muscle Research and Cell Motility. 23 (4), 305-308 (2002).
- Fryer, M. W., Gage, P. W., Neering, I. R., Dulhunty, A. F., Lamb, G. D. Paralysis of skeletal muscle by butanedione monoxime, a chemical phosphatase. Pflügers Archiv: European Journal of Physiology. 411 (1), 76-79 (1988).
- Fleming, J. W., et al. Functional regeneration of tissue engineered skeletal muscle in vitro is dependent on the inclusion of basement membrane proteins. Cytoskeleton. 76 (6), 371-382 (2019).
- Capel, A. J., et al. Scalable 3D printed molds for human tissue engineered skeletal muscle. Frontiers in Bioengineering and Biotechnology. 7, 20 (2019).
- Tsui, J. H., et al. Tunable electroconductive decellularized extracellular matrix hydrogels for engineering human cardiac microphysiological systems. Biomaterials. 272, 120764 (2021).
- Tsui, J. H., et al. Conductive silk-polypyrrole composite scaffolds with bioinspired nanotopographic cues for cardiac tissue engineering. Journal of Materials Chemistry B. 6 (44), 7185-7196 (2018).
- Gabella, G. Muscle cells, nerves, fibroblasts and vessels in the detrusor of the rat urinary bladder. Journal of Smooth Muscle Research. 55, 34-67 (2019).
- Christov, C., et al. Muscle satellite cells and endothelial cells: close neighbors and privileged partners. Molecular Biology of the Cell. 18 (4), 1397-1409 (2007).
- Bersini, S., et al. Engineering an environment for the study of fibrosis: A 3D human muscle model with endothelium specificity and endomysium. Cell Reports. 25 (13), 3858-3868 (2018).
- Gilbert-Honick, J., et al. Engineering functional and histological regeneration of vascularized skeletal muscle. Biomaterials. 164, 70-79 (2018).
- Maffioletti, S. M., et al. Three-dimensional human iPSC-derived artificial skeletal muscles model muscular dystrophies and enable multilineage tissue engineering. Cell Reports. 23 (3), 899-908 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados