Method Article
Ölçeklenebilir 3D Mühendislik Kas Dokularında Preklinik İlaç Testi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, 3D mühendislik ürünü kalp ve iskelet kası dokularının oluşturulması için yöntemler sağlar ve klinik öncesi ilaç tarama modalitelerinde kullanımlarını açıklar. Açıklanan yöntemler, 24 dokunun paralel olarak eşzamanlı olarak değerlendirilmesini kolaylaştırmak için manyetik bir algılama sistemi kullanır.
Özet
Sağlıklı ve hastalık durumlarının in vitro olarak doğru bir şekilde modellenmesi, yeni tedavi stratejilerinin ve terapötiklerin geliştirilmesi için hayati öneme sahiptir. Kardiyak ve iskelet kası hastalıkları için, kontraktil kuvvet ve kinetik, kas fonksiyonunu değerlendirmek için anahtar metrikleri oluşturur. İndüklenmiş pluripotent kök hücrelerden mühendislik kas dokuları (EMT'ler) üretmek için yeni ve geliştirilmiş yöntemler, in vitro hastalık modellemesini kasılma dokuları için daha güvenilir hale getirmiştir; Bununla birlikte, askıya alınmış hücre kültürlerinden dokuları çoğaltmak ve kontraktilitelerini ölçmek zordur. Bu tür teknikler genellikle yüksek arıza oranlarıyla boğuşur ve karmaşık enstrümantasyon ve özelleştirilmiş veri analizi rutinleri gerektirir. 3D EMT'leri etiketsiz, son derece paralel ve otomasyon dostu bir sözleşmelilik testi ile birlikte kullanan yeni bir platform ve cihaz, bu engellerin çoğunu aşıyor. Platform, neredeyse tüm hücre kaynaklarını kullanarak 3D EMT'lerin kolay ve tekrarlanabilir bir şekilde üretilmesini sağlar. Doku kontraktilitesi daha sonra karmaşık yazılım analiz rutinlerine ihtiyaç duymadan 24 dokuyu aynı anda ölçen bir cihazla ölçülür. Cihaz, kuvvetteki mikronewton değişikliklerini güvenilir bir şekilde ölçebilir ve bir ilacın veya terapinin kontraktil çıktı üzerindeki etkisini ölçmek için doza bağımlı bileşik taramasına izin verir. Bu cihazla yapılan mühendislik dokuları tamamen işlevseldir, elektriksel stimülasyon üzerine seğirme ve tetanik kasılmalar üretir ve haftalar veya aylar boyunca kültürde uzunlamasına analiz edilebilir. Burada, beklenmedik kardiyotoksisiteye bağlı hasta ölümlerinden sonra klinik çalışmalardan alınan bir ilaç (BMS-986094) da dahil olmak üzere, bilinen toksik maddelerle akut ve kronik dozlama altındaki kalp kası EMT'lerinden elde edilen verileri gösteriyoruz. Bir miyozin inhibitörü ile tedaviye yanıt olarak mühendislik dokularında değişmiş iskelet kası fonksiyonu da sunulmaktadır. Bu platform, araştırmacının karmaşık, bilgi açısından zengin biyomühendislik model sistemlerini, gereken minimum ek eğitim veya beceri ile ilaç keşif iş akışına entegre etmesini sağlar.
Giriş
İndüklenmiş pluripotent kök hücre (iPSC) modelleri, terapötik keşif ve geliştirme için klinik öncesi boru hattında ve ayrıca temel biyolojik araştırma ve hastalık modellemesindegiderek daha önemli oyuncular haline gelmektedir 1,2,3,4,5. iPSC'lerden türetilen kalp ve iskelet kası gibi kontraktil dokular, in vitro çalışmaların öngörücü gücünü geliştirmek için büyük bir potansiyele sahiptir, çünkü kas kontraktil kuvvetinin ve kinetiğin doğrudan değerlendirilmesi, genel doku fonksiyonunu incelemek için nicel metriklerdir 4,6,7,8. Tipik olarak, kontraktil kuvvet ölçümleri ya substrat saptırma 9,10'un optik izlenmesiyle dolaylı olarak ya da doğrudan hücrelerin / dokuların bir kuvvet dönüştürücü 4,11,12'ye bağlanmasıyla elde edilmiştir. Bu yöntemler, doğru olmakla birlikte, doğası gereği düşük verimlidir ve genellikle yüksek vasıflı operatörlerin veri toplamasını ve analiz etmesini gerektirir.
Önceki çalışmalar, manyetik alan algılamanın bu engelleri aştığını ve birden fazla doku yapısında aynı anda mühendislik kas fonksiyonunu değerlendirmek için alternatif bir yöntem sağladığını göstermiştir13. Mantarray (eNgineered Tissue ARRAY için Manyetometrik Analizör) 3D Kasılma Platformu, mühendislik kas dokularının kontraktilitesini yüksek oranda paralel bir şekilde ölçebilen ve daha yüksek verimli tarama14 ile 3D hücresel modellerin karmaşıklığından yararlanan bir cihaz kullanarak bu teknolojiye dayanmaktadır. Platform, standart bir hücre kültürü inkübatörünün içindeki veya dışındaki kalp ve iskelet kası dokularındaki kontraktil fonksiyonun etiketsiz, kantitatif, gerçek zamanlı olarak izlenmesini sağlayarak optik tabanlı kasılma görüntüleme ve analiz ihtiyacını ortadan kaldırır. Bu teknoloji, sağlıklı ve hastalıklı hücre hatlarının doğrudan karşılaştırılmasını kolaylaştırır ve bir ilacın kontraktil dokular üzerindeki etkisinin ölçülmesini sağlayarak yeni ve mevcut terapötik bileşikler için ölçülebilir, in vitro, güvenlik ve etkinlik verileri oluşturur.
Tasarlanmış 3D kas dokuları, Mantarray sarf malzemesi, 24 kuyucuklu döküm plakası kullanılarak iki direk arasında yüksek oranda tekrarlanabilir bir şekilde üretilebilir (Şekil 1). Bir direk sert, diğer direk esnek ve küçük bir mıknatıs içeriyor. Doku yapısı büzüldüğünde, esnek direğin ve gömülü mıknatısın yerini alır. EMT plakası cihazın içine yerleştirilir ve yer değiştirme sonrası, plaka tutucunun altındaki bir devre kartı üzerindeki bir dizi manyetik sensör aracılığıyla ölçülür. Manyetik alanda ölçülen değişiklikler, matematiksel bir algoritma kullanılarak mutlak kontraktil kuvvete dönüştürülür. Cihaz, büzülme frekansı, hız ve bozunma süresi de dahil olmak üzere test edilen hücre tiplerinin fonksiyonel kapasitesi ve olgunluğu hakkında ayrıntılı bilgi toplanmasını sağlamak için hızlı veri örnekleme hızları kullanır. Bu fonksiyonel ölçümler, manyetik algılama platformu ile aynı anda veya geleneksel optik yöntemler kullanılarak ayrı ayrı ve sıralı olarak 24 kuyunun tamamında elde edilebilir.
Bu çalışma, fibrin bazlı bir hidrojelde 3D iskelet kası ve kalp mikrodokularının mühendisliği için oldukça tekrarlanabilir bir yöntemi açıklamaktadır. Kısa, 80 dakikalık bir reaksiyon sırasında, trombin fibrinojen in dönüşümünü katalize eder ve kas hücrelerinin askıya alınmış kültür15'te gelişmesi için bir iskele sağlar. Stromal hücreler matrisin yeniden şekillendirilmesine yardımcı olur ve kas hücreleri hidrojel içinde bir sinsityum oluşturduğundan dokular kasılmaya başlar. Bu dokuların kontraktilitesi, bileşik maruziyetinden önce ve sonra manyetik algılama yaklaşımı kullanılarak analiz edildi ve doz-yanıt ilaç çalışmalarında kullanılmak üzere bu modaliteyi doğruladı. Sağlıklı bir donör biyopsisinden elde edilen birincil insan miyoblastları ticari olarak elde edildi ve satıcının protokollerine göre 2D olarak kültürlendi. Hücreler, 3D dokuları üretmek için yeterli hücre sayıları üretmek için üç pasaj boyunca bir iskelet kası büyüme ortamı kullanılarak genişletildi. Stromal hücreler ve hiPSC türevi kardiyomiyositler, hücreleri dokulara dökmeden önce kriyoprezervasyondan iyileşmeye izin vermek için 3 gün boyunca satıcının protokolüne göre kültürlendi. Manyetik algılama platformu kullanılarak toplanabilecek veri setlerinin türlerini gösteren temsili sonuçlar verilmiştir. Bu yöntemleri kullanarak mühendislik dokularının üretilmesiyle ilgili yaygın tuzaklar da ele alınmaktadır.
Protokol
1. Hücre kültürü protokolü
- Birincil insan miyoblast kültürü
- Hücre dışı matrisi (ECM) buz üzerinde 8 mL DMEM/F12 ortamında 1:100 oranında seyreltin.
- Bir T175 şişesine 8 mL ECM çözeltisi uygulayın ve hücre tohumlamadan önce en az 1 saat boyunca 37 ° C'de inkübe edin, ancak en fazla 24 saat inkübe edin. ECM çözeltisinin tüm şişe tabanını kapladığından emin olun.
- İskelet kası büyümesinin 5 mL'lik bir Aliquot'u, 15 mL'lik bir konik tüpe kadar.
- Dondurulmuş bir şişe hücreyi (5.0 x 105 miyoblast) 37 ° C'de bir su banyosunda 2 dakika boyunca veya buz eriyene kadar çözün. Şişeye% 70 etanol püskürtün ve bir biyogüvenlik kabinine (BSC) aktarın.
- Bir P1000 kullanarak hücreleri aliquoted ortama aktarın. Triturasyon yapmayın. Hücreleri 3 dakika boyunca 300 x g'de santrifüj yapın.
- Süpernatantı aspire edin ve tek bir hücre süspansiyonu elde etmek için bir P1000 pipet kullanarak büyüme ortamının 1 mL'sindeki hücreleri yeniden askıya alın.
- ECM kaplı şişeyi 15 mL DPBS ile yıkayın. DPBS'yi aspire edin ve ardından şişeye 30 mL büyüme ortamı ekleyin.
- Hücrelere 4 mL büyüme ortamı ekleyin, hücre süspansiyonunu karıştırın ve T-175 şişesine dağıtın. Toplam hacmin 35 mL olduğundan emin olun. Şişe yüzeyindeki hücrelerin eşit dağılımını sağlamak için şişeyi çalışma yüzeyi boyunca yavaşça sola ve sağa 5-6 kez kaydırın, ardından 5-6 kez ileri ve geri kaydırın.
- T-175 şişesini 37 ° C'de ve% 5 CO2'de bir hücre kültürü inkübatörüne yerleştirin. Hücreleri 3 gün boyunca veya% 70'ten fazla akıcılığa ulaşmayana kadar kültürleyin ve ardından hücreleri geçirin.
- Pasajlı birincil insan miyoblastları
- ECM'yi buz üzerinde 30 mL DMEM/F12 ortamında 1:100 oranında seyreltin.
- Üç T225 şişesine 10 mL ECM çözeltisi uygulayın ve hücre tohumlamadan önce en az 1 saat boyunca 37 ° C'de inkübe edin, ancak en fazla 24 saat inkübe edin. ECM çözeltisinin tüm şişe tabanını kapladığından emin olun.
- Hücreleri 15 mL DPBS ile yıkayın. Aspire edin ve satıcının protokolüne göre ayrışma reaktifini ekleyin.
- Hücreler kaldırıldıktan sonra, satıcının protokolüne göre reaksiyonu durdurun ve hücreleri konik bir tüp halinde toplayın. Hücreleri 3 dakika boyunca 300 x g'de santrifüj yapın.
- Süpernatantı aspire edin ve tek bir hücre süspansiyonu elde etmek için bir P1000 pipet kullanarak büyüme ortamının 1 mL'sindeki hücreleri yeniden askıya alın.
- ECM kaplı şişeyi 15 mL DPBS ile yıkayın. DPBS'yi aspire edin ve ardından her T225 şişesine 40 mL büyüme ortamı ekleyin.
- Hücre süspansiyonuna 14 mL büyüme ortamı ekleyin, karıştırın ve her T225 şişesine 5 mL'lik hücre süspansiyonunu dağıtın. Her şişedeki toplam hacmin 45 mL olduğundan emin olun. Eşit dağılımı sağlamak için şişeyi çalışma yüzeyi boyunca yavaşça sola ve sağa 5-6 kez, ardından 5-6 kez ileri ve geri kaydırın.
- Şişeleri hücre kültürü inkübatörüne 37 ° C'de ve% 5 CO2'ye yerleştirin.
- Kültür hücreleri 2-3 gün boyunca veya% 70'ten fazla bir akıcılığa ulaşmayana kadar ve sonra geçer. Hücreleri her geçişte 1:3 veya 1:4'te bölün ve 3 x 103 ile 1 x 104 hücre/cm2 arasında tohumlayın.
- hiPSC kaynaklı kardiyomiyosit kültürü
- ECM'yi buz üzerinde 12 mL DMEM/F12 ortamında 1:60 oranında seyreltin.
- İki adet 6 delikli plakanın her bir kuyucuğuna 1 mL ECM çözeltisi uygulayın ve hücre tohumlamasından önce en az 1 saat boyunca 37 ° C'de inkübe edin, ancak en fazla 24 saat.
- Dondurulmuş bir kardiyomiyosit şişesini 37 ° C'de bir su banyosunda 2 dakika boyunca veya buz eriyene kadar çözün.
- Şişeye% 70 etanol püskürtün ve BSC'ye aktarın.
- Çözülmüş hücreleri 50 mL'lik konik bir tüpe aktarmak için bir p1000 pipet kullanın.
- Kalan hücreleri geri kazanmak için boş kriyovyali 1 mL oda sıcaklığı (RT) kaplama ortamı ile durulayın.
- 1 mL durulama ortamını damla damla (her 5 saniyede bir damla) 90 sn boyunca hücrelerin konik tüpüne yavaşça dağıtın. Yavaş ortam ekleme sırasında hücreleri karıştırmak için tüpü sürekli döndürün.
- 50 mL'lik konik hücre tüpüne 10 mL'lik bir serolojik pipet kullanarak 8 mL'lik kaplama ortamını yavaşça ekleyin.
- Tüm ortamlar dağıtıldıktan sonra, hücreleri iyice karıştırmak için yavaşça yukarı ve aşağı 3 kez pipet yapın. Bir hemasitometre ve tripan mavisi kullanarak hücreleri sayın.
- 50 mL konik tüpteki hücreleri 3 dakika boyunca 300 x g'de santrifüj edin.
- Hücreler peletlendikten sonra, süpernatanı aspire edin.
- Kaplama ortamının 1 mL'sini tüpe aktarmak için bir p1000 pipet kullanın ve 3-5 kez yavaşça yukarı ve aşağı pipetle çekerek peleti yavaşça parçalayın. Hücreleri ek bir kaplama ortamı ile yeniden askıya alın.
- Kaplama ortamının 2 mL'sinde 6 kuyucuklu bir plakanın kuyusu başına 2-4 x 106 hücre arasında tohumlayın.
- ECM kaplı 6 delikli plakaları DPBS (2 mL/kuyu) ile yıkayın.
- Pipet, 6 kuyucuklu bir plakanın kuyusu başına 2 mL hücre süspansiyonu. Plaka yüzeylerindeki hücrelerin eşit dağılımını sağlamak için plakaları çalışma yüzeyi boyunca yavaşça sola ve sağa 5-6 kez sola ve sağa hareket ettirin, ardından 5-6 kez ileri ve geri hareket ettirin.
- Plakayı hücre kültürü inkübatörüne 37 ° C'de ve% 5 CO2'ye yerleştirin.
- Çözülecek hücrelerin tüm şişeleri için 1.3.3-1.3.16 arasındaki adımları yineleyin.
- Kaplamadan sonraki ertesi gün bakım ortamının 3-5 mL'sine (hücre hattına ve yoğunluğuna bağlı olarak) değiştirin ve ardından ortamı her iki günde bir değiştirin. 3D dokulara dökülmeden önce 3-4 gün boyunca kültür hücreleri.
- Stromal hücre kültürü
- Bir T175 şişesine 30 mL ECM çözeltisi uygulayın ve hücre tohumlamadan önce en az 1 saat boyunca 37 ° C'de inkübe edin, ancak en fazla 24 saat inkübe edin.
- Aliquot 5 mL stromal hücre ortamı 15 mL konik tüp içine.
- Dondurulmuş bir stromal hücre şişesini 37 ° C'de bir su banyosunda 2 dakika boyunca veya buz eriyene kadar çözün.
- Şişeye% 70 etanol püskürtün ve BSC'ye aktarın.
- Şişedeki çözülmüş hücrelere stromal hücre ortamının 1 mL'sini yavaşça eklemek için bir p1000 pipet kullanın.
- Hücre süspansiyonunu şişeden konik tüpteki kalan çözülme ortamına aktarın. Hücreleri karıştırmak için 5 mL'lik bir serolojik pipet kullanın. Pipetleri 3 kez yukarı ve aşağı doğru çevirin.
- Bir hemasitometre ve tripan mavisi kullanarak hücreleri sayın. Hücreleri aşağı çevirmeyin.
- ECM kaplı T175 şişeyi 15 mL DPBS ile yıkayın.
- Stromal hücreleri şişeye 3-4 x 103 hücre/cm2 yoğunlukta aktarın. Şişe yüzeyindeki hücrelerin eşit dağılımını sağlamak için şişeyi çalışma yüzeyi boyunca yavaşça sola ve sağa 5-6 kez kaydırın, ardından 5-6 kez ileri ve geri kaydırın.
- Ertesi gün 45 mL ısıtılmış stromal hücre ortamı ile medyayı değiştirin. 3D dokulara dökülmeden önce hücreleri 3-4 gün boyunca kültürleyin.
2. Malzeme hazırlama
- Fibrinojen
NOT: Fibrinojen yeniden yapılandırılırken, fibrinojen tozunun katmanlandığı yüzey alanı miktarını en üst düzeye çıkarmaya dikkat edin. Bu protokolde, kullanılan seyreltici miktarı, kullanılan kabın boyutuna göre optimize edildi, yani kabın tabanını örtmek için yeterli seyreltici kullanıldı. Örneğin, 50 mL'lik bir santrifüj tüpü yerine 100 mm'lik bir kapta 10 mL PBS'nin üzerinde 0,5 g fibrinojen tabakası. Seyrelticinin yüzey alanı miktarını en üst düzeye çıkarmak, fibrinojen yeniden oluşturmak için gereken süreyi azaltacak ve proteinin potansiyel kümelenmesini azaltacaktır.- Yeniden yapılanma
- 10 mL PBS'yi 100 mm'lik bir hücre kültürü kabına aktarın ve bir hücre kültürü inkübatöründe 37 ° C'ye ısıtın.
- Sıcak PBS'nin tüm yüzeyi üzerinde 0.5 g fibrinojen tozu tabakası ve fibrinojen tamamen çözünene kadar 37 ° C'de tutun. Bu 2 saatten fazla sürmemelidir. Çözünen toz hafifçe döndürülebilir, ancak çanağı kuvvetlice sallamayın.
- Steril filtrasyon
- Toz tamamen çözündükten sonra, çözeltiyi 100 μm'lik bir filtreden geçirin ve jelleşmiş fibrinojen kümelerini çıkarmak için 50 mL'lik bir konik tüp içinde toplayın.
- Filtrelenmiş çözeltiyi, 0,2 μm'lik bir filtreyle kaplanmış 10 mL'lik bir şırıngaya dökün. Çözeltiyi filtreden geçirin ve yeni bir 50 mL konik tüp içinde toplayın. 10 mL'lik çözeltinin tamamını sterilize etmek için filtrenin birden fazla kez değiştirilmesi gerekebilir.
- Aliquot 300 mL steril fibrinojen 1.5 mL mikrosantrifüj tüplere ve -20 ° C'de saklayın. Alikotları buz üzerinde veya gerektiğinde 4 ° C'de çözün. Tekrarlanan donma/çözülmelerden kaçının.
- Yeniden yapılanma
- Trombin
- 100 U/mL trombin stok çözeltisi oluşturmak için 6 mL PBS ve 4 mL diH2O doğrudan bir şişe trombin (1 KU) ekleyin.
- Filtre, 0,2 μm filtre, aliquot ile sterilize edin ve -20 °C'de 1,5 mL plastik mikrosantrifüj tüplerinde trombin cama adsorbe olarak saklayın. Tekrarlanan donma/çözülmelerden kaçının.
- Poli(etilenimin) çözeltisi (PEI)
DİKKAT: PEI toksiktir. Üretici tarafından belirlenen uygun KKD'yi kullanın.
NOT: PEI, %50 w/v çözeltisi olarak tedarik edilir. Son derece viskozdur ve pipet uygulaması zordur. Doğrudan %50 w/v çözeltisinden değil, %10'luk bir stok çözeltisinden %0,1'lik bir çözüm üretin.- 50 mL'lik konik bir tüpte 5 mL'lik %50 w/v PEI çözeltisi ölçün.
- 20 mL diH2O ekleyin ve% 10'luk bir stok çözeltisi elde etmek için karıştırın. Bu yüksek konsantrasyonlu stok çözeltisi steril filtrelenemez.
- Hücre kültürü için %0,1'lik bir çözelti oluşturmak için, 500 mL'lik bir filtre şişesi kullanarak 495 mL diH2O. Steril filtreye 5 mL'lik %10'luk bir stok ekleyin ve RT'de 1 haftadan fazla olmamak üzere saklayın.
- Glutaraldehit
DİKKAT: Glutaraldehit toksiktir. Üretici tarafından belirlenen uygun KKD'yi kullanın.- Glutaraldehit% 25'lik bir çözelti olarak verilir. % 0.01'lik bir çözelti oluşturmak için, 99.6 mL'ye 40 μL diH2O. Steril filtre ekleyin ve 1 haftadan fazla olmamak üzere 4 ° C'de saklayın.
- Hazırlık sonrası
- Sarf malzemesi doku döküm kitini steril bir kültür davlumbazının içine yerleştirin. Döküm kiti bir kapak, 24 çift direk tutan bir direk kafesi (24 delikli bir plakanın kuyusu başına bir çift direk) ve 24 döküm kuyusu içeren özel bir 24 delikli plaka tabanı içerir. Her döküm kuyusu, hücre/hidrojel bileşenlerini tutmak ve hidrojel polimerize olurken bunları tüp şeklinde bir dokuya kalıplamak için kuyunun dibinde bir hendek içerir (Şekil 1B).
- 24 delikli bir plakanın kuyularını% 0,1'lik bir PEI çözeltisinin 1,5 mL/kuyucuğu ile doldurun ve her bir direk çiftinin uçları suya batırılacak şekilde plakaya direkler yerleştirin. PEI, direkler üzerinde pozitif bir yük biriktirir, böylece hidrojeldeki proteinler doku dökümü sırasında direklere sıkıca yapışır.
- İkinci bir 24 delikli plakanın kuyularını 2 mL / kuyucuk steril diH2O ile doldurun ve direkleri aktarın. 1 dakika bekletin.
- Üçüncü bir 24 delikli plakada, kuyucukları 1,5 mL / kuyucuk% 0,01 glutaraldehit (GA) ile doldurun ve direkleri aktarın. 30 dakika bekletin. GA, PEI'den direklere pozitif yükü sabitleyecektir.
- Direkler glutaraldehit içinde otururken, diH 2 O kuyucuklarını aspire edin, 2 mL / steril diH 2 O kuyusu ile yıkayın, aspire edin ve2mL / steril diH2O kuyusu ile doldurun. Durulama yerine taze, 24 delikli bir plaka kullanılabilir.
- 30 dakika dolduğunda, direkleri steril diH 2 O'nun2mL / kuyucuğuna aktarın. 1 dakika bekletin.
- diH 2 O'yuaspire edin ve 2 mL / kuyucuk daha steril diH2O ekleyin. 5 dakika bekletin.
- Direkleri kuruması için 24 delikli bir plakaya aktarın (yaklaşık 15 dakika).
- Kuruduktan sonra, döküm Kitini yeniden monte edin. Kapağı ve plakayı birbirine kapatmak için kenarları parafilm haline getirin ve daha sonra hücre tohumlamadan önce 72 saate kadar 4 ° C'de saklayın. Daha uzun depolama süreleri muhtemelen mümkündür, ancak test edilmemiştir.
3. Doku döküm protokolü
- Döküm plakası hazırlama
- Doku döküm kitini 4 °C'de önceden soğutun.
- BSC'ye bir kova buz aktarın. Buz üzerinde, dökülecek kuyucuk başına 50 μL trombin çözeltisi (3 μL trombin stoğu + 47 μL EMT ortamı) hazırlayın.
NOT: EMT ortamıyla ilgili ayrıntılar için adım 3.2.1'e bakın. - Soğutulmuş döküm kitini buzdolabından çıkarın ve hücre kültürü davlumbazının içindeki soğuk bir bloğa veya buza yerleştirin. Döküm plakasını düz bir şekilde buzun üzerine yerleştirin ve post kafesi döküm plakasından yeni, steril 24 delikli bir plakaya taşıyın.
- Pipet, döküm plakasının önceden soğutulmuş her bir kuyucuğuna 50 μL trombin çözeltisi verir.
- Kiti yeniden monte edin ve doku dökümü için gerekli olana kadar buzdolabına geri koyun. Dokuları kuyucuklara ek olarak trombinden 3 saat içinde dökün.
- Hücre hazırlığı
- EMT baz ortamını, steril filtreyi hazırlayın ve buz üzerinde bırakın.
NOT: Hücreye özgü döküm ortamı FBS içeriyorsa, fibrinojen ile etkileşime girebileceği ve erken polimerizasyona neden olabileceği için ısıda inaktive edilmiş FBS kullanın.- Kardiyak EMT ortamı hazırlayın: 500 mL RPMI ortamı, 10 mL B27 ve 2.5 g aminokaproik asit ekleyin. (İsteğe bağlı) 10 mM ROCK inhibitörü ekleyin (500 mL hacminin tamamını değil, sadece dokuları dökmek için kullanılan EMT ortamına ekleyin).
- İskelet EMT ortamını hazırlayın: Birincil EMT'ler için 50 mL F10 ortamı ve 0.25 g aminokaproik asit (ACA) ve iPSC türevi EMT'ler için 0.1 g ACA ekleyin.
- Hücre kültürü sınıfı ayrışma reaktifini 37 °C'ye ısıtın. Ayrışma reaktifini seyreltmek için eşit miktarda EMT ortamını ısıtın.
NOT: Kullanılan proteazın tamamen inaktive edilmesi çok önemlidir. Aktif proteaz, 3D doku oluşumuna ve postveransa müdahale edecektir. - Hücreleri (Şekil 1A) PBS ile yıkayın. 6 delikli bir plaka için 2 mL/kuyu kullanın. 100 mm'lik bir çanak, T175 şişe ve T225 şişe için sırasıyla 6 mL, 15 mL ve 15 mL kullanın.
- Hücreleri kaldırmak için ısıtılmış hücre kültürü sınıfı ayrışma reaktifini ekleyin ve 5 dakika boyunca veya hücreler kalkana kadar 37 ° C'de inkübe edin. Kardiyak kültürler için, 10x ayrışma reaktifini kullanın. Stromal hücreler ve iskelet kası miyoblastları için, 1x ayrışma reaktifi kullanın. 6 delikli bir tabak için 1 mL/kuyucuk, 100 mm'lik bir tabak için 3 mL, T175 şişe için 8 mL ve T225 şişe için 10 mL kullanın.
- Plakanın yan tarafına dokunarak kültürleri her 2-3 dakikada bir kontrol edin.
- Hücreler kaldırıldıktan sonra, bunları 50 mL'lik bir konik tüpe aktarın ve tek hücreli bir süspansiyon sağlamak için bir P1000 pipetle tritüre edin.
- Kalan hücreleri toplamak ve konik tüpe eklemek için plakayı veya şişeyi ek bir EMT ortamı ile yıkayın. 6 delikli bir tabak için EMT ortamının 1 mL/kuyucuğunu, 100 mm'lik bir çanak için 2 mL'yi, T175 şişesi için 5 mL'yi ve bir T225 şişesi için 5 mL'yi kullanın.
- Tek bir hücre süspansiyonu sağlamak için hücreleri tritüre edin.
- Ayrışma işlemini sonlandırmak için EMT ortamı ekleyin ve ardından hücre sayımları için hücre süspansiyonlarının örneklerini alın. 6 delikli bir tabak için 1 mL/kuyucuk, 100 mm'lik bir tabak için 3 mL, T175 şişe için 8 mL ve T225 şişe için 10 mL kullanın.
- Hücreleri 4 dakika boyunca 200 x g'de döndürün. Süspansiyonlar santrifüjlenirken bir hemasitometre ve tripan mavisi kullanarak hücre sayımları yapın.
- Süpernatantı aspire edin ve artık ayrışma reaktifini çıkarmak için hücreleri 5 mL EMT baz ortamında yeniden askıya alın.
- Hücreleri 4 dakika boyunca 200 x g'de santrifüj yapın. Süpernatantı aspire edin ve hücre süspansiyonlarını uygun yoğunluklarda hazırlayın.
- EMT ortamı 14,16'da% 10-20% ECM proteinlerinin eklenmesiyle 3D iskelet kası EMT'lerinin ömrünü ve işlevini artırın.
- Tohum kök hücre kaynaklı kardiyomiyositler ve stromal hücreleri, doku başına sırasıyla 5 x 10 5 hücre ve7.5 x 104 hücre yapısıdır. İskelet kası miyoblastlarını doku yapısı başına 7.5 x 105 hücrede tohumlayın.
- Kardiyak dokular
- Süpernatantı aspire edin ve stromal hücreleri EMT ortamında mL başına 2.5 x 106 hücre yoğunluğunda yeniden askıya alın ve buza koyun. EMT başına bu süspansiyonun 30 μL'sini kullanın.
- Süpernatantı aspire edin ve CM'leri EMT ortamında mL başına 8.3 x 106 hücre yoğunluğunda yeniden askıya alın ve buza koyun. EMT başına bu süspansiyonun 60 μL'sini kullanın.
- İskelet kas dokuları
- Süpernatantı aspire edin ve iskelet kası hücrelerini EMT ortamında mL başına 8.3 x 106 hücre yoğunluğunda yeniden askıya alın ve buza koyun. EMT başına bu süspansiyonun 90 μL'sini kullanın.
- İstenilen doku sayısını oluşturmak için gereken her hücre çözeltisinin hacimlerini hesaplayın (örneğin, hazırlanan CM'lerin 60 μL'si ve hazırlanan stromal hücrelerin 30 μL'si veya EMT başına iskelet kası hücrelerinin 90 μL'si).
- Hesaplanan hücre hacimlerini 15 mL'lik bir konik tüpe pipetleyin.
- Hücre süspansiyonuna EMT başına 10 μL fibrinojen ekleyin ve buz üzerinde tutun.
- EMT başına toplam reaktifler ve hücre hacimleri: Her EMT'nin 90 μL hücre, 10 μL fibrinojen ve 50 μL trombin çözeltisine sahip olduğundan emin olun.
- EMT baz ortamını, steril filtreyi hazırlayın ve buz üzerinde bırakın.
- Doku dökümü
- Doku döküm kitini bir hücre kültürü başlığına aktarın ve kapağı çıkarın (esnek ve sert direkler içeren post kafes döküm plakasında kalmalıdır; Şekil 1B). Döküm plakasını post kafes ile buz üzerinde düz bir şekilde yerleştirin.
- Hücre/fibrinojen karışımını karıştırın ve bir P200 pipet ile 100 μL çekin.
- 50 μL trombin çözeltisi ile hazırlanan kuyucuklara 100 μL karışım ekleyin ve iyice karıştırmak için 5 kez tritüre edin. Pipetin ilk durağın ötesine itilmemesi ve herhangi bir kabarcık oluşmasını önlemek için tritürasyondan sonra ucu çıkarmayın.
- Bu aşamada ve post kafes döküm plakasından kaldırılmaya hazır olana kadar (adım 3.3.10), kafesin herhangi bir hareketi, dokunun direklere uzun süreli bağlanmasını tehlikeye atabilir. Kafesin herhangi bir hareketini önlemek için hem kafesi hem de döküm kuyusu plakasını aynı anda bir elin işaretçi parmağını ve başparmağını kullanarak tutun.
- Tüm dokular dökülene kadar her doku için taze bir P200 ucu ile tekrarlayın. Hücreler hızla yerleştikçe her dokuyu dökmeden önce hücre süspansiyonunu 15 mL'lik bir konik tüpte karıştırın.
- Tohumlu kiti dikkatlice inkübatöre aktarın, kafesi hareket ettirmediğinizden emin olun. Tohumlamadan sonra kafesin hareketi, dokuların döküm kuyularından aktarılmasında başarının azalmasına neden olabilir. Hücre tipine bakılmaksızın 80 dakika boyunca 37 ° C'de inkübe edin. Bu, hidrojelin polimerizasyonuna başlayacak ve proteinlerin direklere yapışmasına izin verecektir.
- Bu arada, kalp dokuları için EMT ortamının 2 mL / kuyucuğu ile taze bir 24 delikli plaka hazırlayın. İstenirse EMT ortamına 10 mM ROCK inhibitörü eklenebilir. Ortamı ısıtmak için plakayı 37 ° C'de inkübe edin.
- Birincil iskelet kası dokuları için 5 g / L aminokaproik asit (0.2 mm steril filtrelenmiş) veya iPSC türevi EMT'ler için 2 g / L ACA içeren 2 mL / kuyucuk büyüme ortamı hazırlayın. Ortamı ısıtmak için plakayı 37 ° C'de inkübe edin.
- Kuluçkadan sonra, döküm kuyularının kenarına yavaşça 1 mL EMT ortamı ekleyin ve hücre tipine bakılmaksızın 37 ° C'de 10 dakika daha inkübe edin. Bu, hidrojeli döküm kuyusunun kenarlarından çıkaracak ve dokunun kolay transferine izin verecektir.
- 10 dakika sonra, post kafesi dikkatlice kaldırın ve dokuları döküm plakasından orta dereceli hazırlanmış 24 delikli bir plakaya aktarın (Şekil 1C). Dokulu plakaları 37 °C'de hücre kültürü inkübatörüne geri getirin.
- Bakım
- 24 saat sonra, döküm dokuları EMT ortamının 2 mL / kuyucuğu (dahil edilmişse ROCK inhibitörü olmadan) içeren taze bir 24 delikli plakaya aktarın ve 37 ° C'de inkübe edin. İskelet kası hücreleri için, miyoblast füzyonunu teşvik etmek için büyüme ortamını farklılaşma ortamına geçirin.
- Kardiyak dokuları her 2-3 günde bir EMT ortamının 2 mL/kuyucuğu ile taze kuyucuklara aktarın.
- İskelet kası dokularını her 2-3 günde bir 5 g / L Aminokaproik asit (0.2 mm steril filtrelenmiş) içeren 2 mL / kuyu farklılaşma ortamı ile taze kuyucuklara aktarın. iPSC türevi dokular için 2 g/L ACA kullanın.
- Orta dereceli değişikliklere yardımcı olmak için, 3D dokulara zarar vermemek için ortamı aynı plakada değiştirmek yerine post kafesi taze bir 24 delikli plakaya aktarın. EMT ortamı ile ikinci bir 24 delikli plaka hazırlayın ve dokuları taze ortama aktarın. Bir sonraki ortam değişimi için kullanmak üzere plakayı aktif kültürün yanında eski ortamla birlikte tutun. Post kafesi kültür dönemi boyunca iki plaka arasında ileri geri aktarın. Alternatif olarak, her ortam değişimi için taze bir plaka kullanın.
- EMT büzülmesini, sapma sonrası optik izleme (Şekil 1D) veya manyetik algılama donanımı13,14 ile ölçün. Kalp dokuları kültürde 3-4 gün sonra kendiliğinden atmaya başlar. İskelet kası dokuları tipik olarak kültürde 7 gün sonra elektriksel alan stimülasyonu ile kasılmaktadır.
Sonuçlar
Hücreler, 2 postlu sarf malzemesi plakasındaki mühendislik kas dokularına döküldü (Şekil 1). Başarılı EMT'ler tek tip görünecek ve matris direkler arasında eşit olarak dağıtılacaktır (Şekil 2A). Matris ayrıca her iki direğin etrafını sarmalı ve doku için eşdeğer bağlantı noktaları üretmelidir. Dökümdeki başarısızlıklar bu yöntemle nadirdir ve genellikle görsel bir inceleme ile belirgindir. Başarısız EMT üretimi, direklerden doku ayrılması gibi yıkıcı başarısızlıklardan (Şekil 2B), hava kabarcıkları ve direklere gevşek bağlanma gibi daha ince yapısal kusurlara (Şekil 2C, D) kadar değişebilir. Küçük kusurları olan dokular hala uygulanabilir olabilir, ancak bu dokulardan elde edilen veriler, ödün vermeyen EMT'lerle karşılaştırılabilir olduğundan emin olmak için dikkatlice incelenmelidir. Örneğin, bir EMT içindeki hava kabarcıkları, doku zamanla sıkıştıkça sıkılabilir ve bu da kontraktil eksiklikler olmadan tamamen işlevsel bir yapı oluşturur. Bununla birlikte, hava kabarcıklarının yeri fonksiyonel iyileşmeyi etkileyebileceğinden, bu dokular duruma göre değerlendirilmelidir. Örneğin, direklerde oluşan hava kabarcıkları, doku bağlanmasını etkileyebilir ve bu da direğe uzun süreli yapışmayı engelleyebilir.
Dokular ilk 24 saat içinde sıkışmaya başlar, çünkü hücreler hidrojel içindeki matrisi yeniden şekillendirir (Şekil 3). Sıkıştırma kademeli bir süreçtir ve genellikle kültürün ilk 2-4 haftasında ilerler. Genel olarak, doku sıkıştırması teknik ve biyolojik replikasyonlar arasında tutarlıdır (Şekil 4). Bazı hücre hatlarının, dokular zamanla olgunlaştıkça matrisi diğerlerinden daha fazla sıkıştırması normaldir. Bir yapı içindeki miyojenik hücrelerin yüzdesi, EMT sıkıştırma oranını ve genel derecesini etkiler. Hem kardiyak hem de iskelet kası hücre hatları için toplam miyojenik içerik, mühendislik dokuları arasındaki varyasyonu en aza indirmek için% 80'in üzerinde olmalıdır. Bu, hücre hatları boyunca kasılma kuvvetlerini ve kinetiği karşılaştırırken özellikle önemlidir.
Dökümden sonraki ilk birkaç gün içinde, kardiyomiyositler kültürde kendiliğinden atmaya başlar ve her kas kasılmasında esnek direği ritmik olarak büker. İskelet kası yapıları, farklılaşmaya başladıktan sonra 7. günde elektriksel stimülasyona yanıt olarak büzülür. Alan stimülasyonu, iskelet kası dokularına, özel bir 24 delikli elektrot kapağına tutturulmuş harici bir stimülatör aracılığıyla uygulandı. Her kuyucuk için bir çift karbon elektrot ile imal edilen kapak, 24 kuyucuklu doku plakasının üzerine oturur ve aynı anda her EMT'yi kas kasılmalarını tetiklemek için uyarır. Dokular, fonksiyonel ölçümler sırasında 1 Hz'de 10 ms darbe süreleri için 10 V'luk bir uyaran kullanılarak hızlandırıldı. Kasılma dokuları, fonksiyonel sarkomerler ve kontraktil makinelerle tamamlanmış miyotüpler oluşturan, kaynaşmış iskelet miyoblastlarını gösterir. İskelet EMT'leri miyozin ağır zinciri (MyHC) için pozitif boyanır ve distrofin miyotüp membranına lokalize olarak kesitsel immünohistokimyasal analizde klasik bir halka şekli ortaya çıkar (Şekil 5). EMT'ler işlevsel hale geldiğinde, kontraktilite, manyetik algılama cihazında günlük olarak ölçülebilir, yapılar zamanla geliştikçe ve olgunlaştıkça kuvvet ve kinetiği izleyebilir. Hem kalp hem de iskelet kası dokuları 3D kültürde haftalarca veya aylarca kasılmaya devam eder (Şekil 6) ve çok çeşitli kontraktilite çalışmaları için kullanılabilirler.
Manyetik algılama yaklaşımı, doksorubisin (Şekil 7) ve BMS-986094 (Şekil 8) gibi yapısal kardiyotoksikanların akut ve kronik etkilerini ve kas kontraktilitesini etkileyen diğer ilaçları aynı anda ölçmek için kullanılabilir. Kasılma tespitinin optik izleme yöntemleri de kullanılabilir, ancak ölçümler sırayla alınmalıdır, çünkü akut ilaç etkilerini incelerken dikkatli olunmalıdır. 3D kültürde kardiyak ve iskelet EMT'lerinin uzun ömürlü olması, bu dokularda uzun süreli ilaç çalışmalarına olanak sağlamaktadır. Bu, kullanıcıların tekrarlanan dozlamanın etkilerini keşfetmelerine ve ayrıca doksorubisin ile meydana geldiği gibi zamanla kardiyotoksik etkiler gösterebilecek bileşiklere uzun süreli maruz kalmalarına izin verir. Doksorubisin (dox) bir anti-kanser kemoterapi ilacıdır17. Hastalara uygulanan ilaç miktarı, kanser türüne, hastanın yaşına, hastanın boyuna ve kilosuna ve diğer faktörlere bağlı olarak değişir. Bu nedenle, dox'un etkisini çok çeşitli konsantrasyonlarda ve teslimat programlarında test etmek önemlidir. Burada, kardiyak EMT'ler 27 gün boyunca üç ayrı doks konsantrasyonu (0.1 μM, 1 μM ve 10 μM) ile tedavi edildi (Şekil 7). Gruplar, EMT'leri her konsantrasyonda bir bolus tedavisi veya her 72 saatte bir orta bir değişiklikle sürekli uygulama ile tedavi ederek daha da tabakalaştırıldı. Doks'un bolus tedavileri verilen kuyular, ilaca üç ayrı zaman noktasında maruz bırakıldı ve dozlama arasında iyileşmeye izin verildi. En yüksek iki bolus dozu ve sürekli maruziyet, çalışma boyunca kontraktil kuvvet üretiminin derhal ve uzun süreli bir şekilde durduğunu göstermiştir. Orta ve en düşük konsantrasyonların, uygulama yöntemine bağlı olarak dokular üzerinde değişen etkileri vardı. İlacın en düşük konsantrasyonunda, bolus grubu kontrollerden hiçbir fark göstermedi. Bununla birlikte, kasılma kuvveti 2 haftalık sürekli maruziyetten sonra azalmıştır. İlacın orta aralıklı konsantrasyonu ilginç bir etkiye sahipti. Sürekli dozlama, tedavinin ilk birkaç günü boyunca kuvveti azaltırken ve deney boyunca sürerken, bolus grubu, ilaç 3 gün sonra yıkandığında kontraktil kuvvetin kontrol seviyelerine geri kazanıldığını gösterdi. Bununla birlikte, ilacın ikinci bolusu kuvvetin tamamen durmasına neden oldu, ardından iyileşme olmadı (Şekil 7), bu konsantrasyonda tekrar tekrar dozlamanın bu ilaçla tedavi edilen hastalarda kardiyotoksik bir etkiye sahip olabileceğini gösteriyor. Bu çalışmanın geniş kapsamı, hem zaman hem de deneysel koşullarda, 3D mühendislik dokularının toksisite taramasındaki faydasını vurgulamaktadır, çünkü uzun süre boyunca kasılmaya ve kimyasal maruziyete duyarlı kaldıklarından, tek bir kas dokusu seti içinde uzun süreli ilaç çalışmalarına izin vermektedir. Bu sadece kronik maruziyet ile kardiyotoksik etkiye sahip olabilecek bileşiklerin tanımlanmasını değil, aynı zamanda potansiyel kardiyotoksik uygulama zamanlamasının tespit edilmesini de kolaylaştırır.
Mühendislik ürünü insan kas dokularında in vitro toksisite testi, klinik çalışmalarda insan hastalarını güvende tutmaya yardımcı olmanın bir yoludur. BMS-986094, hepatit C tedavisinde kullanılan bir nükleotid polimeraz (NS5B) inhibitörüdür. İlaç, Bristol-Myers Squibb'in18,19 hastalarında beklenmedik kalp yetmezliği vakaları nedeniyle gelişimini durdurduğunda Faz II klinik gelişimindeydi. Burada, BMS-986094, 3D mühendislik kas dokularının ilaca karşı kardiyotoksik bir reaksiyon geliştirip geliştirmeyeceğini test etmek için kardiyak EMT'lere uygulandı (Şekil 8). İlacın üç farklı konsantrasyonu uygulandı ve dokular 13 gün boyunca izlendi. Kasılma kuvveti, ilacın doza bağımlı bir şekilde eklenmesiyle düştü (Şekil 8A). Vuruş hızı yavaşladığı için Twitch sıklığı da önemli ölçüde etkilendi ve sonunda kardiyotoksik bileşiğe sürekli maruz kalma ile beklendiği gibi durdu (p < 0.05, Şekil 8B). Bu sonuçlar, 3D mühendislik ürünü insan kas dokularının piyasaya yeni ilaçlar getirmeyi kolaylaştırmak ve sonunda kardiyotoksisite nedeniyle başarısız olan bileşikleri işaretlemek için nasıl kullanılabileceğini göstermektedir. Dahası, bu teknoloji, tehlikeli ilaçları klinik çalışmalarda hastalara sunulmadan önce açığa çıkararak potansiyel olarak hayat kurtarabilir.
Akut ve kronik olarak uygulanan ilaçların insan kontraktil dokusu üzerindeki etkisini ölçme yeteneği, güvenlik ve etkinlik için terapötikleri araştırırken hayati bir ilk adımdır. Bununla birlikte, uygulanan ilaçların konsantrasyonunun fizyolojik olarak alakalı ve in vitro testler için uygun olduğunu bilmek önemlidir. İskelet kası dokuları, tam doz-yanıt eğrisinde 2,3-Bütandion monoksim (BDM) için bir IC50 değeri oluşturmak için kullanıldı. Bu ilaç, iskelet kası miyosin-II20'nin iyi karakterize edilmiş bir ATPaz inhibitörüdür. BDM, sarkomer21'de aktin filament ile miyozin çapraz köprü oluşumunu önleyerek kas kasılmalarını inhibe eder. Burada gösterilen sonuçlar, ilaç uygulandığında mutlak kuvvette doza bağlı bir azalma ve ilaç yıkandığında kontraktil kuvvetin tamamen geri kazanıldığını ortaya koymaktadır, bu da geçici etkinin sadece doku içindeki hücreleri öldürmek değil, kas kasılmalarını önlediğini göstermektedir (Şekil 9A). Ayrıca, incelenen yedi konsantrasyon boyunca tam bir doz-yanıt eğrisi ölçüldü ve bu insan mikrodokularında 3.2 mM'lik bir IC50 oluşturuldu (Şekil 9B).

Şekil 1: 2 postlu Mantarray sarf malzemesi 24 delikli plakada EMT dökümü . (A) Miyojenik ve stromal hücreler, doku dökümünden önce 2D yüzeylerde kültürlendi. (B) Hücreler 2B yüzeylerden kaldırılır ve girişte gösterilen bireysel plaka döküm kuyularında hidrojeller oluşturmak için hücre dışı matris proteinleri ile karıştırılır. (C) Her kuyuda mühendislik dokuları içeren 24 kuyucuklu plaka. (D) Manyetik direğin (yeşil çubuklar) yer değiştirmesini karşılaştıran, gevşemiş ve kasılmış mühendislik kası gösteren temsili dokular. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
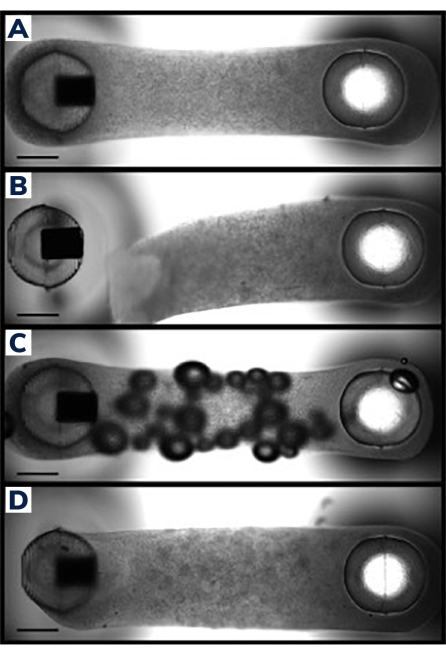
Şekil 2: Başarılı ve başarısız EMT dökümü . (A) İdeal mühendislik kas dokusu 24 saat döküm sonrası, doku boyunca homojen hücre / matris bileşimi ile direklerin etrafına düzgün bir şekilde sıkıştırılmıştır. (B) Hidrojelin esnek direkten ayrılmasını gösteren başarısız EMT. (C) Doku boyunca hava kabarcıkları içeren EMT. (D) Her iki direğin etrafında eşit olmayan doku birikimi. Doku, bir taraftaki esnek direğe gevşek bir şekilde sabitlenir. Ölçek çubukları 1 mm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
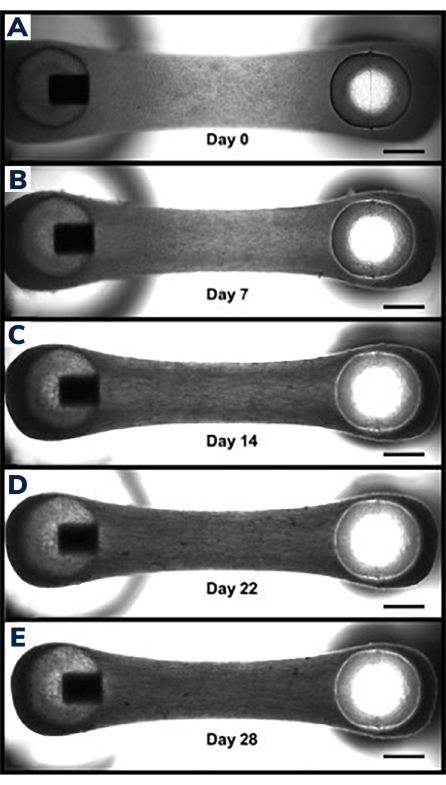
Şekil 3: Zamanla mühendislik kas dokusunda sıkıştırma. (A) EMT yapısı dökümden 1 gün sonra gösterilmiştir. Dokular, hücre füzyonu ve hidrojel sıkıştırmasının 0. gününden başlayarak farklılaşma ortamına aktarılır. (B-E) 7. günden 21. güne kadar aynı EMT, zaman içinde iki gönderi arasında biraz daha kısa bir toplam uzunluk ve EMT'nin orta bölümünden ölçüldüğünde daha küçük bir genişlik göstermektedir. Ölçek çubukları 1 mm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
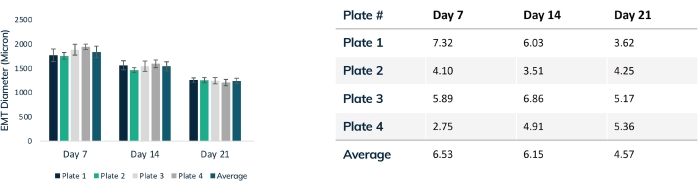
Şekil 4: Zaman içinde EMT çapı. Dört doku plakası 21 gün boyunca izlendi ve sıkıştırma boyunca EMT çapı karşılaştırıldı. Her doku, optik mikroskopi kullanılarak her hafta orta bölümden ölçüldü. Zaman noktaları, plakalar arasında tutarlı EMT boyutu gösterir. Matris yeniden şekillendirme stabilize edildiğinden maksimum sıkıştırmaya 21. günde ulaşılır. Tablo, her bir doku plakası içindeki sıkıştırmanın standart sapmasını (toplamın % 'si) ve tüm plakalar için ortalama sapmayı göstermektedir. Renkli çubuklar ayrı ayrı plakalardır. Hata çubukları, plakalar içindeki EMT'lerin SD'sidir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
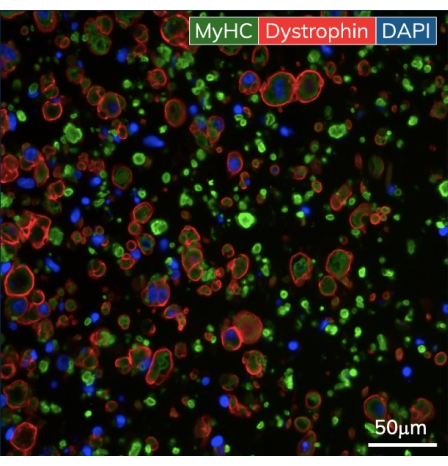
Şekil 5: Tasarlanmış iskelet kası dokularının immünohistokimyası. EMT'ler kültürün 10. gününde sabitlendi ve parafine gömüldü. İnce kesitler (7 μm) görüntüleme öncesinde miyozin ağır zincir ve distrofine karşı antikorlarla boyandı. Yeşil = MyHC, kırmızı = Distrofin, mavi = DAPI. Objektif büyütme 40X'tir; ölçek çubuğu 50 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
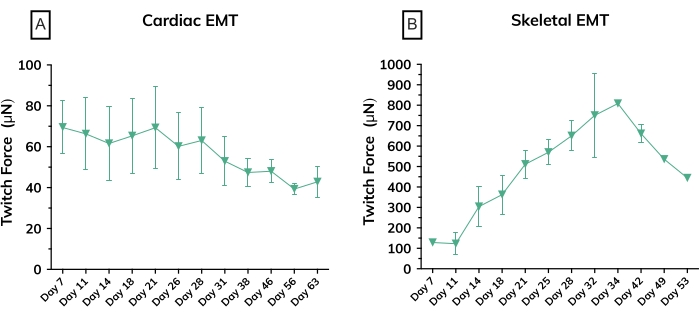
Şekil 6: Zamanla mühendislik kas dokularında kasılma kuvveti. (A) Kültürde 7. günden 63. güne kadar kardiyak EMT'lerden ölçülen ortalama mutlak seğirme kuvveti; n = grup başına 3. (B) Kültürde 7. günden 53. güne kadar birincil hücre hattından türetilen iskelet EMT'lerinde ortalama mutlak seğirme kuvveti; n = 3. Hata çubukları her iki grafik için de SD'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
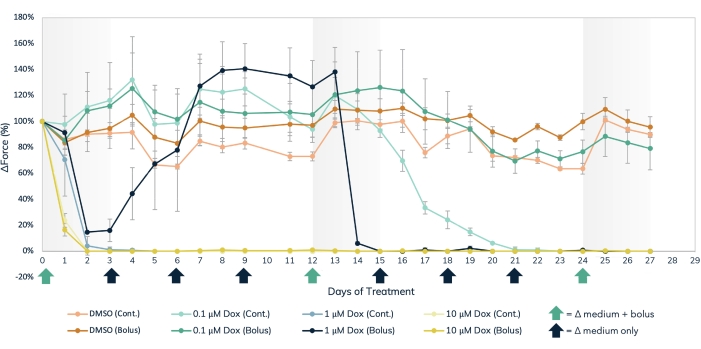
Şekil 7: Mühendislik kas dokusunda akut ve kronik doksorubisin tedavisi. Üç ayrı doz doks konsantrasyonu, 0.1 μM, 1 μM ve 10 μM, bolus içinde verildi veya 27 gün boyunca mühendislik kas dokularına sürekli olarak uygulandı. İlacın Bolus dozları, X eksenindeki yeşil oklarla belirtilen 0, 12 ve 24. günlerdeki medya değişikliklerinde eklendi. İlaç, X eksenindeki siyah ve yeşil oklarla belirtilen sürekli dozlama için her medya değişikliğinde medyaya eklendi. Temel değerlerden (ilaç öncesi tedavi) kuvvetteki yüzde değişim Y eksenindedir ve tedavi günlerindeki süre X eksenindedir. Açık turuncu = DMSO sürekli kontrol, koyu turuncu = DMSO bolus kontrolü, açık yeşil = 0,1 μM dox sürekli, koyu yeşil = 0,1 μM dox bolus, açık mavi = 1 μM dox sürekli, koyu mavi = 1 μM Dox bolus, açık sarı = 10 μM dox sürekli, koyu sarı = 10 μM dox bolus. Hata çubukları SD'dir; n = koşul başına 3. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
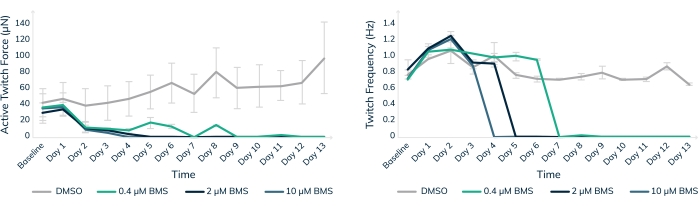
Şekil 8: Mühendislik kas dokusunda BMS-986094 ile kronik tedavi. EMT'ler 13 gün boyunca 0.4 μM (yeşil), 2 μM (koyu mavi) ve 10 μM (açık mavi) BMS-986094 ile tedavi edildi. (A) Kasılma seğirme kuvveti (Y ekseni) ilk 2 günde tüm ilaç konsantrasyonlarında azalırken, DMSO'daki kontrol dokuları zamanla güçlenmeye devam eder (X ekseni). (B) Kardiyak atış hızı veya seğirme frekansı, grafik A'da gösterilen kasılma kuvvetinin durmasıyla birlikte doza bağımlı bir şekilde durur. Hata çubukları SD'dir; n = koşul başına 3. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
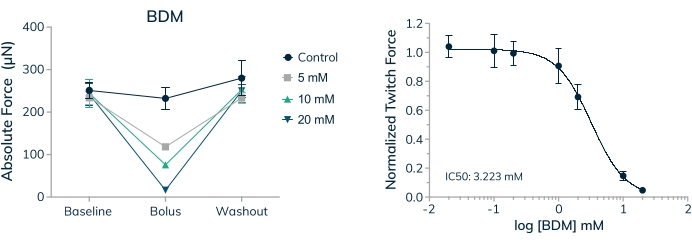
Şekil 9: Mühendislik iskelet kası dokularında BDM'ye doz-yanıt . (A) Mutlak seğirme kuvveti, birincil hücre kaynaklı EMT'ler 3D kültürde 16. günde 2,3-Bütandion monoksimine (BDM) maruz kaldığında doza bağımlı bir şekilde azalır. Mutlak seğirme kuvveti, ilaç yıkandığında taban çizgisine yakın değerlere geri döner. (B) Temel değerlere normalleştirilmiş mutlak seğirme kuvveti, BDM'ye maruz kaldığında doza bağımlı bir şekilde azalır ve tam doz-yanıt eğrisi ve IC50 değeri verir; n = doz başına 4. Hata çubukları SD'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmada, 24 kuyucuklu bir sarf malzemesi döküm kiti içinde 3D mühendislik ürünü kalp ve iskelet kası dokuları oluşturma yöntemleri açıklanmaktadır. Bu yöntemleri izleyerek, sonraki ilaç taraması için döküm hatası olmadan 24 dokudan oluşan eksiksiz bir dizi tutarlı bir şekilde elde etmek mümkündür. Böyle bir sonuca ulaşmak için kritik hususlar, döküm sırasında hidrojellerin erken polimerizasyonunu önlemek için tüm adımların buz üzerinde gerçekleştirilmesini sağlamak, doku dökümünden önce hücre ayrışma reaktifinin uzaklaştırılması, hücrenin iyice karıştırılması ve her doku için hidrojel süspansiyonu, dokular arasında pipet uçlarının değiştirilmesi ve ısıyla inaktive edilmiş FBS'nin (eğer kullanılıyorsa) kullanılmasıdır. Ayrıca, döküm başladıktan sonra post kafesin hareket ettirilmemesini ve hidrojeller oluştuktan sonra yavaşça aktarılmasını sağlamak önemlidir.
Başlıca modifikasyonlar, kardiyak ve iskeletsel EMT'lere ulaşmak için farklı hücre tiplerinin kullanılmasını ve hücresel olgunlaşmayı ve doku stabilitesini teşvik etmek için değişken konsantrasyonlarda bazal membran proteinlerine sahip hidrojellerin dopingini içerir. Bu tür dopingin yararlı etkileri duruma göre test edilmelidir, ancak belirli koşullar altında fonksiyonel sonuçları ve doku ömrünü uzattığı gösterilmiştir14,16,22. Listelenen hücre yoğunluklarının bir rehber olması ve farklı hücre hatları için optimize edilmesi gerekebileceği de dikkat çekicidir. Alternatif hidrojel bileşimleri, elde edilen EMT'lerin yapısal ve fonksiyonel özelliklerini değiştirmek için bir araç olarak da düşünülebilir23,24,25. Doğal kas mikroçevresi ayrıca vaskülarizasyonu, innervasyonu ve miyositleri form ve fonksiyonda desteklemek için matriks birikimini teşvik etmek için destekleyici hücre tiplerini içerir26,27. Burada tarif edilen sistem şu anda fibroblastları 3D kalp dokularına dahil ederken, ek hücre tipleri in vitro terapötik bileşiklerin güvenliğini ve etkinliğini incelemek için daha fizyolojik bir model oluşturabilir. Daha önce, bir dizi destekleyici hücre tipi, manyetik algılama kontraktilitesi platformu 28,29,30 kullanılarak gelecekteki çalışmalar için heyecan verici bir şablon sunan 3D mühendislik dokularına başarıyla entegre edilmiştir.
Bu protokol için sorun giderme, döküm işlemi sırasında güvenilmez veya tutarsız dokuların oluşumuna odaklanır. Hidrojellerde dökülürken kabarcık oluşumunu önlemek için özen gösterilmeli ve karıştırma sırasında hücrelerin eşit dağılımını kolaylaştırmaya devam edilmelidir. İdeal hücre yoğunluklarını, hücre oranlarını ve matris kompozisyonunu tanımlamak için her yeni hücre tipi için optimizasyon deneylerine ihtiyaç duyulacaktır.
Bu teknik için önemli bir sınırlama, 24 EMT'den oluşan tam bir plaka oluşturmak için gereken önemli sayıda hücredir. Burada sunulan veriler için plaka başına 15 milyon kardiyomiyosit ve 18 milyon iskelet miyoblastı kullanılmıştır. Bazı araştırmacılar, bu platformu en iyi şekilde kullanma yeteneklerini engelleyebilecek kadar büyük hücresel malzeme havuzlarına erişemeyebilir. Son kullanıcıların manyetik algılama donanımına erişimi yoksa, post sapmaların ölçümlerinin optik olarak yapılması gerekir, bu da verimi önemli ölçüde azaltır ve birden fazla kuyucukta kas kasılmalarının eşzamanlı olarak kaydedilmesini önler. Bununla birlikte, Mantarray donanımı, EMT büzülmesinin sürekli, invaziv olmayan analizini aynı anda birden fazla yapıda yapabilen ilk ticari sistemi sunmak için bu sınırlamaların üstesinden gelir.
24 kuyucukta manyetik algılama, EMT fonksiyonel gelişiminin gerçek zamanlı olarak uzunlamasına incelenmesini kolaylaştırır ve kimyasal, çevresel veya genetik manipülasyona karşı akut tepkilerin doğru bir şekilde ölçülmesini sağlar. Manyetik algılama, birden fazla doku arasında eşzamanlı ölçüm gibi çeşitli avantajlara sahipken ve karmaşık veri analizi gerektirmezken, optik algılama yöntemleri, kalsiyum akısı veya voltaj haritalaması gibi fizyolojik metriklerin eşzamanlı olarak ölçülmesini sağlar. Bununla birlikte, sonuçlar bölümünde gösterilenler gibi veri kümeleri, bu teknolojinin ilaç geliştirme alanında sahip olduğu uygulamaların genişliğini göstermektedir. Piyasadaki az sayıda tahlilin, mühendislik kasındaki kontraktil çıktının doğrudan bir değerlendirmesini yapmak için araçlar sunduğu göz önüne alındığında, bu yöntemler klinik öncesi gelişim boru hattında devrim yaratma potansiyeline sahiptir.
Açıklamalar
Tüm yazarlar, Mantarray donanımını ve ilgili yazılımı ticarileştiren Curi Bio Inc. şirketinde çalışanlar ve hisse senedi sahipleridir.
Teşekkürler
Bu çalışma kısmen Gıda ve İlaç İdaresi'nden (Sağlık ve Çevre Bilimleri Enstitüsü'ne verilen U01 FD006676-01) ve Ulusal Sağlık Enstitüleri'nden (HL151094'ten Dr. Geisse'e) fon sağlanarak desteklenmiştir. Dr. Alec S. T. Smith'e bu yazının hazırlanmasındaki yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | CELLTREAT | 229485 | |
| 100 mm cell culture dish | ThermoFisher | 150466 | |
| 50 mL Steriflip filter | MilliporeSigma | SCGP00525 | |
| 500 mL filter flask | MilliporeSigma | S2GVU05RE | |
| 6-aminocaproic acid | Sigma | A2504 | |
| B27 | Gibco | 17504044 | |
| Cardiosight Maintenance Medium | NEXEL | CM-002A | |
| Cardiosight Plating Medium | NEXEL | CM-020A | |
| C-Pace EM stimulator | IonOptix | EM | |
| Curi Bio Muscle Differentiation Media Kit | Primary - DIFF | ||
| Curi Bio Muscle Maintenance Media Kit | Curi Bio | Primary - MAINT | |
| DAPI | Invitrogen | D1306 | |
| DMEM, high glucose, GlutaMAX | Gibco | 10566-016 | |
| Dnase | Sigma | 11284932001 | |
| DPBS | Gibco | 14190-250 | |
| Dystrophin antibody | Abcam | ab154168 | |
| Fetal bovine serum (FBS) | Thermo Scientific | 10082147 | Must be heat-inactivated |
| Fibrinogen (Bovine) | Sigma | E8630 | |
| Glutaraldehyde | Sigma | 354400 | |
| Ham's F10 | Gibco | 11550043 | |
| Hemacytometer | Sigma | Z359629 | |
| HS-27A Fibroblasts | ATCC | CRL-2496 | |
| Human Skeletal Muscle Myoblasts | Lonza | CC-2580 | |
| Luer Lock 0.2 µm syringe filter | Corning | 431219 | |
| Luer Lock 10 mL syringe | BH Supplies | BH10LL | |
| Mantarray Instrument | Curi Bio | MANTA-24-B1 | System |
| Mantarray Plate Kits | Curi Bio | MA-24-SKM-5 | Pack of 5 kits |
| Mantarray stimulation lid | Curi Bio | EM | |
| Matrigel (ECM) | Corning | 356231 | |
| Nexel Cardiosight-S, Cardiomyocytes | NEXEL | C-002 | |
| Optical Microscope | Nikon Ti2E | MEA54000 | |
| Pan Myosin Heavy Chain antibody | DSHB | MF-20 | |
| Poly(ethyleneimine) | Sigma | P3143 | |
| ROCK inhibitor | StemCell Technologies | Y-27632 | |
| RPMI | Gibco | 11875-093 | |
| Skeletal Muscle Growth Medium (SkGM-2) | Lonza | CC-3245 | |
| Standard 24-well plates | Greiner | M8812 | Other manufacturer's plates will not fit |
| Standard 6-well plates | ThermoFisher | 140675 | |
| Stromal medium (DMEM + 20% FBS) | |||
| T175 Filter Flask | ThermoFisher | 159910 | |
| T225 Filter Flask | ThermoFisher | 159934 | |
| Thrombin | Sigma | T4648 | |
| Trypan Blue solution, 0.4% | ThermoFisher | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Scientific | A1217702 | |
| TrypLE Select Enzyme (1x) | Thermo Scientific | 12563011 |
Referanslar
- Sharma, A., Wu, J. C., Wu, S. M. Induced pluripotent stem cell-derived cardiomyocytes for cardiovascular disease modeling and drug screening. Stem Cell Research & Therapy. 4, 150 (2013).
- Mudera, V., Smith, A. S. T., Brady, M. A., Lewis, M. P. The effect of cell density on the maturation and contractile ability of muscle derived cells in a 3D tissue-engineered skeletal muscle model and determination of the cellular and mechanical stimuli required for the synthesis of a postural phenotype. Journal of Cellular Physiology. 225 (3), 646-653 (2010).
- Vandenburgh, H., et al. Tissue-engineered skeletal muscle organoids for reversible gene therapy. Human Gene Therapy. 7 (17), 2195-2200 (1996).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nature Communications. 9 (1), 126 (2018).
- Fleming, J. W., et al. Bioengineered human skeletal muscle capable of functional regeneration. BMC Biology. 18 (1), 145 (2020).
- Madden, L., Juhas, M., Kraus, W. E., Truskey, G. A., Bursac, N. Bioengineered human myobundles mimic clinical responses of skeletal muscle to drugs. eLife. 4, 04885 (2015).
- Urciuolo, A., et al. Engineering a 3D in vitro model of human skeletal muscle at the single fiber scale. PLOS One. 15 (5), 0232081 (2020).
- Afshar, M. E., et al. A 96-well culture platform enables longitudinal analyses of engineered human skeletal muscle microtissue strength. Scientific Reports. 10, 6918 (2020).
- Sakar, M. S., et al. Formation and optogenetic control of engineered 3D skeletal muscle bioactuators. Lab on a Chip. 12 (23), 4976-4985 (2012).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Khodabukus, A., Baar, K. Defined electrical stimulation emphasizing excitability for the development and testing of engineered skeletal muscle. Tissue Engineering Part C: Methods. 18 (5), 349-357 (2011).
- Vandenburgh, H., et al. Drug-screening platform based on the contractility of tissue-engineered muscle. Muscle & Nerve. 37 (4), 438-447 (2008).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Enineering Part C Methods. 22 (10), 932-940 (2016).
- Smith, A. S. T., et al. High-throughput, real-time monitoring of engineered skeletal muscle function using magnetic sensing. bioRxiv. , 492879 (2022).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Hinds, S., Bian, W., Dennis, R. G., Bursac, N. The role of extracellular matrix composition in structure and function of bioengineered skeletal muscle. Biomaterials. 32 (14), 3575-3583 (2011).
- Carvalho, C., et al. Doxorubicin: the good, the bad and the ugly effect. Current Medicinal Chemistry. 16 (25), 3267-3285 (2009).
- Ahmad, T., et al. Cardiac dysfunction associated with a nucleotide polymerase inhibitor for treatment of hepatitis C. Hepatology. 62 (2), 409-416 (2015).
- Gill, M., et al. From the cover: Investigative nonclinical cardiovascular safety and toxicology studies with BMS-986094, an NS5b RNA-dependent RNA polymerase inhibitor. Toxicological Sciences. 155 (2), 348-362 (2017).
- Ostap, E. M. 2,3-Butanedione monoxime (BDM) as a myosin inhibitor. Journal of Muscle Research and Cell Motility. 23 (4), 305-308 (2002).
- Fryer, M. W., Gage, P. W., Neering, I. R., Dulhunty, A. F., Lamb, G. D. Paralysis of skeletal muscle by butanedione monoxime, a chemical phosphatase. Pflügers Archiv: European Journal of Physiology. 411 (1), 76-79 (1988).
- Fleming, J. W., et al. Functional regeneration of tissue engineered skeletal muscle in vitro is dependent on the inclusion of basement membrane proteins. Cytoskeleton. 76 (6), 371-382 (2019).
- Capel, A. J., et al. Scalable 3D printed molds for human tissue engineered skeletal muscle. Frontiers in Bioengineering and Biotechnology. 7, 20 (2019).
- Tsui, J. H., et al. Tunable electroconductive decellularized extracellular matrix hydrogels for engineering human cardiac microphysiological systems. Biomaterials. 272, 120764 (2021).
- Tsui, J. H., et al. Conductive silk-polypyrrole composite scaffolds with bioinspired nanotopographic cues for cardiac tissue engineering. Journal of Materials Chemistry B. 6 (44), 7185-7196 (2018).
- Gabella, G. Muscle cells, nerves, fibroblasts and vessels in the detrusor of the rat urinary bladder. Journal of Smooth Muscle Research. 55, 34-67 (2019).
- Christov, C., et al. Muscle satellite cells and endothelial cells: close neighbors and privileged partners. Molecular Biology of the Cell. 18 (4), 1397-1409 (2007).
- Bersini, S., et al. Engineering an environment for the study of fibrosis: A 3D human muscle model with endothelium specificity and endomysium. Cell Reports. 25 (13), 3858-3868 (2018).
- Gilbert-Honick, J., et al. Engineering functional and histological regeneration of vascularized skeletal muscle. Biomaterials. 164, 70-79 (2018).
- Maffioletti, S. M., et al. Three-dimensional human iPSC-derived artificial skeletal muscles model muscular dystrophies and enable multilineage tissue engineering. Cell Reports. 23 (3), 899-908 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır