需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种可重复的软骨冲击模型在兔子中产生创伤后骨关节炎
* 这些作者具有相同的贡献
摘要
兔子开放的股内侧髁突冲击模型对于研究创伤后骨关节炎 (PTOA) 和缓解 PTOA 进展的新治疗策略是可靠的。该协议使用带有撞击头的基于托架的滴塔在兔子中产生后内侧股骨髁的孤立软骨缺损。
摘要
创伤后骨关节炎 (PTOA) 占美国所有骨关节炎病例的 12%。PTOA 可由单个创伤事件引发,例如作用在关节软骨上的高冲击负荷,或由关节不稳定引发,如前交叉韧带断裂。目前尚无有效的治疗方法来预防 PTOA。开发可靠的 PTOA 动物模型对于更好地了解软骨损伤的机制以及研究缓解或预防 PTOA 进展的新治疗策略是必要的。该协议描述了一种开放的、基于落塔的兔股骨髁冲击模型,以诱导软骨损伤。该模型的峰值载荷为 579.1 ± 71.1 N,峰值应力为 81.9 ± 10.1 MPa,峰值载荷时间为 2.4 ± 0.5 ms。与未阻生的对侧 MFC(0.56 ± 0.42)和受阻膝的其他软骨表面相比,来自嵌塞内侧股骨髁 (MFC) 的关节软骨具有更高的凋亡细胞率 (p = 0.0058),并具有更高的国际骨关节炎研究学会 (OARSI) 评分 3.38 ± 1.43 (<0.56 0.42 )。在未受影响的关节面中未检测到OARSI评分的差异(p > 0.05)。
引言
创伤后骨关节炎 (PTOA) 是全球致残的主要原因,占症状性骨关节炎 (OA) 的 12%-16%1。目前终末期 OA 管理的金标准是全膝关节和髋关节置换术2 或关节融合术,如终末期胫距关节或距下关节炎。虽然在很大程度上是成功的,但关节置换术可能会产生昂贵且病态的并发症3.此外,鉴于 77%-83%4,5 的无翻修种植体存活率较低,因此 50 岁以下的患者不太希望进行关节置换术。目前,尚无 FDA 批准的治疗方法来预防或减轻 PTOA 的进展。
PTOA 累及整个关节,包括滑膜组织、软骨下骨和关节软骨。其特征是关节软骨退化、滑膜炎症、软骨下骨重塑和骨赘形成 6,7。PTOA 的表型是通过软骨、滑膜和软骨下骨之间相互作用的复杂过程发展而来的。目前的理解是,软骨损伤导致细胞外基质 (ECM) 成分的释放,例如 2 型胶原 (COL2) 和聚集聚糖 (ACAN)。这些 ECM 组分片段具有促炎作用,可导致 IL-6、IL-1β 和活性氧的产生增加。这些介质作用于软骨细胞,导致基质金属蛋白酶 (MMP) 上调,例如 MMP-13,其降解关节软骨,同时也减少基质合成,导致关节软骨的整体分解代谢环境8。此外,有证据表明原发性骨关节炎和 PTOA 的软骨细胞凋亡增加 9,10。线粒体功能障碍发生在软骨11,12,13,14 的超生理负荷后,可导致软骨细胞凋亡增加 12,15。软骨细胞凋亡增强与蛋白多糖耗竭和软骨分解代谢增加有关,并已被证明先于软骨变化和软骨下骨重塑16,17,18。
与大多数人类疾病一样,需要可靠的 PTOA 转化模型来进一步了解疾病的病理生理学并测试新的治疗方法。猪和犬科动物等大型动物已被用于 PTOA17,19 的关节内骨折和冲击模型,但它们成本高昂。较小的动物模型,如小鼠、大鼠和兔子,成本较低,用于研究通过关节不稳定产生的 PTOA,这通常涉及前交叉韧带 (ACL) 的手术横断和/或内侧半月板的破坏 20、21、22、23、24、25。尽管关节创伤会导致各种后果,包括韧带损伤26,但几乎所有病例都会发生软骨的机械性超负荷。
越来越多的证据表明,韧带不稳定(如前交叉韧带横断)和急性软骨损伤后 PTOA 发展背后的病理学是由于不同的机制27。因此,开发软骨直接损伤模型非常重要。目前在大鼠和小鼠中产生骨软骨或软骨损伤的冲击模型数量有限28,29。然而,小鼠软骨不太适合产生孤立的软骨缺损。这是因为小鼠关节软骨只有 3-5 个细胞层厚,缺乏有组织的浅表、放射状和过渡软骨区,以及在人类和大型动物中发现的厚钙化软骨层。小鼠模型还显示部分软骨缺损的自发消退30,31。因此,我们选择了兔子作为这个冲击模型,因为它的软骨厚度和组织与人类相似,而且它是最小的动物模型,可以提供一致的软骨冲击,导致 PTOA。先前对兔子股骨髁撞击的开放手术模型采用了钟摆32、手持式弹簧加载软骨嵌塞装置 33 和允许创建兔子特异性撞击器的下降塔34。然而,这些研究缺乏体内数据。其他人已经报道了基于摆锤 35、气动36 和弹簧加载37 冲击装置10 的体内数据,这些研究表明,这些方法之间的峰值应力和加载速率的变异率很高。尽管如此,该领域仍缺乏一种一致的方法来可靠地模拟体内急性软骨创伤。
目前的方案采用基于落塔的系统,对兔膝关节的后内侧髁进行一致的冲击。采用膝关节后入路暴露股骨后内侧髁。然后将 Steinman 销从内侧到外侧穿过股骨髁,与关节面成一条直线,并固定在平台上。固定后,负荷被传递到股骨后内侧髁。这种方法允许将一致的软骨损伤传递到兔股骨远端的承重表面。
Access restricted. Please log in or start a trial to view this content.
研究方案
以下程序是在印第安纳大学医学院机构动物护理和使用委员会 (IACUC) 的批准下执行的。所有生存手术均在无菌条件下进行,如美国国立卫生研究院指南所述。使用适当的镇痛药和抗生素来控制疼痛和感染风险,以优化成功的结果。本研究采用骨骼成熟的雄性新西兰白兔,体重3.0-4.0公斤。
1. 落塔制造
- 生成落塔、底座平台和机构组件的 CAD 图纸,以固定 Steinman 销(补充图 1-14)。
- 购买市售组件(参见 材料表)。
- 采购设备的机器零件或将 CAD 图纸交给机械师进行制造。
注意:制造直径为 3 毫米的撞击器尖端需要具有工具制造能力的高精度机械师(补充图 1、第 20 部分和 补充图 13、14)。撞击头撞击面矢状面和冠状面的曲率分别为7.14 mm和5.56 mm,符合兔内侧髁35的曲率(补充图13,14)。 - 组装零件,使下降塔由一个托架组成,托架 通过 固定对准的直线滚珠轴承在两个垂直杆上行驶,底座平台支撑兔子并固定 Steinman 销(图 1 和 图 2)。
注:此设计的托架横梁的弯曲刚度等于先前的落锤塔38 的弯曲刚度,振动水平可接受。
2. 动物准备
- 称量兔子并使用2.5mg / kg阿法沙酮和0.15mg / kg咪达唑仑IM麻醉(参见 材料表)。诱导后将眼药膏涂抹在双眼上。使用~2%-3%异氟醚维持麻醉。给予丁丙诺啡 SR (0.1 mg/kg) SQ 镇痛和围手术期恩诺沙星 (10 mg/kg) SQ。非甾体抗炎药,如卡洛芬,4mg/kg或美洛昔康,0.2-0.3mg/kg或酮洛芬,3mg/kg,可以作为SQ注射剂代替丁丙诺啡。
- 剃掉兔子的后肢,从脚踝到后躯。在去除兔毛时要格外小心,以防止污染切口。使用一套专用的、锋利的兔毛剪很重要。
- 将不锈钢前腿块(补充图 1、第 2 部分和 补充图 4)放在冲击平台末端下方,并用加热垫盖住平台。将兔胸骨(即俯卧)放在加热垫上。在对侧髋关节下方放置一个带衬垫的凸起。
- 确保手术肢体的膝盖居中并放在聚乙烯块上(图 2A1)。使用丝带轻轻缩回手术肢体上部和对侧的尾巴。
- 用氯己定和70%酒精浸泡的无菌纱布擦拭手术部位。擦洗手术部位,从膝后部开始,向外打圈。用新鲜磨砂膏重复至少 3 次,最后以 70% 的酒精结束。
- 将无菌手套放在手术脚上直至脚踝,并用无菌粘性包裹物包裹。
- 用三张窗帘无菌地覆盖手术部位:一张直接在手术肢体下方,另外两张覆盖身体的其他部位。用毛巾夹固定窗帘amps。
3. 手术暴露
注意:在手术和撞击之前,应根据兔子的特定品系、年龄和性别,根据经验确定在不发生软骨下骨折的情况下造成可见软骨损伤的重量和跌落高度。
- 触诊髌骨前方的位置,以估计膝关节的位置,膝关节位于髌骨远端。使用 15 刀片,从髌骨上极远端的水平沿伸展膝盖的后侧切开 3-4 厘米的切口。
- 通过下面的浅筋膜进行钝而尖锐的解剖。在外侧形成皮肤内侧和内侧腓肠肌之间的间隔。在此间隔内放置一个自保持 Weitlaner 牵开器(参见 材料表)。
- 次级筋膜层将变得可见,仅覆盖在隐动脉和静脉上。解剖隐外侧,内侧回缩脉管系统,外侧回缩后腹果狼复合体。
注意:注意不要切断这种脉管系统。如果该动脉受损,请确保正确结扎,因为可能会发生术后失血性休克。
- 次级筋膜层将变得可见,仅覆盖在隐动脉和静脉上。解剖隐外侧,内侧回缩脉管系统,外侧回缩后腹果狼复合体。
- 向远端解剖,直到在股骨后内侧髁上发现一个小的可移动的肛门。进行关节切开术以动员肕门上外侧,暴露下面的股骨内侧髁。通过钝而锋利的解剖轻轻去除软组织,露出股骨内侧髁的后部。使用 Freer 和 Cricket 自保持器(参见 材料表)在此水平回缩软组织。
- 在保持髁突暴露的同时,将 0.062 英寸的 Steinman 销(见 材料表)穿过股骨远端,从股骨内侧的上侧开始,以股骨内侧的前后方向为中心,距离髁突后侧约 5 毫米。
- 使用电池供电的 Steinman 销驱动器将导线横向穿过平行于关节表面的骨骼和外侧皮肤。外上髁的触诊将确保 Steinman 销的适当轨迹。
- 取下牵开器,用 3-0 聚吸附缝线(参见 材料表)以跑步方式闭合皮肤。用无菌纱布覆盖切口。
4.股骨髁的影响
- 取下手术肢体下方的悬垂物,将 Steinman 销固定到可定制且高度可调节的冲击平台上。首先,将高度可调的Steinman销固定装置的下部放置在销下方(图2A2)。根据需要调整螺钉高度,确保电线与该平台上的接地平行。
- 在确保 Steinman 销与地面平行后,将安全平台的顶部基于螺钉的方面(图 2A3)放在高度可调件的下部基于螺钉的方面。通过将顶杆拧入销钉固定平台的下部高度可调部分,确保 Steinman 销钉牢固固定(图 2A2)。
- 将 Steinman 销固定到平台上后,取下缝合线,然后重新打开切口。用自固型 Weitlaner 和蟋蟀牵开器暴露股骨内侧髁。可能需要额外的 Freer 才能将额外的软组织从撞击器尖端的路径中缩回(图 2B)。
- 用经批准的消毒剂擦拭滴塔。将无菌的3mm撞击头(图2A4)连接到落塔托架上。将下降塔放在手术肢体上,并将其底座(图2A6)放在撞击平台下方(图3A)。
- 轻轻地将撞击器(补充图2,第20部分和 补充图13)降低到股骨后内侧髁的中心。确保撞击器的路径中没有软组织。
- 根据需要移动兔子或塔,以确保撞击头位于股骨后内侧髁的中心(图3B)。每当兔子被移动或重新定位时,都应评估该手术部位是否有任何可能的无菌中断,并在需要时重新消毒该区域。
- 一旦确保适当的轨迹,clamp 用肘节夹将塔架固定在平台上amps (图 2A5, 见 材料表)。
- 在撞击前 5-10 分钟静脉注射一剂阿法沙酮 (0.5-0.7 mg/kg) 以进行深度麻醉,而不增加吸入麻醉。
注意:缺乏睑反射、足踏板后退和耳廓反射证明更深的麻醉。这种更深层次的麻醉有助于防止在放置在设备中和撞击期间可能发生的肢体反应。
注意:如果给药太快,阿法沙酮会导致兔子短暂性呼吸暂停和缺氧,应在 1-2 分钟内缓慢给药。如果确实发生缺氧,请确保在继续之前充分氧合和恢复生命体征。 - 将撞击器设置在股骨内侧髁上方的所需高度。对于当前质量为 1.41 kg 的托架组件,包括轴承,这是 7 cm 的高度。
注:下降塔高度是通过对尸体组织的初步研究确定的。在这项研究中,这个高度对兔子产生了可见的软骨损伤,但没有造成软骨下骨折。 - 在松开主轴挡块(补充图2,第14项)之前,单击LabVIEW数据采集软件(补充编码文件1)上的"开始"按钮,以释放托架并使其在重力作用下下降。
注意: 数据采集软件将使用连接到数据采集模块的笔记本电脑,在撞击期间以 100 kHz 的频率从位于撞击器和托架之间的称重传感器(图 6、7)收集数据。 - 将数据采集软件生成的txt文件与Matlab数据分析代码(补充编码文件2)放在同一个文件夹中,运行数据分析代码,对原始数据进行过滤,计算影响参数。
- 确保已确定最大负载。相关时间点被认为是最大变形和零速度的时间。
注意:数据分析代码将分析文件夹中的所有 txt 文件,并报告每个文件的结果。该代码将根据加载时间数据的变化确定影响的开始和结束。来自加速度计的数据将以数值方式积分以计算速度,并再次积分以计算位移。数据分析代码将根据以下公式数值计算脉冲、功和动能:
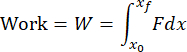

其中 F 是负载传感器测量的力,x 0 和 t 0 是冲击开始时的位移和时间,x 和 tf 是冲击结束时的位移和时间。加载速率将数值计算为冲击加载阶段 dσ/dt 的平均值。峰值应力的计算方法是将峰值载荷除以撞击头的接触面积。 - 对软骨表面进行可视化,以确定是否发生了适当的软骨损伤(图4A)。
5. 手术部位闭合
- 从手术肢体上方取下滴塔。将所有用过的手术工具放在一边,换上新的无菌手套。
注意: 鉴于落塔不是无菌的,现在应将用于撞击的所有工具视为已污染。 - 将无菌悬垂物重新涂抹到下肢,并获得未使用的无菌自牵开器。
- 重新暴露股骨内侧髁,并用 50-60 mL 无菌生理盐水彻底冲洗手术部位。
- 用 5-0 聚吸附缝合线闭合后囊,然后用 4-0 单吸附缝合线闭合皮肤(参见 材料表)。
- 皮内注射 2 mL 利多卡因/布比卡因用于切口周围的局部镇痛。
- 通过振荡移除带有电源驱动器组的 Steinman 销(参见 材料表),以尽量减少软组织损伤。
- 用非粘性敷料包扎伤口,然后用胶带包扎伤口。对手术肢体进行X射线检查,以确保没有发生骨折和适当的销钉放置(图4B)。
6.术后管理
- 将兔子放回笼子里,在加热的毯子上监测它,直到它从麻醉中恢复过来(~25分钟)。
- 手术后几天继续密切监测兔子,以确保它们正常愈合并恢复活动能力。术后给予恩诺沙星 (10 mg/kg) 2 天以预防感染。术后每 2-3 天皮下注射丁丙诺啡 SR 镇痛 (0.1 mg/kg),并根据需要给予。代替丁丙诺啡,非甾体抗炎药,如卡洛芬,每天 4mg/kg SQ,美洛昔康,每天 0.2 – 0.3mg/kg SQ,最多 3 天或酮洛芬,每天 3mg/kg SQ 可以在手术后 3-5 天根据需要给药。
注意:我们已经成功地防止了由于兔子舔或咀嚼而导致的术后伤口裂开,将人类新生儿裤子放在后肢上39.如果兔子咬穿裤子,可以放置一个伊丽莎白时代的项圈(见 材料表)以防止咀嚼切口。
7.组织学评估
- 在受伤后16周,从安乐死的兔子中收获膝盖,将它们固定在10%中性缓冲福尔马林中48小时,然后石蜡包埋并切成5μm厚的切片。
- 脱蜡和再水化后,根据标准方案40,41用番红素O快速绿色染色切片。
- 按照制造商的说明,使用TUNEL显色细胞凋亡检测试剂盒对切片进行末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)测定,并用苏木精42 复染(参见 材料表)。
Access restricted. Please log in or start a trial to view this content.
结果
该手术的成功在撞击后立即通过外科医生对髁突的可视化(图4A)和射线照相来监测,以确保没有发生骨折(图4B)。存在冲击失败的风险,导致术中髁突骨折。这通常是由于 Steinman 引脚放置不当造成的(图 5)。使用该模型,继发于术中骨折的骨折失败率为 9.0%(67 例手术中的 6 例)。平均峰值冲击应力为81.9 ± 10.1 MPa(CV = 12.3%?...
Access restricted. Please log in or start a trial to view this content.
讨论
该外科手术旨在在 PTOA 模型中对兔股骨内侧髁的承重表面产生一致的软骨损伤。该手术的一个优点是膝关节的后入路允许直接观察完整的后股内侧髁,并且可以在大约 37 分钟内完成(表 2)。还应该注意的是,这是一个开放性损伤模型,除了由于滑膜和关节囊的潜在损伤而导致的影响之外,还可能导致急性炎症变化17,44。表3总?...
Access restricted. Please log in or start a trial to view this content.
披露声明
Roman Natoli 为 AO Trauma North America 授课,是 Current Osteoporosis Reports 的版块编辑,并获得了 Morgan 和 Claypool 的教科书版税。托德·麦金利(Todd McKinley)从Innomed获得版税。其余作者没有什么可透露的。
致谢
这项研究得到了美国陆军医学研究收购活动的 DoD 同行评审医学研究计划 - 研究者发起的研究奖 W81XWH-20-1-0304、NIH NIAMS R01AR076477和 NIH (AR065971) 的综合肌肉骨骼 T32 培训计划以及 NIH NIAMS Grant R01 AR069657 的支持。作者要感谢 Kevin Carr 为该项目提供他在加工和制造方面的专业知识,并感谢 Drew Brown 和印第安纳州肌肉骨骼健康骨骼组织学中心对组织学的帮助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Flat head screw | McMaster-Carr | 92210A194 | Stainless steel hex drive flat head screw, 8-32, 1/2" |
| #15 scalpel blades | McKesson | 1029066 | Scalpel McKesson No. 15 Stainless Steel / Plastic Classic Grip Handle Sterile Disposable |
| 1/2”-20 threaded rod | McMaster-Carr | 99065A120 | 1/2”-20 threaded rod |
| 10 mL syringe | McKesson | 1031801 | For irrigation; General Purpose Syringe McKesson 10 mL Blister Pack Luer Lock Tip Without Safety |
| 3 mL syringe | McKesson | 1031804 | For lidocaine/bupiviacaine injection; General Purpose Syringe McKesson 3 mL Blister Pack Luer Lock Tip Without Safety. |
| 3-0 polysorb | Ethicon | J332H | 3-0 Vircryl, CT-2, 1/2 circle, 26 mm, tapered |
| 4-0 monosorb | Ethicon | Z397H | 4-0 PDS 2, FS-2, 3/8 circle, 19mm, cutting edge |
| 5-0 polysorb | Med Vet International | NC9335902 | Med Vet International 5-0 ETHICON COATED VICRYL C-3 |
| Accelerometer | Kistler | 8743A5 | Accelerometer |
| Adson-Browns Forceps | World precision tools | 500177 | Adson-Brown Forceps, 12 cm, Straight, TC Jaws, 7 x 7 Teeth |
| Alfaxalone | Jurox | 49480-002-01 | Alfaxan Multidose by Jurox : 10 mg/mL |
| Buprenorphine | Par Pharmaceuticals | 42023-0179-05 | Buprenorphine HCL injection: 0.3 mg/mL |
| Butorphanol | Zoetis | 54771-2033 | Butorphanol tartrate 10mg/ml by Zoetis |
| Chlorhexidine Hand Scrub | BD | 371073 | BD E-Z Scrub 107 Surgical Scrub Brush/Sponge, 4% CHG, Red |
| Collet | STRYKER | 14023 | Stryker 4100-62 wire Collet 0.28-0.71'' |
| Cordless Driver handpiece | STRYKER | OR-S4300 | Stryker 4300 CD3 Cordless Driver 3 handpiece |
| Cricket Retractors | Novosurgical | G3510 21 | 2x Heiss (Holzheimer) Cross Action Retractor |
| Dissector Scissors | Jorvet labs | J0662 | Aesculap AG, Metzenbaum, Scissors, Straight 5 3/4″ |
| Elizabethian Collar | ElizaSoft | 62054 | ElizaSoft Elizabethan Recovery Collar |
| Enrofloxacin | Custom Meds | Enrofloxacin compounded by Custom Meds | |
| Eye Ointment | Pivetal | 46066-753-55 | Pivetal Articifical Tears- recently recalled |
| Face-mount shaft collar | McMaster-Carr | 5631T11 | Face-mount shaft collar |
| Fast green | Millipore Sigma | F7258 | Fast green |
| Freer | Jorvet labs | J0226Q | Freer elevator |
| Head screw -1 | McMaster-Carr | 91251A197 | Black-oxide alloy steel socket head screw, 8-32, 3/4" |
| Head screw -2 | McMaster-Carr | 92196A194 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -3 | McMaster-Carr | 92196A146 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -4 | McMaster-Carr | 92196A151 | Stainless steel socket head screw, 6-32, 3/4" |
| Hematoxylin Solution, Gill No. 1 | Millipore Sigma | GHS132-1L | Hematoxylin Solution, Gill No. 1 |
| Hex nut | McMaster-Carr | 91841A007 | Stainless steel hex nut, 6-32 |
| Hold-down toggle clamp | McMaster-Carr | 5126A71 | Hold-down toggle clamp |
| Impact device | n/a | n/a | custom made |
| Impact platform | n/a | n/a | custom made |
| K-wires | Jorvet Labs | J0250A | JorVet Intramedullary Steinman Pins, Trocar-Trocar 1/16" x 7" |
| Lab View | National Instruments | n/a | n/a |
| Load cell | Kistler | 9712B5000 | Load cell |
| MATLAB | The MathWorks Inc. | n/a | n/a |
| Microscope | Leica | DMi-8 | Leica DMi8 microscope with LAS-X software |
| Midazolam | Almaject | 72611-749-10 | Midazolam Hydrochloride injection: 5mg/ml by Almaject |
| milling machine depth stops | McMaster-Carr | 2949A71 | Clamp-on milling machine depth stops |
| Mobile C-arm | Philips | 718095 | BV Pulsera, Mobile C-arm |
| Mounted linear ball bearing | McMaster-Carr | 9338T7 | Mounted linear ball bearing |
| Needle Driver | A2Z Scilab | A2ZTCIN39 | TC Webster Needle Holder Smooth Jaws 5", Premium |
| Pentobarbital | Vortech | 0298-9373-68 | Pentobarbital 390 mg/mL by Vortech |
| Safranin O | Millipore Sigma | HT90432 | Safranin O |
| Small Battery pack | STRYKER | NS014036 | 6212 Small Battery pack- 9.6 V |
| Steel rod, 2’ | McMaster-Carr | 89535K25 | Steel rod, 2’ |
| Sterile Saline | ICU Medical | 6139-22 | AquaLite Solution Pour Bottles, 250 mL |
| Stryker 6110-120 System 6 Battery Charger | STRYKER | OR-S6110-120 | |
| Surgical gloves | McKesson | 1044729 | Surgical Glove McKesson Perry Size 6.5 Sterile Pair Latex Extended Cuff Length Smooth Brown Not Chemo Approved |
| Surgical gown | McKesson | 1104452 | Non-Reinforced Surgical Gown with Towel McKesson Large Blue Sterile AAMI Level 3 Disposable |
| Suture scissors | Jorvet Labs | J0910SA | Super Cut Scissors, Mayo, Straight, 5 1/2″ |
| TUNEL staining kit | ABP Bioscience | A049 | TUNEL Chromogenic Apoptosis Detection Kit |
| Weitlaner Retractors | Fine Science Tools | 17012-11 | 2x Weitlaner-Locktite Retractors |
参考文献
- Thomas, A. C., Hubbard-Turner, T., Wikstrom, E. A., Palmieri-Smith, R. M. Epidemiology of posttraumatic osteoarthritis. Journal of Athletic Training. 52 (6), 491-496 (2017).
- Pasquale, M. K., et al. Healthcare Utilization and costs of knee or hip replacements versus pain-relief injections. American Health Drug Benefits. 8 (7), 384-394 (2015).
- Yao, J. J., et al. Direct Inpatient medical costs of operative treatment of periprosthetic hip and knee infections are twofold higher than those of aseptic revisions. Journal of Bone and Joint Surgery America. 103 (4), 312-318 (2021).
- Anatone, A. J., et al. Decreased implant survival is associated with younger patients undergoing total knee arthroplasty. HSS Journal. 18 (2), 290-296 (2022).
- Stone, B., Nugent, M., Young, S. W., Frampton, C., Hooper, G. J. The lifetime risk of revision following total knee arthroplasty : a New Zealand Joint Registry study. The Bone and Joint Journal. 104-B (2), 235-241 (2022).
- Chen, D., et al. Osteoarthritis: toward a comprehensive understanding of pathological mechanism. Bone Research. 5, 16044(2017).
- Robinson, W. H., et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nature Review Rheumatology. 12 (10), 580-592 (2016).
- Perez-Garcia, S., et al. Profile of matrix-remodeling proteinases in osteoarthritis: impact of fibronectin. Cells. 9 (1), 40(2019).
- Hashimoto, S., Ochs, R. L., Komiya, S., Lotz, M. Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis. Arthritis Rheumatology. 41 (9), 1632-1638 (1998).
- Natoli, R. M., Athanasiou, K. A. Traumatic loading of articular cartilage: Mechanical and biological responses and post-injury treatment. Biorheology. 46 (6), 451-485 (2009).
- Coleman, M. C., Brouillette, M. J., Andresen, N. S., Oberley-Deegan, R. E., Martin, J. M. Differential effects of superoxide dismutase mimetics after mechanical overload of articular cartilage. Antioxidants (Basel). 6 (4), 98(2017).
- Goodwin, W., et al. Rotenone prevents impact-induced chondrocyte death. Journal of Orthopaedic Research. 28 (8), 1057-1063 (2010).
- Wolff, K. J., et al. Mechanical stress and ATP synthesis are coupled by mitochondrial oxidants in articular cartilage. Journal of Orthopaedic Research. 31 (2), 191-196 (2013).
- Delco, M. L., Bonnevie, E. D., Bonassar, L. J., Fortier, L. A. Mitochondrial dysfunction is an acute response of articular chondrocytes to mechanical injury. Journal of Orthopaedic Research. 36 (2), 739-750 (2018).
- Coleman, M. C., Ramakrishnan, P. S., Brouillette, M. J., Martin, J. A. Injurious loading of articular cartilage compromises chondrocyte respiratory function. Arthritis Rheumatology. 68 (3), 662-671 (2016).
- Bobinac, D., Spanjol, J., Zoricic, S., Maric, I. Changes in articular cartilage and subchondral bone histomorphometry in osteoarthritic knee joints in humans. Bone. 32 (3), 284-290 (2003).
- Coleman, M. C., et al. Targeting mitochondrial responses to intra-articular fracture to prevent posttraumatic osteoarthritis. Science Translational Medicine. 10 (427), eaan5372(2018).
- Heraud, F., Heraud, A., Harmand, M. F. Apoptosis in normal and osteoarthritic human articular cartilage. Annals of Rheumatological Diseases. 59 (12), 959-965 (2000).
- Narez, G. E., Fischenich, K. M., Donahue, T. L. H. Experimental animal models of post-traumatic osteoarthritis of the knee. Orthopedic Reviews (Pavia). 12 (2), 8448(2020).
- Fischenich, K. M., et al. Chronic changes in the articular cartilage and meniscus following traumatic impact to the lapine knee. Journal of Biomechanics. 48 (2), 246-253 (2015).
- Isaac, D. I., Meyer, E. G., Kopke, K. S., Haut, R. C. Chronic changes in the rabbit tibial plateau following blunt trauma to the tibiofemoral joint. Journal of Biomechanics. 43 (9), 1682-1688 (2010).
- Wei, F., et al. Post-traumatic osteoarthritis in rabbits following traumatic injury and surgical reconstruction of the knee. Annals of Biomedical Engineering. 50 (2), 169-182 (2022).
- Terracciano, R., et al. Quantitative high-resolution 7T MRI to assess longitudinal changes in articular cartilage after anterior cruciate ligament injury in a rabbit model of post-traumatic osteoarthritis. Osteoarthritis and Cartilage Open. 4 (2), 100259(2022).
- Huang, K., Cai, H. L., Zhang, P. L., Wu, L. D. Comparison between two rabbit models of posttraumatic osteoarthritis: A longitudinal tear in the medial meniscus and anterior cruciate ligament transection. Journal of Orthopaedic Research. 38 (12), 2721-2730 (2020).
- Sun, Z. B., Peng, H. Experimental Study on the prevention of posttraumatic osteoarthritis in the rabbit knee using a hinged external fixator in combination with exercises. Journal of Investigative Surgery. 32 (6), 552-559 (2019).
- Gardner, M. J., et al. The incidence of soft tissue injury in operative tibial plateau fractures: a magnetic resonance imaging analysis of 103 patients. Journal of Orthopedic Trauma. 19 (2), 79-84 (2005).
- Dilley, J. E. B. M. A., Roman, N., McKinley, T. O., Sankar, U. Post-traumatic osteoarthritis: A review of pathogenic mechanisms and novel targets for mitigation. Bone Reports. 18, 101658(2023).
- Seol, D., et al. Effects of knockout of the receptor for advanced glycation end-products on bone mineral density and synovitis in mice with intra-articular fractures. Journal of Orthopedic Research. 36 (9), 2439-2449 (2018).
- Furman, B. D., et al. Joint degeneration following closed intraarticular fracture in the mouse knee: a model of posttraumatic arthritis. Journal of Orthopedic Research. 25 (5), 578-592 (2007).
- Glasson, S. S., Chambers, M. G., Van Den Berg, W. B., Little, C. B. The OARSI histopathology initiative - recommendations for histological assessments of osteoarthritis in the mouse. Osteoarthritis Cartilage. 18 Suppl 3, S17-S23 (2010).
- McCoy, A. M. Animal models of osteoarthritis: comparisons and key considerations. Veterinary Pathology. 52 (5), 803-818 (2015).
- Fening, S. D., Jones, M. H., Moutzouros, V., Downs, B., Miniaci, A. Method for Delivering a controlled impact to articular cartilage in the rabbit knee. Cartilage. 1 (3), 211-216 (2010).
- Leucht, F., et al. Development of a new biomechanically defined single impact rabbit cartilage trauma model for in vivo-studies. Journal of Investigative Surgery. 25 (4), 235-241 (2012).
- Vrahas, M. S., Smith, G. A., Rosler, D. M., Baratta, R. V. Method to impact in vivo rabbit femoral cartilage with blows of quantifiable stress. Journal of Orthopedic Research. 15 (2), 314-317 (1997).
- Borrelli, J. Jr, Burns, M. E., Ricci, W. M., Silva, M. J. A method for delivering variable impact stresses to the articular cartilage of rabbit knees. Journal of Orthopedic Trauma. 16 (3), 182-188 (2002).
- Milentijevic, D., Rubel, I. F., Liew, A. S., Helfet, D. L., Torzilli, P. A. An in vivo rabbit model for cartilage trauma: a preliminary study of the influence of impact stress magnitude on chondrocyte death and matrix damage. Journal of Orthopedic Trauma. 19 (7), 466-473 (2005).
- Alexander, P. G., et al. An In vivo lapine model for impact-induced injury and osteoarthritic degeneration of articular cartilage. Cartilage. 3 (4), 323-333 (2012).
- Bonitsky, C. M., et al. Genipin crosslinking decreases the mechanical wear and biochemical degradation of impacted cartilage in vitro. Journal of Orthopedic Research. 35 (3), 558-565 (2017).
- Bartley, K. A., Johnson, C. H. Human Infant pants for postoperative protection during social housing of new zealand white rabbits (Oryctolagus cuniculus). Journal of the American Association for Laboratory Animal Science. 58 (4), 510-516 (2019).
- Lillie, R. D., Fullmer, H. M. Histopathologic technic and practical histochemistry. , 4th edn, Blakiston Division, McGraw-Hill. (1976).
- Armed Forces Institute of Pathology: Laboratory Methods in Histotechnology. Washington DC: American Registry of Pathology. Prophet, E., Mills, B., Arrington, J. B., Sobin, L. H. , (1992).
- Dilley, J. E., et al. CAMKK2 is upregulated in primary human osteoarthritis and its inhibition protects against chondrocyte apoptosis. Osteoarthritis and Cartilage. 31 (7), 908-918 (2023).
- Pritzker, K. P., et al. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis Cartilage. 14 (1), 13-29 (2006).
- Christiansen, B. A., et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 23 (10), 1627-1638 (2015).
- Borrelli, J., Zaegel, M. A., Martinez, M. D., Silva, M. J. Diminished cartilage creep properties and increased trabecular bone density following a single, sub-fracture impact of the rabbit femoral condyle. Journal of Orthopaedic Research. 28 (10), 1307-1314 (2010).
- Borrelli, J., Silva, M. J., Zaegel, M. A., Franz, C., Sandell, L. J. Single high-energy impact load causes posttraumatic OA in young rabbits via a decrease in cellular metabolism. Journal of Orthopedic Research. 27 (3), 347-352 (2009).
- Borrelli, J. Jr, Zhu, Y., Burns, M., Sandell, L., Silva, M. J. Cartilage tolerates single impact loads of as much as half the joint fracture threshold. Clinical Orthopedics and Related Research. 426, 266-273 (2004).
- Karnik, S., et al. Decreased SIRT1 activity is involved in the acute injury response of chondrocytes to ex vivo injurious mechanical overload. International Journal of Molecular Sciences. 24 (7), 6521(2023).
- Mevel, E., et al. Systemic inhibition or global deletion of CaMKK2 protects against post-traumatic osteoarthritis. Osteoarthritis Cartilage. 30 (1), 124-136 (2022).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。