È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un modello riproducibile di impatto della cartilagine per generare l'artrosi post-traumatica nel coniglio
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il modello aperto di impatto del condilo femorale mediale nei conigli è affidabile per lo studio dell'osteoartrite post-traumatica (PTOA) e di nuove strategie terapeutiche per mitigare la progressione della PTOA. Questo protocollo genera un difetto cartilagineo isolato del condilo femorale mediale posteriore nei conigli utilizzando una torre di caduta basata su carrello con una testa del dispositivo di impatto.
Abstract
L'osteoartrite post-traumatica (PTOA) è responsabile del 12% di tutti i casi di osteoartrite negli Stati Uniti. La PTOA può essere innescata da un singolo evento traumatico, come un carico ad alto impatto che agisce sulla cartilagine articolare, o da un'instabilità articolare, come avviene con la rottura del legamento crociato anteriore. Attualmente non esistono terapie efficaci per prevenire la PTOA. Lo sviluppo di un modello animale affidabile di PTOA è necessario per comprendere meglio i meccanismi attraverso i quali procede il danno alla cartilagine e per studiare nuove strategie di trattamento per alleviare o prevenire la progressione della PTOA. Questo protocollo descrive un modello di impatto del condilo femorale di coniglio aperto e basato su una torre di caduta per indurre danni alla cartilagine. Questo modello ha fornito carichi di picco di 579,1 ± 71,1 N e sollecitazioni di picco di 81,9 ± 10,1 MPa con un carico di picco di 2,4 ± 0,5 ms. La cartilagine articolare dei condili femorali mediali (MFC) impattati aveva tassi più elevati di cellule apoptotiche (p = 0,0058) e possedeva punteggi più elevati dell'Osteoarthritis Research Society International (OARSI) di 3,38 ± 1,43 rispetto alle MFC controlaterali non impattate (0,56 ± 0,42) e ad altre superfici cartilaginee del ginocchio impattato (p < 0,0001). Non sono state rilevate differenze nei punteggi OARSI tra le superfici articolari non impattate (p > 0,05).
Introduzione
L'osteoartrite post-traumatica (PTOA) è una delle principali cause di disabilità in tutto il mondo e rappresenta il 12%-16% dell'osteoartrite sintomatica (OA)1. L'attuale gold standard per la gestione dell'OA allo stadio terminale è l'artroplastica totale del ginocchio e dell'anca2 o artrodesi, come nel caso dell'artrite tibioastragalica o sottoastragalica allo stadio terminale. Sebbene abbia in gran parte successo, l'artroplastica può avere complicanze costose e morbose3. Inoltre, l'artroplastica è meno auspicabile nei pazienti di età inferiore ai 50 anni, data la bassa sopravvivenza all'impianto senza revisione, pari al 77%-83%4,5. Attualmente, non esistono trattamenti approvati dalla FDA per prevenire o mitigare la progressione della PTOA.
La PTOA colpisce l'intera articolazione, compreso il tessuto sinoviale, l'osso subcondrale e la cartilagine articolare. È caratterizzata da degenerazione della cartilagine articolare, infiammazione sinoviale, rimodellamento dell'osso subcondrale e formazione di osteofiti 6,7. Il fenotipo della PTOA si sviluppa attraverso un complesso processo di interazione tra cartilagine, sinovia e osso subcondrale. L'attuale comprensione è che la lesione della cartilagine porta alla liberazione di componenti della matrice extracellulare (ECM) come il collagene di tipo 2 (COL2) e l'aggrecano (ACAN). Questi frammenti di componenti dell'ECM sono pro-infiammatori e causano un aumento della produzione di IL-6, IL-1β e specie reattive dell'ossigeno. Questi mediatori agiscono sui condrociti, causando una sovraregolazione delle metalloproteinasi della matrice (MMP), come la MMP-13, che degradano la cartilagine articolare diminuendo anche la sintesi della matrice, portando a un ambiente catabolico complessivo per la cartilagine articolare8. Inoltre, vi è evidenza di un aumento dell'apoptosi dei condrociti nell'osteoartrite primaria e nella PTOA 9,10. La disfunzione mitocondriale si verifica dopo un carico sovrafisiologico della cartilagine 11,12,13,14, che può portare ad un aumento dell'apoptosi dei condrociti 12,15. L'aumento dell'apoptosi dei condrociti è stato associato a un aumento della deplezione dei proteoglicani e del catabolismo della cartilagine e ha dimostrato di precedere i cambiamenti nel rimodellamento della cartilagine e dell'osso subcondrale16,17,18.
Come per la maggior parte delle malattie umane, sono necessari modelli affidabili e traslazionali di PTOA per comprendere ulteriormente la fisiopatologia della malattia e testare nuove terapie. Animali di grandi dimensioni come suini e canini sono stati utilizzati in modelli di frattura intra-articolare e di impatto di PTOA17,19, ma sono costosi. I modelli animali più piccoli, come topi, ratti e conigli, sono meno costosi e vengono utilizzati per studiare la PTOA generata attraverso la destabilizzazione articolare, che in genere comporta la transezione chirurgica del legamento crociato anteriore (LCA) e/o la rottura del menisco mediale 20,21,22,23,24,25. Sebbene il trauma articolare possa portare a varie conseguenze, tra cui lesioni legamentose26, il sovraccarico meccanico della cartilagine si verifica in quasi tutti i casi.
Ci sono evidenze emergenti che la patologia alla base dello sviluppo della PTOA dopo l'instabilità legamentosa (come nella transezione del LCA) e il danno condrale acuto è dovuta a meccanismi distinti27. Pertanto, è importante sviluppare modelli di lesioni dirette alla cartilagine. Attualmente esiste un numero limitato di modelli di impatto che generano lesioni osteocondrali o condrali nei ratti e nei topi28,29. Tuttavia, la cartilagine murina non è adatta a generare difetti condrali isolati. Questo perché la cartilagine articolare murina ha uno spessore di soli 3-5 strati cellulari e manca di zone cartilaginee superficiali, radiali e di transizione organizzate, nonché dello spesso strato di cartilagine calcificata che si trova negli esseri umani e negli animali più grandi. I modelli murini mostrano anche una risoluzione spontanea dei difetti parziali della cartilagine30,31. Quindi, abbiamo scelto il coniglio per questo modello di impatto poiché il suo spessore e la sua organizzazione della cartilagine sono simili a quelli degli esseri umani, ed è il modello animale più piccolo che consentirà di fornire un impatto condrale coerente che si traduce in PTOA. Precedenti modelli chirurgici aperti dell'impatto del condilo femorale nel coniglio hanno impiegato un pendolo32, un dispositivo portatile per l'impatto della cartilagine caricato a molla 33 e una torre di caduta che ha permesso la creazione di un impattatore specifico per il coniglio34. Tuttavia, questi studi mancavano di dati in vivo. Altri hanno riportato dati in vivo con dispositivi a percussione a pendolo 35, pneumatici36 e caricati a molla37 10, e questi studi mostrano un alto tasso di variabilità nelle sollecitazioni di picco e nei tassi di carico tra i metodi. Tuttavia, il campo manca di un approccio coerente per modellare in modo affidabile il trauma acuto della cartilagine in vivo.
L'attuale protocollo impiega un sistema basato su una torre di caduta per fornire un impatto coerente al condilo mediale posteriore del ginocchio del coniglio. Un approccio posteriore al ginocchio viene impiegato per esporre il condilo femorale mediale posteriore. Un perno di Steinman viene quindi posizionato attraverso i condili femorali da mediale a laterale in linea con la superficie articolare e fissato alla piattaforma. Una volta fissato, un carico viene consegnato al condilo femorale mediale posteriore. Questo metodo consente di infliggere danni consistenti alla cartilagine sulla superficie portante del femore distale del coniglio.
Protocollo
La seguente procedura è stata eseguita con l'approvazione del Comitato per la cura e l'uso degli animali istituzionali della Indiana University School of Medicine (IACUC). Tutti gli interventi chirurgici di sopravvivenza sono stati eseguiti in condizioni sterili, come delineato dalle linee guida NIH. I rischi di dolore e infezione sono stati gestiti con analgesici e antibiotici adeguati per ottimizzare i risultati positivi. Per il presente studio sono stati utilizzati conigli bianchi neozelandesi maschi scheletricamente maturi, del peso di 3,0-4,0 kg.
1. Fabbricazione della torre di caduta
- Generare disegni CAD per i componenti della torre di caduta, della piattaforma di base e del meccanismo per fissare il perno di Steinman (Figure supplementari 1-14).
- Acquistare componenti disponibili in commercio (vedere la tabella dei materiali).
- Procurarsi le parti della macchina del dispositivo o fornire i disegni CAD a un macchinista per la fabbricazione.
NOTA: Per fabbricare la punta del dispositivo d'urto di 3 mm di diametro è necessario un macchinista di alta precisione con capacità di costruzione di utensili (Figura supplementare 1, parte 20 e Figure supplementari 13,14). La faccia d'impatto della testa del dispositivo d'urto presentava curvature di 7,14 mm e 5,56 mm rispettivamente sul piano sagittale e coronale, per conformarsi alla curvatura del condilo mediale del coniglio35 (Figure supplementari 13,14). - Assemblare le parti in modo tale che la torre di caduta sia costituita da un carrello che viaggia su due aste verticali tramite cuscinetti a sfere lineari ad allineamento fisso e che la piattaforma di base sostenga il coniglio e fissi il perno di Steinman (Figura 1 e Figura 2).
NOTA: La traversa del carrello di questo design ha una rigidità alla flessione pari a quella di una precedente torre di caduta38 con un livello di vibrazione accettabile.
2. Preparazione dell'animale
- Pesare il coniglio e anestetizzarlo con 2,5 mg/kg di alfaxalone e 0,15 mg/kg di midazolam IM (vedere Tabella dei materiali). Applicare l'unguento per gli occhi su entrambi gli occhi dopo l'induzione. Mantenere l'anestesia utilizzando ~2%-3% di isoflurano. Somministrare buprenorfina SR (0,1 mg/kg) SQ per analgesia ed enrofloxacina perioperatoria (10 mg/kg) SQ. Al posto della buprenorfina, possono essere somministrati FANS come il carprofene, 4 mg/kg o meloxicam, 0,2 – 0,3 mg/kg o ketoprofene, 3 mg/kg possono essere somministrati come iniezioni SQ.
- Radere l'arto posteriore del coniglio dalla caviglia ai quarti posteriori. Si consiglia una maggiore cautela nella depilazione del coniglio per evitare la contaminazione dell'incisione. L'uso di un set di tagliacapelli per conigli dedicati e affilati è importante.
- Posizionare il blocco della gamba anteriore in acciaio inossidabile (Figura supplementare 1, parte n. 2 e Figura supplementare 4) sotto l'estremità della piattaforma d'impatto e coprire la piattaforma con un termoforo. Posiziona lo sternale del coniglio (cioè prono) sul termoforo. Posiziona una protuberanza imbottita sotto l'anca controlaterale.
- Assicurarsi che l'estremità operatoria abbia il ginocchio centrato e appoggiato sul blocco di polietilene (Figura 2A1). Utilizzare del nastro di seta per ritrarre delicatamente la coda superiore e controlaterale all'estremità operativa.
- Pulire il sito chirurgico con cloroesidina e garza sterile imbevuta di alcol al 70%. Strofinare il sito chirurgico, partendo dal ginocchio posteriore, con una spazzata circolare verso l'esterno. Ripetere almeno 3 volte con scrub freschi, terminando con il 70% di alcol.
- Posizionare un guanto sterile sul piede operatorio fino alla caviglia e avvolgerlo con un bendaggio coesivo sterile.
- Coprire sterilmente il sito chirurgico con tre tende: una direttamente sotto l'estremità operatoria e le altre due per coprire il resto del corpo. Fissare le tende con morsetti per asciugamani.
3. Esposizione chirurgica
NOTA: Prima dell'intervento chirurgico e dell'impatto, il peso e l'altezza di caduta che forniscono danni visibili alla cartilagine senza frattura dell'osso subcondrale devono essere determinati empiricamente per il ceppo specifico, l'età e il sesso del coniglio.
- Palpare la posizione della rotula anteriormente per stimare la posizione dell'articolazione del ginocchio, che si trova distale alla rotula. Utilizzando una lama da 15, praticare un'incisione di 3-4 cm lungo la faccia posteriore del ginocchio esteso dal livello del polo superiore della rotula distalmente.
- Eseguire dissezioni smussate e taglienti attraverso la fascia superficiale sottostante. Sviluppare l'intervallo tra la pelle medialmente e il gastrocnemio mediale lateralmente. Collocare un divaricatore Weitlaner autobloccante in questo intervallo (vedere la tabella dei materiali).
- Uno strato fasciale secondario diventerà visibile appena sopra l'arteria e la vena safena. Sezionare lateralmente alla safena e ritrarre medialmente la vascolarizzazione e lateralmente il complesso gastrocsoleo posteriore.
NOTA: Fare attenzione a non tagliare questa vascolarizzazione. Se questa arteria è danneggiata, assicurarsi che la legatura sia corretta, poiché può verificarsi uno shock emorragico post-operatorio.
- Uno strato fasciale secondario diventerà visibile appena sopra l'arteria e la vena safena. Sezionare lateralmente alla safena e ritrarre medialmente la vascolarizzazione e lateralmente il complesso gastrocsoleo posteriore.
- Sezionare distalmente fino a quando non viene identificata una piccola fabella mobile sopra il condilo femorale mediale posteriore. Eseguire un'artrotomia per mobilizzare la fabella superolaterale, esponendo il condilo femorale mediale sottostante. Rimuovere delicatamente i tessuti molli mediante una dissezione smussata e netta per esporre l'aspetto posteriore del condilo femorale mediale. Utilizzare un auto-ritentore Freer and Cricket (vedere Tabella dei materiali) per ritrarre i tessuti molli a questo livello.
- Mantenendo il condilo esposto, far avanzare un perno di Steinman da 0,062 pollici (vedi Tabella dei materiali) attraverso il femore distale, iniziando dall'aspetto superiore del condilo femorale mediale e centrato nella direzione anteriore-posteriore del condilo femorale mediale, a circa 5 mm dall'aspetto posteriore del condilo.
- Guidare il filo lateralmente attraverso l'osso e la pelle laterale parallelamente alla superficie dell'articolazione utilizzando un perno Steinman alimentato a batteria. La palpazione dell'epicondilo laterale garantirà la traiettoria appropriata del perno di Steinman.
- Rimuovere i divaricatori e chiudere la pelle con una sutura in polisorbo 3-0 (vedere la tabella dei materiali) in modo continuo. Coprire l'incisione con una garza sterile.
4. Impatto del condilo femorale
- Rimuovere il telo sotto l'arto operativo e fissare il perno Steinman a una piattaforma di impatto personalizzabile e regolabile in altezza. Innanzitutto, posizionare l'aspetto inferiore regolabile in altezza dell'apparato di fissaggio del perno di Steinman sotto il perno (Figura 2A2). Assicurarsi che il filo sia parallelo al terreno su questa piattaforma regolando l'altezza delle viti secondo necessità.
- Dopo essersi assicurati che il perno di Steinman sia parallelo al suolo, posizionare l'aspetto superiore basato su vite della piattaforma di sicurezza (Figura 2A3) sull'aspetto inferiore basato su vite del pezzo regolabile in altezza. Assicurarsi che il perno Steinman sia saldamente fissato avvitando la barra superiore nella parte inferiore regolabile in altezza della piattaforma di supporto del perno (Figura 2A2).
- Una volta che il perno di Steinman è fissato alla piattaforma, rimuovere la sutura e riaprire l'incisione. Esporre il condilo femorale mediale con divaricatori autobloccanti Weitlaner e cricket. Potrebbe essere necessario un ulteriore Freer per ritrarre ulteriori tessuti molli fuori dal percorso della punta del dispositivo d'urto (Figura 2B).
- Pulisci la torre di caduta con un disinfettante approvato. Fissare la testa sterile del dispositivo di simulazione da 3 mm (Figura 2A4) al carrello della torre di caduta. Portare la torre di caduta sopra l'estremità operativa e posizionare la sua base (Figura 2A6) sotto la piattaforma d'impatto (Figura 3A).
- Abbassare delicatamente il dispositivo d'urto (Figura supplementare 2, parte 20 e Figura supplementare 13) al centro del condilo femorale mediale posteriore. Assicurarsi che non vi siano tessuti molli nel percorso del dispositivo d'urto.
- Spostare il coniglio o la torre secondo necessità per assicurarsi che la testa del dispositivo d'urto sia centrata sul condilo femorale mediale posteriore (Figura 3B). Ogni volta che il coniglio viene spostato o riposizionato, il sito chirurgico deve essere valutato per eventuali interruzioni della sterilità e l'area deve essere risterilizzata se necessario.
- Una volta assicurata la traiettoria appropriata, clamp la torre sulla piattaforma con i morsetti a ginocchiera (Figura 2A5, vedere la tabella dei materiali).
- Somministrare una dose di alfaxalone per via endovenosa (0,5-0,7 mg/kg) 5-10 minuti prima dell'impatto per un'anestesia più profonda senza aumentare l'anestesia inalante.
NOTA: La mancanza di riflesso palpebrale, il ritiro del pedale e il riflesso del padiglione auricolare evidenziano un'anestesia più profonda. Questa anestesia più profonda aiuta a prevenire possibili reazioni agli arti durante il posizionamento nell'apparecchio e durante l'impatto.
ATTENZIONE: Se somministrato troppo rapidamente, alfaxalone può causare apnea transitoria e ipossia nei conigli e deve essere somministrato lentamente nell'arco di 1-2 minuti. Se si verifica ipossia, assicurarsi che l'adeguata ossigenazione e il ripristino dei parametri vitali prima di procedere. - Posizionare l'impattatore sulla torre di caduta all'altezza desiderata sopra il condilo femorale mediale. Per l'attuale gruppo carrello, compresi i cuscinetti, con una massa di 1,41 kg, si tratta di un'altezza di 7 cm.
NOTA: L'altezza della torre di caduta è stata determinata da studi pilota su tessuto da cadavere. Questa altezza ha generato danni visibili alla cartilagine ma non fratture ossee subcondrali per i conigli in questo studio. - Fare clic sul pulsante Start del software di acquisizione dati LabVIEW (Supplementary Coding File 1) appena prima di liberare l'arresto del mandrino (Figura 2 supplementare, elemento n. 14) per rilasciare il carrello e lasciarlo cadere sotto la forza di gravità.
NOTA: Il software di acquisizione dati raccoglierà i dati da una cella di carico (Figura 1, 6) posizionata tra il dispositivo d'urto e il carrello e da un accelerometro (Figura 1, 7) durante l'impatto a 100 kHz utilizzando un laptop collegato a un modulo di acquisizione dati. - Posizionare il file txt generato dal software di acquisizione dati nella stessa cartella con il codice di analisi dei dati Matlab (Supplementary Coding File 2) ed eseguire il codice di analisi dei dati per filtrare i dati grezzi e calcolare i parametri di impatto.
- Assicurarsi che sia identificato il carico massimo. Il punto temporale associato è considerato il tempo di massima deformazione e velocità zero.
NOTA: il codice di analisi dei dati analizzerà tutti i file txt nella cartella e riporterà i risultati per ciascun file. Il codice determinerà l'inizio e la fine dell'impatto in base alle modifiche apportate ai dati relativi al tempo di caricamento. I dati dell'accelerometro saranno integrati numericamente per calcolare la velocità e integrati di nuovo per calcolare lo spostamento. Il codice di analisi dei dati calcolerà numericamente l'impulso, il lavoro e l'energia cinetica dalle seguenti formule:
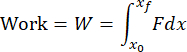

dove F è la forza misurata dal sensore di carico, x 0 e t 0 sono lo spostamento e il tempo all'inizio dell'impatto, e x e tf sono lo spostamento e il tempo alla fine dell'impatto. La velocità di carico sarà calcolata numericamente come media di dσ/dt nella fase di carico dell'impatto. La sollecitazione di picco sarà calcolata dividendo il carico di picco per l'area di contatto della testa del dispositivo d'urto. - Eseguire la visualizzazione della superficie della cartilagine per determinare se si è verificato un danno alla cartilagine appropriato (Figura 4A).
5. Chiusura del sito chirurgico
- Rimuovere la torre di caduta dall'estremità operativa. Mettere da parte tutti gli strumenti chirurgici usati e indossare nuovi guanti sterili.
NOTA: Dato che la torre di caduta non è sterile, tutti gli strumenti utilizzati fino all'impatto devono ora essere considerati contaminati. - Riapplicare un telo sterile sull'arto inferiore e procurarsi autodivaricatori sterili non utilizzati.
- Riesporre il condilo femorale mediale e irrigare accuratamente il sito chirurgico con 50-60 ml di soluzione fisiologica sterile.
- Chiudere la capsula posteriore con una sutura 5-0 polysorb, seguita dalla chiusura cutanea con una sutura monosorb 4-0 (vedere la tabella dei materiali).
- Iniettare 2 mL di lidocaina/bupivacaina per l'analgesia locale intorno all'incisione intradermica.
- Rimuovere il perno Steinman con un set di driver di alimentazione (vedere la tabella dei materiali) oscillando per ridurre al minimo le lesioni ai tessuti molli.
- Medicare la ferita con una medicazione non adesiva, seguita da nastro adesivo. Eseguire una radiografia dell'arto operatorio per assicurarsi che non si sia verificata alcuna frattura e che il perno sia posizionato in modo appropriato (Figura 4B).
6. Gestione post-operatoria
- Rimetti il coniglio nella sua gabbia e monitoralo su coperte riscaldate fino a quando non si riprende dall'anestesia (~25 min).
- Continuare a monitorare attentamente i conigli per diversi giorni dopo l'intervento chirurgico per assicurarsi che guariscano correttamente e riacquistino la mobilità. Somministrare enrofloxacina (10 mg/kg) per 2 giorni dopo l'intervento per la profilassi delle infezioni. Somministrare buprenorfina SR analgesia (0,1 mg/kg) per via sottocutanea ogni 2-3 giorni dopo l'intervento e secondo necessità. Al posto della buprenorfina, i FANS come il carprofene, 4 mg/kg di SQ al giorno, il meloxicam, 0,2 – 0,3 mg/kg di SQ al giorno fino a 3 giorni o il ketoprofene, 3 mg/kg di SQ al giorno possono essere somministrati 3-5 giorni dopo l'intervento chirurgico e secondo necessità.
NOTA: Siamo riusciti a prevenire la deiscenza della ferita postoperatoria, dovuta al leccamento o alla masticazione del coniglio, con il posizionamento di mutandine neonatali umane sugli arti posteriori39. Se il coniglio mastica i pantaloni, si può posizionare un collare elisabettiano (vedi Tabella dei materiali) per evitare di masticare l'incisione.
7. Valutazione istologica
- A 16 settimane dall'infortunio, prelevare le ginocchia dai conigli sottoposti a eutanasia, fissarle in formalina tamponata neutra al 10% per 48 ore, quindi incorporare la paraffina e sezionarle in fette spesse 5 μm.
- Dopo la de-paraffinazione e la reidratazione, colorare le sezioni con safranina O verde rapido secondo i protocolli standard40,41.
- Eseguire il test TUNEL (Terminal Deoxynucleotidyl Transferase dUTP nick end labeling) sulle sezioni utilizzando il kit di rilevamento dell'apoptosi cromogenica TUNEL seguendo le istruzioni del produttore, controcolorato con ematossilina42 (vedere la tabella dei materiali).
Risultati
Il successo di questa procedura è stato monitorato immediatamente dopo l'impatto mediante la visualizzazione del condilo da parte del chirurgo (Figura 4A) e mediante radiografia per garantire che non si verificasse alcuna frattura (Figura 4B). C'è il rischio di fallimento dell'impatto che porta a una frattura intraoperatoria del condilo. Ciò era in genere dovuto a un posizionamento improprio dei perni di Steinman (Figura 5). Util...
Discussione
Questa procedura chirurgica mira a generare un danno cartilagineo consistente alla superficie portante del condilo femorale mediale del coniglio in un modello di PTOA. Un vantaggio di questa procedura è che l'approccio posteriore al ginocchio consente la visualizzazione diretta del condilo femorale mediale posteriore completo e può essere eseguito in circa 37 minuti (Tabella 2). Va anche notato che questo è un modello di lesione aperto e può portare a cambiamenti infiammatori acuti oltre il semplice ...
Divulgazioni
Roman Natoli tiene conferenze per AO Trauma North America, è un editore di sezione per Current Osteoporosis Reports e ha ricevuto i diritti d'autore dei libri di testo da Morgan e Claypool. Todd McKinley riceve royalties da Innomed. Gli altri autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato supportato dal DoD Peer Reviewed Medical Research Program - Investigator-Initiated Research Award W81XWH-20-1-0304 dall'U.S. ARMY MEDICAL RESEARCH ACQUISITION ACTIVITY, dal NIH NIAMS R01AR076477 e da un programma completo di formazione muscoloscheletrica T32 dal NIH (AR065971) e dal NIH NIAMS Grant R01 AR069657. Gli autori desiderano ringraziare Kevin Carr per aver fornito la sua esperienza nella lavorazione e nella fabbricazione a questo progetto, e Drew Brown e l'Indiana Center for Musculoskeletal Health Bone Histology Core per l'aiuto con l'istologia.
Materiali
| Name | Company | Catalog Number | Comments |
| Flat head screw | McMaster-Carr | 92210A194 | Stainless steel hex drive flat head screw, 8-32, 1/2" |
| #15 scalpel blades | McKesson | 1029066 | Scalpel McKesson No. 15 Stainless Steel / Plastic Classic Grip Handle Sterile Disposable |
| 1/2”-20 threaded rod | McMaster-Carr | 99065A120 | 1/2”-20 threaded rod |
| 10 mL syringe | McKesson | 1031801 | For irrigation; General Purpose Syringe McKesson 10 mL Blister Pack Luer Lock Tip Without Safety |
| 3 mL syringe | McKesson | 1031804 | For lidocaine/bupiviacaine injection; General Purpose Syringe McKesson 3 mL Blister Pack Luer Lock Tip Without Safety. |
| 3-0 polysorb | Ethicon | J332H | 3-0 Vircryl, CT-2, 1/2 circle, 26 mm, tapered |
| 4-0 monosorb | Ethicon | Z397H | 4-0 PDS 2, FS-2, 3/8 circle, 19mm, cutting edge |
| 5-0 polysorb | Med Vet International | NC9335902 | Med Vet International 5-0 ETHICON COATED VICRYL C-3 |
| Accelerometer | Kistler | 8743A5 | Accelerometer |
| Adson-Browns Forceps | World precision tools | 500177 | Adson-Brown Forceps, 12 cm, Straight, TC Jaws, 7 x 7 Teeth |
| Alfaxalone | Jurox | 49480-002-01 | Alfaxan Multidose by Jurox : 10 mg/mL |
| Buprenorphine | Par Pharmaceuticals | 42023-0179-05 | Buprenorphine HCL injection: 0.3 mg/mL |
| Butorphanol | Zoetis | 54771-2033 | Butorphanol tartrate 10mg/ml by Zoetis |
| Chlorhexidine Hand Scrub | BD | 371073 | BD E-Z Scrub 107 Surgical Scrub Brush/Sponge, 4% CHG, Red |
| Collet | STRYKER | 14023 | Stryker 4100-62 wire Collet 0.28-0.71'' |
| Cordless Driver handpiece | STRYKER | OR-S4300 | Stryker 4300 CD3 Cordless Driver 3 handpiece |
| Cricket Retractors | Novosurgical | G3510 21 | 2x Heiss (Holzheimer) Cross Action Retractor |
| Dissector Scissors | Jorvet labs | J0662 | Aesculap AG, Metzenbaum, Scissors, Straight 5 3/4″ |
| Elizabethian Collar | ElizaSoft | 62054 | ElizaSoft Elizabethan Recovery Collar |
| Enrofloxacin | Custom Meds | Enrofloxacin compounded by Custom Meds | |
| Eye Ointment | Pivetal | 46066-753-55 | Pivetal Articifical Tears- recently recalled |
| Face-mount shaft collar | McMaster-Carr | 5631T11 | Face-mount shaft collar |
| Fast green | Millipore Sigma | F7258 | Fast green |
| Freer | Jorvet labs | J0226Q | Freer elevator |
| Head screw -1 | McMaster-Carr | 91251A197 | Black-oxide alloy steel socket head screw, 8-32, 3/4" |
| Head screw -2 | McMaster-Carr | 92196A194 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -3 | McMaster-Carr | 92196A146 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -4 | McMaster-Carr | 92196A151 | Stainless steel socket head screw, 6-32, 3/4" |
| Hematoxylin Solution, Gill No. 1 | Millipore Sigma | GHS132-1L | Hematoxylin Solution, Gill No. 1 |
| Hex nut | McMaster-Carr | 91841A007 | Stainless steel hex nut, 6-32 |
| Hold-down toggle clamp | McMaster-Carr | 5126A71 | Hold-down toggle clamp |
| Impact device | n/a | n/a | custom made |
| Impact platform | n/a | n/a | custom made |
| K-wires | Jorvet Labs | J0250A | JorVet Intramedullary Steinman Pins, Trocar-Trocar 1/16" x 7" |
| Lab View | National Instruments | n/a | n/a |
| Load cell | Kistler | 9712B5000 | Load cell |
| MATLAB | The MathWorks Inc. | n/a | n/a |
| Microscope | Leica | DMi-8 | Leica DMi8 microscope with LAS-X software |
| Midazolam | Almaject | 72611-749-10 | Midazolam Hydrochloride injection: 5mg/ml by Almaject |
| milling machine depth stops | McMaster-Carr | 2949A71 | Clamp-on milling machine depth stops |
| Mobile C-arm | Philips | 718095 | BV Pulsera, Mobile C-arm |
| Mounted linear ball bearing | McMaster-Carr | 9338T7 | Mounted linear ball bearing |
| Needle Driver | A2Z Scilab | A2ZTCIN39 | TC Webster Needle Holder Smooth Jaws 5", Premium |
| Pentobarbital | Vortech | 0298-9373-68 | Pentobarbital 390 mg/mL by Vortech |
| Safranin O | Millipore Sigma | HT90432 | Safranin O |
| Small Battery pack | STRYKER | NS014036 | 6212 Small Battery pack- 9.6 V |
| Steel rod, 2’ | McMaster-Carr | 89535K25 | Steel rod, 2’ |
| Sterile Saline | ICU Medical | 6139-22 | AquaLite Solution Pour Bottles, 250 mL |
| Stryker 6110-120 System 6 Battery Charger | STRYKER | OR-S6110-120 | |
| Surgical gloves | McKesson | 1044729 | Surgical Glove McKesson Perry Size 6.5 Sterile Pair Latex Extended Cuff Length Smooth Brown Not Chemo Approved |
| Surgical gown | McKesson | 1104452 | Non-Reinforced Surgical Gown with Towel McKesson Large Blue Sterile AAMI Level 3 Disposable |
| Suture scissors | Jorvet Labs | J0910SA | Super Cut Scissors, Mayo, Straight, 5 1/2″ |
| TUNEL staining kit | ABP Bioscience | A049 | TUNEL Chromogenic Apoptosis Detection Kit |
| Weitlaner Retractors | Fine Science Tools | 17012-11 | 2x Weitlaner-Locktite Retractors |
Riferimenti
- Thomas, A. C., Hubbard-Turner, T., Wikstrom, E. A., Palmieri-Smith, R. M. Epidemiology of posttraumatic osteoarthritis. Journal of Athletic Training. 52 (6), 491-496 (2017).
- Pasquale, M. K., et al. Healthcare Utilization and costs of knee or hip replacements versus pain-relief injections. American Health Drug Benefits. 8 (7), 384-394 (2015).
- Yao, J. J., et al. Direct Inpatient medical costs of operative treatment of periprosthetic hip and knee infections are twofold higher than those of aseptic revisions. Journal of Bone and Joint Surgery America. 103 (4), 312-318 (2021).
- Anatone, A. J., et al. Decreased implant survival is associated with younger patients undergoing total knee arthroplasty. HSS Journal. 18 (2), 290-296 (2022).
- Stone, B., Nugent, M., Young, S. W., Frampton, C., Hooper, G. J. The lifetime risk of revision following total knee arthroplasty : a New Zealand Joint Registry study. The Bone and Joint Journal. 104-B (2), 235-241 (2022).
- Chen, D., et al. Osteoarthritis: toward a comprehensive understanding of pathological mechanism. Bone Research. 5, 16044 (2017).
- Robinson, W. H., et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nature Review Rheumatology. 12 (10), 580-592 (2016).
- Perez-Garcia, S., et al. Profile of matrix-remodeling proteinases in osteoarthritis: impact of fibronectin. Cells. 9 (1), 40 (2019).
- Hashimoto, S., Ochs, R. L., Komiya, S., Lotz, M. Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis. Arthritis Rheumatology. 41 (9), 1632-1638 (1998).
- Natoli, R. M., Athanasiou, K. A. Traumatic loading of articular cartilage: Mechanical and biological responses and post-injury treatment. Biorheology. 46 (6), 451-485 (2009).
- Coleman, M. C., Brouillette, M. J., Andresen, N. S., Oberley-Deegan, R. E., Martin, J. M. Differential effects of superoxide dismutase mimetics after mechanical overload of articular cartilage. Antioxidants (Basel). 6 (4), 98 (2017).
- Goodwin, W., et al. Rotenone prevents impact-induced chondrocyte death. Journal of Orthopaedic Research. 28 (8), 1057-1063 (2010).
- Wolff, K. J., et al. Mechanical stress and ATP synthesis are coupled by mitochondrial oxidants in articular cartilage. Journal of Orthopaedic Research. 31 (2), 191-196 (2013).
- Delco, M. L., Bonnevie, E. D., Bonassar, L. J., Fortier, L. A. Mitochondrial dysfunction is an acute response of articular chondrocytes to mechanical injury. Journal of Orthopaedic Research. 36 (2), 739-750 (2018).
- Coleman, M. C., Ramakrishnan, P. S., Brouillette, M. J., Martin, J. A. Injurious loading of articular cartilage compromises chondrocyte respiratory function. Arthritis Rheumatology. 68 (3), 662-671 (2016).
- Bobinac, D., Spanjol, J., Zoricic, S., Maric, I. Changes in articular cartilage and subchondral bone histomorphometry in osteoarthritic knee joints in humans. Bone. 32 (3), 284-290 (2003).
- Coleman, M. C., et al. Targeting mitochondrial responses to intra-articular fracture to prevent posttraumatic osteoarthritis. Science Translational Medicine. 10 (427), eaan5372 (2018).
- Heraud, F., Heraud, A., Harmand, M. F. Apoptosis in normal and osteoarthritic human articular cartilage. Annals of Rheumatological Diseases. 59 (12), 959-965 (2000).
- Narez, G. E., Fischenich, K. M., Donahue, T. L. H. Experimental animal models of post-traumatic osteoarthritis of the knee. Orthopedic Reviews (Pavia). 12 (2), 8448 (2020).
- Fischenich, K. M., et al. Chronic changes in the articular cartilage and meniscus following traumatic impact to the lapine knee. Journal of Biomechanics. 48 (2), 246-253 (2015).
- Isaac, D. I., Meyer, E. G., Kopke, K. S., Haut, R. C. Chronic changes in the rabbit tibial plateau following blunt trauma to the tibiofemoral joint. Journal of Biomechanics. 43 (9), 1682-1688 (2010).
- Wei, F., et al. Post-traumatic osteoarthritis in rabbits following traumatic injury and surgical reconstruction of the knee. Annals of Biomedical Engineering. 50 (2), 169-182 (2022).
- Terracciano, R., et al. Quantitative high-resolution 7T MRI to assess longitudinal changes in articular cartilage after anterior cruciate ligament injury in a rabbit model of post-traumatic osteoarthritis. Osteoarthritis and Cartilage Open. 4 (2), 100259 (2022).
- Huang, K., Cai, H. L., Zhang, P. L., Wu, L. D. Comparison between two rabbit models of posttraumatic osteoarthritis: A longitudinal tear in the medial meniscus and anterior cruciate ligament transection. Journal of Orthopaedic Research. 38 (12), 2721-2730 (2020).
- Sun, Z. B., Peng, H. Experimental Study on the prevention of posttraumatic osteoarthritis in the rabbit knee using a hinged external fixator in combination with exercises. Journal of Investigative Surgery. 32 (6), 552-559 (2019).
- Gardner, M. J., et al. The incidence of soft tissue injury in operative tibial plateau fractures: a magnetic resonance imaging analysis of 103 patients. Journal of Orthopedic Trauma. 19 (2), 79-84 (2005).
- Dilley, J. E. B. . M. A., Roman, N., McKinley, T. O., Sankar, U. Post-traumatic osteoarthritis: A review of pathogenic mechanisms and novel targets for mitigation. Bone Reports. 18, 101658 (2023).
- Seol, D., et al. Effects of knockout of the receptor for advanced glycation end-products on bone mineral density and synovitis in mice with intra-articular fractures. Journal of Orthopedic Research. 36 (9), 2439-2449 (2018).
- Furman, B. D., et al. Joint degeneration following closed intraarticular fracture in the mouse knee: a model of posttraumatic arthritis. Journal of Orthopedic Research. 25 (5), 578-592 (2007).
- Glasson, S. S., Chambers, M. G., Van Den Berg, W. B., Little, C. B. The OARSI histopathology initiative - recommendations for histological assessments of osteoarthritis in the mouse. Osteoarthritis Cartilage. 18 Suppl 3, S17-S23 (2010).
- McCoy, A. M. Animal models of osteoarthritis: comparisons and key considerations. Veterinary Pathology. 52 (5), 803-818 (2015).
- Fening, S. D., Jones, M. H., Moutzouros, V., Downs, B., Miniaci, A. Method for Delivering a controlled impact to articular cartilage in the rabbit knee. Cartilage. 1 (3), 211-216 (2010).
- Leucht, F., et al. Development of a new biomechanically defined single impact rabbit cartilage trauma model for in vivo-studies. Journal of Investigative Surgery. 25 (4), 235-241 (2012).
- Vrahas, M. S., Smith, G. A., Rosler, D. M., Baratta, R. V. Method to impact in vivo rabbit femoral cartilage with blows of quantifiable stress. Journal of Orthopedic Research. 15 (2), 314-317 (1997).
- Borrelli, J., Burns, M. E., Ricci, W. M., Silva, M. J. A method for delivering variable impact stresses to the articular cartilage of rabbit knees. Journal of Orthopedic Trauma. 16 (3), 182-188 (2002).
- Milentijevic, D., Rubel, I. F., Liew, A. S., Helfet, D. L., Torzilli, P. A. An in vivo rabbit model for cartilage trauma: a preliminary study of the influence of impact stress magnitude on chondrocyte death and matrix damage. Journal of Orthopedic Trauma. 19 (7), 466-473 (2005).
- Alexander, P. G., et al. An In vivo lapine model for impact-induced injury and osteoarthritic degeneration of articular cartilage. Cartilage. 3 (4), 323-333 (2012).
- Bonitsky, C. M., et al. Genipin crosslinking decreases the mechanical wear and biochemical degradation of impacted cartilage in vitro. Journal of Orthopedic Research. 35 (3), 558-565 (2017).
- Bartley, K. A., Johnson, C. H. Human Infant pants for postoperative protection during social housing of new zealand white rabbits (Oryctolagus cuniculus). Journal of the American Association for Laboratory Animal Science. 58 (4), 510-516 (2019).
- Lillie, R. D., Fullmer, H. M. . Histopathologic technic and practical histochemistry. , (1976).
- Prophet, E., Mills, B., Arrington, J. B., Sobin, L. H. . Armed Forces Institute of Pathology: Laboratory Methods in Histotechnology. Washington DC: American Registry of Pathology. , (1992).
- Dilley, J. E., et al. CAMKK2 is upregulated in primary human osteoarthritis and its inhibition protects against chondrocyte apoptosis. Osteoarthritis and Cartilage. 31 (7), 908-918 (2023).
- Pritzker, K. P., et al. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis Cartilage. 14 (1), 13-29 (2006).
- Christiansen, B. A., et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 23 (10), 1627-1638 (2015).
- Borrelli, J., Zaegel, M. A., Martinez, M. D., Silva, M. J. Diminished cartilage creep properties and increased trabecular bone density following a single, sub-fracture impact of the rabbit femoral condyle. Journal of Orthopaedic Research. 28 (10), 1307-1314 (2010).
- Borrelli, J., Silva, M. J., Zaegel, M. A., Franz, C., Sandell, L. J. Single high-energy impact load causes posttraumatic OA in young rabbits via a decrease in cellular metabolism. Journal of Orthopedic Research. 27 (3), 347-352 (2009).
- Borrelli, J., Zhu, Y., Burns, M., Sandell, L., Silva, M. J. Cartilage tolerates single impact loads of as much as half the joint fracture threshold. Clinical Orthopedics and Related Research. 426, 266-273 (2004).
- Karnik, S., et al. Decreased SIRT1 activity is involved in the acute injury response of chondrocytes to ex vivo injurious mechanical overload. International Journal of Molecular Sciences. 24 (7), 6521 (2023).
- Mevel, E., et al. Systemic inhibition or global deletion of CaMKK2 protects against post-traumatic osteoarthritis. Osteoarthritis Cartilage. 30 (1), 124-136 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon