Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Воспроизводимая модель хрящевого удара для формирования посттравматического остеоартрита у кролика
* Эти авторы внесли равный вклад
В этой статье
Резюме
Модель воздействия открытого медиального мыщелка бедренной кости у кроликов надежна для изучения посттравматического остеоартрита (ПТОА) и новых терапевтических стратегий для смягчения прогрессирования ПТС. Этот протокол генерирует изолированный дефект хряща заднего медиального мыщелка бедренной кости у кроликов с использованием подвесной башни на базе каретки с ударной головкой.
Аннотация
Посттравматический остеоартрит (PTOA) является причиной 12% всех случаев остеоартрита в Соединенных Штатах. ПТА может быть инициирована единичным травматическим событием, таким как сильная ударная нагрузка, действующая на суставной хрящ, или нестабильностью сустава, как это происходит при разрыве передней крестообразной связки. В настоящее время не существует эффективных терапевтических средств для профилактики ПТОС. Разработка надежной модели ПТА на животных необходима для лучшего понимания механизмов, с помощью которых происходит повреждение хряща, и для изучения новых стратегий лечения для облегчения или предотвращения прогрессирования ПТОА. В этом протоколе описывается модель воздействия мыщелка бедренной кости кролика с открытой башней для индуцирования повреждения хряща. Эта модель обеспечивала пиковые нагрузки 579,1 ± 71,1 Н и пиковые напряжения 81,9 ± 10,1 МПа при нагрузке 2,4 ± 0,5 мс. Суставной хрящ из ретинированных медиальных мыщелков бедренной кости (MFC) имел более высокую частоту апоптотических клеток (p = 0,0058) и обладал более высокими баллами по шкале Международного общества исследования остеоартрита (OARSI) 3,38 ± 1,43 по сравнению с неретинированными контралатеральными MFC (0,56 ± 0,42), а другие хрящевые поверхности пораженного коленного сустава (p < 0,0001). Различий в показателях OARSI не выявлено среди суставных поверхностей без ретинации (p > 0,05).
Введение
Посттравматический остеоартрит (ПТОА) является ведущей причиной инвалидности во всем мире и составляет 12–16% случаев симптоматического остеоартрита (ОА)1. В настоящее время золотым стандартом лечения терминальной стадии ОА является тотальное эндопротезирование коленного и тазобедренного суставов2 или артродез, как и в случае терминальной стадии большеберцового или подтаранного артрита. Несмотря на то, что эндопротезирование в значительной степени успешно, оно может иметь дорогостоящие и болезненные осложнения3. Кроме того, эндопротезирование менее желательно у пациентов моложе 50 лет, учитывая низкую выживаемость имплантатов без ревизии - 77%-83%4,5. В настоящее время не существует одобренных FDA методов лечения для предотвращения или смягчения прогрессирования PTOA.
ПТОА поражает весь сустав, включая синовиальную ткань, субхондральную кость и суставной хрящ. Характеризуется дегенерацией суставного хряща, воспалением синовиальной оболочки, субхондральным ремоделированием кости и образованием остеофитов 6,7. Фенотип ПТА развивается в результате сложного процесса взаимодействия между хрящом, синовиальной оболочкой и субхондральной костью. В настоящее время считается, что повреждение хряща приводит к высвобождению компонентов внеклеточного матрикса (ECM), таких как коллаген 2-го типа (COL2) и аггрекан (ACAN). Эти фрагменты компонентов ECM являются провоспалительными и вызывают повышенную продукцию IL-6, IL-1β и активных форм кислорода. Эти медиаторы действуют на хондроциты, вызывая повышенную регуляцию матриксных металлопротеиназ (ММП), таких как MMP-13, которые разрушают суставной хрящ, а также снижают синтез матрикса, что приводит к созданию общей катаболической среды для суставного хряща8. Кроме того, имеются данные о повышенном апоптозе хондроцитов при первичном остеоартрозе и PTOA 9,10. Митохондриальная дисфункция возникает после супрафизиологической нагрузки хряща 11,12,13,14, что может привести к повышению апоптоза хондроцитов12,15. Усиленный апоптоз хондроцитов был связан с повышенным истощением протеогликанов и катаболизмом хряща и, как было показано, предшествует изменениям в ремоделировании хряща и субхондральной кости16,17,18.
Как и в случае с большинством заболеваний человека, для дальнейшего понимания патофизиологии заболевания и тестирования новых методов лечения необходимы надежные и трансляционные модели ПТОЗ. Крупные животные, такие как свиньи и собаки, использовались в моделях внутрисуставных переломов и ударов PTOA17,19, но они дорогостоящие. Более мелкие животные модели, такие как мыши, крысы и кролики, дешевле и используются для изучения ПТС, возникающей в результате дестабилизации сустава, которая обычно включает хирургическое рассечение передней крестообразной связки (ПКС) и/или разрушение медиального мениска 20,21,22,23,24,25. Хотя травма сустава может привести к различным последствиям, включая повреждение связок26, механическая перегрузка хряща происходит почти во всех случаях.
Появляются новые доказательства того, что патология, лежащая в основе развития ПТОА после нестабильности связок (как при рассечении передней крестообразной связки) и острого хондрального повреждения, обусловлена различными механизмами27. Поэтому важна разработка моделей прямого повреждения хряща. В настоящее время существует ограниченное число моделей удара, вызывающих остеохондральное или хондральное повреждение у крыс и мышей28,29. Однако мышиный хрящ не очень хорошо подходит для образования изолированных хондральных дефектов. Это связано с тем, что суставной хрящ мышей имеет толщину всего 3-5 клеточных слоев и не имеет организованных поверхностных, радиальных и переходных хрящевых зон, а также толстого кальцинированного хрящевого слоя, обнаруженного у людей и более крупных животных. Мышиные модели также демонстрируют спонтанное разрешение частичных дефектов хряща30,31. Таким образом, мы выбрали кролика для этой модели удара, поскольку толщина и организация его хряща аналогичны человеческим, и это самая маленькая модель животного, которая позволит нанести постоянный хондральный удар, который приводит к PTOA. В предыдущих открытых хирургических моделях удара мыщелка бедренной кости у кролика использовались маятник32, ручное подпружиненное устройство 33 для захвата хряща и падающая башня, которая позволяла создавать специфичный для кролика ударный механизм34. Однако в этих исследованиях отсутствовали данные in vivo. Другие исследователи сообщали данные in vivo с маятниковыми35, пневматическими 36 и подпружиненными37 ударными устройствами10, и эти исследования показывают высокую вариабельность пикового напряжения и скорости нагрузки между методами. Тем не менее, в этой области отсутствует последовательный подход к надежному моделированию острой травмы хряща in vivo.
В текущем протоколе используется система на основе падающей башни для обеспечения последовательного воздействия на задний медиальный мыщелок колена кролика. Задний доступ к коленному суставу используется для обнажения заднего медиального мыщелка бедренной кости. Затем штифт Штейнмана помещается поперек мыщелков бедренной кости от медиального до латерального на одной линии с суставной поверхностью и закрепляется на платформе. После закрепления нагрузка доставляется в задний медиальный мыщелок бедренной кости. Этот метод позволяет добиться последовательного повреждения хряща на несущей поверхности дистального отдела бедренной кости кролика.
Access restricted. Please log in or start a trial to view this content.
протокол
Следующая процедура была выполнена с одобрения Комитета по уходу за животными и их использованию (IACUC) Медицинской школы Университета Индианы. Все операции по выживанию проводились в стерильных условиях, как указано в рекомендациях NIH. Риск боли и инфекции контролировался с помощью надлежащих анальгетиков и антибиотиков для оптимизации успешных результатов. Для настоящего исследования были использованы скелетно-зрелые самцы новозеландских белых кроликов массой 3,0-4,0 кг.
1. Изготовление башни
- Создание чертежей САПР для компонентов сбросной башни, базовой платформы и механизма для крепления штифта Steinman (дополнительные рисунки 1-14).
- Приобретите имеющиеся в продаже компоненты (см. Таблицу материалов).
- Приобретите детали станка или передайте чертежи САПР оператору для изготовления.
ПРИМЕЧАНИЕ: Для изготовления наконечника ударного механизма диаметром 3 мм требуется высокоточный оператор с инструментальным мастерством (Дополнительный рисунок 1, часть 20 и Дополнительный рисунок 13, 14). Ударная поверхность головки ударника имела кривизну 7,14 мм и 5,56 мм в сагиттальной и корональной плоскостях соответственно, чтобы соответствовать кривизне медиального мыщелка кролика35 (дополнительные рисунки 13, 14). - Соберите детали таким образом, чтобы падающая башня состояла из каретки, движущейся на двух вертикальных стержнях с помощью линейных шарикоподшипников с фиксированным выравниванием, а базовая платформа поддерживала кролика и закрепляла штифт Штейнмана (рис. 1 и рис. 2).
ПРИМЕЧАНИЕ: Поперечная балка каретки этой конструкции имеет жесткость на изгиб, равную жесткости предыдущей башни38 с приемлемым уровнем вибрации.
2. Подготовка животных
- Взвесьте кролика и обезболивайте его, используя 2,5 мг/кг алфаксалона и 0,15 мг/кг мидазолама внутримышечно (см. таблицу материалов). Нанесите глазную мазь на оба глаза после индукции. Поддерживайте анестезию, используя ~2%-3% изофлурана. Назначают бупренорфин SR (0,1 мг/кг) SQ для анальгезии и периоперационный энрофлоксацин (10 мг/кг) SQ. Вместо бупренорфина в виде инъекций SQ можно вводить НПВП, такие как карпрофен (4 мг/кг) или мелоксикам (0,2 – 0,3 мг/кг) или кетопрофен (3 мг/кг).
- Побрейте заднюю конечность кролика от лодыжки до задних конечностей. При удалении шерсти кроликов следует соблюдать особую осторожность, чтобы предотвратить загрязнение разреза. Важно использовать набор специальных острых машинок для стрижки кроличьей шерсти.
- Поместите блок передней ножки из нержавеющей стали (дополнительный рисунок 1, деталь No 2 и дополнительный рисунок 4) под конец ударной платформы и накройте платформу грелкой. Положите кролика на грудину (т.е. лежа) на грелку. Поместите мягкий бугорок под контралатеральное бедро.
- Убедитесь, что колено оперированной конечности находится по центру и опирается на полиэтиленовый блок (рис. 2A1). Используйте шелковую ленту, чтобы аккуратно втянуть хвост вверх и контралатерально к оперируемой конечности.
- Протрите место операции стерильной марлей, пропитанной 70% спиртом. Потрите место операции, начиная с задней части колена, круговыми движениями наружу. Повторите не менее 3 раз со свежими скрабами, заканчивая 70% спиртом.
- Наденьте стерильную перчатку на операционную стопу до щиколотки и оберните ее стерильной связующей пленкой.
- Стерильно окройте место операции тремя простынями: одну непосредственно под оперированной конечностью, а две другие для прикрытия остальной части тела. Закрепите шторы зажимами для полотенец.
3. Хирургическое воздействие
ПРИМЕЧАНИЕ: Перед операцией и ударом необходимо эмпирически определить вес и высоту падения, которые приводят к видимому повреждению хряща без субхондрального перелома кости для конкретного штамма, возраста и пола кролика.
- Пальпируйте положение надколенника кпереди, чтобы оценить положение коленного сустава, который расположен дистальнее надколенника. С помощью 15-лопасти сделайте разрез 3-4 см вдоль задней стороны вытянутого колена от уровня верхнего полюса надколенника дистально.
- Выполняют тупые и острые рассечения через нижележащую поверхностную фасцию. Развивайте интервал между кожей медиально и медиальной икроножной мышцей латерально. Поместите в этот интервал самоудерживающееся втягивающее устройство Weitlaner (см. Таблицу материалов).
- Вторичный фасциальный слой станет виден прямо над подкожной артерией и веной. Рассекают латерально от подкожной области и втягивают сосудистую сеть медиально и задний икроножно-камбаловидный комплекс латерально.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не перерезать эту сосудистую сеть. Если эта артерия повреждена, обеспечьте правильную перевязку, так как может возникнуть послеоперационный геморрагический шок.
- Вторичный фасциальный слой станет виден прямо над подкожной артерией и веной. Рассекают латерально от подкожной области и втягивают сосудистую сеть медиально и задний икроножно-камбаловидный комплекс латерально.
- Рассекают дистально до тех пор, пока не будет выявлена небольшая подвижная фабелла над задним медиальным мыщелком бедренной кости. Выполните артротомию, чтобы мобилизовать суперолатеральную фабеллу, обнажив нижележащий медиальный мыщелок бедренной кости. Осторожно удалите мягкие ткани путем тупого и острого рассечения, чтобы обнажить заднюю часть медиального мыщелка бедренной кости. Используйте самофиксатор Freer и Cricket (см. Таблицу материалов), чтобы втянуть мягкие ткани на этом уровне.
- Держа мыщелок открытым, продвиньте штифт Штейнмана диаметром 0,062 дюйма (см. Таблицу материалов) через дистальный отдел бедренной кости, начиная с верхней стороны медиального мыщелка бедренной кости и центрируя его в передне-заднем направлении медиального мыщелка бедренной кости, примерно в 5 мм от задней стороны мыщелка.
- Проденьте проволоку сбоку через кость и боковую кожу параллельно поверхности сустава с помощью штифт-отвертки Steinman с питанием от аккумулятора. Пальпация латерального надмыщелка обеспечит соответствующую траекторию штифта Штейнмана.
- Снимите ретракторы и закройте кожу полисорбным швом 3-0 (см. Таблицу материалов) на ходу. Накройте разрез стерильной марлей.
4. Воздействие мыщелка бедренной кости
- Снимите простыню под оперирующей конечностью и закрепите штифт Steinman на настраиваемой и регулируемой по высоте ударной платформе. Во-первых, поместите регулируемую по высоте нижнюю часть крепежного устройства штифта Steinman под штифт (Рисунок 2A2). Убедитесь, что провод параллельен земле на этой платформе, отрегулировав высоту винтов по мере необходимости.
- Убедившись, что штифт Steinman расположен параллельно земле, поместите верхнюю часть надежной платформы с винтовой опорой (Рисунок 2A3) на нижнюю часть регулируемой по высоте части с винтом. Убедитесь, что штифт Steinman надежно закреплен, вкрутив верхнюю планку в нижнюю регулируемую по высоте часть платформы для крепления штифтов (Рисунок 2A2).
- После того, как штифт Штейнмана будет закреплен на платформе, снимите шов и снова откройте разрез. Обнажите медиальный мыщелок бедренной кости с помощью самоудерживающихся ретракторов Вейтланера и сверчков. Для отвода дополнительных мягких тканей с пути наконечника ударного механизма может потребоваться дополнительный фрир (рис. 2B).
- Протрите башню с понижением одобренным дезинфицирующим средством. Прикрепите стерильную ударную головку диаметром 3 мм (Рисунок 2A4) к каретке падающей башни. Наденьте падающую башню на операционную конечность и поместите ее основание (Рисунок 2A6) под ударную платформу (Рисунок 3A).
- Осторожно опустите ударный механизм (дополнительный рисунок 2, часть 20 и дополнительный рисунок 13) на центр заднего медиального мыщелка бедренной кости. Убедитесь, что мягкие ткани не находятся на пути ударника.
- Перемещайте кролика или башню по мере необходимости, чтобы убедиться, что головка ударника находится по центру заднего медиального мыщелка бедренной кости (Рисунок 3B). Каждый раз, когда кролик перемещается или перемещается в другое положение, это место хирургического вмешательства должно быть оценено на предмет возможных нарушений стерильности и при необходимости повторно стерилизовано.
- Как только будет обеспечена соответствующая траектория, зажмите башню на платформе с помощью рычажных зажимов (Рисунок 2A5, см. Таблицу материалов).
- Вводят одну дозу внутривенного алфаксалона (0,5-0,7 мг/кг) за 5-10 мин до воздействия для более глубокой анестезии без увеличения ингаляционной анестезии.
ПРИМЕЧАНИЕ: Отсутствие пальпебрального рефлекса, отведение педали и рефлекса ушной раковины свидетельствует о более глубоком обезболивании. Такая более глубокая анестезия помогает предотвратить возможные реакции конечностей во время установки в аппарат и во время удара.
ВНИМАНИЕ: При слишком быстром приеме алфаксалона может вызвать преходящее апноэ и гипоксию у кроликов, и его следует вводить медленно в течение 1-2 минут. Если гипоксия все же возникла, обеспечьте адекватное насыщение кислородом и восстановление жизненно важных органов, прежде чем продолжить. - Установите ударный механизм на башне на желаемой высоте над медиальным мыщелком бедренной кости. Для текущей каретки в сборе, включая подшипники, массой 1,41 кг это высота 7 см.
ПРИМЕЧАНИЕ: Высота башни была определена на основе пилотных исследований на трупных тканях. Эта высота вызвала видимые повреждения хряща, но не субхондральный перелом костей у кроликов в этом исследовании. - Нажмите кнопку «Пуск» в программном обеспечении для сбора данных LabVIEW (дополнительный файл кодирования 1) непосредственно перед освобождением упора шпинделя (дополнительный рисунок 2, пункт No 14), чтобы освободить каретку и позволить ей опуститься под действием силы тяжести.
ПРИМЕЧАНИЕ: Программное обеспечение для сбора данных будет собирать данные с тензодатчика (Рисунок 1, 6), расположенного между ударным механизмом и кареткой, и акселерометра (Рисунок 1, 7) во время удара на частоте 100 кГц с помощью ноутбука, подключенного к модулю сбора данных. - Поместите txt-файл, сгенерированный программным обеспечением для сбора данных, в одну папку с кодом анализа данных Matlab (Supplementary Coding File 2) и запустите код анализа данных для фильтрации необработанных данных и расчета параметров воздействия.
- Убедитесь, что определена максимальная нагрузка. Связанная с ней точка времени считается временем максимальной деформации и нулевой скорости.
ПРИМЕЧАНИЕ: Код анализа данных проанализирует все txt-файлы в папке и выдаст результаты для каждого файла. Код будет определять начало и конец воздействия на основе изменений в данных времени загрузки. Данные акселерометра будут интегрированы в числовом виде для расчета скорости и снова интегрированы для расчета смещения. Код анализа данных численно рассчитает импульс, работу и кинетическую энергию по следующим формулам:
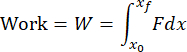

где F — сила, измеренная датчиком нагрузки, x 0 и t 0 — смещение и время в начале удара, а x и tf — смещение и время в конце удара. Скорость нагружения будет численно рассчитана как среднее значение dσ/dt в фазе нагружения удара. Пиковое напряжение будет рассчитано путем деления пиковой нагрузки на площадь контакта головки ударного механизма. - Выполните визуализацию поверхности хряща, чтобы определить, произошло ли соответствующее повреждение хряща (рис. 4A).
5. Закрытие операционного поля
- Снимите сбросную башню с рабочего конечника. Отложите все использованные хирургические инструменты в сторону и переоденьте их в новые стерильные перчатки.
ПРИМЕЧАНИЕ: Учитывая, что падающая башня не стерильна, все инструменты, использованные до удара, теперь следует считать загрязненными. - Повторно наложите стерильную простыню на нижнюю конечность и получите неиспользованные стерильные саморетракторы.
- Повторно обнажите медиальный мыщелок бедренной кости и тщательно орошите место операции 50-60 мл стерильного физиологического раствора.
- Задняя капсула закрывается полисорбным швом 5-0, после чего кожа закрывается моносорбным швом 4-0 (см. таблицу материалов).
- Введите 2 мл лидокаина/бупивакаина для местного обезболивания вокруг разреза внутрикожно.
- Снимите штифт Steinman с помощью комплекта силовых драйверов (см. Таблицу материалов), осциллируя, чтобы свести к минимуму повреждение мягких тканей.
- Наложите на рану нелейкую повязку, а затем лейкопластырь. Выполните рентгенографию прооперированной конечности, чтобы убедиться в отсутствии перелома и правильном размещении штифта (Рисунок 4B).
6. Послеоперационное ведение
- Верните кролика в клетку и наблюдайте за ним на одеялах с подогревом, пока он не оправится от анестезии (~25 мин).
- Продолжайте внимательно наблюдать за кроликами в течение нескольких дней после операции, чтобы убедиться, что они заживают должным образом и восстанавливают подвижность. Вводят энрофлоксацин (10 мг/кг) в течение 2 дней после операции для профилактики инфекций. Применяйте анальгезию бупренорфина (0,1 мг/кг) подкожно каждые 2-3 дня после операции и по мере необходимости. Вместо бупренорфина через 3-5 дней после операции и по мере необходимости можно вводить НПВП, такие как карпрофен в дозе 4 мг/кг в день, мелоксикам в дозе 0,2 – 0,3 мг/кг в день до 3 дней или кетопрофен в дозе 3 мг/кг в день.
ПРИМЕЧАНИЕ: Нам удалось предотвратить расхождение послеоперационной раны из-за облизывания или жевания кроликом с помощью ношения человеческих неонатальных штанов на задние конечности39. Если кролик прогрызает штаны, можно надеть елизаветинский воротник (см. Таблицу материалов), чтобы предотвратить прожевывание разреза.
7. Гистологическое исследование
- Через 16 недель после травмы у кроликов, подвергшихся эвтаназии, соберут колени, зафиксируют их в 10% нейтральном буферном формалине в течение 48 ч, после чего парафин закапывают и нарезают на ломтики толщиной 5 мкм.
- После депарафинизации и регидратации срезы окрашивают сафранином О фаст зеленым цветом по стандартным протоколам40,41.
- В соответствии с инструкциями производителя выполнить анализ концевой дезоксинуклеотидилтрансферазы dUTP (TUNEL) на срезах с помощью набора для обнаружения хромогенного апоптоза TUNEL в соответствии с инструкциями производителя, окрашенного гематоксилином42 (см. таблицу материалов).
Access restricted. Please log in or start a trial to view this content.
Результаты
Успех этой процедуры контролировался сразу после удара путем визуализации мыщелка хирургом (Рисунок 4А) и рентгенографии, чтобы убедиться в отсутствии перелома (Рисунок 4Б). Существует риск неудачного удара, приводящего к интраоперационному перелому мы?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Эта хирургическая процедура направлена на создание последовательного повреждения хряща несущей поверхности медиального мыщелка бедренной кости кролика в модели PTOA. Преимущество этой процедуры заключается в том, что задний доступ к коленному суставу позволяет непосредственно визуа?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Роман Натоли читает лекции для AO Trauma North America, является редактором раздела Current Osteoporosis Reports и получает гонорары за учебники от Моргана и Клейпула. Тодд Мак-Кинли получает гонорары от Innomed. Остальным авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Программой рецензируемых медицинских исследований Министерства обороны США - Исследовательская премия, инициированная исследователями, W81XWH-20-1-0304 от U.S. ARMY MEDICAL RESEARCH ACQUISITION ACTIVITY, NIH NIAMS R01AR076477 и Комплексной программой обучения опорно-двигательного аппарата T32 от NIH (AR065971) и грантом NIH NIAMS R01 AR069657. Авторы хотели бы поблагодарить Кевина Карра (Kevin Carr) за предоставление своего опыта в области механической обработки и изготовления для этого проекта, а также Дрю Брауна (Drew Brown) и Центр гистологии костей опорно-двигательного аппарата штата Индиана (Indiana Center for Musculoskeletal Health Bone Histology Core) за помощь в гистологии.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Flat head screw | McMaster-Carr | 92210A194 | Stainless steel hex drive flat head screw, 8-32, 1/2" |
| #15 scalpel blades | McKesson | 1029066 | Scalpel McKesson No. 15 Stainless Steel / Plastic Classic Grip Handle Sterile Disposable |
| 1/2”-20 threaded rod | McMaster-Carr | 99065A120 | 1/2”-20 threaded rod |
| 10 mL syringe | McKesson | 1031801 | For irrigation; General Purpose Syringe McKesson 10 mL Blister Pack Luer Lock Tip Without Safety |
| 3 mL syringe | McKesson | 1031804 | For lidocaine/bupiviacaine injection; General Purpose Syringe McKesson 3 mL Blister Pack Luer Lock Tip Without Safety. |
| 3-0 polysorb | Ethicon | J332H | 3-0 Vircryl, CT-2, 1/2 circle, 26 mm, tapered |
| 4-0 monosorb | Ethicon | Z397H | 4-0 PDS 2, FS-2, 3/8 circle, 19mm, cutting edge |
| 5-0 polysorb | Med Vet International | NC9335902 | Med Vet International 5-0 ETHICON COATED VICRYL C-3 |
| Accelerometer | Kistler | 8743A5 | Accelerometer |
| Adson-Browns Forceps | World precision tools | 500177 | Adson-Brown Forceps, 12 cm, Straight, TC Jaws, 7 x 7 Teeth |
| Alfaxalone | Jurox | 49480-002-01 | Alfaxan Multidose by Jurox : 10 mg/mL |
| Buprenorphine | Par Pharmaceuticals | 42023-0179-05 | Buprenorphine HCL injection: 0.3 mg/mL |
| Butorphanol | Zoetis | 54771-2033 | Butorphanol tartrate 10mg/ml by Zoetis |
| Chlorhexidine Hand Scrub | BD | 371073 | BD E-Z Scrub 107 Surgical Scrub Brush/Sponge, 4% CHG, Red |
| Collet | STRYKER | 14023 | Stryker 4100-62 wire Collet 0.28-0.71'' |
| Cordless Driver handpiece | STRYKER | OR-S4300 | Stryker 4300 CD3 Cordless Driver 3 handpiece |
| Cricket Retractors | Novosurgical | G3510 21 | 2x Heiss (Holzheimer) Cross Action Retractor |
| Dissector Scissors | Jorvet labs | J0662 | Aesculap AG, Metzenbaum, Scissors, Straight 5 3/4″ |
| Elizabethian Collar | ElizaSoft | 62054 | ElizaSoft Elizabethan Recovery Collar |
| Enrofloxacin | Custom Meds | Enrofloxacin compounded by Custom Meds | |
| Eye Ointment | Pivetal | 46066-753-55 | Pivetal Articifical Tears- recently recalled |
| Face-mount shaft collar | McMaster-Carr | 5631T11 | Face-mount shaft collar |
| Fast green | Millipore Sigma | F7258 | Fast green |
| Freer | Jorvet labs | J0226Q | Freer elevator |
| Head screw -1 | McMaster-Carr | 91251A197 | Black-oxide alloy steel socket head screw, 8-32, 3/4" |
| Head screw -2 | McMaster-Carr | 92196A194 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -3 | McMaster-Carr | 92196A146 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -4 | McMaster-Carr | 92196A151 | Stainless steel socket head screw, 6-32, 3/4" |
| Hematoxylin Solution, Gill No. 1 | Millipore Sigma | GHS132-1L | Hematoxylin Solution, Gill No. 1 |
| Hex nut | McMaster-Carr | 91841A007 | Stainless steel hex nut, 6-32 |
| Hold-down toggle clamp | McMaster-Carr | 5126A71 | Hold-down toggle clamp |
| Impact device | n/a | n/a | custom made |
| Impact platform | n/a | n/a | custom made |
| K-wires | Jorvet Labs | J0250A | JorVet Intramedullary Steinman Pins, Trocar-Trocar 1/16" x 7" |
| Lab View | National Instruments | n/a | n/a |
| Load cell | Kistler | 9712B5000 | Load cell |
| MATLAB | The MathWorks Inc. | n/a | n/a |
| Microscope | Leica | DMi-8 | Leica DMi8 microscope with LAS-X software |
| Midazolam | Almaject | 72611-749-10 | Midazolam Hydrochloride injection: 5mg/ml by Almaject |
| milling machine depth stops | McMaster-Carr | 2949A71 | Clamp-on milling machine depth stops |
| Mobile C-arm | Philips | 718095 | BV Pulsera, Mobile C-arm |
| Mounted linear ball bearing | McMaster-Carr | 9338T7 | Mounted linear ball bearing |
| Needle Driver | A2Z Scilab | A2ZTCIN39 | TC Webster Needle Holder Smooth Jaws 5", Premium |
| Pentobarbital | Vortech | 0298-9373-68 | Pentobarbital 390 mg/mL by Vortech |
| Safranin O | Millipore Sigma | HT90432 | Safranin O |
| Small Battery pack | STRYKER | NS014036 | 6212 Small Battery pack- 9.6 V |
| Steel rod, 2’ | McMaster-Carr | 89535K25 | Steel rod, 2’ |
| Sterile Saline | ICU Medical | 6139-22 | AquaLite Solution Pour Bottles, 250 mL |
| Stryker 6110-120 System 6 Battery Charger | STRYKER | OR-S6110-120 | |
| Surgical gloves | McKesson | 1044729 | Surgical Glove McKesson Perry Size 6.5 Sterile Pair Latex Extended Cuff Length Smooth Brown Not Chemo Approved |
| Surgical gown | McKesson | 1104452 | Non-Reinforced Surgical Gown with Towel McKesson Large Blue Sterile AAMI Level 3 Disposable |
| Suture scissors | Jorvet Labs | J0910SA | Super Cut Scissors, Mayo, Straight, 5 1/2″ |
| TUNEL staining kit | ABP Bioscience | A049 | TUNEL Chromogenic Apoptosis Detection Kit |
| Weitlaner Retractors | Fine Science Tools | 17012-11 | 2x Weitlaner-Locktite Retractors |
Ссылки
- Thomas, A. C., Hubbard-Turner, T., Wikstrom, E. A., Palmieri-Smith, R. M. Epidemiology of posttraumatic osteoarthritis. Journal of Athletic Training. 52 (6), 491-496 (2017).
- Pasquale, M. K., et al. Healthcare Utilization and costs of knee or hip replacements versus pain-relief injections. American Health Drug Benefits. 8 (7), 384-394 (2015).
- Yao, J. J., et al. Direct Inpatient medical costs of operative treatment of periprosthetic hip and knee infections are twofold higher than those of aseptic revisions. Journal of Bone and Joint Surgery America. 103 (4), 312-318 (2021).
- Anatone, A. J., et al. Decreased implant survival is associated with younger patients undergoing total knee arthroplasty. HSS Journal. 18 (2), 290-296 (2022).
- Stone, B., Nugent, M., Young, S. W., Frampton, C., Hooper, G. J. The lifetime risk of revision following total knee arthroplasty : a New Zealand Joint Registry study. The Bone and Joint Journal. 104-B (2), 235-241 (2022).
- Chen, D., et al. Osteoarthritis: toward a comprehensive understanding of pathological mechanism. Bone Research. 5, 16044(2017).
- Robinson, W. H., et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nature Review Rheumatology. 12 (10), 580-592 (2016).
- Perez-Garcia, S., et al. Profile of matrix-remodeling proteinases in osteoarthritis: impact of fibronectin. Cells. 9 (1), 40(2019).
- Hashimoto, S., Ochs, R. L., Komiya, S., Lotz, M. Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis. Arthritis Rheumatology. 41 (9), 1632-1638 (1998).
- Natoli, R. M., Athanasiou, K. A. Traumatic loading of articular cartilage: Mechanical and biological responses and post-injury treatment. Biorheology. 46 (6), 451-485 (2009).
- Coleman, M. C., Brouillette, M. J., Andresen, N. S., Oberley-Deegan, R. E., Martin, J. M. Differential effects of superoxide dismutase mimetics after mechanical overload of articular cartilage. Antioxidants (Basel). 6 (4), 98(2017).
- Goodwin, W., et al. Rotenone prevents impact-induced chondrocyte death. Journal of Orthopaedic Research. 28 (8), 1057-1063 (2010).
- Wolff, K. J., et al. Mechanical stress and ATP synthesis are coupled by mitochondrial oxidants in articular cartilage. Journal of Orthopaedic Research. 31 (2), 191-196 (2013).
- Delco, M. L., Bonnevie, E. D., Bonassar, L. J., Fortier, L. A. Mitochondrial dysfunction is an acute response of articular chondrocytes to mechanical injury. Journal of Orthopaedic Research. 36 (2), 739-750 (2018).
- Coleman, M. C., Ramakrishnan, P. S., Brouillette, M. J., Martin, J. A. Injurious loading of articular cartilage compromises chondrocyte respiratory function. Arthritis Rheumatology. 68 (3), 662-671 (2016).
- Bobinac, D., Spanjol, J., Zoricic, S., Maric, I. Changes in articular cartilage and subchondral bone histomorphometry in osteoarthritic knee joints in humans. Bone. 32 (3), 284-290 (2003).
- Coleman, M. C., et al. Targeting mitochondrial responses to intra-articular fracture to prevent posttraumatic osteoarthritis. Science Translational Medicine. 10 (427), eaan5372(2018).
- Heraud, F., Heraud, A., Harmand, M. F. Apoptosis in normal and osteoarthritic human articular cartilage. Annals of Rheumatological Diseases. 59 (12), 959-965 (2000).
- Narez, G. E., Fischenich, K. M., Donahue, T. L. H. Experimental animal models of post-traumatic osteoarthritis of the knee. Orthopedic Reviews (Pavia). 12 (2), 8448(2020).
- Fischenich, K. M., et al. Chronic changes in the articular cartilage and meniscus following traumatic impact to the lapine knee. Journal of Biomechanics. 48 (2), 246-253 (2015).
- Isaac, D. I., Meyer, E. G., Kopke, K. S., Haut, R. C. Chronic changes in the rabbit tibial plateau following blunt trauma to the tibiofemoral joint. Journal of Biomechanics. 43 (9), 1682-1688 (2010).
- Wei, F., et al. Post-traumatic osteoarthritis in rabbits following traumatic injury and surgical reconstruction of the knee. Annals of Biomedical Engineering. 50 (2), 169-182 (2022).
- Terracciano, R., et al. Quantitative high-resolution 7T MRI to assess longitudinal changes in articular cartilage after anterior cruciate ligament injury in a rabbit model of post-traumatic osteoarthritis. Osteoarthritis and Cartilage Open. 4 (2), 100259(2022).
- Huang, K., Cai, H. L., Zhang, P. L., Wu, L. D. Comparison between two rabbit models of posttraumatic osteoarthritis: A longitudinal tear in the medial meniscus and anterior cruciate ligament transection. Journal of Orthopaedic Research. 38 (12), 2721-2730 (2020).
- Sun, Z. B., Peng, H. Experimental Study on the prevention of posttraumatic osteoarthritis in the rabbit knee using a hinged external fixator in combination with exercises. Journal of Investigative Surgery. 32 (6), 552-559 (2019).
- Gardner, M. J., et al. The incidence of soft tissue injury in operative tibial plateau fractures: a magnetic resonance imaging analysis of 103 patients. Journal of Orthopedic Trauma. 19 (2), 79-84 (2005).
- Dilley, J. E. B. M. A., Roman, N., McKinley, T. O., Sankar, U. Post-traumatic osteoarthritis: A review of pathogenic mechanisms and novel targets for mitigation. Bone Reports. 18, 101658(2023).
- Seol, D., et al. Effects of knockout of the receptor for advanced glycation end-products on bone mineral density and synovitis in mice with intra-articular fractures. Journal of Orthopedic Research. 36 (9), 2439-2449 (2018).
- Furman, B. D., et al. Joint degeneration following closed intraarticular fracture in the mouse knee: a model of posttraumatic arthritis. Journal of Orthopedic Research. 25 (5), 578-592 (2007).
- Glasson, S. S., Chambers, M. G., Van Den Berg, W. B., Little, C. B. The OARSI histopathology initiative - recommendations for histological assessments of osteoarthritis in the mouse. Osteoarthritis Cartilage. 18 Suppl 3, S17-S23 (2010).
- McCoy, A. M. Animal models of osteoarthritis: comparisons and key considerations. Veterinary Pathology. 52 (5), 803-818 (2015).
- Fening, S. D., Jones, M. H., Moutzouros, V., Downs, B., Miniaci, A. Method for Delivering a controlled impact to articular cartilage in the rabbit knee. Cartilage. 1 (3), 211-216 (2010).
- Leucht, F., et al. Development of a new biomechanically defined single impact rabbit cartilage trauma model for in vivo-studies. Journal of Investigative Surgery. 25 (4), 235-241 (2012).
- Vrahas, M. S., Smith, G. A., Rosler, D. M., Baratta, R. V. Method to impact in vivo rabbit femoral cartilage with blows of quantifiable stress. Journal of Orthopedic Research. 15 (2), 314-317 (1997).
- Borrelli, J. Jr, Burns, M. E., Ricci, W. M., Silva, M. J. A method for delivering variable impact stresses to the articular cartilage of rabbit knees. Journal of Orthopedic Trauma. 16 (3), 182-188 (2002).
- Milentijevic, D., Rubel, I. F., Liew, A. S., Helfet, D. L., Torzilli, P. A. An in vivo rabbit model for cartilage trauma: a preliminary study of the influence of impact stress magnitude on chondrocyte death and matrix damage. Journal of Orthopedic Trauma. 19 (7), 466-473 (2005).
- Alexander, P. G., et al. An In vivo lapine model for impact-induced injury and osteoarthritic degeneration of articular cartilage. Cartilage. 3 (4), 323-333 (2012).
- Bonitsky, C. M., et al. Genipin crosslinking decreases the mechanical wear and biochemical degradation of impacted cartilage in vitro. Journal of Orthopedic Research. 35 (3), 558-565 (2017).
- Bartley, K. A., Johnson, C. H. Human Infant pants for postoperative protection during social housing of new zealand white rabbits (Oryctolagus cuniculus). Journal of the American Association for Laboratory Animal Science. 58 (4), 510-516 (2019).
- Lillie, R. D., Fullmer, H. M. Histopathologic technic and practical histochemistry. , 4th edn, Blakiston Division, McGraw-Hill. (1976).
- Armed Forces Institute of Pathology: Laboratory Methods in Histotechnology. Washington DC: American Registry of Pathology. Prophet, E., Mills, B., Arrington, J. B., Sobin, L. H. , (1992).
- Dilley, J. E., et al. CAMKK2 is upregulated in primary human osteoarthritis and its inhibition protects against chondrocyte apoptosis. Osteoarthritis and Cartilage. 31 (7), 908-918 (2023).
- Pritzker, K. P., et al. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis Cartilage. 14 (1), 13-29 (2006).
- Christiansen, B. A., et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 23 (10), 1627-1638 (2015).
- Borrelli, J., Zaegel, M. A., Martinez, M. D., Silva, M. J. Diminished cartilage creep properties and increased trabecular bone density following a single, sub-fracture impact of the rabbit femoral condyle. Journal of Orthopaedic Research. 28 (10), 1307-1314 (2010).
- Borrelli, J., Silva, M. J., Zaegel, M. A., Franz, C., Sandell, L. J. Single high-energy impact load causes posttraumatic OA in young rabbits via a decrease in cellular metabolism. Journal of Orthopedic Research. 27 (3), 347-352 (2009).
- Borrelli, J. Jr, Zhu, Y., Burns, M., Sandell, L., Silva, M. J. Cartilage tolerates single impact loads of as much as half the joint fracture threshold. Clinical Orthopedics and Related Research. 426, 266-273 (2004).
- Karnik, S., et al. Decreased SIRT1 activity is involved in the acute injury response of chondrocytes to ex vivo injurious mechanical overload. International Journal of Molecular Sciences. 24 (7), 6521(2023).
- Mevel, E., et al. Systemic inhibition or global deletion of CaMKK2 protects against post-traumatic osteoarthritis. Osteoarthritis Cartilage. 30 (1), 124-136 (2022).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены