Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un modelo de impacto cartilaginoso reproducible para generar artrosis postraumática en el conejo
* Estos autores han contribuido por igual
En este artículo
Resumen
El modelo de impacto del cóndilo femoral medial abierto en conejos es fiable para estudiar la artrosis postraumática (PTOA) y nuevas estrategias terapéuticas para mitigar la progresión de la PTOA. Este protocolo genera un defecto aislado del cartílago del cóndilo femoral medial posterior en conejos utilizando una torre de caída basada en carros con una cabeza impactadora.
Resumen
La osteoartritis postraumática (PTOA, por sus siglas en inglés) es responsable del 12% de todos los casos de osteoartritis en los Estados Unidos. El PTOA puede iniciarse por un solo evento traumático, como una carga de alto impacto que actúa sobre el cartílago articular, o por inestabilidad articular, como ocurre con la rotura del ligamento cruzado anterior. En la actualidad, no existen terapias eficaces para prevenir el PTOA. Es necesario desarrollar un modelo animal fiable de PTOA para comprender mejor los mecanismos por los que se produce el daño del cartílago e investigar nuevas estrategias de tratamiento para aliviar o prevenir la progresión del PTOA. Este protocolo describe un modelo de impacto de cóndilo femoral de conejo abierto basado en una torre de caída para inducir daño en el cartílago. Este modelo entregó cargas máximas de 579,1 ± 71,1 N, y tensiones máximas de 81,9 ± 10,1 MPa con un tiempo de carga máxima de 2,4 ± 0,5 ms. El cartílago articular de los cóndilos femorales mediales (MFC) impactados tenía tasas más altas de células apoptóticas (p = 0,0058) y poseía puntuaciones más altas de la Sociedad Internacional de Investigación de la Osteoartritis (OARSI) de 3,38 ± 1,43 en comparación con los MFC contralaterales no impactados (0,56 ± 0,42) y otras superficies de cartílago de la rodilla impactada (p < 0,0001). No se detectaron diferencias en las puntuaciones de OARSI entre las superficies articulares no impactadas (p > 0,05).
Introducción
La osteoartritis postraumática (PTOA) es una de las principales causas de discapacidad en todo el mundo y representa entre el 12 % y el 16 % de las osteoartritis sintomáticas (OA)1. El estándar de oro actual para el tratamiento de la artrosis terminal es la artroplastia total de rodilla y cadera2 o artrodesis, como en el caso de la artritis tibioastragalina o subastragalina terminal. Aunque en gran medida es exitosa, la artroplastia puede tener complicaciones costosas y mórbidas3. Además, la artroplastia es menos deseable en pacientes menores de 50 años, dada la baja supervivencia del implante libre de revisión del 77-83%4,5. Actualmente, no existen tratamientos aprobados por la FDA para prevenir o mitigar la progresión del PTOA.
El PTOA afecta a toda la articulación, incluido el tejido sinovial, el hueso subcondral y el cartílago articular. Se caracteriza por degeneración del cartílago articular, inflamación sinovial, remodelación ósea subcondral y formación de osteofitos 6,7. El fenotipo de PTOA se desarrolla a través de un complejo proceso de interacción entre el cartílago, la membrana sinovial y el hueso subcondral. La comprensión actual es que la lesión del cartílago conduce a la liberación de componentes de la matriz extracelular (MEC) como el colágeno tipo 2 (COL2) y el agrecano (ACAN). Estos fragmentos componentes de la MEC son proinflamatorios y provocan un aumento de la producción de IL-6, IL-1β y especies reactivas de oxígeno. Estos mediadores actúan sobre los condrocitos, provocando una regulación positiva de las metaloproteinasas de la matriz (MMP), como la MMP-13, que degradan el cartílago articular y disminuyen la síntesis de la matriz, lo que conduce a un entorno catabólico general para el cartílago articular8. Además, existe evidencia de aumento de la apoptosis de condrocitos en la artrosis primaria y en la PTOA 9,10. La disfunción mitocondrial ocurre después de la carga suprafisiológica del cartílago 11,12,13,14, lo que puede conducir a un aumento de la apoptosis de los condrocitos 12,15. El aumento de la apoptosis de los condrocitos se ha asociado con un aumento de la depleción de proteoglicanos y el catabolismo del cartílago y se ha demostrado que precede a los cambios en la remodelación del cartílago y del hueso subcondral16,17,18.
Al igual que con la mayoría de las enfermedades humanas, se necesitan modelos confiables y traslacionales de PTOA para comprender mejor la fisiopatología de la enfermedad y probar nuevas terapias. Los animales grandes, como los cerdos y los caninos, se han utilizado en modelos de fractura intraarticular e impacto de PTOA17,19, pero son costosos. Los modelos animales más pequeños, como ratones, ratas y conejos, son menos costosos y se utilizan para estudiar el PTOA generado a través de la desestabilización articular, que generalmente implica la transección quirúrgica del ligamento cruzado anterior (LCA) y/o la ruptura del menisco medial 20,21,22,23,24,25. A pesar de que un traumatismo articular puede acarrear diversas consecuencias, entre ellas una lesión ligamentosa26, en casi todos los casos se produce una sobrecarga mecánica del cartílago.
Existe evidencia emergente de que la patología detrás del desarrollo de PTOA después de la inestabilidad ligamentosa (como en la transección del LCA) y la lesión condral aguda se debe a mecanismos distintos27. Por lo tanto, es importante desarrollar modelos de lesión directa del cartílago. Actualmente existe un número limitado de modelos de impacto que generan lesiones osteocondrales o condrales en ratas y ratones28,29. Sin embargo, el cartílago murino no es adecuado para generar defectos condrales aislados. Esto se debe a que el cartílago articular murino tiene solo 3-5 capas celulares de espesor y carece de zonas organizadas de cartílago superficial, radial y de transición, así como de la gruesa capa de cartílago calcificado que se encuentra en humanos y animales más grandes. Los modelos murinos también muestran una resolución espontánea de los defectos parciales del cartílago30,31. Por lo tanto, elegimos el conejo para este modelo de impacto, ya que el grosor y la organización de su cartílago son similares a los de los humanos, y es el modelo animal más pequeño que permitirá la entrega de un impacto condral consistente que da como resultado PTOA. Los modelos quirúrgicos abiertos anteriores del impacto del cóndilo femoral en el conejo han empleado un péndulo32, un dispositivo de impactación de cartílago manual accionado por resorte 33 y una torre de caída que permitió la creación de impactadores específicos para conejos34. Sin embargo, estos estudios carecían de datos in vivo. Otros han reportado datos in vivo con dispositivos de impacto basados en péndulo 35, neumáticos36 y resortes37 10, y estos estudios muestran una alta tasa de variabilidad en el estrés máximo y las tasas de carga entre los métodos. Aun así, el campo carece de un enfoque coherente para modelar de forma fiable el traumatismo agudo del cartílago in vivo.
El protocolo actual emplea un sistema basado en una torre de caída para proporcionar un impacto consistente en el cóndilo medial posterior de la rodilla de conejo. Se emplea un abordaje posterior de la rodilla para exponer el cóndilo femoral medial posterior. A continuación, se coloca un clavo Steinman a través de los cóndilos femorales de medial a lateral en línea con la superficie de la articulación y se fija a la plataforma. Una vez asegurado, se administra una carga al cóndilo femoral medial posterior. Este método permite que el daño constante del cartílago se aplique a la superficie que soporta el peso del fémur distal del conejo.
Protocolo
El siguiente procedimiento se realizó con la aprobación del Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Facultad de Medicina de la Universidad de Indiana. Todas las cirugías de supervivencia se realizaron en condiciones estériles, como se indica en las directrices de los NIH. Los riesgos de dolor e infección se trataron con analgésicos y antibióticos adecuados para optimizar los resultados exitosos. Para el presente estudio se utilizaron conejos blancos de Nueva Zelanda machos esqueléticamente maduros, con un peso de 3,0 a 4,0 kg.
1. Fabricación de torres de caída
- Genere dibujos CAD para los componentes de la torre de caída, la plataforma base y el mecanismo para asegurar el pasador Steinman (Figuras suplementarias 1-14).
- Compre componentes disponibles comercialmente (consulte la tabla de materiales).
- Adquiera las piezas de la máquina del dispositivo o entregue dibujos CAD a un maquinista para su fabricación.
NOTA: Se requiere un maquinista de alta precisión con capacidad de fabricación de herramientas para fabricar la punta del impactador de 3 mm de diámetro (Figura suplementaria 1, parte 20 y Figuras suplementarias 13,14). La cara de impacto de la cabeza del impactador tenía curvaturas de 7,14 mm y 5,56 mm en los planos sagital y coronal, respectivamente, para ajustarse a la curvatura del cóndilo medial de conejo35 (Figuras suplementarias 13,14). - Ensamble las piezas de manera que la torre de caída consista en un carro que se desplaza sobre dos varillas verticales a través de rodamientos de bolas lineales de alineación fija, y la plataforma base soporta el conejo y asegura el pasador Steinman (Figura 1 y Figura 2).
NOTA: El travesaño del carro de este diseño tiene una rigidez a la flexión igual a la de una torre de caída38 anterior con un nivel de vibración aceptable.
2. Preparación de los animales
- Pesar al conejo y anestesiarlo con 2,5 mg/kg de alfaxalona y 0,15 mg/kg de midazolam IM (ver Tabla de materiales). Aplique ungüento para los ojos en ambos ojos después de la inducción. Mantenga la anestesia usando ~2%-3% de isoflurano. Administre buprenorfina SR (0,1 mg/kg) SQ para analgesia y enrofloxacino perioperatorio (10 mg/kg) SQ. En lugar de buprenorfina, se pueden administrar como inyecciones SQ AINE como Carprofeno, 4 mg/kg o Meloxicam, 0,2 – 0,3 mg/kg o Ketoprofeno, 3 mg/kg.
- Afeita la extremidad trasera del conejo desde el tobillo hasta los cuartos traseros. Se recomienda tener especial precaución en la depilación de conejo para evitar la contaminación de la incisión. Es importante usar un juego de cortapelos de conejo afilados y dedicados.
- Coloque el bloque de acero inoxidable de la pata delantera (Figura suplementaria 1, parte n.º 2 y Figura suplementaria 4) debajo del extremo de la plataforma de impacto y cubra la plataforma con una almohadilla térmica. Coloque el esternón del conejo (es decir, boca abajo) sobre la almohadilla térmica. Coloque una protuberancia acolchada debajo de la cadera contralateral.
- Asegúrese de que la extremidad operatoria tenga la rodilla centrada y apoyada en el bloque de polietileno (Figura 2A1). Use cinta de seda para retraer suavemente la cola superior y contralateral a la extremidad operatoria.
- Limpie el sitio quirúrgico con clorohexidina y gasa estéril empapada en alcohol al 70 %. Frote el sitio quirúrgico, comenzando en la parte posterior de la rodilla, con un barrido circular hacia afuera. Repita al menos 3 veces con exfoliantes frescos, terminando con 70% de alcohol.
- Coloque un guante estéril sobre el pie operatorio hasta el tobillo y envuélvalo con una envoltura cohesiva estéril.
- Cubra estérilmente el sitio quirúrgico con tres paños: uno directamente debajo de la extremidad operatoria y los otros dos para cubrir el resto del cuerpo. Asegure las cortinas con abrazaderas para toallas.
3. Exposición quirúrgica
NOTA: Antes de la cirugía y el impacto, el peso y la altura de la caída que producen daño visible en el cartílago sin fractura ósea subcondral deben determinarse empíricamente para la cepa específica, la edad y el sexo del conejo.
- Palpar la posición de la rótula anteriormente para estimar la posición de la articulación de la rodilla, que se encuentra distal a la rótula. Con una cuchilla de 15 hojas, haga una incisión de 3-4 cm a lo largo de la cara posterior de la rodilla extendida desde el nivel del polo superior de la rótula distalmente.
- Realizar disecciones contundentes y afiladas a través de la fascia superficial subyacente. Desarrollar el intervalo entre la piel medialmente y el gastrocnemio medial lateralmente. Coloque un retractor Weitlaner autorretenedor en este intervalo (consulte la Tabla de materiales).
- Una capa fascial secundaria se hará visible justo encima de la arteria y la vena safenas. Diseccionar lateral a la safena y retraer la vasculatura medialmente y el complejo gastrocsoleo posterior lateralmente.
NOTA: Tenga cuidado de no cortar esta vasculatura. Si esta arteria está dañada, asegúrese de una ligadura adecuada, ya que puede ocurrir un shock hemorrágico postoperatorio.
- Una capa fascial secundaria se hará visible justo encima de la arteria y la vena safenas. Diseccionar lateral a la safena y retraer la vasculatura medialmente y el complejo gastrocsoleo posterior lateralmente.
- Diseccionar distalmente hasta que se identifique una pequeña fabella móvil sobre el cóndilo femoral medial posterior. Realizar una artrotomía para movilizar la fabella superolateral, exponiendo el cóndilo femoral medial subyacente. Retire suavemente el tejido blando mediante una disección roma y afilada para exponer la cara posterior del cóndilo femoral medial. Use un Freer and Cricket self-retainer (ver Tabla de Materiales) para retraer los tejidos blandos a este nivel.
- Mientras mantiene el cóndilo expuesto, avance un alfiler Steinman de 0.062 pulgadas (ver Tabla de materiales) a través del fémur distal, comenzando en la cara superior del cóndilo femoral medial y centrado en la dirección antero-posterior del cóndilo femoral medial, aproximadamente a 5 mm de la cara posterior del cóndilo.
- Introduzca el alambre lateralmente a través del hueso y la piel lateral paralela a la superficie de la articulación utilizando un destornillador de clavijas Steinman alimentado por batería. La palpación del epicóndilo lateral asegurará la trayectoria adecuada del clavo de Steinman.
- Retire los retractores y cierre la piel con una sutura de polisorbido 3-0 (ver Tabla de Materiales) de forma corrida. Cubra la incisión con una gasa estéril.
4. Impacto del cóndilo femoral
- Retire la cortina debajo de la extremidad operatoria y asegure el pasador Steinman a una plataforma de impacto personalizable y ajustable en altura. En primer lugar, coloque el aspecto inferior ajustable en altura del aparato de fijación de pasadores de Steinman debajo del pasador (Figura 2A2). Asegúrese de que el cable esté paralelo al suelo en esta plataforma ajustando las alturas de los tornillos según sea necesario.
- Después de asegurarse de que el pasador Steinman esté paralelo al suelo, coloque el aspecto superior basado en el tornillo de la plataforma segura (Figura 2A3) en el aspecto inferior basado en el tornillo de la pieza ajustable en altura. Asegúrese de que el pasador Steinman esté bien asegurado atornillando la barra superior en la parte inferior ajustable en altura de la plataforma de sujeción del pasador (Figura 2A2).
- Una vez que el pasador Steinman esté asegurado a la plataforma, retire la sutura y vuelva a abrir la incisión. Exponga el cóndilo femoral medial con retractores Weitlaner y grillos autorretenedores. Es posible que se necesite un Freer adicional para retraer el tejido blando adicional fuera de la trayectoria de la punta del impactador (Figura 2B).
- Limpie la torre de caída con un desinfectante aprobado. Coloque el cabezal de impacto estéril de 3 mm (Figura 2A4) en el carro de la torre de caída. Coloque la torre de caída sobre la extremidad operatoria y coloque su base (Figura 2A6) debajo de la plataforma de impacto (Figura 3A).
- Baje suavemente el impactador (Figura complementaria 2, parte 20 y figura complementaria 13) sobre el centro del cóndilo femoral medial posterior. Asegúrese de que no haya tejido blando en el camino del impactador.
- Mueva el conejo o la torre según sea necesario para asegurarse de que la cabeza del impactador esté centrada sobre el cóndilo femoral medial posterior (Figura 3B). Cada vez que el conejo se mueva o se vuelva a colocar en ese sitio quirúrgico se debe evaluar para detectar posibles roturas de la esterilidad y volver a esterilizar el área si es necesario.
- Una vez asegurada la trayectoria adecuada, sujete la torre a la plataforma con las abrazaderas de palanca (Figura 2A5, consulte la Tabla de materiales).
- Administrar una dosis de alfaxalona intravenosa (0,5-0,7 mg/kg) 5-10 min antes del impacto para una anestesia más profunda sin aumentar la anestesia inhalante.
NOTA: La falta de reflejo palpebral, el retraimiento del pedal y el reflejo del pabellón auricular evidencian una anestesia más profunda. Esta anestesia más profunda ayuda a prevenir posibles reacciones en las extremidades durante la colocación en el aparato y durante el impacto.
PRECAUCIÓN: Si se administra demasiado rápido, la alfaxalona puede causar apnea transitoria e hipoxia en conejos y debe administrarse lentamente durante 1-2 minutos. Si se produce hipoxia, asegúrese de una oxigenación adecuada y de la restauración de los signos vitales antes de proceder. - Coloque el impactador en la torre de caída a la altura deseada por encima del cóndilo femoral medial. Para el conjunto de carro actual, incluidos los rodamientos, con una masa de 1,41 kg, se trata de una altura de 7 cm.
NOTA: La altura de la torre de caída se determinó a partir de estudios piloto en tejido de cadáveres. Esta altura generó daño visible en el cartílago, pero no fractura ósea subcondral en los conejos de este estudio. - Haga clic en el botón Inicio en el software de adquisición de datos LabVIEW (Archivo de codificación suplementario 1) justo antes de liberar el tope del husillo (Figura suplementaria 2, elemento No. 14) para liberar el carro y permitir que caiga bajo la fuerza de la gravedad.
NOTA: El software de adquisición de datos recopilará los datos de una célula de carga (Figura 1, 6) colocada entre el impactador y el carro y un acelerómetro (Figura 1, 7) durante el impacto a 100 kHz utilizando un ordenador portátil conectado a un módulo de adquisición de datos. - Coloque el archivo txt generado por el software de adquisición de datos en la misma carpeta con el código de análisis de datos de Matlab (Supplemental Coding File 2) y ejecute el código de análisis de datos para filtrar los datos sin procesar y calcular los parámetros de impacto.
- Asegúrese de que se identifique la carga máxima. El punto de tiempo asociado se considera el tiempo de máxima deformación y velocidad cero.
NOTA: El código de análisis de datos analizará todos los archivos txt de la carpeta e informará de los resultados de cada archivo. El código determinará el comienzo y el final del impacto en función de los cambios en los datos de tiempo de carga. Los datos del acelerómetro se integrarán numéricamente para calcular la velocidad y se integrarán de nuevo para calcular el desplazamiento. El código de análisis de datos calculará numéricamente el impulso, el trabajo y la energía cinética a partir de las siguientes fórmulas:
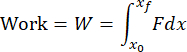

donde F es la fuerza medida por el sensor de carga, x 0 y t 0 son el desplazamiento y el tiempo al comienzo del impacto, y x, y tf son el desplazamiento y el tiempo al final del impacto. La tasa de carga se calculará numéricamente como el promedio de dσ/dt en la fase de carga del impacto. La tensión máxima se calculará dividiendo la carga máxima por el área de contacto de la cabeza del impactador. - Realice la visualización de la superficie del cartílago para determinar si se ha producido el daño adecuado del cartílago (Figura 4A).
5. Cierre del sitio quirúrgico
- Retire la torre de caída de la extremidad operatoria. Deje a un lado todos los instrumentos quirúrgicos usados y cámbiese por guantes estériles nuevos.
NOTA: Dado que la torre de caída no es estéril, todas las herramientas utilizadas hasta el impacto ahora deben considerarse contaminadas. - Vuelva a aplicar un paño estéril en la extremidad inferior y obtenga autorretractores estériles no utilizados.
- Vuelva a exponer el cóndilo femoral medial e irrigar completamente el sitio quirúrgico con 50-60 ml de solución salina estéril.
- Cierre la cápsula posterior con una sutura de polisorb 5-0, seguido de un cierre cutáneo con una sutura de monosorb 4-0 (ver Tabla de materiales).
- Inyecte 2 ml de lidocaína/bupivacaína para la analgesia local alrededor de la incisión por vía intradérmica.
- Retire el pasador Steinman con un destornillador de potencia (consulte la Tabla de materiales) oscilando para minimizar las lesiones en los tejidos blandos.
- Venda la herida con un apósito no adhesivo, seguido de cinta adhesiva. Realice una radiografía de la extremidad operatoria para asegurarse de que no se haya producido ninguna fractura y de que se haya colocado el clavo de forma adecuada (Figura 4B).
6. Manejo postoperatorio
- Regrese al conejo a su jaula y vigílelo con mantas térmicas hasta que se recupere de la anestesia (~25 min).
- Continúe monitoreando de cerca a los conejos durante varios días después de la cirugía para asegurarse de que sanen adecuadamente y recuperen la movilidad. Administrar enrofloxacino (10 mg/kg) durante 2 días después de la operación para la profilaxis de infecciones. Administrar analgesia con buprenorfina SR (0,1 mg/kg) por vía subcutánea cada 2-3 días después de la cirugía y según sea necesario. En lugar de buprenorfina, se pueden administrar AINE como Carprofeno, 4 mg/kg SQ al día, Meloxicam, 0,2 – 0,3 mg/kg SQ al día hasta 3 días o Ketoprofeno, 3 mg/kg SQ al día 3-5 días después de la cirugía y según sea necesario.
NOTA: Hemos logrado prevenir la dehiscencia de la herida postoperatoria, debido al lamido o masticación del conejo, con la colocación de pantalones neonatales humanos sobre las extremidades posteriores39. Si el conejo muerde a través de los pantalones, se puede colocar un collar isabelino (ver Tabla de Materiales) para evitar que se muerda la incisión.
7. Evaluación histológica
- A las 16 semanas después de la lesión, se cosechan rodillas de conejos sacrificados, se fijan en formol tamponado neutro al 10% durante 48 h, seguido de la inclusión en parafina y el corte en rodajas de 5 μm de grosor.
- Después de la desparafinación y la rehidratación, tiñir las secciones con safranina O verde rápido según los protocolos estándar40,41.
- Realice el ensayo de marcaje de punta de muesca (TUNEL) de desoxinucleotidil transferasa terminal dUTP en las secciones utilizando el kit de detección de apoptosis cromogénica TUNEL siguiendo las instrucciones del fabricante, contrateñido con hematoxilina42 (ver Tabla de materiales).
Resultados
El éxito de este procedimiento se controló inmediatamente después del impacto mediante la visualización del cóndilo por parte del cirujano (Figura 4A) y mediante radiografía para garantizar que no se produjera ninguna fractura (Figura 4B). Existe el riesgo de que el fallo del impacto conduzca a una fractura intraoperatoria del cóndilo. Por lo general, esto se debió a la colocación incorrecta de los pines de Steinman (Figura 5
Discusión
Este procedimiento quirúrgico tiene como objetivo generar un daño cartilaginoso consistente en la superficie que soporta el peso del cóndilo femoral medial del conejo en un modelo de PTOA. Una ventaja de este procedimiento es que el abordaje posterior a la rodilla permite la visualización directa del cóndilo femoral medial posterior completo, y se puede realizar en aproximadamente 37 min (Tabla 2). También hay que tener en cuenta que se trata de un modelo de lesión abierta y puede dar lugar a camb...
Divulgaciones
Roman Natoli imparte conferencias para AO Trauma North America, es editor de sección de Current Osteoporosis Reports y recibió regalías de libros de texto de Morgan y Claypool. Todd McKinley recibe regalías de Innomed. El resto de los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue financiado por el Programa de Investigación Médica Revisada por Pares del Departamento de Defensa - Premio de Investigación Iniciada por el Investigador W81XWH-20-1-0304 de la Actividad de Adquisición de Investigación Médica del Ejército de los EE. UU., por el NIH, el NIAMS R01AR076477 y un Programa Integral de Capacitación Musculoesquelética T32 de los NIH (AR065971) y por la Subvención R01 del NIAMS de los NIH AR069657. Los autores desean agradecer a Kevin Carr por aportar su experiencia en mecanizado y fabricación a este proyecto, y a Drew Brown y al Centro de Histología Ósea del Centro de Salud Musculoesquelética de Indiana por ayudar con la histología.
Materiales
| Name | Company | Catalog Number | Comments |
| Flat head screw | McMaster-Carr | 92210A194 | Stainless steel hex drive flat head screw, 8-32, 1/2" |
| #15 scalpel blades | McKesson | 1029066 | Scalpel McKesson No. 15 Stainless Steel / Plastic Classic Grip Handle Sterile Disposable |
| 1/2”-20 threaded rod | McMaster-Carr | 99065A120 | 1/2”-20 threaded rod |
| 10 mL syringe | McKesson | 1031801 | For irrigation; General Purpose Syringe McKesson 10 mL Blister Pack Luer Lock Tip Without Safety |
| 3 mL syringe | McKesson | 1031804 | For lidocaine/bupiviacaine injection; General Purpose Syringe McKesson 3 mL Blister Pack Luer Lock Tip Without Safety. |
| 3-0 polysorb | Ethicon | J332H | 3-0 Vircryl, CT-2, 1/2 circle, 26 mm, tapered |
| 4-0 monosorb | Ethicon | Z397H | 4-0 PDS 2, FS-2, 3/8 circle, 19mm, cutting edge |
| 5-0 polysorb | Med Vet International | NC9335902 | Med Vet International 5-0 ETHICON COATED VICRYL C-3 |
| Accelerometer | Kistler | 8743A5 | Accelerometer |
| Adson-Browns Forceps | World precision tools | 500177 | Adson-Brown Forceps, 12 cm, Straight, TC Jaws, 7 x 7 Teeth |
| Alfaxalone | Jurox | 49480-002-01 | Alfaxan Multidose by Jurox : 10 mg/mL |
| Buprenorphine | Par Pharmaceuticals | 42023-0179-05 | Buprenorphine HCL injection: 0.3 mg/mL |
| Butorphanol | Zoetis | 54771-2033 | Butorphanol tartrate 10mg/ml by Zoetis |
| Chlorhexidine Hand Scrub | BD | 371073 | BD E-Z Scrub 107 Surgical Scrub Brush/Sponge, 4% CHG, Red |
| Collet | STRYKER | 14023 | Stryker 4100-62 wire Collet 0.28-0.71'' |
| Cordless Driver handpiece | STRYKER | OR-S4300 | Stryker 4300 CD3 Cordless Driver 3 handpiece |
| Cricket Retractors | Novosurgical | G3510 21 | 2x Heiss (Holzheimer) Cross Action Retractor |
| Dissector Scissors | Jorvet labs | J0662 | Aesculap AG, Metzenbaum, Scissors, Straight 5 3/4″ |
| Elizabethian Collar | ElizaSoft | 62054 | ElizaSoft Elizabethan Recovery Collar |
| Enrofloxacin | Custom Meds | Enrofloxacin compounded by Custom Meds | |
| Eye Ointment | Pivetal | 46066-753-55 | Pivetal Articifical Tears- recently recalled |
| Face-mount shaft collar | McMaster-Carr | 5631T11 | Face-mount shaft collar |
| Fast green | Millipore Sigma | F7258 | Fast green |
| Freer | Jorvet labs | J0226Q | Freer elevator |
| Head screw -1 | McMaster-Carr | 91251A197 | Black-oxide alloy steel socket head screw, 8-32, 3/4" |
| Head screw -2 | McMaster-Carr | 92196A194 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -3 | McMaster-Carr | 92196A146 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -4 | McMaster-Carr | 92196A151 | Stainless steel socket head screw, 6-32, 3/4" |
| Hematoxylin Solution, Gill No. 1 | Millipore Sigma | GHS132-1L | Hematoxylin Solution, Gill No. 1 |
| Hex nut | McMaster-Carr | 91841A007 | Stainless steel hex nut, 6-32 |
| Hold-down toggle clamp | McMaster-Carr | 5126A71 | Hold-down toggle clamp |
| Impact device | n/a | n/a | custom made |
| Impact platform | n/a | n/a | custom made |
| K-wires | Jorvet Labs | J0250A | JorVet Intramedullary Steinman Pins, Trocar-Trocar 1/16" x 7" |
| Lab View | National Instruments | n/a | n/a |
| Load cell | Kistler | 9712B5000 | Load cell |
| MATLAB | The MathWorks Inc. | n/a | n/a |
| Microscope | Leica | DMi-8 | Leica DMi8 microscope with LAS-X software |
| Midazolam | Almaject | 72611-749-10 | Midazolam Hydrochloride injection: 5mg/ml by Almaject |
| milling machine depth stops | McMaster-Carr | 2949A71 | Clamp-on milling machine depth stops |
| Mobile C-arm | Philips | 718095 | BV Pulsera, Mobile C-arm |
| Mounted linear ball bearing | McMaster-Carr | 9338T7 | Mounted linear ball bearing |
| Needle Driver | A2Z Scilab | A2ZTCIN39 | TC Webster Needle Holder Smooth Jaws 5", Premium |
| Pentobarbital | Vortech | 0298-9373-68 | Pentobarbital 390 mg/mL by Vortech |
| Safranin O | Millipore Sigma | HT90432 | Safranin O |
| Small Battery pack | STRYKER | NS014036 | 6212 Small Battery pack- 9.6 V |
| Steel rod, 2’ | McMaster-Carr | 89535K25 | Steel rod, 2’ |
| Sterile Saline | ICU Medical | 6139-22 | AquaLite Solution Pour Bottles, 250 mL |
| Stryker 6110-120 System 6 Battery Charger | STRYKER | OR-S6110-120 | |
| Surgical gloves | McKesson | 1044729 | Surgical Glove McKesson Perry Size 6.5 Sterile Pair Latex Extended Cuff Length Smooth Brown Not Chemo Approved |
| Surgical gown | McKesson | 1104452 | Non-Reinforced Surgical Gown with Towel McKesson Large Blue Sterile AAMI Level 3 Disposable |
| Suture scissors | Jorvet Labs | J0910SA | Super Cut Scissors, Mayo, Straight, 5 1/2″ |
| TUNEL staining kit | ABP Bioscience | A049 | TUNEL Chromogenic Apoptosis Detection Kit |
| Weitlaner Retractors | Fine Science Tools | 17012-11 | 2x Weitlaner-Locktite Retractors |
Referencias
- Thomas, A. C., Hubbard-Turner, T., Wikstrom, E. A., Palmieri-Smith, R. M. Epidemiology of posttraumatic osteoarthritis. Journal of Athletic Training. 52 (6), 491-496 (2017).
- Pasquale, M. K., et al. Healthcare Utilization and costs of knee or hip replacements versus pain-relief injections. American Health Drug Benefits. 8 (7), 384-394 (2015).
- Yao, J. J., et al. Direct Inpatient medical costs of operative treatment of periprosthetic hip and knee infections are twofold higher than those of aseptic revisions. Journal of Bone and Joint Surgery America. 103 (4), 312-318 (2021).
- Anatone, A. J., et al. Decreased implant survival is associated with younger patients undergoing total knee arthroplasty. HSS Journal. 18 (2), 290-296 (2022).
- Stone, B., Nugent, M., Young, S. W., Frampton, C., Hooper, G. J. The lifetime risk of revision following total knee arthroplasty : a New Zealand Joint Registry study. The Bone and Joint Journal. 104-B (2), 235-241 (2022).
- Chen, D., et al. Osteoarthritis: toward a comprehensive understanding of pathological mechanism. Bone Research. 5, 16044 (2017).
- Robinson, W. H., et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nature Review Rheumatology. 12 (10), 580-592 (2016).
- Perez-Garcia, S., et al. Profile of matrix-remodeling proteinases in osteoarthritis: impact of fibronectin. Cells. 9 (1), 40 (2019).
- Hashimoto, S., Ochs, R. L., Komiya, S., Lotz, M. Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis. Arthritis Rheumatology. 41 (9), 1632-1638 (1998).
- Natoli, R. M., Athanasiou, K. A. Traumatic loading of articular cartilage: Mechanical and biological responses and post-injury treatment. Biorheology. 46 (6), 451-485 (2009).
- Coleman, M. C., Brouillette, M. J., Andresen, N. S., Oberley-Deegan, R. E., Martin, J. M. Differential effects of superoxide dismutase mimetics after mechanical overload of articular cartilage. Antioxidants (Basel). 6 (4), 98 (2017).
- Goodwin, W., et al. Rotenone prevents impact-induced chondrocyte death. Journal of Orthopaedic Research. 28 (8), 1057-1063 (2010).
- Wolff, K. J., et al. Mechanical stress and ATP synthesis are coupled by mitochondrial oxidants in articular cartilage. Journal of Orthopaedic Research. 31 (2), 191-196 (2013).
- Delco, M. L., Bonnevie, E. D., Bonassar, L. J., Fortier, L. A. Mitochondrial dysfunction is an acute response of articular chondrocytes to mechanical injury. Journal of Orthopaedic Research. 36 (2), 739-750 (2018).
- Coleman, M. C., Ramakrishnan, P. S., Brouillette, M. J., Martin, J. A. Injurious loading of articular cartilage compromises chondrocyte respiratory function. Arthritis Rheumatology. 68 (3), 662-671 (2016).
- Bobinac, D., Spanjol, J., Zoricic, S., Maric, I. Changes in articular cartilage and subchondral bone histomorphometry in osteoarthritic knee joints in humans. Bone. 32 (3), 284-290 (2003).
- Coleman, M. C., et al. Targeting mitochondrial responses to intra-articular fracture to prevent posttraumatic osteoarthritis. Science Translational Medicine. 10 (427), eaan5372 (2018).
- Heraud, F., Heraud, A., Harmand, M. F. Apoptosis in normal and osteoarthritic human articular cartilage. Annals of Rheumatological Diseases. 59 (12), 959-965 (2000).
- Narez, G. E., Fischenich, K. M., Donahue, T. L. H. Experimental animal models of post-traumatic osteoarthritis of the knee. Orthopedic Reviews (Pavia). 12 (2), 8448 (2020).
- Fischenich, K. M., et al. Chronic changes in the articular cartilage and meniscus following traumatic impact to the lapine knee. Journal of Biomechanics. 48 (2), 246-253 (2015).
- Isaac, D. I., Meyer, E. G., Kopke, K. S., Haut, R. C. Chronic changes in the rabbit tibial plateau following blunt trauma to the tibiofemoral joint. Journal of Biomechanics. 43 (9), 1682-1688 (2010).
- Wei, F., et al. Post-traumatic osteoarthritis in rabbits following traumatic injury and surgical reconstruction of the knee. Annals of Biomedical Engineering. 50 (2), 169-182 (2022).
- Terracciano, R., et al. Quantitative high-resolution 7T MRI to assess longitudinal changes in articular cartilage after anterior cruciate ligament injury in a rabbit model of post-traumatic osteoarthritis. Osteoarthritis and Cartilage Open. 4 (2), 100259 (2022).
- Huang, K., Cai, H. L., Zhang, P. L., Wu, L. D. Comparison between two rabbit models of posttraumatic osteoarthritis: A longitudinal tear in the medial meniscus and anterior cruciate ligament transection. Journal of Orthopaedic Research. 38 (12), 2721-2730 (2020).
- Sun, Z. B., Peng, H. Experimental Study on the prevention of posttraumatic osteoarthritis in the rabbit knee using a hinged external fixator in combination with exercises. Journal of Investigative Surgery. 32 (6), 552-559 (2019).
- Gardner, M. J., et al. The incidence of soft tissue injury in operative tibial plateau fractures: a magnetic resonance imaging analysis of 103 patients. Journal of Orthopedic Trauma. 19 (2), 79-84 (2005).
- Dilley, J. E. B. . M. A., Roman, N., McKinley, T. O., Sankar, U. Post-traumatic osteoarthritis: A review of pathogenic mechanisms and novel targets for mitigation. Bone Reports. 18, 101658 (2023).
- Seol, D., et al. Effects of knockout of the receptor for advanced glycation end-products on bone mineral density and synovitis in mice with intra-articular fractures. Journal of Orthopedic Research. 36 (9), 2439-2449 (2018).
- Furman, B. D., et al. Joint degeneration following closed intraarticular fracture in the mouse knee: a model of posttraumatic arthritis. Journal of Orthopedic Research. 25 (5), 578-592 (2007).
- Glasson, S. S., Chambers, M. G., Van Den Berg, W. B., Little, C. B. The OARSI histopathology initiative - recommendations for histological assessments of osteoarthritis in the mouse. Osteoarthritis Cartilage. 18 Suppl 3, S17-S23 (2010).
- McCoy, A. M. Animal models of osteoarthritis: comparisons and key considerations. Veterinary Pathology. 52 (5), 803-818 (2015).
- Fening, S. D., Jones, M. H., Moutzouros, V., Downs, B., Miniaci, A. Method for Delivering a controlled impact to articular cartilage in the rabbit knee. Cartilage. 1 (3), 211-216 (2010).
- Leucht, F., et al. Development of a new biomechanically defined single impact rabbit cartilage trauma model for in vivo-studies. Journal of Investigative Surgery. 25 (4), 235-241 (2012).
- Vrahas, M. S., Smith, G. A., Rosler, D. M., Baratta, R. V. Method to impact in vivo rabbit femoral cartilage with blows of quantifiable stress. Journal of Orthopedic Research. 15 (2), 314-317 (1997).
- Borrelli, J., Burns, M. E., Ricci, W. M., Silva, M. J. A method for delivering variable impact stresses to the articular cartilage of rabbit knees. Journal of Orthopedic Trauma. 16 (3), 182-188 (2002).
- Milentijevic, D., Rubel, I. F., Liew, A. S., Helfet, D. L., Torzilli, P. A. An in vivo rabbit model for cartilage trauma: a preliminary study of the influence of impact stress magnitude on chondrocyte death and matrix damage. Journal of Orthopedic Trauma. 19 (7), 466-473 (2005).
- Alexander, P. G., et al. An In vivo lapine model for impact-induced injury and osteoarthritic degeneration of articular cartilage. Cartilage. 3 (4), 323-333 (2012).
- Bonitsky, C. M., et al. Genipin crosslinking decreases the mechanical wear and biochemical degradation of impacted cartilage in vitro. Journal of Orthopedic Research. 35 (3), 558-565 (2017).
- Bartley, K. A., Johnson, C. H. Human Infant pants for postoperative protection during social housing of new zealand white rabbits (Oryctolagus cuniculus). Journal of the American Association for Laboratory Animal Science. 58 (4), 510-516 (2019).
- Lillie, R. D., Fullmer, H. M. . Histopathologic technic and practical histochemistry. , (1976).
- Prophet, E., Mills, B., Arrington, J. B., Sobin, L. H. . Armed Forces Institute of Pathology: Laboratory Methods in Histotechnology. Washington DC: American Registry of Pathology. , (1992).
- Dilley, J. E., et al. CAMKK2 is upregulated in primary human osteoarthritis and its inhibition protects against chondrocyte apoptosis. Osteoarthritis and Cartilage. 31 (7), 908-918 (2023).
- Pritzker, K. P., et al. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis Cartilage. 14 (1), 13-29 (2006).
- Christiansen, B. A., et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 23 (10), 1627-1638 (2015).
- Borrelli, J., Zaegel, M. A., Martinez, M. D., Silva, M. J. Diminished cartilage creep properties and increased trabecular bone density following a single, sub-fracture impact of the rabbit femoral condyle. Journal of Orthopaedic Research. 28 (10), 1307-1314 (2010).
- Borrelli, J., Silva, M. J., Zaegel, M. A., Franz, C., Sandell, L. J. Single high-energy impact load causes posttraumatic OA in young rabbits via a decrease in cellular metabolism. Journal of Orthopedic Research. 27 (3), 347-352 (2009).
- Borrelli, J., Zhu, Y., Burns, M., Sandell, L., Silva, M. J. Cartilage tolerates single impact loads of as much as half the joint fracture threshold. Clinical Orthopedics and Related Research. 426, 266-273 (2004).
- Karnik, S., et al. Decreased SIRT1 activity is involved in the acute injury response of chondrocytes to ex vivo injurious mechanical overload. International Journal of Molecular Sciences. 24 (7), 6521 (2023).
- Mevel, E., et al. Systemic inhibition or global deletion of CaMKK2 protects against post-traumatic osteoarthritis. Osteoarthritis Cartilage. 30 (1), 124-136 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados