Method Article
使用 MicroSiM (μSiM) 屏障组织平台对血脑屏障进行建模
摘要
本报告提供了在μSiM平台上组装、细胞培养和检测的方案,用于构建血脑屏障模型。
摘要
microSiM (μSiM) 是一种基于膜的培养平台,用于模拟血脑屏障 (BBB)。与传统的基于膜的平台不同,μSiM 为实验人员提供了新的功能,包括活细胞成像、“血液”和“脑”室之间不受阻碍的旁分泌信号传导,以及无需提取/重新安装膜即可直接对免疫荧光进行成像的能力。在这里,我们演示了该平台的基本用途,即使用超薄纳米多孔氮化硅膜建立BBB的单一培养(内皮细胞)和共培养(内皮细胞和周细胞)模型。我们证明了与原代细胞培养物和人诱导多能干细胞 (hiPSC) 培养物的相容性。我们提供了通过免疫荧光染色对BBB模型进行定性分析的方法,并演示了 μSiM 在小分子渗透性测定中对屏障功能进行定量评估。所提供的方法应使用户能够在平台上建立他们的屏障模型,从而推动组织芯片技术在研究人体组织的使用。
引言
活组织被专门的细胞隔开,这些细胞产生和维持屏障,并调节哪些细胞和分子从一个隔室运输到另一个隔室。屏障功能的不当调节可能是急性疾病和慢性疾病的根源。血脑屏障(BBB)是人体中限制性最强的组织屏障1。血脑屏障障碍是多种中枢神经系统 (CNS) 疾病的基础,包括阿尔茨海默病2、帕金森病 3,4 和多发性硬化症 5,6。血脑屏障损伤也与急性疾病(如脓毒症7、COVID-198 和术后谵妄9)导致的长期认知障碍有关。开发具有治疗脑部疾病潜力的药物一直非常困难,因为故意破坏血脑屏障以将生物活性分子递送到大脑中的靶标是具有挑战性的10.由于这些原因,在体外研究BBB功能的方法对于了解和治疗中枢神经系统疾病至关重要。
在体外测量屏障功能的基本方法包括在半透膜上建立单层或共培养物,并测量细胞对小分子扩散或小电流的抵抗力11,12,13,14。虽然微生理系统 (MPS) 的出现为 3D15,16 中的 BBB 建模提供了大量选择,但系统几何形状的多样性使得很难将 MPS 之间的渗透率测量值或与已建立的文献值进行比较。在BBB研究中,可信基线值的建立尤为重要,由于脑血管内皮细胞的广泛屏障调节,体外通透性值受到高度审查12,17,18。由于这些原因,在2D膜上建立的单层渗透率测量将在未来几年内仍然是BBB研究的主要内容。这适用于其他组织屏障,包括上皮屏障,其中基线通透性的绝对值用于验证和比较体外模型 19,20,21。
为了为 BBB 研究界建立一个有价值的新工具,我们推出了 22 和先进的 23、24、25、26 微型设备,该微型设备具有 silicon membrane (μSiM) 平台,用于屏障组织建模在过去 5 年中。该平台的使能特征是具有数亿个纳米孔 27,28 或纳米孔和微孔混合物29 的超薄(<100 nm 厚)膜。独立式膜芯片在300μm的硅“芯片”上生产,该芯片稳定了超薄结构30,并允许它们由镊子处理以进行设备组装。由于其超薄特性,该膜的渗透率比商业膜培养设备中使用的传统轨道蚀刻膜高两个数量级31,32。在实践中,这意味着膜对小于纳米孔(<60 nm)的分子扩散的阻碍可以忽略不计33。因此,对于细胞屏障,只有细胞和它们沉积的基质才能决定小分子从顶端到由膜34隔开的基底隔室的转运速率。器件设计和膜的超薄特性也为光学显微镜提供了许多优势。这些包括 1) 使用相差或明场成像跟踪活体培养物的能力,2) 无需提取膜并将其转移到盖玻片上即可原位荧光染色和成像的能力,以及 3) 膜比共聚焦“切片”更薄的事实,因此直接共培养在细胞类型之间具有比 6-10 μm 厚的轨道蚀刻膜更自然的间距。
最近,我们将平台推进为模块化格式,以促进快速组装34 和定制 35,36。我们利用模块化格式在我们的生物工程和协作脑屏障实验室之间分配设备组件。然后,我们共同开发了用于器械组装、单一培养和共培养、免疫荧光染色和小分子通透性的方案,并表明这些方法在实验室之间是可重复的。使用这些方案,我们还表明,模块化平台支持使用扩展内皮培养方法(EECM)开发的经过验证的BBB,用于从人诱导多能干细胞(hiPSCs)37中产生脑微血管样内皮细胞(BMEC)。本报告的目的是更详细地审查这些方法,并借助随附的视频,促进该平台在BBB社区中的更广泛采用。
研究方案
1. μSiM器件组装
注意:此方法描述设备的组装。膜片有沟槽面和平面,可沟槽上下组装。沟槽装置最常用于细胞培养。
- 在无菌环境(即生物安全罩)中,准备所有组装材料,包括组装夹具、组件、膜片和镊子。
- 使用片式镊子将膜片放在夹具 A1 的中心。对于沟槽式器件,芯片的平面朝下,沟槽区域朝上,反 之亦然 。
注意: 以下组装步骤以沟槽下装置为例ample,该装置允许在顶部腔室中具有平坦的生长区域。 - 将组件 1 粘接到芯片上。首先,用直镊子撕下组件 1 两侧的蓝色保护层,并将其放入夹具 A1 中,顶部腔室朝下。轻轻向下按压组件 1,直到压敏胶 (PSA) 接触芯片。
- 将夹具 A2 放在夹具 A1 上,并在不同的角落施加牢固的压力,以确保芯片和组件紧密配合。
注意: 一定不要取下 PSA 层。与蓝色保护层相比,它是一种透明且更坚硬的层。 - 用芯片将组件 2 与组件 1 粘合。首先,用直镊子抓住组件 2 的一个角并将其从片材上剥离,以准备组件 2。然后,抓住组分 2 的非 PSA“三角形”区域,一起去除组分 2 的厚透明保护层和蓝色层,露出 PSA 表面。将组件 2 放在夹具 B1 中,PSA 面朝上。
- 将组件 1 与膜芯片一起放入夹具 B1 中,顶部腔室朝上。
- 将夹具 B2 放在组件 1 上,并在夹具 B2 的不同角落施加牢固的压力。
- 将组装好的装置从夹具中取出,用直镊子压出装置底部的任何气泡,并密封通道的边缘,避免与膜区域接触。在用于细胞培养之前,对新组装的设备进行紫外线 (UV) 灭菌 20 分钟。
2. 细胞培养
注:此方法描述了平台上原代和hiPSC衍生培养物的方案。这些方法描述了在装置的顶部腔室中进行内皮细胞单一培养,以及在沟槽组装装置的底部腔室中与周细胞和内皮细胞在顶部腔室中共培养的周细胞和内皮细胞。有关腔室尺寸和体积,请参见 表 1。这些是最常见的格式;但是,可以根据用户需求使用其他细胞培养布局。
- 细胞培养室制备
- 按照第 1 节中详述的协议组装设备。
- 将设备放入无菌软管夹中amps.在细胞培养之前,通过将夹子浸泡在乙醇中≥20分钟来对夹子进行灭菌。每次实验后重新消毒以备重复使用。
- 在大型无菌培养皿中培养装置。为了获得额外的湿度,添加一个小培养皿或装满无菌水的 50 mL 锥形管盖。
- 用 100 μL 无菌水清洗设备的顶部腔室两次。对于底室细胞培养,用 20 μL 无菌水洗涤底室。
- hCMEC/D3 细胞系 (BBB) 单培养
- 根据第2.1节准备细胞培养室。
- 用25μg/ cm 2的胶原I和5μg/cm 2的人纤连蛋白混合在磷酸盐缓冲盐水(PBS)中涂覆顶部腔室。让它在37°C静置1-2小时或在4°C下过夜。
- 除去包衣溶液,向上腔室中加入 100 μL 预热的生长因子耗尽内皮培养基(测定培养基),向下腔室中加入 20 μL。为了制备测定培养基,混合 100 mL 内皮基础培养基 + 400 μL 人成纤维细胞生长因子 + 40 μL 氢化可的松 + 100 μL 硫酸庆大霉素 + 2 mL 胎牛血清。
- 根据制造商的方案传代 hCMEC/D3 细胞;胰蛋白酶消化细胞在37°C培养箱中3-5分钟,然后通过加入预热的内皮培养基停止胰蛋白酶消化。将细胞悬浮液转移到离心管中,并在室温下以200×g离心5分钟。将细胞沉淀重悬于测定培养基中,并以 40,000-60,000 个细胞/cm2 的密度将细胞接种在顶部腔室中。将装置在37°C下用5%二氧化碳(CO 2)孵育2-4小时,以促进细胞粘附。例如,要在 0.37 cm 2 芯片上达到 40,000 个细胞/cm2,向顶部腔室中加入 100 μL 浓度为 150,000 个细胞/mL 的细胞溶液。
注:我们根据 Hudecz 等人 38 培养和传代 hCMEC/D3,使用改良的内皮生长培养基-2 (EGM-2) 配方进行细胞维持,并在传代培养后使用生长因子还原的“测定培养基”进行测定。其他培养基配方应与设备兼容,但如果用户遇到 hCMEC/D3 存活问题,我们推荐使用 Hudecz 等人 38 的培养基配方。 - 细胞粘附2-4小时后,在两个腔室中与新鲜的测定培养基交换以除去死的或未附着的细胞。
- 将装置保持在37°C和5%CO 2,每2-3天在两个腔室中交换测定培养基,直到实验。检测通常在培养 2 周后进行。
- hiPSC衍生的EECM-BMEC样细胞单培养
- 根据第2.1节准备细胞培养室。
- 通过将 5 mL 的 0.5 mg/mL 乙酸加入 5 mg 胶原 IV 中以制备 1 mg/mL 溶液,从人胎盘溶液制备胶原 IV。让溶液在4°C下静置≥4小时以完全复溶。该溶液在4°C下稳定2周。
- 用 100 μL 4:1:5 比例的胶原 IV、牛纤连蛋白和无菌水涂覆顶部腔室。在37°C下涂覆2-4小时。
- 除去包衣溶液,向顶部腔室加入 100 μL 室温 hECSR,向下腔室加入 20 μL。
- 根据 Nishihara 等人 37 传代 EECM-BMEC 样细胞;向细胞中加入细胞分离酶混合物,并转移到37°C培养箱中5-8分钟。移液细胞溶液以使其单一化,并在离心管中加入4倍体积的内皮培养基。在室温下以200× g 离心5分钟;将细胞重悬于hECSR中,并以40,000个细胞/ cm2的密度在顶部腔室中接种。将设备在37°C下用5%CO 2孵育2-4 小时以促进细胞粘附。例如,要达到 40,000 个细胞/cm2,添加 100 μL 细胞溶液,浓度为 150,000 个细胞/mL。
- 细胞粘附2-4小时后,在两个腔室中与新鲜的hECSR交换以除去死的或未附着的细胞。
- 将装置保持在37°C和5%CO 2,每1-2天在两个腔室中交换hECSR,直到实验。检测通常在培养的第 6 天进行。
- hCMEC/D3 和原代人脑血管周细胞 (HBVP) 共培养
- 在设备组装之前,用混合在PBS中的2μg/cm 2 聚-L-赖氨酸(PLL)涂覆膜芯片。将 50-80 μL PLL 以液滴形式施加到最终设备组件中朝下的一侧。在37°C下1-2小时或在4°C下过夜完成涂层过程。
- 去除涂层溶液。用无菌超纯水清洗膜片并使其干燥。
- 按照上文第1节详述的方案组装设备,PLL涂层面朝下,并根据第2.1节准备细胞培养室。
- 根据第 2.2.2 节涂覆顶部腔室。
- 向顶部腔室中加入 50 μL 预热的周细胞培养基,向下部通道加入 20 μL。
- 根据制造商的方案传代HBVP;胰蛋白酶消化细胞在37°C培养箱中3-5分钟,然后通过加入预热的周细胞培养基停止胰蛋白酶消化。将细胞悬液转移到离心管中,并在室温下以200× g 离心5分钟。将细胞沉淀重悬于周细胞培养基中,并以14,000-25,000个细胞/ cm2的密度将细胞接种在底部腔室中。反转设备,但保持与顶部腔室的空气接口,以促进气体交换。
注意: 反转过程中所需的空气接口可以通过将设备放入软管夹内后翻转来实现amp 并在翻转之前向下推所有角落,或者将设备倒置在平行的丙烯酸或硅胶条上,间隔足够远以保持顶部腔室畅通无阻。可能需要针对每个用户优化播种密度。要达到 14,000 个细胞/cm2,加入 20 μL 细胞悬液,浓度为 ~590,000 个细胞/mL。请注意,将 20 μL 移液到底部腔室以避免气泡,但使用 10 μL 的底部腔室体积计算密度。 - 将细胞在37°C下用5%CO 2在倒置位置孵育2-4 小时,以促进细胞粘附。
- 细胞粘附2-4小时后,将装置直立翻转,并在两个腔室中与新鲜的周细胞培养基交换,以除去死亡或未附着的细胞。
- 周细胞接种后,按照步骤2.2.4-2.2.5在顶部腔室中接种hCMEC / D3s。将两个腔室切换到测定培养基。
- 将装置保持在37°C和5%CO 2,每1-2天在两个腔室中交换测定培养基,直到实验。原代细胞共培养通常在测定前维持 6-8 天。
注意:如果将 HBVP 单一培养物与 hCMEC/D3 单一培养物或 hCMEC/D3 和 HBVP 共培养物进行比较,则在接种 HBVP 后 2-3 天将周细胞培养基与测定培养基交换。
- hiPSC 衍生的 EECM-BMEC 样细胞和脑周细胞样细胞 (BPLC) 共培养
- 根据第2.1节准备细胞培养室,并按照步骤2.3.2-2.3.3涂覆顶部室。
- 除去包衣溶液,向顶部腔室中加入 50 μL 室温 Essential 6 培养基 + 10% 胎牛血清 (E6 + 10% FBS)。
- 根据 Gastfriend 等人 39 通过 BPLC;向细胞中加入细胞分离酶混合物,并转移到37°C培养箱中5-15分钟,直到~90%的细胞变圆。移液细胞溶液以单异化并在 50 mL 离心管中加入 4 倍体积的 DMEM/F12,使用 40 μm 细胞过滤器过滤并完全单异细胞。转移到 15 mL 离心管中,在室温下以 200 × g 离心 5 分钟,将细胞沉淀重悬于 E6 + 10% FBS 中,并以 14,000-25,000 个细胞/cm2 的密度将细胞接种在底部腔室中。反转设备,但与顶部腔室保持空气接口,以促进气体交换。
注意: 反转过程中所需的空气接口可以通过在将设备放入软管夹内后翻转来实现amps 并在翻转之前向下推所有角,或者将设备倒置在平行的丙烯酸或硅胶条上,间隔足够远以保持顶部腔室畅通无阻。可能需要针对每个用户优化播种密度。要达到 14,000 个细胞/cm2,加入 20 μL 细胞悬液,浓度为 ~590,000 个细胞/mL。请注意,将 20 μL 移液到底部腔室以避免气泡,但使用 10 μL 的底部腔室体积计算密度。 - 将细胞在37°C下用5%CO 2在倒置位置孵育2-4 小时,以促进细胞粘附。
- 细胞粘附2-4小时后,将装置直立翻转,并在两个腔室中与新鲜的E6 + 10%FBS交换,以除去死的或未附着的细胞。
- 周细胞接种后一天,按照步骤2.3.5-2.3.6在顶部腔室中接种EECM-BMEC样细胞。将两个腔室切换到 hECSR。
- 将装置保持在37°C,含5%CO 2,每1-2天在两个腔室中更换测定培养基,直到实验。在测定之前,BPLC 的 hiPSC 衍生共培养通常维持 7 天,EECM-BMEC 样细胞维持 6 天。
注意:如果将BPLC单培养物与EECM-BMEC单一培养物或EECM-BMEC和BPLC共培养物进行比较,则在接种BPLC后1天将E6 + 10%FBS与hECSR交换。
3. 免疫细胞化学
注:该方法描述了在膜的顶部和/或底部培养的细胞的免疫细胞化学染色和成像方案。本实验的目的是确定应在 BBB 中发现的关键蛋白质的存在和位置,例如粘附和紧密连接蛋白以及细胞身份蛋白。替代染色和活体染色方法也与该平台兼容。
- 设备上的固定和染色
- 将一抗放在冰上解冻。
- 在室温下制备 4% 多聚甲醛 (PFA) 溶液(例如,将 16% PFA 稀释在其体积的 3 倍 PBS 中)或在 -20 °C 下冷却 100% 甲醇。
- 根据 表 2 创建适当的封闭解决方案。储存在冰上。
注意:可能需要涡旋溶液才能完全溶解Triton X-100。 - 通过将 20 μL 固定剂(例如 PFA 或甲醇)移液到底部腔室中,将 50 μL 移液到顶部腔室中来固定细胞。将设备在室温下孵育 10 分钟(PFA)或 2 分钟(甲醇)。
- 将 20 μL PBS 移液到底部腔室,将 100 μL 移液到顶部腔室中,洗涤 3 x 5 分钟。
- 在室温下封闭30分钟,将20μL封闭溶液加入底部腔室,将50μL封闭溶液加入顶部腔室。检查底部腔室中是否有气泡。
- 根据 表2,通过在封闭溶液中稀释抗体来制备一抗溶液。储存在冰上。
- 通过向底部腔室中加入 20 μL 一抗溶液并用 50 μL 一抗溶液替换顶部腔室的体积,用一抗染色。检查底部腔室中是否有气泡。在室温下孵育1小时或在4°C下孵育过夜。
- 将 20 μL PBS 移液到底部腔室,将 100 μL 移液到顶部腔室中,洗涤 3 x 5 分钟。
- 根据 表2,通过在封闭溶液中稀释抗体来制备二抗溶液。存放在避光的冰上。
- 通过向底部腔室中加入 20 μL 二抗溶液并用 50 μL 二抗溶液替换顶部腔室的体积,用二抗染色。检查底部腔室中是否有气泡。在室温下避光孵育1小时。
- 将 20 μL PBS 移液到底部腔室,将 100 μL 移液到顶部腔室中,洗涤 3 x 5 分钟。
- 制备核染色溶液。在 PBS 中以 1:10,000 的比例稀释 Hoechst。向底部腔室中加入 20 μL 核染色溶液,并用 50 μL 核染色溶液替换顶部腔室的体积。检查底部腔室中是否有气泡。在室温下避光孵育 3 分钟。
- 通过向底部腔室中加入 20 μL PBS 并用 100 μL PBS 替换顶部腔室的体积来去除污渍。立即对设备进行成像或将它们储存在4°C下,培养皿包裹在封口膜中并避光,直到准备好成像。
- 共聚焦成像
注:本节介绍使用具有长工作距离 (LWD) 40 倍物镜(水,WD 590-610,数值孔径 1.15)的倒置转盘共聚焦显微镜对设备进行成像。有关工作距离和镜头兼容性,请参阅 McCloskey 等人 34 中的补充材料。整个膜区域的图像也使用10倍物镜拍摄,以确保40倍图像能够代表整个区域。这些通常是在宽场拍摄的。- 打开显微镜并打开成像软件。
- 使用 共聚焦成像模式,根据二抗和核染色的特性设置通道。优化激光功率和曝光时间,确保信号高于背景并减少成像伪影。
- 对于赫斯特核染色,使用激发 405,发射 450/50 带通 (BP),曝光时间 500 ms,激光功率 50%。对于使用偶联 Alexa Fluor (AF) 488 的二抗的标记物,请使用激发 488、发射 525/50BP、500 ms 曝光时间和 50% 激光功率。对于使用偶联 AF568 的二抗的标记物,请使用激发 561、发射 600/50BP、500 ms 曝光时间和 100% 激光功率。
- 将设备放入显微镜载玻片装置支架中,顶部腔室朝上,并使用显微镜载玻片支架将其置于显微镜中。打开 直播 并选择核染色的通道。使用低物镜找到膜,确保透明氮化硅膜区域居中,因为光线不会穿过蓝色固体硅胶区域。一旦设备正确居中并找到细胞层,切换到 40 倍物镜,润湿物镜,并使用核染色剂作为引导聚焦在膜区域。
- 打开 z-stack 成像并将扫描模式设置为开始/结束。设置步长或计数。使用显微镜上的粗调旋钮,将扫描起点设置为内皮细胞层的顶部,以核染色剂为引导,扫描端位于周细胞层的底部,以核染色剂为引导。检查所有通道,确保在成像场中捕获所有内容。
注意:我们通常使用自动步进,即~0.2μm切片。 - 设置图像名称并按 获取 开始成像。根据需要在不同区域重复上述步骤。
- 使用 ImageJ40 或 Imaris 处理共聚焦图像。
- 要在Imaris中进行处理,请将图像文件拖到程序中打开。选择顶部菜单栏上的 “剖面 ”以查看 x-y 平面的 2D 图像以及 x-z 和 y-z 平面的相应视图。选择顶部菜单栏上的“ 3D 视图 ”以查看 3D 图像。单击图像并拖动它进行旋转。在顶部菜单栏上选择 快照 以拍摄图像。
4. 小分子渗透率的取样测定
注:本节介绍一种定量测量细胞培养物屏障特性的方法。该实验的目的是检测穿过细胞层并进入平台底部腔室的荧光小分子的浓度。然后使用这些数据来计算细胞通透性。
- 取样技术
- 按照第 1 节中详述的方案组装设备,并按照第 2 节所述培养所需的细胞系。包括一个额外的设备,用作无电池涂层控制设备,以测量系统渗透率。
注意:建议每种条件至少进行三次技术重复;然而,只需要一个涂层对照的复制品。 - 在开始采样测定之前,用新鲜培养基替换底部腔室的培养基。在显微镜下检查每个装置中内皮单层的汇合度。注意细胞单层中的任何间隙,因为这会影响染料向底部腔室的扩散。
注意:健康的内皮培养物应 100% 汇合。 - 在细胞培养基中制备荧光小分子溶液(例如,150μg/ mL Lucifer Yellow,457 Da)。制备过量体积的荧光小分子溶液,用于制备标准溶液,作为参考,计算从底部通道采样的荧光小分子的浓度。
注:我们建议制备 400 μL 过量溶液,用作荧光小分子浓度最高的标准溶液。 - 用 100 μL 荧光小分子溶液替换顶部孔中的培养基。
注意: 我们建议使用疏水笔在采样口周围画圆圈,等到疏水性墨水完全干燥后再添加荧光染料溶液。这样可以防止介质从步骤 4.1.7 中采样端口周围的底部通道扩散。我们建议错开将荧光小分子溶液加入顶部孔中 - 等待 2 分钟后再将荧光溶液添加到下一个设备中,或以 3 个为一组(同时将溶液添加到三个设备中,等待 5 分钟以添加下一个三个设备)。 - 将设备在37°C,5%CO2 下孵育1小时。
- 在上一步的1小时长孵育期间,通过从步骤4.1.3中制备的荧光小分子溶液进行2倍连续稀释来制备标准溶液。将 50 μL 每种溶液移液到平底黑色 96 孔板中,一式三份。使用空白细胞培养基作为基线标准溶液。
注:为了制备标准溶液,我们建议以最终体积为200μL进行11次连续稀释,并使用细胞培养基作为空白来测量基线荧光强度。- 将步骤4.1.3制备的过量荧光小分子溶液转移至含有200μL培养基的试管中,充分混合,并将200μL该溶液转移到含有200μL培养基的下一个试管中。重复 1:2 稀释,直到总共有 10 个试管。在96孔板(B1,C1,D1)中一式三份地将50μL最浓缩的标准溶液移入第1列中,将第2个最浓缩 的溶液移入第2列(B2,C2,D2)中,依此类推。对于板中的第 12 列,移液 50 μL 空白培养基,一式三份(B12、C12、D12)。
- 执行以下步骤,从底部通道取样荧光小分子溶液。
- 从孔中取出荧光小分子溶液以停止扩散过程。
- 将装有 50 μL 培养基的吸头放入上端口以用作储液器,方法是将装有 50 μL 的吸头插入端口,提起设备,并在握住顶部的同时轻轻弹出吸头以稳定。放下设备。确保移液器吸头中没有气泡或移液器吸头没有空气,以免在采样过程中将气泡添加到底部腔室中。
- 将 50 μL 培养基加入顶部孔中,以防止在采样过程中破坏细胞单层。
- 为了从底部通道取样溶液,将带有空移液器吸头的移液器推至其第一个阻力,将吸头插入取样口,然后从底部通道反向移出 50 μL 溶液。直接转移到含有标准溶液的平底黑色 96 孔板中。
注意:我们建议在采样后立即在显微镜下检查细胞单层。从底部通道抽取培养基偶尔会导致顶部孔中的细胞层破裂,这可能会导致渗透率测量不一致。在 4.1.7 中的各个步骤中快速工作将有助于防止这种情况。
- 使用所用荧光小分子的适当激发和发射波长参数测量酶标仪中的荧光强度。对于 Lucifer Yellow,使用 428 nm 激发和 536 nm 发射,以获得最佳增益。从板的顶部测量荧光。将板加入酶标仪,突出显示带有样品的孔(包括标准曲线),然后选择 开始 读取孔。
- 按照第 1 节中详述的方案组装设备,并按照第 2 节所述培养所需的细胞系。包括一个额外的设备,用作无电池涂层控制设备,以测量系统渗透率。
- 渗透率值的计算(模板见 补充文件 1 )
- 从所有测得的荧光强度值中减去空白培养基的平均荧光强度值。
- 使用公式(1)计算系统磁导率 Ps:
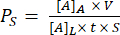 (一)
(一)
其中 [A]A 是从底部通道收集的荧光小分子的浓度,V 是采样并添加到板中的体积 (0.050 mL),[A]L 是添加到顶部孔中的荧光小分子的浓度(例如 0.15 mg/mL),t 是孵育时间(以 s 或 min 为单位,具体取决于所需的单位), S为膜表面积(0.014cm2)。- 使用通过绘制荧光强度输出和标准溶液已知浓度的标准曲线获得的方程计算[A]A 。通过将实验样品的荧光强度值(y)插入方程式中来计算实验样品的浓度(x)。
注意:使用标准曲线的线性部分。我们建议从显微镜下拍摄的膜图像测量膜表面积,因为膜面积可能因批号而异,如果它们与涂层对照不同,可能会显着影响计算出的渗透率值。
- 使用通过绘制荧光强度输出和标准溶液已知浓度的标准曲线获得的方程计算[A]A 。通过将实验样品的荧光强度值(y)插入方程式中来计算实验样品的浓度(x)。
- 使用公式(2)计算细胞单层 Pe的渗透率:
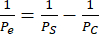 (二)
(二)
其中,PS 是在步骤 4.2.2 中计算的系统磁导率,PC 是无细胞涂层控制装置的系统磁导率值。
结果
沟槽装置的组装如图 1 所示。夹具指导组件和膜芯片的组装。组件 1 主要是丙烯酸,具有用于与芯片粘合的 PSA 表面,以及通向底部腔室的开口和用于移液器进入底部腔室的端口。组件 2 是通道层,右上角包含一个非粘性、不含 PSA 的“三角形”,用于抓取。沟槽式装置在顶部腔室中提供平坦的细胞培养生长区域,而沟槽式装置在底部腔室中具有用于细胞培养的平坦表面。
我们对 hCMEC/D3 和 HBVP 以及 hiPSC IMR90-4 衍生的 EECM-BMEC 样细胞和 BPLC 进行了内皮单一培养和共培养,并使用尼康 Eclipse Ts2 相差显微镜和 10 倍物镜获取了相位图像(图 2)。显示了原代细胞培养的最佳接种密度(接种后1天拍摄的图像)以及接种不足的HBVP(图2A)。最终共培养和单一培养阶段图像(6天内皮细胞培养)可能难以区分(图2C),并且确认成功的原代细胞共培养可能需要免疫荧光染色(参见方案第3节)。图中还显示了低、高和最佳的hiPSC衍生的BPLC接种密度(图2B)。与原代共培养物相比,hiPSC衍生的共培养物在相差成像中更易于区分(图2D)。低 BPLC 接种导致周细胞覆盖率差和周细胞聚集,而过度接种导致周细胞层从膜上剥落。此外,过快地更换底部腔室中的培养基可能会导致周细胞丢失,因为这些细胞对剪切非常敏感。对于BBB模型,周细胞的最佳覆盖率为~90%,内皮层没有间隙。
免疫染色的hiPSC衍生共培养的代表性图像如图 3 所示(6天内皮细胞培养)。IMR90-4 衍生的 BPLC 对周细胞标志物 PDGFRβ 进行染色,IMR90-4 衍生的 EECM-BMEC 样细胞对粘附连接标记 VE-钙粘蛋白进行染色。Hoechst 用于染色细胞核。使用具有 0.2 μm 切片的 40 倍 LWD 物镜在 Spinning Disc 共聚焦显微镜上采集图像,并用 Imaris 处理。即使看不到薄的纳米膜,也可以看到两个细胞层。
我们在瑞士伯尔尼大学和美国纽约州罗切斯特大学的两个物理距离较远的实验室中使用相同的实验条件进行了基于采样的小分子渗透性测定,以证明结果的实验室间可重复性(图 4)34。将 hiPSC IMR90-4 衍生的 EECM-BMEC 样细胞在 μSiM 装置中培养 2、4 或 6 天,并在 transwell 过滤器上培养 6 天。在两个实验室均使用 150 μg/mL Lucifer Yellow (457 Da) 进行测定。在装置中培养 2 天的内皮细胞通透性的高变异性表明 2 天的培养不足以实现屏障成熟。从4天开始,屏障成熟后,实验室之间的渗透性没有显著差异。我们还表明,在μSiM和transwell过滤器中培养6天的内皮细胞的通透性与先前发表的40天相匹配。
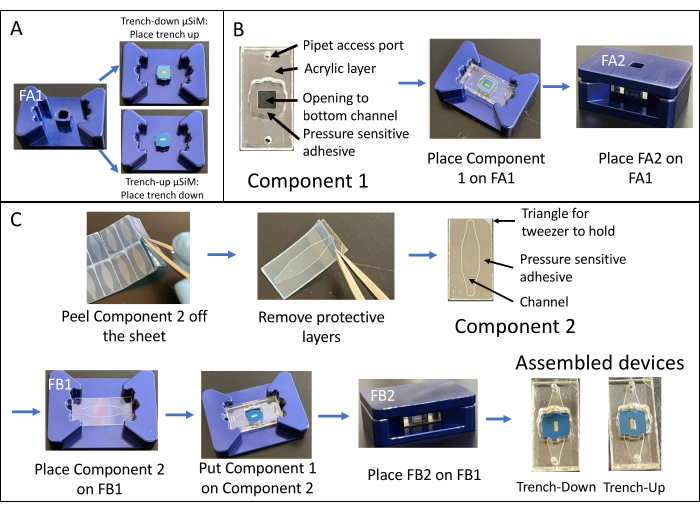
图 1:μSiM 组装的步骤 。 (A) 将芯片放在夹具 A1 上,以准备芯片。将芯片沟槽向上放置,以进行最后的沟槽向下装置。将芯片沟槽放下,用于最后的沟槽装置。(B) 从组件 1 上取下防护面罩并将其面朝下放入 FA1 中,将组件 1 粘合到芯片上。用夹具 A2 施加压力进行粘合。(C) 通过将组件 2 从其片材上取下并剥离顶部保护层来粘合组件 2 和组件 1。将通道向上放入夹具 B1 中,并将组件 1 正面朝上放置在组件 2 的顶部。通过用夹具 B2 施加压力进行粘合。缩写:FAn = fixture An;FBn = 夹具 Bn. 请点击这里查看此图的较大版本.
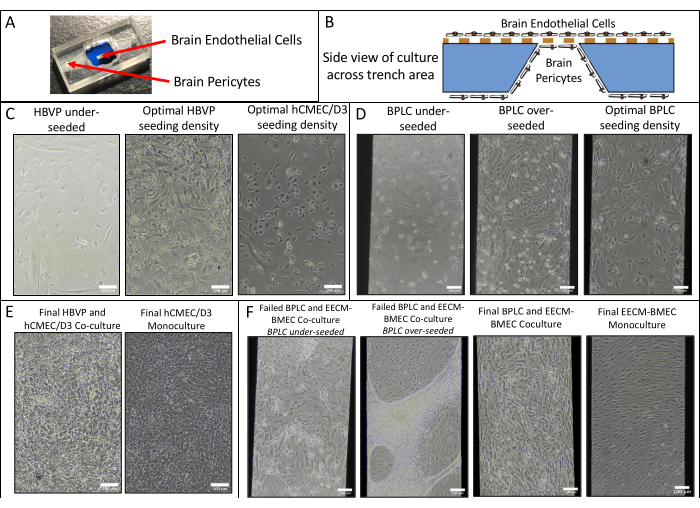
图 2:设备中细胞培养的共培养示意图和代表性相差图像。 (A) 周细胞和内皮细胞接种的位置。(B)膜芯片沟槽中细胞位置的侧视图示意图。(C) 原代 HBVP 和 hCMEC/D3 脑内皮细胞系的低接种密度和最佳接种密度的代表性图像。在接种后 1 天 (HBVP) 和接种后 2 小时采集图像 (hCMEC/D3)。(D) hiPSC 来源的脑周细胞样细胞的低、高和最佳接种密度的代表性图像。播种后 1 天采集图像。(E) 最终 HBVP 和 hCMEC/D3 共培养以及 hCMEC/D3 单一培养的代表性图像。在 HBVP 接种后 8 天和 hCMEC/D3 接种后 7 天采集图像。(F) BPLC 和 EECM-BMEC 样细胞共培养失败和成功的代表性图像以及 EECM-BMEC 样细胞单一培养的代表性图像。图像是在 BPLC 接种后 7 天和 EECM-BMEC 接种后 6 天采集的。未接种的 BPLC 培养物无法具有足够的覆盖率,而过播的 BPLC 培养物会过度汇合并开始结块/后退。比例尺 = 100 μm (C-F)。缩写:HBVPs=人脑血管周细胞;hiPSC = 人诱导多能干细胞;BPLCs = hiPSC 来源的脑周细胞样细胞。请点击这里查看此图的较大版本.
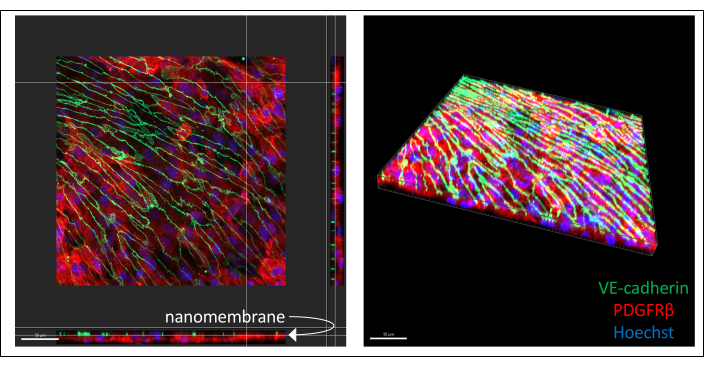
图 3:设备中免疫染色的 hiPSC 衍生细胞共培养的代表性图像。 对细胞进行内皮细胞标志物 VE-cadherin(绿色)、周细胞标志物 PDGFRβ(红色)和核染色(蓝色)染色。近距离可以看到两层细胞,仅由薄的氮化硅纳米膜隔开(左图中的白色箭头标记膜位置)。比例尺 = 50 μm。缩写:hiPSC=人诱导多能干细胞;PDGFRβ = 血小板衍生的生长因子受体 β。 请点击这里查看此图的较大版本.
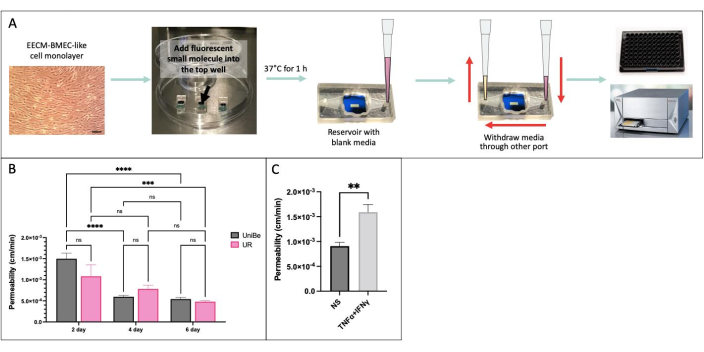
图 4:基于采样的小分子渗透性测定 。 (A) 实验工作流程示意图。(B) 瑞士伯尔尼大学 (UniBe) 和美国纽约州罗切斯特大学 (UR) 两个物理距离较远的实验室之间的实验室间可重复性证明:hiPSC 衍生的内皮细胞在 μSiM 装置中培养 2、4 或 6 天,并在 transwell 过滤器中培养 6 天。使用 150 μg/mL Lucifer Yellow (457 Da) 进行渗透性测定。红色条表示先前发表的荧光素钠 (376 Da) 渗透性数据,这些细胞是在 transwell 过滤器40 中培养 6 天的相同 hiPSC 衍生的内皮细胞。N = 每组 4-16 人。使用双因素方差分析与Tukey的事后检验,仅显示相关p<0.05的比较。 (C) 使用在 μSiM 中培养 2 天的 hiPSC 衍生的 EECM-BMEC 样细胞证明细胞因子反应;在使用 150 μg/mL Lucifer Yellow 进行渗透性测定之前,将 0.1 ng/mL TNFα + 2 IU/mL IFNγ) 或培养基对照(非刺激,NS)加入顶部腔室 20 小时。N = 每组 3 人。学生 t 检验,p < 0.05。 请点击这里查看此图的较大版本.
| 顶腔播种表面积 | 顶孔体积 | 底腔播种表面积 | 底部通道音量 |
| ~37 毫米2 | 100 μL(可容纳 ≥115 μL) | ~42 毫米2 | 10 μL(移液 20 μL 以避免气泡) |
表 1:临界 μSiM 表面积和体积。
| 目标 | 固定 | 封闭解决方案 | 稀释 |
| VE-钙粘蛋白 | 4% PFA 或 100% MeOH | 5% GS + 0.4% Tx-100 或 10% GS + 0.3% Triton X-100 | 1:50 |
| CD31型 | 4% PFA 或 100% MeOH | 5% GS + 0.3-0.4% 海卫一 X-100 | 1:100 |
| 克劳丁-5 | 100%甲醇 | 5-10% GS + 0.3% 海卫一 X-100 | 1:200 |
| ZO-1型 | 100%甲醇 | 5-10% GS + 0.3% 海卫一 X-100 | 1:200 |
| 闭塞素 | 100%甲醇 | 5-10% GS + 0.3% 海卫一 X-100 | 1:50 |
| PDGFRβ | 4%全氟辛烷磺酸 | 5% GS + 0.4% 海卫一 X-100 | 1:100 |
| NG2型 | 4%全氟辛烷磺酸 | 5% GS + 0.4% 海卫一 X-100 | 1:100 |
| 山羊α小鼠IgG Alexa Fluor 488 | 1:200 | ||
| 山羊α小鼠IgG Alexa Fluor 568 | 1:200 |
表 2:在 μSiM 设备中验证用于共培养免疫细胞化学的抗体和染色方法。 缩写:PFA=多聚甲醛;MeOH = 甲醇;GS = 山羊血清。
补充文件1:渗透率值计算模板。请点击这里下载此文件。
讨论
虽然膜片的设计具有稳定性,但如果在组装过程中处理不当,它们可能会破裂或断裂。因此,将芯片夹在芯片镊子槽口中并将其轻轻放入夹具中至关重要。一般处理设备时,必须采取额外的预防措施,不要碰撞或掉落设备。在膜芯片与夹具A1的粘接过程中,芯片必须平放在夹具A1的支柱上居中,以避免在与组件1的粘接过程中膜开裂。此外,在取下防护面罩后,必须避免与暴露的 PSA 层接触。取下防护面罩后处理组件 2 时,建议将其沿组件边缘握住,并使用镊子抓住不含 PSA 的三角角。
虽然描述了可能的 BBB 模型的细胞培养方案,但此处描述的 BBB 的 BMEC/周细胞共培养模型可能足够或不足,具体取决于生理背景和感兴趣的问题。例如,免疫细胞运输主要发生在大脑的毛细血管后小静脉中 41,42。在这些区域中,血管周围空间将BMEC/周细胞屏障与星形胶质细胞建立的神经胶质限制物分开。因此,在毛细血管后小静脉中,神经血管单元 (NVU) 由两个物理上分离的屏障串联组成,星形胶质细胞末端足不直接接触 BMEC/周细胞血屏障,这在当前模型中得到了很好的体现。如果目标是考虑星形胶质细胞分泌因子对血液屏障的影响的NVU模型,则可以在装置中添加一个星形胶质细胞隔室,允许可溶性因子通过血管周围空间进行交换。这个例子在前面的34中已经说明过,可以扩展到包括其他细胞,如小胶质细胞和3D“大脑”隔室中的神经元。该平台的模块化架构支持使用简单的组装策略来实现这些重新配置,从而使平台尽可能简单或复杂,以解决手头的假设。每个细胞培养设置;但是,必须针对新细胞系和多重培养物进行优化。例如,由于氮化硅膜的特性,与组织培养板相比,可能需要调整涂层溶液。纤连蛋白的加入通常有助于细胞附着和存活。此外,用户可以以相反的方向培养内皮细胞和周细胞。在这种情况下,可能需要修改渗透率测量和解释的方式。但是,为此类文化提供步骤超出了本文的范围。
在细胞培养过程中可能遇到的另一个挑战是培养基的快速蒸发,因为与标准组织培养板和烧瓶相比,这些设备对环境的变化更敏感。如果发现蒸发过多或细胞生长减慢,则必须测量所有关键培养箱参数以确保设置准确。可以将更多的水添加到放置在细胞培养室内的组织帽或小培养皿中,或者必须更频繁地更换培养基。此外,气泡可以进入底部通道并卡在沟槽中,以便进行沟槽下降。虽然它们可以去除,但首先避免添加气泡是最容易的。为此,在将介质移液到底部腔室之前,检查移液器吸头中是否有气泡或移液器吸头末端没有空气非常重要。此外,通道中的介质蒸发会导致介质表面和端口顶部之间出现间隙。可以将少量培养基移液到一个端口中,直到培养基到达另一个端口的表面,然后可以在该另一个端口中交换培养基。虽然 hECSR 和 E6 + 10% FBS 培养基不应在水浴中加热,但其他培养基可以预热以减少气泡的形成。如果气泡确实进入底部腔室,可以通过通道快速移液 100 μL 将其去除。然而,这种方法可能会导致腔室或介质之间溢出到设备表面的污染。它还可能破坏细胞层。或者,可以先从通道中取出培养基,然后以 50 μL 的体积重新引入培养基。然而,首先去除介质可能会导致通道中形成更多的气泡。如果气泡不在膜区域的正下方,则可以将其留在通道中,而不会影响细胞培养。
如图 2 所示,周细胞附着和生长可能具有挑战性。使用优化的接种密度对于形成具有生理相关周细胞与内皮细胞比例的层至关重要。此外,由于周细胞对剪切敏感,因此通道中的所有培养基交换都应非常缓慢地进行以保护细胞。对于BPLC培养,可以通过用800μg/ mL IV型胶原蛋白或100μg/ mL纤连蛋白涂覆底部腔室来实现改善附着。
本文描述的设备中的免疫细胞化学可以对细胞健康和功能进行定性分析。在组织培养板或其他平台上进行染色的方法应可直接转化为平台。对于仅在顶部腔室中进行细胞培养,固定后,可以将 PBS 添加到底部腔室中并留给其余步骤,仅在顶部腔室中进行封闭和染色。这最大限度地减少了膜破裂或气泡进入底部腔室的风险。对于共培养染色,我们建议在所有步骤中使用两个腔室。需要注意的是,固定剂和PBS的粘度与介质的粘度不同。因此,将气泡添加到底部腔室中会更容易,并且在移液到底部腔室之前,应格外小心地检查移液器吸头末端的空气。
为小分子通透性测定描述的方案允许对μSiM装置中培养的内皮细胞的屏障功能进行功能和定量评估。在该测定过程中可能遇到的一个问题是在方案步骤4.1.7.4中从底部通道收集样品期间将气泡吸入移液器。为避免此问题,请务必确保在开始样品收集之前将吸头密封在端口中,并且样品不应抽取得太快。如果这不能解决问题,则所用吸头的尺寸可能太小或太大而无法放入端口;使用 材料表中列出的提示。如果尽管单层看起来很健康,但测得的渗透率值却出乎意料地高,则必须在样品采集过程中检查单层的完整性是否中断。我们建议在样品采集后立即在显微镜下检查单层。如果单层看起来仍然完整且健康,则可以固定样品,并且可以评估屏障功能的生物标志物,例如,通过对连接蛋白进行免疫染色。相反,如果测得的渗透率值出乎意料地低,则必须确保从底部通道取样 50 μL 培养基,且没有任何气泡。如果放置储液槽吸头后立即从采样口流出培养基,则必须在将移液器安装到采样口之前收集该培养基,因为大多数荧光小分子将存在于从底部通道采样的初始 10 μL 体积中。使用疏水笔在端口周围画圈或在端口周围放置带有孔的疏水胶带可防止任何被动泵送的介质扩散。如果在取样过程中抽出气泡或未取出完整的 50 μL 样品,则不得使用该样品。或者,可以确定确切的体积并将其用于渗透率计算;然而,只有当去除的体积为 ≥40 μL(相当于 ~98-99% 染料回收率34)时,才应这样做。
披露声明
J.L.M.是SiMPore的联合创始人,并持有该公司的股权。SiMPore正在将超薄硅基技术商业化,包括本研究中使用的膜。
致谢
J.L.M.、B.E.、T.R.G.、M.C.M.、P.K.、M.T.、K.C. 和 LW 由 NIH 拨款 R33 HL154249资助。J.L.M. 由 R44 GM137651 资助。M.M.由罗切斯特大学德尔蒙特神经科学研究所的施密特计划奖资助。M.T. 由 RF1 AG079138资助。K.C.由国际伦理研究基金会资助。
材料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| CD31 Polyclonal antibody | Thermo Fisher Scientific | PA5-32321 | |
| Claudin-5 mouse IgG antibody, 4C3C2 | Thermo Fisher Scientific | 35-2500 | |
| Goat α-Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | |
| Goat α-Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| NG2, mouse IgG2a, 9.2.27 | Millipore | MAB2029 | |
| Occludin mouse IgG antibody, OC-3F10 | Thermo Fisher Scientific | 33-1500 | |
| PDGFRβ, rabbit IgG antibody, 28E1 | Cell Signaling Technology | 3169 | |
| VE-cadherin mouse IgG2B Clone # 123413 | R&D Systems | MAB9381 | |
| ZO-1 rabbit IgG antibody, polyclonal | Thermo Fisher Scientific | 40-2200 | |
| Chemicals, peptides, and recombinant proteins | |||
| 100% Methanol | VWR | 101443-718 | Can be substituted with similar products |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 28908 | Can be substituted with similar products |
| Accutase | Thermo Fisher Scientific | A1110501 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| B27 supplement | Thermo Fischer Scientific | 17504044 | |
| bFGF | R&D Systems | 233-FB-025 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Collagen, Type I solution from rat tail | Sigma-Aldrich | C3867-1VL | Can be substituted with similar products |
| DMEM/Ham’s F12 | Thermo Fisher Scientific | 11320033 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Essential 6 medium | Thermo Fisher Scientific | A1516401 | |
| Fetal bovine serum (FBS) | Peak Serum | PS-FB1 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Fibronectin human protein, plasma | ThermoFisher Scientific | 33016015 | Can be substituted with similar products |
| hESFM | Thermo Fisher Scientific | 11111044 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | 861502 | |
| Normal goat serum | Thermo Fisher Scientific | 500627 | Can be substituted with similar products |
| PBS without calcium, magnesium | Cytiva | SH30256.01 | Can be substituted with similar products |
| Pericyte Medium | ScienCell | 1201 | Use complete kit (includes supplements) |
| Poly-L-Lysine, 10 mg/mL | ScienCell | 0413 | |
| Triton X-100 | JT Baker | X198-05 | Can be substituted with similar products |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen™ | 10977015 | Can be substituted with similar products |
| Experimental models: Cell lines | |||
| Blood-brain barrier hCMEC/D3 cell line | Sigma-Aldrich | SCC066 | |
| Human brain vascular pericytes | ScienCell | 1200 | |
| iPS(IMR90)-4 human induced pluripotent stem cells | WiCell | RRID:CVCL_C437 | |
| Glassware and Plasticware | |||
| 150 mm TC-treated Cell Culture Dish with 20 mm Grid | Falcon | 353025 | |
| Clamps | VWR | MFLX06832-10 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Flat 96-well non-binding microplates | Greiner Bio-One | 655900 | |
| Microscope Slide Device Holder | SiMPore | USIM-SB | Dimensions compatible with micropscope slide holders |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339653 | Tube caps can be filled with water for cell culture |
| P20-200 pipette tips | VWR | 76322-516 | Alternate brands may not seal as effectively into ports |
| Transwell filters (12 well, 12 mm, 0.4 μm pore size, PC) | CoStar | 3401 | |
| Instruments | |||
| 10X Objective (For Andor) | Nikon Instruments Inc. | MRD00105 | Air; WD: 4 mm; NA 0.45 |
| 10X Objective (For Nikon) | Nikon Instruments Inc. | MRP40102 | Air; WD: 6.2 mm; NA 0.25 |
| 40X Objective (LWD) (For Andor) | Nikon Instruments Inc. | MRD77410 | Water immersion; WD: 590-610 mm; NA 1.15 |
| Andor Spinning Disc Confocal microscope | Oxford Instruments, Andor | ||
| Nikon Eclipse Ts2 Phase Contrast Microscope | Nikon Instruments Inc. | Can be substituted with similar products | |
| TECAN Infinite M200 | TECAN | Can be substituted with similar products | |
| Other | |||
| Advanced PAP Pen | Millipore Sigma | Z672548 | 2 mm tip is recommended |
| Assembly kit with fixtures | SiMPore | USIM-JIGSET | Including fixure A1, A2, B1, and B2 |
| Camera Adapter for Microscopes | AmScope | CA-CAN-SLR Canon SLR / D-SLR | Φ23.2 - Φ30 adapter fits Nikon Eclipse Ts2 |
| Canon EOS Rebel SL3 DSLR Camera | Canon | EOS 250D, BH #CAEDRSL3B, MFR #3453C001 | Can be substituted with similar products |
| Cell strainer, 40 µm | Millipore Sigma (Corning) | CLS431750 | |
| Component 1 | SiMPore | USIM-C1 | |
| Component 2 | SiMPore | USIM-C2 | |
| Membrane chips | SiMPore | NPSN100-1L | Other chips formats are available |
| SMD handling tweezer double angle | Techni-Tool | 758TW003 | "Chip Tweezers" |
| Stainless steel precision type GG tweezer | Techni-Tool | 758TW534 | "Straight Tweezers" |
| Software | |||
| Fiji | ImageJ | For image processing | |
| Fusion | Oxford Instruments, Andor | Instructions for version 2.3.0.44 | |
| i-control | TECAN | Instructions for version 2.0 | |
| Imaris | Oxford Instruments | For image processing. Instructions for version 9.9.0 |
参考文献
- Villabona-Rueda, A., Erice, C., Pardo, C. A., Stins, M. F. The evolving concept of the blood brain barrier (BBB): from a single static barrier to a heterogeneous and dynamic relay center. Frontiers in Cellular Neuroscience. 13, 405 (2019).
- Nation, D. A., et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature Medicine. 25 (2), 270-276 (2019).
- Ferrari, C. C., Tarelli, R. Parkinson's disease and systemic inflammation. Parkinsons Disease. 116 (3), 436813 (2011).
- Koch, E. V., Ledwig, V., Bendas, S., Reichl, S., Dietzel, A. Tissue barrier-on-chip: a technology for reproducible practice in drug testing. Pharmaceutics. 14 (7), 1451 (2022).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
- Ortiz, G. G., et al. Role of the blood-brain barrier in multiple sclerosis. Archives of Medical Research. 45 (8), 687-697 (2014).
- Orhun, G., et al. Association between inflammatory markers and cognitive outcome in patients with acute brain dysfunction due to sepsis. Archives of Neuropsychiatry. 56 (1), 63-70 (2019).
- Chen, Y., Yang, W., Chen, F., Cui, L. COVID-19 and cognitive impairment: neuroinvasive and blood-brain barrier dysfunction. Journal of Neuroinflammation. 19 (1), 222 (2022).
- Hughes, C. G., et al. Endothelial activation and blood-brain barrier injury as risk factors for delirium in critically ill patients. Critical Care Medicine. 44 (9), e809-e817 (2016).
- Saraiva, C., et al. Nanoparticle-mediated brain drug delivery: Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of Control Release. 235 (10), 34-47 (2016).
- Jolliet-Riant, P., Tillement, J. P. Drug transfer across the blood-brain barrier and improvement of brain delivery. Fundamental & Clinical Pharmacology. 13 (1), 16-26 (1999).
- Abbott, N. J., et al. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2009).
- Siflinger-Birnboim, A., et al. Molecular sieving characteristics of the cultured endothelial monolayer. Journal of Cellular Physiology. 132 (1), 111-117 (1987).
- Bischoff, I., et al. Pitfalls in assessing microvascular endothelial barrier function: impedance-based devices versus the classic macromolecular tracer assay. Scientific Reports. 6, 23671 (2016).
- van der Helm, M. W., van der Meer, A. D., Eijkel, J. C., van den Berg, A., Segerink, L. I. Microfluidic organ-on-chip technology for blood-brain barrier research. Tissue Barriers. 4 (1), e1142493 (2016).
- Osaki, T., Shin, Y., Sivathanu, V., Campisi, M., Kamm, R. D. In vitro microfluidic models for neurodegenerative disorders. Advanced Healthcare Materials. 7 (2), (2018).
- Girard, S. D., et al. High and low permeability of human pluripotent stem cell-derived blood-brain barrier models depend on epithelial or endothelial features. FASEB Journal. 37 (2), e22770 (2023).
- Vigh, J. P., et al. Transendothelial electrical resistance measurement across the blood-brain barrier: a critical review of methods. Micromachines. 12 (6), 685 (2021).
- Lea, T., et al., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bioactives on Health: in vitro and ex vivo models. , (2015).
- Felix, K., Tobias, S., Jan, H., Nicolas, S., Michael, M. Measurements of transepithelial electrical resistance (TEER) are affected by junctional length in immature epithelial monolayers. Histochemistry and Cell Biology. 156 (6), 609-616 (2021).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Mossu, A., et al. A silicon nanomembrane platform for the visualization of immune cell trafficking across the human blood-brain barrier under flow. Journal of Cerebral Blood Flow and Metabolism. 39 (3), 395-410 (2019).
- Castro Dias, M., et al. Brain endothelial tricellular junctions as novel sites for T-cell diapedesis across the blood-brain barrier. Journal of Cell Science. 134 (8), jcs253880 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Khire, T. S., et al. Microvascular mimetics for the study of lukocyte-endothelial interactions. Cellular and Molecular Bioengineering. 13 (2), 125-139 (2020).
- Salminen, A. T., et al. Endothelial cell apicobasal polarity coordinates distinct responses to luminally versus abluminally delivered TNF-alpha in a microvascular mimetic. Integrative Biology: Quantitative Biosciences from Nano to Macro. 12 (11), 275-289 (2020).
- DesOrmeaux, J. P. S., et al. Nanoporous silicon nitride membranes fabricated from porous nanocrystalline silicon templates. Nanoscale. 6 (18), 10798-10805 (2014).
- Hill, K., et al. Second generation nanoporous silicon nitride membranes for high toxin clearance and small format hemodialysis. Advanced Healthcare Materials. 9 (4), e1900750 (2020).
- Salminen, A. T., et al. Ultrathin dual-scale nano- and microporous membranes for vascular transmigration models. Small. 15 (6), e1804111 (2019).
- Gillmer, S. R., et al. Predicting the failure of ultrathin porous membranes in bulge tests. Thin Solid Films. 631, 152-160 (2017).
- Ishimatsu, R., et al. Ion-selective permeability of ultrathin nanopore silicon membrane as studied using nanofabricated micropipet probes. Analytical Chemistry. 82 (17), 7127-7134 (2010).
- Kim, E., et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. Journal of American Chemical Society. 130 (13), 4230-4231 (2008).
- Snyder, J. L., et al. An experimental and theoretical analysis of molecular separations by diffusion through ultrathin nanoporous membranes. Journal of Membrane Science. 369 (1-2), 119-129 (2011).
- McCloskey, M. C., et al. The modular µSiM: a mass produced, rapidly assembled, and reconfigurable platform for the study of barrier tissue models in vitro. Advanced Healthcare Materials. 11 (18), e2200804 (2022).
- Mansouri, M., et al. The modular microSiM reconfigured: integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. 11 (21), e2200802 (2022).
- Su, S. -. H., et al. A tissue chip with integrated digital immunosensors: In situ brain endothelial barrier cytokine secretion monitoring. Biosensors and Bioelectronics. 224, 115030 (2023).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Gastfriend, B. D., Stebbins, M. J., Du, F., Shusta, E. V., Palecek, S. P. Differentiation of brain pericyte-like cells from human pluripotent stem cell-derived neural crest. Current Protocols. 1 (1), e21 (2021).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. FASEB Journal. 34 (12), 16693-16715 (2020).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- Bechmann, I., Galea, I., Perry, V. H. What is the blood-brain barrier (not). Trends in Immunology. 28 (1), 5-11 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。