Method Article
Utilizzo della piattaforma tissutale barriera MicroSiM (μSiM) per la modellazione della barriera emato-encefalica
In questo articolo
Riepilogo
Questo rapporto fornisce protocolli per l'assemblaggio, la coltura cellulare e i saggi sulla piattaforma μSiM per la costruzione di modelli di barriera emato-encefalica.
Abstract
Il microSiM (μSiM) è una piattaforma di coltura basata su membrana per la modellazione della barriera emato-encefalica (BBB). A differenza delle piattaforme convenzionali basate su membrana, μSiM offre agli sperimentatori nuove capacità, tra cui l'imaging di cellule vive, la segnalazione paracrina senza ostacoli tra le camere "sangue" e "cervello" e la capacità di visualizzare direttamente l'immunofluorescenza senza la necessità di estrarre/rimontare le membrane. Qui dimostriamo l'uso di base della piattaforma per stabilire modelli di monocoltura (cellule endoteliali) e co-coltura (cellule endoteliali e periciti) della BBB utilizzando membrane nanoporose ultrasottili di nitruro di silicio. Dimostriamo la compatibilità sia con colture cellulari primarie che con colture di cellule staminali pluripotenti indotte umane (hiPSC). Forniamo metodi per l'analisi qualitativa di modelli di BBB tramite colorazione in immunofluorescenza e dimostriamo l'uso del μSiM per la valutazione quantitativa della funzione di barriera in un saggio di permeabilità a piccole molecole. I metodi forniti dovrebbero consentire agli utenti di stabilire i loro modelli di barriera sulla piattaforma, promuovendo l'uso della tecnologia dei chip tissutali per lo studio dei tessuti umani.
Introduzione
I tessuti viventi sono compartimentati da cellule specializzate che creano e mantengono barriere e regolano quali cellule e molecole vengono trasportate da un compartimento all'altro. L'impropria regolazione delle funzioni di barriera può essere la fonte sia di malattie acute che di malattie croniche. La barriera emato-encefalica (BBB) è la barriera tissutale più restrittiva del corpo umano1. La disfunzione della BBB è alla base di un'ampia gamma di malattie del sistema nervoso centrale (SNC), tra cui il morbo di Alzheimer2, il morbo di Parkinson3,4 e la sclerosi multipla 5,6. La lesione della BBB è anche legata al deterioramento cognitivo a lungo termine come risultato di disturbi acuti, come la sepsi7, il COVID-198 e il delirio postoperatorio9. Lo sviluppo di farmaci con il potenziale per il trattamento dei disturbi cerebrali è stato frustrantemente difficile a causa della sfida di violare intenzionalmente la BBB per fornire molecole bioattive ai bersagli nel cervello10. Per questi motivi, i metodi per studiare la funzione della BBB in vitro sono di fondamentale importanza per la comprensione e il trattamento delle malattie del SNC.
I metodi di base per misurare la funzione di barriera in vitro prevedono la creazione di un monostrato o di una co-coltura su una membrana semipermeabile e la misurazione della resistenza impartita dalle cellule alla diffusione di piccole molecole o a piccole correnti elettriche11,12,13,14. Mentre l'emergere dei sistemi microfisiologici (MPS) ha prodotto un'abbondanza di scelte per modellare la BBB in 3D15,16, la diversità delle geometrie del sistema rende difficile confrontare le misurazioni di permeabilità tra MPS o con i valori stabiliti in letteratura. La definizione di valori basali affidabili è particolarmente importante nella ricerca sulla BBB dove, a causa dell'ampia regolazione della barriera da parte delle cellule endoteliali vascolari cerebrali, i valori di permeabilità in vitro sono altamente esaminati12,17,18. Per questi motivi, le misurazioni della permeabilità attraverso i monostrati stabiliti su membrane 2D rimarranno un punto fermo negli studi sulla BBB per gli anni a venire. Ciò vale per altre barriere tissutali, comprese le barriere epiteliali, in cui i valori assoluti di permeabilità basale vengono utilizzati per convalidare e confrontare i modelli in vitro 19,20,21.
Con l'obiettivo di creare un nuovo strumento prezioso per la comunità di ricerca sulla BBB, negli ultimi 5 anni abbiamo introdotto 22 eavanzato 23,24,25,26 il microdispositivo dotato di una piattaforma di embrane di licon membrane (μSiM) per l'uso nella modellazione dei tessuti di barriera. La caratteristica abilitante della piattaforma è una membrana ultrasottile (<100 nm di spessore) con centinaia di milioni di nanopori 27,28 o una miscela di nanopori e micropori29. I chip a membrana autoportanti sono prodotti su un "chip" di silicio da 300 μm che stabilizza le strutture ultrasottili30 e consente loro di essere maneggiate con pinzette per l'assemblaggio del dispositivo. A causa della loro natura ultrasottile, le membrane hanno una permeabilità di due ordini di grandezza superiore a quella delle membrane convenzionali incise su traccia utilizzate nei dispositivi commerciali di coltura a membrana31,32. In pratica, ciò significa che l'ostacolo della membrana alla diffusione di molecole più piccole dei nanopori (<60 nm) è trascurabile33. Pertanto, per le barriere cellulari, solo le cellule e le matrici che depositano determineranno la velocità di trasporto di piccole molecole dai compartimenti apicali a quelli basali che sono separati dalla membrana34. Il design del dispositivo e la natura ultrasottile delle membrane offrono anche molti vantaggi per la microscopia ottica. Questi includono 1) la capacità di seguire colture vive utilizzando il contrasto di fase o l'imaging in campo chiaro, 2) la capacità di colorare e visualizzare immagini fluorescenti in situ senza la necessità di estrarre e trasferire la membrana in un vetro di copertura e 3) il fatto che le membrane sono più sottili delle "fette" confocali in modo che le co-colture dirette abbiano una spaziatura più naturale tra i tipi di cellule rispetto a quella che può essere ottenuta con membrane incise in traccia spesse 6-10 μm.
Più recentemente, abbiamo avanzato la piattaforma a un formato modulare per facilitare l'assemblaggio rapido34 e la personalizzazione35,36. Abbiamo sfruttato il formato modulare per distribuire i componenti del dispositivo tra i nostri laboratori di bioingegneria e i laboratori di barriera cerebrale che collaborano. Abbiamo quindi sviluppato congiuntamente protocolli per l'assemblaggio del dispositivo, la monocoltura e la co-coltura, la colorazione immunofluorescente e la permeabilità a piccole molecole e abbiamo dimostrato che questi metodi erano riproducibili tra i laboratori. Utilizzando questi protocolli, abbiamo anche dimostrato che la piattaforma modulare supporta una BBB convalidata sviluppata utilizzando il metodo di coltura endoteliale estesa (EECM) per la creazione di cellule endoteliali simili a microvascolari cerebrali (BMEC) da cellule staminali pluripotenti indotte umane (hiPSCs)37. Lo scopo del presente rapporto è quello di esaminare questi metodi in modo più dettagliato e, con l'aiuto del video di accompagnamento, facilitare una più ampia adozione della piattaforma nella comunità BBB.
Protocollo
1. Assemblaggio del dispositivo μSiM
NOTA: Questo metodo descrive l'assemblaggio dei dispositivi. Il chip a membrana ha un lato della trincea e un lato piatto, che possono essere assemblati in trincea verso l'alto o verso il basso. I dispositivi trench-down sono più comunemente usati per la coltura cellulare.
- In un ambiente sterile (ad esempio, una cappa di biosicurezza), preparare tutti i materiali per l'assemblaggio, compresi i dispositivi di montaggio, i componenti, i trucioli di membrana e le pinzette.
- Posizionare il chip della membrana al centro dell'attrezzatura A1 utilizzando una pinzetta per trucioli. La superficie piana del chip è rivolta verso il basso e l'area della trincea è rivolta verso l'alto per i dispositivi di trincea verso il basso e viceversa per i dispositivi di trincea verso l'alto.
NOTA: Le seguenti fasi di assemblaggio sono illustrate utilizzando come esempio il dispositivo di scavo verso il basso, che consente un'area di crescita piatta nella camera superiore. - Incollare il componente 1 al chip. Per prima cosa, staccare gli strati protettivi blu su entrambi i lati del componente 1 utilizzando una pinzetta diritta e posizionarlo nell'apparecchio A1, con la camera superiore rivolta verso il basso. Premere delicatamente il componente 1 verso il basso fino a quando l'adesivo sensibile alla pressione (PSA) non tocca il chip.
- Posizionare l'attrezzatura A2 sull'attrezzatura A1 e applicare una pressione decisa su angoli diversi per garantire una perfetta aderenza del truciolo e del componente.
NOTA: Assicurarsi di non rimuovere lo strato PSA. È uno strato trasparente e più rigido rispetto agli strati protettivi blu. - Incollare il componente 2 al componente 1 con il chip. Per prima cosa, prepara il componente 2 afferrando un angolo del componente 2 con una pinzetta dritta e staccandolo dal foglio. Quindi, afferrare la regione "triangolare" non PSA del componente 2 e rimuovere insieme lo spesso strato protettivo trasparente e lo strato blu del componente 2, esponendo la superficie PSA. Posizionare il componente 2 nell'attacco B1, con il PSA rivolto verso l'alto.
- Posizionare il componente 1 con il truciolo della membrana nel dispositivo B1, con la camera superiore rivolta verso l'alto.
- Posizionare l'apparecchio B2 sul componente 1 e applicare una pressione decisa su diversi angoli dell'apparecchio B2.
- Estrarre il dispositivo assemblato dall'apparecchio e utilizzare una pinzetta diritta per premere eventuali bolle d'aria sul lato inferiore del dispositivo e sigillare i bordi del canale, evitando il contatto con la regione della membrana. Prima dell'uso per la coltura cellulare, sterilizzare i dispositivi appena assemblati a raggi ultravioletti (UV) per 20 minuti.
2. Colture cellulari
NOTA: questo metodo descrive i protocolli per le colture primarie e derivate da hiPSC sulla piattaforma. I metodi descrivono la monocoltura di cellule endoteliali nella camera superiore del dispositivo e la co-coltura di periciti e cellule endoteliali con periciti nella camera inferiore e cellule endoteliali nella camera superiore di dispositivi assemblati a trincea. Per le dimensioni e i volumi della camera, vedere la Tabella 1. Questi sono i formati più comuni; Tuttavia, è possibile utilizzare altri layout di coltura cellulare a seconda delle esigenze dell'utente.
- Preparazione della camera di coltura cellulare
- Assemblare i dispositivi secondo il protocollo descritto nella sezione 1.
- Collocare i dispositivi in fascette stringitubo sterili. Prima della coltura cellulare, sterilizzare le pinze immergendole in etanolo per ≥20 minuti. Risterilizzare dopo ogni esperimento per il riutilizzo.
- Coltivare i dispositivi in una grande capsula di Petri sterile. Per una maggiore umidità, aggiungere una piccola capsula di Petri o il coperchio della provetta conica da 50 ml riempito con acqua sterile.
- Lavare due volte la camera superiore dei dispositivi con 100 μL di acqua sterile. Per la coltura cellulare della camera inferiore, lavare la camera inferiore con 20 μL di acqua sterile.
- Monocoltura di linea cellulare hCMEC/D3 (BBB)
- Preparare la camera di coltura cellulare secondo il paragrafo 2.1.
- Rivestire le camere superiori con 25 μg/cm 2 di collagene I e 5 μg/cm2 di fibronectina umana mescolati in soluzione salina tamponata con fosfato (PBS). Lasciare riposare per 1-2 ore a 37 °C o per una notte a 4 °C.
- Rimuovere la soluzione di rivestimento e aggiungere 100 μL di terreno endoteliale preriscaldato impoverito di fattore di crescita (Terreno di saggio) nella camera superiore e 20 μL nella camera inferiore. Per preparare il terreno di saggio, miscelare 100 mL di terreno basale endoteliale + 400 μL di fattore di crescita fibroblastico umano + 40 μL di idrocortisone + 100 μL di gentamicina solfato + 2 mL di siero fetale bovino.
- Passaggio celle hCMEC/D3 secondo il protocollo del produttore; tripsinizzare le cellule in un incubatore a 37 °C per 3-5 minuti e poi interrompere la tripsinizzazione con l'aggiunta di mezzo endoteliale preriscaldato. Trasferire la sospensione cellulare in una provetta da centrifuga e centrifugare a 200 × g per 5 minuti a temperatura ambiente. Risospendere il pellet cellulare nei terreni di saggio e seminare le cellule nelle camere superiori a una densità di 40.000-60.000 cellule/cm2. Incubare i dispositivi a 37 °C con il 5% di anidride carbonica (CO 2 ) per2-4 ore per facilitare l'adesione cellulare. Ad esempio, per ottenere 40.000 cellule/cm2 sul chip da 0,37 cm2 , aggiungere 100 μL di una soluzione cellulare con una concentrazione di 150.000 cellule/mL alla camera superiore.
NOTA: Colcoliamo e passiamo hCMEC/D3 secondo Hudecz et al.38, utilizzando una formulazione modificata di terreno di crescita endoteliale-2 (EGM-2) per il mantenimento cellulare e un "terreno di saggio" ridotto con fattore di crescita dopo la subcoltura per i saggi. Altre formulazioni di terreni dovrebbero essere compatibili con i dispositivi, anche se consigliamo le formulazioni di terreni di Hudecz et al.38 se gli utenti riscontrano problemi di sopravvivenza di hCMEC/D3. - Dopo 2-4 ore per l'adesione cellulare, sostituire con terreno di saggio fresco in entrambe le camere per rimuovere le cellule morte o non attaccate.
- Mantenere i dispositivi a 37 °C con il 5% di CO 2 , scambiando il terreno di saggio in entrambe le camere ogni2-3 giorni fino alla sperimentazione. I saggi vengono in genere eseguiti dopo 2 settimane di coltura.
- Monocoltura di cellule simili a EECM-BMEC derivate da hiPSC
- Preparare la camera di coltura cellulare secondo il paragrafo 2.1.
- Preparare il collagene EV dalla soluzione di placenta umana aggiungendo 5 mL di acido acetico 0,5 mg/mL a 5 mg di collagene EV per creare una soluzione da 1 mg/mL. Lasciare riposare la soluzione per ≥4 ore a 4 °C per ricostituirsi completamente. La soluzione è stabile a 4 °C per 2 settimane.
- Rivestire le camere superiori con 100 μL di un rapporto 4:1:5 di collagene IV, fibronectina bovina e acqua sterile. Lasciare in posa a 37 °C per 2-4 h.
- Rimuovere la soluzione di rivestimento e aggiungere 100 μL di hECSR a temperatura ambiente nella camera superiore e 20 μL nella camera inferiore.
- Passaggio di cellule simili a EECM-BMEC secondo Nishihara et al.37; aggiungere una miscela di enzimi di distacco cellulare alle cellule e trasferire in un incubatore a 37 °C per 5-8 minuti. Pipettare la soluzione cellulare per singolarizzare e aggiungere a 4 volte il volume del mezzo endoteliale in una provetta da centrifuga. Centrifugare a 200 × g per 5 min a temperatura ambiente; risospendere le cellule in hECSR e seminare nelle camere superiori ad una densità di 40.000 cellule/cm2. Incubare i dispositivi a 37 °C con il 5% di CO 2 per2-4 ore per facilitare l'adesione cellulare. Ad esempio, per ottenere 40.000 cellule/cm2, aggiungere 100 μL di una soluzione cellulare a 150.000 cellule/mL.
- Dopo 2-4 ore per l'adesione cellulare, scambiare con hECSR fresco in entrambe le camere per rimuovere le cellule morte o non attaccate.
- Mantenere i dispositivi a 37 °C con il 5% di CO 2 , scambiando hECSR in entrambe le camere ogni1-2 giorni fino alla sperimentazione. I test vengono in genere eseguiti il 6° giorno di coltura.
- hCMEC/D3 e co-coltura primaria di periciti vascolari cerebrali umani (HBVP)
- Prima dell'assemblaggio del dispositivo, rivestire i chip della membrana con 2 μg/cm2 di poli-L-lisina (PLL) miscelata in PBS. Applicare 50-80 μL di PLL in una gocciolina solo sul lato che sarà rivolto verso il basso nell'assemblaggio finale del dispositivo. Completare il processo di rivestimento in 1-2 ore a 37 °C o durante la notte a 4 °C.
- Rimuovere la soluzione di rivestimento. Lavare i trucioli di membrana con acqua sterile ultrapura e lasciarli asciugare.
- Assemblare i dispositivi secondo il protocollo descritto nella sezione 1 sopra, con il lato rivestito in PLL rivolto verso il basso e preparare la camera di coltura cellulare secondo la sezione 2.1.
- Rivestire le camere superiori secondo il punto 2.2.2.
- Aggiungere 50 μL di terreno pericitistico preriscaldato alle camere superiori e aggiungere 20 μL ai canali inferiori.
- Passaggio HBVP secondo il protocollo del produttore; tripsinizzare le cellule in un incubatore a 37 °C per 3-5 minuti, quindi interrompere la tripsinizzazione con l'aggiunta di terreno pericitario preriscaldato. Trasferire la sospensione cellulare in una provetta da centrifuga e centrifugare a 200 × g per 5 minuti a temperatura ambiente. Risospendere il pellet cellulare nel terreno pericitario e seminare le cellule nelle camere inferiori a una densità di 14.000-25.000 cellule/cm2. Invertire i dispositivi ma mantenere un'interfaccia d'aria con le camere superiori per facilitare lo scambio di gas.
NOTA: L'interfaccia dell'aria richiesta durante l'inversione può essere ottenuta capovolgendo i dispositivi dopo averli posizionati all'interno di fascette stringitubo e spingendo verso il basso su tutti gli angoli prima del capovolgimento, oppure posizionando i dispositivi capovolti su strisce parallele di acrilico o silicone sufficientemente distanziate tra loro per mantenere libere le camere superiori. Potrebbe essere necessario ottimizzare la densità di semina per ogni utente. Per ottenere 14.000 cellule/cm2, aggiungere 20 μL di una sospensione cellulare a ~590.000 cellule/mL. Si noti che 20 μL vengono pipettati nella camera inferiore per evitare bolle, ma la densità viene calcolata utilizzando il volume della camera inferiore di 10 μL. - Incubare le cellule a 37 °C con il 5% di CO 2 per2-4 ore in posizione invertita per facilitare l'adesione cellulare.
- Dopo 2-4 ore per l'adesione cellulare, capovolgere i dispositivi in posizione verticale e sostituirli con terreno pericitario fresco in entrambe le camere per rimuovere le cellule morte o non attaccate.
- Dopo la semina dei periciti, seminare hCMEC/D3s nella camera superiore, seguendo i passaggi 2.2.4-2.2.5. Commutare entrambe le camere sul mezzo di saggio.
- Mantenere i dispositivi a 37 °C con il 5% di CO 2 , scambiando il terreno di saggio in entrambe le camere ogni1-2 giorni fino alla sperimentazione. La co-coltura di cellule primarie viene solitamente mantenuta per 6-8 giorni prima dei saggi.
NOTA: Se le monocolture di HBVP vengono confrontate con le monocolture hCMEC/D3 o con le cocolture di hCMEC/D3 e HBVP, sostituire il terreno pericitario con il terreno di saggio 2-3 giorni dopo la semina delle HBVP.
- Co-coltura di cellule simili a EECM-BMEC derivate da hiPSC e cellule simili ai periciti cerebrali (BPLC)
- Preparare la camera di coltura cellulare secondo il punto 2.1 e rivestire le camere superiori secondo i passaggi 2.3.2-2.3.3.
- Rimuovere la soluzione di rivestimento e aggiungere 50 μL di Essential 6 Medium + 10% Siero Fetale Bovino a temperatura ambiente (E6 + 10% FBS) nella camera superiore.
- Passaggio dei BPLC secondo Gastfriend et al.39; aggiungere una miscela di enzimi di distacco cellulare alle cellule e trasferire in un incubatore a 37 °C per 5-15 minuti, fino a quando ~90% delle cellule non sono arrotondate. Pipettare la soluzione cellulare per singolarizzare e aggiungere 4 volte il volume di DMEM/F12 in una provetta da centrifuga da 50 mL, utilizzando un colino cellulare da 40 μm per filtrare e singolarizzare completamente le cellule. Trasferire in una provetta da centrifuga da 15 mL, centrifugare a 200 × g per 5 minuti a temperatura ambiente, risospendere il pellet cellulare in E6 + 10% FBS e seminare le cellule nelle camere inferiori a una densità di 14.000-25.000 cellule/cm2. Invertire i dispositivi ma mantenere un'interfaccia d'aria con la camera superiore per facilitare lo scambio di gas.
NOTA: L'interfaccia dell'aria richiesta durante l'inversione può essere ottenuta capovolgendo i dispositivi dopo averli posizionati all'interno del tubo clamps e spingendo verso il basso su tutti gli angoli prima del capovolgimento, oppure posizionando i dispositivi capovolti su strisce parallele di acrilico o silicone sufficientemente distanziate tra loro per mantenere le camere superiori libere. Potrebbe essere necessario ottimizzare la densità di semina per ogni utente. Per ottenere 14.000 cellule/cm2, aggiungere 20 μL di una sospensione cellulare a ~590.000 cellule/mL. Si noti che 20 μL vengono pipettati nella camera inferiore per evitare bolle, ma la densità viene calcolata utilizzando il volume della camera inferiore di 10 μL. - Incubare le cellule a 37 °C con il 5% di CO 2 per2-4 ore in posizione invertita per facilitare l'adesione cellulare.
- Dopo 2-4 ore per l'adesione delle cellule, capovolgere i dispositivi in posizione verticale e sostituirli con E6 fresco + FBS al 10% in entrambe le camere per rimuovere le cellule morte o non attaccate.
- Un giorno dopo la semina dei periciti, seminare cellule simili a EECM-BMEC nella camera superiore, seguendo i passaggi 2.3.5-2.3.6. Commutare entrambe le camere su hECSR.
- Mantenere i dispositivi a 37 °C con il 5% di CO 2 , scambiando il terreno di saggio in entrambe le camere ogni1-2 giorni fino alla sperimentazione. La co-coltura derivata da hiPSC viene solitamente mantenuta per 7 giorni per le BPLC e 6 giorni per le cellule simili a EECM-BMEC prima dei saggi.
NOTA: Se le monocolture BPLC vengono confrontate con le monocolture EECM-BMEC o con le cocolture EECM-BMEC e BPLC, scambiare E6 + 10% FBS con hECSR 1 giorno dopo la semina delle BPLC.
3. Immunocitochimica
NOTA: Questo metodo descrive un protocollo per la colorazione immunocitochimica e l'imaging di cellule coltivate nella parte superiore e/o inferiore della membrana. Lo scopo di questo esperimento è quello di determinare la presenza e la posizione di proteine chiave che dovrebbero essere trovate nella BBB, come le proteine aderenti e a giunzione stretta e le proteine dell'identità cellulare. Anche i metodi di colorazione alternativi e vivi sono compatibili con la piattaforma.
- Fissaggio e colorazione sui dispositivi
- Metti gli anticorpi primari sul ghiaccio per scongelarli.
- Preparare una soluzione di paraformaldeide (PFA) al 4% a temperatura ambiente (ad esempio, diluire il 16% di PFA in 3 volte il suo volume di PBS) o raffreddare il metanolo al 100% a -20 °C.
- Creare una soluzione di blocco appropriata in base alla Tabella 2. Conservare su ghiaccio.
NOTA: Potrebbe essere necessario vorticare la soluzione per sciogliere completamente Triton X-100. - Fissare le cellule pipettando 20 μL di fissativo (ad es. PFA o metanolo) nella camera inferiore e 50 μL nella camera superiore. Incubare i dispositivi per 10 minuti (PFA) o 2 minuti (metanolo) a temperatura ambiente.
- Lavare per 3 x 5 minuti pipettando 20 μL di PBS attraverso la camera inferiore e 100 μL nella camera superiore.
- Bloccare per 30 minuti a temperatura ambiente aggiungendo 20 μL di soluzione bloccante nella camera inferiore e 50 μL di soluzione bloccante nella camera superiore. Verificare la presenza di bolle nella camera inferiore.
- Preparare la soluzione di anticorpi primari diluendo gli anticorpi nella soluzione bloccante secondo la Tabella 2. Conservare su ghiaccio.
- Colorare con gli anticorpi primari aggiungendo 20 μL della soluzione anticorpale primaria alla camera inferiore e sostituendo il volume della camera superiore con 50 μL della soluzione anticorpale primaria. Verificare la presenza di bolle nella camera inferiore. Incubare per 1 ora a temperatura ambiente o per una notte a 4 °C.
- Lavare per 3 x 5 minuti pipettando 20 μL di PBS attraverso la camera inferiore e 100 μL nella camera superiore.
- Preparare la soluzione anticorpale secondaria diluendo il/i corpo/i nella soluzione bloccante secondo la Tabella 2. Conservare su ghiaccio al riparo dalla luce.
- Colorare con anticorpi secondari aggiungendo 20 μL di soluzione anticorpale secondaria alla camera inferiore e sostituendo il volume della camera superiore con 50 μL di soluzione anticorpale secondaria. Verificare la presenza di bolle nella camera inferiore. Incubare per 1 ora a temperatura ambiente al riparo dalla luce.
- Lavare per 3 x 5 minuti pipettando 20 μL di PBS attraverso la camera inferiore e 100 μL nella camera superiore.
- Crea una soluzione per la colorazione nucleare. Diluire Hoechst 1:10.000 in PBS. Aggiungere 20 μL di soluzione di colorante nucleare nella camera inferiore e sostituire il volume della camera superiore con 50 μL di soluzione di colorante nucleare. Verificare la presenza di bolle nella camera inferiore. Incubare per 3 minuti a temperatura ambiente al riparo dalla luce.
- Rimuovere la macchia aggiungendo 20 μL di PBS alla camera inferiore e sostituendo il volume della camera superiore con 100 μL di PBS. Fotografare immediatamente i dispositivi o conservarli a 4 °C con la capsula di Petri avvolta in parafilm e protetta dalla luce fino al momento dell'imaging.
- Imaging confocale
NOTA: Questa sezione descrive l'imaging dei dispositivi utilizzando un microscopio confocale a disco rotante invertito con un obiettivo 40x a lunga distanza di lavoro (LWD) (acqua, WD 590-610, apertura numerica 1,15) come esempio. Per le distanze di lavoro e la compatibilità dell'obiettivo, fare riferimento al materiale supplementare in McCloskey et al.34. Le immagini dell'intera area della membrana vengono inoltre acquisite utilizzando un obiettivo 10x per garantire che le immagini 40x siano rappresentative dell'intero campo. Di solito vengono scattate in campo largo.- Accendere il microscopio e aprire il software di imaging.
- Impostare i canali in base alle proprietà dell'anticorpo secondario e della colorazione nucleare, utilizzando la modalità di imaging confocale. Ottimizza la potenza del laser e il tempo di esposizione per garantire che il segnale sia al di sopra dello sfondo e riduca gli artefatti di imaging.
- Per la colorazione nucleare Hoechst, utilizzare l'eccitazione 405, emissione 450/50 Bandpass (BP), tempo di esposizione 500 ms, potenza laser 50%. Per le etichette che utilizzano un anticorpo secondario coniugato ad Alexa Fluor (AF) 488, utilizzare l'eccitazione 488, l'emissione 525/50BP, il tempo di esposizione di 500 ms e il 50% di potenza laser. Per le etichette che utilizzano un anticorpo secondario coniugato ad AF568, utilizzare l'eccitazione 561, l'emissione 600/50BP, il tempo di esposizione di 500 ms e la potenza laser del 100%.
- Posizionare il dispositivo nel supporto del dispositivo del vetrino del microscopio, con la camera superiore rivolta verso l'alto e posizionarlo nel microscopio utilizzando un supporto per vetrini per microscopio. Attiva Live e seleziona il canale per la colorazione nucleare. Trova la membrana usando un obiettivo basso, assicurandoti che la regione trasparente della membrana in nitruro di silicio sia centrata, poiché la luce non passerà attraverso la regione di silicone solido blu. Una volta che il dispositivo è centrato correttamente e lo strato cellulare è stato trovato, passare all'obiettivo 40x, bagnare l'obiettivo e concentrarsi sulla regione della membrana usando la colorazione nucleare come guida.
- Attivare l'imaging z-stack e impostare la modalità di scansione su Inizio/Fine. Imposta la dimensione o il conteggio dei passi. Utilizzando la manopola di regolazione grossolana del microscopio, impostare l'inizio della scansione sulla parte superiore dello strato di cellule endoteliali, utilizzando la colorazione nucleare come guida, e l'estremità della scansione nella parte inferiore dello strato di periciti, utilizzando la colorazione nucleare come guida. Controllare tutti i canali per assicurarsi che tutto venga catturato nel campo di imaging.
NOTA: Di solito utilizziamo il passo automatico, che è di ~0,2 μm di fette. - Impostare il nome dell'immagine e premere Acquisisci per avviare l'imaging. Ripetere l'operazione su regioni diverse in base alle esigenze.
- Elaborare le immagini confocali utilizzando ImageJ40 o Imaris.
- Per elaborare in Imaris, trascinare il file immagine nel programma per aprirlo. Selezionare Sezione nella barra dei menu in alto per visualizzare un'immagine 2D del piano x-y con le viste corrispondenti dei piani x-z e y-z. Seleziona Visualizzazione 3D nella barra dei menu in alto per visualizzare un'immagine 3D . Fare clic sull'immagine e trascinarla per ruotarla. Seleziona Istantanea nella barra dei menu in alto per scattare un'immagine.
4. Saggio di campionamento della permeabilità di piccole molecole
NOTA: Questa sezione descrive una metodologia per le misurazioni quantitative delle proprietà di barriera delle colture cellulari. Lo scopo di questo esperimento è quello di rilevare la concentrazione di una piccola molecola fluorescente che passa attraverso gli strati cellulari ed entra nella camera inferiore della piattaforma. Questi dati vengono poi utilizzati per calcolare la permeabilità cellulare.
- Tecnica di campionamento
- Assemblare i dispositivi secondo il protocollo descritto nella sezione 1 e coltivare le linee cellulari desiderate come descritto nella sezione 2. Includere un dispositivo aggiuntivo che funga da dispositivo di controllo rivestito e privo di cellule per misurare la permeabilità del sistema.
NOTA: Si consigliano almeno tre repliche tecniche per condizione; Tuttavia, è necessaria una sola replica del controllo rivestito. - Prima di iniziare il test di campionamento, sostituire il terreno nella camera inferiore con terreno fresco. Controllare al microscopio la confluenza del monostrato endoteliale in ciascun dispositivo. Notare eventuali spazi vuoti nei monostrati cellulari, in quanto ciò influirà sulla diffusione del colorante nella camera inferiore.
NOTA: Una coltura endoteliale sana dovrebbe essere confluente al 100%. - Preparare la soluzione fluorescente di piccole molecole (ad es. 150 μg/mL Lucifer Yellow, 457 Da) nel terreno di coltura cellulare. Preparare il volume in eccesso della soluzione fluorescente a piccole molecole da utilizzare per la preparazione delle soluzioni standard che fungono da riferimento per calcolare la concentrazione della piccola molecola fluorescente campionata dal canale inferiore.
NOTA: Si consiglia la preparazione di 400 μL di soluzione in eccesso da utilizzare come soluzione standard con la più alta concentrazione della piccola molecola fluorescente. - Sostituire il terreno nel pozzetto superiore con 100 μL di soluzione fluorescente a piccole molecole.
NOTA: Si consiglia di utilizzare una penna idrofobica per disegnare dei cerchi attorno alle porte di campionamento e attendere che l'inchiostro idrofobico si asciughi completamente prima di aggiungere la soluzione colorante fluorescente. In questo modo si evita la diffusione del fluido dal canale inferiore attorno alla porta di campionamento al punto 4.1.7. Si consiglia di scaglionare l'aggiunta della soluzione fluorescente a piccole molecole nel pozzetto superiore, attendere 2 minuti prima di aggiungere la soluzione fluorescente al dispositivo successivo, oppure lavorare in gruppi di 3 (aggiungere la soluzione in tre dispositivi contemporaneamente e attendere 5 minuti per aggiungere i tre dispositivi successivi). - Incubare i dispositivi a 37 °C, 5% CO2 per 1 ora.
- Durante l'incubazione di 1 ora nella fase precedente, preparare le soluzioni standard eseguendo diluizioni seriali di 2 volte dalla soluzione fluorescente a piccole molecole preparata nella fase 4.1.3. Pipettare 50 μL di ciascuna soluzione nella piastra nera a fondo piatto a 96 pozzetti in triplice copia. Utilizzare un terreno di coltura cellulare bianco come soluzione standard di base.
NOTA: Per preparare soluzioni standard, si consiglia di eseguire 11 diluizioni seriali a un volume finale di 200 μL e l'uso di terreno di coltura cellulare come bianco per misurare l'intensità della fluorescenza al basale.- Trasferire 200 μL di 400 μL della soluzione fluorescente in eccesso di piccole molecole preparata al punto 4.1.3 in una provetta contenente 200 μL di terreno, mescolare bene e trasferire 200 μL di questa soluzione nella provetta successiva contenente 200 μL di mezzo. Ripetere le diluizioni 1:2 fino ad ottenere un totale di 10 provette. Pipettare 50 μL della soluzione standard più concentrata nella colonna 1 in triplicati nella piastra a 96 pozzetti (B1, C1, D1), la secondasoluzione più concentrata nella colonna 2 (B2, C2, D2) e così via. Per la 12acolonna della piastra, pipettare 50 μL di terreno bianco in triplice copia (B12, C12, D12).
- Eseguire i seguenti passaggi per campionare la soluzione fluorescente di piccole molecole dal canale inferiore.
- Rimuovere la soluzione fluorescente di piccole molecole dal pozzetto per arrestare il processo di diffusione.
- Posizionare una punta contenente 50 μL di terreno nella porta superiore per fungere da serbatoio inserendo la punta con 50 μL nella porta, sollevando il dispositivo ed espellendo delicatamente la punta tenendola in alto per la stabilizzazione. Appoggiare il dispositivo. Assicurarsi che non vi siano bolle nel puntale della pipetta o aria sulla punta della pipetta per evitare di aggiungere bolle nella camera inferiore durante il campionamento.
- Aggiungere 50 μL di terreno nel pozzetto superiore per evitare l'interruzione del monostrato cellulare durante il campionamento.
- Per campionare la soluzione dal canale inferiore, spingere una pipetta con il puntale vuoto fino alla prima resistenza, inserire il puntale nella porta di campionamento e pipettare 50 μL di soluzione dal canale inferiore. Trasferire direttamente nella piastra nera a 96 pozzetti a fondo piatto contenente le soluzioni standard.
NOTA: Si consiglia di controllare il monostrato cellulare al microscopio subito dopo il campionamento. Il prelievo di terreni dal canale inferiore può occasionalmente causare l'interruzione dello strato cellulare nel pozzetto superiore, che potrebbe causare misurazioni di permeabilità incoerenti. Lavorare rapidamente durante i passaggi in 4.1.7 aiuterà a evitare questo problema.
- Misurare l'intensità della fluorescenza in un lettore di micropiastre utilizzando i parametri di lunghezza d'onda di eccitazione ed emissione appropriati per la piccola molecola fluorescente utilizzata. Per Lucifer Yellow, utilizzare un'eccitazione di 428 nm e un'emissione di 536 nm, con un guadagno ottimale. La fluorescenza viene misurata dalla parte superiore della piastra. Aggiungere la piastra nel lettore di piastre, evidenziare i pozzetti con il campione (inclusa la curva standard) e selezionare Avvia per leggere la piastra.
- Assemblare i dispositivi secondo il protocollo descritto nella sezione 1 e coltivare le linee cellulari desiderate come descritto nella sezione 2. Includere un dispositivo aggiuntivo che funga da dispositivo di controllo rivestito e privo di cellule per misurare la permeabilità del sistema.
- Calcolo del valore di permeabilità (vedi Scheda supplementare 1 per il modello)
- Sottrarre il valore medio dell'intensità di fluorescenza del mezzo bianco da tutti i valori di intensità di fluorescenza misurati.
- Utilizzare l'equazione (1) per calcolare la permeabilità del sistema Ps:
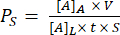 (1)
(1)
Dove [A]A è la concentrazione della piccola molecola fluorescente raccolta dal canale inferiore, V è il volume campionato e aggiunto alla piastra (0,050 mL), [A]L è la concentrazione della piccola molecola fluorescente aggiunta nel pozzetto superiore (ad esempio 0,15 mg/mL), t è il tempo di incubazione (in s o min a seconda delle unità desiderate), e S è la superficie della membrana (0,014 cm2).- Calcolare [A]A utilizzando l'equazione ottenuta tracciando una curva standard dalle uscite dell'intensità di fluorescenza e dalle concentrazioni note delle soluzioni standard. Calcolare le concentrazioni (x) dei campioni sperimentali inserendo i loro valori di intensità di fluorescenza (y) nell'equazione.
NOTA: Utilizzare la parte della curva standard lineare. Si consiglia di misurare l'area della superficie della membrana da un'immagine della membrana scattata al microscopio, poiché l'area della membrana potrebbe variare a seconda del numero di lotto e potrebbe influenzare in modo significativo i valori di permeabilità calcolati se differiscono dal controllo rivestito.
- Calcolare [A]A utilizzando l'equazione ottenuta tracciando una curva standard dalle uscite dell'intensità di fluorescenza e dalle concentrazioni note delle soluzioni standard. Calcolare le concentrazioni (x) dei campioni sperimentali inserendo i loro valori di intensità di fluorescenza (y) nell'equazione.
- Utilizzare l'equazione (2) per calcolare la permeabilità del monostrato cellulare Pe:
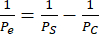 (2)
(2)
Dove PS è la permeabilità del sistema calcolata al punto 4.2.2 e PC è il valore di permeabilità del sistema del dispositivo di controllo rivestito e privo di celle.
Risultati
L'assemblaggio di un dispositivo di scavo è mostrato nella Figura 1. I dispositivi guidano l'assemblaggio dei componenti e del chip a membrana. Il componente 1 è principalmente acrilico con una superficie PSA per l'incollaggio al chip e un'apertura per la camera inferiore e porte per l'accesso della pipetta alla camera inferiore. Il componente 2 è lo strato del canale e contiene un "triangolo" non adesivo e privo di PSA in alto a destra per la presa. I dispositivi trench-down forniscono un'area piatta per la crescita della coltura cellulare nella camera superiore, mentre i dispositivi trench-up hanno una superficie piana per la coltura cellulare nella camera inferiore.
Sono state eseguite monocolture endoteliali e co-colture di hCMEC/D3 e HBVPs e di cellule EECM-BMEC-like derivate da hiPSC IMR90-4 e BPLC e abbiamo acquisito immagini di fase utilizzando un microscopio a contrasto di fase Nikon Eclipse Ts2 e un obiettivo 10x (Figura 2). Vengono mostrate le densità di semina ottimali per la coltura cellulare primaria (immagini scattate 1 giorno dopo la semina), nonché gli HBVP sottoseminati (Figura 2A). Le immagini finali della fase di cocoltura e monocoltura (coltura di cellule endoteliali a 6 giorni) possono essere difficili da distinguere (Figura 2C) e la conferma del successo della co-coltura di cellule primarie può richiedere la colorazione in immunofluorescenza (vedere paragrafo 3 del protocollo). Vengono inoltre illustrate le densità di semina BPLC derivate da hiPSC basse, alte e ottimali (Figura 2B). La co-coltura derivata da hiPSC è più chiara da distinguere nell'imaging a contrasto di fase rispetto alle co-colture primarie (Figura 2D). Una bassa semina BPLC provoca una scarsa copertura dei periciti e l'aggregazione dei periciti, mentre la trasemina eccessiva provoca il distacco dello strato di periciti dalla membrana. Inoltre, lo scambio troppo rapido del mezzo nella camera inferiore può causare la perdita di periciti, poiché queste cellule sono molto sensibili al taglio. La copertura ottimale da parte dei periciti è ~90% per un modello BBB, senza lacune nello strato endoteliale.
Immagini rappresentative di co-colture derivate da hiPSC immunocolorate sono illustrate nella Figura 3 (coltura di cellule endoteliali a 6 giorni). I BPLC derivati da IMR90-4 sono stati colorati per il marcatore pericicitario PDGFRβ e le cellule simili a EECM-BMEC derivate da IMR90-4 sono state colorate per il marcatore di giunzione aderente VE-caderina. Hoechst è stato utilizzato per colorare i nuclei. Le immagini sono state acquisite su un microscopio confocale Spinning Disc utilizzando un obiettivo LWD 40x con fette da 0,2 μm ed elaborate con Imaris. Entrambi gli strati cellulari possono essere visualizzati anche se la sottile nanomembrana non è visibile.
Abbiamo eseguito il saggio di permeabilità a piccole molecole basato sul campionamento utilizzando le stesse condizioni sperimentali in due laboratori fisicamente distanti presso l'Università di Berna, in Svizzera, e l'Università di Rochester, NY, USA, per dimostrare la riproducibilità interlaboratorio dei risultati (Figura 4)34. Le cellule simili a EECM-BMEC derivate da hiPSC IMR90-4 sono state coltivate nel dispositivo μSiM per 2, 4 o 6 giorni e su filtri transwell per 6 giorni. Il test è stato eseguito utilizzando 150 μg/mL di giallo lucifero (457 Da) in entrambi i laboratori. L'elevata variabilità nella permeabilità delle cellule endoteliali coltivate per 2 giorni nel dispositivo indica che 2 giorni di coltura non sono stati sufficienti per la maturazione della barriera. Non ci sono state differenze significative nella permeabilità tra i laboratori al momento della maturazione della barriera, da 4 giorni in poi. Abbiamo anche dimostrato che la permeabilità delle cellule endoteliali coltivate in filtri μSiM e transwell per 6 giorni corrispondeva a quelle precedentemente pubblicate40.
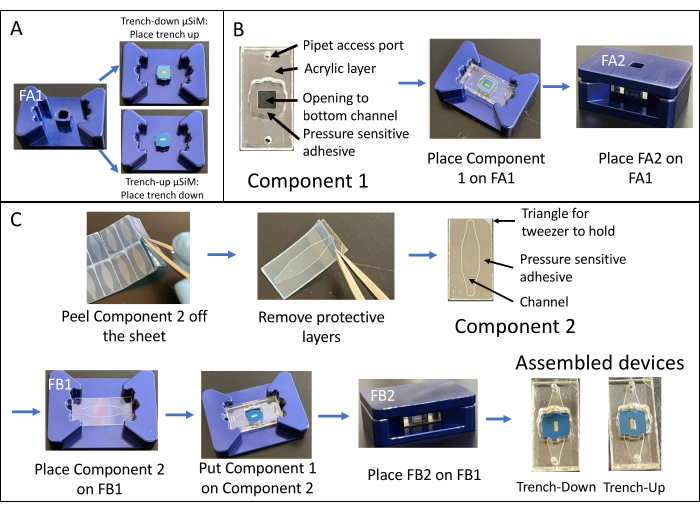
Figura 1: Fasi dell'assemblaggio di μSiM . (A) Preparare il chip posizionandolo sull'attrezzatura A1. Posizionare la trincea dei trucioli verso l'alto per un dispositivo finale di trincea. Posizionare lo scavo trucioli verso il basso per un dispositivo di scavo finale. (B) Incollare il componente 1 al chip rimuovendo le maschere protettive dal componente 1 e posizionandolo a faccia in giù in FA1. Incollare applicando pressione con il dispositivo A2. (C) Incollare il componente 2 e il componente 1 rimuovendo il componente 2 dal suo foglio e staccando gli strati protettivi superiori. Posizionare il canale verso l'alto nell'attrezzatura B1 e posizionare il componente 1 sopra il componente 2 rivolto verso l'alto. Incollare applicando pressione con il dispositivo B2. Abbreviazioni: FAn = apparecchio An; FBn = fixture Bn. Fare clic qui per visualizzare una versione più grande di questa figura.
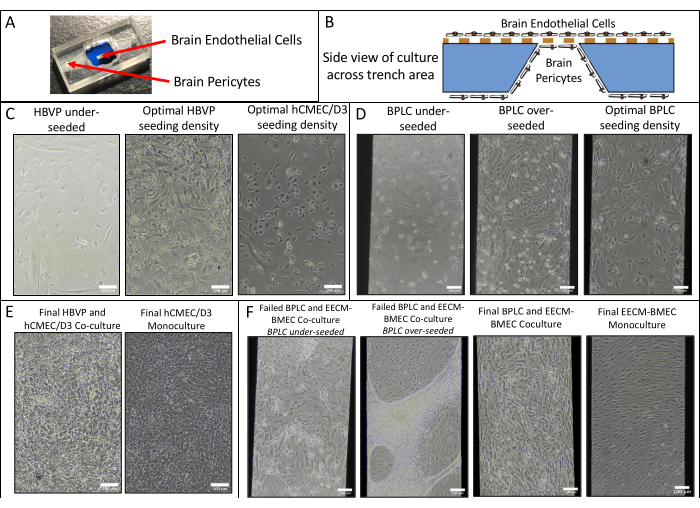
Figura 2: Schema della cocoltura e immagini rappresentative a contrasto di fase di colture cellulari nei dispositivi. (A) Localizzazione della semina di cellule pericitarie ed endoteliali. (B) Vista laterale schematica delle posizioni delle celle attraverso la trincea del chip di membrana. (C) Immagini rappresentative di densità di semina basse e ottimali per linee cellulari endoteliali cerebrali primarie HBVP e hCMEC/D3. Le immagini sono state acquisite 1 giorno dopo la semina (HBVP) e 2 ore dopo la semina (hCMEC/D3). (D) Immagini rappresentative di densità di semina bassa, alta e ottimale per cellule cerebrali simili a periciti derivate da hiPSC. Le immagini sono state acquisite 1 giorno dopo la semina. (E) Immagini rappresentative della co-coltura finale di HBVP e hCMEC/D3 e della monocoltura hCMEC/D3. Le immagini sono state acquisite 8 giorni dopo la semina di HBVP e 7 giorni dopo la semina di hCMEC/D3. (F) Immagini rappresentative di co-colture cellulari BPLC e EECM-BMEC-like fallite e riuscite e monocolture cellulari EECM-BMEC-like. Le immagini sono state acquisite 7 giorni dopo la semina BPLC e 6 giorni dopo la semina EECM-BMEC. Le colture BPLC sottoseminate non riescono ad avere una copertura sufficiente, mentre le colture BPLC traseminate cresceranno in modo eccessivo e inizieranno ad aggregarsi/ritirarsi. Barre di scala = 100 μm (C-F). Abbreviazioni: HBVPs = periciti vascolari del cervello umano; hiPSC = cellula staminale pluripotente indotta umana; BPLCs = cellule cerebrali simili ai periciti derivate da hiPSC. Fare clic qui per visualizzare una versione più grande di questa figura.
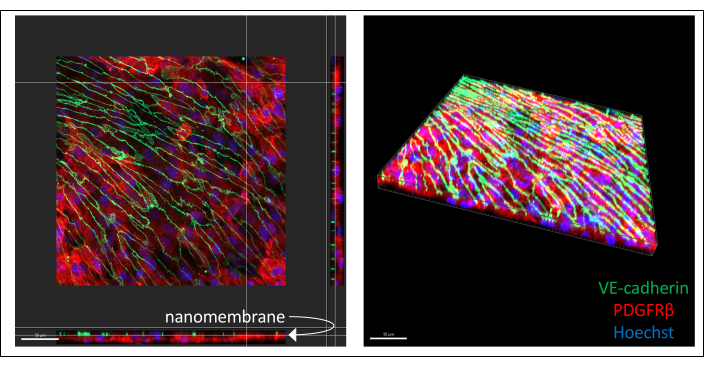
Figura 3: Immagini rappresentative di co-colture cellulari derivate da hiPSC immunocolorate in dispositivi. Le cellule sono state colorate per il marcatore delle cellule endoteliali VE-caderina (verde), il marcatore pericitario PDGFRβ (rosso) e la colorazione nucleare (blu). Due strati di cellule possono essere visti in stretta vicinanza, separati solo da una sottile nanomembrana di nitruro di silicio (la freccia bianca indica la posizione della membrana nell'immagine a sinistra). Barra graduata = 50 μm. Abbreviazioni: hiPSC = cellula staminale pluripotente indotta umana; PDGFRβ = recettore beta del fattore di crescita derivato dalle piastrine. Fare clic qui per visualizzare una versione più grande di questa figura.
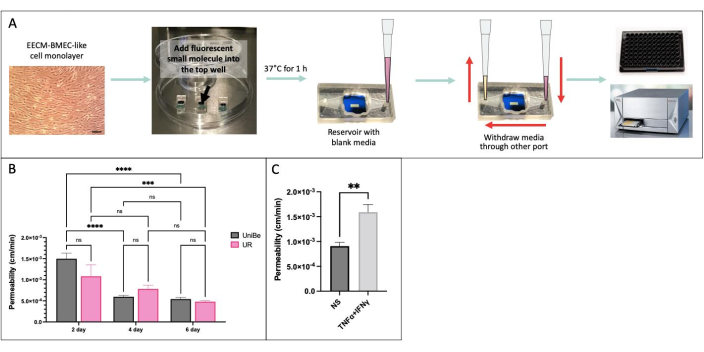
Figura 4: Saggio di permeabilità a piccole molecole basato sul campionamento. (A) Schema del flusso di lavoro sperimentale. (B) Dimostrazione della riproducibilità interlaboratorio tra due laboratori fisicamente distanti presso l'Università di Berna (UniBe), Svizzera, e l'Università di Rochester (UR), NY, USA: cellule endoteliali derivate da hiPSC sono state coltivate nel dispositivo μSiM per 2, 4 o 6 giorni e in filtri transwell per 6 giorni. Il test di permeabilità è stato eseguito utilizzando 150 μg/mL di giallo lucifero (457 Da). La barra rossa indica i dati di permeabilità alla fluoresceina sodica (376 Da) precedentemente pubblicati delle stesse cellule endoteliali derivate da hiPSC coltivate per 6 giorni in filtri transwell40. N = 4-16 per gruppo. È stata utilizzata l'ANOVA bidirezionale con il test post hoc di Tukey e i confronti sono stati visualizzati solo per p < 0,05. (C) Dimostrazione della risposta citochinica utilizzando cellule EECM-BMEC-like derivate da hiPSC coltivate nel μSiM per 2 giorni; 0,1 ng/mL TNFα + 2 UI/mL IFNγ) o il mezzo di controllo (non stimolato, NS) è stato aggiunto alla camera superiore per 20 ore prima del test di permeabilità utilizzando 150 μg/mL di Lucifero Yellow. N = 3 per gruppo. Test t di Student, p < 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.
| Superficie di semina della camera superiore | Volume del pozzo superiore | Area della superficie di semina della camera inferiore | Volume del canale inferiore |
| ~37 millimetri2 | 100 μL (può contenere ≥115 μL) | ~42 millimetri2 | 10 μL (pipetta da 20 μL per evitare bolle) |
Tabella 1: Area superficiale e volumi critici μSiM.
| Bersaglio | Fissativo | Soluzione di blocco | Diluizione |
| VE-caderina | 4% PFA o 100% MeOH | 5% GS + 0,4% Tx-100 o 10% GS + 0,3% Triton X-100 | 1:50 |
| CD31 | 4% PFA o 100% MeOH | 5% GS + 0,3-0,4% Triton X-100 | 1:100 |
| Claudin-5 | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:200 |
| ZO-1 | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:200 |
| Occludina | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:50 |
| PDGFRβ | 4% PFA | 5% GS + 0,4% Triton X-100 | 1:100 |
| NG2 | 4% PFA | 5% GS + 0,4% Triton X-100 | 1:100 |
| Capra α-Mouse IgG Alexa Fluor 488 | 1:200 | ||
| Capra α-Mouse IgG Alexa Fluor 568 | 1:200 |
Tabella 2: Anticorpi e metodi di colorazione convalidati per l'immunocitochimica di co-coltura in dispositivi μSiM. Abbreviazioni: PFA = paraformaldeide; MeOH = metanolo; GS = siero di capra.
File supplementare 1: Modello per il calcolo del valore di permeabilità. Fare clic qui per scaricare il file.
Discussione
Sebbene i trucioli della membrana siano stati progettati per la stabilità, possono rompersi o rompersi se maneggiati in modo errato durante l'assemblaggio. Pertanto, è fondamentale afferrare il chip nelle tacche della pinzetta per chip e posizionarlo delicatamente nell'attrezzatura. Quando si maneggiano i dispositivi in generale, è necessario prendere ulteriori precauzioni per non urtare o far cadere i dispositivi. Durante l'incollaggio del chip della membrana al dispositivo A1, il chip deve essere posato in piano e centrato sul pilastro del dispositivo A1 per evitare la rottura della membrana durante l'incollaggio al componente 1. Inoltre, qualsiasi contatto con gli strati di PSA esposti deve essere evitato dopo aver rimosso le maschere protettive. Quando si maneggia il componente 2 dopo la rimozione delle maschere protettive, si consiglia di tenerlo lungo il bordo del componente e di utilizzare una pinzetta per afferrare l'angolo triangolare privo di PSA.
Mentre i protocolli di coltura cellulare sono stati descritti per possibili modelli di BBB, il modello di co-coltura BMEC/periciti della BBB qui descritto può essere sufficiente o insufficiente a seconda del contesto fisiologico e delle domande di interesse. Ad esempio, il traffico di cellule immunitarie si verifica in gran parte nelle venule postcapillari del cervello41,42. In queste regioni, uno spazio perivascolare separa la barriera BMEC/pericita dai limitans gliali stabiliti dagli astrociti. Pertanto, nelle venule postcapillari, l'unità neurovascolare (NVU) comprende due barriere fisicamente separate in serie e le estremità astrocitarie non entrano direttamente in contatto con la barriera emato-pericitica/BMEC, che è ben rappresentata dal modello attuale. Se l'obiettivo è un modello NVU che tenga conto dell'impatto dei fattori secreti dagli astrociti sulla barriera ematologica, è possibile aggiungere al dispositivo un compartimento astrocitario che consenta lo scambio di fattori solubili attraverso lo spazio perivascolare. Questo esempio è stato illustrato in precedenza 34 e potrebbe essere esteso per includere altre cellule come la microglia e i neuroni in un compartimento "cerebrale"3D. L'architettura modulare della piattaforma consente di utilizzare semplici strategie di assemblaggio per ottenere queste riconfigurazioni, in modo che la piattaforma sia semplice o complessa quanto necessario per affrontare le ipotesi a portata di mano. Ogni configurazione di coltura cellulare; tuttavia, deve essere ottimizzato per nuove linee cellulari e multi-colture. Ad esempio, a causa delle proprietà delle membrane in nitruro di silicio, potrebbe essere necessario adattare le soluzioni di rivestimento rispetto alle piastre di coltura tissutale. L'inclusione di fibronectina in genere aiuta l'attaccamento cellulare e la sopravvivenza. Inoltre, gli utenti potrebbero coltivare cellule endoteliali e periciti in direzioni opposte. In questo caso, potrebbe essere necessario modificare, ad esempio, il modo in cui vengono effettuate e interpretate le misure di permeabilità. Fornire passaggi per questo tipo di cultura, tuttavia, esula dallo scopo di questo documento.
Un'altra sfida che si può incontrare durante la coltura cellulare è la rapida evaporazione dei terreni, poiché i dispositivi possono essere più sensibili alle alterazioni dell'ambiente rispetto alle piastre e ai flaconi standard per la coltura dei tessuti. Se si osserva un'evaporazione eccessiva o una crescita cellulare rallentata, è necessario misurare tutti i parametri critici dell'incubatore per garantire impostazioni accurate. È possibile aggiungere più acqua al cappuccio del tessuto o alla piccola capsula di Petri posta all'interno della camera di coltura cellulare, oppure i terreni devono essere scambiati più frequentemente. Inoltre, le bolle possono entrare nel canale inferiore e rimanere bloccate nella trincea per i dispositivi di trincea. Sebbene possano essere rimossi, è più facile evitare di aggiungere bolle in primo luogo. A tale scopo, è importante verificare che non vi siano bolle nel puntale della pipetta o aria all'estremità del puntale della pipetta prima di pipettare il terreno nella camera inferiore. Inoltre, l'evaporazione del fluido nel canale può portare a uno spazio tra la superficie del supporto e la parte superiore della porta. È possibile pipettare un piccolo volume di supporti in una porta fino a quando non raggiunge la superficie della porta opposta, dopodiché il supporto può essere sostituito in quella porta opposta. Mentre i terreni hECSR ed E6 + 10% FBS non devono essere riscaldati a bagnomaria, altri terreni possono essere preriscaldati per ridurre la formazione di bolle. Se una bolla penetra nella camera inferiore, può essere rimossa pipettando rapidamente 100 μL attraverso il canale. Tuttavia, questo metodo può portare alla contaminazione tra le camere o alla fuoriuscita di fluidi sulla superficie del dispositivo. Può anche distruggere gli strati cellulari. In alternativa, il mezzo può essere prima rimosso dal canale e poi reintrodotto con un volume di 50 μL. Rimuovere prima il supporto, tuttavia, può causare una maggiore formazione di bolle nel canale. Se una bolla non si trova direttamente sotto l'area della membrana, può essere lasciata nel canale senza effetti sulla coltura cellulare.
L'attaccamento e la crescita dei periciti, come dimostrato nella Figura 2, possono essere impegnativi. L'utilizzo di una densità di semina ottimizzata è essenziale per la formazione di uno strato con un rapporto periciti-cellule endoteliali fisiologicamente rilevante. Inoltre, poiché i periciti sono sensibili al taglio, tutti gli scambi di terreni nel canale dovrebbero essere eseguiti molto lentamente per proteggere le cellule. Per la coltura BPLC, è possibile ottenere un migliore attaccamento rivestendo la camera inferiore con 800 μg/mL di collagene di tipo IV o 100 μg/mL di fibronectina.
L'immunocitochimica nei dispositivi qui descritti consente un'analisi qualitativa della salute e della funzione cellulare. I metodi per la colorazione nelle piastre di coltura tissutale o in altre piattaforme devono essere direttamente traducibili nella piattaforma. Per la coltura cellulare solo nella camera superiore, dopo la fissazione, il PBS può essere aggiunto nella camera inferiore e lasciato per i passaggi rimanenti, con il blocco e la colorazione eseguiti solo nella camera superiore. In questo modo si riducono al minimo i rischi di rottura delle membrane o di formazione di bolle nella camera inferiore. Per la colorazione in co-coltura, si consiglia di utilizzare entrambe le camere in tutte le fasi. È importante notare che la viscosità del fissativo e del PBS è diversa da quella del fluido. Pertanto, può essere più facile aggiungere bolle nella camera inferiore ed è necessario prestare particolare attenzione a controllare la presenza di aria nei puntali delle pipette all'estremità del puntale prima di pipettare nella camera inferiore.
Il protocollo descritto per il saggio di permeabilità a piccole molecole consente una valutazione funzionale e quantitativa della funzione di barriera delle cellule endoteliali coltivate nel dispositivo μSiM. Un problema che può essere riscontrato durante questo test è l'aspirazione di bolle d'aria nella pipetta durante la raccolta del campione dal canale inferiore nella fase 4.1.7.4 del protocollo. Per evitare questo problema, è importante assicurarsi che la punta sia sigillata nella porta prima di iniziare la raccolta del campione e che il campione non venga prelevato troppo velocemente. Se ciò non risolve il problema, la dimensione delle punte utilizzate potrebbe essere troppo piccola o troppo grande per adattarsi alle porte; utilizzare i suggerimenti elencati nella Tabella dei materiali. Se vengono misurati valori di permeabilità inaspettatamente elevati nonostante un monostrato confluente dall'aspetto sano, l'integrità del monostrato deve essere verificata per rilevare eventuali interruzioni durante la raccolta del campione. Si consiglia di controllare sempre il monostrato al microscopio subito dopo la raccolta del campione. Se il monostrato sembra ancora intatto e sano, il campione può essere fissato e i marcatori biologici della funzione di barriera possono essere valutati, ad esempio, tramite immunocolorazione delle proteine giunzionali. Al contrario, se vengono misurati valori di permeabilità inaspettatamente bassi, è importante assicurarsi che 50 μL di terreno vengano campionati dal canale inferiore senza bolle d'aria. Se il terreno fuoriesce dalla porta di campionamento non appena viene posizionato il puntale del serbatoio, tale terreno deve essere raccolto prima di inserire la pipetta nella porta di campionamento, poiché la maggior parte della piccola molecola fluorescente sarà presente nel volume iniziale di 10 μL campionato dal canale inferiore. Disegnando cerchi intorno alle porte utilizzando una penna idrofobica o posizionando un nastro idrofobico con un foro intorno alla porta si evita che i fluidi pompati passivamente si diffondano. Se durante il campionamento vengono prelevate delle bolle o se l'intero campione da 50 μL non viene rimosso, il campione non deve essere utilizzato. In alternativa, il volume esatto può essere determinato e utilizzato nel calcolo della permeabilità; tuttavia, questo dovrebbe essere fatto solo se il volume rimosso è ≥40 μL, che corrisponde a ~98-99% di recupero del colorante34.
Divulgazioni
J.L.M. è co-fondatore di SiMPore e detiene una partecipazione azionaria nella società. SiMPore sta commercializzando tecnologie ultrasottili a base di silicio, comprese le membrane utilizzate in questo studio.
Riconoscimenti
J.L.M., B.E., T.R.G., M.C.M., P.K., M.T., K.C. e L.W. sono stati finanziati dalla sovvenzione NIH R33 HL154249. J.L.M. è stato finanziato da R44 GM137651. M.M. è stato finanziato dallo Schmidt Program Award Del Monte Institute for Neuroscience, Università di Rochester. M.T. è stata finanziata da RF1 AG079138. K.C. è stato finanziato dalla Fondazione Internazionale per la Ricerca Etica.
Materiali
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| CD31 Polyclonal antibody | Thermo Fisher Scientific | PA5-32321 | |
| Claudin-5 mouse IgG antibody, 4C3C2 | Thermo Fisher Scientific | 35-2500 | |
| Goat α-Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | |
| Goat α-Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| NG2, mouse IgG2a, 9.2.27 | Millipore | MAB2029 | |
| Occludin mouse IgG antibody, OC-3F10 | Thermo Fisher Scientific | 33-1500 | |
| PDGFRβ, rabbit IgG antibody, 28E1 | Cell Signaling Technology | 3169 | |
| VE-cadherin mouse IgG2B Clone # 123413 | R&D Systems | MAB9381 | |
| ZO-1 rabbit IgG antibody, polyclonal | Thermo Fisher Scientific | 40-2200 | |
| Chemicals, peptides, and recombinant proteins | |||
| 100% Methanol | VWR | 101443-718 | Can be substituted with similar products |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 28908 | Can be substituted with similar products |
| Accutase | Thermo Fisher Scientific | A1110501 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| B27 supplement | Thermo Fischer Scientific | 17504044 | |
| bFGF | R&D Systems | 233-FB-025 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Collagen, Type I solution from rat tail | Sigma-Aldrich | C3867-1VL | Can be substituted with similar products |
| DMEM/Ham’s F12 | Thermo Fisher Scientific | 11320033 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Essential 6 medium | Thermo Fisher Scientific | A1516401 | |
| Fetal bovine serum (FBS) | Peak Serum | PS-FB1 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Fibronectin human protein, plasma | ThermoFisher Scientific | 33016015 | Can be substituted with similar products |
| hESFM | Thermo Fisher Scientific | 11111044 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | 861502 | |
| Normal goat serum | Thermo Fisher Scientific | 500627 | Can be substituted with similar products |
| PBS without calcium, magnesium | Cytiva | SH30256.01 | Can be substituted with similar products |
| Pericyte Medium | ScienCell | 1201 | Use complete kit (includes supplements) |
| Poly-L-Lysine, 10 mg/mL | ScienCell | 0413 | |
| Triton X-100 | JT Baker | X198-05 | Can be substituted with similar products |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen™ | 10977015 | Can be substituted with similar products |
| Experimental models: Cell lines | |||
| Blood-brain barrier hCMEC/D3 cell line | Sigma-Aldrich | SCC066 | |
| Human brain vascular pericytes | ScienCell | 1200 | |
| iPS(IMR90)-4 human induced pluripotent stem cells | WiCell | RRID:CVCL_C437 | |
| Glassware and Plasticware | |||
| 150 mm TC-treated Cell Culture Dish with 20 mm Grid | Falcon | 353025 | |
| Clamps | VWR | MFLX06832-10 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Flat 96-well non-binding microplates | Greiner Bio-One | 655900 | |
| Microscope Slide Device Holder | SiMPore | USIM-SB | Dimensions compatible with micropscope slide holders |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339653 | Tube caps can be filled with water for cell culture |
| P20-200 pipette tips | VWR | 76322-516 | Alternate brands may not seal as effectively into ports |
| Transwell filters (12 well, 12 mm, 0.4 μm pore size, PC) | CoStar | 3401 | |
| Instruments | |||
| 10X Objective (For Andor) | Nikon Instruments Inc. | MRD00105 | Air; WD: 4 mm; NA 0.45 |
| 10X Objective (For Nikon) | Nikon Instruments Inc. | MRP40102 | Air; WD: 6.2 mm; NA 0.25 |
| 40X Objective (LWD) (For Andor) | Nikon Instruments Inc. | MRD77410 | Water immersion; WD: 590-610 mm; NA 1.15 |
| Andor Spinning Disc Confocal microscope | Oxford Instruments, Andor | ||
| Nikon Eclipse Ts2 Phase Contrast Microscope | Nikon Instruments Inc. | Can be substituted with similar products | |
| TECAN Infinite M200 | TECAN | Can be substituted with similar products | |
| Other | |||
| Advanced PAP Pen | Millipore Sigma | Z672548 | 2 mm tip is recommended |
| Assembly kit with fixtures | SiMPore | USIM-JIGSET | Including fixure A1, A2, B1, and B2 |
| Camera Adapter for Microscopes | AmScope | CA-CAN-SLR Canon SLR / D-SLR | Φ23.2 - Φ30 adapter fits Nikon Eclipse Ts2 |
| Canon EOS Rebel SL3 DSLR Camera | Canon | EOS 250D, BH #CAEDRSL3B, MFR #3453C001 | Can be substituted with similar products |
| Cell strainer, 40 µm | Millipore Sigma (Corning) | CLS431750 | |
| Component 1 | SiMPore | USIM-C1 | |
| Component 2 | SiMPore | USIM-C2 | |
| Membrane chips | SiMPore | NPSN100-1L | Other chips formats are available |
| SMD handling tweezer double angle | Techni-Tool | 758TW003 | "Chip Tweezers" |
| Stainless steel precision type GG tweezer | Techni-Tool | 758TW534 | "Straight Tweezers" |
| Software | |||
| Fiji | ImageJ | For image processing | |
| Fusion | Oxford Instruments, Andor | Instructions for version 2.3.0.44 | |
| i-control | TECAN | Instructions for version 2.0 | |
| Imaris | Oxford Instruments | For image processing. Instructions for version 9.9.0 |
Riferimenti
- Villabona-Rueda, A., Erice, C., Pardo, C. A., Stins, M. F. The evolving concept of the blood brain barrier (BBB): from a single static barrier to a heterogeneous and dynamic relay center. Frontiers in Cellular Neuroscience. 13, 405 (2019).
- Nation, D. A., et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature Medicine. 25 (2), 270-276 (2019).
- Ferrari, C. C., Tarelli, R. Parkinson's disease and systemic inflammation. Parkinsons Disease. 116 (3), 436813 (2011).
- Koch, E. V., Ledwig, V., Bendas, S., Reichl, S., Dietzel, A. Tissue barrier-on-chip: a technology for reproducible practice in drug testing. Pharmaceutics. 14 (7), 1451 (2022).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
- Ortiz, G. G., et al. Role of the blood-brain barrier in multiple sclerosis. Archives of Medical Research. 45 (8), 687-697 (2014).
- Orhun, G., et al. Association between inflammatory markers and cognitive outcome in patients with acute brain dysfunction due to sepsis. Archives of Neuropsychiatry. 56 (1), 63-70 (2019).
- Chen, Y., Yang, W., Chen, F., Cui, L. COVID-19 and cognitive impairment: neuroinvasive and blood-brain barrier dysfunction. Journal of Neuroinflammation. 19 (1), 222 (2022).
- Hughes, C. G., et al. Endothelial activation and blood-brain barrier injury as risk factors for delirium in critically ill patients. Critical Care Medicine. 44 (9), e809-e817 (2016).
- Saraiva, C., et al. Nanoparticle-mediated brain drug delivery: Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of Control Release. 235 (10), 34-47 (2016).
- Jolliet-Riant, P., Tillement, J. P. Drug transfer across the blood-brain barrier and improvement of brain delivery. Fundamental & Clinical Pharmacology. 13 (1), 16-26 (1999).
- Abbott, N. J., et al. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2009).
- Siflinger-Birnboim, A., et al. Molecular sieving characteristics of the cultured endothelial monolayer. Journal of Cellular Physiology. 132 (1), 111-117 (1987).
- Bischoff, I., et al. Pitfalls in assessing microvascular endothelial barrier function: impedance-based devices versus the classic macromolecular tracer assay. Scientific Reports. 6, 23671 (2016).
- van der Helm, M. W., van der Meer, A. D., Eijkel, J. C., van den Berg, A., Segerink, L. I. Microfluidic organ-on-chip technology for blood-brain barrier research. Tissue Barriers. 4 (1), e1142493 (2016).
- Osaki, T., Shin, Y., Sivathanu, V., Campisi, M., Kamm, R. D. In vitro microfluidic models for neurodegenerative disorders. Advanced Healthcare Materials. 7 (2), (2018).
- Girard, S. D., et al. High and low permeability of human pluripotent stem cell-derived blood-brain barrier models depend on epithelial or endothelial features. FASEB Journal. 37 (2), e22770 (2023).
- Vigh, J. P., et al. Transendothelial electrical resistance measurement across the blood-brain barrier: a critical review of methods. Micromachines. 12 (6), 685 (2021).
- Lea, T., et al., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bioactives on Health: in vitro and ex vivo models. , (2015).
- Felix, K., Tobias, S., Jan, H., Nicolas, S., Michael, M. Measurements of transepithelial electrical resistance (TEER) are affected by junctional length in immature epithelial monolayers. Histochemistry and Cell Biology. 156 (6), 609-616 (2021).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Mossu, A., et al. A silicon nanomembrane platform for the visualization of immune cell trafficking across the human blood-brain barrier under flow. Journal of Cerebral Blood Flow and Metabolism. 39 (3), 395-410 (2019).
- Castro Dias, M., et al. Brain endothelial tricellular junctions as novel sites for T-cell diapedesis across the blood-brain barrier. Journal of Cell Science. 134 (8), jcs253880 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Khire, T. S., et al. Microvascular mimetics for the study of lukocyte-endothelial interactions. Cellular and Molecular Bioengineering. 13 (2), 125-139 (2020).
- Salminen, A. T., et al. Endothelial cell apicobasal polarity coordinates distinct responses to luminally versus abluminally delivered TNF-alpha in a microvascular mimetic. Integrative Biology: Quantitative Biosciences from Nano to Macro. 12 (11), 275-289 (2020).
- DesOrmeaux, J. P. S., et al. Nanoporous silicon nitride membranes fabricated from porous nanocrystalline silicon templates. Nanoscale. 6 (18), 10798-10805 (2014).
- Hill, K., et al. Second generation nanoporous silicon nitride membranes for high toxin clearance and small format hemodialysis. Advanced Healthcare Materials. 9 (4), e1900750 (2020).
- Salminen, A. T., et al. Ultrathin dual-scale nano- and microporous membranes for vascular transmigration models. Small. 15 (6), e1804111 (2019).
- Gillmer, S. R., et al. Predicting the failure of ultrathin porous membranes in bulge tests. Thin Solid Films. 631, 152-160 (2017).
- Ishimatsu, R., et al. Ion-selective permeability of ultrathin nanopore silicon membrane as studied using nanofabricated micropipet probes. Analytical Chemistry. 82 (17), 7127-7134 (2010).
- Kim, E., et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. Journal of American Chemical Society. 130 (13), 4230-4231 (2008).
- Snyder, J. L., et al. An experimental and theoretical analysis of molecular separations by diffusion through ultrathin nanoporous membranes. Journal of Membrane Science. 369 (1-2), 119-129 (2011).
- McCloskey, M. C., et al. The modular µSiM: a mass produced, rapidly assembled, and reconfigurable platform for the study of barrier tissue models in vitro. Advanced Healthcare Materials. 11 (18), e2200804 (2022).
- Mansouri, M., et al. The modular microSiM reconfigured: integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. 11 (21), e2200802 (2022).
- Su, S. -. H., et al. A tissue chip with integrated digital immunosensors: In situ brain endothelial barrier cytokine secretion monitoring. Biosensors and Bioelectronics. 224, 115030 (2023).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Gastfriend, B. D., Stebbins, M. J., Du, F., Shusta, E. V., Palecek, S. P. Differentiation of brain pericyte-like cells from human pluripotent stem cell-derived neural crest. Current Protocols. 1 (1), e21 (2021).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. FASEB Journal. 34 (12), 16693-16715 (2020).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- Bechmann, I., Galea, I., Perry, V. H. What is the blood-brain barrier (not). Trends in Immunology. 28 (1), 5-11 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon