Method Article
Utilisation de la plateforme tissulaire barrière MicroSiM (μSiM) pour la modélisation de la barrière hémato-encéphalique
Dans cet article
Résumé
Ce rapport fournit des protocoles d’assemblage, de culture cellulaire et de dosage sur la plateforme μSiM pour la construction de modèles de barrière hémato-encéphalique.
Résumé
Le microSiM (μSiM) est une plateforme de culture membranaire pour la modélisation de la barrière hémato-encéphalique (BHE). Contrairement aux plates-formes membranaires conventionnelles, le μSiM offre aux expérimentateurs de nouvelles capacités, notamment l’imagerie de cellules vivantes, la signalisation paracrine sans entrave entre les chambres « sanguines » et « cérébrales », et la possibilité d’imager directement l’immunofluorescence sans avoir besoin d’extraction/remontage des membranes. Nous démontrons ici l’utilisation de base de la plateforme pour établir des modèles de monoculture (cellules endothéliales) et de co-culture (cellules endothéliales et péricytes) de la BHE à l’aide de membranes nanoporeuses ultraminces en nitrure de silicium. Nous démontrons la compatibilité avec les cultures de cellules primaires et les cultures de cellules souches pluripotentes induites humaines (hiPSC). Nous fournissons des méthodes d’analyse qualitative des modèles de BHE par coloration par immunofluorescence et démontrons l’utilisation du μSiM pour l’évaluation quantitative de la fonction barrière dans un test de perméabilité aux petites molécules. Les méthodes fournies devraient permettre aux utilisateurs d’établir leurs modèles de barrière sur la plate-forme, faisant ainsi progresser l’utilisation de la technologie des puces tissulaires pour l’étude des tissus humains.
Introduction
Les tissus vivants sont compartimentés par des cellules spécialisées qui créent et maintiennent des barrières et régulent les cellules et les molécules qui sont transportées d’un compartiment à l’autre. Une mauvaise régulation des fonctions barrières peut être à l’origine de maladies aiguës et de maladies chroniques. La barrière hémato-encéphalique (BHE) est la barrière tissulaire la plus restrictive du corps humain1. Le dysfonctionnement de la BHE est à l’origine d’un large éventail de maladies du système nerveux central (SNC), notamment la maladie d’Alzheimer2, la maladie de Parkinson 3,4 et la sclérose en plaques 5,6. Les lésions de la BHE sont également liées à des troubles cognitifs à long terme résultant de troubles aigus, tels que la septicémie7, la COVID-198 et le délire postopératoire9. La mise au point de médicaments ayant le potentiel de traiter des troubles cérébraux a été extrêmement difficile en raison du défi que représente la violation intentionnelle de la BHE pour délivrer des molécules bioactives à des cibles dans le cerveau10. Pour ces raisons, les méthodes d’étude de la fonction de la BHE in vitro sont d’une importance capitale pour la compréhension et le traitement des maladies du SNC.
Les méthodes de base pour mesurer la fonction barrière in vitro impliquent l’établissement d’une monocouche ou d’une co-culture sur une membrane semi-perméable et la mesure de la résistance conférée par les cellules à la diffusion de petites molécules ou à de petits courants électriques11,12,13,14. Alors que l’émergence des systèmes microphysiologiques (MPS) a produit une abondance de choix pour la modélisation de la BHE en 3D15,16, la diversité des géométries des systèmes rend difficile la comparaison des mesures de perméabilité entre les MPS ou avec les valeurs établies dans la littérature. L’établissement de valeurs de référence fiables est particulièrement important dans la recherche sur la BHE où, en raison de la régulation étendue de la barrière par les cellules endothéliales vasculaires du cerveau, les valeurs de perméabilité in vitro sont très scrutées12,17,18. Pour ces raisons, les mesures de perméabilité à travers les monocouches établies sur des membranes 2D resteront un élément de base des études de la BHE pour les années à venir. Cela est vrai pour d’autres barrières tissulaires, y compris les barrières épithéliales, où les valeurs absolues de la perméabilité de base sont utilisées pour valider et comparer les modèles in vitro 19,20,21.
Dans le but d’établir un nouvel outil précieux pour la communauté de recherche BBB, nous avons introduit22 et avancé 23,24,25,26 le micro-dispositifdoté d’une plate-forme de membrane de silicon(μSiM) pour une utilisation dans la modélisation des tissus barrières au cours des 5 dernières années. La caractéristique habilitante de la plate-forme est une membrane ultramince (<100 nm d’épaisseur) avec des centaines de millions de nanopores 27,28 ou un mélange de nanopores et de micropores29. Les puces membranaires autoportantes sont produites sur une « puce » de silicium de 300 μm qui stabilise les structures ultraminces30 et leur permet d’être manipulées par une pince à épiler pour l’assemblage du dispositif. En raison de leur nature ultramince, les membranes ont une perméabilité supérieure de deux ordres de grandeur à celle des membranes conventionnelles gravées sur traces utilisées dans les dispositifs commerciaux de culture membranaire31,32. En pratique, cela signifie que l’entrave de la membrane à la diffusion de molécules plus petites que les nanopores (<60 nm) est négligeable33. Ainsi, pour les barrières cellulaires, seules les cellules et les matrices qu’elles déposent détermineront la vitesse de transport des petites molécules des compartiments apical vers les compartiments basaux séparés par la membrane34. La conception de l’appareil et la nature ultra-mince des membranes offrent également de nombreux avantages pour la microscopie optique. Il s’agit notamment 1) de la possibilité de suivre des cultures vivantes à l’aide d’un contraste de phase ou d’une imagerie en champ clair, 2) de la possibilité de colorer et d’imager par fluorescence in situ sans avoir besoin d’extraire et de transférer la membrane sur un verre de protection, et 3) le fait que les membranes sont plus minces que les « tranches » confocales, de sorte que les co-cultures directes ont un espacement plus naturel entre les types de cellules que ce qui peut être obtenu avec des membranes gravées à la trace de 6 à 10 μm d’épaisseur.
Plus récemment, nous avons fait évoluer la plate-forme vers un format modulaire pour faciliter l’assemblage rapide34 et la personnalisation35,36. Nous avons tiré parti du format modulaire pour distribuer les composants des dispositifs entre nos laboratoires de bio-ingénierie et les laboratoires de barrière cérébrale collaborateurs. Nous avons ensuite développé conjointement des protocoles pour l’assemblage de dispositifs, la monoculture et la co-culture, la coloration par immunofluorescence et la perméabilité des petites molécules et montré que ces méthodes étaient reproductibles entre laboratoires. À l’aide de ces protocoles, nous avons également montré que la plateforme modulaire prend en charge une BHE validée développée à l’aide de la méthode de culture endothéliale étendue (EECM) pour créer des cellules endothéliales de type microvasculaire cérébral (BMEC) à partir de cellules souches pluripotentes induites humaines (hiPSCs)37. L’objectif du présent rapport est d’examiner ces méthodes plus en détail et, à l’aide de la vidéo qui l’accompagne, de faciliter une adoption plus large de la plateforme dans la communauté BBB.
Protocole
1. Assemblage de l’appareil μSiM
REMARQUE : Cette méthode décrit l’assemblage des appareils. La puce de membrane a un côté tranché et un côté plat, qui peuvent être assemblés en tranchée ou en tranchée. Les dispositifs de tranchée sont le plus souvent utilisés pour la culture cellulaire.
- Dans un environnement stérile (c.-à-d. une hotte de biosécurité), préparez tout le matériel pour l’assemblage, y compris les dispositifs d’assemblage, les composants, les puces de membrane et les pinces à épiler.
- Placez la puce à membrane au centre de l’appareil A1 à l’aide d’une pince à copeaux. La surface plane de la puce est orientée vers le bas et la zone de tranchée vers le haut pour les dispositifs de tranchée, et vice versa pour les dispositifs de tranchée.
REMARQUE : Les étapes de montage suivantes sont illustrées en utilisant le dispositif de tranchée comme exemple, qui permet une zone de croissance plate dans la chambre supérieure. - Collez le composant 1 à la puce. Tout d’abord, décollez les couches protectrices bleues des deux côtés du composant 1 à l’aide d’une pince à épiler droite et placez-la dans le luminaire A1, chambre supérieure vers le bas. Appuyez doucement sur le composant 1 jusqu’à ce que l’adhésif sensible à la pression (PSA) touche la puce.
- Placez le luminaire A2 sur le luminaire A1 et appliquez une pression ferme à différents coins pour assurer un ajustement serré de la puce et du composant.
REMARQUE : Assurez-vous de ne pas enlever la couche PSA. Il s’agit d’une couche transparente et plus rigide que les couches protectrices bleues. - Reliez le composant 2 au composant 1 avec la puce. Tout d’abord, préparez le composant 2 en saisissant un coin du composant 2 avec une pince à épiler droite et en le décollant de la feuille. Ensuite, saisissez la région « triangulaire » non PSA du composant 2 et retirez ensemble la couche protectrice épaisse et transparente et la couche bleue du composant 2, exposant ainsi la surface PSA. Placez le composant 2 dans le luminaire B1, côté PSA vers le haut.
- Placez le composant 1 avec la puce de membrane dans le luminaire B1, chambre supérieure vers le haut.
- Placez le luminaire B2 sur le composant 1 et appliquez une pression ferme à différents coins du luminaire B2.
- Sortez l’appareil assemblé de l’appareil et utilisez une pince à épiler droite pour éliminer les bulles d’air sur la face inférieure de l’appareil et sceller les bords du canal, en évitant tout contact avec la région de la membrane. Avant de l’utiliser pour la culture cellulaire, stérilisez les appareils nouvellement assemblés par ultraviolets (UV) pendant 20 minutes.
2. Culture cellulaire
REMARQUE : Cette méthode décrit les protocoles pour les cultures primaires et dérivées de hiPSC sur la plate-forme. Les méthodes décrivent la monoculture de cellules endothéliales dans la chambre supérieure du dispositif et la co-culture de cellules péricytaires et endothéliales avec les péricytes dans la chambre inférieure et les cellules endothéliales dans la chambre supérieure des dispositifs assemblés en tranchée. Pour les dimensions et les volumes de la chambre, voir le tableau 1. Ce sont les formats les plus courants ; Cependant, d’autres configurations de culture cellulaire peuvent être utilisées en fonction des besoins de l’utilisateur.
- Préparation de la chambre de culture cellulaire
- Assemblez les appareils selon le protocole détaillé dans la section 1.
- Placez les dispositifs dans des colliers de serrage stériles. Avant la culture cellulaire, stérilisez les pinces en les trempant dans de l’éthanol pendant ≥20 min. Restérialiser après chaque expérience pour la réutiliser.
- Cultivez les dispositifs dans une grande boîte de Pétri stérile. Pour plus d’humidité, ajoutez une petite boîte de Pétri ou un couvercle tubulaire conique de 50 ml rempli d’eau stérile.
- Lavez deux fois la chambre supérieure des appareils avec 100 μL d’eau stérile. Pour la culture cellulaire dans la chambre inférieure, laver la chambre inférieure avec 20 μL d’eau stérile.
- Monoculture de lignées cellulaires hCMEC/D3 (BHE)
- Préparer la chambre de culture cellulaire conformément à la section 2.1.
- Enduire les chambres supérieures de 25 μg/cm2 de collagène I et de 5 μg/cm2 de fibronectine humaine mélangés à une solution saline tamponnée au phosphate (PBS). Laissez reposer pendant 1 à 2 h à 37 °C ou toute la nuit à 4 °C.
- Retirer la solution d’enrobage et ajouter 100 μL de milieu endothélial appauvri en facteur de croissance préchauffé (milieu d’essai) dans la chambre supérieure et 20 μL dans la chambre inférieure. Pour préparer le milieu d’essai, mélanger 100 mL de milieu endothélial basal + 400 μL de facteur de croissance fibroblastique humain + 40 μL d’hydrocortisone + 100 μL de sulfate de gentamicine + 2 mL de sérum de veau fœtal.
- Passage des cellules hCMEC/D3 selon le protocole du fabricant ; trypsiniser les cellules dans un incubateur à 37 °C pendant 3 à 5 minutes, puis arrêter la trypsinisation par l’ajout d’un milieu endothélial préchauffé. Transférez la suspension cellulaire dans un tube à centrifuger et centrifugez à 200 × g pendant 5 min à température ambiante. Remettre en suspension la pastille cellulaire dans un milieu de dosage et ensemencer les cellules dans les chambres supérieures à une densité de 40 000 à 60 000 cellules/cm2. Incuber les dispositifs à 37 °C avec 5 % de dioxyde de carbone (CO 2) pendant2 à 4 h pour faciliter l’adhésion cellulaire. Par exemple, pour obtenir 40 000 cellules/cm 2 sur la puce de 0,37 cm2, ajoutez 100 μL d’une solution cellulaire avec une concentration de 150 000 cellules/mL dans la chambre supérieure.
NOTE : Nous cultivons et faisons passer hCMEC/D3 selon Hudecz et al.38, en utilisant une formulation modifiée de milieu de croissance endothélial-2 (EGM-2) pour le maintien cellulaire et un « milieu d’essai » réduit en facteur de croissance après la sous-culture pour les essais. D’autres formulations de milieux devraient être compatibles avec les dispositifs, bien que nous recommandions les formulations de milieux de Hudecz et al.38 si les utilisateurs éprouvent des problèmes de survie avec hCMEC/D3. - Après 2 à 4 h pour l’adhésion cellulaire, échangez avec un milieu d’essai frais dans les deux chambres pour éliminer les cellules mortes ou non attachées.
- Maintenir les dispositifs à 37 °C avec 5 % de CO 2, en changeant le milieu de dosage dans les deux chambres tous les2-3 jours jusqu’à l’expérimentation. Les dosages sont généralement effectués après 2 semaines de culture.
- Monoculture de cellules de type EECM-BMEC dérivées de hiPSC
- Préparer la chambre de culture cellulaire conformément à la section 2.1.
- Préparez du collagène IV à partir d’une solution de placenta humain en ajoutant 5 mL d’acide acétique à 0,5 mg/mL à 5 mg de collagène IV pour créer une solution de 1 mg/mL. Laisser reposer la solution pendant ≥4 h à 4 °C pour qu’elle se reconstitue complètement. La solution est stable à 4 °C pendant 2 semaines.
- Enduisez les chambres supérieures de 100 μL d’un rapport 4 :1 :5 de collagène IV, de fibronectine bovine et d’eau stérile. Enrober à 37 °C pendant 2 à 4 h.
- Retirez la solution de revêtement et ajoutez 100 μL d’hECSR à température ambiante dans la chambre supérieure et 20 μL dans la chambre inférieure.
- Passage de cellules de type EECM-BMEC selon Nishihara et al.37 ; ajouter un mélange d’enzymes de détachement cellulaire aux cellules et transférer dans un incubateur à 37 °C pendant 5 à 8 minutes. Pipeter la solution cellulaire pour singulariser et ajouter jusqu’à 4 fois le volume du milieu endothélial dans un tube à centrifuger. Centrifuger à 200 × g pendant 5 min à température ambiante ; remettre en suspension les cellules dans hECSR et amorcer dans les chambres supérieures à une densité de 40 000 cellules/cm2. Incuber les dispositifs à 37 °C avec 5 % de CO 2 pendant2 à 4 h pour faciliter l’adhésion cellulaire. Par exemple, pour atteindre 40 000 cellules/cm2, ajoutez 100 μL d’une solution cellulaire à 150 000 cellules/mL.
- Après 2 à 4 h pour l’adhésion des cellules, échangez avec de l’hECSR frais dans les deux chambres pour éliminer les cellules mortes ou non attachées.
- Maintenir les dispositifs à 37 °C avec 5 % de CO 2, en échangeant l’hECSR dans les deux chambres tous les 1 à2 jours jusqu’à l’expérimentation. Les dosages sont généralement effectués au jour 6 de la culture.
- co-culture de hCMEC/D3 et de péricyte vasculaire cérébral humain primaire (HBVP)
- Avant l’assemblage de l’appareil, enduisez les puces de membrane de 2 μg/cm2 de poly-L-lysine (PLL) mélangée à du PBS. Appliquer 50 à 80 μL de PLL en gouttelettes uniquement sur le côté qui sera orienté vers le bas dans l’assemblage final de l’appareil. Terminez le processus d’enrobage en 1 à 2 h à 37 °C ou toute la nuit à 4 °C.
- Retirez la solution de revêtement. Lavez les copeaux de membrane avec de l’eau ultrapure stérile et laissez-les sécher.
- Assemblez les dispositifs selon le protocole détaillé dans la section 1 ci-dessus, avec le côté revêtu de PLL vers le bas, et préparez la chambre de culture cellulaire conformément à la section 2.1.
- Enduire les chambres supérieures conformément à la section 2.2.2.
- Ajouter 50 μL de milieu péricytaire préchauffé dans les chambres supérieures et ajouter 20 μL dans les canaux inférieurs.
- Passage des HBVP selon le protocole du fabricant ; Trypsiniser les cellules dans un incubateur à 37 °C pendant 3 à 5 minutes, puis arrêter la trypsinisation par ajout d’un milieu péricytaire préchauffé. Transférez la suspension cellulaire dans un tube à centrifuger et centrifugez à 200 × g pendant 5 min à température ambiante. Remettre en suspension la pastille cellulaire dans un milieu péricytaire et ensemencer les cellules dans les chambres inférieures à une densité de 14 000 à 25 000 cellules/cm2. Inversez les appareils mais maintenez une interface d’air avec les chambres supérieures pour faciliter les échanges gazeux.
REMARQUE : L’interface d’air requise pendant l’inversion peut être obtenue en retournant les appareils après les avoir placés à l’intérieur des colliers de serrage et en appuyant sur tous les coins avant de les retourner, ou en plaçant les appareils à l’envers sur des bandes parallèles d’acrylique ou de silicone suffisamment espacées pour maintenir les chambres supérieures dégagées. Il peut être nécessaire d’optimiser la densité de semis pour chaque utilisateur. Pour obtenir 14 000 cellules/cm2, ajoutez 20 μL d’une suspension cellulaire à ~590 000 cellules/mL. Notez que 20 μL sont pipetés dans la chambre inférieure pour éviter les bulles, mais la densité est calculée en utilisant le volume de la chambre inférieure de 10 μL. - Incuber les cellules à 37 °C avec 5 % de CO 2 pendant2 à 4 h en position inversée pour faciliter l’adhésion cellulaire.
- Après 2 à 4 h pour l’adhérence des cellules, retournez les dispositifs à la verticale et remplacez-les par du milieu péricytaire frais dans les deux chambres pour éliminer les cellules mortes ou non attachées.
- Après l’ensemencement du péricyte, semer les hCMEC/D3 dans la chambre supérieure, en suivant les étapes 2.2.4 à 2.2.5. Basculez les deux chambres sur le milieu d’essai.
- Maintenir les dispositifs à 37 °C avec 5 % de CO 2, en changeant le milieu de dosage dans les deux chambres tous les 1 à2 jours jusqu’à l’expérimentation. La co-culture de cellules primaires est généralement maintenue pendant 6 à 8 jours avant les essais.
REMARQUE : Si les monocultures de HBVP doivent être comparées à des monocultures de hCMEC/D3 ou à des cocultures de hCMEC/D3 et de HBVP, échanger le milieu péricytaire avec le milieu d’essai 2 à 3 jours après l’ensemencement des HBVP.
- Co-culture de cellules de type EECM-BMEC dérivées de hiPSC et de cellules de type péricyte cérébral (BPLC) dérivées de hiPSC
- Préparer la chambre de culture cellulaire conformément à la section 2.1 et enduire les chambres supérieures conformément aux étapes 2.3.2 à 2.3.3.
- Retirez la solution d’enrobage et ajoutez 50 μL de sérum de veau fœtal Essential 6 Medium + 10 % à température ambiante (E6 + 10 % FBS) dans la chambre supérieure.
- Passage des BPLC selon Gastfriend et al.39 ; ajouter un mélange d’enzymes de détachement cellulaire aux cellules et transférer dans un incubateur à 37 °C pendant 5 à 15 minutes, jusqu’à ce que ~90% des cellules soient arrondies. Pipeter la solution cellulaire pour singulariser et ajouter 4 fois le volume de DMEM/F12 dans un tube à centrifuger de 50 ml, à l’aide d’un filtre cellulaire de 40 μm pour filtrer et singulariser complètement les cellules. Transférer dans un tube à centrifuger de 15 mL, centrifuger à 200 × g pendant 5 min à température ambiante, remettre en suspension la pastille cellulaire dans E6 + 10 % FBS et ensemencer les cellules dans les chambres inférieures à une densité de 14 000 à 25 000 cellules/cm2. Inversez les appareils mais maintenez une interface d’air avec la chambre supérieure pour faciliter les échanges gazeux.
REMARQUE : L’interface d’air requise pendant l’inversion peut être obtenue en retournant les appareils après les avoir placés à l’intérieur des colliers de serrage et en appuyant sur tous les coins avant de les retourner, ou en plaçant les appareils à l’envers sur des bandes parallèles d’acrylique ou de silicone suffisamment espacées pour garder les chambres supérieures dégagées. Il peut être nécessaire d’optimiser la densité de semis pour chaque utilisateur. Pour obtenir 14 000 cellules/cm2, ajoutez 20 μL d’une suspension cellulaire à ~590 000 cellules/mL. Notez que 20 μL sont pipetés dans la chambre inférieure pour éviter les bulles, mais la densité est calculée en utilisant le volume de la chambre inférieure de 10 μL. - Incuber les cellules à 37 °C avec 5 % de CO 2 pendant2 à 4 h en position inversée pour faciliter l’adhésion cellulaire.
- Après 2 à 4 h pour l’adhérence des cellules, retournez les dispositifs à la verticale et remplacez-les par de l’E6 frais + 10 % de FBS dans les deux chambres pour éliminer les cellules mortes ou non attachées.
- Un jour après l’ensemencement du péricyte, semez les cellules de type EECM-BMEC dans la chambre supérieure, en suivant les étapes 2.3.5 à 2.3.6. Basculez les deux chambres sur hECSR.
- Maintenir les dispositifs à 37 °C avec 5 % de CO 2, en changeant le milieu de dosage dans les deux chambres tous les 1 à2 jours jusqu’à l’expérimentation. La co-culture dérivée de hiPSC est généralement maintenue pendant 7 jours pour les BPLC et 6 jours pour les cellules de type EECM-BMEC avant les essais.
REMARQUE : Si les monocultures BPLC doivent être comparées à des monocultures EECM-BMEC ou à des cocultures EECM-BMEC et BPLC, alors échanger E6 + 10 % FBS avec hECSR 1 jour après l’ensemencement des BPLC.
3. Immunocytochimie
REMARQUE : Cette méthode décrit un protocole de coloration immunocytochimique et d’imagerie des cellules cultivées dans la face supérieure et/ou inférieure de la membrane. L’objectif de cette expérience est de déterminer la présence et l’emplacement des protéines clés qui devraient être trouvées dans la BHE, telles que les protéines adhérentes et les protéines à jonction serrée, ainsi que les protéines d’identité cellulaire. Les méthodes de coloration alternées et vivantes sont également compatibles avec la plate-forme.
- Fixation et coloration sur les appareils
- Placez les anticorps primaires sur de la glace pour les décongeler.
- Préparez une solution de paraformaldéhyde (PFA) à 4 % à température ambiante (p. ex., diluez 16 % de PFA dans 3 fois son volume de PBS) ou refroidissez du méthanol à 100 % à -20 °C.
- Créez une solution de blocage appropriée conformément au tableau 2. Conserver sur de la glace.
REMARQUE : Il peut être nécessaire de vortex de la solution pour dissoudre complètement Triton X-100. - Fixez les cellules en pipetant 20 μL de fixateur (p. ex., PFA ou méthanol) dans la chambre inférieure et 50 μL dans la chambre supérieure. Incuber les dispositifs pendant 10 min (PFA) ou 2 min (méthanol) à température ambiante.
- Laver pendant 3 x 5 min en pipetant 20 μL de PBS dans la chambre inférieure et 100 μL dans la chambre supérieure.
- Bloquer pendant 30 min à température ambiante en ajoutant 20 μL de solution de blocage dans la chambre inférieure et 50 μL de solution de blocage dans la chambre supérieure. Vérifiez qu’il n’y a pas de bulles dans la chambre inférieure.
- Préparez la solution primaire d’anticorps en diluant le ou les anticorps dans la solution bloquante conformément au tableau 2. Conserver sur de la glace.
- Colorer avec les anticorps primaires en ajoutant 20 μL de la solution d’anticorps primaire dans la chambre inférieure et en remplaçant le volume de la chambre supérieure par 50 μL de la solution d’anticorps primaire. Vérifiez qu’il n’y a pas de bulles dans la chambre inférieure. Incuber pendant 1 h à température ambiante ou toute la nuit à 4 °C.
- Laver pendant 3 x 5 min en pipetant 20 μL de PBS dans la chambre inférieure et 100 μL dans la chambre supérieure.
- Préparez la solution d’anticorps secondaire en diluant le ou les anticorps dans la solution bloquante conformément au tableau 2. Conserver sur glace à l’abri de la lumière.
- Colorer avec des anticorps secondaires en ajoutant 20 μL de solution d’anticorps secondaire dans la chambre inférieure et en remplaçant le volume de la chambre supérieure par 50 μL de la solution d’anticorps secondaire. Vérifiez qu’il n’y a pas de bulles dans la chambre inférieure. Incuber pendant 1 h à température ambiante à l’abri de la lumière.
- Laver pendant 3 x 5 min en pipetant 20 μL de PBS dans la chambre inférieure et 100 μL dans la chambre supérieure.
- Préparez une solution de teinture nucléaire. Diluer Hoechst 1 :10 000 dans du PBS. Ajouter 20 μL de la solution de coloration nucléaire dans la chambre inférieure et remplacer le volume de la chambre supérieure par 50 μL de la solution de coloration nucléaire. Vérifiez qu’il n’y a pas de bulles dans la chambre inférieure. Incuber 3 min à température ambiante à l’abri de la lumière.
- Enlevez la tache en ajoutant 20 μL de PBS dans la chambre inférieure et en remplaçant le volume de la chambre supérieure par 100 μL de PBS. Imagez immédiatement les appareils ou stockez-les à 4 °C avec la boîte de Pétri enveloppée dans un parafilm et à l’abri de la lumière jusqu’à ce qu’ils soient prêts pour l’imagerie.
- Imagerie confocale
REMARQUE : Cette section décrit l’imagerie des dispositifs à l’aide d’un microscope confocal à disque rotatif inversé avec un objectif à longue distance de travail (LWD) 40x (eau, WD 590-610, ouverture numérique 1,15) à titre d’exemple. Pour les distances de travail et la compatibilité des lentilles, reportez-vous aux documents supplémentaires de McCloskey et al.34. Des images de l’ensemble de la surface de la membrane sont également prises à l’aide d’un objectif 10x pour s’assurer que les images 40x sont représentatives de l’ensemble du champ. Ceux-ci sont généralement pris en champ large.- Allumez le microscope et ouvrez le logiciel d’imagerie.
- Réglez les canaux en fonction des propriétés de l’anticorps secondaire et de la coloration nucléaire, à l’aide du mode d’imagerie confocale. Optimisez la puissance laser et le temps d’exposition pour vous assurer que le signal est au-dessus de l’arrière-plan et réduire les artefacts d’imagerie.
- Pour la coloration nucléaire de Hoechst, utilisez l’excitation 405, l’émission 450/50 passe-bande (BP), le temps d’exposition de 500 ms, la puissance laser de 50 %. Pour les étiquettes utilisant un anticorps secondaire conjugué à Alexa Fluor (AF) 488, utilisez l’excitation 488, l’émission 525/50 BP, un temps d’exposition de 500 ms et une puissance laser de 50 %. Pour les étiquettes utilisant un anticorps secondaire conjugué à AF568, utilisez l’excitation 561, l’émission 600/50BP, un temps d’exposition de 500 ms et une puissance laser de 100 %.
- Placez l’appareil dans le support de lame de microscope, la chambre supérieure vers le haut et placez-le dans le microscope à l’aide d’un support de lame de microscope. Activez Live et sélectionnez le canal de la coloration nucléaire. Trouvez la membrane à l’aide d’un objectif bas, en vous assurant que la région de la membrane transparente en nitrure de silicium est centrée, car la lumière ne passera pas à travers la région en silicone bleu et solide. Une fois que l’appareil est correctement centré et que la couche cellulaire est trouvée, passez à l’objectif 40x, mouillez l’objectif et concentrez-vous sur la région de la membrane en utilisant la coloration nucléaire comme guide.
- Activez l’imagerie z-stack et définissez le mode de numérisation sur Démarrer/Fin. Définissez la taille ou le nombre de pas. À l’aide du bouton de réglage grossier du microscope, réglez le début de l’analyse vers le haut de la couche de cellules endothéliales, en utilisant la coloration nucléaire comme guide, et la fin de l’analyse vers le bas de la couche péricytaire, en utilisant la coloration nucléaire comme guide. Vérifiez tous les canaux pour vous assurer que tout sera capturé dans le champ d’imagerie.
REMARQUE : Nous utilisons généralement le pas automatique, qui correspond à des tranches de ~0,2 μm. - Définissez le nom de l’image et appuyez sur Acquérir pour démarrer l’imagerie. Répétez l’opération sur différentes régions au besoin.
- Traitez les images confocales à l’aide d’ImageJ40 ou d’Imaris.
- Pour traiter dans Imaris, faites glisser le fichier image dans le programme pour l’ouvrir. Sélectionnez Section dans la barre de menu supérieure pour afficher une image 2D du plan x-y avec les vues correspondantes des plans x-z et y-z. Sélectionnez Vue 3D dans la barre de menu supérieure pour afficher une image 3D . Cliquez sur l’image et faites-la glisser pour la faire pivoter. Sélectionnez Instantané dans la barre de menu supérieure pour prendre une image.
4. Essai d’échantillonnage de la perméabilité des petites molécules
NOTE : Cette section décrit une méthodologie pour les mesures quantitatives des propriétés barrières des cultures cellulaires. L’objectif de cette expérience est de détecter la concentration d’une petite molécule fluorescente qui traverse les couches cellulaires et pénètre dans la chambre inférieure de la plateforme. Ces données sont ensuite utilisées pour calculer la perméabilité cellulaire.
- Technique d’échantillonnage
- Assemblez les dispositifs selon le protocole détaillé à la section 1 et cultivez les lignées cellulaires souhaitées comme décrit à la section 2. Inclure un dispositif supplémentaire pour servir de dispositif de contrôle sans cellule et enrobé pour mesurer la perméabilité du système.
REMARQUE : Il est recommandé d’effectuer au moins trois répétitions techniques par condition. Cependant, une seule répétition du témoin enrobé est requise. - Avant de commencer l’analyse d’échantillonnage, remplacez le milieu dans la chambre inférieure par un milieu frais. Vérifier la confluence de la monocouche endothéliale dans chaque dispositif sous le microscope. Notez tout espace dans les monocouches cellulaires, car cela aura un impact sur la diffusion du colorant dans la chambre inférieure.
REMARQUE : Une culture endothéliale saine doit être confluente à 100%. - Préparer la solution fluorescente de petites molécules (p. ex., 150 μg/mL de jaune de lucifer, 457 Da) dans un milieu de culture cellulaire. Préparer l’excédent de volume de la solution de petites molécules fluorescentes à utiliser pour la préparation des solutions étalons qui servent de référence pour calculer la concentration de la petite molécule fluorescente prélevée dans le canal inférieur.
REMARQUE : Nous recommandons la préparation de 400 μL de solution excédentaire à utiliser comme solution étalon avec la concentration la plus élevée de la petite molécule fluorescente. - Remplacez le milieu dans le puits supérieur par 100 μL de la solution fluorescente à petites molécules.
REMARQUE : Nous vous recommandons d’utiliser un stylo hydrophobe pour dessiner des cercles autour des orifices d’échantillonnage et d’attendre que l’encre hydrophobe sèche complètement avant d’ajouter une solution de colorant fluorescent. Cela empêche la propagation du milieu à partir du canal inférieur autour de l’orifice d’échantillonnage à l’étape 4.1.7. Nous vous recommandons d’échelonner l’ajout de la solution de petites molécules fluorescentes dans le puits supérieur : attendez 2 min avant d’ajouter la solution fluorescente à l’appareil suivant, ou travaillez par groupes de 3 (ajoutez la solution dans trois appareils en même temps et attendez 5 min pour ajouter les trois appareils suivants). - Incuber les dispositifs à 37 °C, 5% CO2 pendant 1 h.
- Au cours d’une incubation d’une durée de 1 h à l’étape précédente, préparer les solutions étalons en effectuant des dilutions en série 2 fois à partir de la solution de petites molécules fluorescentes préparée à l’étape 4.1.3. Pipeter 50 μL de chaque solution dans la plaque noire à fond plat à 96 puits en trois exemplaires. Utiliser un milieu de culture cellulaire vierge comme solution étalon de base.
REMARQUE : Pour préparer les solutions étalons, nous recommandons 11 dilutions en série à un volume final de 200 μL et l’utilisation d’un milieu de culture cellulaire comme blanc pour mesurer l’intensité fluorescente de base.- Transférer 200 μL de 400 μL de l’excédent de solution de petites molécules fluorescentes préparée à l’étape 4.1.3 dans un tube contenant 200 μL de milieu, bien mélanger et transférer 200 μL de cette solution dans le tube suivant contenant 200 μL de milieu. Répétez les dilutions 1 :2 jusqu’à ce qu’il y ait un total de 10 tubes. Pipeter 50 μL de la solution étalon la plus concentrée dans la colonne 1 en trois exemplaires dans la plaque à 96 puits (B1, C1, D1), la 2ème solution la plus concentrée dans la colonne 2 (B2, C2, D2), et ainsi de suite. Pour la 12ème colonne de la plaque, pipeter 50 μL de milieu vierge en trois exemplaires (B12, C12, D12).
- Effectuez les étapes suivantes pour prélever un échantillon de la solution de petites molécules fluorescentes dans le canal inférieur.
- Retirez la solution de petites molécules fluorescentes du puits pour arrêter le processus de diffusion.
- Placez un embout contenant 50 μL de fluide dans l’orifice supérieur pour servir de réservoir en insérant l’embout contenant 50 μL dans l’orifice, en soulevant l’appareil et en éjectant doucement l’embout tout en le tenant sur le dessus pour la stabiliser. Posez l’appareil. Assurez-vous qu’il n’y a pas de bulles dans l’embout de la pipette ou d’air à l’extrémité de la pipette pour éviter d’ajouter des bulles dans la chambre inférieure pendant l’échantillonnage.
- Ajouter 50 μL de milieu dans le puits supérieur pour éviter la perturbation de la monocouche cellulaire pendant l’échantillonnage.
- Pour prélever la solution à partir du canal inférieur, poussez un pipeteur avec une pointe de pipette vide jusqu’à sa première résistance, insérez la pointe dans l’orifice d’échantillonnage et inversez la pipette pour extraire 50 μL de la solution à partir du canal inférieur. Transférez directement dans la plaque noire à fond plat à 96 puits contenant les solutions étalons.
REMARQUE : Nous recommandons de vérifier la monocouche cellulaire au microscope immédiatement après l’échantillonnage. Le prélèvement de milieux à partir du canal inférieur peut parfois entraîner une perturbation de la couche cellulaire dans le puits supérieur, ce qui peut entraîner des mesures de perméabilité incohérentes. Travailler rapidement tout au long des étapes de la version 4.1.7 permettra d’éviter cela.
- Mesurez l’intensité de fluorescence dans un lecteur de microplaques à l’aide des paramètres de longueur d’onde d’excitation et d’émission appropriés pour la petite molécule fluorescente utilisée. Pour le jaune Lucifer, utilisez une excitation de 428 nm et une émission de 536 nm, avec un gain optimal. La fluorescence est mesurée à partir du haut de la plaque. Ajoutez la plaque dans le lecteur de plaques, mettez en surbrillance les puits contenant l’échantillon (y compris la courbe standard) et sélectionnez Démarrer pour lire la plaque.
- Assemblez les dispositifs selon le protocole détaillé à la section 1 et cultivez les lignées cellulaires souhaitées comme décrit à la section 2. Inclure un dispositif supplémentaire pour servir de dispositif de contrôle sans cellule et enrobé pour mesurer la perméabilité du système.
- Calcul de la valeur de perméabilité (voir le fichier supplémentaire 1 pour le modèle)
- Soustrayez la valeur moyenne de l’intensité de fluorescence du milieu vierge de toutes les valeurs d’intensité de fluorescence mesurées.
- Utilisez l’équation (1) pour calculer la perméabilité du système Ps :
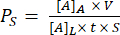 (1)
(1)
Où [A]A est la concentration de la petite molécule fluorescente prélevée dans le canal inférieur, V est le volume échantillonné et ajouté à la plaque (0,050 mL), [A]L est la concentration de la petite molécule fluorescente ajoutée dans le puits supérieur (par exemple 0,15 mg/mL), t est le temps d’incubation (en s ou min selon les unités souhaitées), et S est la surface de la membrane (0,014 cm2).- Calculer [A]A à l’aide de l’équation obtenue en traçant une courbe standard à partir des sorties d’intensité de fluorescence et des concentrations connues des solutions étalons. Calculer les concentrations (x) des échantillons expérimentaux en insérant leurs valeurs d’intensité de fluorescence (y) dans l’équation.
REMARQUE : Utilisez la partie de la courbe standard qui est linéaire. Nous recommandons de mesurer la surface de la membrane à partir d’une image de la membrane prise au microscope, car la surface de la membrane peut varier en fonction du numéro de lot et peut affecter considérablement les valeurs de perméabilité calculées si elles diffèrent du témoin enduit.
- Calculer [A]A à l’aide de l’équation obtenue en traçant une courbe standard à partir des sorties d’intensité de fluorescence et des concentrations connues des solutions étalons. Calculer les concentrations (x) des échantillons expérimentaux en insérant leurs valeurs d’intensité de fluorescence (y) dans l’équation.
- Utilisez l’équation (2) pour calculer la perméabilité de la cellule monocouche Pe :
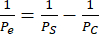 (2)
(2)
Où PS est la perméabilité du système calculée à l’étape 4.2.2 et PC est la valeur de perméabilité du système du dispositif de commande sans cellule et revêtu.
Résultats
L’assemblage d’un dispositif de tranchée est illustré à la figure 1. Les fixations guident l’assemblage des composants et de la puce de membrane. Le composant 1 est principalement composé d’acrylique avec une surface PSA pour le collage à la puce et une ouverture vers la chambre inférieure et des orifices pour l’accès de la pipette à la chambre inférieure. Le composant 2 est la couche de canal et contient un « triangle » non adhésif et sans PSA en haut à droite pour la préhension. Les dispositifs de tranchée fournissent une zone de croissance de la culture cellulaire plate dans la chambre supérieure, tandis que les dispositifs de tranchée ont une surface plane pour la culture cellulaire dans la chambre inférieure.
Nous avons réalisé des monocultures endothéliales et des co-cultures de hCMEC/D3 et HBVP et de cellules de type EECM-BMEC dérivées de hiPSC IMR90-4 et de BPLC et acquis des images de phase à l’aide d’un microscope à contraste de phase Nikon Eclipse Ts2 et d’un objectif 10x (Figure 2). Les densités de semis optimales pour la culture de cellules primaires sont présentées (images prises 1 jour après l’ensemencement), ainsi que les HBVP sous-ensemencés (Figure 2A). Les images finales de la phase de coculture et de monoculture (6 jours de culture de cellules endothéliales) peuvent être difficiles à distinguer (Figure 2C), et la confirmation de la réussite de la co-culture de cellules primaires peut nécessiter une coloration par immunofluorescence (voir la section 3 du protocole). Les densités de semis de BPLC faibles, élevées et optimales dérivées des hiPSC sont également illustrées (figure 2B). La co-culture dérivée de hiPSC est plus claire à distinguer en imagerie par contraste de phase que les co-cultures primaires (Figure 2D). Un faible ensemencement BPLC entraîne une mauvaise couverture du péricyte et une agglutination du péricyte, tandis qu’un sursemis entraîne le décollement de la couche péricytaire de la membrane. De plus, un échange trop rapide du milieu dans la chambre inférieure peut entraîner une perte de péricyte, car ces cellules sont très sensibles au cisaillement. La couverture optimale par les péricytes est de ~90% pour un modèle BHE, sans lacunes dans la couche endothéliale.
Des images représentatives de la co-culture de cellules hiPSC immunocolorées sont illustrées à la figure 3 (culture de cellules endothéliales de 6 jours). Les BPLC dérivés d’IMR90-4 ont été colorés pour le marqueur péricytaire PDGFRβ, et les cellules de type EECM-BMEC dérivées d’IMR90-4 ont été colorées pour le marqueur de jonction adhérente VE-cadhérine. Hoechst a été utilisé pour colorer les noyaux. Les images ont été acquises sur un microscope confocal à disque rotatif à l’aide d’un objectif LWD 40x avec des tranches de 0,2 μm et traitées avec Imaris. Les deux couches cellulaires peuvent être visualisées même si la fine nanomembrane n’est pas visible.
Nous avons effectué le test de perméabilité des petites molécules basé sur l’échantillonnage en utilisant les mêmes conditions expérimentales dans deux laboratoires physiquement distants de l’Université de Berne, en Suisse, et de l’Université de Rochester, NY, aux États-Unis, afin de démontrer la reproductibilité interlaboratoires des résultats (Figure 4)34. Des cellules de type EECM-BMEC dérivées de l’IMR90-4 de hiPSC ont été cultivées dans le dispositif μSiM pendant 2, 4 ou 6 jours et sur des filtres transwell pendant 6 jours. L’essai a été effectué à l’aide de 150 μg/mL de jaune de lucifer (457 Da) dans les deux laboratoires. Une grande variabilité de la perméabilité des cellules endothéliales cultivées pendant 2 jours dans le dispositif indique que 2 jours de culture étaient insuffisants pour la maturation de la barrière. Il n’y avait pas de différences significatives de perméabilité entre les laboratoires lors de la maturation de la barrière, à partir de 4 jours. Nous avons également montré que la perméabilité des cellules endothéliales cultivées dans des filtres μSiM et transwell pendant 6 jours correspondait à celles publiées précédemment40.
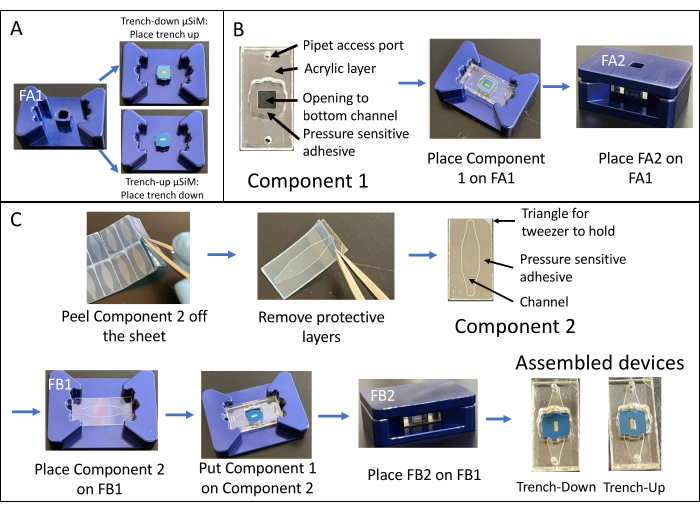
Figure 1 : Étapes de l’assemblage du μSiM. (A) Préparez la puce en la plaçant sur le luminaire A1. Placez la tranchée de copeaux vers le haut pour un dispositif de tranchée final. Placez la tranchée de copeaux vers le bas pour un dispositif de tranchée final. (B) Coller le composant 1 à la puce en retirant les masques de protection du composant 1 et en le plaçant face vers le bas dans FA1. Collage en appliquant une pression avec le luminaire A2. (C) Coller le composant 2 et le composant 1 en retirant le composant 2 de sa feuille et en décollant les couches protectrices supérieures. Placez le canal vers le haut dans le luminaire B1 et placez le composant 1 au-dessus du composant 2 face vers le haut. Collage en appliquant une pression avec le luminaire B2. Abréviations : FAn = luminaire An ; FBn = luminaire Bn. Veuillez cliquer ici pour voir une version agrandie de cette figure.
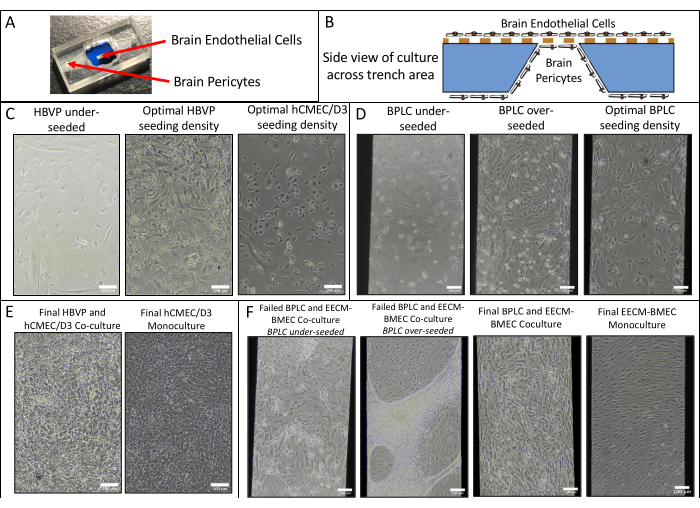
Figure 2 : Schéma de coculture et images représentatives de contraste de phase de la culture cellulaire dans les dispositifs. (A) Emplacement de l’ensemencement des cellules péricytaires et endothéliales. (B) Vue latérale de l’emplacement des cellules dans la tranchée de la puce membranaire. (C) Images représentatives des densités de semis faibles et optimales pour la lignée cellulaire endothéliale cérébrale primaire HBVP et hCMEC/D3. Les images ont été acquises 1 jour après l’ensemencement (HBVP) et 2 h après l’ensemencement (hCMEC/D3). (D) Images représentatives de densités d’ensemencement faibles, élevées et optimales pour les cellules de type péricyte cérébral dérivées de hiPSC. Les images ont été acquises 1 jour après l’ensemencement. (E) Images représentatives de la co-culture finale de HBVP et hCMEC/D3 et de la monoculture hCMEC/D3. Les images ont été acquises 8 jours après l’ensemencement de l’HBVP et 7 jours après l’ensemencement de l’hCMEC/D3. (F) Images représentatives de la co-culture de cellules de type BPLC et EECM-BMEC qui a échoué et qui a réussi, et de la monoculture de cellules de type EECM-BMEC. Les images ont été acquises 7 jours après l’ensemencement BPLC et 6 jours après l’ensemencement EECM-BMEC. Les cultures BPLC sous-ensemencées n’ont pas une couverture suffisante, tandis que les cultures BPLC surensemencées deviendront trop confluentes et commenceront à s’agglutiner/se rétracter. Barres d’échelle = 100 μm (C-F). Abréviations : HBVP = péricytes vasculaires du cerveau humain ; hiPSC = cellule souche pluripotente induite par l’homme ; BPLCs = cellules de type péricyte cérébrale dérivées de hiPSC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
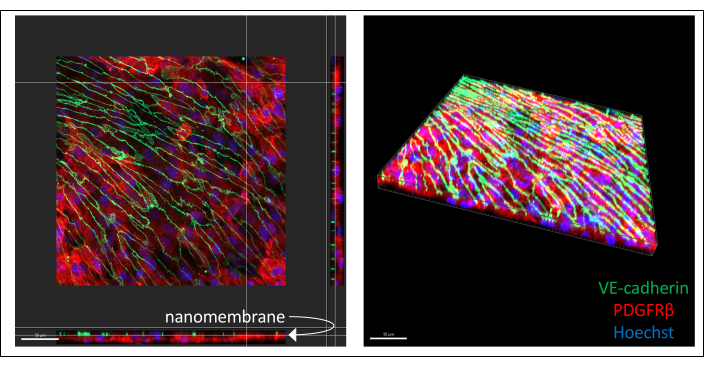
Figure 3 : Images représentatives de la co-culture de cellules dérivées de hiPSC immuno-colorées dans des dispositifs. Les cellules ont été colorées pour le marqueur des cellules endothéliales VE-cadhérine (vert), le marqueur péricytaire PDGFRβ (rouge) et la coloration nucléaire (bleu). Deux couches de cellules peuvent être vues à proximité l’une de l’autre, séparées uniquement par une fine nanomembrane de nitrure de silicium (la flèche blanche marque l’emplacement de la membrane sur l’image de gauche). Barre d’échelle = 50 μm. Abréviations : hiPSC = cellule souche pluripotente induite par l’homme ; PDGFRβ = récepteur bêta du facteur de croissance dérivé des plaquettes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
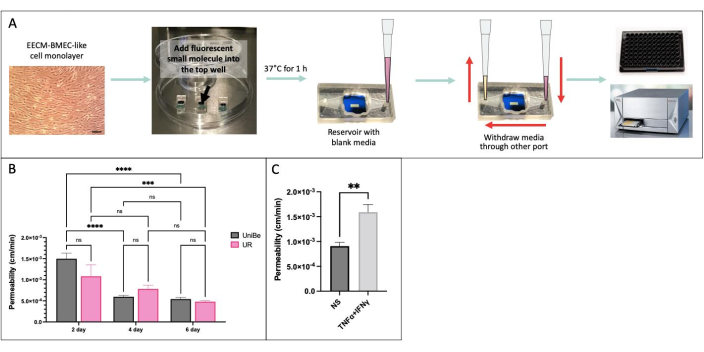
Figure 4 : Essai de perméabilité des petites molécules basé sur l’échantillonnage. (A) Schéma du déroulement expérimental. (B) Démonstration de la reproductibilité interlaboratoires entre deux laboratoires physiquement distants de l’Université de Berne (UniBe), Suisse, et de l’Université de Rochester (UR), NY, USA : des cellules endothéliales dérivées de hiPSC ont été cultivées dans le dispositif μSiM pendant 2, 4 ou 6 jours et dans des filtres transwell pendant 6 jours. Le test de perméabilité a été effectué à l’aide de 150 μg/mL de jaune de lucifer (457 Da). La barre rouge indique les données de perméabilité à la fluorescéine de sodium (376 Da) publiées précédemment des mêmes cellules endothéliales dérivées de hiPSC cultivées pendant 6 jours dans des filtres transwell40. N = 4 à 16 par groupe. Une ANOVA bidirectionnelle avec le test post-hoc de Tukey a été utilisée, et les comparaisons n’ont été affichées que pour p < 0,05 pertinentes. (C) Démonstration de la réponse cytokinique à l’aide de cellules de type EECM-BMEC dérivées de hiPSC cultivées dans le μSiM pendant 2 jours ; 0,1 ng/mL TNFα + 2 UI/mL IFNγ) ou un témoin du milieu (non stimulé, NS) a été ajouté à la chambre supérieure pendant 20 heures avant l’essai de perméabilité à l’aide de 150 μg/mL de jaune de lucifer. N = 3 par groupe. Test t de l’étudiant, p < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Surface d’ensemencement de la chambre supérieure | Volume du puits supérieur | Surface d’ensemencement de la chambre inférieure | Volume du canal inférieur |
| ~37 millimètre2 | 100 μL (peut contenir ≥115 μL) | ~42 millimètre2 | 10 μL (pipette 20 μL pour éviter les bulles) |
Tableau 1 : Surface et volumes critiques en μSiM.
| Cible | Fixateur | Solution de blocage | Dilution |
| VE-cadhérine | 4 % de PFA ou 100 % de MeOH | 5 % GS + 0,4 % Tx-100 ou 10 % GS + 0,3 % Triton X-100 | 1:50 |
| CD31 | 4 % de PFA ou 100 % de MeOH | 5 % GS + 0,3-0,4 % Triton X-100 | 1:100 |
| Claudin-5 | 100% MeOH | 5 à 10 % GS + 0,3 % Triton X-100 | 1:200 |
| ZO-1 | 100% MeOH | 5 à 10 % GS + 0,3 % Triton X-100 | 1:200 |
| Occludine | 100% MeOH | 5 à 10 % GS + 0,3 % Triton X-100 | 1:50 |
| PDGFRβ | 4 % de PFA | 5 % GS + 0,4 % Triton X-100 | 1:100 |
| NG2 | 4 % de PFA | 5 % GS + 0,4 % Triton X-100 | 1:100 |
| Souris α chèvre IgG Alexa Fluor 488 | 1:200 | ||
| Souris α chèvre IgG Alexa Fluor 568 | 1:200 |
Tableau 2 : Anticorps et méthodes de coloration validés pour l’immunocytochimie en co-culture dans les dispositifs μSiM. Abréviations : PFA = paraformaldéhyde ; MeOH = méthanol ; GS = sérum de chèvre.
Fichier supplémentaire 1 : Modèle de calcul de la valeur de perméabilité. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Bien que les puces de membrane aient été conçues pour la stabilité, elles peuvent se fissurer ou se casser si elles sont mal manipulées lors de l’assemblage. Ainsi, il est essentiel de saisir la puce dans les encoches de la pince à puce et de la placer doucement dans le luminaire. Lors de la manipulation des appareils en général, des précautions supplémentaires doivent être prises pour ne pas heurter ou faire tomber les appareils. Lors du collage de la puce de membrane au luminaire A1, le coque doit être posé à plat et centré sur le pilier du luminaire A1 pour éviter la fissuration de la membrane lors du collage au composant 1. De plus, tout contact avec les couches de PSA exposées doit être évité après avoir retiré les masques de protection. Lors de la manipulation du composant 2 après le retrait des masques de protection, il est conseillé de le tenir le long du bord du composant et d’utiliser une pince à épiler pour saisir le coin triangulaire qui est exempt de PSA.
Bien que des protocoles de culture cellulaire aient été décrits pour d’éventuels modèles de BHE, le modèle de co-culture BMEC/péricyte de la BHE décrit ici peut être suffisant ou insuffisant en fonction du contexte physiologique et des questions d’intérêt. Par exemple, le trafic des cellules immunitaires se produit en grande partie dans les veinules postcapillaires du cerveau41,42. Dans ces régions, un espace périvasculaire sépare la barrière BMEC/péricyte des limites gliales établies par les astrocytes. Ainsi, dans les veinules postcapillaires, l’unité neurovasculaire (NVU) comprend deux barrières physiquement séparées en série, et les extrémités astrocytaires ne sont pas directement en contact avec la barrière sanguine BMEC/péricyte, qui est bien représentée par le modèle actuel. Si l’objectif est un modèle NVU qui tient compte de l’impact des facteurs sécrétés par les astrocytes sur la barrière sanguine, un compartiment astrocytaire pourrait être ajouté au dispositif qui permet l’échange de facteurs solubles à travers l’espace périvasculaire. Cet exemple a été illustré précédemment34 et pourrait être étendu pour inclure d’autres cellules telles que la microglie et les neurones dans un compartiment 3D « cerveau ». L’architecture modulaire de la plate-forme permet d’utiliser des stratégies d’assemblage simples pour réaliser ces reconfigurations afin que la plate-forme soit aussi simple ou complexe que nécessaire pour répondre aux hypothèses à portée de main. Chaque installation de culture cellulaire ; Cependant, elle doit être optimisée pour les nouvelles lignées cellulaires et les multi-cultures. Par exemple, en raison des propriétés des membranes en nitrure de silicium, il peut être nécessaire d’ajuster les solutions de revêtement par rapport aux plaques de culture tissulaire. L’inclusion de fibronectine aide généralement à l’attachement cellulaire et à la survie. De plus, les utilisateurs pourraient cultiver des cellules endothéliales et des péricytes dans des directions opposées. Dans ce cas, il peut être nécessaire de modifier, par exemple, la façon dont les mesures de perméabilité sont effectuées et interprétées. Cependant, fournir des étapes pour ce type de culture dépasse le cadre de ce document.
Un autre défi que l’on peut rencontrer lors de la culture cellulaire est l’évaporation rapide des milieux, car les dispositifs peuvent être plus sensibles aux altérations de l’environnement que les plaques et flacons de culture tissulaire standard. Si une évaporation excessive est observée ou si la croissance cellulaire est ralentie, tous les paramètres critiques de l’incubateur doivent être mesurés pour garantir des réglages précis. Plus d’eau peut être ajoutée au capuchon tissulaire ou à la petite boîte de Pétri placée à l’intérieur de la chambre de culture cellulaire, ou les milieux doivent être remplacés plus fréquemment. De plus, des bulles peuvent pénétrer dans le canal inférieur et se coincer dans la tranchée pour les dispositifs de tranchée. Bien qu’ils puissent être retirés, il est plus facile d’éviter d’ajouter des bulles en premier lieu. Pour ce faire, il est important de vérifier qu’il n’y a pas de bulles dans l’embout de pipette ou d’air à l’extrémité de l’embout de pipette avant de pipeter le milieu dans la chambre inférieure. De plus, l’évaporation du média dans le canal peut entraîner un espace entre la surface du support et le dessus de l’orifice. Un petit volume de média peut être pipeté dans un port jusqu’à ce que le support atteigne la surface du port opposé, après quoi le support peut être échangé dans ce port opposé. Bien que les milieux hECSR et E6 + 10 % FBS ne doivent pas être réchauffés au bain-marie, d’autres milieux peuvent être préchauffés pour réduire la formation de bulles. Si une bulle pénètre dans la chambre inférieure, elle peut être éliminée en pipetant rapidement 100 μL à travers le canal. Cependant, cette méthode peut entraîner une contamination entre les chambres ou un déversement de fluide sur la surface de l’appareil. Il peut également perturber les couches cellulaires. Alternativement, le média peut être d’abord retiré du canal, puis réintroduit avec un volume de 50 μL. Cependant, le fait de retirer le média en premier peut entraîner la formation de bulles dans le canal. Si une bulle n’est pas directement sous la zone de la membrane, elle peut être laissée dans le canal sans effet sur la culture cellulaire.
L’attachement et la croissance des péricytes, comme le montre la figure 2, peuvent être difficiles. L’utilisation d’une densité de semis optimisée est essentielle pour la formation d’une couche avec un rapport péricyte/cellule endothéliale physiologiquement pertinent. De plus, comme les péricytes sont sensibles au cisaillement, tous les échanges de milieux dans le canal doivent se faire très lentement pour protéger les cellules. Pour la culture BPLC, une meilleure fixation peut être obtenue en enduisant la chambre inférieure de 800 μg/mL de collagène de type IV ou de 100 μg/mL de fibronectine.
L’immunocytochimie dans les dispositifs décrits ici permet une analyse qualitative de la santé et de la fonction des cellules. Les méthodes de coloration dans des plaques de culture tissulaire ou d’autres plates-formes doivent être directement transposables dans la plate-forme. Pour la culture cellulaire dans la chambre supérieure uniquement, après fixation, le PBS peut être ajouté dans la chambre inférieure et laissé pour les étapes restantes, le blocage et la coloration étant effectués uniquement dans la chambre supérieure. Cela minimise les risques de rupture des membranes ou de formation de bulles dans la chambre inférieure. Pour la coloration en co-culture, nous recommandons d’utiliser les deux chambres à toutes les étapes. Il est important de noter que la viscosité du fixateur et du PBS est différente de celle du milieu. Ainsi, il peut être plus facile d’ajouter des bulles dans la chambre inférieure, et des précautions supplémentaires doivent être prises pour vérifier la présence d’air dans les pointes de pipette à l’extrémité de la pointe avant de pipeter dans la chambre inférieure.
Le protocole décrit pour le test de perméabilité aux petites molécules permet une évaluation fonctionnelle et quantitative de la fonction barrière des cellules endothéliales cultivées dans le dispositif μSiM. L’un des problèmes qui peuvent être rencontrés au cours de cet essai est l’aspiration de bulles d’air dans la pipette lors du prélèvement de l’échantillon à partir du canal inférieur à l’étape de protocole 4.1.7.4. Pour éviter ce problème, il est important de s’assurer que l’embout est scellé dans l’orifice avant de commencer le prélèvement de l’échantillon et que l’échantillon ne doit pas être prélevé trop rapidement. Si cela ne résout pas le problème, la taille des embouts utilisés peut être trop petite ou trop grande pour tenir dans les ports ; utilisez les conseils énumérés dans le tableau des matériaux. Si des valeurs de perméabilité élevées inattendues sont mesurées malgré une monocouche confluente d’apparence saine, l’intégrité de la monocouche doit être vérifiée pour détecter toute perturbation lors du prélèvement de l’échantillon. Nous recommandons de toujours vérifier la monocouche au microscope immédiatement après le prélèvement de l’échantillon. Si la monocouche semble encore intacte et saine, l’échantillon peut être fixé et les marqueurs biologiques de la fonction barrière peuvent être évalués, par exemple par immunomarquage des protéines jonctionnelles. À l’inverse, si des valeurs de perméabilité étonnamment faibles sont mesurées, il est important de s’assurer que 50 μL de milieu sont prélevés dans le canal inférieur sans bulles d’air. Si le milieu sort de l’orifice d’échantillonnage dès que l’embout du réservoir est placé, ce milieu doit être recueilli avant d’insérer la pipette dans l’orifice d’échantillonnage, car la majeure partie de la petite molécule fluorescente sera présente dans le volume initial de 10 μL prélevé dans le canal inférieur. Dessiner des cercles autour des orifices à l’aide d’un stylo hydrophobe ou placer un ruban hydrophobe avec un trou autour de l’orifice empêche tout média pompé passivement de se propager. Si des bulles sont prélevées pendant l’échantillonnage ou si l’échantillon complet de 50 μL n’est pas retiré, l’échantillon ne doit pas être utilisé. Alternativement, le volume exact peut être déterminé et utilisé dans le calcul de perméabilité ; cependant, cela ne doit être fait que si le volume retiré est de ≥40 μL, ce qui correspond à ~98-99% de récupération du colorant34.
Déclarations de divulgation
J.L.M. est co-fondateur de SiMPore et détient une participation dans la société. SiMPore commercialise des technologies ultraminces à base de silicium, y compris les membranes utilisées dans cette étude.
Remerciements
J.L.M., B.E., T.R.G., M.C.M., P.K., M.T., K.C. et L.W. ont été financés par la subvention R33 HL154249 du NIH. J.L.M. a été financé par R44 GM137651. M.M. a été financé par le prix du programme Schmidt de l’Institut Del Monte pour les neurosciences de l’Université de Rochester. M.T. a été financé par RF1 AG079138. K.C. a été financé par l’International Foundation for Ethical Research.
matériels
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| CD31 Polyclonal antibody | Thermo Fisher Scientific | PA5-32321 | |
| Claudin-5 mouse IgG antibody, 4C3C2 | Thermo Fisher Scientific | 35-2500 | |
| Goat α-Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | |
| Goat α-Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| NG2, mouse IgG2a, 9.2.27 | Millipore | MAB2029 | |
| Occludin mouse IgG antibody, OC-3F10 | Thermo Fisher Scientific | 33-1500 | |
| PDGFRβ, rabbit IgG antibody, 28E1 | Cell Signaling Technology | 3169 | |
| VE-cadherin mouse IgG2B Clone # 123413 | R&D Systems | MAB9381 | |
| ZO-1 rabbit IgG antibody, polyclonal | Thermo Fisher Scientific | 40-2200 | |
| Chemicals, peptides, and recombinant proteins | |||
| 100% Methanol | VWR | 101443-718 | Can be substituted with similar products |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 28908 | Can be substituted with similar products |
| Accutase | Thermo Fisher Scientific | A1110501 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| B27 supplement | Thermo Fischer Scientific | 17504044 | |
| bFGF | R&D Systems | 233-FB-025 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Collagen, Type I solution from rat tail | Sigma-Aldrich | C3867-1VL | Can be substituted with similar products |
| DMEM/Ham’s F12 | Thermo Fisher Scientific | 11320033 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Essential 6 medium | Thermo Fisher Scientific | A1516401 | |
| Fetal bovine serum (FBS) | Peak Serum | PS-FB1 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Fibronectin human protein, plasma | ThermoFisher Scientific | 33016015 | Can be substituted with similar products |
| hESFM | Thermo Fisher Scientific | 11111044 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | 861502 | |
| Normal goat serum | Thermo Fisher Scientific | 500627 | Can be substituted with similar products |
| PBS without calcium, magnesium | Cytiva | SH30256.01 | Can be substituted with similar products |
| Pericyte Medium | ScienCell | 1201 | Use complete kit (includes supplements) |
| Poly-L-Lysine, 10 mg/mL | ScienCell | 0413 | |
| Triton X-100 | JT Baker | X198-05 | Can be substituted with similar products |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen™ | 10977015 | Can be substituted with similar products |
| Experimental models: Cell lines | |||
| Blood-brain barrier hCMEC/D3 cell line | Sigma-Aldrich | SCC066 | |
| Human brain vascular pericytes | ScienCell | 1200 | |
| iPS(IMR90)-4 human induced pluripotent stem cells | WiCell | RRID:CVCL_C437 | |
| Glassware and Plasticware | |||
| 150 mm TC-treated Cell Culture Dish with 20 mm Grid | Falcon | 353025 | |
| Clamps | VWR | MFLX06832-10 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Flat 96-well non-binding microplates | Greiner Bio-One | 655900 | |
| Microscope Slide Device Holder | SiMPore | USIM-SB | Dimensions compatible with micropscope slide holders |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339653 | Tube caps can be filled with water for cell culture |
| P20-200 pipette tips | VWR | 76322-516 | Alternate brands may not seal as effectively into ports |
| Transwell filters (12 well, 12 mm, 0.4 μm pore size, PC) | CoStar | 3401 | |
| Instruments | |||
| 10X Objective (For Andor) | Nikon Instruments Inc. | MRD00105 | Air; WD: 4 mm; NA 0.45 |
| 10X Objective (For Nikon) | Nikon Instruments Inc. | MRP40102 | Air; WD: 6.2 mm; NA 0.25 |
| 40X Objective (LWD) (For Andor) | Nikon Instruments Inc. | MRD77410 | Water immersion; WD: 590-610 mm; NA 1.15 |
| Andor Spinning Disc Confocal microscope | Oxford Instruments, Andor | ||
| Nikon Eclipse Ts2 Phase Contrast Microscope | Nikon Instruments Inc. | Can be substituted with similar products | |
| TECAN Infinite M200 | TECAN | Can be substituted with similar products | |
| Other | |||
| Advanced PAP Pen | Millipore Sigma | Z672548 | 2 mm tip is recommended |
| Assembly kit with fixtures | SiMPore | USIM-JIGSET | Including fixure A1, A2, B1, and B2 |
| Camera Adapter for Microscopes | AmScope | CA-CAN-SLR Canon SLR / D-SLR | Φ23.2 - Φ30 adapter fits Nikon Eclipse Ts2 |
| Canon EOS Rebel SL3 DSLR Camera | Canon | EOS 250D, BH #CAEDRSL3B, MFR #3453C001 | Can be substituted with similar products |
| Cell strainer, 40 µm | Millipore Sigma (Corning) | CLS431750 | |
| Component 1 | SiMPore | USIM-C1 | |
| Component 2 | SiMPore | USIM-C2 | |
| Membrane chips | SiMPore | NPSN100-1L | Other chips formats are available |
| SMD handling tweezer double angle | Techni-Tool | 758TW003 | "Chip Tweezers" |
| Stainless steel precision type GG tweezer | Techni-Tool | 758TW534 | "Straight Tweezers" |
| Software | |||
| Fiji | ImageJ | For image processing | |
| Fusion | Oxford Instruments, Andor | Instructions for version 2.3.0.44 | |
| i-control | TECAN | Instructions for version 2.0 | |
| Imaris | Oxford Instruments | For image processing. Instructions for version 9.9.0 |
Références
- Villabona-Rueda, A., Erice, C., Pardo, C. A., Stins, M. F. The evolving concept of the blood brain barrier (BBB): from a single static barrier to a heterogeneous and dynamic relay center. Frontiers in Cellular Neuroscience. 13, 405 (2019).
- Nation, D. A., et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature Medicine. 25 (2), 270-276 (2019).
- Ferrari, C. C., Tarelli, R. Parkinson's disease and systemic inflammation. Parkinsons Disease. 116 (3), 436813 (2011).
- Koch, E. V., Ledwig, V., Bendas, S., Reichl, S., Dietzel, A. Tissue barrier-on-chip: a technology for reproducible practice in drug testing. Pharmaceutics. 14 (7), 1451 (2022).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
- Ortiz, G. G., et al. Role of the blood-brain barrier in multiple sclerosis. Archives of Medical Research. 45 (8), 687-697 (2014).
- Orhun, G., et al. Association between inflammatory markers and cognitive outcome in patients with acute brain dysfunction due to sepsis. Archives of Neuropsychiatry. 56 (1), 63-70 (2019).
- Chen, Y., Yang, W., Chen, F., Cui, L. COVID-19 and cognitive impairment: neuroinvasive and blood-brain barrier dysfunction. Journal of Neuroinflammation. 19 (1), 222 (2022).
- Hughes, C. G., et al. Endothelial activation and blood-brain barrier injury as risk factors for delirium in critically ill patients. Critical Care Medicine. 44 (9), e809-e817 (2016).
- Saraiva, C., et al. Nanoparticle-mediated brain drug delivery: Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of Control Release. 235 (10), 34-47 (2016).
- Jolliet-Riant, P., Tillement, J. P. Drug transfer across the blood-brain barrier and improvement of brain delivery. Fundamental & Clinical Pharmacology. 13 (1), 16-26 (1999).
- Abbott, N. J., et al. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2009).
- Siflinger-Birnboim, A., et al. Molecular sieving characteristics of the cultured endothelial monolayer. Journal of Cellular Physiology. 132 (1), 111-117 (1987).
- Bischoff, I., et al. Pitfalls in assessing microvascular endothelial barrier function: impedance-based devices versus the classic macromolecular tracer assay. Scientific Reports. 6, 23671 (2016).
- van der Helm, M. W., van der Meer, A. D., Eijkel, J. C., van den Berg, A., Segerink, L. I. Microfluidic organ-on-chip technology for blood-brain barrier research. Tissue Barriers. 4 (1), e1142493 (2016).
- Osaki, T., Shin, Y., Sivathanu, V., Campisi, M., Kamm, R. D. In vitro microfluidic models for neurodegenerative disorders. Advanced Healthcare Materials. 7 (2), (2018).
- Girard, S. D., et al. High and low permeability of human pluripotent stem cell-derived blood-brain barrier models depend on epithelial or endothelial features. FASEB Journal. 37 (2), e22770 (2023).
- Vigh, J. P., et al. Transendothelial electrical resistance measurement across the blood-brain barrier: a critical review of methods. Micromachines. 12 (6), 685 (2021).
- Lea, T., et al., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bioactives on Health: in vitro and ex vivo models. , (2015).
- Felix, K., Tobias, S., Jan, H., Nicolas, S., Michael, M. Measurements of transepithelial electrical resistance (TEER) are affected by junctional length in immature epithelial monolayers. Histochemistry and Cell Biology. 156 (6), 609-616 (2021).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Mossu, A., et al. A silicon nanomembrane platform for the visualization of immune cell trafficking across the human blood-brain barrier under flow. Journal of Cerebral Blood Flow and Metabolism. 39 (3), 395-410 (2019).
- Castro Dias, M., et al. Brain endothelial tricellular junctions as novel sites for T-cell diapedesis across the blood-brain barrier. Journal of Cell Science. 134 (8), jcs253880 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Khire, T. S., et al. Microvascular mimetics for the study of lukocyte-endothelial interactions. Cellular and Molecular Bioengineering. 13 (2), 125-139 (2020).
- Salminen, A. T., et al. Endothelial cell apicobasal polarity coordinates distinct responses to luminally versus abluminally delivered TNF-alpha in a microvascular mimetic. Integrative Biology: Quantitative Biosciences from Nano to Macro. 12 (11), 275-289 (2020).
- DesOrmeaux, J. P. S., et al. Nanoporous silicon nitride membranes fabricated from porous nanocrystalline silicon templates. Nanoscale. 6 (18), 10798-10805 (2014).
- Hill, K., et al. Second generation nanoporous silicon nitride membranes for high toxin clearance and small format hemodialysis. Advanced Healthcare Materials. 9 (4), e1900750 (2020).
- Salminen, A. T., et al. Ultrathin dual-scale nano- and microporous membranes for vascular transmigration models. Small. 15 (6), e1804111 (2019).
- Gillmer, S. R., et al. Predicting the failure of ultrathin porous membranes in bulge tests. Thin Solid Films. 631, 152-160 (2017).
- Ishimatsu, R., et al. Ion-selective permeability of ultrathin nanopore silicon membrane as studied using nanofabricated micropipet probes. Analytical Chemistry. 82 (17), 7127-7134 (2010).
- Kim, E., et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. Journal of American Chemical Society. 130 (13), 4230-4231 (2008).
- Snyder, J. L., et al. An experimental and theoretical analysis of molecular separations by diffusion through ultrathin nanoporous membranes. Journal of Membrane Science. 369 (1-2), 119-129 (2011).
- McCloskey, M. C., et al. The modular µSiM: a mass produced, rapidly assembled, and reconfigurable platform for the study of barrier tissue models in vitro. Advanced Healthcare Materials. 11 (18), e2200804 (2022).
- Mansouri, M., et al. The modular microSiM reconfigured: integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. 11 (21), e2200802 (2022).
- Su, S. -. H., et al. A tissue chip with integrated digital immunosensors: In situ brain endothelial barrier cytokine secretion monitoring. Biosensors and Bioelectronics. 224, 115030 (2023).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Gastfriend, B. D., Stebbins, M. J., Du, F., Shusta, E. V., Palecek, S. P. Differentiation of brain pericyte-like cells from human pluripotent stem cell-derived neural crest. Current Protocols. 1 (1), e21 (2021).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. FASEB Journal. 34 (12), 16693-16715 (2020).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- Bechmann, I., Galea, I., Perry, V. H. What is the blood-brain barrier (not). Trends in Immunology. 28 (1), 5-11 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon