Method Article
血液脳関門のモデル化のためのMicroSiM(μSiM)バリア組織プラットフォームの使用
要約
このレポートでは、血液脳関門モデルを構築するための μSiM プラットフォームでのアセンブリ、細胞培養、およびアッセイのプロトコルを提供します。
要約
microSiM(μSiM)は、血液脳関門(BBB)をモデル化するためのメンブレンベースの培養プラットフォームです。従来のメンブレンベースのプラットフォームとは異なり、μSiM は、生細胞イメージング、「血液」室と「脳」室間のパラクリンシグナル伝達の妨害なし、メンブレンの抽出/再マウントを必要とせずに免疫蛍光を直接イメージングする機能など、実験者に新しい機能を提供します。ここでは、極薄ナノ多孔質窒化ケイ素膜を用いて、BBBの単培養(内皮細胞)および共培養(内皮細胞および周皮細胞)モデルを確立するためのプラットフォームの基本的な使用法を示します。初代細胞培養とヒト人工多能性幹細胞(iPS細胞)培養の両方との適合性を実証しています。免疫蛍光染色によるBBBモデルの定性分析法を提供し、低分子透過性アッセイにおけるバリア機能の定量的評価に μSiM を使用することを実証します。提供される手法により、ユーザーはプラットフォーム上でバリアモデルを確立でき、ヒト組織を研究するための組織チップ技術の使用が促進されます。
概要
生体組織は、バリアを作成および維持し、どの細胞と分子があるコンパートメントから別のコンパートメントに輸送されるかを調節する特殊な細胞によって区画化されています。バリア機能の不適切な調節は、急性疾患と慢性疾患の両方の原因となる可能性があります。血液脳関門(BBB)は、人体で最も制限の厳しい組織関門です1。BBBの機能不全は、アルツハイマー病2、パーキンソン病3,4、多発性硬化症5,6など、中枢神経系(CNS)の幅広い疾患の根底にあります。BBBの損傷は、敗血症7、COVID-198、術後せん妄9などの急性疾患の結果としての長期的な認知障害にも関連しています。脳障害を治療する可能性のある薬剤の開発は、BBBを意図的に破って脳内の標的に生理活性分子を送達するという課題のために、苛立たしいほど困難でした10。これらの理由から、in vitroでBBB機能を研究する方法は、中枢神経系の疾患の理解と治療にとって最も重要です。
in vitroでバリア機能を測定するための基本的な方法は、半透膜上に単層または共培養を確立し、低分子拡散または小電流のいずれかに対して細胞によって付与される抵抗を測定することを含む11,12,13,14。微小生理学的システム(MPS)の出現により、BBBを3Dでモデル化するための豊富な選択肢が生まれましたが15,16、システム形状の多様性により、MPS間の透過性測定値や確立された文献値と比較することは困難です。信頼できるベースライン値の確立は、脳血管内皮細胞による広範なバリア制御のために、in vitro透過性値が高度に精査されるBBB研究において特に重要です12,17,18。これらの理由から、2Dメンブレン上に確立された単層間の透過性測定は、今後何年にもわたってBBB研究の定番であり続けるでしょう。これは、ベースライン透過性の絶対値が in vitro モデルを検証および比較するために使用されている上皮バリアを含む他の組織バリアにも当てはまります 19,20,21。
BBB研究コミュニティにとって価値のある新しいツールを確立することを目標に、過去5年間、バリア組織モデリングに使用するためのシリコンMエンベレーン(μSiM)プラットフォームを備えたマイクロデバイスを22と23,24,25,26に導入しました。このプラットフォームの実現可能な特徴は、数億個のナノポア27,28、またはナノポアとマイクロポアの混合物29を備えた超薄型(厚さ<100 nm)メンブレンです。自立型メンブレンチップは、300μmのシリコン「チップ」上に製造され、超薄型構造30を安定化し、デバイス組み立てのためにピンセットで取り扱うことを可能にする。その超薄型の性質のために、膜は、市販の膜培養装置で使用される従来のトラックエッチング膜よりも2桁高い透過性を有する31,32。実際には、これはナノポア(<60 nm)よりも小さい分子の拡散に対する膜の障害が無視できるほど小さいことを意味します33。したがって、細胞障壁については、細胞およびそれらが堆積するマトリックスのみが、膜34によって分離された頂端区画から基底区画への小分子輸送の速度を決定するであろう。また、デバイスの設計と膜の極薄性は、光学顕微鏡に多くの利点をもたらします。これらには、1)位相差または明視野イメージングを使用して生培養を追跡する能力、2)メンブレンを抽出してカバーガラスに転写する必要なく、その場で蛍光染色およびイメージングを行う能力、および3)メンブレンが共焦点の「スライス」よりも薄いため、直接共培養では、厚さ6〜10 μmのトラックエッチングメンブレンで達成できるよりも細胞タイプ間の間隔が自然であるという事実が含まれます。
最近では、迅速な組み立て34とカスタマイズ35,36を容易にするために、プラットフォームをモジュラー形式に進化させました。私たちは、モジュラー形式を活用して、バイオエンジニアリングと共同の脳関門ラボ間でデバイスコンポーネントを分散させました。その後、デバイスの組み立て、単培養と共培養、免疫蛍光染色、および低分子透過性のプロトコルを共同で開発し、これらの方法がラボ間で再現可能であることを示しました。また、これらのプロトコルを用いて、ヒト人工多能性幹細胞(iPS細胞)から脳微小血管様内皮細胞(BMEC)を作製するために、拡張内皮培養法(EECM)を用いて開発された検証済みのBBBを、モジュール式プラットフォームがサポートしていることも示しました37。本レポートの目的は、これらの方法をより詳細に検討し、付随するビデオの助けを借りて、BBBコミュニティにおけるプラットフォームのより広範な採用を促進することです。
プロトコル
1. μSiMデバイスの組み立て
メモ: この方法では、デバイスの組み立てについて説明します。メンブレンチップにはトレンチ側とフラットサイドがあり、トレンチアップまたはトレンチダウンで組み立てることができます。トレンチダウン装置は、細胞培養に最も一般的に使用されます。
- 無菌環境(バイオセーフティフードなど)で、組み立て治具、コンポーネント、メンブレンチップ、ピンセットなど、組み立て用のすべての材料を準備します。
- チップピンセットを使用して、メンブレンチップをフィクスチャーA1の中心に配置します。チップの平坦な面は下向きで、トレンチ領域はトレンチダウンデバイスの場合は上を向き、トレンチアップデバイスの場合は その逆です 。
注:以下の組み立て手順は、トレンチダウン装置を例にとって説明されており、これにより、上部チャンバー内の成長領域が平坦になります。 - コンポーネント 1 をチップに接着します。まず、まっすぐなピンセットを使用してコンポーネント1の両側にある青い保護層をはがし、上部チャンバーを下にして固定具A1に配置します。粘着剤(PSA)がチップに触れるまで、コンポーネント1をゆっくりと押し下げます。
- 治具A2を固定具A1に置き、さまざまなコーナーにしっかりと圧力をかけて、チップとコンポーネントがしっかりとフィットするようにします。
メモ:PSA層を外さないでください。これは、青い保護層に比べて透明で硬い層です。 - 部品2を部品1にチップで接着します。まず、部品2の片隅をまっすぐピンセットで掴み、シートから剥がして部品2を準備します。次に、コンポーネント2の非PSAの「三角形」領域をつかみ、コンポーネント2の厚くて透明な保護層と青色の層を一緒に取り外して、PSA表面を露出させます。コンポーネント 2 を PSA 側を上にして器具 B1 に置きます。
- メンブレンチップをフィクスチャーB1に置き、上部チャンバーを上に向けてコンポーネント1を配置します。
- フィクスチャ B2 をコンポーネント 1 に置き、フィクスチャ B2 のさまざまな角にしっかりと圧力をかけます。
- 組み立てたデバイスを固定具から取り出し、まっすぐなピンセットを使用してデバイスの下側の気泡を押し出し、チャネルx'の端を密閉し、膜領域との接触を避けます。細胞培養に使用する前に、新しく組み立てたデバイスを20分間紫外線(UV)滅菌します。
2. 細胞培養
注:この方法では、プラットフォーム上の初代培養およびiPS細胞由来培養のプロトコルについて説明します。この方法は、デバイスのトップチャンバーでの内皮細胞の単培養と、トレンチダウン組み立てデバイスの下部チャンバーでのペリサイトおよび内皮細胞とのペリサイトおよび内皮細胞の共培養について説明しています。チャンバーの寸法と容量については、 表1を参照してください。これらは最も一般的な形式です。ただし、ユーザーのニーズに応じて、他の細胞培養レイアウトを使用できます。
- 細胞培養チャンバーの準備
- セクション 1 で詳述されているプロトコルに従ってデバイスを組み立てます。
- デバイスを滅菌ホースクランプに入れます。細胞培養の前に、クランプをエタノールに≥20分間浸して滅菌します。各実験後に再滅菌して再利用します。
- 大きな滅菌ペトリ皿でデバイスを培養します。湿度を高めるには、滅菌水で満たされた小さなペトリ皿または50 mLの円錐形チューブ蓋を追加します。
- デバイスの上部チャンバーを100μLの滅菌水で2回洗浄します。ボトムチャンバーでの細胞培養の場合は、ボトムチャンバーを20 μLの滅菌水で洗浄します。
- hCMEC/D3細胞株(BBB)単培養
- セクション2.1に従って細胞培養チャンバーを準備します。
- リン酸緩衝生理食塩水(PBS)に混合した25 μg/cm 2のコラーゲンIと5 μg/cm2のヒトフィブロネクチンで上部チャンバーをコーティングします。37°Cで1〜2時間、または4°Cで一晩放置します。
- コーティング液を除去し、予熱した成長因子枯渇内皮培地(アッセイ培地)100 μLを上部チャンバーに、20 μLを下部チャンバーに加えます。アッセイ培地を調製するには、100 mLの内皮基礎培地+400 μLのヒト線維芽細胞増殖因子+40 μLのヒドロコルチゾン+100 μLの硫酸ゲンタマイシン+2 mLのウシ胎児血清を混合します。
- メーカーのプロトコルに従ってhCMEC / D3細胞を継代します。37°Cのインキュベーターで3〜5分間細胞をトリプシン化した後、予熱した内皮培地を添加してトリプシン化を停止します。細胞懸濁液を遠心チューブに移し、室温で200×gで5分間遠心分離します。細胞ペレットをアッセイ培地に再懸濁し、40,000〜60,000細胞/cm2の密度で上部チャンバーに細胞を播種します。デバイスを37°Cで5%二酸化炭素(CO 2)と2〜4時間インキュベートして、細胞接着を促進します。例えば、0.37 cm 2 チップで 40,000 cells/cm2 を達成するには、150,000 cells/mL の濃度の細胞溶液 100 μL をトップチャンバーに添加します。
注:細胞維持のために内皮増殖培地-2(EGM-2)の改変製剤を使用し、アッセイのために継代培養後に成長因子を減少させた「アッセイ培地」を使用して、Hudecz et al.38に従ってhCMEC/D3を培養および継代しました。他の培地製剤はデバイスと互換性があるはずですが、ユーザーがhCMEC/D3の生存に問題を経験する場合は、Hudecz et al.38 の培地製剤を推奨します。 - 細胞接着のために2〜4時間後、両方のチャンバーで新しいアッセイ培地と交換して、死んだ細胞または付着していない細胞を除去します。
- デバイスを5%CO2で37°Cに維持し、実験まで2〜3日ごとに両方のチャンバーでアッセイ培地を交換します。アッセイは通常、2週間の培養後に実施されます。
- iPS細胞由来EECM-BMEC様細胞単細胞培養
- セクション2.1に従って細胞培養チャンバーを準備します。
- ヒト胎盤溶液から、5 mgのコラーゲンIVに0.5 mg/mLの酢酸5 mLを加えて1 mg/mLの溶液を調製します。溶液を4°Cで≥4時間放置して、完全に再溶解させます。溶液は4°Cで2週間安定です。
- 上部チャンバーを 100 μL の 4:1:5 の比率のコラーゲン IV、ウシフィブロネクチン、および滅菌水でコーティングします。37°Cで2〜4時間コーティングします。
- コーティング液を除去し、室温hECSR100μLを上チャンバーに、20μLを下チャンバーに加えます。
- Nishihara et al.37によるEECM-BMEC様細胞の継代;細胞剥離酵素混合物を細胞に加え、37°Cのインキュベーターに5〜8分間移します。細胞溶液をピペットでつなぎ、単数化し、遠心チューブ内の内皮培地の体積を4倍に添加します。室温で200×gで5分間遠心分離する。細胞をhECSRに再懸濁し、40,000細胞/cm2の密度で上部チャンバーに播種します。デバイスを37°Cで5%CO2で2〜4時間インキュベートし、細胞の接着を促進します。例えば、40,000細胞/cm2を達成するには、150,000細胞/mLで100μLの細胞溶液を添加します。
- 細胞接着のために2〜4時間後、両方のチャンバーで新しいhECSRと交換して、死んだ細胞または付着していない細胞を除去します。
- デバイスを5%CO2で37°Cに維持し、実験まで1〜2日ごとに両方のチャンバーでhECSRを交換します。アッセイは通常、培養の6日目に実施されます。
- hCMEC/D3と初代ヒト脳血管周皮細胞(HBVP)の共培養
- デバイスを組み立てる前に、PBSに混合した2 μg/cm2 のポリ-L-リジン(PLL)でメンブレンチップをコーティングします。50〜80μLのPLLを液滴に含め、最終的なデバイスアセンブリで下向きになる側にのみ塗布します。コーティングプロセスは、37°Cで1〜2時間、または4°Cで一晩完了します。
- 塗工液を取り除きます。メンブレンチップを滅菌超純水で洗浄し、乾燥させます。
- 上記のセクション1で詳述したプロトコルに従って、PLLコーティングされた面を下に向けてデバイスを組み立て、セクション2.1に従って細胞培養チャンバーを準備します。
- セクション2.2.2に従ってトップチャンバーをコーティングします。
- 50 μLの予熱した周皮細胞培地を上部チャンバーに追加し、20 μLを下部チャネルに添加します。
- メーカーのプロトコルに従ってHBVPを通過させます。37°Cのインキュベーターで細胞を3〜5分間トリプシン化した後、予熱した周皮細胞培地を添加してトリプシン化を停止します。細胞懸濁液を遠心チューブに移し、室温で200 × g で5分間遠心分離します。細胞ペレットを周皮細胞培地に再懸濁し、14,000〜25,000細胞/cm2の密度で細胞を底室に播種します。デバイスを反転させますが、ガス交換を容易にするために上部チャンバーとの空気インターフェースを維持します。
注意: 反転中に必要なエアインターフェースは、デバイスをホースクランプ内に配置した後、反転させ、反転する前にすべての角を押し下げるか、上部チャンバーを遮らないように十分な間隔を空けてアクリルまたはシリコンの平行ストリップにデバイスを逆さまに置くことで実現できます。シード密度は、ユーザーごとに最適化する必要がある場合があります。14,000 cells/cm2 を達成するには、~590,000 cells/mL で 20 μL の細胞懸濁液を添加します。気泡を避けるために20 μLを底部チャンバーにピペットで注入しますが、密度は底部チャンバー容量10 μLを使用して計算されます。 - 細胞を37°Cで5%CO 2と逆さにした状態で2 〜4時間インキュベートし、細胞の接着を促進します。
- 細胞接着のために2〜4時間後、デバイスを直立させ、両方のチャンバーで新鮮な周皮細胞培地と交換して、死んだ細胞または付着していない細胞を除去します。
- 周皮細胞播種後、ステップ2.2.4-2.2.5に従って、hCMEC/D3を上部チャンバーに播種します。両方のチャンバーをアッセイ培地に切り替えます。
- デバイスを5%CO2で37°Cに維持し、実験まで1〜2日ごとに両方のチャンバーでアッセイ培地を交換します。初代細胞の共培養は、通常、アッセイの6〜8日前に維持されます。
注:HBVP単培養をhCMEC / D3単培養またはhCMEC / D3およびHBVP共培養と比較する場合は、HBVPを播種してから2〜3日後に周皮細胞培地をアッセイ培地と交換します。
- iPS細胞由来EECM-BMEC様細胞と脳周皮細胞様細胞(BPLC)の共培養
- セクション2.1に従って細胞培養チャンバーを準備し、ステップ2.3.2-2.3.3に従ってトップチャンバーをコーティングします。
- コーティング液を除去し、室温で50 μLのEssential 6 Medium + 10% Fetal Men Serum (E6 + 10% FBS)をトップチャンバーに加えます。
- Gastfriend et al.39によるBPLCの通過。細胞に細胞剥離酵素混合物を加え、細胞の~90%が丸くなるまで37°Cのインキュベーターに5〜15分間移します。細胞溶液をピペットで単数化し、40 μmのセルストレーナーを使用して50 mLの遠心分離チューブに4倍の量のDMEM/F12を加え、細胞をろ過して完全に単数化します。15mLの遠心チューブに移し、室温で200× g で5分間遠心分離し、細胞ペレットをE6 + 10%FBSに再懸濁し、14,000〜25,000細胞/cm2の密度で底室に細胞を播種する。装置を反転させますが、ガス交換を容易にするために、上部チャンバーとの空気インターフェースを維持します。
注意: 反転中に必要なエアインターフェースは、ホースクランプ内にデバイスを配置した後、デバイスをひっくり返し、反転する前にすべての角を押し下げるか、上部チャンバーが遮られないように十分な間隔を空けて、アクリルまたはシリコンの平行ストリップにデバイスを逆さまに置くことで実現できます。シード密度は、ユーザーごとに最適化する必要がある場合があります。14,000 cells/cm2 を達成するには、~590,000 cells/mL で 20 μL の細胞懸濁液を添加します。気泡を避けるために20 μLを底部チャンバーにピペットで注入しますが、密度は底部チャンバー容量10 μLを使用して計算されます。 - 細胞を37°Cで5%CO 2と逆さにした状態で2 〜4時間インキュベートし、細胞の接着を促進します。
- 細胞接着のために2〜4時間後、デバイスを直立させ、両方のチャンバーで新しいE6 + 10%FBSと交換して、死んだ細胞または付着していない細胞を除去します。
- 周皮細胞播種の1日後、ステップ2.3.5-2.3.6に従って、EECM-BMEC様細胞を上部チャンバーに播種します。両方のチャンバーをhECSRに切り替えます。
- デバイスを5%CO2で37°Cに維持し、実験まで1〜2日ごとに両方のチャンバーでアッセイ培地を交換します。ヒトiPS細胞由来の共培養は、通常、BPLCでは7日間、EECM-BMEC様細胞では6日間維持されます。
注:BPLC単培養をEECM-BMEC単培養またはEECM-BMECおよびBPLC共培養と比較する場合は、BPLCを播種してから1日後にE6 + 10%FBSをhECSRと交換します。
3. 免疫細胞化学
注:この方法は、膜の上面および/または下面で培養した細胞の免疫細胞化学的染色およびイメージングのためのプロトコルを説明しています。この実験の目的は、アドヘレンやタイトジャンクションタンパク質、細胞同一性タンパク質など、BBBに存在するはずの重要なタンパク質の存在と位置を決定することです。代替染色法と生染色法もプラットホームと互換性があります。
- デバイスの固定と染色
- 一次抗体を氷上に置いて解凍します。
- 室温で4%パラホルムアルデヒド(PFA)溶液を調製するか(例:16%PFAをPBSの3倍の容量で希釈)、100%メタノールを-20°Cで冷却します。
- 表 2 に従って適切なブロッキング溶液を作成します。氷の上に保管してください。
注意:Triton X-100を完全に溶解するには、溶液のボルテックスが必要な場合があります。 - 20 μLの固定液(PFAやメタノールなど)を下部チャンバーに、50 μLを上部チャンバーにピペッティングして細胞を固定します。デバイスを室温で10分間(PFA)または2分間(メタノール)インキュベートします。
- 20 μL の PBS をボトムチャンバーに、100 μL をトップチャンバーにピペッティングして、5 分間 x 3 分間洗浄します。
- 底チャンバーにブロッキング溶液20 μLを、上部チャンバーにブロッキング溶液50 μLを加えて、室温で30分間ブロッキングします。底部チャンバーに気泡がないか確認してください。
- 表2に従って、抗体をブロッキング溶液で希釈して一次抗体溶液を調製します。氷の上に保管してください。
- 一次抗体溶液20 μLをボトムチャンバーに添加し、トップチャンバーの容量を50 μLの一次抗体溶液に置き換えて、一次抗体で染色します。底部チャンバーに気泡がないか確認してください。室温で1時間、または4°Cで一晩インキュベートします。
- 20 μL の PBS をボトムチャンバーに、100 μL をトップチャンバーにピペッティングして、5 分間 x 3 分間洗浄します。
- 抗体を表2に従ってブロッキング溶液で希釈して二次抗体溶液を調製する。光から保護された氷の上に保管してください。
- 20 μLの二次抗体溶液をボトムチャンバーに添加し、トップチャンバーの容量を50 μLの二次抗体溶液に置き換えて、二次抗体で染色します。底部チャンバーに気泡がないか確認してください。光から保護された室温で1時間インキュベートします。
- 20 μL の PBS をボトムチャンバーに、100 μL をトップチャンバーにピペッティングして、5 分間 x 3 分間洗浄します。
- 核染色液を作ります。Hoechst 1:10,000 を PBS で希釈します。20 μLの核染色溶液を下部チャンバーに加え、上部チャンバーの容量を50 μLの核染色溶液と交換します。底部チャンバーに気泡がないか確認してください。光から保護された室温で3分間インキュベートします。
- 底部チャンバーに20 μLのPBSを添加し、上部チャンバーの容量を100 μLのPBSに置き換えて、染色物を除去します。デバイスをすぐに画像化するか、ペトリ皿をパラフィルムで包み、イメージングの準備が整うまで光から保護して4°Cで保管してください。
- 共焦点イメージング
注:このセクションでは、例として、長作動距離(LWD)40倍対物レンズ(水、WD 590-610、開口数1.15)を備えた倒立回転ディスク共焦点顕微鏡を使用したデバイスのイメージングについて説明します。作動距離とレンズの互換性については、McCloskey et al.34 の補足資料を参照してください。膜領域全体の画像も10倍の対物レンズを使用して撮影され、40倍の画像がフィールド全体を表すようにします。これらは通常、広視野で撮影されます。- 顕微鏡の電源を入れ、イメージングソフトウェアを開きます。
- 二次抗体と核染色の特性に応じて、 共焦点イメージングモードを使用してチャンネルを設定します。レーザー出力と露光時間を最適化して、信号がバックグラウンドより上になるようにし、イメージングアーチファクトを低減します。
- ヘキスト核染色には、励起405、発光450/50バンドパス(BP)、露光時間500ms、レーザー出力50%を使用します。Alexa Fluor(AF)488に結合した二次抗体を用いた標識には、励起488、発光525/50BP、露光時間500ms、レーザー出力50%を使用します。AF568に結合した二次抗体を用いた標識には、励起561、発光600/50BP、露光時間500ms、レーザー出力100%を使用します。
- デバイスを顕微鏡スライドデバイスホルダーに置き、上部チャンバーを上に向けて、顕微鏡スライドホルダーを使用して顕微鏡にセットします。 Live をオンにして、核染色のチャンネルを選択します。光は青色の固体シリコーン領域を透過しないため、透明な窒化ケイ素膜領域が中央にあることを確認して、低い対物レンズを使用して膜を見つけます。デバイスが適切にセンタリングされ、細胞層が見つかったら、40倍対物レンズに切り替え、対物レンズを湿潤させ、核染色をガイドとして使用して膜領域に焦点を合わせます。
- z-stackイメージングをオンにし、スキャンモードを開始/終了に設定します。ステップサイズまたはステップ数を設定します。顕微鏡の粗調整ノブを使用して、核染色をガイドとして使用してスキャン開始を内皮細胞層の上部に設定し、核染色をガイドとして使用して周皮細胞層の下部にスキャン終了を設定します。すべてのチャンネルをチェックして、すべてがイメージングフィールドでキャプチャされることを確認します。
注:通常、~0.2μmのスライスである自動ステップを使用します。 - Image Nameを設定し、 Acquire を押してイメージングを開始します。必要に応じて、異なる領域で繰り返します。
- ImageJ40 または Imaris を使用して共焦点画像を処理します。
- Imarisで処理するには、画像ファイルをプログラムにドラッグして開きます。上部のメニューバーで [断面 ]を選択すると、x-y平面の2D画像と、x-z平面とy-z平面の対応するビューが表示されます。上部のメニューバーで[3Dビュー]を選択して、 3D 画像を表示します。画像をクリックしてドラッグし、回転させます。上部のメニューバーで[ スナップショット ]を選択して、画像を撮影します。
4. 低分子透過性のサンプリングアッセイ
注:このセクションでは、細胞培養のバリア特性を定量的に測定するための方法論について説明します。この実験の目的は、細胞層を通過してプラットフォームの底部チャンバーに入る蛍光小分子の濃度を検出することです。次に、これらのデータを使用して細胞透過性を計算します。
- サンプリング技術
- セクション1で詳述したプロトコルに従ってデバイスを組み立て、セクション2で説明したように目的の細胞株を培養します。システムの透過性を測定するために、無細胞のコーティングされた制御装置として機能する追加のデバイスを含めます。
注: 条件ごとに最低 3 つのテクニカル レプリケートが推奨されます。ただし、コートされたコントロールの複製は 1 回のみ必要です。 - サンプリングアッセイを開始する前に、底部チャンバーの培地を新しい培地と交換してください。各デバイスの内皮単層のコンフルエント度を顕微鏡で確認します。細胞単層に隙間があると、底部チャンバーへの色素の拡散に影響するため、注意してください。
注:健康な内皮培養物は100%コンフルエントでなければなりません。 - 蛍光低分子溶液(例:150 μg/mL Lucifer Yellow、457 Da)を細胞培養培地で調製します。ボトムチャンネルからサンプリングした蛍光低分子の濃度を計算するための基準となる標準溶液の調製に使用する蛍光低分子溶液を過剰に調製します。
注:蛍光低分子の濃度が最も高い標準溶液として使用するために、400 μLの過剰溶液を調製することをお勧めします。 - 上部ウェルの培地を100 μLの蛍光低分子溶液と交換します。
注意: 疎水性ペンを使用してサンプリングポートの周囲に円を描き、疎水性インクが完全に乾くまで待ってから蛍光染料溶液を追加することをお勧めします。これにより、ステップ4.1.7でサンプリングポートの周りの下部チャネルから媒体が広がるのを防ぎます。蛍光低分子溶液を上部にずらして2分間待ってから次のデバイスに追加するか、3つのグループで作業することをお勧めします(溶液を3つのデバイスに同時に追加し、5分間待って次の3つのデバイスを追加する)。 - デバイスを37°C、5%CO2 で1時間インキュベートします。
- 前のステップでの1時間のインキュベーション中に、ステップ4.1.3で調製した蛍光低分子溶液から2倍段階希釈を行い、標準溶液を調製します。各溶液50 μLを平底の黒色96ウェルプレートに3回に分けてピペットで入れます。ブランク細胞培養培地をベースライン標準液として使用します。
注:標準溶液を調製するには、最終容量200 μLで11段階希釈し、細胞培養培地をブランクとして使用してベースラインの蛍光強度を測定することをお勧めします。- ステップ4.1.3で調製した過剰な蛍光低分子溶液400μLのうち200μLを培地200μLのチューブに移し、よく混合し、この溶液200μLを培地200μLの入った次のチューブに移す。合計10本のチューブになるまで、1:2の希釈を繰り返します。50 μL の最も濃度の高い標準溶液を 96 ウェルプレートのカラム 1 に 3 回に分けてピペットで移し(B1、C1、D1)、2番目に 濃度の高い溶液をカラム 2(B2、C2、D2)にピペットでつなぎます。プレートの12番目の カラムに、50 μLのブランク培地を3回に分けてピペット(B12、C12、D12)します。
- 以下のステップを実行して、下部チャネルから蛍光低分子溶液をサンプリングします。
- 蛍光性低分子溶液をウェルから取り出して、拡散プロセスを停止します。
- 培地50 μLのチップをポートに挿入し、デバイスを持ち上げ、上部を押さえながらチップを静かに排出して安定させ、リザーバーとして機能するように上部ポートに配置します。デバイスを置きます。サンプリング中に底部チャンバーに気泡が入らないように、ピペットの先端に気泡やピペットの先端に空気がないことを確認してください。
- サンプリング中の細胞単層の破壊を防ぐために、50 μLの培地を上部ウェルに添加します。
- ボトムチャンネルから溶液をサンプリングするには、ピペットチップが空のピペッターを最初の抵抗まで押し込み、チップをサンプリングポートに挿入し、ボトムチャンネルから50 μLの溶液を逆ピペッティングします。標準溶液を含む平底の黒色の 96 ウェルプレートに直接移します。
注:サンプリング後すぐに顕微鏡で細胞単層を確認することをお勧めします。下部のチャネルから培地を採取すると、上部ウェルの細胞層が破壊され、透過性測定に一貫性がなくなることがあります。4.1.7 の手順で迅速に作業することで、これを防ぐことができます。
- 使用する蛍光低分子の適切な励起波長および発光波長パラメータを使用して、マイクロプレートリーダーで蛍光強度を測定します。Lucifer Yellowには、428 nmの励起と536 nmの発光を使用し、最適なゲインを実現します。蛍光はプレートの上部から測定されます。プレートをプレートリーダーに追加し、サンプル(検量線を含む)を含むウェルをハイライトし、 開始 を選択してプレートを読み取ります。
- セクション1で詳述したプロトコルに従ってデバイスを組み立て、セクション2で説明したように目的の細胞株を培養します。システムの透過性を測定するために、無細胞のコーティングされた制御装置として機能する追加のデバイスを含めます。
- 透磁率値の計算(テンプレートについては 補足ファイル1 を参照)
- 測定したすべての蛍光強度値から、ブランク培地の平均蛍光強度値を差し引きます。
- 式 (1) を使用して、システムの透磁率 Ps を計算します。
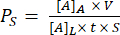 (1)
(1)
ここで、[A]A は底流路から採取した蛍光低分子の濃度、V はサンプリングしてプレートに添加した容量(0.050 mL)、 [A]L は上部ウェルに添加した蛍光低分子の濃度(例:0.15 mg/mL)、t はインキュベーション時間(所望の単位に応じて s または分)、 Sは膜表面積(0.014 cm2)です。- 蛍光強度の出力と標準溶液の既知の濃度から検量線をプロットして得られた式を使用して、[A]A を計算します。蛍光強度値(y)を式に挿入して、実験サンプルの濃度(x)を計算します。
注:検量線の線形部分を使用してください。膜面積はロット番号によって異なる場合があり、コーティングされたコントロールと異なる場合、計算された透過率値に大きな影響を与える可能性があるため、顕微鏡で撮影した膜の画像から膜表面積を測定することをお勧めします。
- 蛍光強度の出力と標準溶液の既知の濃度から検量線をプロットして得られた式を使用して、[A]A を計算します。蛍光強度値(y)を式に挿入して、実験サンプルの濃度(x)を計算します。
- 式(2)を使用して、セル単層PEの透磁率を計算します。
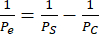 (2)
(2)
ここで、PSは、ステップ4.2.2で計算されたシステム透磁率であり、PCは、無細胞、コーティングされた制御装置のシステム透磁率の値である。
結果
トレンチダウン装置の組み立てを 図1に示します。固定具は、コンポーネントとメンブレンチップの組み立てをガイドします。コンポーネント 1 は主にアクリル製で、チップに接着するための PSA 表面と、底部チャンバーへの開口部と底部チャンバーへのピペットアクセス用のポートを備えています。コンポーネント 2 はチャネル層で、右上にグリップ用の非粘着性で PSA フリーの「三角形」が含まれています。トレンチダウン装置は上部チャンバーに平坦な細胞培養増殖領域を提供しますが、トレンチアップ装置は下部チャンバーに細胞培養用の平らな表面を備えています。
hCMEC/D3とHBVP、iPS細胞IMR90-4由来EECM-BMEC様細胞とBPLCの内皮単培養と共培養を行い、ニコンエクリプスTs2位相差顕微鏡と10倍対物レンズを用いて位相画像を取得しました(図2)。初代細胞培養に最適な播種密度(播種後1日で撮影した画像)と、播種不足のHBVPを示しています(図2A)。最終的な共培養と単培養の段階の画像(6日間の内皮細胞培養)を区別することは困難であり(図2C)、初代細胞の共培養が成功したことを確認するには、免疫蛍光染色が必要になる場合があります(プロトコルセクション3を参照)。また、iPS細胞由来のBPLCシード密度の低さ、高値、最適な濃度も示されています(図2B)。ヒトiPS細胞由来の共培養は、初代共培養と比較して、位相差イメージングでより明確に区別できます(図2D)。BPLCの播種が少ないと、周皮細胞の被覆が悪くなり、周皮細胞が凝集し、オーバーシードすると周皮皮膜が剥がれてしまいます。さらに、ボトムチャンバー内の培地交換が速すぎると、これらの細胞はせん断に対して非常に敏感であるため、周皮細胞の損失につながる可能性があります。周皮細胞による最適な被覆率は、BBBモデルで~90%であり、内皮層に隙間はありません。
免疫染色したヒトiPS細胞由来の共培養の代表的な画像を 図3 (6日間の内皮細胞培養)に示します。IMR90-4由来のBPLCを周皮細胞マーカーPDGFRβについて染色し、IMR90-4由来のEECM-BMEC様細胞を接着器ジャンクションマーカーVE-cadherinについて染色しました。ヘキストは核の染色に使用されました。画像は、0.2 μmスライスの40倍LWD対物レンズを使用してスピニングディスク共焦点顕微鏡で取得し、Imarisで処理しました。薄いナノ膜が見えなくても、両方の細胞層を可視化することができます。
我々は、結果の実験室間の再現性を実証するために、物理的に離れたスイスのベルン大学と米国ニューヨーク州のロチェスター大学の2つの研究室で、同じ実験条件を用いてサンプリングベースの低分子透過性アッセイを実施しました(図4)34。iPS細胞IMR90-4由来EECM-BMEC様細胞をμSiMデバイスで2、4、または6日間培養し、トランズウェルフィルターで6日間培養しました。アッセイは、両方のラボで 150 μg/mL の Lucifer Yellow(457 Da)を使用して行いました。装置内で2日間培養した内皮細胞の透過性のばらつきが大きいということは、2日間の培養ではバリア成熟が不十分であったことを示している。バリア成熟時(4日後)のラボ間の透過性に有意差はありませんでした。また、μSiMとトランズウェルフィルターで6日間培養した内皮細胞の透過性が、以前に発表された40の透過性と一致することを示しました。
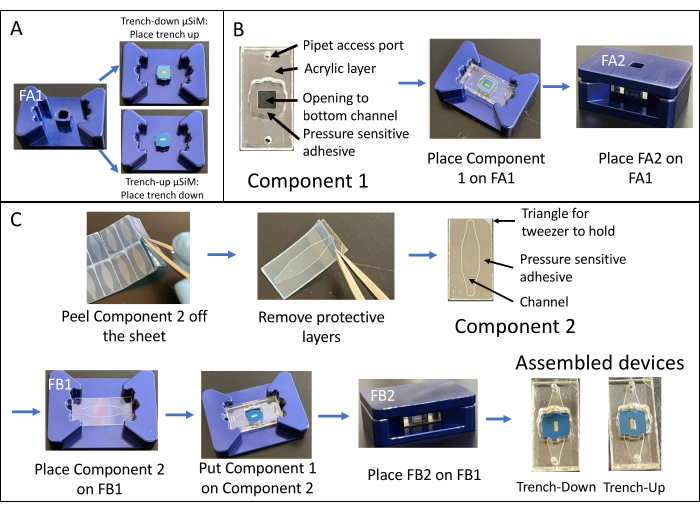
図1:μSiMの組み立て手順 。 (A)チップを治具A1に置いて準備します。チップトレンチを上にして、最終的なトレンチダウンデバイスを作成します。チップトレンチを下にして、最終的なトレンチアップ装置にします。(B)コンポーネント1から保護マスクを取り外し、FA1に裏向きに置いて、コンポーネント1をチップに接着します。治具A2で圧力をかけて接着します。(C)シートから成分2を剥がし、上部の保護層を剥がして、成分2と成分1を接着します。チャネルを上向きに器具 B1 に置き、コンポーネント 1 をコンポーネント 2 の上に上向きに置きます。治具B2で圧力をかけて接着します。略語: FAn = fixture An;FBn = フィクスチャ Bn. この図の拡大版をご覧になるには、ここをクリックしてください。
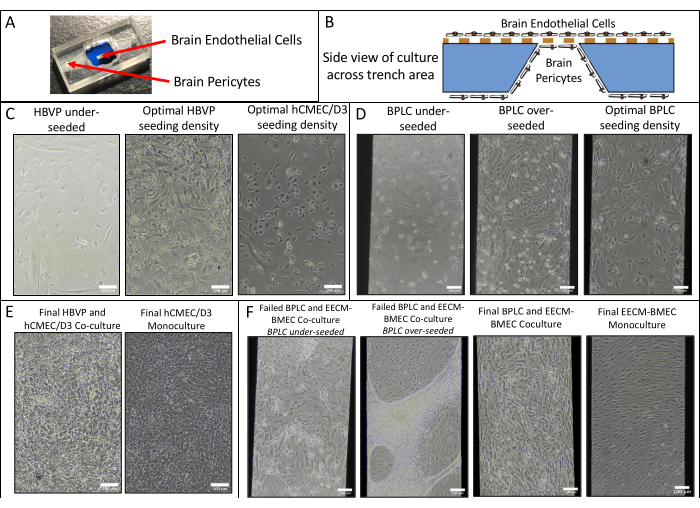
図2:共培養の模式図と、装置での細胞培養の代表的な位相差画像。 (A)周皮細胞および内皮細胞播種の位置。(B)メンブレンチップのトレンチを横切る細胞位置の側面図。(C)初代HBVPおよびhCMEC/D3脳内皮細胞株の低播種密度と最適播種密度の代表的な画像。画像は播種1日後(HBVP)および播種2時間後(hCMEC/D3)に取得しました。(D)iPS細胞由来脳周皮細胞様細胞の低播種密度、高播種密度、最適播種密度の代表画像。画像は播種の1日後に取得しました。(E)HBVPとhCMEC/D3の共培養とhCMEC/D3の単培養の代表画像。画像は、HBVPシーディングの8日後、hCMEC/D3シーディングの7日後に取得しました。(F)BPLCとEECM-BMEC様細胞の共培養とEECM-BMEC様細胞の共培養の失敗と成功の代表的な画像。画像は、BPLCシーシングの7日後、EECM-BMECシーディングの6日後に取得しました。播種不足の BPLC 培養物は十分な被覆率が得られませんが、播種過播した BPLC 培養物は過剰にコンフルエントに成長し、凝集/後退し始めます。スケールバー = 100 μm (C-F)。略語:HBVP =ヒト脳血管周皮細胞;ヒト人工多能性幹細胞 = ヒト人工多能性幹細胞;BPLC = ヒトiPS細胞由来の脳周皮細胞様細胞。この図の拡大版をご覧になるには、ここをクリックしてください。
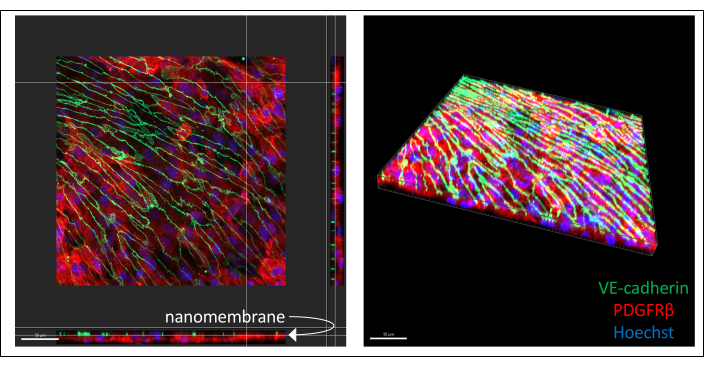
図3:免疫染色したiPS細胞由来細胞をデバイス内で共培養した代表画像。 細胞を内皮細胞マーカーVE-cadherin(緑)、周皮細胞マーカーPDGFRβ(赤)、および核染色(青)で染色しました。2つの細胞層が近接して見られ、薄い窒化ケイ素ナノメンブレンによってのみ分離されています(左の画像の白い矢印はメンブレンの位置を示しています)。スケールバー = 50 μm。略語:iPS細胞=ヒト人工多能性幹細胞;PDGFRβ = 血小板由来成長因子受容体ベータ。 この図の拡大版をご覧になるには、ここをクリックしてください。
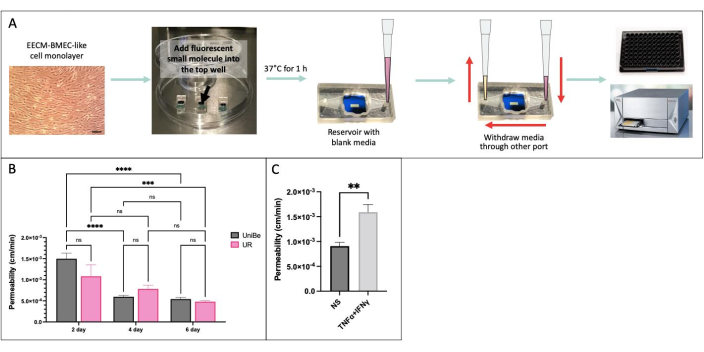
図4:サンプリングベースの低分子透過性アッセイ 。 (A)実験ワークフローの概略図。(B)スイスのベルン大学(UniBe)と米国ニューヨーク州ロチェスター大学(UR)の物理的に離れた2つの研究室間の実験室間再現性の実証:ヒトiPS細胞由来の内皮細胞をμSiMデバイスで2、4、または6日間培養し、トランズウェルフィルターで6日間培養しました。透過性アッセイは、150 μg/mL Lucifer Yellow(457 Da)を使用して行いました。赤色のバーは、トランズウェルフィルター40で6日間培養した同じiPS細胞由来内皮細胞のフルオレセインナトリウム(376Da)透過性データを示す。N = グループあたり 4-16。テューキーの事後検定による二元配置分散分析を使用し、比較は関連するp<0.05についてのみ表示しました。 (C) μSiMで2日間培養したiPS細胞由来EECM-BMEC様細胞を用いたサイトカイン応答の実証。0.1 ng/mL TNFα + 2 IU/mL IFNγ)または培地コントロール(非刺激、NS)をトップチャンバーに 20 時間添加してから、150 μg/mL Lucifer Yellow を使用した透過性アッセイを行いました。N = グループあたり 3。スチューデントの t検定、p < 0.05。 この図の拡大版をご覧になるには、ここをクリックしてください。
| トップチャンバー播種表面積 | トップウェルボリューム | ボトムチャンバー播種表面積 | ボトムチャンネルボリューム |
| ~37のmm2 | 100 μL(≥115 μLを保持可能) | ~42のmm2 | 10 μL (気泡を避けるためピペット 20 μL) |
表1:臨界μSiM表面積と体積。
| ターゲット | 固定 | ブロッキングソリューション | 希釈 |
| VE-カドヘリン | 4% PFAまたは100% MeOH | 5% GS + 0.4% Tx-100 または 10% GS + 0.3% Triton X-100 | 1:50 |
| CD31の | 4% PFAまたは100% MeOH | 5%GS + 0.3-0.4%トリトンX-100 | 1:100 |
| Claudin-5 (クローディン 5) | 100%MeOH | 5-10% GS + 0.3% トリトン X-100 | 1:200 |
| ZO-1 (ゾワン) | 100%MeOH | 5-10% GS + 0.3% トリトン X-100 | 1:200 |
| オクルージン | 100%MeOH | 5-10% GS + 0.3% トリトン X-100 | 1:50 |
| PDGFRβ | 4%のPFA | GS 5% + Triton X-100 0.4% | 1:100 |
| NG2の | 4%のPFA | GS 5% + Triton X-100 0.4% | 1:100 |
| ヤギαマウス IgG Alexa Fluor 488 | 1:200 | ||
| ヤギαマウスIgG Alexa Fluor 568 | 1:200 |
表2:μSiMデバイスにおける共培養免疫細胞化学で検証された抗体および染色法。 略語:PFA =パラホルムアルデヒド;MeOH =メタノール;GS = ヤギ血清。
補足ファイル1:透磁率値計算用テンプレートこのファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
メンブレンチップは安定性を重視して設計されていますが、組み立て時に取り扱いを誤ると、ひび割れや破損の原因となります。したがって、チップピンセットの切り欠きでチップをつかみ、固定具にそっと置くことが重要です。一般的にデバイスを取り扱うときは、デバイスをぶつけたり落としたりしないように特別な注意を払う必要があります。メンブレンチップをフィクスチャーA1に接着する際、チップを平らに置き、フィクスチャーA1のピラーの中央に配置して、コンポーネント1への接着中にメンブレンの亀裂が発生しないようにする必要があります。さらに、保護マスクを取り外した後は、露出したPSA層との接触を避ける必要があります。保護マスクを取り外した後にコンポーネント2を取り扱うときは、コンポーネントの端に沿って保持し、ピンセットを使用してPSAフリーの三角形の角をつかむことをお勧めします。
細胞培養プロトコルは可能なBBBモデルについて説明されていますが、ここで説明するBBBのBMEC/周皮細胞共培養モデルは、生理学的状況と関心のある質問に応じて十分または不十分である可能性があります。例えば、免疫細胞の輸送は、主に脳の毛細血管後細静脈で起こる41,42。これらの領域では、血管周囲腔がBMEC/ペリサイトバリアをアストロサイトによって確立されたグリアリミタンスから分離します。したがって、毛細血管後細静脈では、神経血管ユニット(NVU)は物理的に分離された2つの直列のバリアで構成されており、アストロサイトの末端足はBMEC/ペリサイト血液関門に直接接触しません。目標がアストロサイト分泌因子が血液関門に与える影響を説明するNVUモデルである場合、血管周囲腔を介した可溶性因子交換を可能にするアストロサイトコンパートメントをデバイスに追加できます。この例は、以前に図示され34、3D「脳」区画内のミクログリアおよびニューロンなどの他の細胞を含むように拡張することができる。プラットフォームのモジュラーアーキテクチャにより、シンプルな組み立て戦略を使用してこれらの再構成を実現できるため、プラットフォームは、手元の仮説に対処するために必要なだけシンプルまたは複雑になります。各細胞培養セットアップ;ただし、新しい細胞株や多培養用に最適化する必要があります。例えば、窒化ケイ素膜の特性上、組織培養プレートに比べてコーティング液の調整が必要な場合があります。フィブロネクチンの含有は、通常、細胞の接着と生存を助けます。さらに、ユーザーは内皮細胞と周皮細胞を逆方向に培養することができます。この場合、例えば、透磁率測定の方法や解釈の仕方を変更する必要があるかもしれません。ただし、この種のカルチャの手順を説明することは、このホワイト ペーパーの範囲を超えています。
細胞培養中に遭遇する可能性のあるもう一つの課題は、標準的な組織培養プレートやフラスコと比較して、環境の変化に対してより敏感であるため、培地の迅速な蒸発です。過剰な蒸発が見られたり、細胞増殖が遅くなったりした場合は、正確な設定を確保するために、すべての重要なインキュベーターパラメーターを測定する必要があります。細胞培養チャンバー内に置かれたティッシュキャップや小さなシャーレに水を追加するか、培地をより頻繁に交換する必要があります。さらに、気泡が底部の溝に入り、トレンチダウン装置のトレンチに詰まる可能性があります。それらは削除できますが、そもそも泡を追加しないようにするのが最も簡単です。そのためには、培地をボトムチャンバーにピペッティングする前に、ピペットチップに気泡やピペットチップの端に空気がないことを確認することが重要です。さらに、チャネル内の媒体の蒸発は、媒体表面とポート上部との間に隙間を生じさせる可能性がある。少量の培地を1つのポートにピペッティングし、反対側のポートの表面に到達するまでピペッティングし、その後、反対側のポートで培地を交換できます。hECSRおよびE6 + 10% FBS培地はウォーターバスで温めないでくださいが、他の培地を予熱して気泡の形成を減らすことができます。気泡が底部チャンバーに入った場合は、チャネルから100 μLをすばやくピペッティングすることで除去できます。ただし、この方法では、チャンバー間の汚染やメディアがデバイスの表面にこぼれる可能性があります。また、細胞層を破壊する可能性もあります。あるいは、培地を最初にチャネルから除去し、次に50 μLの容量で再導入することもできます。ただし、最初にメディアを取り外すと、チャネル内の気泡の形成が多くなる可能性があります。気泡が膜領域の真下にない場合は、細胞培養に影響を与えずにチャネルに残すことができます。
図2に示されているように、周皮細胞の接着と増殖は困難な場合があります。最適化された播種密度を使用することは、生理学的に適切な周皮細胞と内皮細胞の比率を持つ層の形成に不可欠です。さらに、周皮細胞はせん断に敏感であるため、チャネル内のすべての培地交換は、細胞を保護するために非常にゆっくりと行う必要があります。BPLC培養では、800 μg/mLのIV型コラーゲンまたは100 μg/mLのフィブロネクチンでボトムチャンバーをコーティングすることで、接着性を向上させることができます。
ここで説明するデバイスの免疫細胞化学により、細胞の健康状態と機能の定性分析が可能になります。組織培養プレートまたは他のプラットホームでの染色方法は、プラットホームに直接変換できる必要があります。上部チャンバーのみでの細胞培養の場合、固定後、PBSを下部チャンバーに添加し、残りのステップに残し、ブロッキングと染色は上部チャンバーでのみ行うことができます。これにより、メンブレンが破れたり、底部チャンバーに気泡が入ったりするリスクが最小限に抑えられます。共培養染色では、すべてのステップで両方のチャンバーを使用することをお勧めします。固定液とPBSの粘度は培地の粘度とは異なることに注意することが重要です。したがって、ボトムチャンバーに気泡を追加する方が簡単であり、ボトムチャンバーにピペッティングする前に、チップの端に空気が入っていないかピペットチップをチェックするように特に注意する必要があります。
低分子透過性アッセイについて記載されたプロトコルは、μSiMデバイスで培養された内皮細胞のバリア機能の機能的および定量的評価を可能にします。このアッセイ中に発生する可能性のある問題の 1 つは、プロトコルステップ 4.1.7.4 で下部チャネルからサンプルを採取する際に気泡をピペットに引き込むことです。この問題を回避するには、サンプル採取を開始する前にチップがポートに密閉されていることを確認し、サンプルの吸出が速すぎないようにすることが重要です。それでも問題が解決しない場合は、使用するチップのサイズが小さすぎるか大きすぎてポートに収まらない可能性があります。 材料表に記載されているヒントを使用してください。健康そうに見えるコンフルエント単分子膜にもかかわらず、予想外に高い透過性値が測定された場合は、サンプル収集中に単分子膜の完全性に破壊がないかチェックする必要があります。単分子膜は、採取後すぐに顕微鏡で確認することをお勧めします。単層がまだ無傷で健康であると思われる場合は、サンプルを固定し、例えば接合部タンパク質の免疫染色によってバリア機能の生物学的マーカーを評価することができます。逆に、予想外に低い透過性値が測定された場合は、気泡のない底流路から50 μLの培地をサンプリングすることが重要です。リザーバーチップを装着するとすぐに培地がサンプリングポートから出てくる場合は、底部チャネルからサンプリングした最初の10 μLの容量に蛍光低分子のほとんどが存在するため、ピペットをサンプリングポートに取り付ける前に培地を回収する必要があります。疎水性ペンを使用してポートの周囲に円を描いたり、ポートの周囲に穴を開けた疎水性テープを貼ったりすることで、受動的にポンプで送られた媒体が広がるのを防ぐことができます。サンプリング中に気泡が排出された場合、または50 μLのサンプルを完全に除去しない場合は、サンプルを使用しないでください。あるいは、正確な体積を決定し、透磁率の計算に使用することもできます。ただし、これは除去された容量が≥40μLの場合にのみ行う必要があり、これは98~99%の色素回収率に相当します34。
開示事項
J.L.M.はSiMPoreの共同設立者であり、同社の株式を保有しています。SiMPoreは、本研究で用いた膜を含む超薄膜シリコンベースの技術を商品化しています。
謝辞
J.L.M.、B.E.、T.R.G.、M.C.M.、P.K.、M.T.、K.C.、およびL.W.は、NIHの助成金R33 HL154249によって資金提供されました。J.L.M.はR44 GM137651から資金提供を受けました。M.M.は、ロチェスター大学デルモンテ神経科学研究所のSchmidt Program Awardから資金提供を受けました。M.T.はRF1 AG079138から資金提供を受けました。K.C.は、International Foundation for Ethical Researchから資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| CD31 Polyclonal antibody | Thermo Fisher Scientific | PA5-32321 | |
| Claudin-5 mouse IgG antibody, 4C3C2 | Thermo Fisher Scientific | 35-2500 | |
| Goat α-Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | |
| Goat α-Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| NG2, mouse IgG2a, 9.2.27 | Millipore | MAB2029 | |
| Occludin mouse IgG antibody, OC-3F10 | Thermo Fisher Scientific | 33-1500 | |
| PDGFRβ, rabbit IgG antibody, 28E1 | Cell Signaling Technology | 3169 | |
| VE-cadherin mouse IgG2B Clone # 123413 | R&D Systems | MAB9381 | |
| ZO-1 rabbit IgG antibody, polyclonal | Thermo Fisher Scientific | 40-2200 | |
| Chemicals, peptides, and recombinant proteins | |||
| 100% Methanol | VWR | 101443-718 | Can be substituted with similar products |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 28908 | Can be substituted with similar products |
| Accutase | Thermo Fisher Scientific | A1110501 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| B27 supplement | Thermo Fischer Scientific | 17504044 | |
| bFGF | R&D Systems | 233-FB-025 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Collagen, Type I solution from rat tail | Sigma-Aldrich | C3867-1VL | Can be substituted with similar products |
| DMEM/Ham’s F12 | Thermo Fisher Scientific | 11320033 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Essential 6 medium | Thermo Fisher Scientific | A1516401 | |
| Fetal bovine serum (FBS) | Peak Serum | PS-FB1 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Fibronectin human protein, plasma | ThermoFisher Scientific | 33016015 | Can be substituted with similar products |
| hESFM | Thermo Fisher Scientific | 11111044 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | 861502 | |
| Normal goat serum | Thermo Fisher Scientific | 500627 | Can be substituted with similar products |
| PBS without calcium, magnesium | Cytiva | SH30256.01 | Can be substituted with similar products |
| Pericyte Medium | ScienCell | 1201 | Use complete kit (includes supplements) |
| Poly-L-Lysine, 10 mg/mL | ScienCell | 0413 | |
| Triton X-100 | JT Baker | X198-05 | Can be substituted with similar products |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen™ | 10977015 | Can be substituted with similar products |
| Experimental models: Cell lines | |||
| Blood-brain barrier hCMEC/D3 cell line | Sigma-Aldrich | SCC066 | |
| Human brain vascular pericytes | ScienCell | 1200 | |
| iPS(IMR90)-4 human induced pluripotent stem cells | WiCell | RRID:CVCL_C437 | |
| Glassware and Plasticware | |||
| 150 mm TC-treated Cell Culture Dish with 20 mm Grid | Falcon | 353025 | |
| Clamps | VWR | MFLX06832-10 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Flat 96-well non-binding microplates | Greiner Bio-One | 655900 | |
| Microscope Slide Device Holder | SiMPore | USIM-SB | Dimensions compatible with micropscope slide holders |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339653 | Tube caps can be filled with water for cell culture |
| P20-200 pipette tips | VWR | 76322-516 | Alternate brands may not seal as effectively into ports |
| Transwell filters (12 well, 12 mm, 0.4 μm pore size, PC) | CoStar | 3401 | |
| Instruments | |||
| 10X Objective (For Andor) | Nikon Instruments Inc. | MRD00105 | Air; WD: 4 mm; NA 0.45 |
| 10X Objective (For Nikon) | Nikon Instruments Inc. | MRP40102 | Air; WD: 6.2 mm; NA 0.25 |
| 40X Objective (LWD) (For Andor) | Nikon Instruments Inc. | MRD77410 | Water immersion; WD: 590-610 mm; NA 1.15 |
| Andor Spinning Disc Confocal microscope | Oxford Instruments, Andor | ||
| Nikon Eclipse Ts2 Phase Contrast Microscope | Nikon Instruments Inc. | Can be substituted with similar products | |
| TECAN Infinite M200 | TECAN | Can be substituted with similar products | |
| Other | |||
| Advanced PAP Pen | Millipore Sigma | Z672548 | 2 mm tip is recommended |
| Assembly kit with fixtures | SiMPore | USIM-JIGSET | Including fixure A1, A2, B1, and B2 |
| Camera Adapter for Microscopes | AmScope | CA-CAN-SLR Canon SLR / D-SLR | Φ23.2 - Φ30 adapter fits Nikon Eclipse Ts2 |
| Canon EOS Rebel SL3 DSLR Camera | Canon | EOS 250D, BH #CAEDRSL3B, MFR #3453C001 | Can be substituted with similar products |
| Cell strainer, 40 µm | Millipore Sigma (Corning) | CLS431750 | |
| Component 1 | SiMPore | USIM-C1 | |
| Component 2 | SiMPore | USIM-C2 | |
| Membrane chips | SiMPore | NPSN100-1L | Other chips formats are available |
| SMD handling tweezer double angle | Techni-Tool | 758TW003 | "Chip Tweezers" |
| Stainless steel precision type GG tweezer | Techni-Tool | 758TW534 | "Straight Tweezers" |
| Software | |||
| Fiji | ImageJ | For image processing | |
| Fusion | Oxford Instruments, Andor | Instructions for version 2.3.0.44 | |
| i-control | TECAN | Instructions for version 2.0 | |
| Imaris | Oxford Instruments | For image processing. Instructions for version 9.9.0 |
参考文献
- Villabona-Rueda, A., Erice, C., Pardo, C. A., Stins, M. F. The evolving concept of the blood brain barrier (BBB): from a single static barrier to a heterogeneous and dynamic relay center. Frontiers in Cellular Neuroscience. 13, 405 (2019).
- Nation, D. A., et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature Medicine. 25 (2), 270-276 (2019).
- Ferrari, C. C., Tarelli, R. Parkinson's disease and systemic inflammation. Parkinsons Disease. 116 (3), 436813 (2011).
- Koch, E. V., Ledwig, V., Bendas, S., Reichl, S., Dietzel, A. Tissue barrier-on-chip: a technology for reproducible practice in drug testing. Pharmaceutics. 14 (7), 1451 (2022).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
- Ortiz, G. G., et al. Role of the blood-brain barrier in multiple sclerosis. Archives of Medical Research. 45 (8), 687-697 (2014).
- Orhun, G., et al. Association between inflammatory markers and cognitive outcome in patients with acute brain dysfunction due to sepsis. Archives of Neuropsychiatry. 56 (1), 63-70 (2019).
- Chen, Y., Yang, W., Chen, F., Cui, L. COVID-19 and cognitive impairment: neuroinvasive and blood-brain barrier dysfunction. Journal of Neuroinflammation. 19 (1), 222 (2022).
- Hughes, C. G., et al. Endothelial activation and blood-brain barrier injury as risk factors for delirium in critically ill patients. Critical Care Medicine. 44 (9), e809-e817 (2016).
- Saraiva, C., et al. Nanoparticle-mediated brain drug delivery: Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of Control Release. 235 (10), 34-47 (2016).
- Jolliet-Riant, P., Tillement, J. P. Drug transfer across the blood-brain barrier and improvement of brain delivery. Fundamental & Clinical Pharmacology. 13 (1), 16-26 (1999).
- Abbott, N. J., et al. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2009).
- Siflinger-Birnboim, A., et al. Molecular sieving characteristics of the cultured endothelial monolayer. Journal of Cellular Physiology. 132 (1), 111-117 (1987).
- Bischoff, I., et al. Pitfalls in assessing microvascular endothelial barrier function: impedance-based devices versus the classic macromolecular tracer assay. Scientific Reports. 6, 23671 (2016).
- van der Helm, M. W., van der Meer, A. D., Eijkel, J. C., van den Berg, A., Segerink, L. I. Microfluidic organ-on-chip technology for blood-brain barrier research. Tissue Barriers. 4 (1), e1142493 (2016).
- Osaki, T., Shin, Y., Sivathanu, V., Campisi, M., Kamm, R. D. In vitro microfluidic models for neurodegenerative disorders. Advanced Healthcare Materials. 7 (2), (2018).
- Girard, S. D., et al. High and low permeability of human pluripotent stem cell-derived blood-brain barrier models depend on epithelial or endothelial features. FASEB Journal. 37 (2), e22770 (2023).
- Vigh, J. P., et al. Transendothelial electrical resistance measurement across the blood-brain barrier: a critical review of methods. Micromachines. 12 (6), 685 (2021).
- Lea, T., et al., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bioactives on Health: in vitro and ex vivo models. , (2015).
- Felix, K., Tobias, S., Jan, H., Nicolas, S., Michael, M. Measurements of transepithelial electrical resistance (TEER) are affected by junctional length in immature epithelial monolayers. Histochemistry and Cell Biology. 156 (6), 609-616 (2021).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Mossu, A., et al. A silicon nanomembrane platform for the visualization of immune cell trafficking across the human blood-brain barrier under flow. Journal of Cerebral Blood Flow and Metabolism. 39 (3), 395-410 (2019).
- Castro Dias, M., et al. Brain endothelial tricellular junctions as novel sites for T-cell diapedesis across the blood-brain barrier. Journal of Cell Science. 134 (8), jcs253880 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Khire, T. S., et al. Microvascular mimetics for the study of lukocyte-endothelial interactions. Cellular and Molecular Bioengineering. 13 (2), 125-139 (2020).
- Salminen, A. T., et al. Endothelial cell apicobasal polarity coordinates distinct responses to luminally versus abluminally delivered TNF-alpha in a microvascular mimetic. Integrative Biology: Quantitative Biosciences from Nano to Macro. 12 (11), 275-289 (2020).
- DesOrmeaux, J. P. S., et al. Nanoporous silicon nitride membranes fabricated from porous nanocrystalline silicon templates. Nanoscale. 6 (18), 10798-10805 (2014).
- Hill, K., et al. Second generation nanoporous silicon nitride membranes for high toxin clearance and small format hemodialysis. Advanced Healthcare Materials. 9 (4), e1900750 (2020).
- Salminen, A. T., et al. Ultrathin dual-scale nano- and microporous membranes for vascular transmigration models. Small. 15 (6), e1804111 (2019).
- Gillmer, S. R., et al. Predicting the failure of ultrathin porous membranes in bulge tests. Thin Solid Films. 631, 152-160 (2017).
- Ishimatsu, R., et al. Ion-selective permeability of ultrathin nanopore silicon membrane as studied using nanofabricated micropipet probes. Analytical Chemistry. 82 (17), 7127-7134 (2010).
- Kim, E., et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. Journal of American Chemical Society. 130 (13), 4230-4231 (2008).
- Snyder, J. L., et al. An experimental and theoretical analysis of molecular separations by diffusion through ultrathin nanoporous membranes. Journal of Membrane Science. 369 (1-2), 119-129 (2011).
- McCloskey, M. C., et al. The modular µSiM: a mass produced, rapidly assembled, and reconfigurable platform for the study of barrier tissue models in vitro. Advanced Healthcare Materials. 11 (18), e2200804 (2022).
- Mansouri, M., et al. The modular microSiM reconfigured: integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. 11 (21), e2200802 (2022).
- Su, S. -. H., et al. A tissue chip with integrated digital immunosensors: In situ brain endothelial barrier cytokine secretion monitoring. Biosensors and Bioelectronics. 224, 115030 (2023).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Gastfriend, B. D., Stebbins, M. J., Du, F., Shusta, E. V., Palecek, S. P. Differentiation of brain pericyte-like cells from human pluripotent stem cell-derived neural crest. Current Protocols. 1 (1), e21 (2021).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. FASEB Journal. 34 (12), 16693-16715 (2020).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- Bechmann, I., Galea, I., Perry, V. H. What is the blood-brain barrier (not). Trends in Immunology. 28 (1), 5-11 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved