需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠骨骼肌的普通散装培养物,以概括生态位和干细胞静止
* 这些作者具有相同的贡献
摘要
骨骼肌由多种细胞类型组成,包括常驻干细胞,每种细胞都对肌肉稳态和再生有特殊贡献。在这里,描述了肌肉干细胞的 2D 培养和肌肉细胞生态位在 离体 环境中保留了许多生理、 体内和环境特征。
摘要
骨骼肌是身体最大的组织,具有从运动到体温控制的多种功能。它的功能和从损伤中恢复取决于多种细胞类型以及核心肌肉细胞(肌纤维、肌肉干细胞)与其生态位之间的分子信号。大多数实验环境不能保留这种复杂的生理微环境,也不允许对静止的肌肉干细胞进行 离体 研究,这种细胞状态对它们至关重要。在这里,概述了具有其生态位的细胞成分的肌肉干细胞的 离体 培养方案。通过肌肉的机械和酶促分解,获得细胞类型的混合物,并将其放入 2D 培养物中。免疫染色显示,在 1 周内,培养物中存在多个生态位细胞以及具有静止肌肉干细胞特征的 Pax7 阳性细胞。这些独特的特性使该协议成为细胞扩增和产生可用于解决基本和转化问题的静止样干细胞的强大工具。
引言
运动、呼吸、新陈代谢、身体姿势和体温维持都依赖于骨骼肌,因此骨骼肌功能障碍会导致使人衰弱的病症(即肌病、肌营养不良等)。1. 鉴于其基本功能和丰富性,骨骼肌引起了全球研究实验室的关注,这些实验室致力于了解支持正常肌肉功能并可作为治疗靶点的关键方面。此外,骨骼肌是研究再生和干细胞功能的广泛使用模型,因为健康的肌肉在完全损伤和退化后可以完全自我修复,这主要是由于其驻留的干细胞2;这些也称为卫星细胞,位于肌纤维外围的基底层下3.
成人骨骼肌的核心细胞是肌纤维(长合胞体多核细胞)和卫星细胞(具有肌源性潜力的干细胞,在损伤激活它们之前处于静止状态)。后者细胞是肌肉再生的中心细胞,在没有它们的情况下,这个过程不会发生4,5,6,7。在它们的直接微环境中,有多种细胞类型和分子因子向它们发出信号。这个生态位在整个发育过程中逐渐建立,直到成年8.成人肌肉含有多种细胞类型(内皮细胞、周细胞、巨噬细胞、纤维脂肪祖细胞-FAPs、调节性T细胞等)9,10和细胞外基质成分(层粘连蛋白,胶原蛋白,纤连蛋白,原纤维蛋白,骨膜蛋白等)11 在健康、疾病和再生的背景下相互相互作用以及与卫星细胞相互作用。
在实验环境中保留这个复杂的生态位是基本的,但具有挑战性。同样困难的是保持或恢复静止状态,这是对卫星小区至关重要的细胞状态9。已经引入了几种方法来部分应对这些挑战,每种方法都有其优点和缺点(详见讨论部分)。在这里,提出了一种可以部分克服这两个障碍的方法。肌肉最初被收获,然后在异质细胞混合物被放入培养物之前通过机械和酶促分解。在培养过程中,检测到生态位的许多细胞类型,并观察到已恢复静止的卫星细胞。作为协议的最后一步,介绍了允许通过使用普遍接受的标记物检测每种细胞类型的免疫荧光步骤。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验均符合法国和欧盟的动物法规,特别是指令2010/63/UE。动物被饲养在动物设施的受控和富集环境中,认证编号为A94 028 379和D94-028-028;它们仅由授权的研究人员和动物看护人处理,并由动物饲养人员目视检查其一生中是否有不适迹象。他们在解剖前因颈椎脱位而被安乐死。在动物的一生中没有进行任何介入手术;因此,没有必要获得伦理委员会和法国高等教育、研究和创新部对该程序的批准。事实上,根据 2010/63/UE 指令,安乐死和尸后解剖不需要伦理许可。本手稿中介绍的结果来自野生型C57BL / 6NRj系(见 材料表)和转基因 Tg:Pax7-nGFP 系12(由我们团队培育)。该方案应用于8-12周龄的雄性和雌性小鼠。
1.试剂和设备制备预消化
- 用70%乙醇喷洒解剖工具(直剪刀和弯剪刀,镊子,见 材料表),并用纸擦干。在软木板上涂上铝箔,并在附近放置 10 厘米的培养皿(每只动物一个)。将纸张和 70% 乙醇放在触手可及的地方。
注意:在解剖结束时,用水冲洗解剖工具,然后用70%乙醇喷洒,并用纸擦干。 - 将旋转水浴设置为37°C,并通过将DMEM与1%青霉素 - 链霉素,0.5U / mL胶原酶,3U / mL分散酶(参见 材料表)和0.2%BSA在50mL管中混合来制备消化混合物(20mL /动物)。
- 将消化混合物通过细胞培养罩中的0.22μm过滤器。
注意:建议每次都新鲜准备消化混合物。
2. 酶解后的试剂和设备准备
- 消化后,混合物可以冷冻或培养。冷冻时,准备 10% DMSO:90% 胎牛血清 (FBS) 以及一组冻存管(每 2 mL 冻存管 1 mL 细胞悬液)。对于培养,准备培养基(补充有 1% 青霉素 - 链霉素、4 ng/mL bFGF 和 20% FBS 的 DMEM)和一组 8 孔板。在电镀细胞之前,必须对板进行涂层(步骤7.1中提供了详细信息)。
- 对于染色,在磷酸盐缓冲盐水(PBS)(0.15 mL /孔的8孔板)和封闭溶液(PBS中的5%无IgG牛血清白蛋白[BSA];0.15mL /孔的8孔板)中制备4%多聚甲醛(PFA)。
注意:不要吸入PFA粉末;在化学罩下准备和处理。
3. 解剖
- 用70%乙醇喷洒安乐死的动物。用大剪刀在腹部水平处做一个水平切口(身体左侧到右侧),并在腰部周围剪开。将皮肤从后肢上拉下来,露出肌肉(图1A)。
- 将动物放在铝箔覆盖的软木板上,然后固定相对的前肢和后肢。快速将所有后肢肌肉(前部和后部)放入放置在冰上的10厘米培养皿中(图1B,C)。特别注意从股四头肌和后肌周围区域去除脂肪组织。筋膜、神经和肌腱也可以在这一点上切除,前提是这不会影响解剖所花费的总时间。
注意:双侧后肢的最佳解剖时间应约为 15-20 分钟。建议解剖时间不超过30分钟。 - 偶尔向肌肉中滴入DMEM以保持肌肉湿润,但不要太多,因为这会使切碎变得困难。对另一只后肢重复上述步骤。一旦一只动物的所有肌肉都在培养皿中(图1D),用剪刀将它们切碎7-10分钟以获得光滑的匀浆(图1E)。
注:在该方案中,使用补充有L-谷氨酰胺,丙酮酸和4.5g / L D-葡萄糖的DMEM。
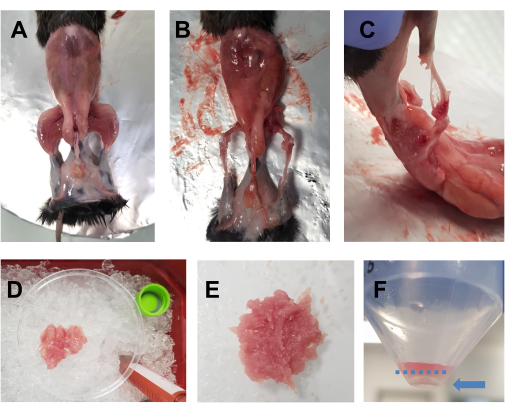
图 1:培养前肌肉准备。(A) 去除皮肤以露出后肢肌肉,如步骤 3.1 所述。(乙,丙)如步骤3.2所述,所有后肢肌肉都收获(B)在骨头周围和(C)之间。(D) 如步骤3.3所述,将收获的肌肉放入冰上的10厘米培养皿中,并用DMEM滴液保持湿润。(E) 用剪刀将肌肉切碎,直到获得具有本图像中描绘的稠度的光滑糊状物。(F) 最终离心后的颗粒图像;蓝色箭头突出显示了蓝色虚线下方的颗粒,该颗粒与管子相对。 请点击这里查看此图的较大版本.
4. 消化
注意:在消化结束时,第5部分需要4°C的离心机,一桶冰,三个细胞过滤器(100um,70um,40um)和三个50mL管(每只动物)。
- 按照步骤1.2中的说明制备和过滤消化混合物。将混合物放在冰上。
- 一旦所有肌肉都被切碎,将匀浆放入装有 20 mL 消化混合物的 50 mL 试管中。用柔性薄膜包裹盖子的边缘以防止泄漏,并将试管置于37°C振荡水浴中以中低速(50rpm)进行。
- 在37°C下1小时后,打开盖子,用10mL移液管轻轻上下移液7次,以获得均匀的混合物。在盖子周围涂上新薄膜,然后将其放回摇晃的水浴中。1小时后,取出管子,关闭浴液。
注意:对于培养物,在移至第 5 节之前,使用该孵育时间按照步骤 7.1 中的说明涂覆板。
5. 过滤
- 用冷DMEM(补充有1%青霉素 - 链霉素)填充消化管,最多50mL。将试管倒置三次混合。将 DMEM 保存在冰桶中以备后续步骤使用。
- 将 100 μm 细胞过滤器放在新的 50 mL 试管上。将消化的混合物通过细胞过滤器进入新管中。在4°C下以600× g 离心5分钟。 将上清液倒入液体废物容器中。
- 将沉淀重悬于 1 mL 冷 DMEM(补充有 1% 青霉素 - 链霉素)中。用相同的 DMEM 填充试管至 50 mL。注意:如果跳过离心机,下一个颗粒将更难识别和维护。
- 将 70 μm 细胞过滤器放在新的 50 mL 试管上。将离心/重悬的混合物通过细胞过滤器进入新管中。在4°C下以80× g 离心5分钟。
注意:此步骤不是强制性的,但建议用于消除细胞碎片。 - 将 40 μm 细胞过滤器放在新的 50 mL 管上。将上清液通过细胞过滤器进入新管中。在4°C下以600× g 离心5分钟,将上清液倒入液体废物容器中,并将沉淀重悬于培养罩下的FBS中。在此步骤中,颗粒非常小(图1F)。
注意:通过40μm过滤器过滤可去除碎屑,这些碎屑将在培养物的后期染色中产生非特异性信号。
6.(可选)冻结
注意:第 6 部分是可选的。过滤后可以暂停实验方案,但这会降低细胞存活率和培养成功率。
- 加入DMSO以获得10%DMSO:90%FBS比例,并转移到冷冻管中(每2mL冷冻管1mL重悬沉淀)。
- 将冷冻管在-80°C下放入聚苯乙烯盒中过夜。第二天移至-150°C进行长期储存。
注意:也可以在-80°C下短期储存。 - 开始培养时,在37°C水浴中快速解冻冻管,直到细胞悬液解冻。在培养罩下与 4 mL DMEM 混合。在4°C下以600× g 旋转5分钟。 移出上清液,然后按照步骤7.2中的说明继续。
7. 培养
注:冷冻或新鲜细胞悬浮液可预期填充 24-32 孔,每孔 3 至 4 个 8 孔板。
- 用包被溶液包被8孔板,该溶液应在4°C或冰上解冻(储备包被溶液通常保持在-20°C)。向一个孔中加入 0.4 mL 包衣溶液,然后从一个孔移液到另一个孔。将包衣溶液转移至所有孔后,可将其回收并重新冷冻,以备将来培养。在铺板细胞之前,将涂层板在37°C下保持30分钟。
- 将补充有 4 ng/mL bFGF(参见 材料表)的 DMEM(补充有 1% 青霉素 - 链霉素)添加到 FBS 细胞悬液中,以获得 20% FBS:80% DMEM 比率。
注意:尽管添加 bFGF 在原代成肌细胞培养和批量培养中的卫星样细胞生产中是有益的,但其添加是可选的,因为在 ~7 天的批量培养中省略它不会严重影响细胞产量。 - 在包被的 8 孔板中每孔板(来自步骤 7.2)板 0.4 mL 悬浮液。
注意:计算每只动物30cm2 的冷冻和新鲜制剂的培养物。 - 将培养物在37°C下用5%CO2 孵育长达10天,在培养物开始变为淡黄色(通常为5-7天)后每天更换培养基。
注:要定量细胞周期13 的 S 期细胞,请在固定前 2 小时加入 10 μM EdU。为了捕获第一个S期,从板中加入10μM EdU,并在培养40小时时固定。
8. 固定
注意:除非另有说明,否则第 8-10 节应在室温下进行。
- 移出培养基,并用 4% PFA(0.15 mL/孔)固定细胞。
注意:在化学罩下添加 PFA。
注意:如果所有孔同时固定,则在室温下与PFA孵育10分钟。如果孔固定在不同的时间点,则在要固定的孔中加入PFA,并将板在37°C的培养箱中保持5分钟。 - 移出 PFA,加入 PBS 10 秒(0.15 mL/孔)。移出 PBS,加入新鲜 PBS 5 分钟(0.15 mL/孔)。
注意:如果所有孔同时固定,则在室温下与PBS一起孵育。如果孔固定在不同的时间点,则向固定孔中加入PBS,并将板保持在37°C的培养箱中5分钟。然后,加入 0.4 mL PBS,并将板在培养箱中保存长达 1 周。
9.透化和封闭
- 准备染色时,移出PBS,并用0.5%TritonX 100在PBS(0.15mL /孔)中透化8分钟。移出TritonX 100,用PBS冲洗10秒(0.15mL /孔),移出PBS,用PBS洗涤5分钟(0.15mL /孔)。
- 用不含 5% IgG 的 BSA 在 PBS 中封闭 30-60 分钟(0.15 mL/孔)。
10. 染色
- 移出BSA,加入在PBS(0.15mL /孔)中稀释的一抗混合物(参见 材料表;稀释度:抗CD31 1:100,抗FOSB 1:200,抗GFP 1:1,000,抗KI67 1:1,000,抗MyHC 1:400,抗MYOD 1:200,抗MYOG 1:150,抗PAX7 1:100,抗PDGFRa 1:50)在4°C下孵育过夜。
注:抗体孵育后,收集抗体混合物,加入叠氮化钠,并保持在4°C或-20°C(根据抗体制造商的说明)以备将来重复使用。 - 移出抗体混合物,用 PBS 冲洗 10 秒(0.15 mL/孔),移出 PBS,然后用 PBS 洗涤 5 分钟(0.15 mL/孔)。
- 移出洗涤的PBS,加入二抗混合物(山羊抗小鼠Alexa Fluor 488,山羊抗兔Alexa Fluor 555,山羊抗大鼠Alexa Fluor 647,山羊抗小鼠Alexa Fluor 555,山羊抗鸡Alexa Fluor 488,均以1:500-1,000的稀释度使用)和在PBS(0.15mL/孔)中稀释的细胞核标记物(例如DAPI)(参见 材料表), 并在室温下孵育1小时,避光。
- 移出二抗混合物,用 PBS 冲洗 10 秒(0.15 mL/孔),移出 PBS,用 PBS 洗涤 5 分钟(0.15 mL/孔),移出 PBS,然后安装。
注意: 如果使用带有可拆卸分离器的 8 孔板,请在安装前撕下分离器。
Access restricted. Please log in or start a trial to view this content.
结果
该协议允许肌肉细胞培养,同时保留卫星细胞和大多数细胞的内源性生态位。图 2 总结了协议的主要步骤,而解剖和消化的基本部分如图 1 所示。建议对后肢肌肉组织进行解剖(图1A-C),因为这组肌肉经过充分研究,并且具有发育起源和分子层次结构14。建议在无菌条件下制备所有混合...
Access restricted. Please log in or start a trial to view this content.
讨论
成人骨骼肌功能由一组精心编排的细胞相互作用和分子信号支撑。在这里,提出了一种方法,该方法允许在与生理微环境非常相似的 离体 环境中研究这些参数。
一些小组已经报道了体外培养肌原细胞的方法。这些方法旨在分离卫星细胞以研究其肌源祖细胞特性。使用两种主要方法分离纯卫星细胞,从比目鱼肌和/或 EDL 肌肉18的分离纤维培养物?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有利益冲突。
致谢
在图2中,使用了施维雅Medical Art(https://smart.servier.com/)的模板。FR 实验室得到了法国抗肌病协会 - 通过 TRANSLAMUSCLE 的 AFM(赠款 19507 和 22946)、Fondation pour la Recherche Médicale - FRM(EQU202003010217、ENV202004011730、ECO201806006793)、Agence Nationale pour la Recherche - ANR (ANR-21-CE13-0006-02、ANR-19-CE13-0010、ANR-10-LABX-73) 和 La Ligue Contre le Cancer (IP/SC-17130) 的支持。上述资助者在本研究的设计、收集、分析、解释或报告或本手稿的撰写中没有任何作用。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| Bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| Cell strainer 40 um | Dominique Dutscher | 352340 | |
| Cell strainer 70 um | Dominique Dutscher | 352350 | |
| Cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Culture plate | Sarstedt | 94.6140.802 | |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
参考文献
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297(2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817(2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16(2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149(2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12(2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17(2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143(2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。