JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
틈새 및 줄기 세포 정지를 재현하기 위한 쥐 골격근의 분획되지 않은 대량 배양
* 이 저자들은 동등하게 기여했습니다
요약
골격근은 상주 줄기세포를 포함한 여러 세포 유형으로 구성되어 있으며, 각 세포 유형은 근육 항상성과 재생에 특별한 기여를 합니다. 여기에서는 근육 줄기 세포의 2D 배양과 생리학적, in vivo 및 환경적 특성의 많은 부분을 보존하는 ex vivo 환경에서의 근육 세포 틈새에 대해 설명합니다.
초록
골격근은 신체에서 가장 큰 조직이며 운동에서 체온 조절에 이르기까지 다양한 기능을 수행합니다. 그 기능과 부상으로부터의 회복은 다양한 세포 유형과 핵심 근육 세포(근섬유, 근육 줄기 세포)와 틈새 사이의 분자 신호에 달려 있습니다. 대부분의 실험 환경은 이 복잡한 생리학적 미세환경을 보존하지 않으며, 근육 줄기 세포에 중요한 세포 상태인 정지 상태의 생체 외 연구도 허용하지 않습니다. 여기에서는 틈새 시장의 세포 성분을 가진 근육 줄기 세포의 생체 외 배양을 위한 프로토콜이 요약되어 있습니다. 근육의 기계적 및 효소적 분해를 통해 세포 유형의 혼합물을 얻어 2D 배양에 넣습니다. 면역염색은 1주일 이내에 여러 틈새 세포가 근섬유와 함께 배양에 존재하며, 중요하게는 정지된 근육 줄기 세포의 특성을 나타내는 Pax7 양성 세포가 존재한다는 것을 보여줍니다. 이러한 고유한 특성으로 인해 이 프로토콜은 세포 증폭 및 근본적이고 중개 문제를 해결하는 데 사용할 수 있는 정지 유사 줄기 세포 생성을 위한 강력한 도구입니다.
서문
운동, 호흡, 신진대사, 자세 및 체온 유지는 모두 골격근에 의존하며, 골격근의 오작동은 쇠약해지는 병리학(예: 근육병증, 근이영양증 등)을 유발할 수 있습니다. 1. 골격근은 본질적인 기능과 풍부함을 감안할 때 정상적인 근육 기능을 지원하고 치료 표적이 될 수 있는 주요 측면을 이해하기 위해 노력하는 전 세계 연구 실험실의 관심을 끌었습니다. 또한, 골격근은 재생과 줄기세포 기능을 연구하는 데 널리 사용되는 모델인데, 건강한 근육은 주로 줄기세포에 의해 완전한 손상과 퇴화 후 완전히 자가 회복할 수 있기 때문이다2; 이들은 위성 세포라고도 불리며, 근육 섬유의 주변부에 있는 기저층(basal lamina) 아래에 국한되어 있다3.
성인 골격근의 핵심 세포는 근섬유(긴 세포융합 다핵 세포)와 위성 세포(근육 생성 전위가 있는 줄기 세포로 부상으로 활성화될 때까지 정지 상태)입니다. 후자의 세포는 근육 재생의 중심 세포이며,이 과정은 부재 할 때 발생할 수 없습니다 4,5,6,7. 즉각적인 미세 환경에는 신호를 보내는 여러 세포 유형과 분자 요인이 있습니다. 이 틈새 시장은 발달 과정과 성인기까지 점진적으로 확립된다8. 성인 근육에는 여러 세포 유형(내피 세포, 주위 세포, 대식세포, 섬유-지방 생성 전구-FAP, 조절 T 세포 등)이 포함되어 있습니다. 9,10 및 세포외 기질 성분(라미닌, 콜라겐, 피브로넥틴, 피브릴린, 페리오스틴 등) 11 건강, 질병 및 재생의 맥락에서 서로 상호 작용하고 위성 세포와 상호 작용합니다.
실험 환경에서 이 복잡한 틈새를 보존하는 것은 기본적이지만 어려운 일입니다. 마찬가지로 어려운 것은 정지 상태로 돌아가거나 정지 상태로 돌아가는 것인데, 이는 위성 셀(satellite cell)9에 매우 중요하다. 이러한 문제를 부분적으로 해결하기 위해 몇 가지 방법이 도입되었으며, 각 방법에는 장점과 단점이 있습니다(자세한 내용은 토론 섹션 참조). 여기에서는 이 두 가지 장벽을 부분적으로 극복할 수 있는 방법을 제시합니다. 근육은 처음에 채취된 다음 이질적인 세포 혼합물을 배양하기 전에 기계적, 효소적으로 분해됩니다. 배양 과정에서 틈새의 많은 세포 유형이 검출되고 정지 상태로 돌아온 위성 세포가 관찰됩니다. 프로토콜의 마지막 단계로, 보편적으로 허용되는 마커를 사용하여 각 세포 유형을 검출할 수 있는 면역형광 단계가 제시됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 실험은 Institut Mondor de Recherche Biomédicale (INSERM U955)의 프랑스 및 EU 동물 규정, 특히 지침 2010/63/UE를 준수했습니다. 동물은 인증 번호 A94 028 379 및 D94-028-028로 동물 시설에서 통제되고 풍부한 환경에서 사육되었습니다. 그들은 공인된 연구원과 동물 관리인에 의해서만 취급되었으며, 동물 사육 담당자는 일생 동안 불편함의 징후가 있는지 육안으로 검사했습니다. 그들은 해부 전에 자궁 경부 탈구로 안락사되었습니다. 동물의 일생 동안 중재적 절차는 수행되지 않았습니다. 따라서 윤리 위원회와 프랑스 고등 교육, 연구 및 혁신부로부터 절차에 대한 승인을 받을 필요가 없었습니다. 실제로, 지침 2010/63/UE에 따라 안락사 및 사후 해부에 대한 윤리적 허가는 필요하지 않습니다. 이 원고에 제시된 결과는 야생형 C57BL/6NRj 라인( 재료 표 참조)과 형질전환 Tg:Pax7-nGFP 라인12(우리 팀에서 육종)에서 얻은 것입니다. 프로토콜은 생후 8-12주 된 수컷 및 암컷 마우스에 적용되었습니다.
1. 시약 및 장비 준비 사전 소화
- 해부 도구(직선 및 곡선 가위, 집게, 재료 표 참조)에 70% 에탄올을 뿌리고 종이로 건조시킵니다. 코르크 접시에 알루미늄 호일을 입히고 10cm 페트리 접시(동물당 1개)를 근처에 두십시오. 종이와 70% 에탄올을 손이 닿는 곳에 두십시오.
알림: 해부가 끝나면 해부 도구를 물로 헹군 다음 70% 에탄올을 뿌리고 종이로 말리십시오. - 회전수 수조를 37°C로 설정하고 50mL 튜브에 DMEM을 1% 페니실린-스트렙토마이신, 0.5U/mL 콜라겐분해효소, 3U/mL 디스파제( 재료 표 참조) 및 0.2% BSA와 결합하여 분해 혼합물(20mL/동물)을 준비합니다.
- 세포 배양 후드의 0.22μm 필터를 통해 분해 혼합물을 통과시킵니다.
알림: 매번 신선한 소화 믹스를 준비하는 것이 좋습니다.
2. 시약 및 장비 준비 후 소화
- 분해 후 혼합물을 냉동하거나 배양할 수 있습니다. 냉동을 위해 10% DMSO:90% 소 태아 혈청(FBS)과 극저온 튜브 세트(2mL 극저온 튜브당 1mL의 세포 현탁액)를 준비합니다. 배양을 위해 배양 배지(1% 페니실린-스트렙토마이신, 4ng/mL bFGF 및 20% FBS가 보충된 DMEM)와 8웰 플레이트 세트를 준비합니다. 셀을 도금하기 전에 플레이트를 코팅해야 합니다(자세한 내용은 7.1단계에서 제공됨).
- 염색을 위해 인산염 완충 식염수(PBS)(8웰 플레이트의 0.15mL/웰) 및 차단 용액(PBS의 5% IgG-free 소 혈청 알부민[BSA], 8웰 플레이트의 0.15mL/웰)에 4% 파라포름알데히드(PFA)를 준비합니다.
주의 : PFA 분말을 흡입하지 마십시오. 화학 후드 아래에서 준비하고 취급하십시오.
3. 해부
- 안락사된 동물에게 70% 에탄올을 뿌린다. 복부 높이에서 큰 가위로 수평으로 절개 (몸의 왼쪽에서 오른쪽으로)하고 허리 주위를 자릅니다. 뒷다리의 피부를 잡아당겨 근육을 드러냅니다(그림 1A).
- 알루미늄 호일로 덮인 코르크 판에 동물을 놓고 반대쪽 앞다리와 뒷다리를 고정합니다. 모든 뒷다리 근육(앞과 뒤)을 얼음 위에 놓인 10cm 페트리 접시에 빠르게 제거합니다(그림 1B,C). 대퇴사두근과 후방 근육 주변 부위의 지방 조직을 제거하도록 각별히 주의하십시오. 근막, 신경 및 힘줄도 해부에 소요되는 전체 시간을 손상시키지 않는 한 이 시점에서 제거할 수 있습니다.
알림: 양쪽 뒷다리의 최적 절개 시간은 약 15-20분이어야 합니다. 해부 시간은 30분을 초과하지 않는 것이 좋습니다. - 가끔씩 근육에 DMEM을 한 방울 떨어뜨려 촉촉하게 유지하되 너무 많이 떨어뜨리면 자르기가 어려워집니다. 다른 뒷다리에 대해서도 반복합니다. 한 동물의 모든 근육이 페트리 접시에 들어가면(그림 1D) 가위로 7-10분 동안 잘게 썰어 부드러운 균질화를 얻습니다(그림 1E).
참고: 이 프로토콜에서는 L-글루타민, 피루브산 및 4.5g/L D-글루코스가 보충된 DMEM이 사용됩니다.
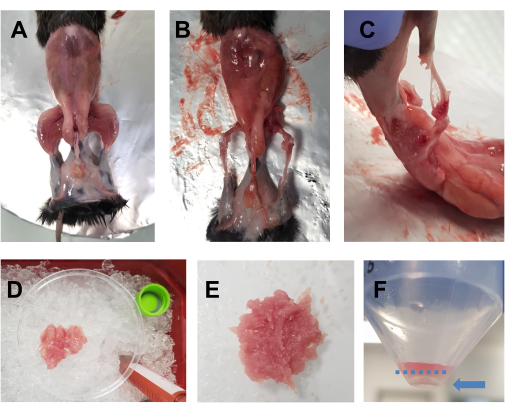
그림 1: 배양 전 근육 준비. (A) 3.1단계에서 설명한 대로 피부를 제거하여 뒷다리 근육을 드러냅니다. (나,씨) 모든 뒷다리 근육은 3.2단계에서 설명한 대로 뼈 주위(B)와 뼈 사이(C)를 채취합니다. (D) 수확된 근육은 3.3단계에 설명된 대로 촉촉한 상태를 유지하기 위해 DMEM 방울과 함께 얼음 위의 10cm 페트리 접시에 넣습니다. (E) 이 이미지에 묘사된 농도로 부드러운 반죽이 될 때까지 가위로 근육을 잘게 썬다. (F) 최종 원심분리 후의 펠릿 이미지; 파란색 화살표는 파란색 점선 아래에서 튜브에 대한 펠릿을 강조 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 소화
참고: 분해가 끝나면 섹션 5에는 4°C의 원심분리기, 얼음 양동이, 세포 여과기 3개(100um, 70um, 40um) 및 50mL 튜브 3개(동물당)가 필요합니다.
- 1.2단계에서 설명한 대로 분해 혼합물을 준비하고 여과합니다. 혼합물을 얼음 위에 두십시오.
- 모든 근육이 잘리면 균질액을 20mL의 분해 혼합물과 함께 50mL 튜브에 넣습니다. 뚜껑의 가장자리를 플렉시블 필름으로 감싸 누출을 방지하고 튜브를 37°C 저속(50rpm)의 진탕 수조에 넣습니다.
- 37°C에서 1시간 후 뚜껑을 열고 10mL 피펫으로 위아래로 7회 부드럽게 피펫팅하여 혼합하여 균일한 혼합물을 얻습니다. 뚜껑 주위에 새 필름을 바르고 흔들리는 수조에 다시 넣습니다. 1시간 후 튜브를 제거하고 수조를 끕니다.
알림: 배양의 경우 이 배양 시간을 사용하여 섹션 7.1로 이동하기 전에 5단계에 설명된 대로 플레이트를 코팅합니다.
5. 여과
- 최대 50mL의 차가운 DMEM(1% 페니실린-스트렙토마이신 보충)으로 분해 튜브를 채웁니다. 튜브를 세 번 뒤집어 섞는다. 다음 단계를 위해 DMEM을 얼음 양동이에 보관하십시오.
- 새 50mL 튜브에 100μm 셀 스트레이너를 놓습니다. 분해된 혼합물을 세포 스트레이너를 통해 새 튜브로 통과시킵니다. 600 x g 에서 4°C에서 5분 동안 원심분리합니다. 상층액을 액체 폐기물 용기에 붓습니다.
- 펠릿을 1mL의 차가운 DMEM(1% 페니실린-스트렙토마이신 보충)에 재현탁시킵니다. 동일한 DMEM으로 튜브를 최대 50mL까지 채웁니다. 알림: 원심분리를 건너뛰면 다음 펠릿을 식별하고 유지하기가 더 어려워집니다.
- 70μm 셀 스트레이너를 새 50mL 튜브에 놓습니다. 원심분리/재현탁 혼합물을 세포 스트레이너를 통해 새 튜브에 통과시킵니다. 4 °C에서 5분 동안 80 x g 으로 원심분리합니다.
참고: 이 단계는 필수는 아니지만 셀 파편을 제거하는 데 권장됩니다. - 새 50mL 튜브에 40μm 셀 스트레이너를 놓습니다. 상층액을 세포 여과기를 통해 새 튜브로 통과시킵니다. 4°C에서 5분 동안 600 x g 으로 원심분리하고, 상층액을 액체 폐기물 용기에 붓고, 배양 후드 아래의 FBS에 펠릿을 재현탁시킵니다. 이 단계에서 펠릿은 매우 작습니다(그림 1F).
참고: 40μm 스트레이너를 통해 여과하면 파편이 제거되어 나중에 배양물 염색 시 비특이적 신호를 얻을 수 있습니다.
6. (선택 사항) 동결
참고: 섹션 6은 선택 사항입니다. 필터링 후 프로토콜을 일시 중지할 수 있지만 이로 인해 세포 생존 및 배양 성공률이 떨어질 수 있습니다.
- DMSO를 첨가하여 10% DMSO:90% FBS 비율을 얻고 극저온 튜브(2mL 극저온 튜브당 1mL의 재현탁 펠릿)로 옮깁니다.
- -80°C의 극저온 튜브를 폴리스티렌 상자에 밤새 넣습니다. 장기 보관을 위해 다음날 -150 °C로 이동하십시오.
알림: -80°C에서 단기 보관도 가능합니다. - 배양을 시작할 때 세포 현탁액이 해동될 때까지 37°C 수조에서 cryotube를 빠르게 해동합니다. 배양 후드 아래에서 4mL의 DMEM과 혼합합니다. 600 x g 에서 4°C에서 5분 동안 회전합니다. 상층액을 피펫팅하고 7.2단계에 설명된 대로 계속합니다.
7. 배양
참고: 냉동 또는 신선 셀 현탁액은 3-4웰 플레이트의 24-32웰을 채울 것으로 예상할 수 있습니다.
- 8웰 플레이트에 코팅 용액을 코팅하고 4°C 또는 얼음 위에서 해동해야 합니다(스톡 코팅 용액은 일반적으로 -20°C로 유지됨). 코팅 용액 0.4mL를 하나의 웰에 추가하고 웰에서 웰로 피펫팅합니다. 코팅 용액을 모든 웰을 통해 옮긴 후 향후 배양을 위해 다시 회수하고 다시 냉동할 수 있습니다. 셀을 도금하기 전에 코팅된 플레이트를 37°C에서 30분 동안 유지합니다.
- FBS-세포 현탁액에 4ng/mL bFGF( 재료 표 참조)가 보충된 DMEM(1% 페니실린-스트렙토마이신 보충)을 추가하여 20% FBS:80% DMEM 비율을 얻습니다.
참고: bFGF의 첨가는 원발성 근모세포 배양 및 벌크 배양의 위성과 같은 세포 생산에 도움이 될 수 있지만, ~7일의 벌크 배양에서 생략해도 세포 수율이 심각하게 저하되지 않기 때문에 추가는 선택 사항입니다. - 코팅된 8-웰 플레이트에서 웰당 현탁액 0.4mL(단계 7.2부터)를 플레이트합니다.
알림: 냉동 및 신선 준비를 위해 동물당 30cm2의 배양액을 계산합니다. - 37 °C에서 5 % CO2 로 최대 10 일 동안 배양 한 후 배양 물을 매일 교체하여 배양액이 황색으로 변하기 시작한 후 매일 배지를 교체합니다 (보통 5-7 일).
참고: 세포 주기13의 S상에 있는 세포를 정량하려면 고정 2시간 전에 10μM EdU를 첨가합니다. 첫 번째 S상을 캡처하려면 도금에서 10μM EdU를 추가하고 배양 40시간에서 고정합니다.
8. 고정
알림: 섹션 8-10은 달리 명시되지 않는 한 실온에서 수행해야 합니다.
- 배양 배지를 피펫팅하고 4% PFA(0.15mL/웰)로 세포를 고정합니다.
주의 : 화학 후드 아래에 PFA를 추가하십시오.
참고: 모든 웰이 동시에 고정된 경우 PFA로 실온에서 10분 동안 배양합니다. 웰이 다른 시점에 고정되어 있는 경우 고정할 웰에 PFA를 추가하고 플레이트를 인큐베이터에서 37°C로 5분 동안 유지합니다. - PFA를 피펫팅하고 PBS를 10초(0.15mL/웰) 동안 추가합니다. PBS를 피펫팅하고 신선한 PBS를 5분 동안 추가합니다(0.15mL/웰).
참고: 모든 웰이 동시에 고정된 경우 실온에서 PBS로 배양합니다. 웰이 다른 시점에 고정된 경우 고정 웰에 PBS를 추가하고 플레이트를 인큐베이터에서 37°C로 5분 동안 유지합니다. 그런 다음 PBS 0.4mL를 추가하고 플레이트를 최대 1주일 동안 인큐베이터에 보관합니다.
9. 투과성 및 차단
- 염색할 준비가 되면 PBS를 피펫팅하고 PBS(0.15mL/웰)에서 0.5% TritonX 100으로 8분 동안 투과시킵니다. TritonX 100을 피펫팅하고 PBS로 10초(0.15mL/웰) 헹구고 PBS를 피펫팅한 다음 PBS로 5분(0.15mL/웰) 세척합니다.
- PBS에서 5% IgG가 없는 BSA로 30-60분(0.15mL/웰) 동안 차단합니다.
10. 염색
- BSA를 피펫팅하고 PBS(0.15mL/well)에 희석한 1차 항체 혼합물을 첨가합니다( 재료 표 참조; 희석: 항-CD31 1:100, 항-FOSB 1:200, 항-GFP 1:1,000, 항-KI67 1:1,000, 항-MyHC 1:400, 항-MYOD 1:200, 항-MYOG 1:150, 항-PAX7 1:100, 항-PDGFRa 1:50)를 첨가하여 4°C에서 하룻밤 동안 배양합니다.
참고: 항체 배양 후 항체 혼합물을 수집하고 아지드화나트륨을 첨가한 후 향후 재사용을 위해 4°C 또는 -20°C(항체 제조업체의 지침에 따름)에서 보관합니다. - 항체 혼합물을 피펫팅하고 PBS로 10초(0.15mL/웰) 헹구고 PBS를 피펫팅한 다음 PBS로 5분(0.15mL/웰) 세척합니다.
- 세척 PBS를 피펫으로 꺼내고, 2차 항체 혼합물(염소 항-마우스 Alexa Fluor 488, 염소 항-토끼 Alexa Fluor 555, 염소 항-쥐 Alexa Fluor 647, 염소 항-마우스 Alexa Fluor 555, 염소 항-닭 Alexa Fluor 488, 모두 1:500-1,000의 희석액에서 사용됨) 및 PBS(0.15mL/웰)에 희석된 핵 마커(예: DAPI)를 첨가하고( 재료 표 참조), 빛으로부터 보호된 실온에서 1시간 동안 배양합니다.
- 2차 항체 혼합물을 피펫팅하고, PBS로 10초(0.15mL/웰) 헹구고, PBS를 피펫팅하고, PBS로 5분(0.15mL/웰) 세척하고, PBS를 피펫팅하고, 마운트합니다.
알림: 탈착식 분리기가 있는 8웰 플레이트를 사용하는 경우 장착하기 전에 분리기를 떼어내십시오.
Access restricted. Please log in or start a trial to view this content.
결과
이 프로토콜은 내인성 틈새에서 위성 세포와 대부분의 세포를 보존하면서 근육 세포 배양을 허용합니다. 그림 2는 프로토콜의 주요 단계를 요약한 것이며, 해부 및 분해의 필수 부분은 그림 1에 나와 있습니다. 뒷다리 근육 조직의 해부가 권장되는데(그림 1A-C), 이 근육 그룹은 잘 연구되어 있고 발달 기원...
Access restricted. Please log in or start a trial to view this content.
토론
성인의 골격근 기능은 정교하게 조율된 일련의 세포 상호 작용과 분자 신호에 의해 뒷받침됩니다. 여기에서, 생리학적 미세환경과 매우 유사한 생체외 환경에서 이러한 파라미터를 연구할 수 있는 방법이 제시된다.
몇몇 그룹은 근육 세포를 배양하기 위한 시험관 내 방법을 보고했습니다. 이러한 방법은 위성 세포를 분리하여 근육 전구 세포의 특성을 연구하는 ...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
그림 2에서는 Servier Medical Art(https://smart.servier.com/)의 템플릿이 사용되었습니다. FR 연구소는 Association Française contre les Myopathies - AFM via TRANSLAMUSCLE (보조금 19507 및 22946), Fondation pour la Recherche Médicale - FRM (EQU202003010217, ENV202004011730, ECO201806006793), Agence Nationale pour la Recherche - ANR (ANR-21-CE13-0006-02, ANR-19-CE13-0010, ANR-10-LABX-73) 및 La Ligue Contre le Cancer (IP/SC-17130)의 지원을 받습니다. 위의 연구비 제공자는 본 연구의 설계, 수집, 분석, 해석 또는 보고나 본 원고의 작성에 어떠한 역할도 하지 않았다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| Bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| Cell strainer 40 um | Dominique Dutscher | 352340 | |
| Cell strainer 70 um | Dominique Dutscher | 352350 | |
| Cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Culture plate | Sarstedt | 94.6140.802 | |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
참고문헌
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297(2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817(2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16(2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149(2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12(2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17(2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143(2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유